 |
 |
| Korean J Med > Volume 97(2); 2022 > Article |
|
Abstract
Rheumatoid arthritis (RA) is a chronic systemic autoimmune disease with synovitis and extra-articular systemic involvement. Chronic RA treatment is challenging and represents a major health burden worldwide. Recent insights regarding RA pathogenesis have led to novel therapeutic agents, especially biologics. Furthermore, accumulating experience and new clinical studies have helped to inform updated recommendations for treatment of RA. Recently, treatment guidelines from the American College of Rheumatology were released. Here, we review these guidelines and their application to daily practice.
ÙÑÿÙºêÝï░ýèñÛ┤Çýáêýù╝ýØÇ ÙîÇÝæ£ýáüýØ© ÙïñÙ░£ ýù╝ýªØ Û┤Çýáê ýºêÝÖÿý£╝Ùí£ ý╣ÿÙúîÝòÿýºÇ ýòèÙèö Û▓¢ýÜ░ Ù░£Ù│æ Ýøä 2Ùàä ýØ┤Ùé┤ýùÉ Û┤ÇýáêýùÉ Ù╣äÛ░Çýù¡ýáüýØ© ýåÉýâüýØ┤ ýØ╝ýû┤Ùéÿ ýØ╝ýâüýâØÝÖ£ýùÉ ý×ÑýòáÙÑ╝ ý┤êÙ×ÿÝòá ýêÿ ý×êÙïñ[1]. ÙÿÉÝò£ Û┤Çýáêýù╝ ýÖ©ýùÉÙÅä ÙïñÙÑ© ýáäýïá ýªØýâü(Û│ÁÙºëýù╝, Û░äýºêýä▒ ÝÅÉýºêÝÖÿ, Ýö╝ÙÂÇ ÝÿêÛ┤Çýù╝, ÙÑÿÙºêÝï░ýèñ Û▓░ýáê Ùô▒)ýØä ýØ╝ý£╝Ýé¼ ýêÿ ý×êÛ│á, ýáäýïá ýù╝ýªØýùÉ ÙîÇÝò£ ýºü┬ÀÛ░äýáæýáüýØ© ýÿüÝûÑý£╝Ùí£ ýï¼ÝÿêÛ┤ÇÛ│ä ýºêÝÖÿ, Û│¿ÙïñÛ│ÁýªØ Ùô▒ ÙÅÖÙ░ÿ Ýò®Ù│æ ýºêÝÖÿýØÿ Ù░£ýâØÙÑáÙÅä ýØ╝Ù░ÿ ýØ©ÛÁ¼Ù│┤Ùïñ ÙåÆÙïñ. Ùö░ÙØ╝ýä£ ýºêÙ│æ ý┤êÛ©░ÙÂÇÝä░ Û┤Çýáê ýåÉýâüýØä Ù░®ýºÇÝòá ýêÿ ý×êÙèö Ýò¡ÙÑÿÙºêÝï░ýèñýò¢ýá£(disease modifying anti rheumatic drug, DMARD)ÙÑ╝ ýé¼ýÜ®ÝòÿÙèö Û▓âýØ┤ ýñæýÜöÝòÿÙ®░, ýáäýïá ýªØýâüýùÉ ÙîÇÝò£ ýäáÙ│ä Û▓Çýé¼ Ù░Å ýáòÝÖòÝò£ ýºäÙï¿Û│╝ ÙÅÖÙ░ÿ Ýò®Ù│æýªØýùÉ ÙîÇÝò£ Ù¬¿ÙïêÝä░Ùºü, Û┤ÇÙª¼Û░Ç ýáäÙ░ÿýáüý£╝Ùí£ Ýò¿Û╗ÿ ýØ┤Ùú¿ýû┤ýá©ýò╝ Ýò£Ùïñ.
ÙÑÿÙºêÝï░ýèñÛ┤Çýáêýù╝ýØÿ ý╣ÿÙúîÙèö Ùé«ýØÇ ýºêÙ│æÝÖ£ýä▒ÙÅä/Û┤ÇÝò┤ÙÑ╝ Ù¬®Ýæ£Ùí£ ýØ╝ýáò Û©░Û░äÙºêÙïñ Ù¬®Ýæ£ Ùï¼ýä▒ ýù¼ÙÂÇÙÑ╝ ÝÅëÛ░ÇÝòÿýù¼ ý╣ÿÙúî ýò¢ýá£ÙÑ╝ Ù│ÇÛ▓¢ÝòÿÙèö Ù░®ýïØý£╝Ùí£ ýØ┤Ùú¿ýû┤ýºäÙïñ[2]. 2000ÙàäÙîÇ Ùôñýû┤ Ýò¡ tumor necrosis factor-╬▒ (anti-TNF)ÙÑ╝ ý£äýï£Ýò£ ýâØÙ¼╝ÝòÖýáü ýá£ýᣠ(biologics)Û░Ç ÙÅäý×àÙÉÿýû┤ ÙÑÿÙºêÝï░ýèñÛ┤Çýáêýù╝ ý╣ÿÙúîýØÿ ÝÜìÛ©░ýáüýØ© Ù░£ýáäýØ┤ ý×êýùêÙïñ[3]. ý┤êÛ©░ýùÉÙèö ýáäÝåÁýáüýØ© DMARDÙí£ ýï£ý×æÝòÿýù¼, Ýæ£ýáü ý╣ÿÙúîýᣠýé¼ýÜ®ý£╝Ùí£ Ùäÿýû┤Û░ÇÙèö Ùï¿Û│äýáüýØ© ý╣ÿÙúîÙÑ╝ ÝòÿÛ▓î ÙÉÿÙèöÙì░, ýØ┤Ùƒ¼Ýò£ ýá£ýá£ÙôñýØÿ ýáüýáêÝò£ ýé¼ýÜ®ýØä ý£äÝò┤ýä£Ùèö Û░Éýù╝ ýÀ¿ýò¢ýä▒(Û▓░ÝòÁ ÝÖ£ýä▒ÝÖö Ùô▒)ýØä Ù╣äÙí»Ýòÿýù¼ ÙÂÇý×æýÜ®ýùÉ Û┤ÇÙá¿ÙÉ£ ýé¼ýáä ýñÇÙ╣äýÖÇ Ù¬¿ÙïêÝä░ÙºüýØ┤ ÝòäýÜöÝòÿÙïñ[4].
ýâêÙí£ýÜ┤ ý╣ÿÙúîýá£ýØÿ ÙÅäý×àÛ│╝ ýù¼Ùƒ¼ Û░ÇýºÇ ýù░ÛÁ¼Ùí£ ýû╗ýû┤ýºÇÙèö ýªØÛ▒░ÙÑ╝ Ù░öÝâòý£╝Ùí£ ýá£ýáòÙÉÿÙèö ÙÑÿÙºêÝï░ýèñÛ┤Çýáêýù╝ ý╣ÿÙúîýºÇý╣¿ýØÇ Û¥©ýñÇÝ×ê ýùàÙì░ýØ┤Ýè© ÙÉÿÛ│á ý×êÙïñ. ýä©Û│äýáüý£╝Ùí£ ýù¼Ùƒ¼ ýºäÙúîýºÇý╣¿ýØ┤ ý×êýºÇÙºî, Ù»©ÛÁ¡ÙÑÿÙºêÝï░ýèñÝòÖÝÜîýÖÇ ý£áÙƒ¢ÙÑÿÙºêÝï░ýèñÝòÖÝÜîýØÿ Û░ÇýØ┤Ùô£ÙØ╝ýØ©ýØ┤ ýú╝ýÂòýØ┤ ÙÉÿÛ│á ý×êý£╝Ù®░, ýÁ£ÛÀ╝ Ù»©ÛÁ¡ÙÑÿÙºêÝï░ýèñÝòÖÝÜî Û░ÇýØ┤Ùô£ÙØ╝ýØ©ýØ┤ Û░£ýáòÙÉÿýû┤ Ù░£Ýæ£ÙÉÿýùêÙïñ. Ýÿäý×¼ ýÜ░Ùª¼ÙéÿÙØ╝ýØÿ ÙÑÿÙºêÝï░ýèñÛ┤Çýáêýù╝ ýºäÙúî ýºÇý╣¿ýØÇ ÙîÇÝò£ÙÑÿÙºêÝï░ýèñÝòÖÝÜîýùÉýä£ Û░£Ù░£ ýñæýØ┤Ù®░, Ù│© ýóàýäñýùÉýä£Ùèö 2021 Ù»©ÛÁ¡ÙÑÿÙºêÝï░ýèñÝòÖÝÜî ý╣ÿÙúîýºÇý╣¿[5]Û│╝ 2019 ý£áÙƒ¢ÙÑÿÙºêÝï░ýèñÝòÖÝÜî ý╣ÿÙúîýºÇý╣¿[6]ýØä ýñæýï¼ý£╝Ùí£ ýïñýᣠýÜ░Ùª¼ ýºäÙúî Ýÿäý×ÑýùÉýä£ ýáüýÜ®Ýòá ýêÿ ý×êÙèö ÙÑÿÙºêÝï░ýèñÛ┤Çýáêýù╝ýØÿ ý╣ÿÙúîýºÇý╣¿ýØä ýåîÛ░£ÝòÿÛ│áý×É Ýò£Ùïñ.
Ýÿäý×¼ ý╣ÿÙúî Û░ÇýØ┤Ùô£ÙØ╝ýØ©ýØÇ ÙÑÿÙºêÝï░ýèñÛ┤Çýáêýù╝ýØÿ ýºêÙ│æÝÖ£ýä▒ÙÅäÙÑ╝ ÝÅëÛ░ÇÝòÿÙèö ýºÇÝæ£ÙÑ╝ Û©░ýñÇý£╝Ùí£ Ýòÿýù¼ Ùé«ýØÇ ýºêÙ│æÝÖ£ýä▒ÙÅäÙÑ╝ ý£áýºÇÝòÿÙèö Û▓âýØä Ù¬®Ýæ£Ùí£ ÝòÿÙ®░, ýØ┤ÙÑ╝ treat-to-target (T2T) ýáäÙ×ÁýØ┤ÙØ╝Û│á Ýòÿýù¼ ý╣ÿÙúîýØÿ ýØ╝Ù░ÿýáüýØ© ýøÉý╣Öý£╝Ùí£ ÝòÿÛ│á ý×êÙïñ. ýºêÙ│æÝÖ£ýä▒ÙÅä ÝÅëÛ░Ç ýºÇÝæ£ Û░ÇýÜ┤Ùì░ ÝòÿÙéÿýØ© Disease Activity Score 28ýØÇ ýòòÝåÁÛ┤Çýáêýêÿ, ÙÂÇýóàÛ┤Ç ýáêýêÿ, ÝÖÿý×ÉÛ░Ç ÝÅëÛ░ÇÝòÿÙèö ýºêÙ│æÝÖ£ýä▒ÙÅä Ù░Å Û©ëýä▒Û©░ Ù░ÿýØæ Ù¼╝ýºê(acute phase reactant)ýØÿ ýâüýè╣ ýáòÙÅäÙÑ╝ Û│äýé░Ýòÿýù¼ ÙºîÙôñýû┤Ùé© ýóàÝò®ýºÇÝæ£Ùí£ýä£ ýØ┤ÙÑ╝ ÝåÁÝò┤ ýºêÙ│æÝÖ£ýä▒ÙÅäÙÑ╝ ÝÅëÛ░ÇÝòÿýù¼ ý╣ÿÙúî Ù░®ý╣¿ýØÿ Ù│ÇÛ▓¢ýØä Û▓░ýáòÝòÿÙèö Ùì░ ýé¼ýÜ®ÝòÿÛ│á ý×êÙïñ[7]. 1ý░¿ýáüý£╝Ùí£ ÙÑÿÙºêÝï░ýèñÛ┤Çýáêýù╝ýØ┤ ýºäÙï¿ÙÉ£ ÝÖÿý×ÉýùÉýä£ Ýè╣Ù│äÝò£ Ù╣äýáüýØæýªØýØ┤ ýùåÙïñÙ®┤ Ù¬¿Ùôá ÙÑÿÙºêÝï░ýèñÛ┤Çýáêýù╝ ÝÖÿý×ÉýùÉýä£ Ù®öÝåáÝè©Ùáëýä©ýØ┤Ýè©(methotrexate, MTX)ÙÑ╝ Û©░Ù│©ý£╝Ùí£ ÝòÿÙèö DMARDÙÑ╝ ýé¼ýÜ®ÝòÿÛ│á, ýØ┤ýùÉ ý®ÙÂäÝò£ Ù░ÿýØæýØä Ù│┤ýØ┤ýºÇ ýòèýØäÙòî, ýâØÙ¼╝ÝòÖýáü ýá£ýá£/Ýæ£ýáü Ýò®ýä▒ DMARD ýá£ýá£ÙÑ╝ ýé¼ýÜ®ÝòÿÛ▓î ÙÉ£Ùïñ. 2019Ùàä ý£áÙƒ¢ÙÑÿÙºêÝï░ýèñÝòÖÝÜî ý╣ÿÙúîýºÇý╣¿ýùÉýä£Ùèö MTX Ýÿ╣ýØÇ ÙïñÙÑ© ýáäÝåÁýáüýØ© DMARD (conventional synthetic [cs] DMARD)ÙÑ╝ Û©░Ù░ÿý£╝Ùí£ Ýòÿýù¼ ý╣ÿÙúîÙÑ╝ ýï£ý×æÝòÿÛ│á, 3-6Û░£ýøöÙºêÙïñ T2T ÝÅëÛ░ÇÙÑ╝ ýï£Ýûë Ýòÿýù¼, Ýÿä Ùï¿Û│äýØÿ ý╣ÿÙúîÙÑ╝ ýºÇýåìÝòÿÛ▒░Ùéÿ, ÙïñýØî Ùï¿Û│äýØÿ ý╣ÿÙúîÙÑ╝ ÙÅäý×à ÝòÿÙèö ý╣ÿÙúî ýòîÛ│áÙª¼ýªÿýØä ýá£ýï£ÝòÿýÿÇÙïñ(Fig. 1). 2021Ùàä Ù»©ÛÁ¡ÙÑÿÙºêÝï░ýèñÝòÖÝÜî ý╣ÿÙúîýºÇý╣¿ýùÉýä£ csDMARDsÙèö ÝòÿýØ┤Ùô£ÙíØýï£Ýü┤Ùí£Ùí£ÝÇ© (hydroxychloroquine, HCQ), ýäñÝîîýé┤ÙØ╝ýºä(sulfasalazine, SSZ), MTX, ÙáêÝöîÙú¿Ùà©ÙºêýØ┤Ùô£(leflunomide)ÙÑ╝ ÝżÝò¿ÝòÿÙèö Û▓âý£╝Ùí£ ýáòýØÿÝòÿýÿÇÙïñ.
ÙÑÿÙºêÝï░ýèñÛ┤Çýáêýù╝ýØ┤ ýºäÙï¿ÙÉÿÙ®┤ ýÁ£ÙîÇÝò£ Ù╣¿Ùª¼ Ýò¡ÙÑÿÙºêÝï░ýèñ ýá£ýá£ÙÑ╝ ÙÅäý×àÝòÿýù¼ýò╝ Ýò£Ùïñ. Ýè╣Ù│äÝò£ ÙÂÇýáüýØæýªØýØ┤ ýùåÙèö Ýò£ MTXÙÑ╝ ýé¼ýÜ®ÝòÿÙèöÙì░, MTX Ùï¿ÙÅà ý╣ÿÙúîÙÑ╝ ÛÂîÛ│áÝò£Ùïñ. 2019 ý£áÙƒ¢ÙÑÿÙºêÝï░ýèñÝòÖÝÜî ý╣ÿÙúîýºÇý╣¿ýùÉýä£Ùèö ýï£ý×æ ýï£ýùÉ Ùï¿Û©░Û░äýØÿ ýèñÝàîÙí£ýØ┤Ùô£ÙÑ╝ Ù│æÝò®ÝòÿÙèö Û▓âýØä ÛÂîÛ│áÝòÿýÿÇÙèöÙì░, 2021 Ù»©ÛÁ¡ÙÑÿÙºêÝï░ýèñÝòÖÝÜî ý╣ÿÙúî ýºÇý╣¿ýùÉýä£Ùèö Ùï¿Û©░Û░äýØÿ ýèñÝàîÙí£ýØ┤Ùô£ýí░ý░¿ ýé¼ýÜ®ÝòÿýºÇ ýòèÙèö Û▓âý£╝Ùí£ ÛÂîÛ│áÝòÿÛ│á ý×êÙïñ. ÙÿÉÝò£ Û▓¢ýªØýØÿ ýºêÙ│æÝÖ£ýä▒ÙÅäÙÑ╝ Ù│┤ýØ┤Ùèö Û▓¢ýÜ░ýùÉÙèö HCQÙÑ╝ ýé¼ýÜ®Ýòá ýêÿ ý×êÛ│á, SSZÙÑ╝ ýé¼ýÜ®Ýò┤ Ù│╝ ýêÿ ý×êÙïñ. Ýè╣Ý×ê ý£äý×Ñ ý×ÑýòáÙí£ ýØ©Ýò┤ Û▓¢ÛÁ¼ MTXýØÿ ýé¼ýÜ®ýØ┤ ýû┤ÙáñýÜ┤ Û▓¢ýÜ░ýùÉÙèö ÛÀ╝ý£íýú╝ýé¼ÙÑ╝ ýé¼ýÜ®Ýò£ MTXÙÑ╝ Û│áÙáñÝòÿÙØ╝Û│á ÙÉÿýû┤ý×êýû┤ MTX ýé¼ýÜ®ýØÿ ýñæýÜöýä▒ýØä Ùïñýï£ Ýò£ Ù▓ê Û░òýí░ÝòÿýÿÇÙïñ(Fig. 2).
ý╣ÿÙúî 3-6Û░£ýøöýùÉ T2T ýáäÙ×ÁýØÿ Ùï¼ýä▒ ýù¼ÙÂÇÙÑ╝ ÝÅëÛ░ÇÝòÿýù¼ ÙïñýØî Ùï¿Û│äýØÿ ý╣ÿÙúîÛ░Ç ÝòäýÜöÝò£ýºÇ ÝÅëÛ░ÇÝòÿÙèöÙì░, ýØ┤ÙáçÛ▓î ýò¢ýá£ýØÿ ý£áÝÜ¿ýä▒ýùÉ ÙîÇÝò£ ÝÅëÛ░ÇÙ┐É ýòäÙïêÙØ╝, csDMARD ýò¢ýá£ýØÿ ÙÂÇý×æýÜ®ýùÉ ÙîÇÝò£ Ù¬¿ÙïêÝä░ÙºüýØ┤ ýÜöÛÁ¼ÙÉ£Ùïñ. ýú╝Ùí£ ÝÿêÛÁ¼ ýêÿý╣ÿýØÿ Û░Éýåî, Û░ä ýêÿý╣ÿ ýâüýè╣ ýù¼ÙÂÇÙÑ╝ Ù¬¿ÙïêÝä░Ùºü ÝòÿÛ▓î ÙÉ£Ùïñ.
Û▓¢ÛÁ¼ MTXýØÿ Ùï¿ÙÅà ýé¼ýÜ®ý£╝Ùí£ ý╣ÿÙúî Ù¬®Ýæ£ÙÑ╝ Ùï¼ýä▒ÝòÿýºÇ Ù¬╗Ýòá Û▓¢ýÜ░, csDMARDýØÿ Ù│æÝò®ýÜöÙ▓òýØ┤Ùéÿ ýâØÙ¼╝ÝòÖýáü ýá£ýá£/Ýæ£ýáü Ýò®ýä▒ DMARD ýá£ýᣠýé¼ýÜ®ý£╝Ùí£ Ùäÿýû┤Û░ÇÛ▓î ÙÉÿÙèöÙì░, 2021 Ù»©ÛÁ¡ÙÑÿÙºêÝï░ýèñÝòÖÝÜî ý╣ÿÙúîýºÇý╣¿ýùÉýä£Ùèö HCQ, SSZ, MTXýØÿ 3ýᣠÙ│æÝò®ýÜöÙ▓òÙ│┤ÙïñÙèö ýâØÙ¼╝ÝòÖýáü ýá£ýá£/Ýæ£ýáü Ýò®ýä▒ DMARDÙÑ╝ ýÂöÛ░ÇÝòÿÙèö Û▓âýØä ÛÂîÛ│áÝòÿÛ│á ý×êÙïñ. ÛÀ©Ùƒ¼Ùéÿ Ýÿäý×¼ ýÜ░Ùª¼ÙéÿÙØ╝ýØÿ Û©ëýù¼ý▓┤Û│äýùÉýä£Ùèö csDMARDýØÿ Ù│æÝò®ýÜöÙ▓òýØä Ù¿╝ýáÇ ýé¼ýÜ®Ýò£ Ýøä 6Û░£ýøö ýØ┤ýâü ý╣ÿÙúîÝòÿýù¼ÙÅä ÙÂêý®ÙÂäÝò£ Ù░ÿýØæýØä Ù│┤ýØ╝ Ùòî, ýâØÙ¼╝ÝòÖýáü ýá£ýá£/Ýæ£ýáü Ýò®ýä▒ DMARDÙÑ╝ ýé¼ýÜ®ÝòÿÙÅäÙíØ ÙÉÿýû┤ý×êÙïñ. ý▓½ Ù▓êýº© ýâØÙ¼╝ÝòÖýáü ýá£ýá£/Ýæ£ýáü Ýò®ýä▒ DMARDÙÑ╝ ýé¼ýÜ®Ýò£ ýØ┤ÝøäýùÉÙÅä ý╣ÿÙúî Ù¬®Ýæ£ýùÉ ÙÅäÙï¼ÝòÿýºÇ Ù¬╗Ýò£ Û▓¢ýÜ░, ÙïñÙÑ© Û©░ýáäýØä Û░ÇýºÇÙèö ýò¢ýá£Ùí£ ÙæÉ Ù▓êýº© ýò¢ýá£ÙÑ╝ ýäáÝâØÝòÿÙèö Û▓âýØ┤ ÛÂîÛ│áÙÉ£Ùïñ.
2021Ùàä Ù»©ÛÁ¡ÙÑÿÙºêÝï░ýèñÝòÖÝÜî ý╣ÿÙúîýºÇý╣¿ýùÉýä£ ýá£ýï£ÝòÿÛ│á ý×êÙèö ýâØÙ¼╝ÝòÖýáü ýá£ýá£Ùèö Ýò¡ TNF ýá£ýá£(etanercept, adalimumab, infliximab, golimumab, certolizumab pegol), co-stimulation ýûÁýá£ýá£(abatacept), IL-6 ýêÿýÜ®ý▓┤ ýûÁýá£ýá£(tocilizumab, sarilumab), Ýò¡ CD20 ýá£ýá£(rituximab)ýØ┤Ù®░, Ýæ£ýáü Ýò®ýä▒ DMARDÙèö Janus kinase (JAK) ýûÁýá£ýá£(tofacitinib, baricitinib, upadacitinib)Û░Ç ý×êÙïñ. Ù░öýØ┤ýÿñýï£Ù░ÇÙƒ¼ ýá£ýá£Ùèö originator ýâØÙ¼╝ÝòÖýáü ýá£ýá£ýÖÇ ÙÅÖÙô▒ÝòÿÛ▓î ýÀ¿Û©ëÙÉ£ÙïñÛ│á ýá£ýï£ÙÉÿÛ│á ý×êÙïñ. ýØ┤ýùÉ ÙîÇÝò£ ýé¼ýÜ®Û╣îýºÇ Û│áÙáñÝò£ÙïñÙ®┤ ýäáÝâØ Û░ÇÙèÑÝò£ ýò¢ýá£Û░Ç ÙºñýÜ░ ÙïñýûæÝòÿÛ▓î ýí┤ý×¼Ýò£Ùïñ.
csDMARDÙí£ ÙÂêý®ÙÂäÝò£ ý╣ÿÙúî Ù░ÿýØæýØä Ù│┤ýØ╝ Ùòî, ý▓½ Ù▓êýº© ýäáÝâØý£╝Ùí£Ùèö ýâüýÜ® ýñæýØ© ý╣ÿÙúîýá£ýùÉýä£ ÝÜ¿Û│╝ýáüýØ© Ù®┤ý£╝Ùí£ ýÜ░ýøöÝò£ ýò¢ýá£Ùèö ýùåýû┤ ÙïñÙÑ© ýâüÝÖ®ýØä Û│áÙáñÝòÿýù¼ ýáüýáêÝòÿÛ▓î ýäáÝâØÝòá ýêÿ ý×êÙïñ. ÙïñÙºî ýÜ░Ùª¼ÙéÿÙØ╝ýùÉýä£ rituximabýØÇ 2ý░¿ ýò¢ýá£Ùí£ ÙÂäÙÑÿÙÉÿýû┤ ý×êÙïñ.
JAK ýûÁýá£ýá£ýØÿ Û▓¢ýÜ░ Ýè╣Ý×ê ýÜ░Ùª¼ÙéÿÙØ╝ýÖÇ ýØ╝Ù│©Û│╝ Û░ÖýØÇ ýòäýï£ýòä ÛÁ¡Û░ÇýùÉýä£ ÙîÇýâüÝżýºäýØÿ ý£äÝùÿýä▒ýØ┤ ÙåÆýòäýºÇÛ│á ýáòÙºÑÝÿêýáä Û░ÇÙèÑýä▒ýùÉ ÙîÇÝò┤ ý£áýØÿÝò┤ýò╝ Ýò¿ýØ┤ ýòîÙáñýá© ýÖöÙïñ. ýÁ£ÛÀ╝ tofacitinib (Xeljanz, Pfizer Inc., New York, NY, USA)ýùÉ ÙîÇÝò£ ý×äýâü ýù░ÛÁ¼ýùÉýä£ TNF ýûÁýá£ýᣠÙîÇÙ╣ä ýú╝ýÜö ýï¼ÝÿêÛ┤Ç ýØ┤ýâüýé¼Û▒┤ Ù░Å ýòö Ù░£ýâØ ý£äÝùÿýùÉ Û┤ÇÝò£ ýòêýáäýä▒ýùÉýä£ Ù╣äýù┤Ùô▒ýä▒ýØä Ùºîýí▒ÝòÿýºÇ Ù¬╗Ýò£ Û▓âý£╝Ùí£ ÙéÿÝâÇÙéÿ Ù¼©ýá£Û░Ç ýá£Û©░ÙÉÿýùêÙïñ[8]. ÛÀ©Ùƒ¼Ùéÿ ÙîÇÛÀ£Ù¬¿ ÙáêýºÇýèñÝè©Ùª¼ýØÿ ÙÂäýäØ Û▓░Û│╝ýùÉýä£Ùèö ÙîÇýâüÝżýºä ýÖ©ýØÿ ýï¼ÝÿêÛ┤Ç ýØ┤ýâüýé¼Û▒┤, ýòö Ù░£ýâØ, ýé¼ÙºØ ý£äÝùÿýùÉ ÙîÇÝò┤ ÙæÉ ýá£ýá£Û░Ç Ù╣äýèÀÝò£ ý£äÝùÿÙÅäÙÑ╝ Ù│┤ýÿÇÙïñ[9]. ÙÿÉÝò£, ýÜ░Ùª¼ÙéÿÙØ╝ýØÿ ÝÖÿý×É Ýè╣ýä▒Û│╝Ùèö ÙïñÙÑ© ÝÖÿý×ÉÙôñýùÉýä£ýØÿ ÙÂäýäØ Û▓░Û│╝Ùí£ ýâØÛ░üÙÉÿýû┤ ýòäýºüÛ╣îýºÇ csDMARD ýïñÝî¿ ýØ┤Ýøä 1ý░¿ ý╣ÿÙúîýá£ýùÉýä£ Ù¬¿Ùôá b/tsDMARDÛ░Ç Û░ÖýØÇ ýáòÙÅäýØÿ ýäáÝÿ©ÙÅäÙí£ ýäáÝâØÙÉÿýû┤ýò╝ Ýò£ÙïñÙèö ÛÂîÛ│áýùÉÙèö Ù│ÇÝò¿ýØ┤ ýùåÛ│á, ýÂöÝøä ýù░ÛÁ¼ÙôñýØÿ Û▓░Û│╝Û░Ç Ù│┤Û│áÙÉÿýû┤ýò╝ Ýòá Û▓âý£╝Ùí£ Ù│┤ýØ©Ùïñ.
ýâØÙ¼╝ÝòÖýáü ýá£ýá£/Ýæ£ýáüÝò®ýä▒ý╣ÿÙúîýᣠýé¼ýÜ® ýáäýùÉÙèö Ýê¼ýù¼ ýáä Û│áÙáñÝò┤ýò╝ Ýòá ýé¼Ýò¡ÙôñýØ┤ ý×êÙïñ. ýâØÙ¼╝ÝòÖýáü ýá£ýᣠÝê¼ýù¼ ýØ┤Ýøä Û▓░ÝòÁ Û░Éýù╝/ ý×áÙ│Á Û▓░ÝòÁýØÿ ÝÖ£ýä▒ÝÖö Û░ÇÙèÑýä▒ýØ┤ ý×êýû┤, ýâØÙ¼╝ÝòÖýáü ýá£ýᣠÝê¼ýù¼ ýáäýùÉ Ù░ÿÙô£ýï£ Û▓░ÝòÁýùÉ ÙîÇÝò£ Û▓Çýé¼ÙÑ╝ ýï£ÝûëÝòÿÙÅäÙíØ ÛÂîÛ│áÝòÿÛ│á ý×êÙïñ[10]. Interferon gamma release assay Û▓Çýé¼ýÖÇ ÝØëÙÂÇ X-ray Û▓Çýé¼ÙÑ╝ Ýê¼ýù¼ ýáäýùÉ Ù░ÿÙô£ýï£ ýï£ÝûëÝòÿÛ│á, ý×áÙ│Á Û▓░ÝòÁ ýûæýä▒ýØ© Û▓¢ýÜ░ýùÉÙèö 3ýú╝ýØ┤ýâüýØÿ ýÿêÙ░® ýÜöÙ▓òýØä ýï£ÝûëÝò£ ÙÆñ ýò¢ýᣠÝê¼ýù¼ÙÑ╝ Û│áÙáñÝòá ýêÿ ý×êÙïñ. ý£íýòäýóàýØä Ýÿòýä▒ÝòÿÙèö Ùì░ ÝòäýÜöÝò£ TNFÙÑ╝ ýûÁýá£ÝòÿÙèö Ýò¡ TNF ýá£ýá£ýùÉýä£ ý£äÝùÿýä▒ýØ┤ ÙåÆý£╝Ù®░, ýØ┤ ýñæ etanerceptýùÉýä£Ùèö ýâüÙîÇýáüý£╝Ùí£ ý£äÝùÿÙÅäÛ░Ç Ùé«Ùïñ. ýâØÙ¼╝ÝòÖýáü ýá£ýᣠýáäý▓┤ýùÉýä£Ùèö rituximabýØ┤ Û░Çý×Ñ ý£äÝùÿÙÅäÛ░Ç Ùé«ýØÇ ýò¢ýá£Ùí£ ýòîÙáñýá© ý×êÙïñ.
ÙÿÉÝò£, ýú╝Ùí£ JAK ýûÁýá£ýá£ýùÉýä£ ÙîÇýâüÝżýºäýØÿ ý£äÝùÿÙÅäÛ░Ç ýâüýè╣Ýòÿýù¼, Ýê¼ýù¼ ýáä Ù░▒ýïá Ýê¼ýù¼ÙÑ╝ Û│áÙáñÝòá ýêÿ ý×êÙïñ. MTXýÖÇýØÿ Ù│æýÜ® ýùåýØ┤ Ùï¿ÙÅà ýÜöÙ▓òýØä ýé¼ýÜ®Ýòá Ùòî ý£äÝùÿÙÅäÛ░Ç Ùé«ýòäýºÇÙèö Û▓âý£╝Ùí£ ýòîÙáñýá© ý×êÙïñ. BÝÿòÛ░äýù╝ýØÿ ÝÖ£ýä▒ÝÖö ý£äÝùÿýØ┤ ý×êýû┤ Ýò¡Ù░öýØ┤Ùƒ¼ýèñýá£ýᣠÝê¼ýù¼ÙÑ╝ Û│áÙáñÝòÿýù¼ýò╝ Ýò£Ùïñ. Ýæ£Ù®┤Ýò¡ýøÉ(hepatitis B surface antigen) ýûæýä▒ýØ┤Û▒░Ùéÿ DNA ýûæýä▒ýØ© ÝÖÿý×ÉýùÉýä£ ýò¢ýᣠÙ░Å ÝÖÿý×É ýâüÝâ£ÙÑ╝ Û│áÙáñÝòÿýù¼ Ýê¼ýù¼ÝòÿÙ®░, rituximabýØÿ Û▓¢ýÜ░ ý£äÝùÿÙÅäÛ░Ç ÙåÆýòä core Ýò¡ý▓┤Ùºî ýûæýä▒ýØ┤ýû┤ÙÅä Ýò¡Ù░öýØ┤Ùƒ¼ýèñýá£ýá£ÙÑ╝ Ýê¼ýù¼ÝòÿÙèö Û▓âýØ┤ ÛÂîÛ│áÙÉ£Ùïñ.
ýâØÙ¼╝ÝòÖýáü ýá£ýá£ÙÑ╝ Ýê¼ýù¼ Ù░øÙèö ÝÖÿý×ÉÙôñýØÇ ýâØÙ░▒ýïáýØÿ Ýê¼ýù¼Û░Ç Û©êÛ©░ýØ┤Ùïñ. ÙîÇÝæ£ýáüý£╝Ùí£ Ýÿäý×¼ ÛÁ¡Ùé┤ýùÉýä£ ýé¼ýÜ®ÙÉÿÙèö ÙîÇýâüÝżýºä Ù░▒ýïáýØÇ ýâØÙ░▒ýïáý£╝Ùí£, ýâØÙ¼╝ÝòÖýáü ýá£ýá£ÙÑ╝ Ýê¼ýù¼ ýñæýØ© ÝÖÿý×ÉýùÉýä£Ùèö Û©êÛ©░ýØ┤Ùïñ. JAK ýûÁýá£ýá£ýØÿ Û▓¢ýÜ░ Ýê¼ýù¼ ýØ┤Ýøä ÙîÇýâü Ýżýºä Ù░£ýâØýØÿ ý£äÝùÿýØ┤ ý×êý£╝Ù»ÇÙí£, ýï£ý×æ ýáäýùÉ Ù░▒ýïáýØä Û│áÙáñÝòá ýêÿ ý×êÙïñ.
ý╣ÿÙúî Ù¬®Ýæ£ýùÉ ÙÅäÙï¼Ýòÿýù¼ ý×ÑÛ©░Û░ä Ùé«ýØÇ Û┤ÇÝò┤/Ýÿ╣ýØÇ Ùé«ýØÇ ýºêÙ│æ ÝÖ£ýä▒ÙÅäÙÑ╝ ý£áýºÇÝòÿÙèö ýâüÝâ£Û░Ç ÙÉÿÙ®┤ ý╣ÿÙúî ýò¢ýá£ýØÿ Û░ÉÙƒëýØä Û│áÙáñÝòá ýêÿ ý×êÙïñ. 2021 Ù»©ÛÁ¡ÙÑÿÙºêÝï░ýèñÝòÖÝÜî ý╣ÿÙúîýºÇý╣¿ýùÉýä£Ùèö ýáüýû┤ÙÅä 1Û░ÇýºÇýØÿ DMARDÙèö ý£áýºÇÙÑ╝ ÝòÿÙèö Û▓âýØä ýøÉý╣Öý£╝Ùí£ Ýòÿýù¼, ÙüèÙèö Û▓âÙ│┤ÙïñÙèö ýܮكëýØä Û░ÉÙƒëÝòá Û▓âýØä ÛÂîÛ│áÝòÿÛ│á ý×êÙïñ. Û░ÉÙƒëÝòá Û▓¢ýÜ░ 2019 ý£áÙƒ¢ÙÑÿÙºêÝï░ýèñÝòÖÝÜî ýºÇý╣¿ýùÉýä£Ùèö ýâØÙ¼╝ÝòÖýáü ýá£ýá£ÙÑ╝ Ù¿╝ýáÇ Û░ÉÙƒëÝòá Û▓âýØä ÛÂîÛ│áÝòÿýÿÇÙèöÙì░, 2021 Ù»©ÛÁ¡ÙÑÿÙºêÝï░ýèñÝòÖÝÜî ý╣ÿÙúî ýºÇý╣¿ýùÉýä£Ùèö csDMARDÙÑ╝ Ù¿╝ýáÇ Û░ÉÙƒëÝòá Û▓âýØä ÛÂîÛ│áÝòÿýÿÇÙïñ. ýØ┤Ùèö csDMARDýùÉ ÙÂêý®ÙÂäÝò£ ÝÜ¿Û│╝ÙÑ╝ Ù│┤ýÿÇÛ©░ ÙòîÙ¼©ýùÉ ýâØÙ¼╝ÝòÖýáü ýá£ýá£ÙÑ╝ ýÂöÛ░ÇÝò£ Û▓âýØ┤ýùêý£╝Ù»ÇÙí£ ýâØÙ¼╝ÝòÖýáü ýá£ýᣠÛ░ÉÙƒë ýï£ ýºêÙ│æýØÿ ý×¼ÝÖ£ýä▒ ý£äÝùÿýØ┤ Ùìö ÙåÆÛ©░ ÙòîÙ¼©ýØ┤ÙØ╝Û│á ÛÀ╝Û▒░ÙÑ╝ ýá£ýï£ÝòÿÛ│á ý×êÙïñ.
Ýè╣Ù│äÝ×ê, 2021 Ù»©ÛÁ¡ÙÑÿÙºêÝï░ýèñÝòÖÝÜî ý╣ÿÙúîýºÇý╣¿ýùÉýä£Ùèö ÔÇ£Ýè╣ýêÿýâüÝÖ®ýùÉýä£ýØÿ Û│áÙáñÔÇØýùÉ ÙîÇÝò£ ÙÂÇÙÂäýØä Ùö░Ùí£ ýºÇý╣¿ý£╝Ùí£ ýá£ýï£ÝòÿÛ│á ý×êÙïñ. ÙÑÿÙºêÝï░ýèñ Û▓░ýáêýØ┤ ý×êÙèö ÝÖÿý×ÉýùÉýä£Ùèö MTXÙÑ╝ ýé¼ýÜ®ÝòÿýÿÇýØä Ùòî Û▓░ýáêýØ┤ ýòàÝÖöÙÉá ýêÿ ý×êýû┤ MTX ÙîÇýïá ÙïñÙÑ© DMARDÙÑ╝ ýé¼ýÜ®ÝòÿÙèö Û▓âýØ┤ ýóïÙïñÙèö ýØÿÛ▓¼ýØ┤ ý×êýû┤ ýÖöýºÇÙºî, Û▓░ýáêýØ┤ ý×êÙèö ÝÖÿý×ÉýùÉýä£ÙÅä MTXÙÑ╝ ýï£ý×æÝò┤Ù│┤Ùèö Û▓âýØ┤ ýóïÛ│á, ýòàÝÖö ýï£ýùÉ Ù│ÇÛ▓¢ýØä Û│áÙáñÝò£ÙïñÛ│á ÛÂîÛ│áÝòÿýÿÇÙïñ. Û░äýºêýä▒ ÝÅÉýºêÝÖÿýØ┤Ùéÿ ÙîÇýé¼ýä▒ Û░äýºêÝÖÿýØ┤ ý×êÙèö ÝÖÿý×ÉýùÉýä£ÙÅä ÝÅÉýºêÝÖÿýØÿ ýºäÝûëýØ┤Ùéÿ, Û░äýºêÝÖÿ ýòàÝÖöÙÑ╝ ýÜ░ÙáñÝòÿýù¼ Ù¼┤ýí░Û▒┤ MTXýØÿ ýé¼ýÜ®ýØä Ù░░ýá£ÝòÿÛ©░Ù│┤ÙïñÙèö Ýò£ Ù▓ê ýé¼ýÜ®Ýò┤Ù│┤Û│á ýòàÝÖöýï£ýùÉ ÙïñÙÑ© ýò¢ýá£ÙÑ╝ Û│áÙáñÝò┤Ù│┤Ùèö Û▓âýØ┤ ýóïÛ▓áÙïñÛ│á ÛÂîÛ│áÝòÿýù¼ MTXýØÿ ýñæýÜöýä▒ýØä Ùïñýï£ Ýò£ Ù▓ê Û░òýí░ÝòÿýÿÇÙïñ.
ýâØÙ¼╝ÝòÖýáü ýá£ýᣠýé¼ýÜ® ýï£ ý£áÝÜ¿ýä▒ ý©íÙ®┤ýùÉýä£Ùèö ÙÅÖÙô▒ÝòÿýÿÇýºÇÙºî, ýØ┤ýáäýùÉ Ùª╝ÝöäÛÁ¼ ýªØýïØ ýºêÝÖÿýØ┤ ý×êÙìÿ ÝÖÿý×ÉýùÉýä£Ùèö rituximabýØä ÛÂîÛ│áÝòÿÛ│á, ýñæÙô▒ÙÅä ýï¼ÙÂÇýáäýØ┤ ý×êÙèö ÝÖÿý×ÉýùÉýä£Ùèö Ýò¡ TNF ýá£ýᣠýØ┤ýÖ©ýØÿ ÙïñÙÑ© ýá£ýá£ÙÑ╝ ÛÂîÛ│áÝòÿÙ®░, Ù╣äýáòÝÿòÝò¡ýé░ÝÖöÛÀá Û░Éýù╝ýØ┤ ý×êÙèö ÝÖÿý×ÉýùÉýä£Ùèö abataceptÛ░Ç ýóÇ Ùìö ýòêýáäÝòÿÛ▓î ýé¼ýÜ®ÙÉá ýêÿ ý×êýØîýØä ÛÂîÛ│áÝòÿýÿÇÙïñ.
ÙÑÿÙºêÝï░ýèñÛ┤Çýáêýù╝ýØÿ ý╣ÿÙúîÙèö ýïñýᣠÙ│æÝâ£ýâØÙª¼ýùÉ ÙîÇÝò£ ýºÇýïØýØÿ ýÂòýáüÛ│╝ Ýò¿Û╗ÿ, Ýæ£ýáü Ù¼╝ýºêýØä ýûÁýá£ÝòÿÙèö ýâØÙ¼╝ÝòÖýáü ýá£ýá£/Ýæ£ýáüÝò®ýä▒ ý╣ÿÙúîýá£Û░Ç ÙÅäý×àÙÉÿÙ®┤ýä£ Û┤äÙ¬®Ýòá ÙºîÝò£ ý╣ÿÙúî ýä▒ýáüýØÿ ÝûÑýâüýØä Ù│┤ýØ┤Û│á ý×êÙïñ. ýºêÙ│æÝÖ£ýä▒ÙÅäÙÑ╝ Ùé«Û▓î ý£áýºÇÝòÿÙÅäÙíØ ý╣ÿÙúîÙÑ╝ ýí░ýáêÝòÿÙèö T2TýØÿ ýøÉý╣Öý£╝Ùí£, ýù¼Ùƒ¼ Û░ÇýºÇ Ýè╣ýä▒ýØä Û│áÙáñÝò£ ýò¢ýá£ýØÿ ýäáÝâØÛ│╝ Ù¬¿ÙïêÝä░Ùºü, Û░ÉÙƒëýùÉ ÙîÇÝò£ ý╣ÿÙúîýºÇý╣¿ýØ┤ ýùàÙì░ýØ┤Ýè© ÙÉÿÛ│á ý×êÙïñ(Table 1). ÝÖÿý×É Û░£Û░£ýØ©ýØÿ ýºêÙ│æ Ýè╣ýä▒ýùÉ Ùö░ÙÑ© Ùº×ýÂñ ý╣ÿÙúî ýáäÙ×ÁýùÉ ÙîÇÝò£ ýªØÛ▒░Û░Ç ýÂöÝøä ýù░ÛÁ¼ýùÉýä£ ýû╗ýû┤ýºäÙïñÙ®┤ Ùìö ýØ┤ýâüýáüýØ© ý╣ÿÙúîýºÇý╣¿ý£╝Ùí£ Ù░£ýáäÝòá ýêÿ ý×êýØä Û▓âýØ┤Ùïñ.
REFERENCES
1. McInnes IB, Schett G. The pathogenesis of rheumatoid arthritis. N Engl J Med 2011;365:2205ÔÇô2219.


2. van Vollenhoven R. Treat-to-target in rheumatoid arthritis -are we there yet? Nat Rev Rheumatol 2019;15:180ÔÇô186.


3. Monaco C, Nanchahal J, Taylor P, Feldmann M. Anti-TNF therapy: past, present and future. Int Immunol 2015;27:55ÔÇô62.


4. Lau CS, Chia F, Dans L, et al. 2018 update of the APLAR recommendations for treatment of rheumatoid arthritis. Int J Rheum Dis 2019;22:357ÔÇô375.


5. Fraenkel L, Bathon JM, England BR, et al. 2021 American College of Rheumatology guideline for the treatment of rheumatoid arthritis. Arthritis Care Res (Hoboken) 2021;73:924ÔÇô939.

6. Smolen JS, Landew├® RBM, Bijlsma JWJ, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2019 update. Ann Rheum Dis 2020;79:685ÔÇô699.

7. Lee YH. Comparison of disease activity score-28 based on erythrocyte sedimentation rate and C-reactive protein level in rheumatoid arthritis. J Rheum Dis 2018;25:1ÔÇô2.

8. Ytterberg SR, Bhatt DL, Mikuls TR, et al. Cardiovascular and cancer risk with tofacitinib in rheumatoid arthritis. N Engl J Med 2022;386:316ÔÇô326.


2019 Update of the European league against rheumatism rheumatoid arthritis management recommendations in form of an algorithm. Adapted from reference [6].
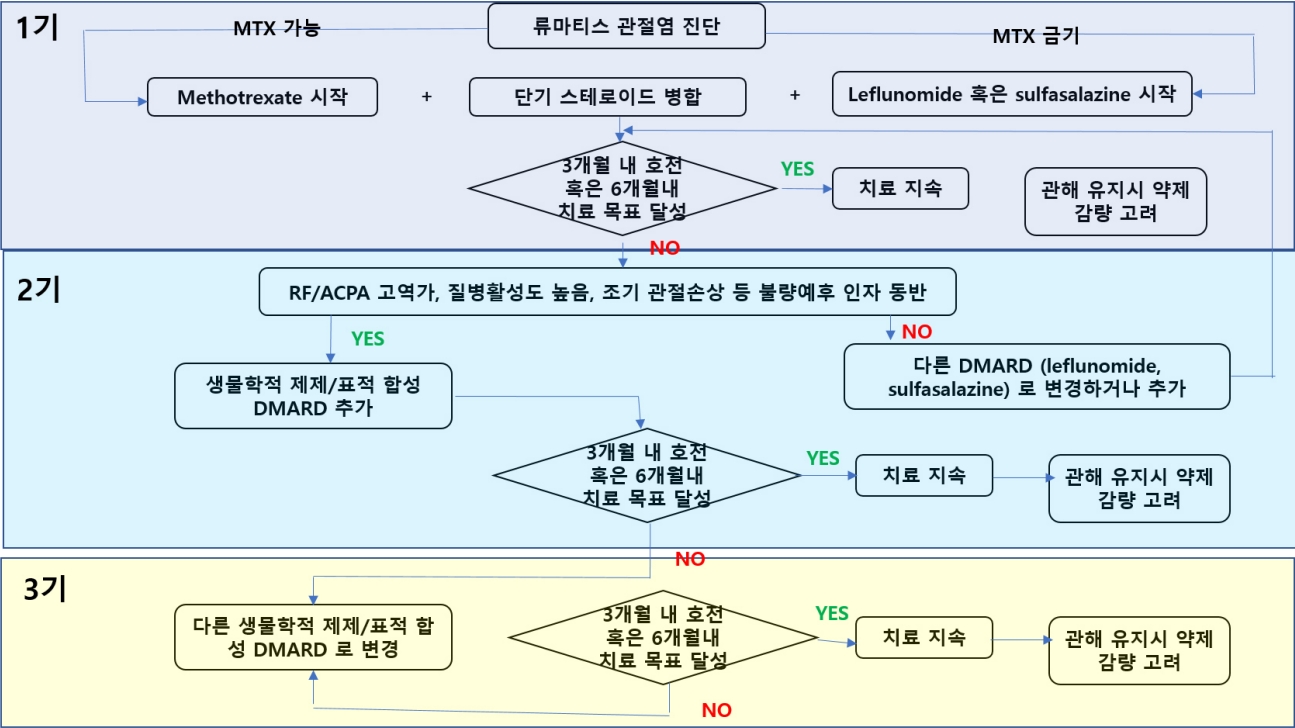
Figure 1.
Presentation of the 2021 American College of Rheumatology guideline for the treatment of rheumatoid arthritis in form of an algorithm.
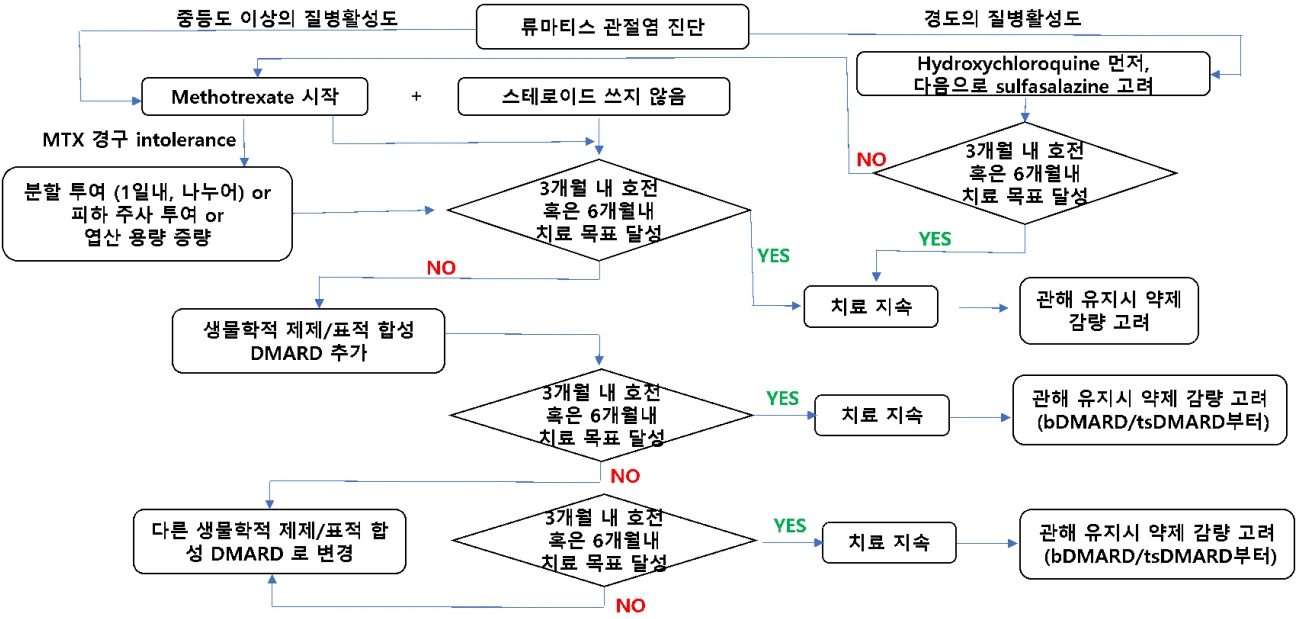
Figure 2.
Table 1.
Comparison of the 2015 American College of Rheumatology, 2021 American College of Rheumatology and European league against rheumatism guideline for the treatment of rheumatoid arthritis
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 9,423 View
- 935 Download



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



