류마티스관절염 치료지침 업데이트
Treatment Guidelines for Rheumatoid Arthritis
Article information
Trans Abstract
Rheumatoid arthritis (RA) is a chronic systemic autoimmune disease with synovitis and extra-articular systemic involvement. Chronic RA treatment is challenging and represents a major health burden worldwide. Recent insights regarding RA pathogenesis have led to novel therapeutic agents, especially biologics. Furthermore, accumulating experience and new clinical studies have helped to inform updated recommendations for treatment of RA. Recently, treatment guidelines from the American College of Rheumatology were released. Here, we review these guidelines and their application to daily practice.
서 론
류마티스관절염은 대표적인 다발 염증 관절 질환으로 치료하지 않는 경우 발병 후 2년 이내에 관절에 비가역적인 손상이 일어나 일상생활에 장애를 초래할 수 있다[1]. 또한 관절염 외에도 다른 전신 증상(공막염, 간질성 폐질환, 피부 혈관염, 류마티스 결절 등)을 일으킬 수 있고, 전신 염증에 대한 직·간접적인 영향으로 심혈관계 질환, 골다공증 등 동반 합병 질환의 발생률도 일반 인구보다 높다. 따라서 질병 초기부터 관절 손상을 방지할 수 있는 항류마티스약제(disease modifying anti rheumatic drug, DMARD)를 사용하는 것이 중요하며, 전신 증상에 대한 선별 검사 및 정확한 진단과 동반 합병증에 대한 모니터링, 관리가 전반적으로 함께 이루어져야 한다.
류마티스관절염의 치료는 낮은 질병활성도/관해를 목표로 일정 기간마다 목표 달성 여부를 평가하여 치료 약제를 변경하는 방식으로 이루어진다[2]. 2000년대 들어 항 tumor necrosis factor-α (anti-TNF)를 위시한 생물학적 제제 (biologics)가 도입되어 류마티스관절염 치료의 획기적인 발전이 있었다[3]. 초기에는 전통적인 DMARD로 시작하여, 표적 치료제 사용으로 넘어가는 단계적인 치료를 하게 되는데, 이러한 제제들의 적절한 사용을 위해서는 감염 취약성(결핵 활성화 등)을 비롯하여 부작용에 관련된 사전 준비와 모니터링이 필요하다[4].
새로운 치료제의 도입과 여러 가지 연구로 얻어지는 증거를 바탕으로 제정되는 류마티스관절염 치료지침은 꾸준히 업데이트 되고 있다. 세계적으로 여러 진료지침이 있지만, 미국류마티스학회와 유럽류마티스학회의 가이드라인이 주축이 되고 있으며, 최근 미국류마티스학회 가이드라인이 개정되어 발표되었다. 현재 우리나라의 류마티스관절염 진료 지침은 대한류마티스학회에서 개발 중이며, 본 종설에서는 2021 미국류마티스학회 치료지침[5]과 2019 유럽류마티스학회 치료지침[6]을 중심으로 실제 우리 진료 현장에서 적용할 수 있는 류마티스관절염의 치료지침을 소개하고자 한다.
본 론
치료의 일반적인 원칙
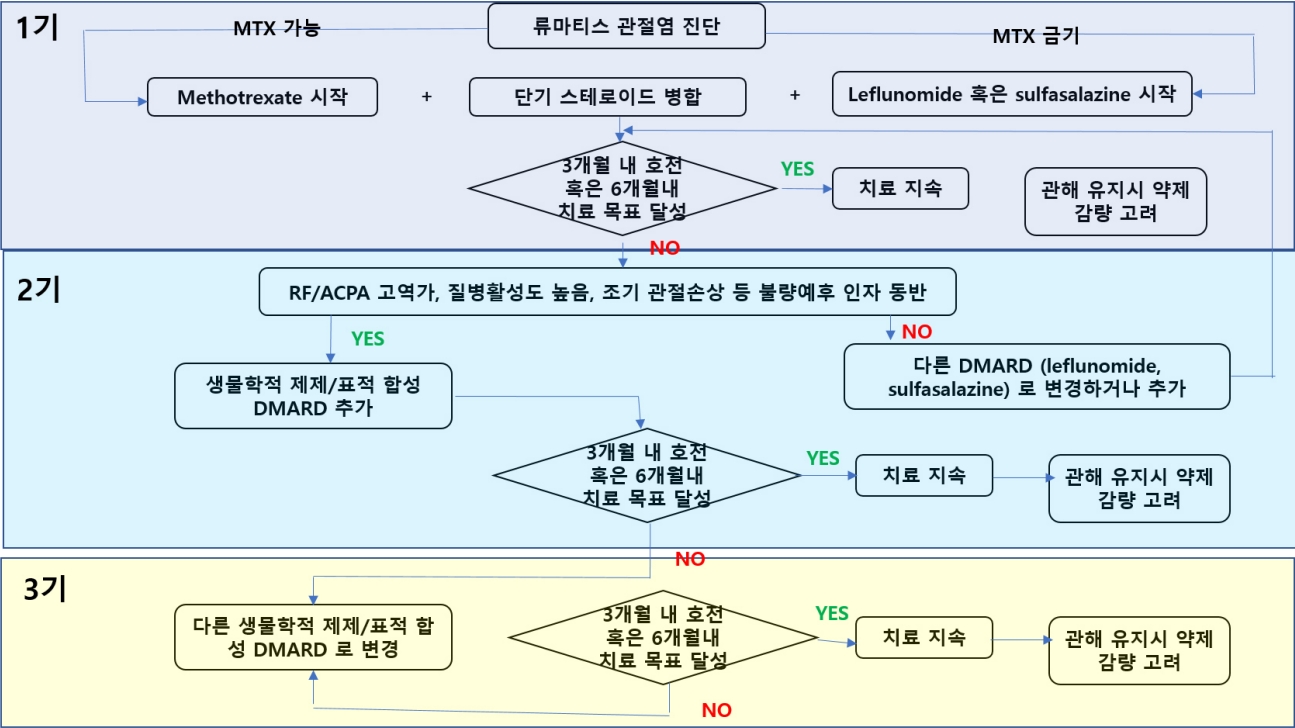
현재 치료 가이드라인은 류마티스관절염의 질병활성도를 평가하는 지표를 기준으로 하여 낮은 질병활성도를 유지하는 것을 목표로 하며, 이를 treat-to-target (T2T) 전략이라고 하여 치료의 일반적인 원칙으로 하고 있다. 질병활성도 평가 지표 가운데 하나인 Disease Activity Score 28은 압통관절수, 부종관 절수, 환자가 평가하는 질병활성도 및 급성기 반응 물질(acute phase reactant)의 상승 정도를 계산하여 만들어낸 종합지표로서 이를 통해 질병활성도를 평가하여 치료 방침의 변경을 결정하는 데 사용하고 있다[7]. 1차적으로 류마티스관절염이 진단된 환자에서 특별한 비적응증이 없다면 모든 류마티스관절염 환자에서 메토트렉세이트(methotrexate, MTX)를 기본으로 하는 DMARD를 사용하고, 이에 충분한 반응을 보이지 않을때, 생물학적 제제/표적 합성 DMARD 제제를 사용하게 된다. 2019년 유럽류마티스학회 치료지침에서는 MTX 혹은 다른 전통적인 DMARD (conventional synthetic [cs] DMARD)를 기반으로 하여 치료를 시작하고, 3-6개월마다 T2T 평가를 시행 하여, 현 단계의 치료를 지속하거나, 다음 단계의 치료를 도입 하는 치료 알고리즘을 제시하였다(Fig. 1). 2021년 미국류마티스학회 치료지침에서 csDMARDs는 하이드록시클로로퀸 (hydroxychloroquine, HCQ), 설파살라진(sulfasalazine, SSZ), MTX, 레플루노마이드(leflunomide)를 포함하는 것으로 정의하였다.
치료의 시작, 모니터링, 변경
류마티스관절염이 진단되면 최대한 빨리 항류마티스 제제를 도입하여야 한다. 특별한 부적응증이 없는 한 MTX를 사용하는데, MTX 단독 치료를 권고한다. 2019 유럽류마티스학회 치료지침에서는 시작 시에 단기간의 스테로이드를 병합하는 것을 권고하였는데, 2021 미국류마티스학회 치료 지침에서는 단기간의 스테로이드조차 사용하지 않는 것으로 권고하고 있다. 또한 경증의 질병활성도를 보이는 경우에는 HCQ를 사용할 수 있고, SSZ를 사용해 볼 수 있다. 특히 위장 장애로 인해 경구 MTX의 사용이 어려운 경우에는 근육주사를 사용한 MTX를 고려하라고 되어있어 MTX 사용의 중요성을 다시 한 번 강조하였다(Fig. 2).
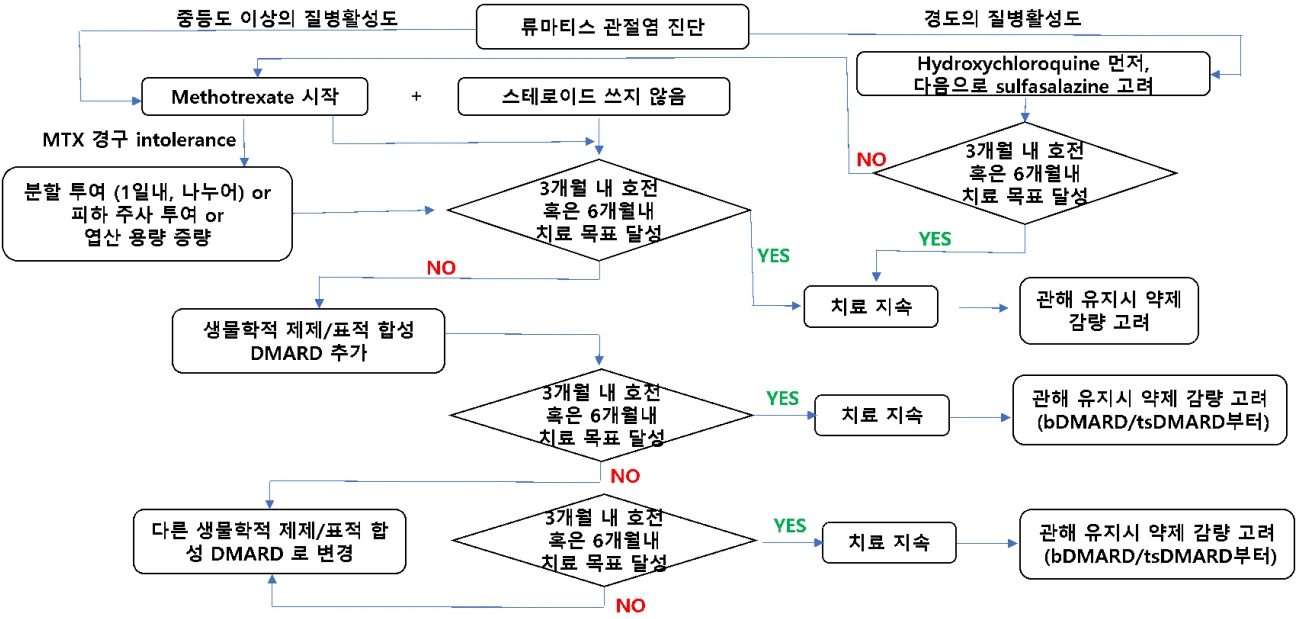
Presentation of the 2021 American College of Rheumatology guideline for the treatment of rheumatoid arthritis in form of an algorithm.
치료 3-6개월에 T2T 전략의 달성 여부를 평가하여 다음 단계의 치료가 필요한지 평가하는데, 이렇게 약제의 유효성에 대한 평가뿐 아니라, csDMARD 약제의 부작용에 대한 모니터링이 요구된다. 주로 혈구 수치의 감소, 간 수치 상승 여부를 모니터링 하게 된다.
경구 MTX의 단독 사용으로 치료 목표를 달성하지 못할 경우, csDMARD의 병합요법이나 생물학적 제제/표적 합성 DMARD 제제 사용으로 넘어가게 되는데, 2021 미국류마티스학회 치료지침에서는 HCQ, SSZ, MTX의 3제 병합요법보다는 생물학적 제제/표적 합성 DMARD를 추가하는 것을 권고하고 있다. 그러나 현재 우리나라의 급여체계에서는 csDMARD의 병합요법을 먼저 사용한 후 6개월 이상 치료하여도 불충분한 반응을 보일 때, 생물학적 제제/표적 합성 DMARD를 사용하도록 되어있다. 첫 번째 생물학적 제제/표적 합성 DMARD를 사용한 이후에도 치료 목표에 도달하지 못한 경우, 다른 기전을 가지는 약제로 두 번째 약제를 선택하는 것이 권고된다.
생물학적 제제/표적합성치료제의 사용
2021년 미국류마티스학회 치료지침에서 제시하고 있는 생물학적 제제는 항 TNF 제제(etanercept, adalimumab, infliximab, golimumab, certolizumab pegol), co-stimulation 억제제(abatacept), IL-6 수용체 억제제(tocilizumab, sarilumab), 항 CD20 제제(rituximab)이며, 표적 합성 DMARD는 Janus kinase (JAK) 억제제(tofacitinib, baricitinib, upadacitinib)가 있다. 바이오시밀러 제제는 originator 생물학적 제제와 동등하게 취급된다고 제시되고 있다. 이에 대한 사용까지 고려한다면 선택 가능한 약제가 매우 다양하게 존재한다.
csDMARD로 불충분한 치료 반응을 보일 때, 첫 번째 선택으로는 상용 중인 치료제에서 효과적인 면으로 우월한 약제는 없어 다른 상황을 고려하여 적절하게 선택할 수 있다. 다만 우리나라에서 rituximab은 2차 약제로 분류되어 있다.
JAK 억제제의 경우 특히 우리나라와 일본과 같은 아시아 국가에서 대상포진의 위험성이 높아지고 정맥혈전 가능성에 대해 유의해야 함이 알려져 왔다. 최근 tofacitinib (Xeljanz, Pfizer Inc., New York, NY, USA)에 대한 임상 연구에서 TNF 억제제 대비 주요 심혈관 이상사건 및 암 발생 위험에 관한 안전성에서 비열등성을 만족하지 못한 것으로 나타나 문제가 제기되었다[8]. 그러나 대규모 레지스트리의 분석 결과에서는 대상포진 외의 심혈관 이상사건, 암 발생, 사망 위험에 대해 두 제제가 비슷한 위험도를 보였다[9]. 또한, 우리나라의 환자 특성과는 다른 환자들에서의 분석 결과로 생각되어 아직까지 csDMARD 실패 이후 1차 치료제에서 모든 b/tsDMARD가 같은 정도의 선호도로 선택되어야 한다는 권고에는 변함이 없고, 추후 연구들의 결과가 보고되어야 할 것으로 보인다.
생물학적 제제/표적합성치료제 사용 전에는 투여 전 고려해야 할 사항들이 있다. 생물학적 제제 투여 이후 결핵 감염/ 잠복 결핵의 활성화 가능성이 있어, 생물학적 제제 투여 전에 반드시 결핵에 대한 검사를 시행하도록 권고하고 있다[10]. Interferon gamma release assay 검사와 흉부 X-ray 검사를 투여 전에 반드시 시행하고, 잠복 결핵 양성인 경우에는 3주이상의 예방 요법을 시행한 뒤 약제 투여를 고려할 수 있다. 육아종을 형성하는 데 필요한 TNF를 억제하는 항 TNF 제제에서 위험성이 높으며, 이 중 etanercept에서는 상대적으로 위험도가 낮다. 생물학적 제제 전체에서는 rituximab이 가장 위험도가 낮은 약제로 알려져 있다.
또한, 주로 JAK 억제제에서 대상포진의 위험도가 상승하여, 투여 전 백신 투여를 고려할 수 있다. MTX와의 병용 없이 단독 요법을 사용할 때 위험도가 낮아지는 것으로 알려져 있다. B형간염의 활성화 위험이 있어 항바이러스제제 투여를 고려하여야 한다. 표면항원(hepatitis B surface antigen) 양성이거나 DNA 양성인 환자에서 약제 및 환자 상태를 고려하여 투여하며, rituximab의 경우 위험도가 높아 core 항체만 양성이어도 항바이러스제제를 투여하는 것이 권고된다.
생물학적 제제를 투여 받는 환자들은 생백신의 투여가 금기이다. 대표적으로 현재 국내에서 사용되는 대상포진 백신은 생백신으로, 생물학적 제제를 투여 중인 환자에서는 금기이다. JAK 억제제의 경우 투여 이후 대상 포진 발생의 위험이 있으므로, 시작 전에 백신을 고려할 수 있다.
약제 감량(tapering)
치료 목표에 도달하여 장기간 낮은 관해/혹은 낮은 질병 활성도를 유지하는 상태가 되면 치료 약제의 감량을 고려할 수 있다. 2021 미국류마티스학회 치료지침에서는 적어도 1가지의 DMARD는 유지를 하는 것을 원칙으로 하여, 끊는 것보다는 용량을 감량할 것을 권고하고 있다. 감량할 경우 2019 유럽류마티스학회 지침에서는 생물학적 제제를 먼저 감량할 것을 권고하였는데, 2021 미국류마티스학회 치료 지침에서는 csDMARD를 먼저 감량할 것을 권고하였다. 이는 csDMARD에 불충분한 효과를 보였기 때문에 생물학적 제제를 추가한 것이었으므로 생물학적 제제 감량 시 질병의 재활성 위험이 더 높기 때문이라고 근거를 제시하고 있다.
특수상황에서의 고려
특별히, 2021 미국류마티스학회 치료지침에서는 “특수상황에서의 고려”에 대한 부분을 따로 지침으로 제시하고 있다. 류마티스 결절이 있는 환자에서는 MTX를 사용하였을 때 결절이 악화될 수 있어 MTX 대신 다른 DMARD를 사용하는 것이 좋다는 의견이 있어 왔지만, 결절이 있는 환자에서도 MTX를 시작해보는 것이 좋고, 악화 시에 변경을 고려한다고 권고하였다. 간질성 폐질환이나 대사성 간질환이 있는 환자에서도 폐질환의 진행이나, 간질환 악화를 우려하여 무조건 MTX의 사용을 배제하기보다는 한 번 사용해보고 악화시에 다른 약제를 고려해보는 것이 좋겠다고 권고하여 MTX의 중요성을 다시 한 번 강조하였다.
생물학적 제제 사용 시 유효성 측면에서는 동등하였지만, 이전에 림프구 증식 질환이 있던 환자에서는 rituximab을 권고하고, 중등도 심부전이 있는 환자에서는 항 TNF 제제 이외의 다른 제제를 권고하며, 비정형항산화균 감염이 있는 환자에서는 abatacept가 좀 더 안전하게 사용될 수 있음을 권고하였다.
결 론
류마티스관절염의 치료는 실제 병태생리에 대한 지식의 축적과 함께, 표적 물질을 억제하는 생물학적 제제/표적합성 치료제가 도입되면서 괄목할 만한 치료 성적의 향상을 보이고 있다. 질병활성도를 낮게 유지하도록 치료를 조절하는 T2T의 원칙으로, 여러 가지 특성을 고려한 약제의 선택과 모니터링, 감량에 대한 치료지침이 업데이트 되고 있다(Table 1). 환자 개개인의 질병 특성에 따른 맞춤 치료 전략에 대한 증거가 추후 연구에서 얻어진다면 더 이상적인 치료지침으로 발전할 수 있을 것이다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
None.
AUTHOR CONTRIBUTIONS
JJL conceived and designed the study, collected the data, wrote the manuscript.