 |
 |
| Korean J Med > Volume 96(5); 2021 > Article |
|
Abstract
Adult growth hormone (GH) deficiency is associated with insulin resistance, elevated cardiovascular risk profile, increased fat mass, reduced muscle mass, skeletal fragility, and impaired quality of life. GH replacement therapy improves body composition, exercise capacity, skeletal health, cardiovascular outcomes, and quality of life, while reducing mortality. Prior to initiation of GH replacement therapy, it is essential to diagnose GH deficiency via a GH stimulation test in adults suspicious of such deficiency. Therapy should be started using (individualized) low dose of GH, followed by titration to the normal range of insulin-like growth factor-1. Clinical improvements should be monitored and side effects should be minimized.
ýä▒ýØ©ýùÉýä£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼(growth hormone, GH) Û▓░ÝòìýªØýØÇ ý▓┤ýºÇÙ░® Ýè╣Ý×ê Ùé┤ý×ÑýºÇÙ░® ýªØÛ░ÇýÖÇ ÛÀ╝ý£íÙƒë Û░ÉýåîýÖÇ Û░ÖýØÇ ý▓┤ýä▒ÙÂä Ù│ÇÝÖö, Û│¿ÙïñÛ│ÁýªØ, ýØ┤ýâüýºÇýºêÝÿêýªØ, ýØ©ýèÉÙª░ ýáÇÝò¡ýä▒ Ùô▒Û│╝ Û┤ÇÙá¿ÙÉÿÙ®┤ýä£ ýï¼ÝÿêÛ┤Ç ýºêÝÖÿ Ù░Å Û│¿ýáê ý£äÝùÿýØä ÙåÆýØ©Ùïñ[1-3]. ÙÿÉÝò£ ýä▒ýØ© ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØ ÝÖÿý×ÉÙèö ýçáýò¢Û░É, Ýö╝Û│ñÝò¿, ÙÂêýòê, ýÜ░ýÜ©ýªØ, ýêÿÙ®┤ý×Ñýòá, ý▓┤ýºÇÙ░® ýªØÛ░Ç, ÛÀ╝ý£íÙƒë Û░Éýåî, ýéÂýØÿ ýºê ýáÇÝòÿÙÑ╝ Ýÿ©ýåîÝòá ýêÿ ý×êÙïñ. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ù│┤ý®ýÜöÙ▓òýØÇ ýä▒ýØ© ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØ ÝÖÿý×ÉýùÉýä£ ýØ┤Ùƒ¼Ýò£ Ýò®Ù│æýªØýØä ýñäýØ╝ ýêÿ ý×êÙèö ýñæýÜöÝò£ ý╣ÿÙúîÙ▓òýØ┤ ÙÉá ýêÿ ý×êÙïñ. ÝòÿýºÇÙºî ýØ┤Ùƒ░ ÝÜ¿Û│╝ÙÑ╝ ÛÀ╣ÙîÇÝÖöÝòÿÙáñÙ®┤ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØä ýáòÝÖòÝ×ê ýºäÙï¿Ýòÿýù¼ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ÙÂäÙ╣äÙèÑýØ┤ ýáòýâüýØ© ÝÖÿý×ÉýùÉýä£ ÙÂêÝòäýÜöÝò£ ý╣ÿÙúîÙÑ╝ ÝòÿýºÇ ýòèÛ│á ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØ┤ ý×êÙèö ÝÖÿý×ÉýùÉýä£ ýáüýáêÝò£ ýÜöÙ▓òý£╝Ùí£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ù│┤ý®ýÜöÙ▓òýØä ýáüýÜ®ÝòÿÙèö Û▓âýØ┤ ÝòäýÜöÝòÿÙïñ. ÝòÿýºÇÙºî ýä▒ýØ© ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÇ ý×äýâü ýûæýâüýØ┤ Ù╣äÝè╣ýØ┤ýáüýØ┤Û│á ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ýê¼ýò¢ Ýøä ýªØýâü Ýÿ©ýáä ýù¼ÙÂÇÙÅä ÙÜ£ÙáÀÝòÿýºÇ ýòèýØä ýêÿ ý×êýû┤ýä£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÿ ýáòÝÖòÝò£ ýºäÙï¿Û│╝ ýáüýáêÝò£ ý╣ÿÙúîýùÉ ÙîÇÝò£ Ùà╝Ù×ÇýØ┤ ýºÇýåìÙÉÿÛ│á ý×êÙïñ. ÙìöÛÁ¼Ùéÿ ýÁ£ÛÀ╝ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØ Û┤ÇÙá¿ ÛÁ¡Ùé┤ýÖ© Û░ÇýØ┤Ùô£ÙØ╝ýØ©ýØ┤ Ù░£Ýæ£ÙÉ¿ýùÉ Ùö░ÙØ╝ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÿ ýºäÙï¿ Ù░Å ý╣ÿÙúîýùÉ ÙîÇÝò┤ ýñæýáÉýáüý£╝Ùí£ Ùà╝ýØÿÝòÿÛ│áý×É Ýò£Ùïñ[4-7].
ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÇ ýåîýòäÛ©░ Ù░£Ù│æÛ│╝ ýä▒ýØ©Û©░ Ù░£Ù│æý£╝Ùí£ ÙÂäÙÑÿÝòá ýêÿ ý×êÙïñ. ýåîýòä ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÇ ýäáý▓£ýáüýØ© ýøÉýØ©ýØ┤ ÙîÇÙÂÇÙÂäýØ┤Û│á ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ýò®ýä▒ Ù░Å ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ýêÿýÜ®ý▓┤ýÖÇ Û┤ÇÙá¿ÙÉ£ ý£áýáäý×ÉýØÿ ÙÅîýù░Ù│ÇýØ┤ Ù░Å ÙçîýØÿ Ù░£Ùï¼ ÛÁ¼ýí░ýáü ý×ÑýòáýÖÇ Û░ÖýØÇ ýäáý▓£ýáüýØ© ýøÉýØ©ýØ┤ ÙºÄý£╝Ù®░, Ýøäý▓£ýáüýØ┤Û▒░Ùéÿ Ýè╣Ù░£ýä▒ýØ╝ ýêÿÙÅä ý×êÙïñ. ÝòÿýºÇÙºî ýä▒ýØ© ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÇ ýåîýòä ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØ┤ ýä▒ýØ©Û©░Û╣îýºÇ ýØ┤ýû┤ýºê ýêÿÙÅä ý×êýºÇÙºî, ýØ╝Ù░ÿýáüý£╝Ùí£ Ýøäý▓£ýáüýØ© Û▓¢ýÜ░Û░Ç ÙºÄý£╝Ù®░ ÛÀ© ýøÉýØ©ý£╝Ùí£ ÙçîÝòÿýêÿý▓┤ýÖÇ ýï£ýâüÝòÿÙÂÇýØÿ ýóàýûæýØ┤Ùéÿ ýØ┤ýùÉ ÙîÇÝò£ ýêÿýêáýØ┤Ùéÿ Ù░®ýé¼ýäá ý╣ÿÙúî, ý╣¿ý£ñýä▒ ýºêÝÖÿ, ÝÿêÛ┤Ç ýåÉýâü, Û░Éýù╝ Ùô▒ýØ┤ ý×êÙïñ(Table 1) [4,7,8].
ýä▒ýØ© ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÿ Û░Çý×Ñ ÝØöÝò£ ýøÉýØ©ýØÇ ýï£ýâüÝòÿÙÂÇ-ÙçîÝòÿýêÿý▓┤ ýóàýûæ ý×Éý▓┤ ÙÿÉÙèö ýóàýûæ ý╣ÿÙúîÙÑ╝ ý£äÝò£ ýêÿýêá ÙÿÉÙèö Ù░®ýé¼ýäá ý╣ÿÙúîýØ┤Ùïñ. ÙçîÝòÿýêÿý▓┤ Ù»©ýä©ýäáýóàýØ┤ ÙçîÝòÿýêÿý▓┤ Û©░ÙèÑýáÇÝòÿýªØýØä ÙéÿÝâÇÙé┤Ùèö Û▓¢ýÜ░Ùèö Ùô£Ù¼╝ýºÇÙºî, ÙçîÝòÿýêÿý▓┤ Û▒░ÙîÇýäáýóàýØÇ ýò¢ 30-60%ýùÉýä£ ýáüýû┤ÙÅä ÝòÿÙéÿýØÿ ÙçîÝòÿýêÿý▓┤ Ýÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØä ÙéÿÝâÇÙé┤ÙèöÙì░, Ýÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÿ ýú╝ýÜö Û©░ýáäýØÇ ÙçîÝòÿýêÿý▓┤ ýñäÛ©░ýØÿ Ù¼©ÙºÑýùÉ ÙîÇÝò£ ýòòÙáÑý£╝Ùí£ ýØ©Ýò£ ÝÿêÝûëý×ÑýòáýØ┤Ùïñ[9]. ÙçîÝòÿýêÿý▓┤ ýóàýûæýØä ýá£Û▒░Ýò£ ÝøäýùÉÙÅä ÙçîÝòÿýêÿý▓┤Û©░ÙèÑýáÇÝòÿýªØýØ┤ Ù░£ýâØÝòá ýêÿ ý×êýºÇÙºî ýêÿýêáýØä ÝåÁÝò┤ ýóàýûæ ý£áÙ░£ ÙçîÝòÿýêÿý▓┤Û©░ÙèÑýáÇÝòÿýªØýØ┤ 50%ýùÉýä£ ÝÜîÙ│ÁÝòá ýêÿ ý×êÙïñ[10]. ÛÀ©Ùƒ¼Ùéÿ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ýØÇ Û░Çý×Ñ ÝÜîÙ│ÁýØ┤ ý×ÿ ýòê ÙÉÿÙèö ÙçîÝòÿýêÿý▓┤ Ýÿ©ÙÑ┤Ù¬¼ýØ┤Ùïñ. Ù░®ýé¼ýäá ý╣ÿÙúî ÙÿÉÝò£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØä ý£áÙ░£ÝòÿÙ®░ ÙæÉÛ░£Ùé┤ Ù░®ýé¼ýäá Ýøä ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÿ ý£äÝùÿýØÇ ýáèýØÇ ÝÖÿý×ÉýùÉýä£ Ùìö ÙåÆý£╝Ù®░ Ù░®ýé¼ýäá ý╣ÿÙúî Ýøä ýï£Û░äýØ┤ ýºÇÙé¿ýùÉ Ùö░ÙØ╝ ýªØÛ░ÇÝòÿÛ│á Ù░®ýé¼ýäáÙƒëýØ┤ 40 Gy ýØ┤ýâüýØ┤Ù®┤ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÿ ÝÖòÙÑáýØ┤ 50%ýùÉ Ùï¼Ýò£Ùïñ[11]. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÇ ÙæÉÙÂÇ ýåÉýâü ÙÿÉÙèö ýºÇýú╝ÙºëÝòÿ ý£Ýÿê ÝÖÿý×ÉýØÿ 25%ýùÉýä£ Ù░£ýâØÝòÿÙ®░ ýØ╝ÙÂÇ ÝÖÿý×ÉÙèö ýï£Û░äýØ┤ ýºÇÙéÿÙ®┤ ÝÜîÙ│ÁÙÉÿýºÇÙºî ýòàÝÖöÙÉÿÙèö ÝÖÿý×ÉÙÅä ý×êÙïñ[12]. Ùö░ÙØ╝ýä£ ýØ┤Ùƒ¼Ýò£ ÝÖÿý×ÉýØÿ ÙçîÝòÿýêÿý▓┤ Ýÿ©ÙÑ┤Ù¬¼ ýâüÝâ£Ùèö ý×àýøÉ ýï£ýÖÇ ýØ┤Ýøä ýáòÛ©░ýáüý£╝Ùí£ Ù¬¿ÙïêÝä░ÙºüÝò┤ýò╝ Ýò£Ùïñ.
ýä▒ýØ© ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÇ ÙîÇÙÂÇÙÂä Û©░ýºêýáüýØ© ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÿ ýøÉýØ© ýºêÝÖÿýØ┤ ý×êý£╝Ù»ÇÙí£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØä ý£áÙ░£Ýòá ÙºîÝò£ ýøÉýØ© Ù│æÙáÑýØ┤ ý×êÙèöýºÇÙÑ╝ ÝÖòýØ©ÝòÿÙèö Û▓âýØ┤ ýñæýÜöÝòÿÙïñ. ýØ┤Ùƒ¼Ýò£ Û©░ýáÇ ýºêÝÖÿýØ┤ ý×êÛ│á ý×äýâü ýªØýâüýØ┤ ý×êÙèö ÝÖÿý×ÉýùÉýä£ ýØÿýï¼ÝòÿÛ│á ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýùÉ ÙîÇÝò£ ÝÅëÛ░ÇÙÑ╝ Û│áÙáñÝò┤ýò╝ Ýò£Ùïñ. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ÙÂäÙ╣äÙÑ╝ Û▓Çýé¼ÝòÿÛ©░ ýáäýùÉ ÙïñÙÑ© Û▓░ÝòìýªØ Ýÿ©ÙÑ┤Ù¬¼ýØä Ù│┤ý®Ýò┤ýò╝ Ýò£Ùïñ. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ýØÇ Ù░òÙÅÖýä▒ý£╝Ùí£ ÙÂäÙ╣äÙÉÿÛ©░ ÙòîÙ¼©ýùÉ ý×äýØÿÙí£ ý©íýáòÝò£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ýêÿý╣ÿÙèö ýºäÙï¿ýáüýØ┤ýºÇ ýòèý£╝Ù®░ Ýÿêý▓¡ ýØ©ýèÉÙª░ýûæýä▒ý×ÑýØ©ý×É(insulin-like growth factor-1, IGF-1)Û░Ç ýáòýâüýØ© Û▓¢ýÜ░ýùÉÙÅä ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØä Ù░░ýá£Ýòá ýêÿ ýùåÙïñ[13]. ýØ┤ýùÉ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÇ Ù░ÿÙô£ýï£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý×ÉÛÀ╣ Û▓Çýé¼ÙÑ╝ ÝåÁÝò┤ ýºäÙï¿Ýò┤ýò╝ ÝòÿÙéÿ, Û©░ýºêýáü Ýÿ╣ýØÇ ý£áýáäýáüýØ© ýï£ýâüÝòÿÙÂÇ-ÙçîÝòÿýêÿý▓┤ ýºêÝÖÿýØ┤ ý×êÛ▒░Ùéÿ ÛÁ¼ýí░ýáü Ù│æÙ│ÇýØ┤ ý×êÙèö Û▓¢ýÜ░ 3Û░£ ýØ┤ýâüýØÿ ÙçîÝòÿýêÿý▓┤ Ýÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØ┤ ý×êÛ│á IGF-1 ýêÿý╣ÿÛ░Ç Ùé«ÙïñÙ®┤(ýáòýâüÙ│┤Ùïñ ýÁ£ýåî 2.0 Ýæ£ýñÇÝÄ©ý░¿ ýØ┤ýâü) ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý×ÉÛÀ╣ Û▓Çýé¼ÙÑ╝ ýâØÙ×ÁÝòá ýêÿ ý×êÙïñ[4,7,13]. ýØ┤Ùƒ¼Ýò£ ÛÁ¼ýí░ýáü Ù¼©ýá£Ùí£ ýØ©Ýò£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÇ ýä▒ýØ©ýØ┤ ÙÉÿýû┤ýä£ÙÅä Û░£ýäáÙÉÿýºÇ ýòèý£╝Ù»ÇÙí£ ýØ┤Ùƒ¼Ýò£ ÝÖÿý×ÉýùÉýä£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý×ÉÛÀ╣ Û▓Çýé¼ÙÑ╝ Ù░ÿÙ│ÁÝòá ÝòäýÜöÙèö ýùåÙïñ. ÝòÿýºÇÙºî Ýè╣Ù░£ýä▒ ýåîýòä ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØ ÝÖÿý×ÉÙèö ýä▒ýØ©Û©░ýùÉ ý×¼ÝÅëÛ░ÇÙÉá Ùòî ÙîÇÙÂÇÙÂäýØÿ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ÙÂäÙ╣äÙèö ýáòýâüýØ┤Ù»ÇÙí£ ýä▒ýØ©ýØ┤ ÙÉÿÙ®┤ ý×¼ÝÅëÛ░ÇÛ░Ç ÝòäýÜöÝòÿÙïñ[14].
ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý×ÉÛÀ╣ Û▓Çýé¼Ùí£Ùèö ýØ©ýèÉÙª░ Ùé┤ýä▒ Û▓Çýé¼(insulin tolerance test), ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼Ù░®ý£Ýÿ©ÙÑ┤Ù¬¼(growth hormone-releasing hormone, GHRH)-ýòäÙÑ┤Û©░Ùïî(arginine), Û©ÇÙú¿ý╣┤Û│ñ(glucagon), ÙáêÙ│┤ÙÅäÝîî(levodopa), Ýü┤Ùí£ÙïêÙöÿ(clonidine) ý×ÉÛÀ╣ Û▓Çýé¼ Ùô▒ýØ┤ ý×êÙïñ. GHRHÙèö Ùìö ýØ┤ýâü ýé¼ýÜ®ýØ┤ ÙÂêÛ░ÇÙèÑÝòÿÙïñ. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý×ÉÛÀ╣ Û▓Çýé¼ýØÿ Û©░Ù│© ýøÉÙª¼Ùèö ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ýØä Ù╣áÙÑ┤Û▓î ý×ÉÛÀ╣ÝòÿÙèö ýò¢Ù¼╝ýØä Ýê¼ýù¼Ýò£ Ýøä Ýÿêýñæ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ýêÿý╣ÿÙÑ╝ ýù░ýåìýáüý£╝Ùí£ ý©íýáòÝò£ Û▓░Û│╝ ýñæ Û░Çý×Ñ ÙåÆýØÇ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ýêÿý╣ÿÛ░Ç ÝÖÿý×ÉýØÿ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ù░ÿýØæý£╝Ùí£ Ýò┤ýäØÙÉ£Ùïñ. Ýæ£ 2Ùèö ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý×ÉÛÀ╣ Û▓Çýé¼ýØÿ Ù░®Ù▓ò, Û©░ýñÇ Ù░Å ÙÂÇý×æýÜ®/Û©êÛ©░ýé¼Ýò¡ýØä ýÜöýò¢Ýò£ Û▓âýØ┤Ùïñ.
ýØ©ýèÉÙª░ Ùé┤ýä▒ Û▓Çýé¼Ùèö ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØ ýºäÙï¿ýØä ý£äÝò£ Ýæ£ýñÇ Û▓Çýé¼Ùí£ ÛÂîý×ÑÙÉÿýºÇÙºî, ýáÇÝÿêÙï╣ýØä ý£áÙ░£ÝòÿÙ»ÇÙí£ Û▓Çýé¼ Û©░Û░äÙÅÖýòê ýºÇýåìýáüý£╝Ùí£ ýØÿýé¼ýØÿ Ù¬¿ÙïêÝä░ÙºüýØ┤ ÝòäýÜöÝòÿÛ│á Û│áÙá╣ý×É Ù░Å Û▓¢Ùá¿ýØ┤Ùéÿ ýï¼ÝÿêÛ┤Ç ýºêÝÖÿýØ┤ ý×êÙèö ÝÖÿý×ÉýùÉýä£Ùèö Û©êÛ©░ýØ┤Ùïñ. ýØ©ýèÉÙª░ ýáÇÝò¡ýä▒ýØ┤ ý×êÙèö Ù╣äÙºî ÝÖÿý×ÉýØÿ Û▓¢ýÜ░ Ùìö ÙºÄýØÇ ýûæýØÿ ýØ©ýèÉÙª░ýØ┤ ÝòäýÜöÝòÿÛ│á ýØ┤ Û│╝ýáòýùÉýä£ ýºÇýù░ÙÉ£ ýáÇÝÿêÙï╣ýØÿ ý£äÝùÿýØ┤ ýªØÛ░ÇÝò£Ùïñ. ýØ©ýèÉÙª░ýùÉ ÙîÇÝò£ Ù░ÿýØæýØÇ Û▒┤Û░òÝò£ Û░£ýØ©ýí░ý░¿ÙÅä ÙòîýùÉ Ùö░ÙØ╝ ÙïñÙÑ┤Û©░ ÙòîÙ¼©ýùÉ ý×¼Ýÿäýä▒ýØ┤ Ùé«ý£╝Ù®░, ýù¼ýä▒ýØÇ ýøöÛ▓¢ ýú╝Û©░ýùÉ Ùö░ÙØ╝ýä£ÙÅä Ù░ÿýØæýØ┤ ÙïñÙÑ┤Ùïñ.
Û©ÇÙú¿ý╣┤Û│ñýØÇ ýØ©ýèÉÙª░ ÙÂäÙ╣äÙÑ╝ ý×ÉÛÀ╣Ýòÿýù¼ Û░äýáæýáüý£╝Ùí£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ýØä ý×ÉÛÀ╣Ýò£Ùïñ. Û©ÇÙú¿ý╣┤Û│ñýùÉ ÙîÇÝò£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ù░ÿýØæýØÇ ý▓£ý▓£Ý×ê ýØ╝ýû┤ÙéÿÙ»ÇÙí£ Û©ÇÙú¿ý╣┤Û│ñ ý×ÉÛÀ╣ Û▓Çýé¼ÙÑ╝ ýÖäÙúîÝòÿÙèö Ùì░ ýÁ£ýåî 3ýï£Û░äýØ┤ ÝòäýÜöÝòÿÙ®░ ýºÇýù░ÙÉ£ ýáÇÝÿêÙï╣ýØÿ ý£äÝùÿýØ┤ ý×êÙïñ. ýØ┤ Û▓Çýé¼ýùÉýä£Ùèö ýáòÙºÑ ýú╝ýé¼Ù│┤Ùïñ ÛÀ╝ý£í ýú╝ýé¼ ÙÿÉÙèö Ýö╝Ýòÿ ýú╝ýé¼Û░Ç Ùìö ÝÜ¿Û│╝ýáüýØ┤Ùïñ. ýºäÙï¿ýØä ý£äÝò£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û©░ýñÇý╣ÿÙèö 3 ╬╝g/LÛ░Ç ýáüÙï╣ÝòÿýºÇÙºî, Ù╣äÙºî ÝÖÿý×É(BMI > 25 kg/m2)ýùÉýä£Ùèö ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ù░ÿýØæýØ┤ ÙæöÝÖöÙÉÿÙ»ÇÙí£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û©░ýñÇý╣ÿÙèö 1 ╬╝g/LÙí£ ýáüýÜ®Ýò£Ùïñ[15]. ÝÿêÙï╣ý╣ÿÛ░Ç ÙåÆýØäýêÿÙíØ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ù░ÿýØæýØ┤ ýò¢Ýò┤ýºÇÛ©░Ùèö ÝòÿýºÇÙºî ÝÿêÙï╣ ýêÿý╣ÿýùÉ Ùö░ÙØ╝ ÙïñÙÑ© ýºäÙï¿ Û©░ýñÇý╣ÿÙÑ╝ ýáüýÜ®ÝòÿýºÇÙèö ýòèÙèöÙïñ. ÙÂÇý×æýÜ®ý£╝Ùí£Ùèö Ù®öýèñÛ║╝ýøÇ, ÛÁ¼Ýåá Ù░Å ÙæÉÝåÁýØ┤ ý×êÛ│á Ùà©ýØ©ýùÉýä£ ýï¼Ýò£ ýáÇÝÿêýòò, ýáÇÝÿêÙï╣ Ù░Å Û▓¢Ùá¿ýØ┤ Ù│┤Û│áÙÉÿýùêÙïñ.
ýÁ£ÛÀ╝ Ù»©ÛÁ¡Û│╝ ý£áÙƒ¢ýùÉýä£ ýè╣ýØ©ÙÉ£ Û▓¢ÛÁ¼ýÜ® ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ÙÂäÙ╣äý┤ëýºä ýêÿýÜ®ý▓┤-1a ý×æýÜ®ýá£ýØ© macimorelinýØÇ ýØ©ýèÉÙª░ Ùé┤ýä▒ Û▓Çýé¼ýÖÇ ý£áýé¼Ýò£ Ù»╝Û░ÉÙÅä(92%) Ù░Å Ýè╣ýØ┤ýä▒(96%)ý£╝Ùí£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ù░®ý£ýØä ý×ÉÛÀ╣ÝòÿÛ│á ÙÂÇý×æýÜ®ýØ┤ ýáüÙïñ[16]. ýØ╝Ù░ÿýáüýØ© ÙÂÇý×æýÜ®ýØÇ ýï£Û░äýØ┤ ýºÇÙé¿ýùÉ Ùö░ÙØ╝ Û░£ýäáÙÉÿÙèö ýò¢Û░äýØÿ Ù»©Û░üý×ÑýòáýØ┤ýºÇÙºî ýï¼ýáäÙÅäýùÉýä£ Ù│┤Û│áÙÉ£ ýï¼Û░üÝò£ ÙÂÇý×æýÜ®ýØÇ QT ýù░ý×ÑýØ┤Ùïñ. MacimorelinýØÇ ýòäýºü ÛÁ¡Ùé┤ ÙÅäý×àÙÉÿýºÇ ýòèýòÿýºÇÙºî, Ýò┤ýÖ©ýùÉýä£ÙÅä ýØ┤Ù»© Û│áÛ░ÇýØÿ ýò¢ýá£Ùí£ ýòîÙáñýá© ý×êÙïñ.
GHRHÙèö ýï£ýâüÝòÿÙÂÇ ýåîÙºêÝåáýèñÝâÇÝï┤ýØÿ ÙÂäÙ╣äÙÑ╝ ýûÁýá£ÝòÿÙèö ýòäÙÑ┤Û©░ÙïîÛ│╝ Ýò¿Û╗ÿ Ýê¼ýò¢ ýï£ Û░òÙáÑÝòÿÛ│á ýòêýáäÝò£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý×ÉÛÀ╣ Û▓Çýé¼Û░Ç ÙÉ£Ùïñ[12]. Biller Ùô▒[17]ýØÇ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û©░ýñÇý╣ÿ 5.1 ╬╝g/LýùÉýä£ ýØ©ýèÉÙª░ Ùé┤ýä▒ Û▓Çýé¼Ùèö Ù»╝Û░ÉÙÅä 96%, Ýè╣ýØ┤ÙÅä 92%ÙÑ╝ Ù│┤ýÿÇÛ│á, GHRH-ýòäÙÑ┤Û©░Ùïî Û▓Çýé¼Ùèö ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û©░ýñÇý╣ÿ 4.1 ╬╝g/LýùÉýä£ Ù»╝Û░ÉÙÅä 95%, Ýè╣ýØ┤ÙÅä 91%Ùí£ ý£áýé¼Ýò£ ýºäÙï¿ ÝâÇÙï╣ýä▒ýØä Ù│┤ýÿÇÙïñ. ÛÀ©Ùƒ¼Ùéÿ GHRHÙèö ÙçîÝòÿýêÿý▓┤ÙÑ╝ ýºüýáæ ý×ÉÛÀ╣ÝòÿÙ»ÇÙí£ ýï£ýâüÝòÿÙÂÇ ýºêÝÖÿýØ┤ ý×êÙèö ÝÖÿý×ÉýùÉýä£ ýáòýâüýáüý£╝Ùí£ Ù░ÿýØæÝòÿýù¼ ý£äýØîýä▒ýØä ý£áÙ░£Ýòá ýêÿ ý×êÙïñ. ÙÿÉÝò£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ýºäÙï¿ Û©░ýñÇý╣ÿÙèö Ù╣äÙºî ÝÖÿý×ÉýùÉýä£ ýí░ýáòýØ┤ ÝòäýÜöÝòá ýêÿ ý×êÙïñ[18]. ýòäÙÑ┤Û©░ÙïîÙºîýØä ýé¼ýÜ®Ýò£ Û▓Çýé¼ýùÉýä£Ùèö 0.4 ╬╝g/LÙí£ Û©░ýñÇý╣ÿÛ░Ç ýá£ýï£ÙÉÿýùêý£╝Ùéÿ Û░ÆýØ┤ Ùé«ýòäýä£ ýºäÙï¿ ýáòÝÖòÙÅäÛ░Ç Ùé«ýòä Ùï¿ÙÅà ýòäÙÑ┤Û©░Ùïî ý×ÉÛÀ╣Û▓Çýé¼Ùèö ÛÂîý×ÑÙÉÿýºÇ ýòèÙèöÙïñ.
ÙáêÙ│┤ÙÅäÝîîÙèö ýï£ýâüÝòÿÙÂÇýØÿ ÙÅäÝîîÙ»╝ ýêÿýÜ®ý▓┤ÙÑ╝ ÝåÁÝò┤, Ýü┤Ùí£ÙïêÙöÿýØÇ ýòîÝîî ýêÿýÜ®ý▓┤ÙÑ╝ ÝåÁÝò┤ GHRHÙÑ╝ Ù░®ý£Ýòÿýù¼ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ýØÇ ý×ÉÛÀ╣Ýò£Ùïñ. ÙáêÙ│┤ÙÅäÝîîýÖÇ Ýü┤Ùí£ÙïêÙöÿýØÇ ýò¢Ýò£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý×ÉÛÀ╣ýá£ýØ┤Ù»ÇÙí£ Ù»╝Û░ÉÝò£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý©íýáòÙ▓òýØä ýé¼ýÜ®ÝòÿÙ®┤ ýºäÙï¿ýØ┤ Û░ÇÙèÑÝòÿÙïñ. ýù░Ùá╣, ýä▒Ù│ä, ý▓┤ýºêÙƒëýºÇýêÿ, ÝÿêÙï╣ ýêÿý╣ÿ ÙÿÉÙèö Û©░ýáÇ ýºêÝÖÿýØÿ ýí┤ý×¼ýùÉ Ùö░ÙÑ© ýÁ£ýáüýØÿ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û©░ýñÇý╣ÿýùÉ ÙîÇÝò£ ÛÀ╝Û▒░Û░Ç ýòäýºü ÙÂÇýí▒ÝòÿÙïñ.
Û©êÛ©░ ýé¼Ýò¡ýØ┤ ýùåÙèö Ýò£, ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý×ÉÛÀ╣ Û▓Çýé¼ÙÑ╝ ÝåÁÝò┤ ýºäÙï¿ÙÉ£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØ ÝÖÿý×ÉýùÉÛ▓î ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ÙîÇý▓┤ýÜöÙ▓òýØ┤ ÛÂîý×ÑÙÉ£Ùïñ. ýØ╝Ù░ÿýáüýØ© ÙÂÇý×æýÜ®ý£╝Ùí£Ùèö ý▓┤ýòí ýáÇÙÑÿ, Û┤ÇýáêÝåÁ, ÛÀ╝ý£íÝåÁ, Û░ÉÛ░üý×Ñýòá, ýåÉÙ¬® Ýä░ÙäÉýªØÝøäÛÁ░, ýêÿÙ®┤Ù¼┤Ýÿ©ÝØíýªØ, ýêÿÙ®┤ý×Ñýòá Ù░Å Ýÿ©ÝØíÛ│ñÙ×ÇýØ┤ ý×êÙïñ. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ÙÂÇý×æýÜ®ýØÿ ÙîÇÙÂÇÙÂäýØÇ ýò¢ 20%ýØÿ ÝÖÿý×ÉýùÉýä£ ýܮكë ýØÿýí┤ýáüý£╝Ùí£ Ù░£ýâØÝòÿÙ»ÇÙí£ ýáÇýܮكëýùÉýä£ÙÂÇÝä░ ýï£ý×æÝò┤ýò╝ ÝòÿÙ®░, ýܮكëýØä Ùé«ýÂöÙ®┤ ýé¼ÙØ╝ýºäÙïñ[19]. ýä▒ýØ©ýùÉýä£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ýܮكëýØÇ ý┤êÛ©░ýùÉ ýåîýòä ÛÂîý×Ñ ýܮكëýØÿ ý▓┤ýñæýØä Û©░Ù░ÿý£╝Ùí£ ýäñýáòÙÉÿýùêý£╝Ùéÿ ý▓┤ýñæ Û©░Ù░ÿýùÉýä£ Û░£Ù│ä Û│áýáò ýܮكëý£╝Ùí£ Ù│ÇÛ▓¢ÙÉÿÙ®┤ýä£ ÙÂÇý×æýÜ®ýØÇ ýáêÙ░ÿý£╝Ùí£ Û░ÉýåîÝòÿýÿÇÙïñ[20].
ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ÙÂäÙ╣äÙèö ÙéÿýØ┤Û░Ç ÙôñýêÿÙíØ Û░ÉýåîÝòÿÛ│á ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ýØÿ ÙÂÇý×æýÜ®ýØÇ Ùà©ýØ© ÝÖÿý×ÉýùÉýä£ Ùìö ÝØöÝòÿÙïñ. Ùö░ÙØ╝ýä£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ýØÿ Ù¬®Ýæ£ ýêÿý╣ÿÙèö Ùà©ýØ©ýùÉýä£ Ùìö Ùé«Û│á ýáèýØÇ ýé¼Ù×îÙôñýùÉýä£ Ùìö ÙåÆÙïñ. 30ýä©ýùÉýä£ 60ýä© ýé¼ýØ┤ýØÿ Û░£ýØ©ýØÿ Û▓¢ýÜ░ ýáüýáêÝò£ ýï£ý×æ ýܮكëýØÇ 0.2-0.3 mg/day (0.6-0.9 IU/day)ýØ┤Ùïñ. 30ýä© Ù»©ÙºîýØÿ Û▓¢ýÜ░ 0.4-0.5 mg/day (1.2-1.5 IU/day)ýØÿ Ùìö ÙåÆýØÇ ýܮكëýØ┤ Û░ÇÙèÑÝòÿÙ®░, 60ýä© ýØ┤ýâüýØÿ Û░£ýØ©ýØÿ Û▓¢ýÜ░ ýï£ý×æ ýܮكëýØÇ 0.1-0.2 mg/day (0.3-0.6 IU/day) ýØ┤Ýøä ýä£ýä£Ý×ê ýªØÙƒëÝò£Ùïñ(Fig. 1). 1-2Û░£ýøö Û░äÛ▓®ý£╝Ùí£ 0.1-0.2 mg/day (0.3-0.6 IU/day)ýö® ýªØÙƒëÝòÿÛ│á ÝÖÿý×ÉýØÿ ý×äýâü Ù░ÿýØæ, ÙÂÇý×æýÜ®, ýù░Ùá╣Ù│ä IGF-1ýØÿ ýáòýâüÙ▓öý£ä Ùô▒ýØä ÝÅëÛ░ÇÝòÿýù¼ ý£áýºÇ ýܮكëýØä Û▓░ýáòÝò£Ùïñ[4]. ý£áýºÇ ýܮكëýØ┤ Û▓░ýáòÙÉÿÙ®┤ 6Û░£ýøöÙºêÙïñ IGF-1 ýêÿý╣ÿÙÑ╝ ÝÖòýØ©Ýò£Ùïñ. ÙºñÙàä ÝùêÙª¼ÙæÿÙáê, Ýÿêýòò, ÙºÑÙ░ò, Ýÿêýñæ ýºÇýºê Ù░Å ÝÿêÙï╣, ýéÂýØÿ ýºêýØä Û▓Çýé¼ÝòÿÛ│á ý┤êÛ©░ Û│¿Ù░ÇÙÅäÛ░Ç Ù╣äýáòýâüýØ© Û▓¢ýÜ░ 1.5-2ÙàäÙºêÙïñ Û│¿Ù░ÇÙÅäÙÑ╝ ý×¼ÝÅëÛ░ÇÝò┤ýò╝ Ýò£Ùïñ. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ýØä ýû©ýá£Û╣îýºÇ Ýê¼ýù¼Ýò┤ýò╝ ÝòÿÙèöýºÇ ýáòÝÖòÝ×ê ýòî ýêÿ ýùåý£╝Ùéÿ ýÁ£ýåî 12-18Û░£ýøö ÝøäýùÉÙÅä ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ù│┤ý®ýÜöÙ▓òýùÉ ÙîÇÝò£ Ù¬àÝÖòÝò£ ý×äýâü Ù░ÿýØæýØ┤ ýùåý£╝Ù®┤ ý╣ÿÙúîÙÑ╝ ýñæÙï¿Ýòá ýêÿ ý×êÙïñ[7].
ýù¼ýä▒ýØÇ ýØ╝Ù░ÿýáüý£╝Ùí£ Ùìö ÙåÆýØÇ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ýáÇÝò¡ýä▒ýØä ÙéÿÝâÇÙé┤Ù»ÇÙí£ Ùìö ÙåÆýØÇ ýï£ý×æ Ù░Å ý£áýºÇ ýܮكëýØ┤ ÝòäýÜöÝòÿÙïñ[21]. ýùÉýèñÝè©Ùí£Û▓ÉýØÇ Ýÿêý▓¡ IGF-1ýØÿ 85%Û░Ç Û©░ýøÉÝòÿÙèö Û░äýùÉýä£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ýØÿ Ýè╣ýáò Ù╣äÛ▓¢ýƒüýáü ýûÁýá£ýá£ýØ© ýé¼ýØ┤Ýåáý╣┤ýØ© ýïáÝÿ©ýáäÙï¼ 2 ýûÁýá£ýá£(suppressor of cytokine signaling 2)ÙÑ╝ ý×ÉÛÀ╣Ýò£Ùïñ[22]. Û▓¢ÛÁ¼ ýùÉýèñÝè©Ùí£Û▓ÉýØÇ IGF-1ýØä ýûÁýá£ÝòÿÛ©░ ÙòîÙ¼©ýùÉ ýù¼ýä▒ýùÉýä£ ÙÅÖýØ╝Ýò£ IGF-1 ýêÿý╣ÿÙÑ╝ ý£áýºÇÝòÿÙáñÙ®┤ Ùìö ÙºÄýØÇ ýûæýØÿ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ýØ┤ ÝòäýÜöÝòÿÙïñ. ÝòÿýºÇÙºî Û▓¢ÛÁ¼ ýùÉýèñÝè©Ùí£Û▓ÉýØä Û▓¢Ýö╝ ýùÉýèñÝè©Ùí£Û▓Éý£╝Ùí£ Ù│ÇÛ▓¢ÝòÿÙ®┤ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ýÜöÛÁ¼ÙƒëýØÇ Û░ÉýåîÝò£Ùïñ[22].
ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØ┤ ý×êÙèö ÝÖÿý×ÉýùÉýä£ ÙçîÝòÿýêÿý▓┤Û©░ÙèÑýáÇÝòÿýªØýØÿ ÙïñÙÑ© ýªØýâüýØ┤ ÙéÿÝâÇÙéÿÙèö Û▓âýØ┤ ýØ╝Ù░ÿýáüýØ┤Ù®░, ý┤êÛ©░ýùÉÙèö ýáòýâüýØ┤ÙìöÙØ╝ÙÅä Û░æýâüýäá Ù░Å ÙÂÇýïá Û©░ÙèÑýØÇ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúî ýñæ Ù¬¿ÙïêÝä░ÙºüÝò┤ýò╝ Ýò£Ùïñ. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîÙèö ý£áÙª¼ T4 ýêÿý╣ÿÙÑ╝ Û░Éýåîýï£Ýé¼ ýêÿ ý×êý£╝Ù»ÇÙí£ ý╣ÿÙúî ýñæ Û░æýâüýäá Û©░ÙèÑýØä ÝÅëÛ░ÇÝò┤ýò╝ Ýò£Ùïñ. ýØ┤ýáä ýù░ÛÁ¼ýùÉýä£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØ ÝÖÿý×É ýñæ Û░æýâüýäá Û©░ÙèÑýØ┤ ýáòýâüýØ© ÝÖÿý×ÉýØÿ 36-47%Û░Ç Û░æýâüýäáÛ©░ÙèÑýáÇÝòÿýªØýØ┤ ÙÉÿýùêÛ│á, Û░æýâüýäáÛ©░ÙèÑýáÇÝòÿýªØ ÝÖÿý×ÉýØÿ 16-18%ýùÉýä£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúî Ýøä 3-6Û░£ýøö ýØ┤Ùé┤ýùÉ Û░æýâüýäáÝÿ©ÙÑ┤Ù¬¼ ýܮكë ýªØÙƒëýØ┤ ÝòäýÜöÝòÿÙïñÛ│á Ù│┤Û│áÝòÿýÿÇÙïñ[23]. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîÙÑ╝ ýï£ý×æÝòÿÛ▒░Ùéÿ ýܮكëýØä Ù│ÇÛ▓¢ÝòÿÙèö Û▓¢ýÜ░ýùÉÙèö 6ýú╝ ÝøäýùÉ ýñæýÂöýä▒ Û░æýâüýäáÛ©░ÙèÑýáÇÝòÿýªØýØä ÝÖòýØ©Ýò┤ýò╝ Ýò£Ùïñ. ÙÿÉÝò£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúî ýáäÝøäýùÉ ýï£ýâüÝòÿÙÂÇ-ÙçîÝòÿýêÿý▓┤-ÙÂÇýïá Û©░ÙèÑýØä ÝÅëÛ░ÇÝò┤ýò╝ Ýò£Ùïñ. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ýØÇ 11╬▓-hydroxysteroid dehydrogenase type 1 ÝÜ¿ýåîÙÑ╝ ýûÁýá£Ýòÿýù¼ ý¢öÙÑ┤Ýï░ýåö(cortisol)ýùÉýä£ ý¢öÙÑ┤Ýï░ýåÉ(cortisone)ý£╝Ùí£ ÙîÇýé¼ÙÑ╝ ý┤ëýºäýï£Ýé¿Ùïñ[24]. Ùö░ÙØ╝ýä£ ýáòýâü ÙÂÇýïá Û©░ÙèÑý▓ÿÙƒ╝ Ù│┤ýØ┤Ùèö ÝÖÿý×ÉýùÉýä£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ýØä Ýê¼ýù¼ÝòÿÙèö Û▓¢ýÜ░ ÙÂÇýïá Û©░ÙèÑýáÇÝòÿýªØýØ┤ ÙéÿÝâÇÙéÿÛ▒░Ùéÿ, ýØ┤Ù»© Ù│ÁýÜ® ýñæýØ© Û▓¢ýÜ░ ýܮكë ýí░ýáêýØ┤ ÝòäýÜöÝòá ýêÿ ý×êÙïñ[25].
ýÁ£ÛÀ╝ Û░£Ù░£ÙÉ£ ýºÇýåìÝÿò ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ýØÇ ÙºñýØ╝ Ýê¼ýò¢ÝòÿÙèö Û▓âýØ┤ ýòäÙïêÙØ╝ ýú╝ 1ÝÜî Ýÿ╣ýØÇ ýøö 1ÝÜî Ýê¼ýò¢ÝòÿÙèö ýá£ýá£Ùí£, ÙºñýØ╝ Ýê¼ýò¢ÝòÿÙèö ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ýú╝ýé¼ýØÿ ÙÂêÝÄ©Ýò¿Û│╝ ÙÂêÝÄ©Ýò¿ýØä ýñäýù¼ ýê£ýØæÙÅäÙÑ╝ ÙåÆýØ┤Ù»ÇÙí£ Ùìö ÝÜ¿Û│╝ýáüýØ╝ ýêÿ ý×êÙïñ. ýÁ£ÛÀ╝ýùÉ Ù░£Ýæ£ÙÉ£ Ù®öÝâÇÙÂäýäØýùÉýä£Ùèö ýºÇýåìÝÿò ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼Û│╝ ÙºñýØ╝ Ýê¼ýò¢ÝòÿÙèö ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ýØ┤ ý£áýé¼Ýò£ ÝÜ¿ÙèÑ Ù░Å ýòêýáäýä▒ýØä Û░ûÙèö Û▓âý£╝Ùí£ Ù│┤Û│áÝòÿýÿÇÙïñ[26]. ÛÀ©Ùƒ¼Ùéÿ IGF-1 ýêÿý╣ÿÙèö ýºÇýåìÝÿò ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ýØä Ýê¼ýù¼Ù░øýØÇ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØ ýåîýòäýùÉýä£ ý£áýØÿÝòÿÛ▓î ýâüýè╣ÝòÿýÿÇÙïñ. Ùö░ÙØ╝ýä£ ÝûÑÝøäýùÉÙèö ýºÇýåìÝÿò ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ýê¼ýò¢ ýï£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ù░Å IGF-1ýØÿ ýÁ£Û│á Ù░Å ýÁ£ýáÇ ýêÿýñÇýØ┤ ÝÜ¿ÙèÑ Ù░Å ýòêýáäýä▒ýùÉ ýû┤Ùû╗Û▓î ýÿüÝûÑýØä Ù»©ý╣ÿÙèöýºÇ, ýܮكë ýí░ýáê Ù░®Ù▓ò, IGF-1 ýêÿý╣ÿ Ù¬¿ÙïêÝä░Ùºü ýï£Û©░, ý×ÑÛ©░Û░ä Ù╣äýÜ®-ÝÜ¿Û│╝ýùÉ ÙîÇÝò£ ýÂöÛ░Ç ýù░ÛÁ¼Û░Ç ÝòäýÜöÝòÿÙïñ.
ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÇ Ù│ÁÙÂÇ Ù╣äÙºî, ýØ©ýèÉÙª░ ýáÇÝò¡ýä▒ Ù░Å ýØ┤ýâüýºÇýºêÝÿêýªØ, ýù╝ýªØ Ùºêý╗ñ ýªØÛ░ÇÙÑ╝ ÝåÁÝò┤ ýï¼ÝÿêÛ┤Ç ýºêÝÖÿýØÿ ý£äÝùÿýØä ýªØÛ░Çýï£ÝéñÙèö Û▓âý£╝Ùí£ ÙéÿÝâÇÙé¼Ùïñ[27]. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØÇ ÙÿÉÝò£ ýóîýï¼ýïñýØÿ ÙæÉÛ╗ÿ Û░Éýåî, Ù░òý£ÙÑáý×Ñýòá, ýóîýï¼ýïñ ýØ┤ýÖäÛ©░ ý®ٺîýØä ý£áÙ░£Ýòÿýù¼ ýï¼ý×Ñ Û©░ÙèÑ Ù░Å ýú¢ýâüÙÅÖÙºÑÛ▓¢ÝÖöýªØýùÉ ÙÂÇýáòýáüýØ© ýÿüÝûÑýØä Ù»©ý╣ÿÙèö Û▓âý£╝Ùí£ Ù│┤Û│áÙÉÿýùêÙïñ[28]. ÙÿÉÝò£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØ ÝÖÿý×ÉýùÉýä£ ýï¼ÝÿêÛ┤Ç ýé¼ÙºØÙÑáýØ┤ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØ┤ ýùåÙèö ÝÖÿý×ÉÙ│┤Ùïñ 2Ù░░ ÙåÆÙïñÛ│á Ù│┤Û│áÝòÿýÿÇÙïñ[29]. ýØ┤ýùÉ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîÙèö ý▓┤ýºÇÙ░® Û░Éýåî, Ýè╣Ý×ê Ùé┤ý×ÑýºÇÙ░® Û░ÉýåîýÖÇ Ù░Å ÛÀ╝ý£íÙƒë ýªØÛ░ÇÙÑ╝ ÝżÝò¿Ýòÿýù¼ ý▓┤ýä▒ÙÂäýùÉ ýâüÙï╣Ýò£ ýÿüÝûÑýØä Ù»©ý╣£ÙïñÛ│á ýØ╝Û┤ÇÙÉÿÛ▓î Ù│┤Û│áÙÉÿÛ│á, ÛÁ¡Ùé┤ ýù░ÛÁ¼ýùÉýä£ÙÅä ÝÖòýØ©ÙÉÿýùêÙïñ[30-32]. ÙÿÉÝò£ ÙçîÝòÿýêÿý▓┤ Û©░ÙèÑýáÇÝòÿýªØ ÝÖÿý×ÉýùÉýä£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ù│┤ý®ýÜöÙ▓ò ýï£ ý╣ÿÙ¬àýáüýØ© ýï¼ÛÀ╝Û▓¢ýâëýØÿ Ù░£ýâØÙÑáÛ│╝ ýé¼ÙºØÙÑáýØä Ùé«ýÂÿÙïñÛ│á Ù│┤Û│áÝòÿýÿÇÙïñ[33,34]. ÙïñÙºî, ýù¼ýä▒ýØÿ ýé¼ÙºØÙÑá Û░£ýäáýØÇ Ùé¿ýä▒Ù│┤Ùïñ Ùé«ý£╝Ù®░, ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ù│┤ý®ýÜöÙ▓òýØ┤ ýï¼ÝÿêÛ┤Ç ý£äÝùÿýØ©ý×ÉÙÑ╝ ýÖäýáäÝ×ê ÝÜîÙ│Áýï£Ýé¼ýºÇÙèö ýòäýºü ÙÂêÙÂäÙ¬àÝòÿýù¼ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ù│┤ý®ýÜöÙ▓òýØÿ ýï¼ÝÿêÛ┤Ç ýé¼ÙºØÙÑá Û░£ýäáýùÉ ÙîÇÝò£ ÙîÇÛÀ£Ù¬¿ ýóàÙï¿ýáü ýù░ÛÁ¼Û░Ç ÝòäýÜöÝòÿÙïñ.
ýä▒ýØ© ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØ ÝÖÿý×ÉýØÿ Û│¿Ù░ÇÙÅäÙèö ýù░Ùá╣ Ù░Å ýä▒Ù│äýØ┤ ýØ╝ý╣ÿÝòÿÙèö Û▒┤Û░òÝò£ ÙîÇýí░ÛÁ░Ù│┤Ùïñ Ùé«ý£╝Ù®░, ýØ┤Ùèö ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░Ýòì ýáòÙÅäýÖÇ ýâüÛ┤ÇÛ┤ÇÛ│äýùÉ ý×êÙïñ. Ùö░ÙØ╝ýä£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØ ÝÖÿý×ÉýØÿ Û│¿ýáê ý£äÝùÿýØÇ Û▒┤Û░òÝò£ ÙîÇýí░ÛÁ░Ù│┤Ùïñ 2-5Ù░░ Ùìö ÙåÆÙïñ[35]. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîýùÉ ÙîÇÝò£ Ù░ÿýØæý£╝Ùí£ Û│¿Ù░ÇÙÅäýØÿ ýâüÙï╣Ýò£ Û░£ýäáýØ┤ Ùé¿ýä▒Û│╝ ýï¼Ýò£ Û│¿ÙïñÛ│ÁýªØ ÝÖÿý×ÉýùÉýä£ Ù│┤Û│áÙÉÿýùêý£╝Ù®░, Û│¿ÙïñÛ│ÁýªØýØÿ Ù│æÙáÑýØ┤ ýùåÙèö ÝÖÿý×ÉýùÉýä£ÙÅä ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîÙèö Û│¿ýáêýØä ýÿêÙ░®ÝòÿýÿÇÙïñ[36].
ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØ ÝÖÿý×ÉÙèö ýïáý▓┤ ÙèÑÙáÑýØÿ ýáÇÝòÿýÖÇ ýï¼ÝÿêÛ┤Ç ý£äÝùÿ ýªØÛ░ÇÙí£ ýØ©Ýò┤ ýéÂýØÿ ýºêýØ┤ ýáÇÝòÿÙÉá ýêÿ ý×êÙïñ. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØ ÝÖÿý×ÉÙèö ýêÿÙ®┤, ýé¼ÝÜîÝÖ£ÙÅÖ, ýïáý▓┤ÝÖ£ÙÅÖýùÉýä£ ý£áýØÿÝòÿÛ▓î Ùé«ýØÇ Û▓░Û│╝ÙÑ╝ Ù│┤ýÿÇÛ│á, ýïáý▓┤ýáü Û▒┤Û░ò ýòàÝÖöÙèö ýºüýùà Ù░Å ýØ╝ýâüýâØÝÖ£ýùÉÙÅä ÙÂÇýáòýáüýØ© ýÿüÝûÑýØä Ù»©ý│ñÙïñ[37]. ýØ┤ýùÉ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ù│┤ý®ýÜöÙ▓òýØ┤ ýéÂýØÿ ýºêýØä ÝûÑýâüýï£Ýé¼ ýêÿ ý×êýØîýØä Ù│┤ýù¼ýú╝ýùêÙïñ[38].
ýØ┤Ùíáýáüý£╝Ùí£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîÙí£ ýØ©Ýò£ IGF-1 ÝÖ£ýä▒ ýªØÛ░ÇÙèö ýòàýä▒ ýóàýûæýØä ýòàÝÖöýï£Ýé¼ ýêÿ ý×êýû┤ýä£, ÝÖ£ÙÅÖýä▒ ýòàýä▒ ýóàýûæýØ┤ ý×êÙèö ÝÖÿý×ÉýùÉýä£ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîÙèö Û©êÛ©░ýØ┤Ùïñ[39]. ýØ╝ÙÂÇ ýù░ÛÁ¼ýùÉýä£Ùèö ýØ┤ýáäýùÉ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîÙÑ╝ Ù░øýØÇ ýåîýòäýòö ÝÖÿý×ÉýùÉýä£ 2ý░¿ ýóàýûæ Ýÿòýä▒ ý£äÝùÿýØ┤ ýò¢Û░ä ýªØÛ░ÇÝòÿýÿÇÙïñÛ│á Ù│┤Û│áÝòÿýÿÇýºÇÙºî[40], ÙîÇÙÂÇÙÂäýØÿ ýù░ÛÁ¼ýùÉýä£Ùèö ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîýÖÇ ýòàýä▒ ýóàýûæýØÿ ý×¼Ù░£ ÙÿÉÙèö ýØ┤ý░¿ ýóàýûæ Ýÿòýä▒ ýé¼ýØ┤ýùÉ ýù░Û┤Çýä▒ýØ┤ ýùåýØîýØä Ù░£Û▓¼ÝòÿýÿÇÙïñ[41]. ýØ┤Ùƒ¼Ýò£ Û▓░Û│╝Ùèö ÙæÉÛ░£Ùé┤ ý×öÙÑÿ ýûæýä▒ ýóàýûæýØ┤ ý×ÑÛ©░Û░äýùÉ Û▒©ý│É ýòêýáòýáüýØ┤ÙØ╝Ù®┤ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîÙÑ╝ Û©êýºÇÝòá ÝòäýÜöÙèö ýùåý£╝Ù®░, ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîÙèö ýòàýä▒ ýóàýûæ Ù│æÙáÑýØ┤ ý×êÙèö ÝÖÿý×ÉÛ░Ç 1Ùàä ýØ┤ýâü ý×¼Ù░£ ýùåýØ┤ Û┤ÇÝò┤ ýâüÝâ£ÙÑ╝ ý£áýºÇÝò£ Û▓¢ýÜ░ Ýê¼ýù¼Ýòá ýêÿ ý×êÙïñ[42].
ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼Û│╝ IGF-1ýØÇ ýÀîý×Ñ ╬▓ ýä©ÝżýùÉ ýØÿÝò£ ýØ©ýèÉÙª░ ýáÇÝò¡ýä▒Û│╝ ýØ©ýèÉÙª░ ÙÂäÙ╣äýùÉ ÙÅàÙª¢ýáüý£╝Ùí£ ýÿüÝûÑýØä Ù»©ý╣£Ùïñ[43]. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Ù░Å IGF-1 ýêÿý╣ÿýØÿ ýªØÛ░Ç Ù░Å Û░ÉýåîÙèö Ù¬¿ÙæÉ ÝÿêÙï╣ ýêÿý╣ÿýØÿ ýØ┤ýâüýØä ý£áÙ░£Ýòá ýêÿ ý×êÙïñ. ÙîÇÛÀ£Ù¬¿ ý×äýâü ýù░ÛÁ¼ýùÉýä£Ùèö ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîÛ░Ç ýØ©ýèÉÙª░ ýáÇÝò¡ýä▒ Ù░Å ýá£2Ýÿò Ùï╣Ùç¿Ù│æÛ│╝ Û┤ÇÙá¿ýØ┤ ý×êÙïñÛ│á Ù│┤Û│áÝò£ Ù░öÛ░Ç ý×êÙïñ[44]. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúî ýï£ý×æ ý▓½ Ýò┤ýùÉ Ù░£ýâØÝòÿÙèö Ùï╣Ùç¿Ù│æ ýáä Ùï¿Û│ä Ýÿ╣ýØÇ Ùï╣Ùç¿Ù│æÛ│╝ ýù░Û┤ÇÙÉÿÙ®░, ýØ┤Ùƒ░ Û▓¢ýÜ░ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ýܮكëýØä Û░ÉÙƒëÝòÿÛ▒░Ùéÿ, Ùï╣Ùç¿Ù│æ ýò¢ýᣠýí░ýáêýØ┤ ÝòäýÜöÝòá ýêÿ ý×êÙïñ. ÙÿÉÝò£ ÝÖ£ÙÅÖýä▒ ýªØýïØýä▒ Ýÿ╣ýØÇ ýñæýªØ Ù╣äýªØýïØýä▒ Ùï╣Ùç¿Ù│æÙºØÙºëÙ│æýªØýØ┤ ý×êÙèö Û▓¢ýÜ░ýùÉÙèö ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîÙèö Û©êÛ©░ýØ┤Ùïñ.
ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîÛ░Ç ÙçîÝòÿýêÿý▓┤Û©░ÙèÑýáÇÝòÿýªØ ÝÖÿý×ÉýØÿ ýï¼ÝÿêÛ┤Ç ýé¼ÙºØÙÑáýØä Û░Éýåîýï£ÝéñÙèöýºÇÙèö ýòäýºü Ùà╝Ù×ÇýØÿ ýù¼ýºÇÛ░Ç ý×êýºÇÙºî, ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØ ÝÖÿý×ÉýØÿ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîÙèö ý£äÝùÿÙ│┤ÙïñÙèö ýØ┤ÙôØýØ┤ Ùìö ÙºÄÙïñ. ÝòÿýºÇÙºî ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý╣ÿÙúîÙÑ╝ ýï£ý×æÝòÿÛ©░ ýáäýùÉ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ý×ÉÛÀ╣ Û▓Çýé¼ÙÑ╝ ÝåÁÝò┤ ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ Û▓░ÝòìýªØýØä ýáòÝÖòÝòÿÛ▓î ýºäÙï¿ÝòÿÙèö Û▓âýØ┤ ýñæýÜöÝò£Ùïñ. ýä▒ý×ÑÝÿ©ÙÑ┤Ù¬¼ ýܮكëýØÇ ÙÂÇý×æýÜ®ýØä ýÁ£ýåîÝÖöÝòÿÛ│á ý×äýâü ÝÜ¿ÙèÑýØä ýÁ£ÙîÇÝÖöÝòÿÛ©░ ý£äÝò┤ Û░£Ù│äÝÖöÙÉÿýû┤ýò╝ ÝòÿÙ®░ ý╣ÿÙúîÛ©░Û░ä ÙÅÖýòê ÙÂÇý×æýÜ® Ù░Å ý×äýâü Ù░ÿýØæýØä ýáòÛ©░ýáüý£╝Ùí£ Ù¬¿ÙïêÝä░ÙºüÝò┤ýò╝ Ýò£Ùïñ.
REFERENCES
1. Weaver JU, Monson JP, Noonan K, et al. The effect of low dose recombinant human growth hormone replacement on regional fat distribution, insulin sensitivity, and cardiovascular risk factors in hypopituitary adults. J Clin Endocrinol Metab 1995;80:153ÔÇô159.


2. Beshyah SA, Johnston DG. Cardiovascular disease and risk factors in adults with hypopituitarism. Clin Endocrinol (Oxf) 1999;50:1ÔÇô15.


3. Khang AR, Ku EJ, Kim YA, et al. Sex differences in the prevalence of metabolic syndrome and its components in hypopituitary patients: comparison with an age- and sex-matched nationwide control group. Pituitary 2016;19:573ÔÇô581.


4. Kim JH, Chae HW, Chin SO, et al. Diagnosis and treatment of growth hormone deficiency: a position statement from Korean Endocrine Society and Korean Society of Pediatric Endocrinology. Endocrinol Metab (Seoul) 2020;35:272ÔÇô287.



5. Yuen KCJ, Biller BMK, Radovick S, et al. American Association of Clinical Endocrinologists and American College of Endocrinology guidelines for management of growth hormone deficiency in adults and patients transitioning from pediatric to adult care. Endocr Pract 2019;25:1191ÔÇô1232.


6. Fleseriu M, Hashim IA, Karavitaki N, et al. Hormonal replacement in hypopituitarism in adults: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2016;101:3888ÔÇô3921.


7. Molitch ME, Clemmons DR, Malozowski S, Merriam GR, Vance ML; Endocrine Society. Evaluation and treatment of adult growth hormone deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2011;96:1587ÔÇô1609.


8. Melmed S. Pathogenesis and diagnosis of growth hormone deficiency in adults. N Engl J Med 2019;380:2551ÔÇô2562.


9. Molitch ME. Nonfunctioning pituitary tumors and pituitary incidentalomas. Endocrinol Metab Clin North Am 2008;37:151ÔÇô171; xi.


10. Webb SM, Rigla M, W├ñgner A, Oliver B, Bartumeus F. Recovery of hypopituitarism after neurosurgical treatment of pituitary adenomas. J Clin Endocrinol Metab 1999;84:3696ÔÇô3700.


11. Mulder RL, Kremer LC, van Santen HM, et al. Prevalence and risk factors of radiation-induced growth hormone deficiency in childhood cancer survivors: a systematic review. Cancer Treat Rev 2009;35:616ÔÇô632.


12. Schneider HJ, Kreitschmann-Andermahr I, Ghigo E, Stalla GK, Agha A. Hypothalamopituitary dysfunction following traumatic brain injury and aneurysmal subarachnoid hemorrhage: a systematic review. JAMA 2007;298:1429ÔÇô1438.


13. Hartman ML, Crowe BJ, Biller BM, et al. Which patients do not require a GH stimulation test for the diagnosis of adult GH deficiency? J Clin Endocrinol Metab 2002;87:477ÔÇô485.


14. Wacharasindhu S, Cotterill AM, Camacho-H├╝bner C, Besser GM, Savage MO. Normal growth hormone secretion in growth hormone insufficient children retested after completion of linear growth. Clin Endocrinol (Oxf) 1996;45:553ÔÇô556.


15. Hamrahian AH, Yuen KC, Gordon MB, Pulaski-Liebert KJ, Bena J, Biller BM. Revised GH and cortisol cut-points for the glucagon stimulation test in the evaluation of GH and hypothalamic-pituitary-adrenal axes in adults: results from a prospective randomized multicenter study. Pituitary 2016;19:332ÔÇô341.


16. Garcia JM, Biller BMK, Korbonits M, et al. Macimorelin as a diagnostic test for adult GH deficiency. J Clin Endocrinol Metab 2018;103:3083ÔÇô3093.


17. Biller BM, Samuels MH, Zagar A, et al. Sensitivity and specificity of six tests for the diagnosis of adult GH deficiency. J Clin Endocrinol Metab 2002;87:2067ÔÇô2079.


18. Corneli G, Di Somma C, Baldelli R, et al. The cut-off limits of the GH response to GH-releasing hormone-arginine test related to body mass index. Eur J Endocrinol 2005;153:257ÔÇô264.


19. Holmes SJ, Shalet SM. Which adults develop side-effects of growth hormone replacement? Clin Endocrinol (Oxf) 1995;43:143ÔÇô149.


20. Hoffman AR, Strasburger CJ, Zagar A, et al. Efficacy and tolerability of an individualized dosing regimen for adult growth hormone replacement therapy in comparison with fixed body weight-based dosing. J Clin Endocrinol Metab 2004;89:3224ÔÇô3233.


21. Johannsson G, Bjarnason R, Bramnert M, et al. The individual responsiveness to growth hormone (GH) treatment in GH-deficient adults is dependent on the level of GH-binding protein, body mass index, age, and gender. J Clin Endocrinol Metab 1996;81:1575ÔÇô1581.


22. Cook DM, Ludlam WH, Cook MB. Route of estrogen administration helps to determine growth hormone (GH) replacement dose in GH-deficient adults. J Clin Endocrinol Metab 1999;84:3956ÔÇô3960.


23. Agha A, Walker D, Perry L, et al. Unmasking of central hypothyroidism following growth hormone replacement in adult hypopituitary patients. Clin Endocrinol (Oxf) 2007;66:72ÔÇô77.

24. Stewart PM, Toogood AA, Tomlinson JW. Growth hormone, insulin-like growth factor-I and the cortisol-cortisone shuttle. Horm Res 2001;56(Suppl 1):1ÔÇô6.

25. Giavoli C, Lib├® R, Corbetta S, et al. Effect of recombinant human growth hormone (GH) replacement on the hypothalamic-pituitary-adrenal axis in adult GH-deficient patients. J Clin Endocrinol Metab 2004;89:5397ÔÇô5401.


26. Yang Y, Bai X, Yuan X, et al. Efficacy and safety of long-acting growth hormone in children with short stature: a systematic review and meta-analysis. Endocrine 2019;65:25ÔÇô34.


27. Giovannini L, Tirabassi G, Muscogiuri G, Di Somma C, Colao A, Balercia G. Impact of adult growth hormone deficiency on metabolic profile and cardiovascular risk [Review]. Endocr J 2015;62:1037ÔÇô1048.


28. Colao A, Cuocolo A, Di Somma C, et al. Impaired cardiac performance in elderly patients with growth hormone deficiency. J Clin Endocrinol Metab 1999;84:3950ÔÇô3955.


29. Ros├®n T, Bengtsson BA. Premature mortality due to cardiovascular disease in hypopituitarism. Lancet 1990;336:285ÔÇô288.


30. Choi HS, Kim SS, Ko KJ, et al. The effects of growth hormone administration on the markers of cardiovascular disease in growth hormone deficient adults. Korean J Med 2005;68:519ÔÇô528.
31. Kim KW, Nam SY, Kim DS, et al. Effects of growth hormone treatment beyond the body fat changes in GH-deficient adults. Korean J Obes 2013;22:56ÔÇô65.

32. G├Âtherstr├Âm G, Elbornsson M, Stibrant-Sunnerhagen K, Bengtsson BA, Johannsson G, Svensson J. Ten years of growth hormone (GH) replacement normalizes muscle strength in GH-deficient adults. J Clin Endocrinol Metab 2009;94:809ÔÇô816.


33. Pappachan JM, Raskauskiene D, Kutty VR, Clayton RN. Excess mortality associated with hypopituitarism in adults: a meta-analysis of observational studies. J Clin Endocrinol Metab 2015;100:1405ÔÇô1411.


34. van Bunderen CC, Olsson DS. Growth hormone deficiency and replacement therapy in adults: impact on survival. Rev Endocr Metab Disord 2021;22:125ÔÇô133.


35. Vestergaard P, J├©rgensen JO, Hagen C, et al. Fracture risk is increased in patients with GH deficiency or untreated prolactinomas--a case-control study. Clin Endocrinol (Oxf) 2002;56:159ÔÇô167.


36. Mo D, Fleseriu M, Qi R, et al. Fracture risk in adult patients treated with growth hormone replacement therapy for growth hormone deficiency: a prospective observational cohort study. Lancet Diabetes Endocrinol 2015;3:331ÔÇô338.


37. Bj├Ârk S, J├Ânsson B, Westphal O, Levin JE. Quality of life of adults with growth hormone deficiency: a controlled study. Acta Paediatr Scand Suppl 1989;356:55ÔÇô74.

38. Svensson J, Mattsson A, Ros├®n T, et al. Three-years of growth hormone (GH) replacement therapy in GH-deficient adults: effects on quality of life, patient-reported outcomes and healthcare consumption. Growth Horm IGF Res 2004;14:207ÔÇô215.


39. Boguszewski CL, Boguszewski MCDS. Growth hormone's links to cancer. Endocr Rev 2019;40:558ÔÇô574.


40. Ergun-Longmire B, Mertens AC, Mitby P, et al. Growth hormone treatment and risk of second neoplasms in the childhood cancer survivor. J Clin Endocrinol Metab 2006;91:3494ÔÇô3498.


41. Olsson DS, Buchfelder M, Schlaffer S, et al. Comparing progression of non-functioning pituitary adenomas in hypopituitarism patients with and without long-term GH replacement therapy. Eur J Endocrinol 2009;161:663ÔÇô669.


42. Sklar CA, Antal Z, Chemaitilly W, et al. Hypothalamic-pituitary and growth disorders in survivors of childhood cancer: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2018;103:2761ÔÇô2784.


A suggested algorithm for GH replacement therapy in GH-deficient adults [4]. GH, growth hormone; IGF-1, insulin-like growth factor-1.
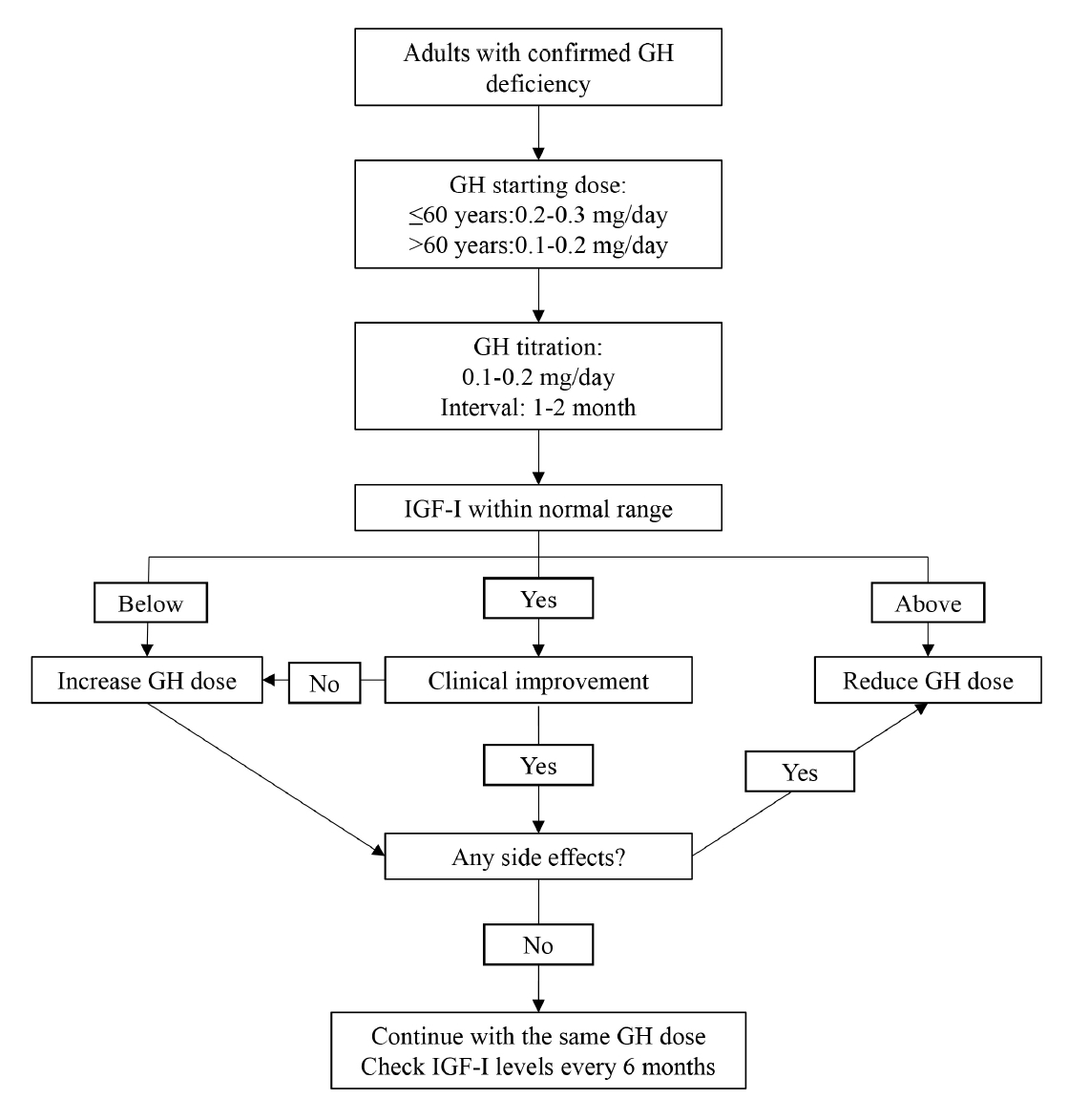
Figure 1.
Table 1.
The etiology of growth hormone deficiency [4]
Table 2.
GH stimulation tests used to diagnose GH deficiency



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




