 |
 |
| Korean J Med > Volume 98(4); 2023 > Article |
|
Abstract
In recent years, the incidence of portal vein thrombosis (PVT) in patients with cirrhosis has increased; the thrombosis ranges from asymptomatic partial to complete occlusion. Treatment is difficult. Anticoagulation therapy may be the optimal first-line treatment for patients with acute PVT who lack variceal bleeding or mesenteric ischemia. Minimally invasive treatment options include mechanical thrombectomy, chemical thrombolysis, and stent placement. However, the effectiveness and timing of anticoagulation and interventional therapies remain unclear.
Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØĆ Ļ░äļ¼Ėļ¦ź ļé┤ļČĆņŚÉ ĒśłņĀäņØ┤ ĒśĢņä▒ļÉśļŖö Ļ▓āņ£╝ļĪ£ ņĀĢņØśļÉśļ®░, ņĄ£ĻĘ╝ Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ ņżæņÜöĒĢ£ ļ¼ĖņĀ£ļĪ£ ĻĖēļČĆņāüĒĢśĻ│Ā ņ׳ļŗż. Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØĆ ļ¼┤ņ”ØņāüņØś ļČĆļČä ĒÅÉņāēļČĆĒä░ Ļ░äĻĖ░ļŖź ļČĆņĀäņŚÉ ņØśĒĢ£ ņĀĢļ¦źļźś ņČ£Ēśł, ņן Ļ┤┤ņé¼Ļ╣īņ¦Ć ņĢ╝ĻĖ░ĒĢĀ ņłś ņ׳ļŖö ņÖäņĀä ĒÅÉņāēĻ╣īņ¦Ć ļŗżņ¢æĒĢ£ ĒśĢĒā£ļĪ£ ļéśĒāĆļéĀ ņłś ņ׳ļŗż. Ļ░äĻ▓Įļ│Ćņ”Ø ņÖĖņŚÉļÅä ņäĀņ▓£ņĀü Ēś╣ņØĆ Ēøäņ▓£ņĀü ņØæĻ│Ā ņ¦łĒÖś, ļ│ĄļČĆ Ļ░ÉņŚ╝, ņłśņłĀņØ┤ļéś ņÖĖņāüņ£╝ļĪ£ ņØĖĒĢ£ ĒśłĻ┤Ć ļé┤Ēö╝ņäĖĒżņØś ņåÉņāüļÅä Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØä ņØ╝ņ£╝Ēé¼ ņłś ņ׳ļŗż[1]. ļśÉĒĢ£ Ļ░äņäĖĒżņĢö ļ░Å ņĀäņØ┤ņĢö ļō▒ņØś ĒśłĻ┤Ć ņ╣©ņ£żļÅä Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŗż[2,3]. Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØ┤ Ļ░äĻ▓Įļ│Ćņ”ØņØś ņĢģĒÖöļĪ£ ļ░£ņāØĒĢśļŖöņ¦Ć, ņĢäļŗłļ®┤ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ Ļ░äĻĖ░ļŖźņØ┤ ņĢģĒÖöļÉśļŖöņ¦Ć ĻĘĖ ņØĖĻ│╝Ļ┤ĆĻ│äļŖö ļ¬ģĒÖĢĒĢśņ¦Ć ņĢŖņ¦Ćļ¦ī, ņĄ£ĻĘ╝ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ Ļ░äĻĖ░ļŖź ņĢģĒÖöņŚÉ ļö░ļØ╝ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØ┤ ļ░£ņāØĒĢ£ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[2,4,5]. ņØ┤Ļ▓āņØĆ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØ┤ Ļ░äĻĖ░ļŖź ņĢģĒÖöņØś ņøÉņØĖņØ┤ļØ╝ĻĖ░ļ│┤ļŗżļŖö Ļ░äĻĖ░ļŖź ņĢģĒÖöļź╝ ļéśĒāĆļé┤ļŖö ņżæņ”ØļÅä ņ¦ĆĒæ£Ļ░Ć ļÉĀ ņłś ņ׳ļŗżļŖö Ļ▓āņØä ņØśļ»ĖĒĢ£ļŗż. ļīĆņ▓┤ļĪ£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØś 30-50% ņĀĢļÅäļŖö ņ×ÉņŚ░ņĀüņ£╝ļĪ£ ĒśĖņĀäļÉśņ¦Ćļ¦ī, ņØ╝ļČĆ ņŚ░ĻĄ¼ņŚÉņä£ ņÖäņĀäĒĢ£ ĒÅÉņćäņä▒ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ņØ┤ņŗØ Ēøä ņé¼ļ¦ØļźĀņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż[5]. ļö░ļØ╝ņä£ Ļ░ä ņØ┤ņŗØņØ┤ ĒĢäņÜöĒĢ£ ĒÖśņ×ÉĻ░Ć ņÖäņĀäĒĢ£ ĒÅÉņćäņä▒ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ņŗĀņåŹĒĢ£ ņ×¼Ļ┤Ćļźś ņĀäļץņØ┤ ĒĢäņÜöĒĢśļŗż[6]. ĻĘĖļ¤¼ļéś ņĢäņ¦ü Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØä ņ¢┤ļ¢ż ņŗ£ņłĀļĪ£ ņ¢ĖņĀ£ ņ╣śļŻīĒĢ┤ņĢ╝ ĒĢśļŖöņ¦Ć, ĒĢŁņØæĻ│ĀņĀ£ņØś ņóģļźśņÖĆ ņé¼ņÜ® ĻĖ░Ļ░ä ļō▒ņŚÉ ļīĆĒĢśņŚ¼ ņØ╝ņ╣śļÉ£ Ļ▓░ļĪĀņØ┤ ņŚåļŖö ņāüĒā£ņØ┤ļŗż. ļ│Ė ļģ╝ļ¼ĖņŚÉņä£ļŖö ņØ┤ņŚÉ ļīĆĒĢ£ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ļōżņØä ņé┤ĒÄ┤ļ│┤ļĀżĻ│Ā ĒĢ£ļŗż.
Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØś ļ╣łļÅäļŖö 0.6-26%ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳Ļ│Ā, ļ╣äļīĆņāüņä▒ Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ ļ╣łļÅäĻ░Ć ļŹöņÜ▒ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[7,8]. ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ļōżņŚÉņä£ ļÅÖņ¢æņŚÉņä£ņØś ņĀäņ▓┤ Ļ░äļ¼Ėļ¦ź Ļ│ĀĒśłņĢĢņØś ņøÉņØĖ ņżæ 1/3ņØ┤ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”Øņ£╝ļĪ£ ņØĖĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ņ£╝ļ®░, ņä£ņ¢æņŚÉņä£ļŖö ļīĆņ▓┤ļĪ£ Ļ░äļ¼Ėļ¦ź Ļ│ĀĒśłņĢĢņØś ņøÉņØĖ ņżæ 5-10% ņĀĢļÅäļź╝ ņ░©ņ¦ĆĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[9,10].
ņØ┤ļ¤░ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØś ņ×äņāü ņ”ØņāüņØĆ ļ╣äĒŖ╣ņØ┤ņĀüņ£╝ļĪ£, ļīĆļץ 1/3 ņĀĢļÅäņØś ĒÖśņ×ÉļōżņØĆ ļ¼┤ņ”Øņāüņ£╝ļĪ£ ņÜ░ņŚ░Ē׳ Ļ▓Ćņ¦äņŚÉņä£ ļ░£Ļ▓¼ļÉśĻ│ż ĒĢ£ļŗż. Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØĆ ņŗ£Ļ░ä Ļ▓ĮĻ│╝ņŚÉ ļö░ļØ╝ ņ”Øņāü ļ░£Ēśä 60ņØ╝ņØä ĻĖ░ņżĆņ£╝ļĪ£ ĻĖēņä▒Ļ│╝ ļ¦īņä▒ņ£╝ļĪ£ ĻĄ¼ļČäĒĢ£ļŗż. ņ”ØņāüņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ĒśłņĀäņØś ņ£äņ╣śļéś ņĀĢļÅä, ĒÖśņ×ÉņØś ļéśņØ┤ņŚÉ ļö░ļØ╝ņä£ ņ×äņāü ņ¢æņāüņØ┤ ļŗ¼ļØ╝ņ¦ł ņłś ņ׳ļŗż. ĻĖēņä▒ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņŚÉņä£ļŖö Ļ░äļ¼Ėļ¦ź Ļ│ĀĒśłņĢĢņØ┤ļéś ņĖĪļČĆ ĒśłĒ¢ēņØä Ļ┤Ćņ░░ĒĢĀ ņłś ņŚåĻ│Ā, Ļ░äĻĖ░ļŖźļÅä ņØ╝ļ░śņĀüņ£╝ļĪ£ ņĀĢņāüņØ┤ļŗż. ņ”ØņāüņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ļ│ĄĒåĄ, ļ░£ņŚ┤, ņśżņŗ¼ ļō▒ņØś ņ”ØņāüņØä ĒśĖņåīĒĢĀ ņłś ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī ĻĖēņä▒ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØ┤ ņāüņןĻ░äļ¦ēņĀĢļ¦źņŚÉ ņ׳ļŖö Ļ▓ĮņÜ░ ļ│ĄĒåĄ, ņäżņé¼ļéś ņןļ¦łļ╣äņØś ĒśĢĒā£ļĪ£ ļéśĒāĆļéĀ ņłś ņ׳ņ£╝ļ®░ ņŗ¼ĒĢĀ Ļ▓ĮņÜ░ ļ│Ąļ¦ēņŚ╝Ļ│╝ ĒĢ©Ļ╗ś Ēī©Ēśłņ”Ø, ļŗżņןĻĖ░ ļČĆņĀäĻ╣īņ¦ĆļÅä ņś¼ ņłś ņ׳ļŗż[11]. ĒŖ╣Ē׳ ļ¼Ėļ¦źņĢĢĒĢŁņ¦äņ”ØņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ņŚÉļŖö ļ¼Ėļ¦źņ£ä ļ│æņ”Øņ£╝ļĪ£ ņØĖĒĢ£ ņ£äņןĻ┤Ć ņČ£ĒśłņØś ņ£äĒŚśļÅä ņ”ØĻ░ĆĒĢĀ ņłś ņ׳ļŗż. ĻĖēņä▒ ņāüņןĻ░äļ¦ēņĀĢļ¦ź ĒśłņĀäņ”ØņØ┤ļéś ĒĢśņןĻ░äļ¦ēņĀĢļ¦ź ĒśłņĀäņ”ØņØĆ ĒŚłĒśłņ”ØņØ┤ ļÅÖļ░śļÉ£ ĻĖēņä▒ ļ│ĄĒåĄņ£╝ļĪ£ ļ░£ĒśäļÉĀ ņłś ņ׳ļŗż. ļīĆĻ░£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņŚÉņä£ ĻĖēņä▒ ņןĻ░äļ¦ē ĒŚłĒśłņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░Ļ░Ć 6-15% ņĀĢļÅä ļÉ£ļŗż[12,13].
ļ¦īņä▒ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØĆ ņØ╝ļ░śņĀüņ£╝ļĪ£ ņŗØļÅä ļ░Å ņ£äņĀĢļ¦źļźś ļśÉļŖö Ļ░äļ¼Ėļ¦źņ£ä ļ│æņ”ØņŚÉ ļö░ļźĖ ņāüļČĆņ£äņןĻ┤Ć ņČ£Ēśł, ļ▓öĒśłĻĄ¼ Ļ░Éņåīņ”ØņØä ļÅÖļ░śĒĢ£ ļ╣äņן ņóģļīĆ, ļ│Ąņłś ļō▒ņØś ņ”ØņāüņØä ļéśĒāĆļé┤ļŖö Ļ░äļ¼Ėļ¦ź Ļ│ĀĒśłņĢĢņØś ņ¦ĢĒøäļź╝ ļ│┤ņØ┤ļ®░, ļō£ļ¼╝Ļ▓ī Ļ░äļ¼Ėļ¦ź ĒĢ┤ļ®┤ ļ│ĆĒśĢņ£╝ļĪ£ ņØĖĒĢ£ ļ¼Ėļ¦źņä▒ ļŗ┤ņ”Öņ”Ø(portal cholangiopathy)ļÅä ļéśĒāĆļéĀ ņłśļÅä ņ׳ļŗż. ļśÉĒĢ£ ņØ╝ļČĆņŚÉņä£ļŖö ļ¼┤ņ”ØņāüņØ┤ĻĖ░ļÅä ĒĢśņ¦Ćļ¦ī ņØ╝ļČĆņŚÉņä£ļŖö ĒÖ®ļŗ¼ņØ┤ļéś ļŗ┤Ļ┤ĆņŚ╝, ļ│ĄĒåĄ ļō▒ņØś ņ”ØņāüņØ┤ ņāØĻĖĖ ņłś ņ׳ļŗż[14,15].
Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØś ļČäļźś ņ▓┤Ļ│äļŖö ļŗżņ¢æĒĢśļ®░ ļīĆļČĆļČä Ļ░ä ņØ┤ņŗØ ĒÖśņ×ÉņŚÉņä£ ņśłĒøäļź╝ ņśłņĖĪĒĢśĻĖ░ ņ£äĒĢ┤ Ļ░£ļ░£ļÉśņŚłļŗż[16]. Ēśäņ×¼Ļ╣īņ¦Ć ļ│┤Ļ│ĀļÉ£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”Ø ļČäļźś ņ▓┤Ļ│äļŖö Ēæ£ 1ņŚÉ ņÜöņĢĮļÉśņ¢┤ ņ׳ļŗż[17-26]. Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØä ĻĖ░ņłĀĒĢśĻĖ░ ņ£äĒĢ£ ņŚ¼ļ¤¼ ņóģļźśņØś ļČäļźś ņ▓┤Ļ│ä ņżæ Ļ░Ćņן ņ×ÉņŻ╝ ņé¼ņÜ®ļÉśļŖö ļČäļźś ņ▓┤Ļ│ä ņżæ ĒĢśļéśņØĖ Yerdel ļČäļźśļŖö Ļ░ä ņØ┤ņŗØ ļō▒ņØś ņłśņłĀņØä ĒĢśļŖö ļÅÖņĢłņØś ņ╣śļŻī ļ░®ļ▓ĢņØä ņĀĢĒĢśļŖö ļŹ░ ņØ┤ņÜ®ļÉ£ļŗż[20]. ĒĢśņ¦Ćļ¦ī ņØ┤ ļČäļźś ņ▓┤Ļ│äļŖö ĒĢ┤ļČĆĒĢÖņĀü ļČäļźś ņ▓┤Ļ│äņØ╝ ļ┐ÉņØ┤ļ®░, ĒśłņĀäņØś ĻĖ░Ļ░äņØ┤ļéś ĒÖśņ×ÉņØś ņ”Øņāü ļō▒ņØś ņĀĢļ│┤ļŖö ņĀ£Ļ│ĄĒĢśņ¦Ć ņĢŖļŖöļŗż. ņØ┤ņŚÉ Yerdel ļČäļźśņØś ĒĢ£Ļ│äļź╝ Ļ│ĀļĀżĒĢśņŚ¼ ĒÖśņ×ÉņØś ĻĖ░ļŖźņĀü ņĀĢļ│┤ļź╝ ĒżĒĢ©ĒĢśļŖö ņāłļĪ£ņÜ┤ ļČäļźś ņ▓┤Ļ│äĻ░Ć ņĀ£ņĢłļÉśņ¢┤ ņÖöļŗż. 2016ļģä SarinņØ┤ ņĀ£ņĢłĒĢ£ ĒĢ┤ļČĆ-ĻĖ░ļŖźņĀü ļČäļźś ņ▓┤Ļ│äļŖö ĒśłņĀäņØś ņ£äņ╣śļ┐É ņĢäļŗłļØ╝ ĒÅÉņāēņØś ņĀĢļÅä, ĻĖ░Ļ░ä, ĒÖśņ×ÉņØś ņ”Øņāü, ĒśłņĀäņØś ņĀĢļÅäņÖĆ ĻĖ░ņĀĆ Ļ░ä ņ¦łĒÖśņØś ņ£Āļ¼┤ļÅä Ļ│ĀļĀżĒĢśļ®░, 2019ļģä BhanguiĻ░Ć ņĀ£ņĢłĒĢ£ ļČäļźś ņ▓┤Ļ│äņŚÉņä£ļŖö Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØä ļ│ĄĒĢ®ņä▒(complex type)Ļ│╝ ļ╣äļ│ĄĒĢ®ņä▒(non-complex type) Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ£╝ļĪ£ ļČäļźśĒĢśļ®░, ĻĖ░ļŖźņĀü, ĒśłņŚŁĒĢÖņĀü Ļ┤ĆņĀÉņŚÉņä£ ņśłĒøäļź╝ ņśłņĖĪĒĢśļŖö ļŹ░ ņØ┤ņÜ®ļÉ£ļŗż[25,26].
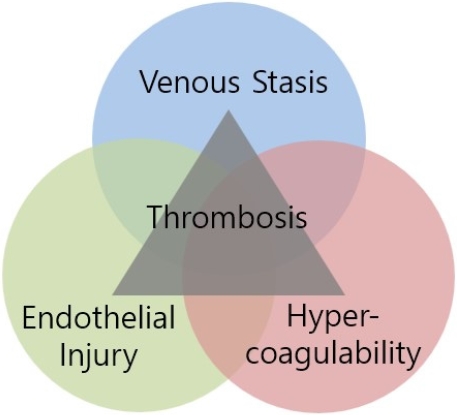
ļ╣äļīĆņāüņä▒ Ļ░äĻ▓Įļ│Ć ĒÖśņ×ÉņŚÉņä£ Ļ│╝ņØæĻ│Āņä▒, Ēśłļźś ņĀĢņ▓┤ ĻĘĖļ”¼Ļ│Ā ļé┤Ēö╝ ņäĖĒż ņåÉņāüņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö VirchowņØś ņäĖ Ļ░Ćņ¦Ć ņÜöņåīļŖö ļ¼Ėļ¦źĻ│äņÖĆ ņןĻ░äļ¦ēņĀĢļ¦źĻ│äņŚÉņä£ ĒśłņĀäņ”ØņØä ņ£Āļ░£ĒĢśļŖö ņŻ╝ņÜö ņøÉņØĖņØ┤ ļÉ£ļŗż(Table 2, Fig. 1) [27]. Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉļŖö ĻĖ░ļ│ĖņĀüņ£╝ļĪ£ Ļ│╝ņØæĻ│Ā ņāüĒā£ņŚÉ ņ׳ļŖöļŹ░, ņØ┤ļŖö ņ¦ĆĒśł ĻĘĀĒśĢņØś ļ│ĆĒÖöļĪ£ ņØĖĒĢ┤ ņ”ØĻ░ĆļÉ£ ĒŖĖļĪ¼ļ╣ł ņłśņ╣śļĪ£ ļéśĒāĆļéśļ®░, ņØæĻ│ĀņØĖņ×É ĒĢ®ņä▒ ļČĆņĪ▒ņ£╝ļĪ£ ņČ£Ēśł Ļ▓ĮĒ¢źņØ┤ ņ׳ņ£╝ļéś ņŗżņĀ£ ĒĢŁņØæĻ│ĀņØĖņ×ÉņØś ĒĢ®ņä▒ļÅä ļČĆņĪ▒ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņČ£Ēśł-ĒśłņĀä Ļ▓ĮĒ¢źņØĆ ĻĘĀĒśĢņØä ņØ┤ļŻ©Ļ│Ā ņ׳ļŗż[28]. ĒÖśņ×ÉļōżņØĆ ņĢłĒŗ░ĒŖĖļĪ¼ļ╣łĻ│╝ ļŗ©ļ░▒ņ¦ł CņÖĆ Ļ░ÖņØĆ ĒĢŁņØæĻ│ĀņØĖņ×É ņłśņ╣śĻ░Ć Ļ░ÉņåīĒĢ┤ ņ׳ņ£╝ļéś factor VIIIĻ│╝ von Willebrand factorņÖĆ Ļ░ÖņØĆ ņØæĻ│Āņ┤ēņ¦äņØĖņ×É ņłśņ╣śļŖö ņ”ØĻ░ĆĒĢ┤ ņ׳ļŗż. ņØ┤ Ļ▓ĮņÜ░ ĒśłņåīĒīÉ Ļ░Éņåīņ”ØņØ┤ ņØ╝ļ░śņĀüņØ┤ņ¦Ćļ¦ī ADAMTS-13ņØś Ļ░ÉņåīļĪ£ ņØĖĒĢ┤ ĒśłņåīĒīÉņØś ĒśłņĀä ņāØņä▒ ļŖźļĀźņØ┤ ņ”ØĻ░ĆĒĢśĻ▓ī ļÉ£ļŗż[1,29,30]. ņØ┤ļ¤░ Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ ņןņĀÉļ¦ēņØś Ļ░ÉņŚ╝ ļĢīļ¼ĖņŚÉ ļ¼Ėļ¦źĻ│äļĪ£ ņäĖĻĘĀņØ┤ ņØ┤ļÅÖĒĢśņŚ¼ ņØ┤ņ░©ņĀüņ£╝ļĪ£ ļ░£ņāØĒĢśļŖö ļé┤ļÅģņåīĒśłņ”Ø ņŚŁņŗ£ ĒśłņĀäņ”ØņØä ņ£Āļ░£ĒĢśĻĖ░ļÅä ĒĢ£ļŗż[1,2,31].
Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ļŖö ņŗżņ¦ł ĻĄ¼ņĪ░ņØś ĻĄ¼ņĪ░ņĀü ļ│ĆĒśĢņ£╝ļĪ£ ņØĖĒĢ┤ Ēśłļźś ĒØÉļ”äņØ┤ Ļ░ÉņåīĒĢśĻ│Ā ĒśłĻ┤Ć ņĀĆĒĢŁņØ┤ ņ”ØĻ░ĆĒĢśĻ▓ī ļÉ£ļŗż. ļśÉĒĢ£ ļ¼Ėļ¦źņĀäņŗĀ ņĖĪļČĆ ņł£ĒÖś ļ░Å ļé┤ņןĒśłĻ┤ĆņØś ĒÖĢņןņ£╝ļĪ£ ĒśłļźśĻ░Ć ņĀĢņ▓┤ĒĢśĻ▓ī ļÉ£ļŗż. ļ¼Ėļ¦źĻ│äņØś ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒÖöļŖö Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ņ£╝ļ®░, ĒŖ╣Ē׳ Ļ░äļ¼Ėļ¦źņŚÉņä£ 15 cm/s ļ»Ėļ¦īņØś Ēśłļźś ņåŹļÅäļŖö ĒśłņĀäņ”ØņØś ļ░£ņāØ ņ£äĒŚśņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[7,32]. Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņØś ļé┤Ēö╝ņäĖĒż ņåÉņāüņØĆ ņ×Éļ░£ņĀü ņäĖĻĘĀņä▒ ļ│Ąļ¦ēņŚ╝, ņĀäņŗĀ Ļ░ÉņŚ╝, Ļ░ä ņĀłņĀ£ņłĀ, ļé┤ņŗ£Ļ▓Į ņĀĢļ¦źļźś Ļ▓ĮĒÖö ņÜöļ▓Ģ, Ļ▓ĮņĀĢļ¦ź Ļ░ä ļé┤ ļ¼Ėļ¦źņĀäņŗĀļŗ©ļØĮ(transjugular intrahepatic portosystemic shunt, TIPS) ļ░░ņ╣ś ļśÉļŖö ĻĖ░ĒāĆ ĒśłĻ┤Ć ļé┤ ļ¼Ėļ¦ź-ņĀĢļ¦ź ņżæņ×¼ļĪ£ ņØĖĒĢ£ Ļ▓āņØ╝ ņłś ņ׳Ļ│Ā, ņØ┤ļ¤¼ĒĢ£ ņÜöņåīļōżņØ┤ Ļ░äļ¼Ėļ¦ź ĒśłņĀä ĒśĢņä▒ņŚÉ ĻĖ░ņŚ¼ĒĢĀ ņłś ņ׳ļŗż.
Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØĆ ļŗżļźĖ ņĀĢļ¦ź ĒśłņĀäņ”ØĻ│╝ļŖö ļŗ¼ļ”¼ ņ×ÉņŚ░ Ļ▓ĮĻ│╝ņŚÉ ņ׳ņ¢┤ņä£ļÅä ļŗżņ¢æĒĢ£ Ļ▓ĮĻ│╝ļź╝ ļ│┤ņØĖļŗż[33]. Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØĆ Ļ░äĻ▓Įļ│Ćņ”ØņØ┤ ļÅÖļ░śļÉ£ Ļ▓ĮņÜ░ņÖĆ ļÅÖļ░śļÉśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ņŚÉ ļö░ļØ╝ ņśłĒøäĻ░Ć ļŗżļźĖ Ļ▓ĮĻ│╝ļź╝ ļ│┤ņØ┤ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż. Ļ░äĻ▓Įļ│Ćņ”ØņØ┤ ļÅÖļ░śļÉ£ ņØ╝ļČĆ Ļ▓ĮņÜ░ņŚÉņä£ļŖö Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØś ņ×ÉņŚ░ Ļ┤ĆĒĢ┤Ļ░Ć Ļ┤Ćņ░░ļÉśĻĖ░ļÅä ĒĢ£ļŗż. ņĄ£ĻĘ╝ņØś ļ®öĒāĆļČäņäØņŚÉņä£ļŖö ĒĢŁņØæĻ│Ā ņ╣śļŻīļź╝ ļ░øņØĆ ĒÖśņ×ÉņÖĆ ļ░øņ¦Ć ņĢŖņØĆ ĒÖśņ×É ņżæ Ļ░äĻ▓Įļ│Ćņ”ØņŚÉņä£ ļÅÖļ░śļÉ£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”Ø ĒÖśņ×ÉņŚÉņä£ ĒĢŁņØæĻ│Ā ņ╣śļŻī ņŚåņØ┤ 42%ņØś ņ×¼Ļ┤Ćļźśņ£©ņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż[34]. ņØ┤ļĀćĻ▓ī ņ×ÉņŚ░ Ļ┤ĆĒĢ┤ļÉśļŖö ļ╣äņ£©ņØĆ ļīĆņāüņä▒ Ļ░äĻ▓Įļ│Ćņ”Ø, ļČĆļČä Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØś Ļ▓ĮņÜ░ņŚÉņä£ ļ╣äļīĆņāüņä▒ Ļ░äĻ▓Įļ│Ćņ”Ø, Ļ░ä ņØ┤ņŗØ ļīĆĻĖ░ ĒÖśņ×Éļōżļ│┤ļŗż ļŹö ļåÆņĢśļŗż[35]. ņØ┤ļ¤░ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØś Ļ┤ĆĒĢ┤ņŚÉļŖö ĻĘĖ ņÖĖņŚÉļÅä ņłśļ¦ÄņØĆ ņÜöņØĖļōżņØ┤ Ļ┤ĆĻ│äļÉśĻĖ░ ļĢīļ¼ĖņŚÉ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØś ņ×¼Ļ┤Ćļźśņ£©ņŚÉ ļīĆĒĢ£ Ļ░ØĻ┤ĆņĀüņØĖ ĒÅēĻ░ĆļŖö ņēĮņ¦Ć ņĢŖļŗż. ĒĢŁņØæĻ│ĀņĀ£ ņé¼ņÜ® ņŚåņØ┤ ņ×ÉņŚ░ Ļ┤ĆĒĢ┤Ļ░Ć ļÉśļŖö Ļ▓ĮņÜ░ļÅä ņ׳ņ¦Ćļ¦ī ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļīĆņāüņä▒ Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×Éļōż ņżæ ņ╣śļŻīļź╝ ļ░øņ¦Ć ņĢŖņØĆ ĒÖśņ×Éļōż Ļ░ĆņÜ┤ļŹ░ 33%ņŚÉņä£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØ┤ ņ¦äĒ¢ēļÉśļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņŚ¼ņŻ╝ņŚłļŗż[34]. ļ░śļ®┤ ĒĢŁņØæĻ│Ā ņ╣śļŻī ņØ┤ĒøäņØś Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”Ø Ļ┤ĆĒĢ┤ņ£©ņØĆ ļŗżļźĖ ņĀĢļ¦ź ĒśłņĀäņ”ØņŚÉ ļ╣äĒĢ┤ ļé«ņØĆ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[33].
Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØä ņśłņĖĪĒĢśļŖö Ēśłņ▓ŁĒĢÖņĀü ņ¦ĆĒæ£ņØś ņŚŁĒĢĀņØĆ ļČłļČäļ¬ģĒĢśļŗż. D-dimerņÖĆ ļŗ©ļ░▒ņ¦ł C, ļŗ©ļ░▒ņ¦ł SņØś ņłśņ╣śĻ░Ć ņ×Āņ×¼ņĀüņØĖ ņśłņĖĪ ņØĖņ×ÉļĪ£ ņĀ£ņĢłļÉśņ¦Ćļ¦ī, ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ļōżņØä ļ│┤ņĢśņØä ļĢī ņØ╝ļ░śĒÖöĻ░Ć Ļ░ĆļŖźĒĢ£ Ļ▓░ļĪĀņØä ļé┤ļ”┤ ņłśļŖö ņŚåņŚłļŗż[36,37]. ņØ┤ņĀäņŚÉ 10Ļ░Ćņ¦Ć ĻĖ░ņżĆņ£╝ļĪ£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņŚÉ ļīĆĒĢ£ ņé¼ņĀä ĒÅēĻ░ĆĻ░Ć ņĀ£ņĢłļÉ£ ņĀü ņ׳ļŖöļŹ░, ņäĖ Ļ░Ćņ¦Ć ņŻ╝ņÜö ĻĖ░ņżĆņØĆ Child-Pugh B/C, Ļ░äļ¼Ėļ¦ź ĒśłņĀä Ļ│╝Ļ▒░ļĀź ļ░Å ņĀäĒśłņĀäņä▒ ņ£äĒŚś ņØĖņ×É(factor V leiden mutation, prothrombin gene mutation, MTHFR mutation)ļź╝ ĒżĒĢ©ĒĢśĻ│Ā, ļéśļ©Ėņ¦Ć ņØ╝Ļ│▒ Ļ░Ćņ¦Ć ļČĆĻ░ĆņĀüņØĖ ĻĖ░ņżĆņŚÉļŖö ļ¼Ėļ¦źņĀäņŗĀ ļŗ©ļØĮ, ņ£äņĀĢļ¦źļźś, Ļ░äņĢö, ņĀäņŗĀņĀĢļ¦ź ĒśłņĀäņ”ØņØś ņ£Āļ¼┤, ņ£Āņé░, ĻĖēņä▒ ļ│ĄĒåĄ, Ļ░äļ¼Ėļ¦ź Ļ│ĀĒśłņĢĢ ĒĢ®ļ│æņ”ØņØś ļ░£ļ│æņØ┤ļéś ņĢģĒÖö, ņĄ£ĻĘ╝ ļé┤ņŗ£Ļ▓ĮņĀü/ņÖĖĻ│╝ņĀü/ļ░®ņé¼ņäĀ ņżæņ×¼ņłĀ ĻĖ░ņÖĢļĀź ļ░Å ļ¼Ėļ¦ź ņ£ĀņåŹņØ┤ 15 cm/s ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ļź╝ ĒżĒĢ©ĒĢ£ļŗż. Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”Ø ņśłņĖĪņØä ņ£äĒĢ┤ ņĀ£ņĢłļÉ£ ņØ┤ 10ņĀÉ ĒÅēĻ░ĆļŖö ĒżĻ┤äņĀüņØĖ Ļ▓āņ£╝ļĪ£ ļ│┤ņØ┤ņ¦Ćļ¦ī ņĢäņ¦ü ņĀäĒ¢źņĀü ņŚ░ĻĄ¼ņŚÉņä£ Ļ▓Ćņ”ØļÉ£ ļ░öĻ░Ć ņŚåļŗż[25].
ņóģņóģ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØ┤ Ļ░äņĢö ņĀĢĻĖ░ Ļ▓Ćņ¦äņØä ļ░øļŖö Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ ņÜ░ņŚ░Ē׳ ļ░£Ļ▓¼ļÉśĻĖ░ļÅä ĒĢ£ļŗż. ļÅäĒöīļ¤¼ ĒÅēĻ░Ćļź╝ ņØ┤ņÜ®ĒĢ£ Ļ░ä ņ┤łņØīĒīī Ļ▓Ćņé¼ļŖö Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØä ĒÖĢņØĖĒĢĀ ļĢī ņé¼ņÜ®ļÉśļŖö ņ┤łĻĖ░ Ļ▓Ćņé¼ņØ┤ļ®░, 89%ņØś ļ»╝Ļ░ÉļÅäņÖĆ 92%ņØś ĒŖ╣ņØ┤ļÅäļź╝ ļ│┤ņØĖļŗż. ĒśłĻ┤ĆņĪ░ņśü computed tomography (CT) ļ░Å ĒśłĻ┤ĆņĪ░ņśü magnetic resonance imaging (MRI)ņØĆ 90%ņØś ļ»╝Ļ░ÉļÅäņÖĆ 99%ņØś ĒŖ╣ņØ┤ļÅäļź╝ ļ│┤ņŚ¼(Fig. 2) ņ┤łņØīĒīī ļÅäĒöīļ¤¼ļ│┤ļŗż ļŹö ļ»╝Ļ░ÉĒĢśĻ│Ā ĒŖ╣ņØ┤ņĀüņØ┤ļ®░, ĒśłņĀäņØś ĻĖ░Ļ░äĻ│╝ ļ▓öņ£äņŚÉ ļīĆĒĢ£ ņĀĢļ│┤ļÅä ņĀ£Ļ│ĄĒĢ£ļŗż. ļśÉĒĢ£ ņāüļČĆ ņןĻ░äļ¦ēĻ│╝ ļ╣äņן ņĀĢļ¦źņŚÉņä£ ĒśłņĀäņØ┤ ņ׳ļŖöņ¦Ćļź╝ ĒÖĢņØĖĒĢśĻ│Ā, ņןĻ░äļ¦ēĻ│╝ Ļ░ÖņØĆ ĒśłĻ┤Ć ņÖĖ ĻĄ¼ņĪ░ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢ£ ņĀĢļ│┤ļÅä ņĀ£Ļ│ĄĒĢśļ®░, ņĖĪļČĆ ļ░Å ļ¼Ėļ¦ź ņĀäņŗĀ ļŗ©ļØĮ ņ£Āļ¼┤ļÅä ņĢī ņłś ņ׳ļŗż[12,38]. ņØ╝ļ░śņĀüņ£╝ļĪ£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØ┤ ņØśņŗ¼ļÉśļŖö Ļ▓ĮņÜ░ Ļ░ä ļÅäĒöīļ¤¼ ņ┤łņØīĒīīļź╝ ļ©╝ņĀĆ ņŗ£Ē¢ēĒĢśļ®░, ĒśłņĀäņ”ØņØ┤ ĒÖĢņØĖļÉśļ®┤ ĒśłĻ┤ĆņĪ░ņśü CTļéś MRIļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ ĒśłņĀäņØś ļ▓öņ£äņÖĆ ĒśłĻ┤Ć ņÖĖ ĻĄ¼ņĪ░ļź╝ ĒīīņĢģĒĢśļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢśļŗż.
ņØ┤ ļ░¢ņŚÉļÅä ņ¢æņä▒(bland thrombosis)Ļ│╝ ņĢģņä▒(portal vein tumor thrombosis, PVTT)ņØä ĻĄ¼ļ│äĒĢśļŖö Ļ▓āņØĆ ļ¦żņÜ░ ņżæņÜöĒĢśļŗż. Ļ░äņŗżņ¦ł ļé┤ņŚÉ Ļ░äņäĖĒżņĢöņØ┤ļéś ļŗ┤Ļ┤ĆņĢö ļō▒ņØś ņóģņ¢æņØ┤ ņ׳ņ£╝ļ®░ ņØ┤ ņóģņ¢æņØ┤ Ļ░äļ¼Ėļ¦źņØä ņ¦üņĀæ ņ╣©ļ▓öĒĢśļŖö Ļ▓ĮņÜ░ PVTTļĪ£ ņ¦äļŗ©ĒĢĀ ņłś ņ׳Ļ▓Āņ¦Ćļ¦ī, ļ¢©ņ¢┤ņĀĖ ņ׳ņ£╝ļ®┤ dynamic CTļéś MRI Ēś╣ņØĆ ļÅäĒöīļ¤¼ ņ┤łņØīĒīī ļō▒ņØś ņśüņāü ņ¦äļŗ©ņ£╝ļĪ£ ĻĄ¼ļ│äĒĢ┤ņĢ╝ ĒĢ£ļŗż. ņĢäņ¦üĻ╣īņ¦Ć ņ▓┤Ļ│äĒÖöļÉ£ ĻĄ¼ļ│äļ▓ĢņØĆ ņŚåļŖö ņāüĒÖ®ņ£╝ļĪ£ ļ¼Ėļ¦źņØś ĒÖĢļīĆ ņŚ¼ļČĆ, ļ¼Ėļ¦ź ļé┤ļČĆņŚÉ ņĀäļ░śņĀüņØĖ ņĪ░ņśüņ”ØĻ░Ģ ņŚ¼ļČĆ, ļ¼Ėļ¦ź ļé┤ ņŗĀņāØĒśłĻ┤Ć(neovascularity) ņŚ¼ļČĆ ļō▒ņØä ņóģĒĢ®ĒĢśņŚ¼ ĒīÉļŗ©ĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż. ņØ┤ņĀäņØś CTļź╝ ņØ┤ņÜ®ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ņĢģņä▒Ļ│╝ ņ¢æņä▒ ĒśłņĀäņ”ØņŚÉņä£ ļ¼Ėļ¦ź ĒÅēĻĘĀ ņ¦üĻ▓ĮņØ┤ Ļ░üĻ░ü 23.4 mmņÖĆ 16 mmļĪ£ ņĢģņä▒ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļŹö ļäōņ¢┤ņĀĖ ņ׳ļŖö Ļ▓āņØä ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ļŗż[39].
Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØ┤ ļ░£ņāØĒ¢łņØä ļĢī ņĄ£ņĀüņØś ņ╣śļŻīļŖö ņĢäņ¦ü ļ¬ģĒÖĢĒĢ£ ĻČīņן ņé¼ĒĢŁņØ┤ ņŚåņ¢┤ ļČłļČäļ¬ģĒĢśņ¦Ćļ¦ī ĒĢŁņØæĻ│Ā ņÜöļ▓ĢņØĆ ĒśłņĀäņØś ĒÖĢņן ļśÉļŖö ņ×¼ļ░£ ļ░®ņ¦Ć, ĒśłĻ┤Ć Ļ░£ĒåĄņä▒ņØś ĒÖĢļ”Į, Ļ░äļ¼Ėļ¦ź Ļ│ĀĒśłņĢĢ ļ░Å ņן ĒŚłĒśłĻ│╝ Ļ░ÖņØĆ ĒĢ®ļ│æņ”Ø ņśłļ░®ņØä ņ£äĒĢ£ ņĄ£ņäĀņØś ņ╣śļŻīņØĖ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż.
Ļ░äĻ▓Įļ│Ćņ”ØņŚÉņä£ ļÅÖļ░śļÉ£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņŚÉ ĒĢŁņØæĻ│ĀņĀ£ļź╝ ņé¼ņÜ®ĒĢśĻĖ░ ņĀä Ļ░äļ¼Ėļ¦ź Ļ│ĀĒśłņĢĢņ£╝ļĪ£ ņØĖĒĢ£ ņČ£Ēśł ņ£äĒŚśļÅä, Ļ░äĻ▓Įļ│Ćņ”ØņØś ņżæņ”ØļÅä, ĒÅÉņāēļÉ£ ĒśłĻ┤Ć ņ×¼Ļ┤ĆļźśņØś ņØ┤ņĀÉņØä ņŗĀņżæĒĢśĻ▓ī Ļ│ĀļĀżĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż. ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ļōżņŚÉņä£ ĒĢŁņØæĻ│ĀņĀ£ ņé¼ņÜ®ņØś ņĀüņĀłĒĢ£ ņŗ£ĻĖ░ļéś ņĀüņØæņ”ØņŚÉ ļīĆĒĢ┤ņä£ļŖö ĻĄ¼ņ▓┤ņĀüņ£╝ļĪ£ ņĀĢĒĢ┤ņ¦ä ĒĢ®ņØśļŖö ņŚåņ£╝ļéś ļ╣äĻĄÉņĀü ņĢłņĀäĒĢśļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż. ĒĢ£ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ņŚÉņä£ ĒĢŁņØæĻ│ĀņĀ£ļź╝ Ēł¼ņŚ¼ļ░øņØĆ ļ¼Ėļ¦źņĢĢĒĢŁņ¦äņ”Ø ĒÖśņ×ÉņŚÉņä£ļŖö ņ×¼ņČ£ĒśłļźĀ, ņ×ģņøÉ ĻĖ░Ļ░ä, 6ņŻ╝ ņé¼ļ¦ØļźĀ ļśÉļŖö TIPS ņéĮņ×ģĻ│╝ Ļ░ÖņØĆ ĻĄ¼ņĪ░ ņÜöļ▓ĢņØś ĒĢäņÜöņä▒ņØ┤ ņ”ØĻ░ĆĒĢśņ¦Ć ņĢŖņĢśļŗż[6]. ļśÉ ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ļŖö 52ļ¬ģņØś ĒĢŁņØæĻ│Ā ņ╣śļŻīļź╝ ļ░øļŖö ĒÖśņ×ÉņÖĆ 104ļ¬ģņØś ĒĢŁņØæĻ│Ā ņ╣śļŻīļź╝ ļ░øņ¦Ć ņĢŖļŖö ĒÖśņ×Éļź╝ ļ╣äĻĄÉĒĢśņśĆļŖöļŹ░ ļæÉ ĻĄ░ņŚÉņä£ ņČ£ĒśłņØś ļ░£ņāØļźĀņØĆ ĒĢŁņØæĻ│ĀņĀ£ ņŚ¼ļČĆņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ ļÅÖņØ╝Ē¢łĻ│Ā, ņØ┤ņÖĆ ņ£Āņé¼ĒĢ£ Ļ▓░Ļ│╝Ļ░Ć ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ļÅä ļéśĒāĆļé¼ļŗż[40,41].
Ļ░äļ¼Ėļ¦źņØś ņ×¼Ļ┤Ćļźśņ£©ņØĆ ĒĢŁņØæĻ│Ā ņ╣śļŻīļź╝ ļ░øņØĆ ĒÖśņ×ÉļōżņŚÉņä£ ļ░øņ¦Ć ņĢŖņØĆ ņé¼ļ×īļōżļ│┤ļŗż ļŹö ļåÆņĢśĻ│Ā(51.4% vs. 18.8%; p= 0.005) [34], ņ▓┤Ļ│äņĀü ļ¼ĖĒŚī Ļ│Āņ░░ņŚÉņä£ļÅä ņØ┤ņÖĆ ļ╣äņŖĘĒĢ£ Ļ▓░Ļ│╝Ļ░Ć ļ│┤Ļ│ĀļÉśņŚłļŗż(33-75%) [6,34,41]. ĒĢ£ ļŗżļ│Ćļ¤ē ļČäņäØņŚÉņä£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņØś ņ¦äļŗ© ļŗ╣ņŗ£ņØś model for end-stage liver disease (MELD) ņĀÉņłśĻ░Ć Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ ĒĢŁņØæĻ│Ā ņ╣śļŻīņØś ņ×¼Ļ┤Ćļźśņ£©ņØä ņ£ĀņØśĒĢśĻ▓ī ņśłņĖĪĒĢĀ ņłś ņ׳ņØīņØ┤ ļ│┤Ļ│ĀļÉ£ ļ░ö ņ׳ļŗż(hazard ratio, 1.105; 95% confidence interval, 1.012-1.207; p= 0.027) [6]. ņ×¼ĒśłņĀäņ”ØņØś ļ░£ņāØļźĀņØĆ ĒĢŁņØæĻ│ĀņĀ£ļź╝ ņżæļŗ©ĒĢ£ ĒÖśņ×ÉņŚÉņä£ 35.3%ņśĆĻ│Ā ņØ┤ļŖö ņØ┤ņĀäņØś ļŗżļźĖ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆļÅä ļ╣äņŖĘĒĢśņśĆļŗż[6,42,43]. ņØ┤ļ¤¼ĒĢ£ ņŚ░ĻĄ¼ļōżņØĆ ņ¦ĆņåŹņĀüņØĖ ĒśłņĀäņ”ØņØ┤ Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņØś ļ¼Ėļ¦źĻ│äņŚÉ ņĪ┤ņ×¼ĒĢśļŖö Ļ▓āņØä ņŗ£ņé¼ĒĢ£ļŗż. ļö░ļØ╝ņä£ ĻĖłĻĖ░ņé¼ĒĢŁņØ┤ ņŚåļŖö ĒĢ£ ĒĢŁņØæĻ│ĀņĀ£ļź╝ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ£Āņ¦ĆĒĢśļŖö Ļ▓āņØś ĻĘ╝Ļ▒░Ļ░Ć ļÉĀ ņłś ņ׳ļŗż[44].
ĒĢŁņØæĻ│ĀņĀ£ņØś ņŗ£ņ×æ ņŗ£ņĀÉņØĆ ņ×¼Ļ┤Ćļźśņ£©ņØś ņżæņÜöĒĢ£ ņØĖņ×ÉļĪ£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”Ø ņ¦äļŗ© ņØ┤Ēøä 6Ļ░£ņøö ņØ┤ļé┤ņŚÉ ĒĢŁņØæĻ│ĀņĀ£ļź╝ ņŗ£ņ×æĒĢśļŖö Ļ▓āņØĆ ļŹö ļåÆņØĆ ņ×¼Ļ┤Ćļźśņ£©Ļ│╝ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż[43,45,46]. ĻĘĖļ¤¼ļéś ĒĢŁņØæĻ│ĀņĀ£ņØś ņ£Āņ¦Ć ĻĖ░Ļ░äņØĆ ņé¼ņÜ®ĒĢśļŖö ĒĢŁņØæĻ│ĀņĀ£ņØś ņóģļźśņŚÉ ļö░ļØ╝ ļŗżņ¢æĒĢśļ®░ ņŚ░ĻĄ¼ļōżļ¦łļŗż ļööņ×ÉņØĖņØ┤ ļŗżļź┤ĻĖ░ ļĢīļ¼ĖņŚÉ ļ¬ģĒÖĢĒĢśĻ▓ī ĒĢ®ņØśļÉ£ Ļ░ĆņØ┤ļō£ļØ╝ņØĖņØĆ ņŚåļŗż.
Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØĆ ņØ┤ņŗØ ļīĆĻĖ░ņ×É ļ¬ģļŗ© ņé¼ļ¦ØļźĀņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śņ¦Ć ņĢŖņ¦Ćļ¦ī Ļ░ä ņØ┤ņŗØ ņłśņłĀ ņŗ£ņŚÉ ņłśĒśł ņÜöĻĄ¼ļ¤ē ņ”ØĻ░Ć, ĻĖ┤ ņłśņłĀ ņŗ£Ļ░ä, ņØ┤ņŗØ Ēøä ņé¼ļ¦ØļźĀ ņ”ØĻ░Ć, ņØ┤ņŗØ Ēøä ņżæņ×¼ņĀü ņ╣śļŻī ņ”ØĻ░ĆņÖĆ ņŚ░Ļ┤ĆļÉśņ¢┤ ņ׳ļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ Ļ░äĻ▓Įļ│Ćņ”ØĻ│╝ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØ┤ ļÅÖļ░śļÉ£ ĒÖśņ×ÉņŚÉņä£ Ļ░ä ņØ┤ņŗØ ļīĆĻĖ░ ņŗ£ ĒĢŁņØæĻ│ĀņĀ£ ņé¼ņÜ®ņØ┤ ņČöņ▓£ļÉ£ļŗż[47].
ņĢäņ¦üĻ╣īņ¦ĆļŖö ņĀ£ĒĢ£ļÉ£ ņ×äņāü ļŹ░ņØ┤Ēä░ļĪ£ ņØĖĒĢ┤ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņŚÉ ļīĆĒĢ£ ņØ┤ņāüņĀüņØĖ ĒĢŁņØæĻ│ĀņĀ£ ņé¼ņÜ®ņŚÉ ļīĆĒĢśņŚ¼ ĒĢ®ņØśĻ░Ć ļČĆņĪ▒ĒĢ£ ņāüĒÖ®ņØ┤ļŗż[48]. ĒĢŁņØæĻ│Ā ņÜöļ▓Ģņ£╝ļĪ£ ņō░ņØ┤ļŖö ņĢĮļ¼╝ļĪ£ļŖö ļ╣äĒāĆļ»╝K ĻĖĖĒĢŁņĀ£(ņÖĆĒīīļ”░), ļ»ĖļČäĒÜŹ ĒŚżĒīīļ”░(unfractionated heparin), ņĀĆļČäņ×Éļ¤ē ĒŚżĒīīļ”░, fondaparinux, direct oral anticoagulants (DOAC) ļō▒ ļŗżņ¢æĒĢ£ ņśĄņģśņØ┤ ņĪ┤ņ×¼ĒĢ£ļŗż. ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņŚÉņä£ ņÖĆĒīīļ”░Ļ│╝ ņĀĆļČäņ×Éļ¤ē ĒŚżĒīīļ”░ņØä ņØ┤ņÜ®ĒĢ£ Ļ▓ĮņÜ░ ļ╣äņŖĘĒĢ£ ņ╣śļŻī ņä▒ņĀüņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż[34]. ņØ╝ļ░śņĀüņ£╝ļĪ£ ņ×ģņøÉ ĒÖśņ×ÉļōżņŚÉĻ▓īļŖö Ļ┤æļ▓öņ£äĒĢ£ Ļ░ĆņÜ®ņä▒Ļ│╝ ņ¦¦ņØĆ ļ░śĻ░ÉĻĖ░ļź╝ Ļ░Ćņ¦Ćļ®░ Ļ░ĆņŚŁņä▒ņØä Ļ│ĀļĀżĒĢśņŚ¼ ņ▓┤ņżæ ĻĖ░ļ░ś ņĀĢļ¦ź ļé┤ ĒŚżĒīīļ”░ņØ┤ ņ▓śļ░®ļÉśļ®░ ņÖĖļל ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ ņÖĆĒīīļ”░ņØ┤ļéś ņĀĆļČäņ×Éļ¤ē ĒŚżĒīīļ”░, DOAC ņĀ£ņĀ£ ļō▒ņØś ļŗżņ¢æĒĢ£ ņśĄņģśņØä ņé¼ņÜ®ĒĢśĻ│ż ĒĢ£ļŗż[14].
Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØś ņ╣śļŻīņŚÉ ņ׳ņ¢┤ņä£ ļ»ĖļČäĒÜŹ ĒŚżĒīīļ”░ņØĆ ņŗĀĻĖ░ļŖźņØ┤ ļČłļ¤ēĒĢ£ ĒÖśņ×Éļéś ņן ĒŚłĒśłņØś Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŖö ĒÖśņ×ÉņŚÉņä£ ļ╣ĀļźĖ ĒĢŁņØæĻ│Ā ņŚŁĒĢĀņØä ņ£äĒĢ┤ ņ┤łĻĖ░ ņ╣śļŻīņĀ£ļĪ£ ņé¼ņÜ®ļÉĀ ņłś ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī ļ»ĖļČäĒÜŹ ĒŚżĒīīļ”░ņØĆ ņĀĢļ¦ź ļé┤ Ēł¼ņŚ¼ĒĢśļŖö ļ░®ņŗØņ£╝ļĪ£, ņןĻĖ░Ļ░ä ņ╣śļŻīĒĢśļŖö ļŹ░ņŚÉļŖö ņĀüĒĢ®ĒĢśņ¦Ć ņĢŖņĢä ņé¼ņÜ®ņØ┤ ņĀ£ĒĢ£ņĀüņØ┤ļŗż[49].
ņĀĆļČäņ×Éļ¤ē ĒŚżĒīīļ”░ņØĆ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØś ņ┤łĻĖ░ ņ╣śļŻīņĀ£ļĪ£ ļ¦ÄņØĆ Ļ▓ĮņÜ░ņŚÉ ņé¼ņÜ®ļÉśļéś, Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØś ņ╣śļŻīļŖö ņןĻĖ░ņĀüņ£╝ļĪ£ ĒĢśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦Äņ£╝ļ»ĆļĪ£ ĒÖśņ×ÉņØś ņł£ņØæļÅäņÖĆ Ļ┤ĆļĀ©ĒĢ┤ Ļ▓░ĻĄŁ ņÖĆĒīīļ”░Ļ│╝ DOAC ņĀ£ņĀ£ļź╝ ņé¼ņÜ®ĒĢśĻĖ░ ņĀä ļĖīļ”┐ņ¦Ć ņ╣śļŻī(bridge therapy)ņŚÉ ņé¼ņÜ®ļÉ£ļŗż. ņé¼ņÜ®ļÉśļŖö ļ░®ļ▓ĢņØĆ ĻĖ░Ļ┤Ćļ¦łļŗż ņāüņØ┤ĒĢĀ ņłś ņ׳ņ¦Ćļ¦ī ņÖĆĒīīļ”░Ļ│╝ ļÅÖņŗ£ņŚÉ Ēł¼ņĢĮņØä ņŗ£ņ×æĒĢśņŚ¼ INRņØ┤ ņ╣śļŻī ļ▓öņ£äņØĖ 2-3ņŚÉ ļÅäļŗ¼ĒĢśļ®┤ ņĀĆļČäņ×Éļ¤ē ĒŚżĒīīļ”░ņØä ņżæļŗ©ĒĢśĻ│ż ĒĢ£ļŗż[50]. ĻĘĖļ¤¼ļéś ņØ╝ļČĆ ĒÖśņ×Éļōż(ņ×¼ļ░£ņä▒ ļ│ĄļČĆļĪ£ ņØĖĒĢ┤ ņ¦ĆņåŹņĀüņØĖ ļ│Ąņłś ņ▓£ņ×Éļź╝ ĒĢäņÜöĒĢśļŖö ĒÖśņ×É, INRņØ┤ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ļåÆņØĆ ĒÖśņ×É ļō▒)ņŚÉņä£ļŖö ņĀĆļČäņ×Éļ¤ē ĒŚżĒīīļ”░ņØ┤ ņÖĆĒīīļ”░ļ│┤ļŗż ļŹö ņĀüĒĢ®ĒĢĀ ņłś ņ׳ļŗż. ņÜ®ļ¤ēĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņŚ░ĻĄ¼ņŚÉņä£ enoxaparinņØä 1 mg/kg ņé¼ņÜ®ĒĢ£ ĻĘĖļŻ╣ņØ┤ 1.5 mg/kg ņé¼ņÜ®ĒĢ£ ĻĘĖļŻ╣ļ│┤ļŗż ļ╣äņŖĘĒĢ£ ĒÜ©Ļ│╝ļź╝ ļ│┤ņØ┤ļ®┤ņä£ ĒĢ®ļ│æņ”ØņØĆ ņĀüņŚłļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ļŗż[51]. ņĀĆļČäņ×Éļ¤ē ĒŚżĒīīļ”░ņØä Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØś ņ╣śļŻīņŚÉ ņé¼ņÜ®ĒĢ£ ĻĖ░ņĪ┤ņØś ļ¬ćļ¬ć ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒÅēĻĘĀ 6Ļ░£ņøöņØś ĻĖ░Ļ░ä ļÅÖņĢł ņé¼ņÜ® Ēøä ņ×¼Ļ┤Ćļźś ņŚ¼ļČĆļź╝ ĒÅēĻ░ĆĒĢśņśĆļŗż[43,51].
ņÖĆĒīīļ”░ņØĆ ņĀĆļČäņ×Éļ¤ē ĒŚżĒīīļ”░Ļ│╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī ļ╣äņŖĘĒĢ£ ņ×¼Ļ┤Ćļźśņ£© ņä▒ņĀüĻ│╝ ļ╣äņŖĘĒĢ£ ļČĆņ×æņÜ® ļ╣äņ£©ņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż[52,53]. ĒĢśņ¦Ćļ¦ī ņóüņØĆ ņ╣śļŻī ļ▓öņ£äļĪ£ ņØĖĒĢśņŚ¼ ņŻ╝ĻĖ░ņĀüņ£╝ļĪ£ ļ¬©ļŗłĒä░ļ¦üņØä ĒĢ┤ņĢ╝ ĒĢĀ ĒĢäņÜöņä▒Ļ│╝ Ļ░äĻ▓Įļ│Ćņ”ØņŚÉņä£ ĻĖ░ļ│ĖņĀüņ£╝ļĪ£ ņāüņŖ╣ļÉśņ¢┤ ņ׳ļŖö ĻĖ░ņĀĆ INR ņłśņ╣śļĪ£ ņØĖĒĢ┤ Ļ│╝ņåī Ēł¼ņŚ¼ļÉĀ Ļ░ĆļŖźņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØś ņ╣śļŻīņĀ£ļĪ£ ņÖĆĒīīļ”░ņØä ņØ┤ņÜ®ĒĢ£ ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒÅēĻĘĀ 3Ļ░£ņøöļČĆĒä░ 2ļģäĻ╣īņ¦Ć ņé¼ņÜ® Ēøä ņ×¼Ļ┤Ćļźś ņŚ¼ļČĆļź╝ ĒÅēĻ░ĆĒĢśņśĆļŗż[54-56].
ņĄ£ĻĘ╝ direct thrombin inhibitor (dabigatran) ļ░Å factor Xa inhibitor (rivaroxaban, apixaban, and edoxaban)ļź╝ ĒżĒĢ©ĒĢ£ DOACĻ░Ć Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”Ø ņ╣śļŻīņŚÉ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż. DOACļŖö ņÖĆĒīīļ”░Ļ│╝ ļ╣äĻĄÉĒĢśņŚ¼ Ļ│ĀņĀĢļÉ£ ņÜ®ļ¤ēņ£╝ļĪ£ ņé¼ņÜ®ņØ┤ Ļ░ĆļŖźĒĢśļ®░ ĻĄ¼Ļ░Ģ Ēł¼ņŚ¼Ļ░Ć Ļ░ĆļŖźĒĢśĻ│Ā ļŗżļźĖ ņĢĮļ¼╝Ļ│╝ņØś ņāüĒśĖņ×æņÜ®ņØ┤ Ļ▒░ņØś ņŚåļŗżļŖö ņןņĀÉņØ┤ ņ׳ļŗż. ņĄ£ĻĘ╝ ļ│┤Ļ│ĀļÉ£ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ Child-Pugh Aļŗ©Ļ│äņØś ĒÖśņ×ÉņŚÉņä£ DOAC ņé¼ņÜ®ņŚÉ ļīĆĒĢ£ ņĢłņĀäņä▒ ļ¼ĖņĀ£ļŖö ņŚåņŚłņ¦Ćļ¦ī Child-Pugh Cļŗ©Ļ│äņØś ĒÖśņ×ÉņŚÉņä£ļŖö DOAC ņé¼ņÜ®ņØ┤ ĻČīņ£ĀļÉśņ¦Ć ņĢŖņĢśļŗż[57]. ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ rivaroxabanņØ┤ ņÖĆĒīīļ”░ļ│┤ļŗż ņ×¼Ļ┤Ćļźśņ£©, Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØś ņ×¼ļ░£ ņĖĪļ®┤ņŚÉņä£ ļŹö ĒÜ©Ļ│╝ņĀüņØ┤ņŚłļŗżļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņŚ¼ņżĆ ļ░ö ņ׳Ļ│Ā, edoxaban, dabigatranņØä ņØ┤ņÜ®ĒĢ£ ņĀäĒ¢źņĀü ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņØ┤ņÖĆ ņ£Āņé¼ĒĢ£ Ļ▓░Ļ│╝Ļ░Ć ļéśĒāĆļé¼ļŗż[55,58,59]. ņĢłņĀäņä▒ ņĖĪļ®┤ņŚÉņä£ļŖö ņĄ£ĻĘ╝ņØś ĒĢ£ ļ®öĒāĆļČäņäØņŚÉņä£ Ļ░äĻ▓Įļ│Ćņ”ØņŚÉ ļÅÖļ░śļÉ£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”Ø ĒÖśņ×ÉņŚÉņä£ DOACĻ░Ć ņÖĆĒīīļ”░ņŚÉ ļ╣äĒĢ┤ ņČ£Ēśł ĒĢ®ļ│æņ”Ø ņĖĪļ®┤ņŚÉņä£ ņ£Āņé¼ĒĢśĻ▒░ļéś ļŹö ļéśņØĆ ņĢłņĀäņä▒ņØä ļ│┤ņŚ¼ņżĆļŗżĻ│Ā ĒĢśņśĆļŗż[60]. ĒĢśņ¦Ćļ¦ī ņĢäņ¦üĻ╣īņ¦ĆļŖö ĻĖ░ņĪ┤ņØś ĒŚżĒīīļ”░ņØ┤ļéś ņÖĆĒīīļ”░ ņĀ£ņĀ£ņŚÉ ļ╣äĒĢ┤ ĻĘ╝Ļ▒░ ņłśņżĆņØ┤ ļ╣łņĢĮĒĢśĻ│Ā, ļ╣äņÜ® ļČĆļČäņŚÉ ņ׳ņ¢┤ ĒÖśņ×É ļČĆļŗ┤ņØ┤ ņ׳ņ¢┤ ņé¼ņÜ®ņŚÉ ņØ╝ļČĆ ņĀ£ĒĢ£ņØ┤ ņ׳ļŖö ņāüĒā£ļŗż. DOAC ņĀ£ņĀ£ ņżæņŚÉņä£ rivaroxabanņØä 10 mg ĒĢśļŻ© ļæÉ ļ▓ł ņé¼ņÜ®ĒĢśņśĆļŹś ņĀäĒ¢źņĀü ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņĄ£ļīĆ 6Ļ░£ņøöĻ╣īņ¦Ć ņé¼ņÜ® Ēøä ņ×¼Ļ░£ĒåĄ ņŚ¼ļČĆļź╝ ĒÅēĻ░ĆĒĢ£ ļ░ö ņ׳ļŗż[55].
ņČ£ĒśłņØĆ ĒĢŁņØæĻ│ĀņĀ£ ņé¼ņÜ®ņØś Ļ░Ćņן ĒØöĒĢ£ ļČĆņ×æņÜ®ņ£╝ļĪ£ ņĀĢļ¦źļźś ņČ£ĒśłņØ┤ļéś ļ╣äņĀĢļ¦źļźś ņČ£Ēśł ļō▒ ļŗżņ¢æĒĢ£ ņ¢æņāüņØś ņČ£ĒśłņØ┤ ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ¦Ćļ¦ī, ĻĖ░ņĪ┤ ņŚ░ĻĄ¼ļōżņŚÉņä£ ņČ£ĒśłņØś ņĀĢņØśĻ░Ć ņŚ░ĻĄ¼ļ¦łļŗż ņāüņØ┤ĒĢśĻ│Ā ņØśļ»ĖĻ░Ć ĒÖĢļ”ĮļÉśņ¢┤ ņ׳ņ¦Ć ņĢŖņĢä ņĀĢĒÖĢĒĢ£ ļ╣äĻĄÉļŖö ņ¢┤ļĀĄļŗż.
ņĄ£ĻĘ╝ņØś ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ĒĢŁņØæĻ│Ā ņ╣śļŻīļź╝ ļ░øļŖö Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉļōżņØä ĒĢŁņØæĻ│Ā ņ╣śļŻīļź╝ ļ░øņ¦Ć ņĢŖļŖö Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉļōżņØä ļ╣äĻĄÉĒĢśņśĆņØä ļĢī, ĒĢŁņØæĻ│Ā ņ╣śļŻīļź╝ ļ░øņ¦Ć ņĢŖļŖö ĒÖśņ×ÉļōżņŚÉņä£ ņČ£ĒśłņØś ņĀĢļÅäļéś ņé¼ļ¦ØļźĀņØ┤ ņ”ØĻ░ĆĒĢśņ¦Ć ņĢŖņĢśļŗż[40]. ļö░ļØ╝ņä£ ĒÖśņ×ÉņØś ĻĖ░ņĀĆ ņ¦łĒÖśņØ┤ļéś ĒśłņĢĪĒĢÖņĀü Ļ▓Ćņé¼ ņåīĻ▓¼ņØä ņ░ĖĻ│ĀĒĢśņŚ¼ ņØ┤ņĀÉ ļ░Å ņ£äĒŚśņä▒ņØä ĒÅēĻ░ĆĒĢśĻ│Ā ĒĢŁņØæĻ│ĀņĀ£ļź╝ ņé¼ņÜ®ĒĢśļŖö Ļ▓āņØä Ļ│ĀļĀżĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż.
ĻĖēņä▒ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņŚÉņä£ ĒĢŁņØæĻ│ĀņĀ£ ņÖĖņŚÉ ņżæņ×¼ņĀü ņŗ£ņłĀļÅä ĒĢśļéśņØś ņ╣śļŻī ļ░®ļ▓ĢņØ┤ļŗż. ņĢäņ¦üĻ╣īņ¦Ć ņĀĢĒÖĢĒĢ£ ņĀüņØæņ”ØņØĆ ĒĢ®ņØśļÉ£ ļ░öĻ░Ć ņŚåņ¦Ćļ¦ī, ņØ┤ļ¤¼ĒĢ£ ņżæņ×¼ņĀü ņŗ£ņłĀņŚÉļŖö ĻĖ░Ļ│äņĀü ĒśłņĀä ņĀ£Ļ▒░ņłĀ ļ░Å ņ╣┤ĒģīĒä░ ņ£ĀļÅä ĒśłņĀä ņÜ®ĒĢ┤ņłĀ, ņŗØļÅä ļ░Å ņ£äņĀĢļ¦źļźś ņ╣śļŻīļź╝ ņ£äĒĢ£ TIPS ļ░░ņ╣ś ļō▒ņØ┤ ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ņ╣śļŻīļōżņØĆ ņä£ļĪ£ ļ│æņÜ®ļÉśņ¢┤ ņé¼ņÜ®ļÉśĻĖ░ļÅä ĒĢśļ®░ ņŗ£ņłĀ Ēøä ĒĢŁņØæĻ│ĀņĀ£ ņé¼ņÜ®ņØä ļ│æĒ¢ēĒĢ£ļŗż.
ĻĖ░Ļ│äņĀü ĒśłņĀä ņĀ£Ļ▒░ņłĀņØś ņĀĢĒÖĢĒĢ£ ņĀüņØæņ”ØņØ┤ ņ׳ņ¦ĆļŖö ņĢŖņ¦Ćļ¦ī, ĻĖ░Ļ│äņĀü ĒśłņĀä ņĀ£Ļ▒░ņłĀņØĆ ĒĢŁņØæĻ│ĀņĀ£ ņé¼ņÜ®ņØ┤ ĻĖłĻĖ░ļÉ£ Ļ▓ĮņÜ░ļéś ņןĻ░äļ¦ē ĒŚłĒśłņØ┤ ļÅÖļ░śļÉ£ Ļ▓ĮņÜ░ Ēś╣ņØĆ ņĀüņĀłĒĢ£ ĒĢŁņØæĻ│ĀņĀ£ ņé¼ņÜ®ņŚÉļÅä ĒśłņĀäņ”ØņØ┤ ņ¦äĒ¢ēļÉĀ Ļ▓ĮņÜ░ņŚÉ ņŗ£ļÅäļź╝ Ļ│ĀļĀżĒĢ┤ ļ│╝ ņłś ņ׳ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ĻĖ░Ļ│äņĀü ĒśłņĀä ņĀ£Ļ▒░ņłĀņØĆ ņ╣┤ĒģīĒä░ ņ£ĀļÅä ĒśłņĀä ņÜ®ĒĢ┤ņĀ£ņÖĆ ĒĢ©Ļ╗ś ņŗ£Ē¢ēļÉśļŖöļŹ░, ņØ┤ļŖö ņØ┤ļĪĀņĀüņ£╝ļĪ£ ĒśłņĀäņØś ņ¢æņØä ņżäņŚ¼ ĒśłņĀä ņÜ®ĒĢ┤ņĀ£ ņÜöĻĄ¼ļ¤ēņØ┤ Ļ░ÉņåīļÉśĻ│Ā ņØ┤ļĪ£ ņØĖĒĢ┤ ņČ£Ēśł ņ£äĒŚśņØ┤ Ļ░ÉņåīĒĢśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ĒØöĒ׳ ņØ┤ņÜ®ļÉśļŖö ĻĖ░Ļ│äņĀü ĒśłņĀä ņĀ£Ļ▒░ņłĀņŚÉļŖö ņ£Āņ▓┤ņŚŁĒĢÖņĀü ĒśłņĀä ņĀ£Ļ▒░ņłĀ(ĒØĪņØĖņØä ĒåĄĒĢ£ ĒśłņĀä ņÜ®ĒĢ┤)Ļ│╝ ĒÆŹņäĀ ĒśłņĀä ņĀ£Ļ▒░ņłĀ, ĒØĪņØĖ ņןņ╣śļź╝ ĒåĄĒĢ£ ĒśłņĀä ņĀ£Ļ▒░ņłĀņØ┤ ņ׳ļŗż. ĒśłņĀä ņĀ£Ļ▒░ņłĀņØä ņ£äĒĢ┤ ļ¼Ėļ¦ź ņĀĢļ¦źĻ│äļĪ£ ņĀæĻĘ╝ĒĢśĻĖ░ ņ£äĒĢ£ ļ░®ļ▓Ģņ£╝ļĪ£ļŖö Ļ▓ĮĻ▓ĮņĀĢļ¦ź Ļ▓ĮļĪ£, Ļ▓ĮĻ░äņĀü Ļ▓ĮļĪ£ Ēś╣ņØĆ Ļ▓ĮĒö╝ņĀü Ļ▓ĮļĪ£ ĻĘĖļ”¼Ļ│Ā Ļ▓Įļ╣äņĀü Ļ▓ĮļĪ£ļĪ£ ņĀæĻĘ╝ĒĢśļŖö ļ░®ļ▓ĢņØ┤ ņ׳ļŗż[61,62].
ņØ╝ļ░śņĀüņ£╝ļĪ£ ĻĖ░Ļ│äņĀü ĒśłņĀä ņĀ£Ļ▒░ņłĀņŚÉ ņé¼ņÜ®ļÉśļŖö ĒśłņĀä ņĀ£Ļ▒░ ņןņ╣ś ņżæ ĒĢśļéśļŖö AngioJet (Boston Scientific, Marlborough, MA, USA)ņ£╝ļĪ£, ņØ┤ļŖö ĒśłņĀäņØä ņŚ░ĒÖöņŗ£ĒéżĻ│Ā ņ£ĀļÅÖņä▒ ĒÜ©Ļ│╝ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņĀ£Ļ▒░ĒĢśļŖö ņĢĮļ”¼ĒĢÖņĀü ĒśłņĀä ņĀ£Ļ▒░ ņןņ╣śņØ┤ļŗż. ļ¼Ėļ¦źņØś Ēü¼ĻĖ░ļź╝ Ļ│ĀļĀżĒĢĀ ļĢī 8 FrĻ░Ć ņĀ£ņØ╝ ļ¦ÄņØ┤ ņō░ņØĖļŗż. ĒśłņĀä ņĪ░Ļ░üņØĆ ņ╣┤ĒģīĒä░ ļé┤Ļ░ĢņØä ĒåĄĒĢ┤ Ļ│ĀņåŹļÅäļĪ£ ĒØĪņ×ģļÉśņ¢┤ ļ░░ņČ£ļÉ£ļŗż[63,64]. ņØ┤ļ¤░ ĒśłņĀä ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒĢśĻĖ░ ņĀäņŚÉ tPAļź╝ ņé¼ņÜ®ĒĢśĻ▒░ļéś AngioJetņØä power pulse modeņŚÉņä£ ņé¼ņÜ®ĒĢśņŚ¼ ĒśłņĀä ļé┤ ĒśłņĀä ņÜ®ĒĢ┤ņĀ£ļź╝ ļČäņé¼ĒĢĀ ņłś ņ׳ļŗż. ņØ┤ļ¤¼ĒĢ£ ĻĖ░Ļ│äņĀü ĒśłņĀä ņĀ£Ļ▒░ļŖö ĒøäņåŹ ĒśłņĀä ņÜ®ĒĢ┤ņŚÉ ĒĢäņÜöĒĢ£ ņÜ®ĒĢ┤ņĀ£ņØś ņÜ®ļ¤ēĻ│╝ ņŻ╝ņ×ģ ņŗ£Ļ░äņØä ņżäņŚ¼ ņČ£Ēśł ņ£äĒŚśņØä ņżäņŚ¼ ĒÖśņ×ÉņØś ĒÜīļ│ĄņŚÉ ļÅäņøĆņØä ņżĆļŗż[64,65].
ĒØĪņØĖ ĒśłņĀä ņĀłņĀ£ņłĀņØĆ ļīĆņÜ®ļ¤ēņØś Ļ│ĀņĢĢ ņŻ╝ņé¼ĻĖ░ņÖĆ ĻĄ¼ļ®ŹņØ┤ Ēü░ ņ╣┤ĒģīĒä░ļź╝ ņé¼ņÜ®ĒĢśļŗżĻ░Ć ņ¦äĻ│Ą ļ│┤ņĪ░ ņŗ£ņŖżĒģ£ņ£╝ļĪ£ ļ░£ņĀäĒĢśņśĆļŗż. Indigo ĒØĪņØĖ ĒśłņĀä ņĀłņĀ£ņłĀ ņŗ£ņŖżĒģ£(Penumbra, Alameda, CA, USA)ņØĆ ņŗĀĻ▓ĮĒśłĻ┤Ć ļ░Å ļ¦Éņ┤ł ņØæņÜ® ļČäņĢ╝ņŚÉņä£ ņ×ÉņŻ╝ ņé¼ņÜ®ļÉśļŖö ņŚ░ņåŹ ĒØĪņ×ģ ņןņ╣śļĪ£ 8 FrĻ░Ć ļ¼Ėļ¦ź ņĀĢļ¦źĻ│äņŚÉņä£ Ļ░Ćņן ņØ╝ļ░śņĀüņ£╝ļĪ£ ņé¼ņÜ®ļÉ£ļŗż. ņØ┤ ņןņ╣śļź╝ ņé¼ņÜ®ĒĢśļ®┤ ņ╣┤ĒģīĒä░ ĒīüņØ┤ ĒśłņĀäĻ│╝ ļ¦×ļ¼╝ļ”¼ņ¦Ć ņĢŖņ£╝ļ®┤ņä£ ļŗ©ĻĖ░Ļ░äņŚÉ ņāüļŗ╣ĒĢ£ ņ¢æņØś ĒśłņĢĪ ņåÉņŗżņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ņ¦Ćļ¦ī ņ×ÉļÅÖ ļ░ĖļĖī ņĀ£ņ¢┤ļź╝ ņé¼ņÜ®ĒĢśļ®┤ ĒśłņĀä ĒØĪņØĖņØ┤ ņĄ£ņĀüĒÖöļÉśĻ│Ā ĒśłņĢĪ ņåÉņŗż ņ£äĒŚśņØ┤ ņżäņ¢┤ļōĀļŗż. ņØ┤ļ¤░ ņ╣┤ĒģīĒä░ ņŗ£ņŖżĒģ£ņŚÉļŖö Ēü░ ņĀæĻĘ╝ ļŹ«Ļ░£Ļ░Ć ĒĢäņÜöĒĢśļ®░ ļ¼Ėļ¦ź ņĀĢļ¦źĻ│äņŚÉ ļīĆĒĢ£ ņĀæĻĘ╝ņ£╝ļĪ£ TIPSļź╝ ņé¼ņÜ®ĒĢĀ ņłś ņŚåļŖö Ļ▓ĮņÜ░ļŖö ņé¼ņÜ®ĒĢĀ ņłś ņŚåļŗż[66].
ņ╣┤ĒģīĒä░ ņ£ĀļÅä ĒśłņĀä ņÜ®ĒĢ┤ņłĀņØĆ ĻĖ░Ļ│äņĀü ĒśłņĀä ņĀ£Ļ▒░ņłĀĻ│╝ ļ│æĒ¢ēĒĢśņŚ¼ ņŗ£Ē¢ēļÉśļ®░ ĒśłņĀä ņÜ®ĒĢ┤ ņĢĮļ¼╝ņØä ĒśłņĀäņØ┤ ņ׳ļŖö ĒśłĻ┤ĆņŚÉ ņ¦üņĀæ ņŻ╝ņ×ģĒĢśņŚ¼ ņŗ£Ē¢ēĒĢ£ļŗż. Ļ░äļ¼Ėļ¦źņŚÉļŖö Ļ▓ĮĻ▓ĮņĀĢļ¦ź Ļ▓ĮļĪ£ļéś Ļ▓ĮĒö╝ņĀü Ļ▓ĮļĪ£ ĻĘĖļ”¼Ļ│Ā Ļ▓ĮĻ░ä Ļ▓ĮļĪ£ļź╝ ĒåĄĒĢ┤ ņĀæĻĘ╝ĒĢśņŚ¼ ĒśłņĀäņØ┤ ņ׳ļŖö Ļ││ņŚÉ ņŻ╝ņ×ģ ņ╣┤ĒģīĒä░ļź╝ ļ░░ņ╣śĒĢ£ļŗż. ņØ┤Ēøä ĒśłņĀäņØ┤ ņ׳ļŖö ĒśłĻ┤ĆņŚÉ ĒŖ╣ņĀĢ ņåŹļÅäļĪ£ ņä¼ņ£Āņåī ņÜ®ĒĢ┤ņĀ£(alteplase)ļź╝ ļČäņé¼ĒĢśļŖöļŹ░, ņŻ╝ņ×ģ ņåŹļÅäņÖĆ ņŻ╝ņ×ģ ņŗ£Ļ░äņØĆ ĒśłņĀäļ¤ēņŚÉ ļö░ļØ╝ ļŗżļź┤ņ¦Ćļ¦ī, ņØ╝ļ░śņĀüņ£╝ļĪ£ ņĄ£ļīĆ 24ņŗ£Ļ░ä ļÅÖņĢł 1 mg/hrņØś ņåŹļÅäļĪ£ ņŻ╝ņ×ģļÉ£ļŗż. ĻĘĖ ļÅÖņĢł ĒÖśņ×ÉļŖö ņżæĒÖśņ×ÉņŗżņŚÉņä£ ņČ£Ēśł ņ¦ĢĒøäĻ░Ć ņ׳ļŖöņ¦Ć ļ¬©ļŗłĒä░ļ¦üĒĢśļ®░ ņä¼ņ£Āņåī ņÜ®ĒĢ┤ņĀ£ļź╝ ņŻ╝ņ×ģĒĢ£ļŗż. ņØ┤ļĢī Ēśłņ▓Ł fibrinogen level, coagulation factor, hemoglobin ņłśņ╣śņŚÉ ļīĆĒĢ£ ĒśłņĢĪĒĢÖņĀü ļ¬©ļŗłĒä░ļ¦üļÅä ļ│æĒ¢ēĒĢ£ļŗż. ĻĖ░Ļ│äņĀü ĒśłņĀä ņĀłņĀ£ņłĀĻ│╝ ĒśłņĀä ņÜ®ĒĢ┤ņłĀ ņŗ£Ē¢ē ņØ┤Ēøä ĒÖśņ×ÉļŖö ĒĢŁņØæĻ│ĀņĀ£ļź╝ ņé¼ņÜ®ĒĢ┤ņĢ╝ ĒĢśļ®░, ĒśłņĀäņ”ØņØś ņ×¼ļ░£ ņŚ¼ļČĆļź╝ ĒÅēĻ░ĆĒĢśĻĖ░ ņ£äĒĢ┤ ņŻ╝ĻĖ░ņĀüņ£╝ļĪ£ ņśüņāü Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢ┤ņĢ╝ ĒĢ£ļŗż[67].
TIPS ļ░░ņ╣śļŖö ņŻ╝ļĪ£ ĻĖ░Ļ│äņĀü ĒśłņĀä ņĀ£Ļ▒░ņłĀņØ┤ļéś ĒÖöĒĢÖņĀü ĒśłņĀä ņÜ®ĒĢ┤ņłĀ ņØ┤ĒøäņŚÉ ņŗ£Ē¢ēļÉ£ļŗż. ĒśłņĀä ņĀ£Ļ▒░ņłĀĻ│╝ ņÜ®ĒĢ┤ņłĀņØ┤ ĻĖēņä▒ĻĖ░ ĒśłņĀäņØĆ ņÜ®ĒĢ┤ĒĢśņ¦Ćļ¦ī ĻČüĻĘ╣ņĀüņ£╝ļĪ£ Ļ░ä ļé┤ ĒśłĻ┤ĆņĀĆĒĢŁņØä ņ”ØĻ░Ćņŗ£ĒéżĻ│Ā ĻĘ╝ļ│ĖņĀüņØĖ ļ¼ĖņĀ£ņØĖ ņŻ╝ ļ¼Ėļ¦źņØś ļŖÉļĀżņ¦ä ĒśłļźśļŖö ĒĢ┤Ļ▓░ĒĢśņ¦Ć ļ¬╗ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ TIPSļź╝ ļ░░ņ╣śĒĢśņŚ¼ ņŻ╝ ļ¼Ėļ¦źņØś ņĢĢļĀźņØä Ļ░Éņåīņŗ£ĒéżĻ│Ā ņĀĢņ▓┤ņŚåņØ┤ ĒśłņĢĪņØ┤ ĒØÉļź┤Ļ▓ī ĒĢ£ļŗż[68]. ĻĖ░Ļ│äņĀü ĒśłņĀä ņĀ£Ļ▒░ņłĀņØ┤ļéś ĒÆŹņäĀ ņĀĢļ¦ź ņä▒ĒśĢņłĀņØĆ TIPS ļ░░ņ╣ś ņĀäņŚÉ ņŗ£Ē¢ēĒĢśļÅäļĪØ ĻČīņ£ĀļÉ£ļŗż. TIPS ļ░░ņ╣ś ĒøäņŚÉļŖö Ļ░äļ¼Ėļ¦źņ£╝ļĪ£ ņĀüņĀłĒĢ£ ņ£ĀņåŹņØ┤ ņ£Āņ¦ĆļÉśļŖöņ¦Ć ĒÖĢņØĖĒĢśĻ│Ā, ļ╣äņן-ļ¼Ėļ¦ź ņĀĢļ¦ź ņĪ░ņśüņłĀņØä ņŗ£Ē¢ēĒĢśņŚ¼ ņĀĢļ¦źļźś ņ£Āļ¼┤ļź╝ ĒÅēĻ░ĆĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż. ļ¦īņĢĮņŚÉ TIPS ļ░░ņ╣śļź╝ ĒĢśņŚ¼ ņĀüņĀłĒĢ£ ļ¼Ėļ¦ź-ņĀäņŗĀ ņĢĢļĀźņØ┤ ĒśĢņä▒ļÉ£ ņØ┤ĒøäņŚÉļÅä ņĀĢļ¦źļźśĻ░Ć ņ׳ņ£╝ļ®┤ ņāēņĀäņłĀņØä ņŗ£Ē¢ēĒĢśļŖö Ļ▓āļÅä Ļ│ĀļĀżĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż.
ņĄ£ĻĘ╝ Ļ░ĆņØ┤ļō£ļØ╝ņØĖņŚÉ ļö░ļź┤ļ®┤ Ļ░äĻ▓Įļ│Ćņ”ØĻ│╝ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØ┤ ļÅÖļ░śļÉśņ¢┤ ņ׳ļŖö ĒÖśņ×ÉņŚÉņä£ ļŗżņØīĻ│╝ Ļ░ÖņØĆ Ļ▓ĮņÜ░ņŚÉ TIPS ļ░░ņ╣śļź╝ ĒĢśļŖö Ļ▓āņØä Ļ│ĀļĀżĒĢśļÅäļĪØ ņČöņ▓£ĒĢśĻ│Ā ņ׳ļŗż[57]: (1) ĒĢŁņØæĻ│ĀņĀ£ņØś ĒÜ©Ļ│╝Ļ░Ć ņŚåĻ▒░ļéś ĒĢŁņØæĻ│ĀņĀ£ ņé¼ņÜ®ņØ┤ ĻĖłĻĖ░ņŗ£ļÉ£ Ļ▓ĮņÜ░, (2) ļé┤Ļ│╝ņĀü ņ╣śļŻīņŚÉ ļ░śņØæĒĢśņ¦Ć ņĢŖļŖö ļ¼Ėļ¦ź Ļ│ĀĒśłņĢĢĻ│╝ Ļ┤ĆļĀ©ļÉ£ ĒĢ®ļ│æņ”ØņØä ļÅÖļ░śĒĢ£ ļ¦īņä▒ Ļ░äļ¼Ėļ¦ź ĒśłņĀä/ĒĢ┤ļ®┤ņāü ļ│ĆĒśĢ, (3) ņØ┤ņŗØļÉ£ Ļ░äņĀĢļ¦ź ņé¼ņØ┤ņŚÉ ņāØļ”¼ņĀü ļ¼ĖĒĢ®ļČĆņØś ĒØÉļ”äņØä ļ░®ĒĢ┤ĒĢśļŖö ļ¦īņä▒ Ļ░äļ¼Ėļ¦ź ĒśłņĀä.
TIPS ļ░░ņ╣śņÖĆ ĒĢŁņØæĻ│ĀņĀ£ņØś ĒÜ©ņÜ®ņä▒ņŚÉ ļīĆĒĢ£ ļ®öĒāĆļČäņäØņØä ļ│┤ļ®┤ 179ļ¬ģņØś ĒĢŁņØæĻ│ĀņĀ£ ņé¼ņÜ® ĒÖśņ×ÉĻĄ░Ļ│╝ 148ļ¬ģņØś TIPS ļ░░ņ╣ś ĒÖśņ×ÉĻĄ░ ļ¬©ļæÉ ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢ┤ņä£ ļåÆņØĆ ņ×¼Ļ┤Ćļźśņ£©ņØä ļ│┤ņŚ¼ņŻ╝ņŚłļŗż[69]. ĻĘĖļ¤¼ļéś TIPS ļ░░ņ╣śĻĄ░ņŚÉņä£ ĒĢŁņØæĻ│ĀņĀ£ ņé¼ņÜ®ĻĄ░ļ│┤ļŗż ņé¼ļ¦ØļźĀ Ļ░£ņäĀņØś ĒÜ©Ļ│╝ļŖö ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. ņØ┤Ļ▓āņ£╝ļĪ£ ļ│┤ņĢśņØä ļĢī, Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØ┤ ņ׳ļŖö ĒÖśņ×ÉņŚÉņä£ ņĀĢļ¦źļźś ņśłļ░®ņØä ņ£äĒĢ┤ņä£ 1ņ░©ņĀüņ£╝ļĪ£ ĒĢŁņØæĻ│ĀņĀ£ļź╝ Ēł¼ņŚ¼ļ░øļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢśļ®░, ņØ┤ļ¤░ ĒĢŁņØæĻ│ĀņĀ£ ņ╣śļŻīņŚÉ ĒÜ©Ļ│╝Ļ░Ć ņŚåĻ▒░ļéś ĻĖłĻĖ░ņé¼ĒĢŁņØĖ Ļ▓ĮņÜ░ 2ņ░© ņ╣śļŻīļĪ£ TIPSļź╝ Ļ│ĀļĀżĒĢ┤ ļ│╝ ņłś ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż[38,70].
Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņŚÉņä£ TIPS ļ░░ņ╣śņØś ņĢłņĀäņä▒Ļ│╝ ĒÜ©ņÜ®ņä▒ņØä ĒÅēĻ░ĆĒĢśļŖö ļīĆĻĘ£ļ¬© ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ņŚÉņä£ TIPS ļ░░ņ╣śņØś 100% ĻĖ░ņłĀņĀü ņä▒Ļ│ĄļźĀņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. TIPSļź╝ ņŗ£Ē¢ēĒĢ£ ĒÖśņ×É 70ļ¬ģ ņżæ 40ļ¬ģ(57%)ņŚÉņä£ ļ¼Ėļ¦źņØś ņÖäņĀä Ļ░£ĒåĄņØ┤ ņØ┤ļŻ©ņ¢┤ņĪīĻ│Ā ļČĆļČä Ļ░£ĒåĄņØ┤ 21ļ¬ģ(30%)ņŚÉņä£ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░ Ļ░£ņäĀļÉśņ¦Ć ņĢŖņØĆ ĒÖśņ×ÉļŖö 9ļ¬ģ(13%)ņØ┤ņŚłļŗż. ĒÅēĻĘĀ 20.7Ļ░£ņøöņØś ņČöņĀü Ļ┤Ćņ░░ ĻĖ░Ļ░ä ļÅÖņĢł 38ļ¬ģ(95%)ņŚÉņä£ ļ¼Ėļ¦ź Ļ░£ĒåĄņØ┤ ņ£Āņ¦ĆļÉśņŚłņ£╝ļ®░, 6Ļ░£ņøö ļÅÖņĢł 2ļ¬ģ(5%)Ļ│╝ 26Ļ░£ņøö ļÅÖņĢł 1ļ¬ģņŚÉĻ▓īņä£ ņ×¼ĒśłņĀäņ”ØņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż. 38ļ¬ģņØś ĒÖśņ×É ņżæ 17ļ¬ģ(45%)ņŚÉņä£ ņäĀņ▓£ņä▒ ĒśłņĀäņØĖņ×ÉņØś ļåÆņØĆ ļ░£ņāØļźĀņŚÉ ļö░ļźĖ Ļ│╝ņØæĻ│Ā ņāüĒā£ņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ļåÆņØĆ Ļ░£ĒåĄļźĀĻ│╝ Ļ░£ĒåĄņä▒ņØ┤ ņ£Āņ¦ĆļÉśņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļź╝ ĒåĄĒĢ┤ ļåÆņØĆ Ļ░ä ļé┤ ļ¼Ėļ¦źņĢĢņØä ņÜ░ĒÜīĒĢśņŚ¼ ĒØÉļ”äņØä Ļ░£ņäĀĒĢ©ņ£╝ļĪ£ņŹ© ļ¼Ėļ¦ź Ļ░£ĒåĄņä▒ņØä ņ£Āņ¦ĆĒĢśĻĖ░ ņ£äĒĢ£ TIPS ļ░░ņ╣śņØś ĒÜ©ņÜ®ņä▒ņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż[68].
ĻĘĖļ¤¼ļéś ņĢäņ¦ü TIPS ļ░░ņ╣śļź╝ ņ×äņāüņĀü ņ”ØņāüņØ┤ ņŚåļŖö Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņŚÉņä£ ņŗ£Ē¢ēĒĢ┤ņĢ╝ ĒĢśļŖöņ¦ĆņŚÉ ļīĆĒĢ£ ļīĆļŗĄņØĆ ĒÖĢņŗżņ╣ś ņĢŖņØĆ ņāüĒÖ®ņØ┤ļŗż. ņŚ¼ļ¤¼ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ņŚÉņä£ TIPSņØś ņĢłņĀĢņä▒Ļ│╝ ĒÜ©ņÜ®ņä▒ņØ┤ ņ”Øļ¬ģļÉ£ ļ░ö ņ׳ņ¦Ćļ¦ī, ļīĆņĪ░ĻĄ░ņØś ļČĆņ×¼ļĪ£ ņØĖĒĢ┤ ņĀĢĒÖĢĒĢ£ ļ╣äĻĄÉļŖö ņŗ£Ē¢ēļÉśņ¦Ć ņĢŖņĢśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż.
TIPSņØś ļČĆņ×æņÜ®ņ£╝ļĪ£ Ļ░äņä▒ļćīņ”ØņØś ņ£äĒŚśņØ┤ ņ”ØĻ░ĆĒĢ£ļŗżĻ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż. ĻĘĖļ¤¼ļéś Ļ░äĻ▓Įļ│Ćņ”ØņŚÉņä£ ļÅÖļ░śļÉ£ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”Ø ĒÖśņ×ÉņŚÉņä£ ņĀĢļ¦źļźś ņČ£ĒśłņØś ņśłļ░®ņØä ņ£äĒĢ£ TIPS ļ░░ņ╣śņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ĻĖ░ņĪ┤ņØś ņ╣śļŻīņŚÉ ļ╣äĒĢ┤ TIPS ļ░░ņ╣śĻ░Ć ņé¼ļ¦ØļźĀņŚÉ ņ׳ņ¢┤ ņ£ĀņØśĒĢ£ Ļ░£ņäĀņØä ļ│┤ņØ┤ņ¦ä ļ¬╗Ē¢łņ¦Ćļ¦ī Ļ░äņä▒ļćīņ”ØņØś ņ£äĒŚśņä▒ņØä ņ”ØĻ░Ćņŗ£Ēéżņ¦Ć ņĢŖņĢśļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ņŚłļŗż[71,72].
ļ¦īņĢĮ ĻĖēņä▒ĻĖ░ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØä ņ╣śļŻīĒĢśņ¦Ć ņĢŖĻ│Ā ļ░®ņ╣śĒĢśļ®┤ ļ¦ī ņä▒ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØ┤ ļÉĀ ņłś ņ׳ņ£╝ļ®░, ļŹö ņ¦äĒ¢ēļÉśļ®┤ ĒĢ┤ļ®┤ņāü ļ│ĆĒśĢņŚÉ ņØ┤ļź┤Ļ▓ī ļÉ£ļŗż. ĒśłņĀä ļČĆņ£ä ņØ┤ņĀäņØś ļ¼Ėļ¦źĒśłļźśļź╝ Ļ░äņ£╝ļĪ£ ņÜ┤ļ░śĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ļ¼Ėļ¦ź ņŻ╝ļ│ĆņØś ņĖĪļČĆ ĒśłĻ┤ĆļōżņØś ņ¦üĻ▓ĮņØ┤ ĒÖĢņןļÉśĻ│Ā ĒÅÉņāēļÉ£ ļ¼Ėļ¦ź ņŻ╝ļ│Ćņ£╝ļĪ£ ņÜ░ĒÜīĒĢśņŚ¼ ņŻ╝Ē¢ēĒĢśĻ▓ī ļÉśļŖöļŹ░, ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒśĢ ļÉ£ ĻĄ¼ņĪ░ ņĀäņ▓┤ļź╝ ĒĢ┤ļ®┤ņāü ļ│ĆĒśĢņØ┤ļØ╝Ļ│Ā ĒĢ£ļŗż. ņØ┤ Ļ▓ĮņÜ░ ņ×äņāüņĀüņ£╝ļĪ£ ņŗØļÅäļéś ņ£äņĀĢļ¦źļźśņØś ļīĆļ¤ē ņČ£ĒśłņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ņ£╝ļ®░ ļČłņØæņä▒ ļ│Ąņłśļéś ĒØēņłś ļśÉĒĢ£ ņāØĻĖĖ ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņĀüņĀłĒĢ£ ņÜ░ĒÜī ņł£ĒÖśņØ┤ ņ׳ļŖö ĒÖśņ×ÉļōżņØś Ļ▓ĮņÜ░ ļ¼┤ņ”Øņāüņ£╝ļĪ£ ļéśĒāĆļéĀ ņłś ņ׳ļŗż.
ņØ┤ļ¤░ ļ¦īņä▒ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”Ø ĒÖśņ×ÉļōżņŚÉĻ▓ī ņŻ╝ļĪ£ Ļ▓Įļ╣äņĀü Ļ▓ĮļĪ£ļéś Ļ▓ĮĻ░äņĀü Ļ▓ĮļĪ£ļź╝ ĒåĄĒĢ£ Ļ░äļ¼Ėļ¦źņØś ņ×¼Ļ┤ĆļźśņÖĆ TIPS ļ░░ņ╣śĻ░Ć ņØ┤ņÜ®ļÉśĻ│ż ĒĢ£ļŗż. Ļ░ä ņØ┤ņŗØ ĒøäņŚÉ ļ¦īņä▒ņĀüņ£╝ļĪ£ Ļ░äļ¼Ėļ¦źņØ┤ ļ¦ēĒ×ī ĒÖśņ×ÉņŚÉĻ▓īļŖö ņ×¼Ļ┤Ćļźśļź╝ ņ£äĒĢ┤ TIPS ļ░░ņ╣śļź╝ ĒĢĀ Ļ▓ĮņÜ░ ļ¼Ėļ¦źĻ│ä ĒśłĻ┤Ć ņł£ĒÖśņØä ļ│ĄĻĄ¼ĒĢśļŖö Ļ▓āĻ│╝ Ļ░ä-ņĀäņŗĀ ļ¼ĖĒĢ®ļČĆ ĻĖ░ļŖźņØä ņĀĢņāüņ▓śļ¤╝ ņ£Āņ¦ĆĒĢśĻ▓ī ĒĢśļŖö ļŹ░ņŚÉ ļÅäņøĆņØä ņżä ņłś ņ׳ļŗż[38].
Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņØś Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”ØņØĆ ņĄ£ĻĘ╝ ļōżņ¢┤ ņĀÉņĀÉ ļŹö ļ¦ÄņØ┤ ņØĖņŗØļÉśĻ│Ā ņ׳ņ£╝ļéś ņłśļ¦ÄņØĆ ļ│ĆņłśĻ░Ć ņ׳ņ¢┤ ņ╣śļŻī ļ░®ļ▓ĢņØ┤ ļ│Ąņ×ĪĒĢ£ ĒÄĖņØ┤ļŗż. ĻĘĖņżæ ĒĢŁņØæĻ│Ā ņÜöļ▓ĢņØĆ ĻĖēņä▒ Ļ░äļ¼Ėļ¦ź ĒśłņĀäņ”Ø ĒÖśņ×ÉņŚÉņä£ ņĀĢļ¦źļźś ņČ£ĒśłņØ┤ļéś ņןĻ░äļ¦ē ĒŚłĒśłņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ 1ņ░© ņ╣śļŻīļĪ£ ņō░ņØ╝ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. ņé¼ņÜ® Ļ░ĆļŖźĒĢ£ ņĄ£ņåī ņ╣©ņŖĄ ņ╣śļŻīļ▓ĢņŚÉļŖö ĻĖ░Ļ│äņĀü ĒśłņĀä ņĀ£Ļ▒░ņłĀ, ĒÖöĒĢÖņĀü ĒśłņĀä ņÜ®ĒĢ┤ņłĀ ļ░Å TIPS ļ░░ņ╣ś ļō▒ņØś ļ░®ļ▓ĢņØ┤ ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņĢäņ¦ü ļ¼┤ņ×æņ£ä ļīĆņĪ░ ņŚ░ĻĄ¼ ņłśņżĆņØś ĻĘ╝Ļ▒░Ļ░Ć ļČĆņĪ▒ĒĢśĻ│Ā, ņŚ░ĻĄ¼ ļŹ░ņØ┤Ēä░ļōżņØś ņāüņØ┤ĒĢ©ņ£╝ļĪ£ ņØĖĒĢ┤ ĒĢ®ņØśļÉ£ Ļ░ĆņØ┤ļō£ ļØ╝ņØĖņØä ļ¦īļōż ņłś ņŚåĻĖ░ ļĢīļ¼ĖņŚÉ ĒĢŁņØæĻ│ĀņĀ£ņÖĆ ņżæņ×¼ņĀü ņ╣śļŻīļ▓ĢņØś ņé¼ņÜ®ļ▓ĢĻ│╝ ĒāĆņØ┤ļ░ŹņØä ĒÅēĻ░ĆĒĢśĻĖ░ ņ£äĒĢ┤ņä£ ļŗżĻĖ░Ļ┤Ć ļ¼┤ņ×æņ£ä ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢ£ ņŗżņĀĢņØ┤ļŗż.
REFERENCES
1. Faccia M, Ainora ME, Ponziani FR, et al. Portal vein thrombosis in cirrhosis: why a well-known complication is still matter of debate. World J Gastroenterol 2019;25:4437ŌĆō4451.



2. Zocco MA, Di Stasio E, De Cristofaro R, et al. Thrombotic risk factors in patients with liver cirrhosis: correlation with MELD scoring system and portal vein thrombosis development. J Hepatol 2009;51:682ŌĆō689.


3. Stine JG, Shah NL, Argo CK, Pelletier SJ, Caldwell SH, Northup PG. Increased risk of portal vein thrombosis in patients with cirrhosis due to nonalcoholic steatohepatitis. Liver Transpl 2015;21:1016ŌĆō1021.



4. Francoz C, Valla D, Durand F. Portal vein thrombosis, cirrhosis, and liver transplantation. J Hepatol 2012;57:203ŌĆō212.


5. Rodr├Łguez-Castro KI, Porte RJ, Nadal E, Germani G, Burra P, Senzolo M. Management of nonneoplastic portal vein thrombosis in the setting of liver transplantation: a systematic review. Transplantation 2012;94:1145ŌĆō1153.

6. Noronha Ferreira C, Reis D, Cortez-Pinto H, et al. Anticoagulation in cirrhosis and portal vein thrombosis is safe and improves prognosis in advanced cirrhosis. Dig Dis Sci 2019;64:2671ŌĆō2683.


8. Qi X, Han G, Fan D. Management of portal vein thrombosis in liver cirrhosis. Nat Rev Gastroenterol Hepatol 2014;11:435ŌĆō446.


9. Sarin SK, Sollano JD, Chawla YK, et al. Consensus on extra-hepatic portal vein obstruction. Liver Int 2006;26:512ŌĆō519.


10. Valla DC, Condat B, Lebrec D. Spectrum of portal vein thrombosis in the West. J Gastroenterol Hepatol 2002;17 Suppl 3:S224ŌĆōS227.


11. Gertsch P, Matthews J, Lerut J, Luder P, Blumgart LH. Acute thrombosis of the splanchnic veins. Arch Surg 1993;128:341ŌĆō345.


12. Valeriani E, Riva N, Di Nisio M, Ageno W. Splanchnic vein thrombosis: current perspectives. Vasc Health Risk Manag 2019;15:449ŌĆō461.


13. Thatipelli MR, McBane RD, Hodge DO, Wysokinski WE. Survival and recurrence in patients with splanchnic vein thromboses. Clin Gastroenterol Hepatol 2010;8:200ŌĆō205.


14. Alzubaidi S, Patel I, Saini A, et al. Current concepts in portal vein thrombosis: etiology, clinical presentation and management. Abdom Radiol (NY) 2019;44:3453ŌĆō3462.


15. Chandra R, Kapoor D, Tharakan A, Chaudhary A, Sarin SK. Portal biliopathy. J Gastroenterol Hepatol 2001;16:1086ŌĆō1092.


16. Northup PG, Garcia-Pagan JC, Garcia-Tsao G, et al. Vascular liver disorders, portal vein thrombosis, and procedural bleeding in patients with liver disease: 2020 practice guidance by the American Association for the Study of Liver Diseases. Hepatology 2021;73:366ŌĆō413.


17. Stieber AC, Zetti G, Todo S, et al. The spectrum of portal vein thrombosis in liver transplantation. Ann Surg 1991;213:199ŌĆō206.



18. Nonami T, Yokoyama I, Iwatsuki S, Starzl TE. The incidence of portal vein thrombosis at liver transplantation. Hepatology 1992;16:1195ŌĆō1198.


19. Gayowski TJ, Marino IR, Doyle HR, et al. A high incidence of native portal vein thrombosis in veterans undergoing liver transplantation. J Surg Res 1996;60:333ŌĆō338.



20. Yerdel MA, Gunson B, Mirza D, et al. Portal vein thrombosis in adults undergoing liver transplantation: risk factors, screening, management, and outcome. Transplantation 2000;69:1873ŌĆō1881.


21. Jamieson NV. Changing perspectives in portal vein thrombosis and liver transplantation. Transplantation 2000;69:1772ŌĆō1774.


22. Charco R, Fuster J, Fondevila C, Ferrer J, Mans E, Garc├Ła-Valdecasas JC. Portal vein thrombosis in liver transplantation. Transplant Proc 2005;37:3904ŌĆō3905.


23. Bauer J, Johnson S, Durham J, et al. The role of TIPS for portal vein patency in liver transplant patients with portal vein thrombosis. Liver Transpl 2006;12:1544ŌĆō1551.


24. Ma J, Yan Z, Luo J, Liu Q, Wang J, Qiu S. Rational classification of portal vein thrombosis and its clinical significance. PLoS One 2014;9:e112501.



25. Sarin SK, Philips CA, Kamath PS, et al. Toward a comprehensive new classification of portal vein thrombosis in patients with cirrhosis. Gastroenterology. 2016. 151:574ŌĆō577.e3.


26. Bhangui P, Lim C, Levesque E, et al. Novel classification of non-malignant portal vein thrombosis: a guide to surgical decision-making during liver transplantation. J Hepatol 2019;71:1038ŌĆō1050.


27. Kumar DR, Hanlin E, Glurich I, Mazza JJ, Yale SH. Virchow's contribution to the understanding of thrombosis and cellular biology. Clin Med Res 2010;8:168ŌĆō172.



29. Mikuła T, Kozłowska J, Stańczak W, Sapuła M, Różyk A, Wiercińska-Drapało A. Serum ADAMTS-13 levels as an indicator of portal vein thrombosis. Gastroenterol Res Pract 2018;2018:3287491.


30. Violi F, Ferro D, Basili S, et al. Ongoing prothrombotic state in the portal circulation of cirrhotic patients. Thromb Haemost 1997;77:44ŌĆō47.


31. Wosiewicz P, ┼╗orniak M, Hartleb M, et al. Portal vein thrombosis in cirrhosis is not associated with intestinal barrier disruption or increased platelet aggregability. Clin Res Hepatol Gastroenterol 2016;40:722ŌĆō729.


32. DeLeve LD, Valla DC, Garcia-Tsao G; American Association for the Study Liver Diseases. Vascular disorders of the liver. Hepatology 2009;49:1729ŌĆō1764.



33. Anton A, Campreci├│s G, P├®rez-Campuzano V, Orts L, Garc├Ła-Pag├Īn JC, Hern├Īndez-Gea V. The pathophysiology of portal vein thrombosis in cirrhosis: getting deeper into Virchow's triad. J Clin Med 2022;11:800.



34. Loffredo L, Pastori D, Farcomeni A, Violi F. Effects of anticoagulants in patients with cirrhosis and portal vein thrombosis: a systematic review and meta-analysis. Gastroenterology 2017;153:480ŌĆō487.e1.


35. Nery F, Chevret S, Condat B, et al. Causes and consequences of portal vein thrombosis in 1,243 patients with cirrhosis: results of a longitudinal study. Hepatology 2015;61:660ŌĆō667.


36. Zhang D, Hao J, Yang N. Protein C and D-dimer are related to portal vein thrombosis in patients with liver cirrhosis. J Gastroenterol Hepatol 2010;25:116ŌĆō121.


37. Cheng XQ, Zuo CJ, Tian JM, et al. Portal vein aneurysms with multiple associated findings. Vasa 2010;39:312ŌĆō318.


38. Thornburg B, Desai K, Hickey R, et al. Pretransplantation portal vein recanalization and transjugular intrahepatic portosystemic shunt creation for chronic portal vein thrombosis: final analysis of a 61-patient cohort. J Vasc Interv Radiol 2017;28:1714ŌĆō1721.e2.


39. Tublin ME, Dodd GD 3rd, Baron RL. Benign and malignant portal vein thrombosis: differentiation by CT characteristics. AJR Am J Roentgenol 1997;168:719ŌĆō723.


40. Cerini F, Gonzalez JM, Torres F, et al. Impact of anticoagulation on upper-gastrointestinal bleeding in cirrhosis. A retrospective multicenter study. Hepatology 2015;62:575ŌĆō583.


41. Qi X, De Stefano V, Li H, Dai J, Guo X, Fan D. Anticoagulation for the treatment of portal vein thrombosis in liver cirrhosis: a systematic review and meta-analysis of observational studies. Eur J Intern Med 2015;26:23ŌĆō29.


42. Pettinari I, Vukotic R, Stefanescu H, et al. Clinical impact and safety of anticoagulants for portal vein thrombosis in cirrhosis. Am J Gastroenterol 2019;114:258ŌĆō266.


43. Delgado MG, Seijo S, Yepes I, et al. Efficacy and safety of anticoagulation on patients with cirrhosis and portal vein thrombosis. Clin Gastroenterol Hepatol 2012;10:776ŌĆō783.


44. Amitrano L, Guardascione MA, Menchise A, et al. Safety and efficacy of anticoagulation therapy with low molecular weight heparin for portal vein thrombosis in patients with liver cirrhosis. J Clin Gastroenterol 2010;44:448ŌĆō451.


45. Senzolo M, Sartori TM, Rossetto V, et al. Prospective evaluation of anticoagulation and transjugular intrahepatic portosystemic shunt for the management of portal vein thrombosis in cirrhosis. Liver Int 2012;32:919ŌĆō927.


46. Rodriguez-Castro KI, Vitale A, Fadin M, et al. A prediction model for successful anticoagulation in cirrhotic portal vein thrombosis. Eur J Gastroenterol Hepatol 2019;31:34ŌĆō42.


47. Francoz C, Belghiti J, Vilgrain V, et al. Splanchnic vein thrombosis in candidates for liver transplantation: usefulness of screening and anticoagulation. Gut 2005;54:691ŌĆō697.



48. Turon F, Hern├Īndez-Gea V, Garc├Ła-Pag├Īn JC. Portal vein thrombosis: yes or no on anticoagulation therapy. Curr Opin Organ Transplant 2018;23:250ŌĆō256.

49. Simonetto DA, Singal AK, Garcia-Tsao G, Caldwell SH, Ahn J, Kamath PS. ACG clinical guideline: disorders of the hepatic and mesenteric circulation. Am J Gastroenterol 2020;115:18ŌĆō40.


50. Odriozola A, Puente Á, Cuadrado A, et al. Portal vein thrombosis in the setting of cirrhosis: a comprehensive review. J Clin Med 2022;11:6435.



51. Cui SB, Shu RH, Yan SP, et al. Efficacy and safety of anticoagulation therapy with different doses of enoxaparin for portal vein thrombosis in cirrhotic patients with hepatitis B. Eur J Gastroenterol Hepatol 2015;27:914ŌĆō919.


52. Chung JW, Kim GH, Lee JH, et al. Safety, efficacy, and response predictors of anticoagulation for the treatment of nonmalignant portal-vein thrombosis in patients with cirrhosis: a propensity score matching analysis. Clin Mol Hepatol 2014;20:384ŌĆō391.



53. Chen H, Liu L, Qi X, et al. Efficacy and safety of anticoagulation in more advanced portal vein thrombosis in patients with liver cirrhosis. Eur J Gastroenterol Hepatol 2016;28:82ŌĆō89.


54. Cai M, Zhu K, Huang W, et al. Portal vein thrombosis after partial splenic embolization in liver cirrhosis: efficacy of anticoagulation and long-term follow-up. J Vasc Interv Radiol 2013;24:1808ŌĆō1816.


55. Hanafy AS, Abd-Elsalam S, Dawoud MM. Randomized controlled trial of rivaroxaban versus warfarin in the management of acute non-neoplastic portal vein thrombosis. Vascul Pharmacol 2019;113:86ŌĆō91.

56. La Mura V, Braham S, Tosetti G, et al. Harmful and beneficial effects of anticoagulants in patients with cirrhosis and portal vein thrombosis. Clin Gastroenterol Hepatol 2018;16:1146ŌĆō1152.e4.


57. de Franchis R, Bosch J, Garcia-Tsao G, Reiberger T, Ripoll C; Baveno VII Faculty. Baveno VII - Renewing consensus in portal hypertension. J Hepatol 2022;76:959ŌĆō974.

58. Nagaoki Y, Aikata H, Daijyo K, et al. Efficacy and safety of edoxaban for treatment of portal vein thrombosis following danaparoid sodium in patients with liver cirrhosis. Hepatol Res 2018;48:51ŌĆō58.


59. Ai MH, Dong WG, Tan XP, et al. Efficacy and safety study of direct-acting oral anticoagulants for the treatment of chronic portal vein thrombosis in patients with liver cirrhosis. Eur J Gastroenterol Hepatol 2020;32:1395ŌĆō1400.


60. Nisly SA, Mihm AE, Gillette C, Davis KA, Tillett J. Safety of direct oral anticoagulants in patients with mild to moderate cirrhosis: a systematic review and meta-analysis. J Thromb Thrombolysis 2021;52:817ŌĆō827.


61. Chamarthy MR, Anderson ME, Pillai AK, Kalva SP. Thrombolysis and transjugular intrahepatic portosystemic shunt creation for acute and subacute portal vein thrombosis. Tech Vasc Interv Radiol 2016;19:42ŌĆō51.


62. Kwon J, Koh Y, Yu SJ, Yoon JH. Low-molecular-weight heparin treatment for portal vein thrombosis in liver cirrhosis: efficacy and the risk of hemorrhagic complications. Thromb Res 2018;163:71ŌĆō76.


63. Uflacker R. Applications of percutaneous mechanical thrombectomy in transjugular intrahepatic portosystemic shunt and portal vein thrombosis. Tech Vasc Interv Radiol 2003;6:59ŌĆō69.


64. Lichtenberg MKW, Stahlhoff S, M┼éy┼äczak K, et al. Endovascular mechanical thrombectomy versus thrombolysis in patients with iliofemoral deep vein thrombosis - a systematic review and meta-analysis. Vasa 2021;50:59ŌĆō67.


65. Cai G, Li C, Hua Z, et al. AngioJet aspiration thrombectomy combined with transcatheter thrombolysis in treatment of acute portal venous systemic thrombosis. Ann Vasc Surg 2020;66:362ŌĆō369.


66. Seedial SM, Mouli SK, Desai KR. Acute portal vein thrombosis: current trends in medical and endovascular management. Semin Intervent Radiol 2018;35:198ŌĆō202.



67. Abdel-Aal AK, Ezzeldin IB, Hamed MF, et al. Endovascular treatment of acute portal vein thrombosis using ultrasound-accelerated catheter-directed thrombolysis. Vasc Endovascular Surg 2014;48:460ŌĆō465.


68. Luca A, Miraglia R, Caruso S, et al. Short- and long-term effects of the transjugular intrahepatic portosystemic shunt on portal vein thrombosis in patients with cirrhosis. Gut 2011;60:846ŌĆō852.


69. Davis JPE, Ogurick AG, Rothermel CE, Sohn MW, Intagliata NM, Northup PG. Anticoagulation and transjugular intrahepatic portosystemic shunting for treatment of portal vein thrombosis in cirrhosis: a systematic review and meta-analysis. Clin Appl Thromb Hemost 2019;25:1076029619888026.



70. Stine JG, Wang J, Shah PM, et al. Decreased portal vein velocity is predictive of the development of portal vein thrombosis: a matched case-control study. Liver Int 2018;38:94ŌĆō101.


The Virchow triad considers three factors that presumably contribute to PVT: hypercoagulability, hemodynamic changes in stasis and turbulence, and endothelial injury/dysfunction. PVT, portal vein thrombosis.
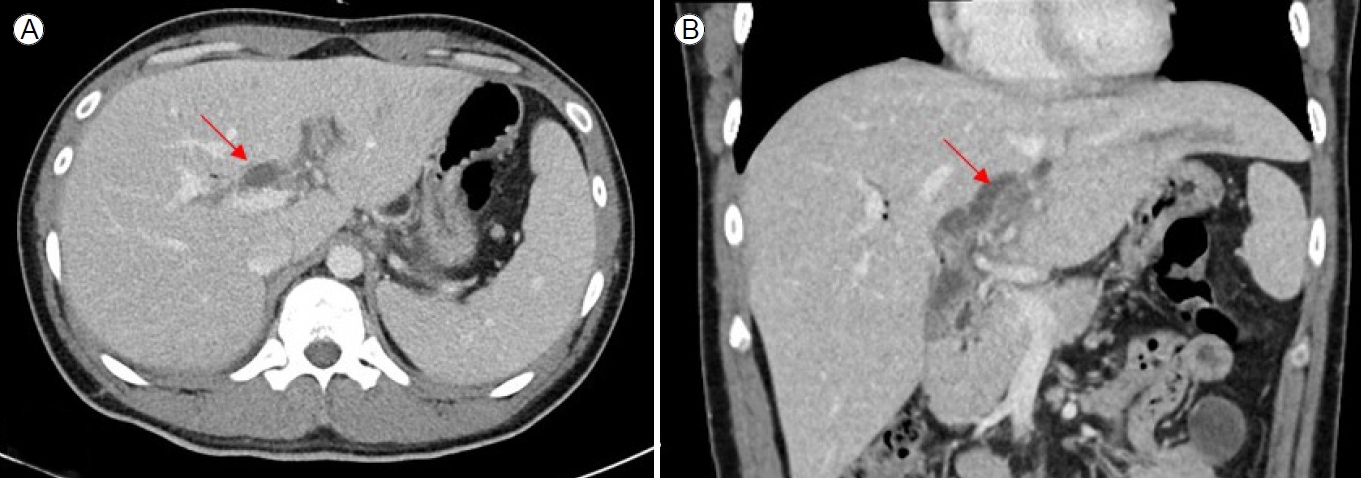
Figure┬Ā1.
Transverse (A) and coronal (B) images of an asymptomatic 52-year-old man with an incidentally diagnosed portal vein thrombosis (PVT) visible on computed tomography performed during routine healthcare screening (arrow).
Figure┬Ā2.
Table┬Ā1.
Various forms of non-malignant PVT in patients with cirrhosis
| Study | Grade 1 | Grade 2 | Grade 3 | Grade 4 | Surgical decisiveness of classification |
|---|---|---|---|---|---|
| Stieber et al. (1991) [17] | Partial of complete | Extended to SMV | Extended to SV | As grade 3 Complete | No |
| Nonami et al. (1992) [18] | Intrahepatic PVT | Rt/Lt portal branches | Partial PVT trunk | Complete PVT trunk | No |
| Gayowski et al. (1996) [19] | Partial PVT | Complete PVT confined to portal trunk | Complete PVT extending to the confluence | Complete PVT extending below confluence | No |
| Yerdel et al. (2000) [20] | PVT < 50% occlusion | PVT > 50% | Complete thrombosis of PVT and distal SMV | Complete thrombosis of PVT and distal and proximal SMV | Yes |
| Jamieson (2000) [21] | Confined to PV trunk | Extending to distal SMV | Diffuse thrombosis of splanchnic venous system with collateral | Diffuse thrombosis of splanchnic venous system without collateral | Yes |
| Charco et al. (2005) [22] | Limited PV trunk | Extending to distal SMV with patent spleno-mesenteric confluence | Diffuse thrombosis of splanchnic venous system with collateral | Diffuse thrombosis of splanchnic venous system without collateral | Yes |
| Bauer et al. (2006) [23] | Thrombosis < 25% | Thrombosis 26-50% | Thrombosis 51-75% | Thrombosis > 76% | No |
| Ma et al. (2014) [24] | Partial PVT without cavernoma | Partial PVT with cavernoma | Complete PVT without cavernoma | Complete PVT with cavernoma | No |
| Sarin et al. (2016) [25] | Trunk | Branches | Trunk and branches | - | No |
| Bhangui et al. (2019) [26] | Non-complex type (Yerdel grade 1-3) | Complex type (Yerdel grade 4 or Jamieson and Charco grade 3-4) | Yes | ||
Table┬Ā2.
Risk factor for portal vein thrombosis according to cirrhosis status



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




