서 론
Klebsiella pneumoniae는 과거에 원내 감염을 주로 일으키는 병원체로 알려져 왔으나 1980년대 중반부터 타이완에서 독성이 높은 hypermucoviscous phenotype을 가진 K. pneumoniae에 의한 지역사회 획득 감염을 보고하기 시작하였다[1]. 최근에는 hypermucoviscous K. pneumoniae (hmKP)에 대해서 다른 부위로의 전이성 감염을 일으키는 임상적인 특징까지 고려하여 hypervirulent K. pneumoniae (hvKP)라고 부르고 있다[2].
이후 타이완뿐만 아니라 싱가포르, 홍콩 등 다른 아시아 지역에서도 hvKP에 의한 감염이 증가되고 있다고 알려져 있다.
hvKP감염은 대부분 원발성 간농양을 일으키며 전이성 병변으로 안내염, 폐농양, 뇌수막염 등의 간 외 합병증을 수반하므로 간농양 없이 타 장기에 감염을 일으키는 경우는 매우 드물다. 특히 hvKP에 의한 원발성 간농양 없이 괴사근막염으로 발병한 경우는 우리나라에서는 보고가 없고 외국에서만 보고된 바가 있다[3].
이에 저자들은 hvKP에 의해 발생한 괴사근막염과 요근 농양이 합병된 1예를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
증 례
62세 여자 환자가 내원 2일 전에 넘어진 후에 발생한 왼쪽 무릎의 통증과 의식 변화를 주소로 내원하였다. 기저 질환은 고혈압, 당뇨와 만성 신부전이 있었고 당뇨는 경구 혈당 강하제로 조절하였으나 당 조절이 잘 되지 않고 있었다.
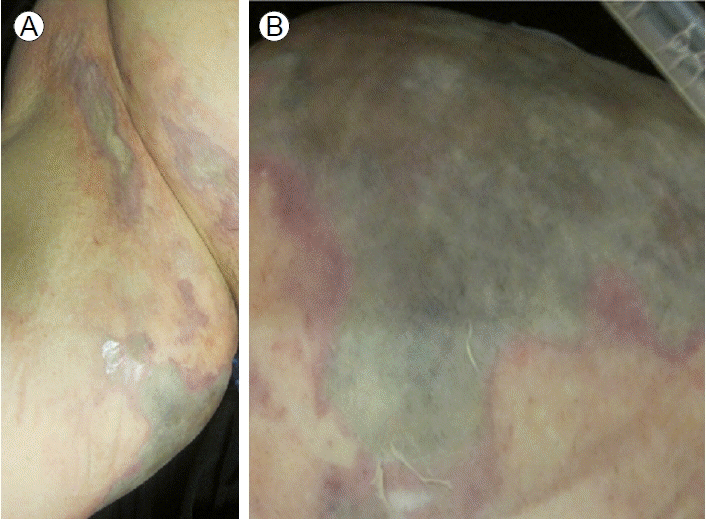
내원 당시의 활력 징후는 혈압 115/78 mmHg, 맥박 118/분, 호흡수 24/분, 체온 37.8℃였고 급성 병색 소견을 보였으며 의식은 혼미하였다. 왼쪽 다리의 무릎 이하 부위 연부 조직에 발적, 종창과 열감이 있었고 오른쪽 다리의 하복부, 대퇴부와 서혜부에 붉고 보라색을 띄는 피부의 변색이 관찰되었다(Fig. 1).
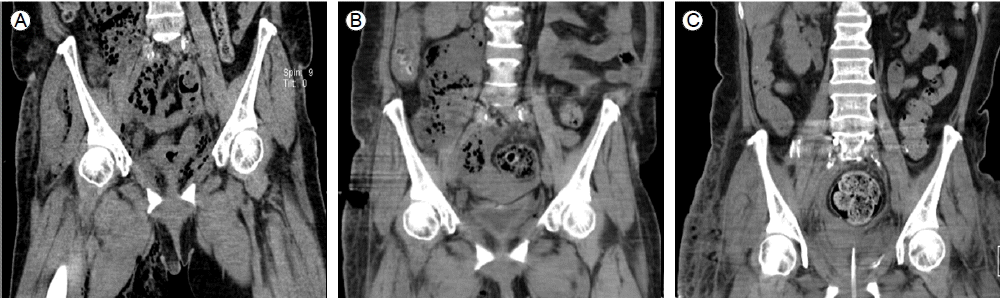
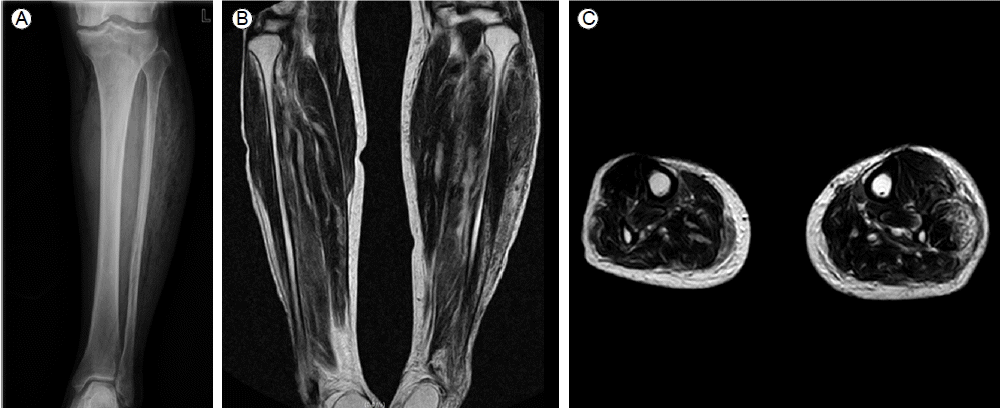
내원 당시 시행한 말초혈액검사에서 백혈구 2,440/mm3(호중구 83.3%), 혈색소 11.3 g/dL, 혈소판 102,000/mm3였으며, 혈청 생화학적 검사에서 혈당 265 mg/dL, asparate aminotr ansferase 33 IU/L, alanine aminotransferase 27 IU/L, 총 빌리루빈 0.3 mg/dL, 혈중요소질소 58.6 mg/dL, 크레아티닌 2.5 mg/dL 이었다. 적혈구 침강 속도 78 mm/hr, C-반응단백은 28.23 mg/dL으로 상승되어 있었다. 골반 전산화단층촬영에서 복직근, 볼기근, 넓적다리 전내측부와 서혜부를 따라서 기포를 포함한 피하 부종이 있었고 복강 내에는 기포가 들어 있는 6.8 cm 크기의 요근 농양이 관찰되었다(Fig. 2). 하지 자기공명영상촬영의 T2 강조영상에서는 좌측 하지의 긴종아리근, 짧은 종아리근과 근막을 따라서 고신호 강도를 보이고 있었다(Fig. 3). 이에 양다리와 복근의 괴사근막염과 요근 농양으로 진단하고 경험적인 항생제는 ceftriaxone 2 g을 24시간마다 clindamycin 600 mg을 8시간마다 투여하였다. 내원 2시간 뒤에 패혈성 쇼크로 승압제를 사용하였고 중환자실로 이실하여 기계 환기를 시행하였다. 이후에 환자는 양쪽 하지와 하복부의 근막 절개술 및 광범위 죽은 조직 제거술을 받았다. 육안적인 수술 소견은 양하지의 피하 조직과 근막의 괴사가 있었고 다량의 농이 있어 이에 대한 배액을 시행하였다. 입원 3일 후에 다시 시행한 복부 컴퓨터단층촬영에서 근육 내의 다발성 기포는 이전보다 감소하였으나 요근 농양은 9 × 20cm으로 크기가 증가하였고 전복강안에도 4.3 × 7.5 cm 크기의 기포를 포함한 농양이 관찰되었다. 이에 요근 및 복강 내 농양에 대해서 농양 제거 및 세척을 시행하고 배액관을 삽입하였다. 제4병일째 혈액, 괴사 근육조직과 요근 농양에서 K. pneumoniae가 동정되었으며 string test에서 hypermucoviscosity 양성이었다(Fig. 4). 배양 검사에서는 ampicillin과 piperacillin에만 내성이 있고 그 외의 항생제에는 cephalosporin을 포함한 모든 약제에 감수성이 있었다. 복강 내 농양에서도 같은 균이 보고되었다. 제6병일째 환자는 안정적인 생체 징후를 보여서 승압제를 중단하였고 제9병일째 기계 호흡을 중단하였다. 제10병일째 2차 상처 감염으로 상처 배액관에서 hmKp와 함께 multidrug-resistant Acinetobacter baumannii가 배양되어서 신기능에 맞추어 colistin 150 mg을 24시간마다 추가하였다.
제17병일째 시행한 복부 컴퓨터단층촬영에서 복강 내 농양의 크기가 증가하여 복강 내 괴사 조직과 농양에 대해서 세척 및 괴사조직 제거수술을 시행하였다. 양 하지의 병변에 대해 여러 차례 괴사 조직 제거를 시행한 이후 환자는 피부 결손 부위에 대한 피부 이식 수술을 시행하였고 증상이 모두 호전된 뒤에 재활치료를 위해서 재활병원으로 전원하였다.
고 찰
K. pneumoniae에 의한 침습성 증후군은 1980년대 중반부터 심한 패혈증을 동반한 원발성 간농양과 전이성 병변으로 타이완에서 보고되기 시작한 이후에 싱가포르, 홍콩과 같은 아시아에서 호발하다가 최근에는 전 세계에서 보고되고 있다[4]. 최근에는 hypermucoviscous phenotype을 가지면서 다른 부위로의 전이성 감염과 심한 합병증을 일으키는 임상적인 특징까지 고려하여 hmKP를 hvKP라고 부르고 있다[2].
Fang 등[1]은 magA (mucoviscosity-associated gene A)가 phagocytosis에 저항성을 보이며 세균에 대한 serum killing의 저항을 증가시키면서 hypermucoviscous phenotype과 연관이 있다고 하였으나 이후의 연구에서 magA는 hvKP와 관련된 것이 아닌 K1 피막 항원과 관련된 것임을 발표하였다[8]. Yu 등[6]은 rmpA (regulator of the mucoid phenotype) 유전자가 hypermucoviscous phenotype의 발현에 중요하다는 것을 밝혔고 hypermucoviscous phenotype은 지역사회 획득 감염에서 높은 빈도를 보이며 농양을 더 많이 형성한다고 보고한 바 있다. 또한 이 유전자는 세균의 피막 다당류 생성에 관여하여서 K1 또는 K2 피막 항원 등의 강한 독성 인자의 발현을 유도한다[9]. 한국에서 K. pneumoniae 균혈증 환자에서 발견된 hvKP 균주를 분석하였을 때 hypermucoviscous phenotype 양성인 균주에서 rmpA 유전자가 더 많았고 간농양과 지역사회 획득 감염의 빈도가 높았으며 모든 균주가 K1 또는 K2 피막 항원을 가지고 있었다[7]. 따라서 K. pneumoniae의 침습적인 지역사회 획득 원발성 간농양과 전이성 감염에 hypermucoviscous phenotype의 발현과 rmpA가 중요한 요인이라는 것을 알 수 있다[6].
Hypermucoviscosity는 string test를 통해서 확진하는데, 고리로 세균 집락을 건드렸을 때 집락이 5 mm 이상의 긴 줄을 형성하면 양성으로 진단한다. 본 환자의 경우 hypermucoviscous phenotype은 확인하였으나 균주가 보관되어 있지 않아 rmpA 유전자의 보유 상태를 확인할 수 없었다.
인체에서 K. pneumoniae의 장내 침입 입구는 간문맥으로 이를 통해서 K. pneumoniae가 간으로 들어가기 때문에 침습성 K. pneumoniae 감염은 원발성 간농양을 대부분 형성하고 이후에 다른 기관으로 전이성 감염이 발생한다[1]. 전이성 감염은 안내염이 가장 많고(60%), 폐농양(40%), 뇌수막염 (25%)의 순서로 나타나고 괴사근막염은 전이성 감염 중에서 드문 형태로 약 4%의 빈도를 보고하고 있다[8].
괴사근막염은 급속하게 매우 치명적으로 진행하는 연부 조직 감염 질환으로 조기 진단과 빠른 수술적 치료가 관건이다. 이의 대표적인 원인균은 group A streptococci (GAS)로 알려져 있으나 최근에 발표된 타이완 연구에서는 괴사근막염의 단일 균 감염 원인으로 K. pneumoniae (17%)가 GAS (18.2%)와 비슷한 빈도로 증가하였음을 보고하고 있다[9]. 그러나 아직까지 그 외의 지역에서는 K. pneumoniae에 의한 괴사근막염은 드물게 보고되고 있고 대부분은 간농양의 전이성 병변으로 나타난다[3,10]. 우리나라에서도 K1 피막항원이 있는 독성이 높은 K. pneumoniae에 의한 간농양이 증가하고 있다고 보고되었으나, 아직까지 우리나라에서 hvKP에 의한 간농양 없이 괴사근막염이 발생한 보고는 없으나 앞으로 타이완과 같이 우리나라에서도 괴사근막염의 한 원인으로 K. pneumoniae를 고려해야 한다.
hvKP 감염 환자를 보면 hypermucoviscous phenotype 양성균주에 의한 균혈증 환자에서 사망률이 28.6%로 hypermucoviscous phenotype 음성인 환자의 10.5%에 비해서 매우 높았다[7]. 그리고 hvKP에 의한 괴사근막염 환자에서는 47%의 사망률을 보고하였으며[9] 또 중추 신경계나 안구에 전이성 감염이 발생한다면 이에 대한 처치는 매우 어렵고 안구내염 발생 시에 85%에서 시력상실을 할 정도로 예후가 좋지 않다. 이처럼 hvKP에 의한 감염은 지역사회 획득 감염 중에서 사망률이 높고 합병증에 따른 후유증 발병률이 높으므로 감염에 대한 빠른 진단과 처치가 필요하겠다.
본 환자는 원발성 간농양 없이 괴사근막염과 요근 농양으로 진단받고 항생제와 수술적 치료를 시행하였다. 기저질환으로 당뇨가 있었고 다리의 넘어진 상처로 K. pneumoniae가 침입한 뒤에 인접 부위로 감염이 진행하여서 간문맥을 거치지 않았기 때문에 간농양이 발생하지 않았을 것으로 추정된다. 괴사근막염에 대해서 적절한 항생제와 여러 차례의 괴사 조직 제거 및 농양 제거와 배액을 했어도 복강 내 농양이 커지는 것을 볼 수 있었는데 이는 괴사근막염이 진행이 빠르고 치명적인 질환이라는 점 외에도 hvKP의 독성이 높음을 시사한다고 볼 수 있다. hvKP에 의한 괴사근막염에는 항생제 치료와 더불어서 적극적인 수술적 치료가 환자의 생존에 중요하다.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






