мДЬ л°†
кЄЙмД± лМАлПЩлІ•л∞Хл¶ђлКФ лМАлПЩлІ• мІИнЩШ м§С к∞АмЮ• мЛђк∞БнХЬ лђЄм†ЬмЭілВШ м†ДнШХм†БмЭЄ м¶ЭмГБмЭі мЧЖк±∞лВШ кЄЙмД± мЛђкЈЉк≤љмГЙк≥Љ лПЩл∞ШлР† к≤љмЪ∞ мІДлЛ®мЭі лК¶мЦімІАк±∞лВШ лЖУмє† мИШ мЮИлЛ§[1]. кЄЙмД± лМАлПЩлІ•л∞Хл¶ђмЧР мЭШнХЬ кіАмГБлПЩлІ• нПРмЗДлКФ лІ§мЪ∞ лУЬлђЉмІАлІМ мєШл™Ем†БмЭіл©∞ мЛђм†ДлПДл•Љ нЖµнХЬ кЄЙмД± мЛђкЈЉк≤љмГЙмЭШ мІДлЛ®мЭА лПЩл∞ШлРЬ лМАлПЩлІ•л∞Хл¶ђмЭШ мІДлЛ®мЭД к∞Дк≥ЉнХ† мИШ мЮИлЛ§[2]. кЄЙмД± лМАлПЩлІ•л∞Хл¶ђмЧР мЭШнХЬ мЛђкЈЉк≤љмГЙ нЩШмЮРмЧРк≤М нШИм†Д мЪ©нХім†Ьл•Љ нИђмЧђнХЬ м¶Эл°А л≥ік≥†к∞А мЮИмЧИмЬЉл©∞ мЭілЯђнХЬ м¶Эл°АлУ§мЧРмДЬ лЖТмЭА мВђлІЭ땆мЭД л≥імШАлЛ§[3]. кЈЄлЯђлѓАл°Ь мЭілЯђнХЬ нЩШмЮРмЧРмДЬ лМАлПЩлІ• л∞Хл¶ђ мЧђлґАл•Љ к∞АлК•нХЬ лє†л•ік≤М к∞Рл≥ДнХШк≥† мєШл£МнХШлКФ к≤ГмЭі м§СмЪФнХШлЛ§. лМАлПЩлІ•л∞Хл¶ђмЧР мЭШнХЬ кЄЙмД± мЛђкЈЉк≤љмГЙмЭА мЭСкЄЙ кіАмГБлПЩлІ• мЮђк∞ЬнЖµмИ† л∞П лМАлПЩлІ•л∞Хл¶ђмЧР лМАнХЬ мИШмИ†мЭі мГЭм°імЧР нХДмИШм†БмЭілЛ§. м†АмЮРлУ§мЭА м≤ШмЭМ мЮЕмЫР мЛЬ лМАлПЩлІ•л∞Хл¶ђмЧР мЭШнХЬ мЛђкЈЉк≤љмГЙмЭД к∞Рл≥ДнХШмІА л™їнХШк≥† мЭСкЄЙ кіАмГБлПЩлІ• мЮђк∞ЬнЖµ нЫД нЗімЫРнХШмШАмЬЉлВШ мІАмЖНлРШлКФ к∞АмКінЖµм¶ЭмЬЉл°Ь мЮђмЮЕмЫРнХШмЧђ нЩХмЭЄлРЬ лМАлПЩлІ• л∞Хл¶ђл•Љ мИШмИ†м†БмЬЉл°Ь мєШл£МнХЬ 1мШИк∞А мЮИмЦі л≥ік≥†нХШлКФ л∞ФмЭілЛ§.
м¶Э л°А
нЩШ мЮР: кєАгАЗгАЗ, мЧђмЮР, 50мДЄ
м£Љ мЖМ: к∞СмЮРкЄ∞ л∞ЬмГЭнХЬ 2мЛЬк∞Д мІАмЖНлРЬ к∞АмКінЖµм¶Э
нШДл≥С놕: к≥†нШИмХХмЬЉл°Ь нХ≠к≥†нШИмХХм†Ь мєШл£Мл•Љ л∞Ык≥† мЮИмЧИмЬЉл©∞ лВімЫРмЭЉ к∞СмЮРкЄ∞ л∞ЬмГЭнХЬ к∞АмКінЖµм¶ЭмЭі 2мЛЬк∞Д мІАмЖНлРШмЦі мЭСкЄЙмЛ§мЧР лВімЫРнХШмШАлЛ§.
к≥Љк±∞놕 л∞П мВђнЪМ놕: нЭ°мЧ∞놕 л∞П мЭМм£Љл†•мЭА мЧЖмЧИлЛ§.
к∞А찱놕: нКємЭі мВђнХ≠ мЧЖмЭМ.
мЛ†м≤ік≤АмВђ мЖМк≤ђ: лВімЫР мЛЬ нШИмХХмЭА 110/90 mmHg, лІ•л∞ХмИШ 80нЪМ/лґД, нШЄнЭ°мИШ 18нЪМ/лґД, м≤імШ® 36.0вДГмШАмЬЉл©∞ мЭШмЛЭмЭА л™Ел£МнХШмШАлЛ§. мЛ†м≤ім†Б мІДм∞∞мГБ нКємЭі мЖМк≤ђ мЧЖмЧИмЬЉлВШ к∞АмКінЖµм¶ЭмЭД мЛђнХШк≤М нШЄмЖМнХШмШАлЛ§.
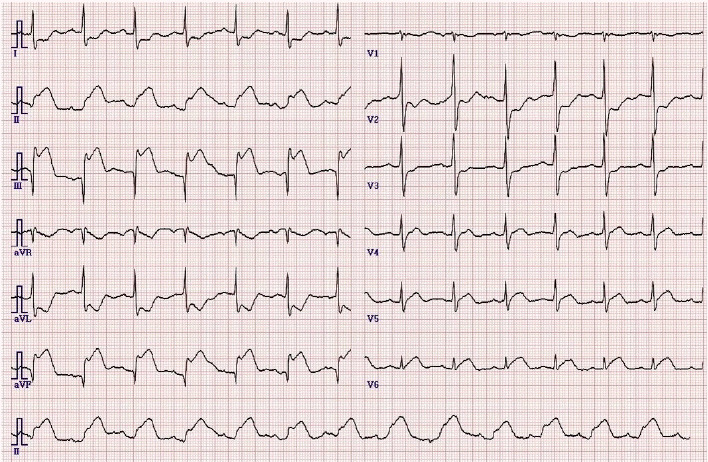
мЛђм†ДлПД мЖМк≤ђ: мЭСкЄЙмЛ§мЧРмДЬ мЛЬнЦЙнХЬ мЛђм†ДлПДмЧРмДЬ мЛђл∞ХмИШ 80нЪМ/лґДмЭШ м†ХмГБлПЩл¶ђлУђ(normal sinus rhythm)мЭімЧИк≥† II, III, aVF мЬ†лПДмЧРмДЬ STлґДм†И мГБмКємЭі мЮИмЦі нХШл≤љмЭШ кЄЙмД±STлґДм†И мГБмКє мЛђкЈЉ к≤љмГЙмЭі мЭШмЛђлРШмЧИлЛ§(Fig. 1).
к≤АмВђмЛ§ мЖМк≤ђ: мЮЕмЫР лЛємЛЬ нШИмХ° к≤АмВђмЧРмДЬ мЛђкЈЉнЪ®мЖМ(CK-MB, Troponin-T)лКФ м†ХмГБмЭімЧИмЬЉлВШ 4мЛЬк∞Д нЫД мґФм†Бк≤АмВђмЧРмДЬ CK-MB 365.0 ng/mL, Troponin-T > 10.0 ng/mLл°Ь мГБмКєнХШмШАлЛ§.
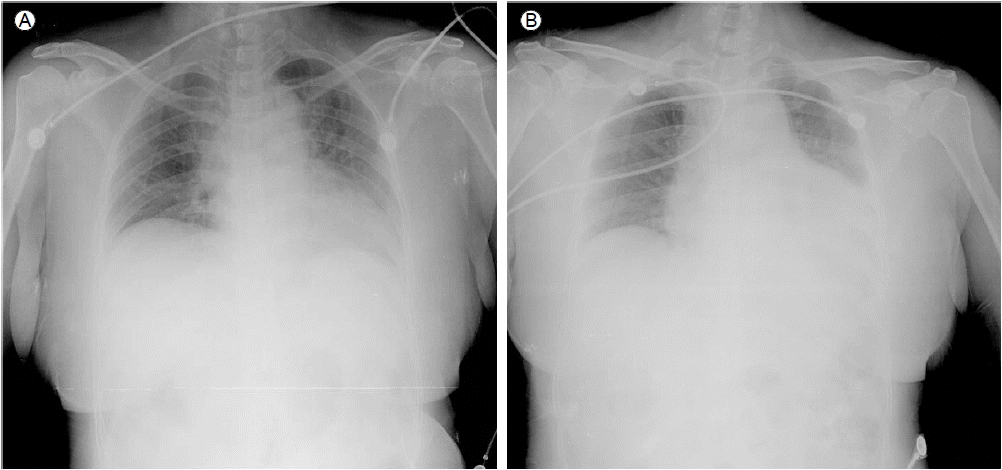
л∞©мВђмД†нХЩм†Б мЖМк≤ђ: лВімЫР мЛЬ нЭЙлґАл∞©мВђмД†мЧРмДЬ нКємЭі мЖМк≤ђ мЧЖмЧИлЛ§(Fig. 2A).
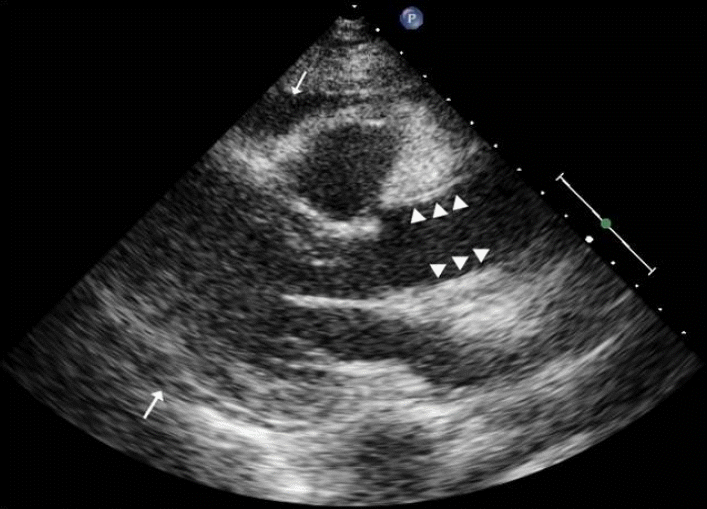
мЛђміИмЭМнММ мЖМк≤ђ: лВімЫР лЛємЛЬ мЭСкЄЙмЛ§мЧРмДЬ мЛЬнЦЙнХЬ мЛђміИмЭМнММмЧРмДЬ мҐМмЛђмЛ§ мИШмґХ кЄ∞лК•мЭА к≤љлПДл°Ь м†АнХШлРШмЦі мЮИмЧИмЬЉл©∞ нХШл≤љмЭШ мЪілПЩм†АнХШк∞А мЮИмЧИмЬЉлВШ мЭШлѓЄ мЮИлКФ лМАлПЩлІ•нМР мЧ≠л•ШлВШ мЛђлВ≠мВЉмґЬмЭА мЧЖмЧИлЛ§.
кіАмГБлПЩлІ•м°∞мШБмИ† мЖМк≤ђ: мЭСкЄЙ кіАмГБлПЩлІ• мЮђк∞ЬнЖµмЭД мЬДнХі кіАмГБлПЩлІ•м°∞мШБмИ†мЭД мЛЬнЦЙнХШмШАлЛ§. мҐМкіАмГБлПЩлІ•мЭА м†ХмГБ мЖМк≤ђмЭД л≥імШАлЛ§. мЪ∞кіАмГБлПЩлІ•мЭА к∞ЬкµђлґАмЧР мЛђнХЬ нШСм∞©мЭД л≥імШАмЬЉл©∞ кЈЉмЬДлґАлґАнД∞ Thrombolysis In Myocardial Infarction (TIMI)-0л°Ь мЩДм†Д нШИкіАнПРмГЙмЭД л≥імШАлЛ§(Fig. 3A). кіАмГБлПЩлІ• лВі лЛИнКЄл°ЬкЄАл¶ђмДЄл¶∞(nitroglycerin) нИђмЧђ мІБнЫД, TIMI-3л°Ь мЮђк∞ЬнЖµлРШмЧИмЬЉл©∞ к∞ЬкµђлґАмЭШ нШСм∞©лПД м°∞кЄИ нШЄм†ДлРШмЧИлЛ§. кЈЄлЯђлВШ мЪ∞кіАмГБлПЩлІ• м§СлЛ®лґАмЬДмЧР мЭМмШБ к≤∞мЖР л∞П м§СлУ±лПДмЭШ нШСм∞©мЭі лВШнГАлВђлЛ§(Fig. 3B). м§СлЛ®лґАмЬД нТНмД† нШИкіАмД±нШХмИ† нЫД мД±нШХмИ†лґАмЬД мЫРмЬДлґАмЧР мЛђнХЬ нШСм∞©мЭі мГИл°Ь л∞ЬмГЭлРШк≥† TIMI-2л°Ь нШИл•Шк∞А к∞РмЖМлРШмЧИлЛ§(Fig. 3C). м§СлЛ®лґАнД∞ мЫРмЬДлґА мЪ∞кіАмГБлПЩлІ•мЧР Promus 3.0 √Ч 20 mm мК§нЕРнКЄл•Љ мВљмЮЕнХШмШАмЬЉлВШ мК§нЕРнКЄ кЈЉмЬДлґАмЧР мЛђнХЬ нШСм∞©мЭі лЛ§мЛЬ кіАм∞∞лРШмЧИмЬЉл©∞(Fig. 3D), кіАмГБлПЩлІ• лВі лЛИнБђл°ЬкЄАл¶ђмДЄл¶∞ нИђмЧђмЧРлПД нШЄм†ДмЭі мЧЖмЧИлЛ§. м§СлЛ® лґАмЬДлґАнД∞ мЫРмЬДлґА мК§нЕРнКЄмЧР к≤єм≥Р мґФк∞Ал°Ь Promus 3.0 √Ч 38 mmмЭШ мК§нЕРнКЄл•Љ мВљмЮЕнХШмШАмЬЉлВШ мЪ∞кіАмГБлПЩлІ• к∞ЬкµђлґАк∞А нПђнХ®лРШмІА мХКмХШлЛ§(Fig. 3E). мµЬмҐЕм†БмЬЉл°Ь к∞ЬкµђлґАмЧР Promus 3.0 √Ч 16 mm мК§нЕРнКЄл•Љ мВљмЮЕнХШмШАлЛ§(Fig. 3F). мЛЬмИ† лЛємЛЬмЧРлКФ кіАмГБлПЩлІ• мЧ∞мґХ(coronary spasm) лШРлКФ кіАмГБлПЩлІ• л∞Хл¶ђ(coronary dissection) л∞П мЫРмЬДлґА мГЙм†ДнШХмД±(distal embolization) лУ±мЭШ к∞АлК•мД±мЭД мЭШмЛђнХШмШАлЛ§. нШИкіА лВі міИмЭМнММ(Intravascular ultrasound, IVUS)к∞А мЛђкЈЉ к≤љмГЙмЭШ кЄ∞м†ДмЭД мХМкЄ∞ мЬДнХі лПДмЫАмЭі лР† к≤ГмЬЉл°Ь нМРлЛ®нХШмШАмЬЉлВШ мЛЬмИ† м§С нШИкіАл≥Сл≥АмЭі лДИлђі мЧ≠лПЩм†БмЭік≥† лґИмХИм†ХнХШмЧђ мХИм†Хм†БмЭЄ кіАмГБлПЩлІ•нШИл•Шл•Љ нЩХл≥інХШлКФ к≤ГмЭі мЪ∞мД†мЭілЭЉ мГЭк∞БнХШмЧђ мЛЬнЦЙнХШмІА мХКмХШлЛ§.
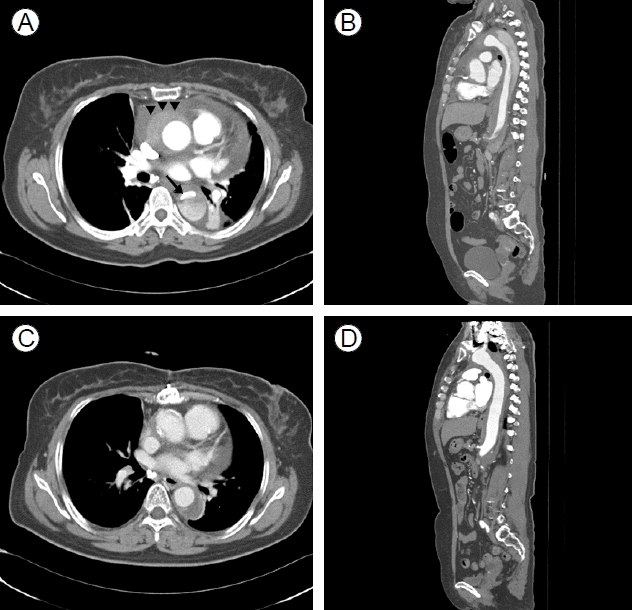
мЮДмГБк≤љк≥Љ л∞П мєШл£М: нЩШмЮРлКФ мД±к≥µм†БмЭЄ кіАмГБлПЩлІ• мЮђк∞ЬнЖµ мЭінЫДмЧРлПД к∞АмКі нЖµм¶ЭмЭі лВ®мХД мЮИмЧИмЬЉлВШ 7мЭЉмІЄ мЛђміИмЭМнММ мЛЬнЦЙ нЫД нЗімЫРнХШмШАлЛ§. мґФм†Б мЛђміИмЭМнММмЧРмДЬ мЖМлЯЙмЭШ мЛђлВ≠мВЉмґЬмЭі мГИл°Ь л∞ЬмГЭнХШмШАмЬЉл©∞ нХШл≤љмЭШ мЪілПЩм†АнХШлКФ нБ∞ л≥АнЩФ мЧЖлКФ мЖМк≤ђмЭімЧИлЛ§. лМАлПЩлІ• л∞Хл¶ђ мІДлЛ® нЫД нЫДнЦ•м†БмЬЉл°Ь мЮђк≤АнЖ†нХШмШАмЭД лХМ мГБнЦЙлМАлПЩлІ•мЭШ л∞Хл¶ђлРЬ нФЉнМР(dissection flap)мЭД мЭШмЛђнХ† мИШ мЮИмЧИлЛ§(Fig. 4). 2мЭЉ лТ§ нЩШмЮРлКФ лУ±мЬЉл°Ь л∞©мВђлРШлКФ мЛђнХЬ к∞АмКі нЖµм¶ЭмЬЉл°Ь мЭСкЄЙмЛ§л°Ь лЛ§мЛЬ лВімЫРнХШмШАмЬЉл©∞ мЛђм†ДлПДмГБ STлґДм†ИмЭШ л≥АнЩФлКФ мЧЖмЧИк≥† мЛђкЈЉнЪ®мЖМ к≤АмВђмГБ CK-MB 1.4 ng/mL, Troponin-T 0.637 ng/mLл°Ь м†ХмГБ мЖМк≤ђмЭімЧИлЛ§. нЭЙлґА л∞©мВђмД†мГБ мҐЕк≤©лПЩмЭШ нЩХмЮ•мЭі мЮИмЦі лМАлПЩлІ• л∞Хл¶ђл•Љ мЭШмЛђнХШмШАлЛ§(Fig. 2B). м†ДмВ∞нЩФлЛ®мЄµміђмШБмГБ лМАлПЩлІ• м†ДмЮ•мЧР к±Єм≥Р л∞ЬмГЭнХЬ Stanford type AмЭШ лМАлПЩлІ•л∞Хл¶ђк∞А нЩХмЭЄлРШмЧИлЛ§(Fig. 5A and 5B). лФ∞лЭЉмДЬ STлґДм†И мГБмКє кЄЙмД± мЛђкЈЉк≤љмГЙмЭШ мЫРмЭЄмЭі кЈЉмЬДлґАмЭШ л∞Хл¶ђлРЬ нФЉнМР(dissection flap)мЭШ мІДнЦЙмЧР мЭШнХЬ мЪ∞кіАмГБлПЩлІ• нПРмЗДмЮДмЭД мХМк≤М лРШмЧИлЛ§. нЩШмЮРлКФ мД±к≥µм†БмЬЉл°Ь кЈЉмЬДлґАмЩА лМАлПЩлІ•кґБ л∞Хл¶ђмЧР лМАнХЬ мИШмИ†(graft interposition)мЭД л∞Ык≥† нХ©л≥См¶Э мЧЖмЭі нЗімЫРнХШмШАлЛ§. мИШмИ† 6к∞ЬмЫФ лТ§ мЛЬнЦЙнХЬ м†ДмВ∞нЩФлЛ®мЄµ міђмШБмГБ нХШнЦЙлМАлПЩлІ•мЭШ нКєл≥ДнХЬ мЛЬмИ† мЧЖмЭі к±∞мІУмЖНк≥µк∞Д(false lumen)мЭі к∞РмЖМнХШмШАлЛ§(Fig. 5C and 5D).
к≥† м∞∞
кЄЙмД± лМАлПЩлІ•л∞Хл¶ђлКФ лІ§мЪ∞ мЛђк∞БнХЬ мІИнЩШмЬЉл°Ь мЧ∞к∞Д л∞±лІМл™Е м§С 5-30мШИмЭШ л∞ЬмГЭ땆мЭД л≥імЭіл©∞ мВђлІЭ땆мЭі лЖТмЭА к≤ГмЬЉл°Ь мХМ놧솪 мЮИлЛ§[4]. лМАлПЩлІ•л∞Хл¶ђмЧРмДЬмЭШ кЄЙмЮСмК§лЯ∞ к∞АмКі нЖµм¶ЭмЭА мЛђкЈЉ нЧИнШИ лШРлКФ лЛ§л•Є мІИнЩШк≥Љ лПЩл∞ШлР† к≤љмЪ∞ к∞Рл≥ДмЭі мֳ놧мЪЄ мИШ мЮИлЛ§[5]. кЈЄлЯђлѓАл°Ь лМАлПЩлІ• л∞Хл¶ђлКФ мІДлЛ®мЭі мҐЕмҐЕ мֳ놧мЪЄ мИШ мЮИмЬЉл©∞ мЮДмГБм†БмЬЉл°Ь мЭі мІИнЩШмЭД мЭШмЛђнХШлКФ к≤ГмЭі м§СмЪФнХШлЛ§. л≥Є м¶Эл°АмЧРмДЬлПД м≤Ђ мЮЕмЫР мЛЬмЧР лМАлПЩлІ• л∞Хл¶ђмЧР лМАнХЬ мІДлЛ®мЭД нХШмІА л™ї нХШмШАлЛ§. мµЬкЈЉ л©ФнГА лґДмДЭмЧРмДЬ D-dimerк∞А 500 ng/mL мЭінХШмЭЄ к≤љмЪ∞ лМАлПЩлІ• л∞Хл¶ђк∞А мЧЖмЭД к∞АлК•мД±мЭі лІ§мЪ∞ лЖТмЭА к≤ГмЬЉл°Ь мХМ놧솪 D-dimerмЭШ мЄ°м†ХмЭі лМАлПЩлІ• л∞Хл¶ђмЭШ мД†л≥Дк≤АмВђл°Ь к∞АлК•нХ† к≤ГмЬЉл°Ь л≥ік≥†лРШмЧИлЛ§[6]. лШРнХЬ D-dimerлКФ кЄЙмД± мЛђкЈЉ к≤љмГЙ нЩШмЮРмЧРмДЬ лМАлПЩлІ• л∞Хл¶ђ л∞П нПРмГЙм†Дм¶Э нЩШмЮРмЧР лєДнХі мЭШлѓЄ мЮИк≤М лВЃмЭА к≤ГмЬЉл°Ь л≥ік≥†лРШмЧИлЛ§[7]. л≥Є м¶Эл°АмЧРмДЬ D-dimerл•Љ мЄ°м†ХнХШмШАлЛ§л©і мҐА лНФ лє®л¶ђ лМАлПЩлІ• л∞Хл¶ђл•Љ мЭШмЛђнХ† мИШ мЮИмЧИмЭД к≤ГмЭілЛ§. лМАлПЩлІ• л∞Хл¶ђмЧР мЭШнХЬ STлґДм†И мГБмКє мЛђкЈЉк≤љмГЙмЭА мДЄ к∞АмІА кЄ∞м†ДмЬЉл°Ь мД§л™ЕлРЬлЛ§. AнШХмЭА кіАмГБлПЩлІ• к∞ЬкµђлґАмЭШ л∞Хл¶ђ(ostial dissection), BнШХмЭА кіАмГБлПЩлІ• к±∞мІУ нЖµл°ЬмЧР мЭШнХЬ л∞Хл¶ђ(dissection with a coronary false channel) кЈЄл¶ђк≥† CнШХмЭА кіАмГБлПЩлІ• лСШл†И л∞Хл¶ђмЧР мЭШнХЬ лВілґА мЫРм£Љ м§См≤©(circumferential detachment with an inner cylinder intussusceptions)мЭілЛ§[8]. нШИкіА лВі міИмЭМнММ(IVUS)лКФ мІДлЛ®мЧР к≤∞м†Хм†БмЭЄ лПДмЫАмЭД м§Д мИШ мЮИлКФ к≤ГмЬЉл°Ь мХМ놧솪 мЮИмЬЉлВШ[9] л≥Є м¶Эл°АлКФ мЭіл•Љ мЛЬнЦЙнХШмІА л™їнХШмЧђ м†ХнЩХнХЬ мІДлЛ®мЭД лВіл¶ђмІА л™їнХШмШАк≥† кЈЄ кЄ∞м†ДмЭД мХМкЄ∞ мֳ놧мЫ†лЛ§. кЈЄлЯђлВШ кіАмГБлПЩлІ• м°∞мШБмИ† мЖМк≤ђмГБ мК§нЕРнКЄ мВљмЮЕ мЭінЫДмЧРлПД л∞Шл≥µлРШлКФ мЛђнХЬ нШСм∞©мЭШ л∞ЬмГЭмЬЉл°Ь лѓЄл£®мЦі кіАмГБлПЩлІ• к±∞мІУ нЖµл°ЬмЧР мЭШнХЬ л∞Хл¶ђ(BнШХ)л°Ь мґФм†ХлРЬлЛ§.
л≥Є м¶Эл°АлКФ мЛђкЈЉ к≤љмГЙмЭД мЬ†л∞ЬнХШмІА мХКмЭА мҐМкіАмГБлПЩлІ•мЧР лПЩлІ• к≤љнЩФмЭШ м¶Эк±∞к∞А мЧЖлКФ м†Рк≥Љ лєДм†ХнШХм†БмЭЄ мЪ∞кіАмГБлПЩлІ• к∞ЬкµђлґАмЭШ нПРмЗД л∞П кіАмГБлПЩлІ• мЮђк∞ЬнЖµмИ† мЛЬмИ†к≥Љм†Х кЈЄл¶ђк≥† мД±к≥µм†БмЭЄ кіАмГБлПЩлІ• мЮђк∞ЬнЖµмИ† мЭінЫДмЧРлПД к∞АмКі нЖµм¶ЭмЭі лВ®мХД мЮИмЧИмЬЉлѓАл°Ь лМАлПЩлІ•л∞Хл¶ђл•Љ л∞ШлУЬмЛЬ мЭШмЛђнЦИмЦімХЉ нХЬлЛ§. кЄЙмД± к∞АмКінЖµм¶ЭмЭД нШЄмЖМнХШлКФ нЩШмЮРк∞А к≤љнЭЙлґА мЛђміИмЭМнММмГБ лМАлПЩлІ• кЈЉлґА(aortic root)мЭШ нЩХмЮ•, лМАлПЩлІ•нМР мЧ≠л•Ш лШРлКФ мЛђлВ≠мВЉмґЬмЭі мЮИмЬЉл©і лМАлПЩлІ•л∞Хл¶ђл•Љ мЭШмЛђнХімХЉ нХЬлЛ§[10]. лМАлПЩлІ•л∞Хл¶ђ нЩШмЮРлКФ лМАлПЩлІ•мЬЉл°ЬлґАнД∞ мІБм†См†Б нШИкіА мЩЄ мЬ†мґЬмЭілВШ лМАлПЩлІ• нШИмҐЕмЭШ нШИкіА мЩЄлІЙ мЮРкЈємЧР мЭШнХі мЭім∞®м†БмЬЉл°Ь мЛђлВ≠мВЉмґЬмЭі л∞ЬмГЭнХ† мИШ мЮИлЛ§[10]. л≥Є м¶Эл°АмЧРмДЬлПД мЛђлВ≠мВЉмґЬмЭі лПЩл∞ШлРШмЧИмЬЉл©∞ нЫДнЦ•м†БмЬЉл°Ь мЛђміИмЭМнММл•Љ мЮђк≤АнЖ†нХШмШАмЭД лХМ мГБнЦЙ лМАлПЩлІ•мЧР л∞Хл¶ђлРЬ нФЉнМР(dissection flap)мЭі мЭШмЛђлРШмЦі лМАлПЩлІ•л∞Хл¶ђ мІДлЛ®мЭД мЬДнХЬ лЛ®мДЬк∞А лР† мИШ мЮИмЧИмЭД к≤ГмЭілЛ§. мєШл£МлКФ лМАлґАлґД мИШмИ†мЭі нХДмЪФнХШлВШ нЩШмЮРл•Љ мХИм†ХмЛЬнВ§к≥† мЛђкЈЉ мЖРмГБмЭД м§ДмЭікЄ∞ мЬДнХі к≤љнФЉм†Б кіАмГБлПЩлІ• мЮђк∞ЬнЖµмИ†мЭД л®Љм†А мЛЬнЦЙнХШк≥† лМАлПЩлІ•л∞Хл¶ђл•Љ мИШмИ†нХШмЧђ мД±к≥µм†БмЬЉл°Ь мєШл£МнХЬ м¶Эл°АлУ§мЭі л≥ік≥†лРШмЧИлЛ§[9,11,12]. л≥Є м¶Эл°АлПД лЛ§нЦЙнЮИ мЬДмЩА к∞ЩмЭА л∞©л≤ХмЬЉл°Ь мєШл£МлРШмЧИлЛ§. мЭілЯђнХЬ нЩШмЮРмЧРмДЬлКФ мєШл£М л∞©л≤ХмЭД к≤∞м†ХнХШкЄ∞ м†Д м†ХнЩХнХЬ мІДлЛ®мЭі лІ§мЪ∞ м§СмЪФнХШл©∞ мЭілКФ нШИм†Д мЪ©нХім†Ь нИђмЧђлВШ нХ≠мЭСк≥† мєШл£Мл°Ь мЭЄнХі мєШл™Ем†БмЭЄ к≤∞к≥Љл•Љ міИлЮШнХ† мИШ мЮИкЄ∞ лХМлђЄмЭілЛ§. м†Хл¶ђнХШл©і мЮДмГБм†БмЬЉл°Ь лМАлПЩлІ• л∞Хл¶ђл•Љ мЭШмЛђнХШлКФ к≤ГмЭі к∞АмЮ• м§СмЪФнХ† к≤ГмЭіл©∞ лМАлПЩлІ•л∞Хл¶ђмЧР мЭШнХЬ кЄЙмД± мЛђкЈЉ к≤љмГЙмЭД мЭШмЛђнХ† мИШ мЮИлКФ мЖМк≤ђмЭА 1) мЛђкЈЉ к≤љмГЙмЭД мЬ†л∞ЬнХШмІА мХКмЭА кіАмГБлПЩлІ•мЧР лПЩлІ•к≤љнЩФмЭШ м¶Эк±∞к∞А мЧЖлКФ лєДм†ХнШХм†Б кіАмГБлПЩлІ• к∞ЬкµђлґА нПРмЗД, 2) мД±к≥µм†БмЭЄ кіАмГБлПЩлІ• мЮђк∞ЬнЖµмИ† мЭінЫДмЧРлПД мІАмЖНлРШлКФ к∞АмКі нЖµм¶Э, 3) нЭЙлґА л∞©мВђмД†мГБ мҐЕк≤©лПЩмЭШ нЩХмЮ•, 4) к≤љнЭЙлґА мЛђміИмЭМнММмГБ лМАлПЩлІ• кЈЉлґА нЩХмЮ•, лМАлПЩлІ•нМР мЧ≠л•Ш лШРлКФ мЛђлВ≠мВЉмґЬ, 5) D-dimerмЭШ мГБмКємЭі 500 ng/mL мЭімГБ мЄ°м†ХлР† лХМмЭілЛ§.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






