žĄú Ž°†
ÍįĎžÉĀžĄ† žú†ŽĎźžēĒ(papillary thyroid carcinoma)žĚÄ ÍįĎžÉĀžĄ†žóźžĄú ŽįúžÉĚŪēėŽäĒ žēĒ ž§ĎžóźžĄú ÍįÄžě• ŪĚĒŪēú žĘÖŽ•ėŽ°ú 70% ž†ēŽŹĄ žį®žßÄŪēėÍ≥†1), ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžĚÄ žĄĪžě• žÜ掏ĄÍįÄ ŽäźŽ¶¨Í≥† žĖĎŪėłŪēú žėąŪõĄŽ•ľ Ž≥īžĚīŽ©į, žßĄŽč® ŽčĻžčú žēĹ 5%žóźžĄú žõźÍ≤©ž†ĄžĚīÍįÄ ŽāėŪÉÄŽāúŽč§. žõźÍ≤©ž†ĄžĚī ž§Ď ŪŹźž†ĄžĚīÍįÄ ÍįÄžě• ŪĚĒŪēėÍ≤Ć žĚľžĖīŽāėŽ©į2,3) žěė Ž∂ĄŪôĒŽźú ÍįĎžÉĀžĄ† žēĒžĚĄ 20ŽÖĄ žĚīžÉĀ ž∂Ēž†ĀŪēú Í≤įÍ≥ľ ŪôėžěźžĚė 35~80%žóźžĄú Í≤ĹŽ∂ÄŽ¶ľŪĒĄž†ąžóź ž†ĄžĚīÍįÄ ŽįúžÉĚŪēėÍ≥† 10~40%žĚė ŪôėžěźžóźžĄú ŪŹźŽ•ľ ŪŹ¨Ūē®Ūēú žõźÍ≤©ž†ĄžĚīÍįÄ ŽįúžÉĚŪēúŽč§4).
2007ŽÖĄŽŹĄ žĄłÍ≥ĄŽ≥īÍĪīÍłįÍĶ¨(WHO)žĚė Ž≥īÍ≥†žóź ŽĒįŽ•īŽ©ī ŪēúÍĶ≠žĚÄ ž§ĎŽďĪŽŹĄžĚė Í≤įŪēĶžú†Ž≥Ďžú®žĚĄ Ž≥īžĚīŽäĒ žßÄžó≠žĚīŽč§5). Í≤įŪēĶžĄĪ ŪĚČŽßČžāľž∂úžĚÄ Í≤įŪēĶÍįźžóľžúľŽ°ú žĚłŪēėžó¨ ŽäĎŽßČžóź ŽįúžÉĚŪēėŽäĒ žßÄžóįžĄĪ Í≥ľŽĮľŽįėžĚĎ(delayed hypersensitivity)žúľŽ°ú žÉĚÍįĀŽźúŽč§. ŪĚČŽßČžāľž∂úžĚÄ ŪĚČŽ≤ĹÍ≥ľ 2007ŽÖĄŽŹĄ žĄłÍ≥ĄŽ≥īÍĪīÍłįÍĶ¨(WHO)žĚė Ž≥īÍ≥†žóź ŽĒįŽ•īŽ©ī ŪēúÍĶ≠žĚÄ ž§ĎŽďĪŽŹĄžĚė Í≤įŪēĶžú†Ž≥Ďžú®žĚĄ Ž≥īžĚīŽäĒ žßÄžó≠žĚīŽč§5). Í≤įŪēĶžĄĪ ŪĚČŽßČžāľž∂úžĚÄ Í≤įŪēĶÍįźžóľžúľŽ°ú žĚłŪēėžó¨ ŽäĎŽßČžóź ŽįúžÉĚŪēėŽäĒ žßÄžóįžĄĪ Í≥ľŽĮľŽįėžĚĎ(delayed hypersensitivity)žúľŽ°ú žÉĚÍįĀŽźúŽč§. ŪĚČŽßČžāľž∂úžĚÄ ŪĚČŽ≤ĹÍ≥ľ ŪŹź žā¨žĚīžĚė ŪĚČÍįēžóź žē°ž≤īžĚė ŽĻĄž†ēžÉĀž†ĀžĚł ž∂ēž†ĀžĚė ŪėēŪÉúžĚīŽ©į6), Í≤įŪēĶžĄĪ ŪĚČŽßČžóľžĚÄ ŪĚČŽßČ žāľž∂úžē°žĚė ŽįįžĖĎÍ≤Äžā¨Žāė ŪĚČŽßČ ž°įžßĀÍ≤Äžā¨žóźžĄú Í≤įŪēĶÍ∑†ž£ľŽ•ľ ŪôēžĚłŪēėžó¨ žßĄŽč®Ūē† žąė žěąŽč§. ŪĚČžąėžē°žĚė žēĄŽćįŽÖłžč†ŪÉąžēĄŽĮłŽÖłŪö®žÜĆ(ADA) žąėžĻėŽ•ľ 40 IU/LžĚĄ Íłįž§ÄžúľŽ°ú Ūē† ŽēĆ 97.5%žĚė ŪäĻžĚīŽŹĄŽ•ľ Ž≥īžĚłŽč§5).
ž†ÄžěźŽď§žĚÄ 70žĄł žó¨žěź ŪôėžěźÍįÄ žēĹ 5ŽÖĄ ž†Ą ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžúľŽ°ú ÍįĎžÉĀžĄ† ž†Ą ž†ąž†úžą†žĚĄ žčúŪĖČŽįõžĚÄ ŪõĄ žĒ¨žßÄŽ°úžĚīŽďúŽ•ľ Ž≥Ķžö©ŪēėŽ©į ŪäĻžĚīž¶ĚžÉĀžóÜžĚī žßÄŽÉąŽćė ŪôėžěźŽ°ú ŪėłŪĚ°Í≥§ŽěĞ̥ ž£ľžÜĆŽ°ú ŽāīžõźŪēėžó¨ žčúŪĖČŪēú ŪĚČŽ∂ÄŽį©žā¨žĄ†Í≤Äžā¨žóźžĄú žöįžł° ŪĚČžąėžÜĆÍ≤¨žĚĄ Ž≥īžó¨ ŪĚČŽßČÍ≤Äžā¨Ž•ľ žčúŪĖČŪēėžėÄŽč§. ŪĚČŽßČ ž°įžßĀÍ≤Äžā¨žóźžĄú Í≤įŪēĶžĄĪ ŪĚČŽßČžóľžúľŽ°ú žßĄŽč®ŽźėžóąžúľŽāė, žēĄŽćįŽÖłžč† ŪÉąžēĄŽĮłŽÖłŪö®žÜĆÍįÄ ŽāģÍ≤Ć žł°ž†ēŽźėžóąžúľŽ©į, ŪĚČŽßČ žāľž∂úžē°žĚī ÍįźžÜĆŪēú ŪõĄ žčúŪĖČŪēú ŪĚČŽ∂ÄžĽīŪď®ŪĄį žī¨žėĀžÉĀ ŪĚČŽßČ žāľž∂úžē°žóź ÍįÄŽ†§ž°ĆŽćė ŪŹźÍ≤įž†ąžĚī ŽįúÍ≤¨ŽźėžóąŽč§. žĚī Í≤įž†ąžĚė ž°įžßĀÍ≤Äžā¨žóźžĄú ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžĚė ŪŹź ž†ĄžĚīŽ°ú žßĄŽč®Žźú ž¶ĚŽ°ÄŽ•ľ Í≤ĹŪóėŪēėžėÄÍłįžóź Ž¨łŪóĆÍ≥†žįįÍ≥ľ Ūē®ÍĽė Ž≥īÍ≥†ŪēėŽäĒ ŽįĒžĚīŽč§.
ž¶Ě Ž°Ä
Ūôė žěź: žĶú‚óčžąú, 70žĄł, žó¨žěź
ž£ľ žÜĆ: ŪėłŪĚ°Í≥§ŽěÄ
Í≥ľÍĪįŽ†•: 2003ŽÖĄ 12žõĒ ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžúľŽ°ú ÍįĎžÉĀžĄ† ž†Ą ž†ąž†úžą† žčúŪĖČ ŪõĄ žĒ¨žßÄŽ°úžĚīŽďú Ž≥Ķžö© ž§ĎžĚł ŪôėžěźŽ°ú Žāīžõź 10žĚľ ž†ĄŽ∂ÄŪĄį ŽįúžÉĚŪēú ŪėłŪĚ°Í≥§ŽěĞ̥ ž£ľžÜĆŽ°ú ŽāīžõźŪēėžėÄŽč§. ÍįĄŪ󟞆ĀžĚł ÍłįžĻ®žĚī žěąžóąžúľŽāė, ÍįĚŪėąžĚÄ žóÜžóąÍ≥†, ŪĚČŪÜĶžĚÄ ŪėłžÜĆŪēėžßÄ žēäžēėžúľŽ©į, ž≤īž§ĎÍįźžÜĆŽäĒ žóÜžóąŽč§.
žĚīŪēôž†Ā Í≤Äžā¨: Žāīžõź ŽčĻžčú ŪėąžēēžĚÄ 150/80 mmHg, Žß•ŽįēžĚÄ 87ŪöĆ/Ž∂Ą, ŪėłŪĚ°žąėŽäĒ 22ŪöĆ/Ž∂Ą, ž≤īžė®žĚÄ 37.4‚ĄÉžėÄžúľŽ©į, ž†ēžč†žÉĀŪÉúŽäĒ Ž™ÖŽ£ĆŪēėžėÄÍ≥†, ͳȞĄĪŽ≥ĎžÉČžÜĆÍ≤¨ ÍīÄžįįŽźėžóąÍ≥†, Í≤įŽßČžĚÄ žįĹŽįĪŪēėžßÄ žēäžēėÍ≥†, žöįž§ĎžóĹÍ≥ľ žöįŪēėžóĹž™ĹžúľŽ°ú ŪėłŪĚ°žĚĆ ÍįźžÜĆŽźėžĖī žěąžóąŽč§.
Í≤Äžā¨žč§ žÜĆÍ≤¨: Žāīžõź ŽčĻžčú ŽßźžīąŪėąžē°Í≤Äžā¨žÉĀ ŽįĪŪėąÍĶ¨ 3,670/mm3(Žč§ŪēĶÍĶ¨ 62.2%), ŪėąžÉČžÜĆ 11.6 g/dL, Ūó§ŽßąŪ܆ŪĀ¨Ž¶Ņ 35.2%, ŪėąžÜĆŪĆź 462,000/mm3žĚīžóąŽč§. ŽėźŪēú ŪĚČžąėž≤úžěźžÉĀ ŽįĪŪėąÍĶ¨ 5,200/mm3 (Ž¶ľŪĒĄÍĶ¨ 99%), ŪĚČžąėŽč®ŽįĪ 5.2 mg/dL, Ūėąž≤≠Žč®ŽįĪ 6.9 mg/dL, ŪĚČžąė LDH 874 IU/L, Ūėąž≤≠ LDH 323 IU/LŽ°ú žāľž∂úžĄĪ ŪĚČžąėžėÄžúľŽ©į, ŪĚČžąėŪėąŽčĻ 87 mg/dL, žēĄŽćįŽÖłžč† ŪÉąžēĄŽĮłŽÖłŪö®žÜĆŽäĒ 2.4 IU/LžĚīžóąŽč§. ŪĚČžąėžôÄ ÍįĚŽčī Í≤Äž≤īžóźžĄú ÍįĀÍįĀžĚė Ūē≠žāįÍ∑† ŽŹĄŽßźÍ≤Äžā¨žôÄ ŽįįžĖĎÍ≤Äžā¨ŽäĒ žĚĆžĄĪžĚīžóąŽč§. žÜĆÍ≤¨Í≤Äžā¨žÉĀ ŪäĻžĚīžÜĆÍ≤¨ žóÜžóąŽč§. ŪĚČžąė Žāī aFP, CEA, CA19-9, Cyfra21-1žĚÄ ž†ēžÉĀžĚīžóąŽč§.
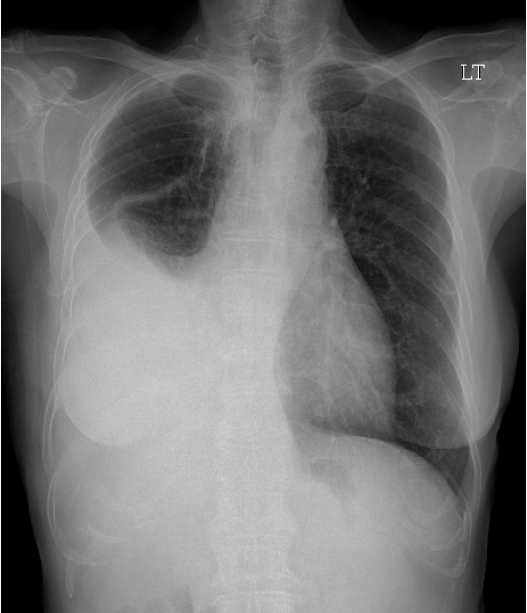
Žį©žā¨žĄ†Ūēôž†Ā Í≤Äžā¨: Žč®žąú ŪĚČŽ∂Ä X-žĄ† žā¨žßĄžóźžĄú žöįžł° ŪŹźžēľžóź Žč§ŽüČžĚė ŪĚČžąėÍįÄ ÍīÄžįįŽźėžóąŽč§(Í∑łŽ¶ľ 1). ŪĚČžąėž≤úžěź ŽįŹ ŪĚČŽßČ ž°įžßĀÍ≤Äžā¨Ž•ľ žčúŪĖČŪēėžėÄÍ≥†, žčúŪĖČ ŪõĄ žąėžĄĪÍłįŪĚČ(hydropneumothorax)žĚī ŽįúžÉĚŪēėžó¨ Pigtail ŽŹĄÍīĞ̥ žāĹžěÖŪēėžėÄŽč§.
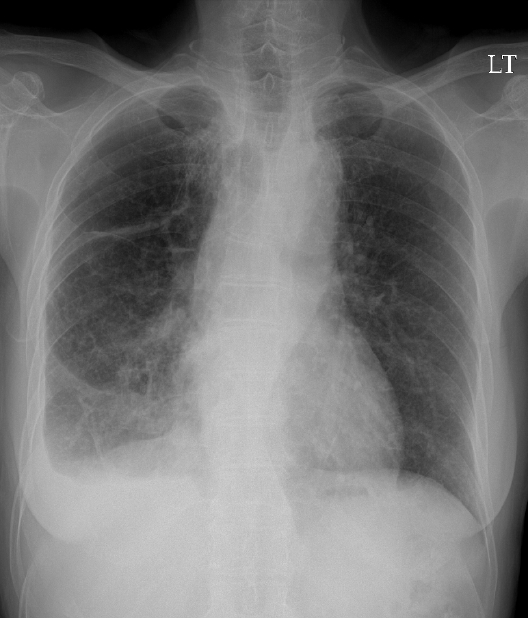
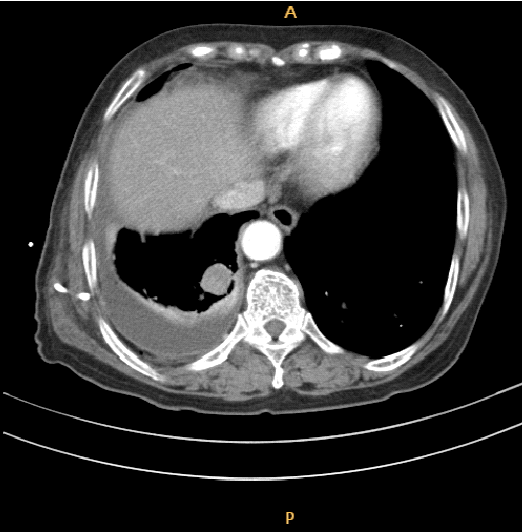
žöįžł° ŪŹźžĚė ŪĚČžąėÍįÄ ž§ĄžĖīŽď† ŪõĄ, ŪĚČŽ∂ÄŽį©žā¨žĄ†Í≤Äžā¨žóźžĄú žöįŪēėžóĹžóź ŪŹźÍ≤įž†ąžĚī Ž≥īžėÄŽč§(Í∑łŽ¶ľ 2). žĚīžĖīžĄú žčúŪĖČŪēú ŪĚČŽ∂Ä ž†ĄžāįŪôĒ Žč®žłĶžī¨žėĀ žÜĆÍ≤¨žÉĀ žöįžł° ŪĚČÍįēŽāī ž†ÄžĚĆžėĀžĚė ŪĚČžąėžē° ž†ÄŽ•ėÍįÄ ÍīÄžįįŽźėŽ©į žöįŪēėžóĹžĚė ŪõĄÍłįž†ÄŽ∂Ąž†ąžóź 2 cm ŪĀ¨ÍłįžĚė ŽĎ•Í∑ľ žĘÖÍīīÍįÄ žěąÍ≥†(Í∑łŽ¶ľ 3), žöįŪēėžóĹÍ≥ľ žĘĆŪēėžóĹžóź ŽĮłžĄłÍ≤įž†ą žÜĆÍ≤¨žĚī ÍīÄžįįŽźėžóąŽč§.
ž°įžßĀ ŽįŹ žĄłŪŹ¨Ž≥ĎŽ¶¨Í≤Äžā¨ Í≤įÍ≥ľ: ŪĚČŽßČžĚė Ž≥ĎŽ¶¨Ūēôž†Ā ž°įžßĀÍ≤Äžā¨ Í≤įÍ≥ľ, žú°žēĄžĘÖÍ≥ľ žĄ¨žú†ÍįÄ ŪėēžĄĪŽźú Ž∂ÄŽ∂Ąžóź Žč§žąėžĚė žĄ¨žú†žÜĆ Ž™®žĖĎžĚė Íīīžā¨žĄĪ žāľž∂ú(fibrinoid necrotic exudate with multiple foci of granulomas and fibrosis)žĚī ÍīÄžįįŽźėžóąÍ≥†, Ziehl-Neelsen žóľžÉȞ󟞥ú Ūē≠žāįÍ∑†(acid-fast bacilli)žĚī ÍīÄžįįŽźėžĖī Í≤įŪēĶžĄĪ ŽäĎŽßČžóľžúľŽ°ú žßĄŽč®ŽźėžóąŽč§(Í∑łŽ¶ľ 4). žöįŪēėžóŞ󟞥ú ŽįúÍ≤¨Žźú 2 cm ŪĀ¨ÍłįžĚė ŽĎ•Í∑ľ žĘÖÍīīžóź ŽĆÄŪēú ŪôēžßĄ žúĄŪēī Í≤ĹŪĚČžĄłžĻ®ŪĚ°žěÖ žĄłŪŹ¨Í≤Äžā¨(PTNA: percutaneous transthoracic needle aspiration)Ž•ľ žčúŪĖČŪēėžėÄŽč§. Ž≥ĎŽ¶¨Í≤Äžā¨Í≤įÍ≥ľžóźžĄú Ž∂ąÍ∑úžĻôŪēú žÜĆŪŹ¨žĄĪŪēĶ(irregular vesicular nuclei)Í≥ľ ŪēĶŽāī ÍĪįžßłŪŹ¨Ūē®žú†Ž¨ľ(intranuclear pseudoinclusions)žĚī ŪŹ¨Ūē®Žźú ŽĻĄž†ēžÉĀž†ĀžĚł žĄłŪŹ¨žĚė žú†ŽĎźŽ™®žĖĎžĚė ÍĶįžßĎ(papillary clusters of atypical cells)žĚī žěąžĖī ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžúľŽ°úŽ∂ÄŪĄį ž†ĄžĚīžÜĆÍ≤¨žúľŽ°ú Ž≥īžĚīŽäĒ žú†ŽĎźžĄ†žēĒžĚī ÍīÄžįįŽźėžóąŽč§(Í∑łŽ¶ľ 5). ŪĚČžąėžôÄ ÍłįÍīÄžßÄžĄłž≤ôžē°žóźžĄú žĄłŪŹ¨Ž≥ĎŽ¶¨Í≤Äžā¨žÉĀ žēÖžĄĪžĄłŪŹ¨ŽäĒ ÍīÄžįįŽźėžßÄ žēäžēėŽč§.
žÉĀÍłį ŪôėžěźŽäĒ Í≤įŪēĶžĄĪ ŪĚČŽßČžóľžĚī ŽŹôŽįėŽźú ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžĚė ŪŹźž†ĄžĚīŽ°ú žßĄŽč®ŽźėžóąžúľŽ©į 4ž†úžöĒŽ≤ē(Isoniazid, Rifampin, Ethambutol, Pyrazinamide)žúľŽ°ú Ūē≠Í≤įŪēĶžĻėŽ£Ć žčúžěĎŪēėžėÄÍ≥†, ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžĚė ŪŹźž†ĄžĚīžóź ŽĆÄŪēú Žį©žā¨žĄ† žöĒžė§Žďú žĻėŽ£ĆŽ•ľ žúĄŪēī 3žį® Ž≥ĎžõźžúľŽ°ú ž†ĄžõźŽźėžóąŽč§.
Í≥† žįį
ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžĚÄ ÍįĎžÉĀžĄ†žóźžĄú ŽįúžÉĚŪēėŽäĒ žēĒ ž§ĎžóźžĄú ÍįÄžě• ŪĚĒŪēú žĘÖŽ•ėŽ°ú 70% ž†ēŽŹĄ žį®žßÄŪēėÍ≥† žó¨ŪŹ¨žēĒžĚÄ 15%, žó≠ŪėēžĄĪžēĒžĚÄ 5%, žąėžßąžēĒžĚÄ 3%žĚīŽč§1). 2006ŽÖĄ ÍįĎžÉĀžĄ† žēĒžúľŽ°ú žßĄŽč®ŽįõžĚÄ 30,180 žėą ž§ĎžóźžĄú ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžĚÄ 70~75% ÍįÄÍĻĆžĚī žį®žßÄŪēėžėÄŽč§7). Žč§Ž•ł Í≥†Ūėē žĘÖžĖĎŽď§Í≥ľŽäĒ Žč¨Ž¶¨ ÍįĎžÉĀžĄ†žĚė žēÖžĄĪ žĘÖžĖĎžĚÄ Í∑ł žěĄžÉĀŽįúŪėĄžĚī Žß§žöį Žč§žĖĎŪēėŽč§. Í∑ł ž§Ď ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžĚÄ žĄĪžě• žÜ掏ĄÍįÄ ŽäźŽ¶¨Í≥† žĖĎŪėłŪēú žėąŪõĄŽ•ľ Ž≥īžĚīŽ©į, žßĄŽč® ŽčĻžčúžóź ÍįĎžÉĀžĄ†žóź ÍĶ≠ŪēúŽźėÍĪįŽāė, Í≤ĹŽ∂Ä žěĄŪĆĆž†ą(42%)žóźŽßĆ Ūćľž†łžěąŽč§1). žßĄŽč® ŽčĻžčú žõźÍ≤©ž†ĄžĚīŽäĒ žēĹ 5%žóźžĄú ŽāėŪÉÄŽāúŽč§2,3).
žěė Ž∂ĄŪôĒŽźú ÍįĎžÉĀžĄ†žēĒžĚĄ 20ŽÖĄ žĚīžÉĀ ž∂Ēž†ĀŪēú Í≤įÍ≥ľ, ŪôėžěźžóźžĄúŽäĒ 35~80%žóźžĄú Í≤ĹŽ∂ÄŽ¶ľŪĒĄž†ąžóź ž†ĄžĚīÍįÄ ŽįúžÉĚŪēėÍ≥† 10~40%žĚė ŪôėžěźžóźžĄú ŪŹźŽ•ľ ŪŹ¨Ūē®Ūēú žõźÍ≤©ž†ĄžĚīÍįÄ ŽįúžÉĚŪēúŽč§2-4). žõźÍ≤©ž†ĄžĚī ž§Ď ŪŹźž†ĄžĚīÍįÄ ÍįÄžě• ŪĚĒŪēėÍ≤Ć žĚľžĖīŽāėŽ©į, ŪŹźž†ĄžĚīŽ•ľ ŪÜĶŪēī žě†žě¨žĄĪ ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžĚĄ ŽįúÍ≤¨ŪēėŽäĒ Í≤ÉŽŹĄ ŽďúŽ¨ľžßÄ žēäŽč§2,3). ŪŹźž†ĄžĚīŽäĒ Žč®žąú ŪĚČŽ∂Ä X-žĄ† žā¨žßĄžóźžĄú ŽĮłžĄłÍ≤įž†ąŪėēžĚīŽāė ÍĪįŽĆÄÍ≤įž†ąŪėēžúľŽ°ú ŽįúÍ≤¨ŽźėÍłįŽŹĄ ŪēėÍ≥†, ÍįĄŪėĻ Žč®žąú ŪĚČŽ∂Ä X-žĄ† žā¨žßĄžĚÄ ž†ēžÉĀžĚīžßÄŽßĆ ŪĚČŽ∂Ä ž†ĄžāįŪôĒŽč®žłĶžī¨žėĀžĚīŽāė 131I ž†Ąžč†žä§žļĒžóźžĄú ŽįúÍ≤¨ŽźėÍłįŽŹĄ ŪēúŽč§. Žč®žąú ŪĚČŽ∂Ä X-žĄ† žā¨žßĄžÉĀ žĚīžÉĀžÜĆÍ≤¨žĚī ŽāėŪÉÄŽāúŽč§Ž©ī ŪŹźž†ĄžĚīžĚė žßĄŽč®žĚī žö©žĚīŪēėžßÄŽßĆ Žč®žąú ŪĚČŽ∂Ä X-žĄ† žā¨žßĄžĚī ž†ēžÉĀžúľŽ°ú Ž≥īžĚīŽäĒ Í≤ĹžöįžóźŽäĒ ŪŹźž†ĄžĚīŽ•ľ žĚėžč¨ŪēėÍłį žĖīŽ†ĶŽč§2,3,8).
ÍįĎžÉĀžĄ†žēĒžĚė žßĄŽč® ŪõĄ ŪŹźž†ĄžĚī ŽįúŪėĄ žčúÍłįŽäĒ 5ŽÖĄžóźžĄú 30ŽÖĄÍĻĆžßÄ Ž≥īÍ≥†ŽźėÍ≥† žěąŽč§8). Schlumberger ŽďĪžĚÄ žóįÍĶ¨žóźžĄú ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžĚė ŪŹźž†ĄžĚīŽ•ľ ÍįĞߥ 102Ž™Ö ž§Ď 64Ž™Ö(62.7%)žóźžĄú ŪĚČŽ∂Äžā¨žßĄžúľŽ°ú ŽįúÍ≤¨Ūēú Í≤ÉžúľŽ°ú ŽįúŪĎúŪēėžėÄŽč§9). ŪŹź Žč§žĚĆžúľŽ°ú ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžĚė ŪėąŪĖČžĄĪ žõźÍ≤©ž†ĄžĚīÍįÄ ŽįúžÉĚŪēėŽäĒ Ž∂ÄžúĄŽäĒ ŽľąžôÄ ŽáĆ, ÍįĄ, žč†žě•, Ž∂Ğ膞ĚīŽč§1).
Ž≥ł ŪôėžěźžĚė Í≤ĹžöįŽäĒ žöįžł°ŪĚČžąėÍįÄ žóÜžóąŽč§Ž©ī, ŪĚČŽ∂Äžā¨žßĄžóź žĚėŪēėžó¨ žöįŪēėžóĹžĚė žĘÖÍīīÍįÄ ŽįúÍ≤¨ŽźėžĖī Í≤Äžā¨ÍįÄ žßĄŪĖČŽźėžóąžĚĄ Í≤ÉžúľŽ°ú žā¨Ž£ĆŽźúŽč§. Í∑łŽü¨Žāė Ž≥ł ŪôėžěźžóźžĄú žöįžł°ŪĚČžąėÍįÄ žóÜÍ≥†, žöįŪēėžóĹžĚė žĘÖÍīīŽŹĄ žóÜžĚī, Žč®žßÄ žĖĎžł°ŪŹźŪēėžóŞ󟞥ú ÍīÄžįįŽźėžóąŽćė ŽĮłžĄłÍ≤įž†ąŽßĆ žěąžóąŽč§Ž©ī, ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžĚė ŪŹź žõźÍ≤©ž†ĄžĚīÍįÄ ŽįúÍ≤¨ŽźėžßÄ žēäžēėžĚĄ Í≤ÉžúľŽ°ú Ž≥īžĚłŽč§.
ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžĚĄ žßĄŽč®ŽįõžĚÄ ŽĆÄŽ∂ÄŽ∂ĄžĚė ŪôėžěźŽď§žĚÄ žēĒžóź žĚėŪēī žā¨ŽßĚŪēėžßÄ žēäŽäĒŽč§. žú†ŽĎźžĄ†žēĒžĚīŽāė žó¨ŪŹ¨žĄ†žēĒ ÍįôžĚÄ Ž∂ĄŪôĒŽźú ÍįĎžÉĀžĄ†žēĒžĚÄ žõźÍ≤©ž†ĄžĚīÍįÄ žóÜŽäĒ Í≤ĹžöįžóźŽäĒ 10ŽÖĄ žÉĚž°īžú®žĚī 80~90%žóź Žč¨ŪēėŽ©į10), žõźÍ≤©ž†ĄžĚīÍįÄ žóÜŽäĒ ŪôėžěźŽď§žĚĄ 16ŽÖĄÍįĄ ž∂Ēž†ĀÍīÄžįį Ūēī Ž≥ł Í≤įÍ≥ľ 6% ž†ēŽŹĄŽßĆžĚī žēĒÍ≥ľ ÍīÄŽ†®ŽźėžĖī žā¨ŽßĚŪēėžėÄŽč§11). ŪŹźžóź ŽĮłžĄłž†ĄžĚī žôłžóź Žč§Ž•ł ž†ĄžĚīÍįÄ žóÜŽäĒ ŪôėžěźŽď§žĚė 10ŽÖĄ žÉĚž°īžú®žĚÄ 30~50%žĚīŽč§. žõźÍ≤©ž†ĄžĚīÍįÄ žěąžĖīŽŹĄ ŽĆÄŽüČžĚė Žį©žā¨žĄĪžė•žÜĆžĻėŽ£ĆžôÄ ÍįĎžÉĀžĄ† ŪėłŽ•īŽ™¨ žĖĶž†úžöĒŽ≤ēžúľŽ°ú žĘčžĚÄ ŽįėžĚϞ̥ žĖĽžĚĄ žąė žěąžĖī Žč§Ž•ł žēĒžóź ŽĻĄŪēī žĖĎŪėłŪēú žěĄžÉĀÍ≤ĹÍ≥ľŽ•ľ ž∑®ŪēúŽč§10). Žį©žā¨žĄĪžöĒžė§Žďú Í≤Äžā¨žóź žĚėŪēī ŽįúÍ≤¨ŽźėŽāė, ŪĚČŽ∂Äžā¨žßĄžóźžĄúŽäĒ ÍīÄžįįŽźėžßÄ žēäŽäĒ ŪĀ¨ÍłįžĚė ŪŹźž†ĄžĚīÍįÄ žěąŽäĒ ŪôėžěźŽď§žĚÄ žÉĚž°īžú®žĚī ŽćĒ ŽÜížĚÄ ŽįėŽ©ī ÍĪįŽĆÄÍ≤įž†ąžĚīŽ©īžĄú Žį©žā¨žĄ†žöĒžė§Žďú žĄ≠ž∑®Žä•žĚĄ žÜĆžč§Ūēú Í≤Ĺžöį žėąŪõĄÍįÄ Ž∂ąŽüČŪēú Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąŽč§12). žóįŽ†ĻŽ≥ĄŽ°ú Ž≥ľ ŽēĆ 40žĄł žĚīž†Ąžóź Ž∂ĄŪôĒžēĒžĚė ŪŹźž†ĄžĚīŽ•ľ Ž≥īžĚł Í≤ĹžöįÍįÄ 40žĄł žĚīŪõĄ ŽįúÍ≤¨Žźú Í≤ĹžöįŽ≥īŽč§ žĘčžĚÄ žėąŪõĄŽ•ľ Ž≥īžėÄŽč§13). ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžĚė ŪŹźž†ĄžĚīÍįÄ žěąžĚĄ ŽēĆ ŪĚČžąėÍįÄ ŽŹôŽįėŽźėŽ©ī žÉĚž°īžú®žĚī ŽāģžĚÄ Í≤ÉžúľŽ°ú Ž≥īÍ≥†ŪēėžėÄŽč§14). žěė Ž∂ĄŪôĒŽźú ÍįĎžÉĀžĄ†žēĒžĚė žĄĪžě•žĚÄ Žß§žöį ŽäźŽ¶¨Íłį ŽēĆŽ¨łžóź Íłī žčúÍįĄžĚĄ ŽĎźÍ≥† žĻėŽ£ĆŽ•ľ Í≤įž†ēŪēėŽäĒ Í≤ÉžĚī žöĒÍĶ¨ŽźúŽč§4).
Ž≥ł ž¶ĚŽ°ÄžĚė ŪôėžěźžĚė Í≤Ĺžöį žõźÍ≤©ž†ĄžĚīÍįÄ žěąÍ≥†, 70žĄłžĚė Í≥†Ž†ĻžĚł ž†ź, ÍĪįŽĆÄÍ≤įž†ąžÜĆÍ≤¨žĚī žěąŽäĒ ž†źŽēĆŽ¨łžóź žėąŪõĄÍįÄ Ž∂ąŽüČŪē† Í≤ÉžúľŽ°ú žā¨Ž£ĆŽźúŽč§. žĚī ŪôėžěźžóźžĄú ŪĚČžąėžē°žĚÄ Í≤įŪēĶžĄĪ ŪĚČžąėŽ°ú žßĄŽč®ŽźėžóąžúľŽāė, žúĄžĚĆžĄĪžĚĄ Ž≥īžĚł žēĄŽćįŽÖłžč† ŪÉąžēĄŽĮłŽÖłŪö®žÜĆÍįÄ žĚĆžĄĪžėąžł°ŽŹĄÍįÄ ŽÜížĚÄ ž†źžĚĄ Í≥†Ž†§Ūēėžó¨, ÍįĎžÉĀžĄ†žú†ŽĎźžēĒžĚė ŪŹźž†ĄžĚīžóź ŽŹôŽįėŽźú ŪĚČžąėžē°žúľŽ°ú ž∂Ēž†ēŪēī Ž≥łŽč§Ž©ī Ž∂ąŽüČŪēú žėąŪõĄžĚłžěźŽ°ú Ž≥ľ žąė žěąŽč§.
2007ŽÖĄŽŹĄ žĄłÍ≥ĄŽ≥īÍĪīÍłįÍĶ¨žĚė Ž≥īÍ≥†žóź ŽĒįŽ•īŽ©ī ŪēúÍĶ≠žĚÄ ž§ĎŽďĪŽŹĄžĚė Í≤įŪēĶžú†Ž≥Ďžú®žĚĄ Ž≥īžĚīŽäĒ žßÄžó≠žĚīŽč§5). Í≤įŪēĶžóź žĚėŪēú ŪĚČŽßČžóľžĚÄ ŪŹźÍ≤įŪēĶžĚė ŪĚČŽßČŪēė Ž≥ĎžÜĆÍįÄ ŪĆĆžóīŽźėžĖī ÍĪīŽĚĹžĄĪ Ž¨ľžßąžĚī ŪĚČŽßČÍįē ŽāīŽ°ú žú†ž∂úŽźėžĖī žĚīžóź ŽĆÄŪēú Ž©īžó≠ŽįėžĚĎžúľŽ°ú ŽįúžÉĚŪēėŽ©į15), ŪĚČŽßČžāľž∂úžĚÄ ŽĆÄÍįú ŪĚČŽ≤ĹÍ≥ľ ŪŹź žā¨žĚīžĚė ŪĚČÍįēžóź žē°ž≤īžĚė ŽĻĄž†ēžÉĀž†ĀžĚł ž∂ēž†ĀžĚė ŪėēŪÉúžĚīŽč§6). Í≤įŪēĶ ŪĚČŽßČžāľž∂úžĚÄ M. tuberculosisžóź žĚėŪēú Ž™®Žď† žßąŽ≥ĎžĚė 5% ÍįÄŽüČ žį®žßÄŪēúŽč§16,17). Í∑ł žėąŽ°ú Ūēú žóįÍĶ¨žóźžĄú ÍįúŪĚČžą†žĚĄ žčúŪĖČŪĖąŽćė Í≤įŪēĶŪĚČŽßČžāľž∂úžĚī žěąŽäĒ 24Ž™ÖžĚė Ūôėžěź ž§Ď 12Ž™ÖžóźžĄú Ž≥ĎžĚī žěąŽäĒ ŽäĎŽßČÍ≥ľ žĚłž†ĎŪēú ŪŹźžóź ÍĪīŽĚĹžĄĪ žīąž†ź(caseous focus)žĚī ŽįúÍ≤¨ŽźėžóąŽč§18).
Í≤įŪēĶžĄĪ ŪĚČŽßČžóľžĚÄ ŽäĎŽßČŪĚČžąėžĚė ŽįįžĖĎÍ≤Äžā¨Žāė ŪĚČŽßČ ž°įžßĀÍ≤Äžā¨žóźžĄú Í≤įŪēĶÍ∑†žĚĄ ŪôēžĚłŪēėžó¨ žßĄŽč®Ūē† žąė žěąŽč§. Í∑łŽü¨Žāė ŽįįžĖϞ󟞥ú Í≤įŪēĶÍ∑† Í≤Äž∂úžú®žĚÄ 25~37%Ž°ú ŽāģÍ≥†, ŪĚČŽßČ ž°įžßĀÍ≤Äžā¨ŽäĒ žĻ®žäĶž†ĀžĚł žčúžą†žĚīŽč§. žēĄŽćįŽÖłžč† ŪÉąžēĄŽĮłŽÖłŪö®žÜĆÍįÄ 40 IU/LžôÄ Ž¶ľŪĒĄÍĶ¨/Ūėłž§ĎÍĶ¨ ŽĻĄ 0.75Ž•ľ Íłįž§ÄžúľŽ°ú Ūē† ŽēĆ 97.5%žĚė ŪäĻžĚīŽŹĄŽ•ľ Ž≥īžĚīÍ≥†, žúĄ žĚĆžĄĪžĚľ ŪôēŽ•†žĚī 5.6%ŽĚľÍ≥† Ž≥īÍ≥†ŪēėžėÄŽč§5).
žĄĪžĚłžóźžĄú žāľž∂úžĄĪ ŪĚČžąėžóźžĄú žēÖžĄĪžÜĆÍ≤¨žĚÄ ÍįÄžě• ŪĚĒŪēú žõźžĚł ž§ĎžĚė ŪēėŽāėžĚīŽč§. žēÖžĄĪŪĚČžąėžĚė žõźžĚł ž§ĎžóźžĄú ŪĚĒŪēú žõźŽįúžēĒžĚÄ ŪŹźžēĒ, žú†Žį©žēĒÍ≥ľ žěĄŪĆĆžĄ†žēĒžĚī žěąŽč§19). MD žē§ŽćĒžä® žēĒžĄľŪĄįžĚė ŪõĄŪĖ•ž†Ā žóįÍĶ¨žóźžĄú ŽįúŪĎúŪēú ŽįĒžóź ŽĒįŽ•īŽ©ī 1,772Ž™ÖžĚė ÍįĎžÉĀžĄ†žú†ŽĎźžēĒ ŪôėžěźžĚė ž∂Ēž†ĀÍ≥ľž†ēžóźžĄú 10Ž™ÖžĚė Ūôėžěź(0.6%)žóźžĄú žēÖžĄĪŪĚČžąėÍįÄ ŽįúžÉĚŪēėžėÄŽč§20).
Ž≥ł ŪôėžěźžóźžĄúŽäĒ ŽäĎŽßČŪĚČžąėžóźžĄú žēÖžĄĪžĄłŪŹ¨ÍįÄ Ž≥īžĚīžßÄ žēäžēėÍ≥†, ŪĚČŽßČ ž°įžßĀÍ≤Äžā¨žóźžĄú žēÖžĄĪžÜĆÍ≤¨žĚī žóÜžóąÍ≥†, Ūē≠žāįÍ∑†žĚī ŪôēžĚłŽźėžĖī Í≤įŪēĶžĄĪ ŪĚČŽßČžóľžúľŽ°ú žßĄŽč®ŽźėžóąžúľŽāė, žēĄŽćįŽÖłžč† ŪÉąžēĄŽĮłŽÖłŪö®žÜĆÍįÄ ŽāģÍ≤Ć ŽāėžôÄ žēÖžĄĪžóź ŽĆÄŪēú ÍįźŽ≥ĄžĚī ŪēĄžöĒŪēėÍ≤Ć ŽźėžóąŽč§. Žāīžõź ŽčĻžčú Žč§ŽüČžĚė žöįžł° ŪĚČžąėžóź žĚėŪēī žöįžł° ŪŹźžĚė Ž≥ĎŽ≥ÄžĚī ÍīÄžįįŽźėžßÄ žēäžēėžúľŽāė, ŪĚČÍīÄžúľŽ°ú ŪĚČžąėÍįÄ ž†úÍĪįŽźú Ží§ žöįŪēėžóĹžóź ŪŹźÍ≤įž†ąžĚī ŪôēžĚłŽźėžĖī žĚīžóź ŽĆÄŪēú ž°įžßĀÍ≤Äžā¨Ž•ľ žčúŪĖČŪēėžėÄžúľŽ©į, Í≤įÍ≥ľžóźžĄú ÍįĎžÉĀžĄ† žú†ŽĎźžēĒžĚė ŪŹźž†ĄžĚīŽ°ú ŪĆźŽ™ÖŽźėžóąŽč§.
Ž≥ł ž¶ĚŽ°ÄŽ•ľ ŪÜĶŪēėžó¨ ÍįĎžÉĀžĄ†žú†ŽĎźžēĒ ŪôėžěźžĚė ŽįúžÉĚžčú Ž≥ĎŪÉúžÉĚŽ¶¨žóź ŽĆÄŪēú žĚīŪēīŽ•ľ ŽįĒŪÉēžúľŽ°ú žßĄŽč® ŽčĻžčúŽ∂ÄŪĄį 30ŽÖĄ žĚīžÉĀžĚė ÍłįÍįĄžóź ÍĪłž≥źžĄú žõźÍ≤©ž†ĄžĚī žó¨Ž∂Äžóź ŽĆÄŪēú žßÄžÜ枆ĀžĚł Í≤Äžā¨ÍįÄ ŪēĄžöĒŪē† Í≤ÉžúľŽ°ú žā¨Ž£ĆŽźúŽč§. ŪĚČžąėžē°žĚė Í≤Äžā¨žÜĆÍ≤¨žóźžĄú žēĄŽćįŽÖłžč† ŪÉąžēĄŽĮłŽÖłŪö®žÜĆÍįÄ ŽāģžĚĄ Í≤ĹžöįžóźŽäĒ žēÖžĄĪžóź ŽĆÄŪēú ÍįźŽ≥Ąžčú ŽĻąŽŹĄŽäĒ ŽāģžßÄŽßĆ Í≥ľÍĪį ÍįĎžÉĀžĄ†žēĒ Ž≥ĎŽ†•ŽŹĄ Í≥†Ž†§ŽźėžĖīžēľ ŪēúŽč§. ÍįĎžÉĀžĄ†žēĒ Í≥ľÍĪįŽ†•žĚī žěąŽäĒ Í≤Ĺžöį ŽėźŪēú ŪĚČžąėÍįÄ ž†úÍĪįŽźú Ží§žóź ŪĚČŽ∂ÄŽį©žā¨žĄ†žÉĀžóźžĄú Í≤įž†ą žó¨Ž∂ÄŽ•ľ ŪôēžĚłŪēīžēľ ŪēėÍ≤†žúľŽ©į, Í≤įž†ąžĚī ŪĚČŽ∂ÄŽį©žā¨žĄ†žÉĀžóźžĄú ÍīÄžįįŽźėžßÄ žēäŽćĒŽĚľŽŹĄ, ŪĚČŽ∂Ä ž†ĄžāįŪôĒŽč®žłĶžī¨žėĀ ŽįŹ 131I ž†Ąžč†žä§žļĒ Í≤Äžā¨Ž•ľ ŪÜĶŪēú ŽĮłžĄłÍ≤įž†ąžó¨Ž∂ÄžĚė ŪôēžĚłžĚī ŪēĄžöĒŪēėŽč§. ŽßąžßÄŽßČžúľŽ°ú Í≤įŪēĶžĄĪ ŪĚČŽßČžóľžěĄžóźŽŹĄ Ž∂ąÍĶ¨ŪēėÍ≥† ŪäĻžĚīŽŹĄÍįÄ ŽÜíÍ≥† žúĄžĚĆžĄĪŽ•†žĚī ŽāģžĚÄ žēĄŽćįŽÖłžč† ŪÉąžēĄŽĮłŽÖłŪö®žÜĆÍįÄ ŽāģÍ≤Ć Žāėžė® žõźžĚłžúľŽ°úŽäĒ ÍįĎžÉĀžĄ† ž†Ąž†ąž†úžą† žčúŪĖČ ŽįŹ žĒ¨žßÄŽ°úžĚīŽďú Ž≥Ķžö©žĚī Ž¶ľŪĒĄÍĶ¨žóź žĚėŪēú žĄłŪŹ¨Ž©īžó≠Í≥ľ ÍīÄÍ≥ĄžěąŽäĒ žēĄŽćįŽÖłžč† ŪÉąžēĄŽĮłŽÖłŪö®žÜĆžĚė ŪôúžĄĪŽŹĄžóź žėĀŪĖ•žĚĄ ž£ľžóąžĚĄ Í≤ÉžúľŽ°ú ž∂Ēžł°ŽźėžßÄŽßĆ žĚīžóź ŽĆÄŪēú ž∂ĒÍįÄ žóįÍĶ¨ÍįÄ ŪēĄžöĒŪē† Í≤ÉžúľŽ°ú žÉĚÍįĀŽźúŽč§.





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






