 |
 |
| Korean J Med > Volume 98(3); 2023 > Article |
|
Abstract
Thyrotoxicosis is a clinical state with a variety of various etiologies that results from excess thyroid hormones, including hyperthyroidism and thyroiditis. Graves' disease (GD) is a well-known autoimmune thyroid disease that causes hyperthyroidism, and its pathogenesis is mainly driven by the thyroid-stimulating hormone receptor antibody (TSHRAb), which is highly specific for GD. Measuring the TSHRAb is a fast and accurate diagnostic tool for GD and has been used to monitor disease activity and the treatment response. However, conventional TSH-binding inhibitory immunoglobulin (TBII) does not differentiate between stimulating, blocking, or neutral antibodies. In contrast, thyroid stimulatory immunoglobulin bioassays differentiate between stimulating and blocking antibodies and have comparably high sensitivity and specificity to TBII for GD. We also discuss the role of thyroid peroxidase antibody (TPOAb) and thyroglobulin antibody (TgAb) in thyrotoxicosis, although they are less specific than TSHRAb for GD. TPOAb is associated with autoimmune thyroiditis, while TgAb appears with TPOAb in patients with autoimmune thyroid disease. In addition, TPOAb or TgAb may be associated with a low recurrence of GD after discontinuing anti-thyroid drugs. Clinicians should interpret thyroid autoantibodies in the context of the patient's clinical presentation and consider their implications to manage and monitor thyrotoxicosis.
Ļ░æņāüņäĀņżæļÅģņ”Ø(thyrotoxicosis)ņØĆ Ļ░æņāüņäĀĒśĖļź┤ļ¬¼ņØ┤ ĒśłņĢĪ ļé┤ņŚÉ Ļ│╝ļŗżĒĢśĻ▓ī ļČäļ╣äļÉśņ¢┤ ļ░£ņāØĒĢśļŖö ņŗĀņ▓┤ņØś ņ”Øņāü ļ░Å ņ¦ĢĒøäļź╝ ņØśļ»ĖĒĢśļ®░ ļŗżņ¢æĒĢ£ ņøÉņØĖņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż[1]. Ļ░æņāüņäĀņżæļÅģņ”ØņŚÉļŖö ļæÉ Ļ░Ćņ¦Ć ņŻ╝ņÜö ļ│æņØĖņØ┤ ņ׳ļŗż. ņ▓½ņ¦ĖļŖö ĒśłņĢĪ ļé┤ Ļ░æņāüņäĀ ņĪ░ņ¦üņØä ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ×ÉĻĘ╣ĒĢśļŖö Ļ░æņāüņäĀņ×ÉĻĘ╣ĒśĖļź┤ļ¬¼(thyroid stimulating hormone, TSH) ņłśņÜ®ņ▓┤ ĒĢŁņ▓┤(TSH receptor antibody, TSHRAb)ņØś ņ”ØĻ░Ćļéś TSH ņłśņÜ®ņ▓┤ ļÅīņŚ░ļ│ĆņØ┤ļĪ£ ņØĖĒĢśņŚ¼ ļČĆņĀüņĀłĒĢśĻ▓ī Ļ░æņāüņäĀĒśĖļź┤ļ¬¼ņØś ĒĢ®ņä▒Ļ│╝ ļČäļ╣äĻ░Ć ļŖśņ¢┤ļéśņä£ ļ░£ņāØĒĢśļŖö Ļ░æņāüņäĀĻĖ░ļŖźĒĢŁņ¦äņ”Ø(hyperthyroidism)ņØ┤ļŗż[2]. ļæśņ¦ĖļŖö Ļ░æņāüņäĀņŚ╝(thyroiditis)ņ£╝ļĪ£, Ļ░æņāüņäĀņØś ņŚ╝ņ”Øņ£╝ļĪ£ ņØĖĒĢ┤ Ļ░æņāüņäĀ ņĪ░ņ¦üņØ┤ ĒīīĻ┤┤ļÉśĻ│Ā Ļ░æņāüņäĀņŚÉņä£ ĒśĖļź┤ļ¬¼ņØ┤ ņ£ĀņČ£ļÉśņ¢┤ ĒśłņĢĪ ļé┤ Ļ░æņāüņäĀĒśĖļź┤ļ¬¼ ļåŹļÅäĻ░Ć ļåÆņĢäņĀĖ Ļ░æņāüņäĀņżæļÅģņ”ØņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż[2]. Ļ░æņāüņäĀņżæļÅģņ”ØņØä ņ¦äļŗ©ĒĢśĻ│Ā ņ╣śļŻīĒĢśļŖö ļŹ░ Ļ░æņāüņäĀ ņ×ÉĻ░ĆĒĢŁņ▓┤ņØś ņĖĪņĀĢņØĆ ņżæņÜöĒĢ£ ņØśļ»Ėļź╝ Ļ░Ćņ¦äļŗż. ļ│Ė ļģ╝ļ¼ĖņŚÉņä£ļŖö Ļ░æņāüņäĀņżæļÅģņ”ØņØä ņ¦äļŗ©ĒĢśĻ│Ā ņ╣śļŻīĒĢśļŖö ļŹ░ ņé¼ņÜ®ĒĢśļŖö Ļ░æņāüņäĀ ņ×ÉĻ░ĆĒĢŁņ▓┤ņØś ņĖĪņĀĢņØś ņØśļ»ĖņÖĆ ĒĢ┤ņäØņØä ņĀĢļ”¼ĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ĻĘĖļĀłņØ┤ļĖīņŖżļ│æ(GravesŌĆÖ disease)ņØĆ Ļ░Ćņן ņל ņĢīļĀżņ¦ä ņ×ÉĻ░Ćļ®┤ņŚŁņä▒ Ļ░æņāüņäĀ ņ¦łĒÖś ņżæ ĒĢśļéśļĪ£, Ļ░æņāüņäĀĻĖ░ļŖźĒĢŁņ¦äņ”ØņØä ņØ╝ņ£╝ĒéżļŖö ļīĆĒæ£ņĀüņØĖ ņ¦łĒÖśņØ┤ļŗż. Ļ░æņāüņäĀņżæļÅģņ”ØņØś ļŗżļźĖ ļ│æņØĖņØĖ Ļ░æņāüņäĀņŚ╝ ņżæņŚÉņä£ ļ¼┤ĒåĄņä▒ Ļ░æņāüņäĀņŚ╝(painless thyroiditis)Ļ│╝ ĒĢśņŗ£ļ¬©ĒåĀ Ļ░æņāüņäĀņŚ╝(HashimotoŌĆÖs thyroiditis) ļśÉĒĢ£ ĒĢŁĻ░æņāüņäĀ ĒĢŁņ▓┤(anti-thyroid antibodies)Ļ░Ć ņŚ░Ļ┤ĆļÉśņ¢┤ ļéśĒāĆļéśļŖö ņ×ÉĻ░Ćļ®┤ņŚŁ ņ¦łĒÖśņØ┤ļŗż.
Ļ░æņāüņäĀņ×ÉĻĘ╣ĒśĖļź┤ļ¬¼ņłśņÜ®ņ▓┤ĒĢŁņ▓┤(TSH receptor antibody, TSHRAb)ļŖö ĻĘĖļĀłņØ┤ļĖīņŖżļ│æņØś ļ░£ļ│æ ĻĖ░ņĀäņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļ®░, Ļ░æņāüņäĀ ņŚ¼Ēż ņäĖĒżņØś TSH ņłśņÜ®ņ▓┤ņŚÉ Ļ▓░ĒĢ®ĒĢśņŚ¼ Ļ░æņāüņäĀĒśĖļź┤ļ¬¼ņØś ņāØņé░Ļ│╝ ļ░®ņČ£ņØä ņ”ØĻ░Ćņŗ£Ēé©ļŗż[2]. ĻĘĖļ¤¼ļ»ĆļĪ£ TSHRAbļŖö ĻĘĖļĀłņØ┤ļĖīņŖżļ│æĻ│╝ Ļ┤ĆļĀ©ļÉ£ Ļ░Ćņן ĒŖ╣ņØ┤ņĀüņØĖ ņ×ÉĻ░ĆĒĢŁņ▓┤ņØ┤ļŗż[3]. ļ░®ņé¼ņä▒ ņÜöņśżļō£ ņŖżņ║öĻ│╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī, TSHRAbļŖö ĻĘĖļĀłņØ┤ļĖīņŖżļ│æņŚÉ ļīĆĒĢ£ ļ╣Āļź┤Ļ│Ā ņĀĢĒÖĢĒĢ£ ņ¦äļŗ©ņØä ņĀ£Ļ│ĄĒĢ£ļŗż[1,4]. ļśÉĒĢ£ ĒśłņĢĪ ļé┤ TSHRAbļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ¦łļ│æņØś ĒÖ£ņä▒ļÅä ļ░Å ņ╣śļŻīņŚÉ ļīĆĒĢ£ ļ░śņØæņØä ļ¬©ļŗłĒä░ļ¦üĒĢĀ ņłś ņ׳ļŗż[1].
ĒśłņĢĪ ļé┤ TSHRAbļź╝ ņĖĪņĀĢĒĢśļŖö ļŹ░ņŚÉļŖö Ēü¼Ļ▓ī ļæÉ Ļ░Ćņ¦Ć ļ░®ļ▓ĢņØ┤ ņØ┤ņÜ®ļÉ£ļŗż[3]. ņ▓½ ļ▓łņ¦Ė ļ░®ļ▓ĢņØĆ ĒÖśņ×ÉņØś ĒśłņĢĪ ļé┤ immunoglobulin G (IgG)Ļ░Ć TSHņÖĆ TSH ņłśņÜ®ņ▓┤ Ļ▓░ĒĢ®ņØä ņ¢ĄņĀ£ĒĢśļŖö ņĀĢļÅäļź╝ ĒÅēĻ░ĆĒĢśļŖö Ļ▓Įņ¤üņĀüĻ▓░ĒĢ®ņĖĪņĀĢļ▓Ģņ£╝ļĪ£, Ļ░æņāüņäĀņ×ÉĻĘ╣ĒśĖļź┤ļ¬¼Ļ▓░ĒĢ®ņ¢ĄņĀ£ļ®┤ņŚŁĻĖĆļĪ£ļČłļ”░(TSH binding inhibitory immunoglobulin, TBII)ņØä ņĖĪņĀĢĒĢśļŖö Ļ▓āņØ┤ļŗż. ļæÉ ļ▓łņ¦Ė ļ░®ļ▓ĢņØĆ ĒÖśņ×ÉņØś ĒśłņĢĪ ļé┤ IgGĻ░Ć ļ░░ņ¢æļÉ£ Ļ░æņāüņäĀ ņäĖĒżļź╝ ņ¢╝ļ¦łļéś ņ×ÉĻĘ╣ĒĢśļŖöņ¦Ć cyclic AMPļź╝ ņĖĪņĀĢĒĢśņŚ¼ ĒīÉļŗ©ĒĢśļŖö Ļ░æņāüņäĀņ×ÉĻĘ╣ļ®┤ņŚŁĻĖĆļĪ£ļĖöļ”░ ņāØļ¼╝ĒĢÖņĀü ņĖĪņĀĢļ▓Ģ(thyroid stimulating immunoglobulin bioassay, TSI bioassay)ņØ┤ļŗż. TBII ņĖĪņĀĢļ▓ĢņØĆ ĻĘĖļĀłņØ┤ļĖīņŖżļ│æņØä ņ¦äļŗ©ĒĢśļŖö ļŹ░ ļø░ņ¢┤ļé£ ļ»╝Ļ░ÉļÅä(98%)ņÖĆ ĒŖ╣ņØ┤ļÅä(99%)ļź╝ ļ│┤ņŚ¼ņżĆļŗż[5]. ĻĘĖļ¤¼ļéś ņØ┤ Ļ▓Ćņé¼ļŖö ņ×ÉĻĘ╣, ņ░©ļŗ© Ēś╣ņØĆ ņżæņä▒ ĒĢŁņ▓┤ļź╝ ĻĄ¼ļČäĒĢśņ¦Ć ļ¬╗ĒĢśļŖö ĒĢ£Ļ│äĻ░Ć ņ׳ļŗż. ļ░śļ®┤, TSI bioassay ĻĖ░ņłĀņØĆ ņ×ÉĻĘ╣ ĒĢŁņ▓┤ņÖĆ ņ░©ļŗ© ĒĢŁņ▓┤ļź╝ ĻĄ¼ļČäĒĢĀ ņłś ņ׳ļŗż. ņØ┤ ņāłļĪ£ņÜ┤ TSI bioassay Ļ▓Ćņé¼ļŖö Ļ░æņāüņäĀņżæļÅģņ”ØņŚÉņä£ ĻĘĖļĀłņØ┤ļĖīņŖżļ│æņØä ņ¦äļŗ©ĒĢśļŖö ļŹ░ 96-97%ņØś ļ»╝Ļ░ÉļÅäņÖĆ 99%ņØś ĒŖ╣ņØ┤ļÅäļź╝ ļ│┤ņŚ¼ņŻ╝ņŚłļŗż[1]. ĒĢ┤ļŗ╣ ņŚ░ĻĄ¼ņØś Ļ▓░Ļ│╝ļŖö TSI bioassayņØś ņ¢æņä▒ ĻĖ░ņżĆņØä Ļ▓Ćņé¼ Ļ▓░Ļ│╝ņŚÉņä£ Ļ▓Ćņ▓┤-ņ░ĖĻ│Ā Ēæ£ņżĆļ╣äņ£©(specimen-to-reference control ratio, SRR)ņØ┤ 140% ņØ┤ņāüņØ╝ Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆņØä ļĢīņØś Ļ▓Ćņé¼ ņĀĢĒÖĢļÅäņØ┤ļŗż[6]. ļ░śļ®┤ ĒĢ£ĻĄŁņŚÉņä£ 386ļ¬ģņØś ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĻĘĖ ĻĖ░ņżĆĻ░ÆņØä 123 SRR%ļĪ£ ĒĢśņśĆļŖöļŹ░, ņØ┤ļĢī TSI bioassayļŖö 97%ņØś ļ»╝Ļ░ÉļÅäņÖĆ 97%ņØś ĒŖ╣ņØ┤ļÅäļź╝ ļ│┤ņŚ¼ņŻ╝ņŚłļŗż. ņØ┤ļŖö ņÜöņśżļō£ ņäŁņĘ©Ļ░Ć ļåÆņØĆ ņ¦ĆņŚŁņŚÉņä£ļŖö TSI bioassayņØś Ļ▓ĮĻ│äĻ░ÆņØ┤ ļŹö ļé«ņĢäņĀĖņĢ╝ ĒĢ©ņØä ņŗ£ņé¼ĒĢ£ļŗż[7].
ņØ┤ļ¤¼ĒĢ£ ĻĖ░ļŖźņä▒(functional) TSH ņłśņÜ®ņ▓┤ ĒĢŁņ▓┤ņØś ņĖĪņĀĢņØĆ Ļ░æņāüņäĀ ņÖĖ ņ”Øņāü(extra-thyroidal manifestation)ņŚÉ ļīĆĒĢ£ ņśłņĖĪņŚÉļÅä ņé¼ņÜ®ļÉĀ ņłś ņ׳ļŗż[8]. ĒĢ£ĻĄŁņŚÉņä£ ņ¦äĒ¢ēļÉ£ 101ļ¬ģņØś ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£, TSI bioassayļŖö Ļ░æņāüņäĀņĢłļ│æņ”Ø(thyroid associated opthalmopathy, TAO)ņØä ņ¦äļŗ©ĒĢśļŖö ļŹ░ 85%ņØś ļ»╝Ļ░ÉļÅä, 77%ņØś ĒŖ╣ņØ┤ļÅäļź╝ ļ│┤ņŚ¼ņŻ╝ņŚłņ£╝ļ®░ ņØ┤ļĢī Ļ▓ĮĻ│äĻ░ÆņØĆ 406.7 SRR%ņśĆļŗż[9]. ļśÉĒĢ£ TSI bioassayļŖö ĒĢŁĻ░æņāüņäĀ ņĢĮļ¼╝(anti-thyroid drugs, ATD)ņØä ņżæļŗ©ĒĢĀ ļĢī ĻĘĖļĀłņØ┤ļĖīņŖżļ│æņØś ņ×¼ļ░£ņØä ņśłņĖĪĒĢśļŖö ļŹ░ņŚÉļÅä ĒÖ£ņÜ®ĒĢĀ ņłś ņ׳ļŗż. ĒĢ£ĻĄŁņŚÉņä£ ņ¦äĒ¢ēļÉ£ ņŚ░ĻĄ¼ņŚÉņä£ TSI bioassayņØś ATD ņżæļŗ© ņŗ£ ĻĘĖļĀłņØ┤ļĖīņŖżļ│æ ņ×¼ļ░£ ņśłņĖĪ ļ»╝Ļ░ÉļÅäļŖö 63%, ĒŖ╣ņØ┤ļÅäļŖö 83%ņśĆļŗż[10]. ņĀĆņ×ÉļōżņØĆ 219ļ¬ģņØś ĻĘĖļĀłņØ┤ļĖīņŖżļ│æ ĒÖśņ×Éļź╝ ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. ņØ┤ ņŚ░ĻĄ¼ņŚÉ ĒżĒĢ©ļÉ£ ĒÖśņ×ÉļōżņØĆ ļ¬©ļæÉ TSI bioassay SRR ņłśņ╣śĻ░Ć 140% ļ»Ėļ¦īņØ┤ņ¢┤ņä£ ĒĢŁĻ░æņāüņäĀņĀ£ļź╝ ņżæļŗ©ĒĢ£ ĒÖśņ×ÉņØ┤ļ®░, ĒÖśņ×Éļōż ņżæ 39.3%Ļ░Ć ņ×¼ļ░£ņØä Ļ▓ĮĒŚśĒĢśņśĆļŗż. TSI bioassay SRR ņłśņ╣ś 66.5%ļź╝ ĻĖ░ņżĆņ£╝ļĪ£ ĒĢśņŚ¼ 66.5% ņØ┤ņāüņØś TSI bioassay Ļ░ÆņØä Ļ░Ćņ¦ä ĒÖśņ×ÉļŖö 23.8%Ļ░Ć ņĢĮņĀ£ ņżæļŗ© Ēøä 2ļģä ļÆżņŚÉ ņ×¼ļ░£ņØä Ļ▓ĮĒŚśĒĢśņśĆņ£╝ļ®░, 66.5% ļ»Ėļ¦īņØś Ļ░ÆņØä Ļ░Ćņ¦ä ĒÖśņ×ÉļŖö 12.7%Ļ░Ć ņ×¼ļ░£ņØä Ļ▓ĮĒŚśĒĢśņśĆļŗż. ļŹö ļéśņĢäĻ░Ć ļéśņØ┤, ņä▒ļ│ä, TBII ĻĘĖļ”¼Ļ│Ā TSI bioassayļź╝ ĒżĒĢ©ĒĢśņŚ¼ ņśłņĖĪ ļ¬©ļŹĖņØä ļ¦īļōżņŚłņØä ļĢī ĻĘĖļĀłņØ┤ļĖīņŖżļ│æ ņ×¼ļ░£ņØĆ ļ»╝Ļ░ÉļÅä 57%, ĒŖ╣ņØ┤ļÅä 71%ļĪ£ ņśłņĖĪļÉśņŚłļŗż[3].
2023ļģä 4ņøö Ēśäņ×¼ ĒĢ£ĻĄŁņŚÉņä£ TSI bioassayļŖö ļŗżņØīņØś Ļ▓ĮņÜ░ ĻĖēņŚ¼ ļīĆņāüņØ┤ļŗż: 1) Ļ░æņāüņäĀņżæļÅģņ”ØņŚÉņä£ TBII ņĖĪņĀĢļ¦īņ£╝ļĪ£ ĻĘĖļĀłņØ┤ļĖīņŖżļ│æ ņ¦äļŗ©ņØ┤ ņĢĀļ¦żĒĢ£ Ļ▓ĮņÜ░, 2) ĻĘĖļĀłņØ┤ļĖīņŖżļ│æņŚÉņä£ Ļ░æņāüņäĀĻĖ░ļŖźĒĢŁņ¦äņ”ØĻ│╝ Ļ░æņāüņäĀĻĖ░ļŖźņĀĆĒĢśņ”ØņØ┤ ļ░śļ│ĄļÉśĻ▒░ļéś TAOņØś Ļ▓ĮĻ│╝ Ļ┤Ćņ░░, ņĢĮņĀ£ Ēł¼ņŚ¼ ņżæļŗ© ņĀä ņ×¼ļ░£ ņŚ¼ļČĆ ĒÅēĻ░Ć, 3) ĻĘĖļĀłņØ┤ļĖīņŖżļ│æ ļ│æļĀźņØ┤ ņ׳ļŖö ņ×äņé░ļČĆņØś ņ×äņŗĀ 3ĻĖ░ ļ░Å Ļ░ÖņØĆ ņé░ļ¬©ņŚÉņä£ Ēā£ņ¢┤ļé£ ņŗĀņāØņĢäņØś ņĖĪņĀĢ, 4) ņŗĀņāØņĢä ņäĀļ│ä Ļ▓Ćņé¼ Ļ▓░Ļ│╝ Ļ░æņāüņäĀĻĖ░ļŖźņĀĆĒĢśņ”ØņØ┤ ņØśņŗ¼ļÉśļŖö ņŗĀņāØņĢäļĪ£ņä£ ņ×ÉĻ░Ćļ®┤ņŚŁņä▒ Ļ░æņāüņäĀ ņ¦łĒÖśņØ┤ ņ׳ļŖö ņé░ļ¬©ņŚÉņä£ Ēā£ņ¢┤ļé£ Ļ▓ĮņÜ░. TSI bioassay ņ¦äļŗ© ņŗ£ 1ĒÜī, ņČöņĀü Ļ▓Ćņé¼ ņŗ£ ņŚ░ 1ĒÜī ĻĖēņŚ¼ ņØĖņĀĢņØ┤ ļÉ£ļŗż[11].
ĒĢŁĻ░æņāüņäĀĻ│╝ņé░ĒÖöĒÜ©ņåīĒĢŁņ▓┤(anti-thyroid peroxidase antibody, TPOĒĢŁņ▓┤)ļŖö Ļ░æņāüņäĀĒśĖļź┤ļ¬¼ņØś ĒĢ®ņä▒ņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö ĒÜ©ņåīņØĖ TPOņŚÉ ļīĆĒĢ£ ĒĢŁņ▓┤ņØ┤ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ TPOĒĢŁņ▓┤ļŖö ĒĢśņŗ£ļ¬©ĒåĀ Ļ░æņāüņäĀņŚ╝Ļ│╝ Ļ░ÖņØĆ ņ×ÉĻ░Ćļ®┤ņŚŁ Ļ░æņāüņäĀņŚ╝Ļ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ņ£╝ļ®░ ņØ┤ļŖö ļ│┤ĒåĄ Ļ░æņāüņäĀĻĖ░ļŖźņĀĆĒĢśņ”Øņ£╝ļĪ£ ņØ┤ņ¢┤ņ¦ł ņłś ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī TPOĒĢŁņ▓┤ļŖö 70-80%ņØś ĻĘĖļĀłņØ┤ļĖīņŖżļ│æ ĒÖśņ×ÉņŚÉņä£ļÅä Ļ▓ĆņČ£ļÉ£ļŗż[12]. ĒĢŁĻ░æņāüņäĀĻĖĆļĪ£ļČłļ”░ĒĢŁņ▓┤(anti-thyroglobulin antibody, TgĒĢŁņ▓┤)ļŖö Ļ░æņāüņäĀĒśĖļź┤ļ¬¼ņØś ļŗ©ļ░▒ņ¦ł ņĀäĻĄ¼ņ▓┤ņØĖ TgņŚÉ ļīĆĒĢ£ ĒĢŁņ▓┤ļĪ£ TgĒĢŁņ▓┤ņØś ņ”ØĻ░Ć ļśÉĒĢ£ ņ×ÉĻ░Ćļ®┤ņŚŁņä▒ Ļ░æņāüņäĀņŚ╝Ļ│╝ Ļ░æņāüņäĀĻĖ░ļŖźņĀĆĒĢśņ”ØņØś ļ░£ļ│æ ņ£äĒŚś ņ”ØĻ░ĆņÖĆ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗż. ļ│┤ĒåĄ TgĒĢŁņ▓┤ļŖö ņ×ÉĻ░Ćļ®┤ņŚŁņä▒ Ļ░æņāüņäĀ ņ¦łĒÖś ĒÖśņ×ÉņŚÉņä£ TPOĒĢŁņ▓┤ņÖĆ ĒĢ©Ļ╗ś ļéśĒāĆļé£ļŗż. Ļ░æņāüņäĀ ņ¦łĒÖśņØś ņ£äĒŚś ņØĖņ×ÉĻ░Ć ņŚåļŖö ņĀĢņāü ņé¼ļ×īļōż ņżæ 3%ļ¦īņØ┤ TgĒĢŁņ▓┤ļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ņŚłļŗż.
ļ¬ćļ¬ć ņŚ░ĻĄ¼ņŚÉņä£ TPOĒĢŁņ▓┤ļéś TgĒĢŁņ▓┤Ļ░Ć ĒĢŁĻ░æņāüņäĀņĀ£ ņżæļŗ© ņØ┤Ēøä ĻĘĖļĀłņØ┤ļĖīņŖżļ│æņØś ņ×¼ļ░£Ļ│╝ Ļ┤ĆĻ│äļÉ£ļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ļŗż. ĻĘĖļĀłņØ┤ļĖīņŖżļ│æ ĒÖśņ×É 204ļ¬ģņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ TPOĒĢŁņ▓┤Ļ░Ć Ļ▓ĆņČ£ļÉśņ¦Ć ņĢŖņØĆ ĒÖśņ×ÉĻ░Ć Ļ▓ĆņČ£ļÉ£ ĒÖśņ×Éļ│┤ļŗż ĻĘĖļĀłņØ┤ļĖīņŖżļ│æņØś ņ×¼ļ░£ ĒÖĢļźĀņØ┤ ņĢĮ 2ļ░░ ļåÆņĢśļŗż(odds ratio, 2.21) [13]. ĒĢ£ĻĄŁņŚÉņä£ ņ¦äĒ¢ēļÉ£ ĒøäĒ¢ź ņŚ░ĻĄ¼ņŚÉņä£ TPOĒĢŁņ▓┤ ņ¢æņä▒ņØĖ ĻĘĖļĀłņØ┤ļĖīņŖżļ│æ ĒÖśņ×É 38ļ¬ģņŚÉņä£ ĒĢŁĻ░æņāüņäĀņĀ£ ņ╣śļŻī Ēøä TPOĒĢŁņ▓┤ Ēś╣ņØĆ TgĒĢŁņ▓┤ņØś ņ”ØĻ░ĆļŖö ĻĘĖļĀłņØ┤ļĖīņŖżļ│æņØś ņ×¼ļ░£ Ļ░ÉņåīņÖĆ ņŚ░Ļ┤ĆņØ┤ ņ׳ļŗżļŖö Ļ▓░Ļ│╝Ļ░Ć ļ│┤Ļ│ĀļÉśņŚłļŗż[14]. ņ¢ĖĻĖēļÉ£ ņŚ░ĻĄ¼ ļ░Å ļŗżļźĖ ļ¬ćļ¬ć ņŚ░ĻĄ¼ļōżņŚÉņä£ļŖö ļåÆņØĆ TPOĒĢŁņ▓┤ Ēś╣ņØĆ TgĒĢŁņ▓┤ļź╝ Ļ░Ćņ¦ä ĒÖśņ×ÉļōżņŚÉņä£ ĒĢŁĻ░æņāüņäĀņĀ£ ņ╣śļŻī Ēøä ņ×¼ļ░£ņØ┤ Ļ░ÉņåīĒĢśĻ▒░ļéś ņŗ¼ņ¦Ćņ¢┤ Ļ░æņāüņäĀĻĖ░ļŖźņĀĆĒĢśņ”Øņ£╝ļĪ£ ņ¦äĒ¢ēļÉśļŖö Ļ▓āņØä ļ│┤ņśĆļŗż. ņØ┤ļŖö TPOĒĢŁņ▓┤ Ēś╣ņØĆ TgĒĢŁņ▓┤Ļ░Ć ļåÆņØĆ ĒÖśņ×ÉļōżņŚÉĻ▓īņä£ ĻĘĖļĀłņØ┤ļĖīņŖżļ│æņØ┤ ņĀÉņ¦äņĀüņ£╝ļĪ£ ļ¦īņä▒ Ļ░æņāüņäĀņŚ╝ņ£╝ļĪ£ ļ░£ņĀäĒĢśĻ│Ā, ņØ┤Ļ▓āņØ┤ Ļ░æņāüņäĀĻĖ░ļŖźņĀĆĒĢśņ”Øņ£╝ļĪ£ ņØ┤ņ¢┤ņ¦ł ņłś ņ׳ņØīņØä ņŗ£ņé¼ĒĢ£ļŗż. ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśĻ▓Āņ£╝ļéś, ņØ┤ļ¤¼ĒĢ£ ņ×ÉĻ░ĆĒĢŁņ▓┤ņØś ļ│ĆĒÖöļŖö ĒĢŁĻ░æņāüņäĀņĀ£ņØś ļ®┤ņŚŁ ņĪ░ņĀł ĒÜ©Ļ│╝ļź╝ ņŗ£ņé¼ĒĢśļ®░ ņ×ÉĻ░Ćļ®┤ņŚŁ Ļ░æņāüņäĀ ņ¦łĒÖśņØś ĒÖ£ņä▒ ņĀĢļÅäļź╝ ļ¬©ļŗłĒä░ļ¦üĒĢśĻĖ░ ņ£äĒĢ┤ ĒĢŁņ▓┤ ņŚŁĻ░ĆņØś ņ×Āņ×¼ņĀü ņé¼ņÜ®ņŚÉ ļīĆĒĢ£ ĻĘ╝Ļ▒░ļź╝ ņĀ£ņŗ£ĒĢ£ļŗż.
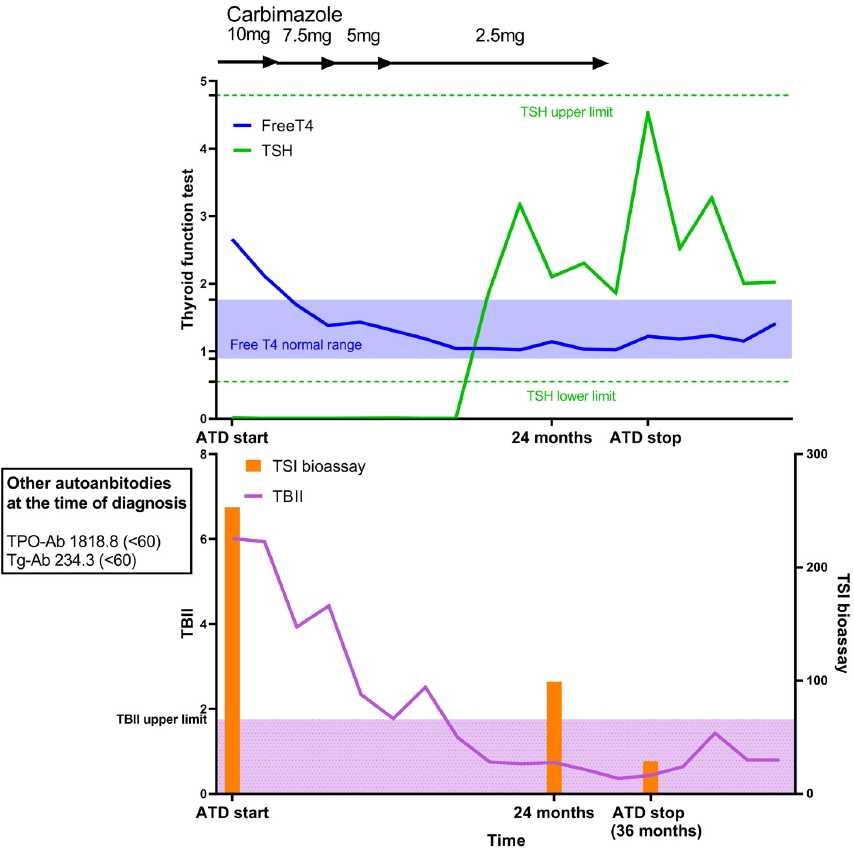
47ņäĖ ņŚ¼ņ×ÉĻ░Ć ņāüĻĖ░ļÅä Ļ░ÉņŚ╝ ņØ┤Ēøä ļ¬® ļČłĒÄĖĻ░Éņ£╝ļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. ļ¬®ņåīļ”¼ ļ│ĆĒÖö, ņŚ┤Ļ░É, ņŗØņØĆļĢĆ, ņ¢┤ņ¦Ćļ¤¼ņøĆ ļ░Å Ļ░ĆņŖ┤ ļæÉĻĘ╝Ļ▒░ļ”╝ņØ┤ ļÅÖļ░śļÉśņŚłņ£╝ļ®░ ņŗĀņ▓┤ Ļ▓Ćņ¦äņŚÉņä£ ĒÖśņ×ÉņØś Ļ░æņāüņäĀņØ┤ ņ╗żņĀĖ ņ׳ņŚłļŗż(70-80 g). ĒÖśņ×ÉņØś ĒśłņĢĢņØĆ 117/60 mmHgņśĆĻ│Ā ļ¦źļ░ĢņØĆ ļČäļŗ╣ 90ĒÜīļĪ£ ņĖĪņĀĢļÉśņŚłļŗż. ĒśłņĢĪ Ļ▓Ćņé¼ņŚÉņä£ ņ£Āļ”¼T4 (free thyroxine, free T4) ņłśņ╣ś 2.66 ng/dL (ņ░ĖĻ│Āņ╣ś, 0.82-1.76 ng/dL), TSH 0.013 ╬╝IU/mL (ņ░ĖĻ│Āņ╣ś, 0.55-4.78 ╬╝IU/mL)ļĪ£ Ļ░æņāüņäĀņżæļÅģņ”ØņØ┤ ĒÖĢņØĖļÉśņŚłļŗż. ņČöĻ░ĆļĪ£ Ļ░æņāüņäĀ ņ×ÉĻ░ĆĒĢŁņ▓┤ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśĻ│Ā, ļ▓ĀĒāĆņ░©ļŗ©ņĀ£ņØĖ ĒöäļĪ£ĒöäļØ╝ļåĆļĪż(propranolol) 60 mgņ£╝ļĪ£ ļ¦źļ░Ģņłśļź╝ ļé«ņČöņŚłļŗż. ņłśņØ╝ Ēøä ĒÖĢņØĖļÉ£ ņ×ÉĻ░ĆĒĢŁņ▓┤ ņłśņ╣śļŖö ļŗżņØīĻ│╝ Ļ░Öļŗż: TBII 6.01 IU/L (ņ░ĖĻ│Āņ╣ś, < 1.75 IU/L), TSI bioassay 253 SRR% (ņ░ĖĻ│Āņ╣ś, < 140 SRR%), TPOĒĢŁņ▓┤ 1,818.8 U/mL (ņ░ĖĻ│Āņ╣ś, < 60 U/mL), TgĒĢŁņ▓┤ 234.3 U/mL (ņ░ĖĻ│Āņ╣ś, < 60 U/mL). ĒÖśņ×ÉņØś ņ×äņāü ņ”ØņāüĻ│╝ ĒśłņĢĪ Ļ░æņāüņäĀĻĖ░ļŖź Ļ▓Ćņé¼ ļ░Å Ļ░æņāüņäĀ ņ×ÉĻ░ĆĒĢŁņ▓┤ Ļ▓Ćņé¼ Ļ▓░Ļ│╝ļź╝ ĒåĀļīĆļĪ£ ĻĘĖļĀłņØ┤ļĖīņŖżļ│æņØä ņ¦äļŗ©ĒĢśĻ│Ā ĒĢŁĻ░æņāüņäĀņĀ£ņØĖ ņ╣┤ļ╣äļ¦łņĪĖ(carbimazole) 10 mgņØä ņŗ£ņ×æĒĢśņśĆļŗż. ĒĢ£ ļŗ¼ Ļ░äĻ▓®ņ£╝ļĪ£ ņČöņĀüĒĢśņśĆņØä ļĢī, ĒÖśņ×ÉņØś ņ×äņāü ņ”ØņāüņØĆ ĒśĖņĀäņØä ļ│┤ņśĆĻ│Ā free T4 ņłśņ╣śļÅä ĒśĖņĀäņØä ļ│┤ņśĆļŗż. ĒĢŁĻ░æņāüņäĀņĀ£ ņ╣śļŻī ņŗ£ņ×æ Ēøä 24Ļ░£ņøöņŚÉ, ĒĢŁĻ░æņāüņäĀņĀ£ļŖö 2.5 mgĻ╣īņ¦Ć Ļ░Éļ¤ēĒĢśņśĆĻ│Ā, Ļ░æņāüņäĀ ĻĖ░ļŖźņØĆ ņĀĢņāüņØ┤ņŚłņ£╝ļ®░(free T4, 1.04 ng/dL; TSH, 2.102 ╬╝IU/mL), TBII ņłśņ╣ś(0.738 IU/L) ļśÉĒĢ£ ņĀĢņāüņØ┤ņŚłļŗż. ņØ┤ņŚÉ ĒĢŁĻ░æņāüņäĀņĀ£ ņżæļŗ©ņØä Ļ│ĀļĀżĒĢśņŚ¼ TSI bioassayļź╝ ņĖĪņĀĢĒĢśņśĆļŖöļŹ░, ņĖĪņĀĢ Ļ▓░Ļ│╝ 99 SRR%ļĪ£ ņĀĢņāü ņ░ĖĻ│Āņ╣ś ņØ┤ĒĢśņśĆņ£╝ļéś ņĢĮņĀ£ ņżæļŗ©ņØä Ļ│ĀļĀżĒĢśņśĆņØä ļĢīļŖö ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉśņ¢┤ ņĢĮņĀ£ļź╝ ņ¦ĆņåŹĒĢśņśĆļŗż. ĻĘĖļĪ£ļČĆĒä░ 12Ļ░£ņøö Ēøä, ņ╣śļŻī ņŗ£ņ×æ 36Ļ░£ņøöņ¦ĖņŚÉ TSI bioassayĻ░Ć 29 SRR%ļĪ£ ĒÖĢņŚ░Ē׳ ļé«ņĢäņ¦ä Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆĻ│Ā, ļ│æņØś ĒÖ£ņä▒ļÅäĻ░Ć ņČ®ļČäĒ׳ ļ¢©ņ¢┤ņ¦ä Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉśņ¢┤ ĒĢŁĻ░æņāüņäĀņĀ£ļź╝ ņżæļŗ©ĒĢśņśĆļŗż. ņØ┤Ēøä 2ļģä ļÅÖņĢł ņČöņĀü Ļ┤Ćņ░░ ņŗ£ ļ│æņØś ņ×¼ļ░£ ņŚåņØ┤ ņĀĢņāü Ļ░æņāüņäĀ ĻĖ░ļŖźņØä ņ£Āņ¦ĆĒĢśņśĆļŗż(Fig. 1).
68ņäĖ ņŚ¼ņ×É ĒÖśņ×ÉĻ░Ć Ļ░ĆņŖ┤ ļæÉĻĘ╝Ļ▒░ļ”╝Ļ│╝ ņåÉļ¢©ļ”╝ ņ”Øņāüņ£╝ļĪ£ ņÖĖļל ļ░®ļ¼ĖĒĢśņśĆļŗż. ĒÖśņ×ÉļŖö ĒĢśņŗ£ļ¬©ĒåĀ Ļ░æņāüņäĀņŚ╝ņ£╝ļĪ£ ĒāĆ ļ│æņøÉņŚÉņä£ ņ▓śļ░®ļ░øņØĆ levothyroxine 100 ╬╝gņØä ļ│ĄņÜ® ņżæņØ┤ņŚłļŗż. ņŗ£Ē¢ēĒĢ£ ĒśłņĢĪ Ļ▓Ćņé¼ņŚÉņä£ free T4 ņłśņ╣ś 1.79 ng/dL (ņ░ĖĻ│Āņ╣ś, 0.82-1.76 ng/dL), TSH 0.051 ╬╝IU/mL (ņ░ĖĻ│Āņ╣ś, 0.55-4.78 ╬╝IU/mL)ļĪ£ Ļ░æņāüņäĀņżæļÅģņ”ØņØ┤ ĒÖĢņØĖļÉśņŚłļŗż. TPOĒĢŁņ▓┤ 3,259.6 U/mL (ņ░ĖĻ│Āņ╣ś, < 60 U/mL) TgĒĢŁņ▓┤ 2,389.2 U/mL (ņ░ĖĻ│Āņ╣ś, < 60 U/mL)ļĪ£ ņ”ØĻ░ĆļÉśņ¢┤ ĒĢśņŗ£ļ¬©ĒåĀ Ļ░æņāüņäĀņŚ╝ ņØśņŗ¼ļÉśņŚłņ£╝ļéś, TBII ļśÉĒĢ£ 38.53 IU/L (ņ░ĖĻ│Āņ╣ś, < 1.75 IU/L)ļĪ£ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłļŗż. ņØ┤ņŚÉ ĻĘĖļĀłņØ┤ļĖīņŖżļ│æ Ļ░Éļ│äņØä ņ£äĒĢśņŚ¼ TSI bioassayļź╝ ņĖĪņĀĢĒĢśņśĆņ£╝ļ®░, 31% (ņ░ĖĻ│Āņ╣ś, < 140%)ļĪ£ ņĖĪņĀĢļÉśņŚłļŗż. ņØ┤ļŖö ņĀĢņāü ņåīĻ▓¼ņ£╝ļĪ£, ĒÖśņ×ÉņØś Ļ░æņāüņäĀņżæļÅģņ”ØņØś ņøÉņØĖņØĆ ĻĘĖļĀłņØ┤ļĖīņŖżļ│æņØ┤ ņĢäļŗī ĒĢśņŗ£ļ¬©ĒåĀ Ļ░æņāüņäĀņŚ╝ņ£╝ļĪ£ ĒīÉļŗ©ļÉśļ®░, ņ”ØĻ░ĆļÉ£ TBIIļŖö ņ£äņ¢æņä▒ņ£╝ļĪ£ TSHĻ░Ć ņĀĢņāü Ļ░æņāüņäĀ ņäĖĒżņØś TSH ņłśņÜ®ņ▓┤ņŚÉ ņ×æņÜ®ĒĢśļŖö Ļ▓āņØä ļ¦ēļŖö ņ░©ļŗ© ĒĢŁņ▓┤(thyroid stimulation blocking antibody, TSBAb)ļĪ£ ņČöņĀĢĒĢĀ ņłś ņ׳ņŚłļŗż. ņØ┤ņŚÉ ĒĢŁĻ░æņāüņäĀņĀ£ ņé¼ņÜ® ņŚåņØ┤ levothyroxineņØä 50 ╬╝gņ£╝ļĪ£ Ļ░Éļ¤ēĒĢśņŚ¼ ņČöņĀüĒĢśņśĆļŗż. ĒĢ£ ļŗ¼ Ēøä Ļ▓Ćņé¼ņŚÉņä£ free T4 1.08 ng/dL (ņ░ĖĻ│Āņ╣ś, 0.82-1.76 ng/dL), TSH 18.38 ╬╝IU/mL (ņ░ĖĻ│Āņ╣ś, 0.55-4.78 ╬╝IU/mL)ļĪ£ Ļ░æņāüņäĀĻĖ░ļŖźņĀĆĒĢśņ”ØņØä ļ│┤ņŚ¼ 2-3Ļ░£ņøöļ¦łļŗż levothyroxineņØä ņĀÉņ░© ņ”Øļ¤ēĒĢśņśĆļŗż. ņØ┤Ēøä TBIIļŖö 21.72 IU/LĻ╣īņ¦Ć ņĀÉņ░© Ļ░ÉņåīļÉśļŖö ņČöņäĖļź╝ ļ│┤ņśĆņ£╝ļ®░, ĒÖśņ×ÉņØś Ļ░æņāüņäĀĻĖ░ļŖźņĀĆĒĢśņ”ØņŚÉ ļīĆĒĢśņŚ¼ Ļ░æņāüņäĀĒśĖļź┤ļ¬¼ņØä ļ│┤ņČ®ĒĢśļ®░ ņČöņĀü Ļ┤Ćņ░░ ņżæņØ┤ļŗż.
ĻĘĖļĀłņØ┤ļĖīņŖżļ│æņŚÉņä£ TSHRAb ņĖĪņĀĢņØĆ ņ¦äļŗ© ļ░Å ņśłĒøä ņśłņĖĪņŚÉ ņżæņÜöĒĢśļŗż. ņĄ£ĻĘ╝ TSI bioassay ņĖĪņĀĢņØ┤ ĻĘĖļĀłņØ┤ļĖīņŖżļ│æņØś ņ¦äļŗ© ļ░Å ņśłĒøäļź╝ ņśłņĖĪĒĢśļŖö ļŹ░ ņČöĻ░ĆņĀüņØĖ ņĀĢļ│┤ļź╝ ņĀ£Ļ│ĄĒĢśĻ│Ā ņ׳ļŗż. ļśÉĒĢ£, TPOĒĢŁņ▓┤ Ēś╣ņØĆ TgĒĢŁņ▓┤ ļō▒ņØś Ļ░æņāüņäĀ ņ×ÉĻ░ĆĒĢŁņ▓┤Ļ░Ć ĒÖśņ×ÉņØś ņ×äņāü Ļ▓ĮĻ│╝ļź╝ ņśłņĖĪĒĢśļŖö ļŹ░ ļ│┤ņĪ░ņĀü ņŚŁĒĢĀņØä ĒĢ£ļŗż. ņ£äņØś ļé┤ņÜ®ņØä ļ░öĒāĢņ£╝ļĪ£ ņ×äņāüņØśņé¼ļŖö ĻĘĖļĀłņØ┤ļĖīņŖżļ│æņŚÉņä£ ļéśĒāĆļéśļŖö ĒÖśņ×ÉņØś ļŗżņ¢æĒĢ£ ņ×äņāü ņ”Øņāü ļ░Å ņāüĒÖ®ņØä Ļ│ĀļĀżĒĢśņŚ¼ Ļ░æņāüņäĀ ņ×ÉĻ░ĆĒĢŁņ▓┤ ņłśņ╣śļź╝ ĒĢ┤ņäØĒĢ┤ņĢ╝ ĒĢ£ļŗż.
REFERENCES
1. Ross DS, Burch HB, Cooper DS, et al. 2016 American Thyroid Association guidelines for diagnosis and management of hyperthyroidism and other causes of thyrotoxicosis. Thyroid 2016;26:1343ŌĆō1421.


3. Baek HS, Lee J, Jeong CH, et al. The prediction model using thyroid-stimulating immunoglobulin bioassay for relapse of Graves' disease. J Endocr Soc 2022;6:bvac023.



4. Lytton SD, Kahaly GJ. Bioassays for TSH-receptor autoantibodies: an update. Autoimmun Rev 2010;10:116ŌĆō122.


5. Tozzoli R, Bagnasco M, Giavarina D, Bizzaro N. TSH receptor autoantibody immunoassay in patients with Graves' disease: improvement of diagnostic accuracy over different generations of methods. Systematic review and meta-analysis. Autoimmun Rev 2012;12:107ŌĆō113.


6. Woo YJ, Jang SY, Lim TH, Yoon JS. Clinical association of thyroid stimulating hormone receptor antibody levels with disease severity in the chronic inactive stage of Graves' orbitopathy. Korean J Ophthalmol 2015;29:213ŌĆō219.



7. Lee JI, Jang HW, Kim SK, et al. Diagnostic value of a chimeric TSH receptor (Mc4)-based bioassay for Graves' disease. Korean J Intern Med 2011;26:179ŌĆō186.



8. Kahaly GJ. Management of Graves thyroidal and extrathyroidal disease: an update. J Clin Endocrinol Metab 2020;105:3704ŌĆō3720.



9. Jeon H, Lee JY, Kim YJ, Lee MJ. Clinical relevance of thyroid-stimulating immunoglobulin as a biomarker of the activity of thyroid eye disease. Eye (Lond) 2023;37:543ŌĆō547.


10. Kwon H, Kim WG, Jang EK, et al. Usefulness of measuring thyroid stimulating antibody at the time of antithyroid drug withdrawal for predicting relapse of Graves disease. Endocrinol Metab (Seoul) 2016;31:300ŌĆō310.



11. Health Insurance Review & Assessment Service (HIRA). Health insurance benefit expenses (February 2022) [Internet]. Wonju (KR): HIRA, c2022 [cited 2023 Apr 6]. Available from:
https://repository.hira.or.kr/handle/2019.oak/2964
12. Cho BY. Clinical Thyroidology. 4th ed. Seoul: Korea Medical Book Publishing Company, 2014:139.
Changes of thyroid function tests and thyroid autoantibodies during ATD treatment in case 1 patient. TSH, thyroid stimulating hormone; Free T4; free thyroxine; ATD, anti-thyroid drug; TSI, thyroid stimulating immunoglobulin; TBII, TSH-binding inhibitory immunoglobulin; TPO-Ab, thyroperoxidase antibody; Tg-Ab, thyroglobulin antibody.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




