 |
 |
| Korean J Med > Volume 97(4); 2022 > Article |
|
요약
목적
방법
결과
결론
Abstract
Background/Aims
Methods
Results
Notes
FUNDING
This study was supported by grants of The Korean Health Technology R & D Project, Ministry of Health & Welfare (HI13C1527) and the Research of Korea Centers for Disease Control and Prevention (2016-ER6304-01), Republic of Korea
AUTHOR CONTRIBUTIONS
Conceptualization – Eun Young Cho
Data curation – Eun Young Cho, Hyung Yoon Kim
Formal analysis – Eun Young Cho
Investigation – Eun Young Cho, Myung Ho Jeong
Writing – original draft: Eun Young Cho
Writing – review & editing: Eun Young Cho, Myung Ho Jeong, Hyung Yoon Kim, Hyuk Jin Park, Hyun Ju Yoon, Kye Hun Kim, Young Keun Ahn
REFERENCES

Figure 1.
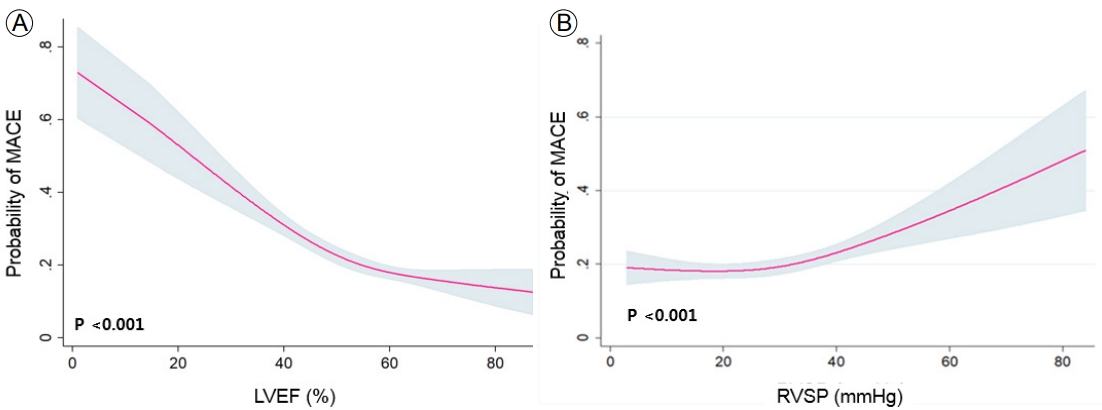
Figure 2.
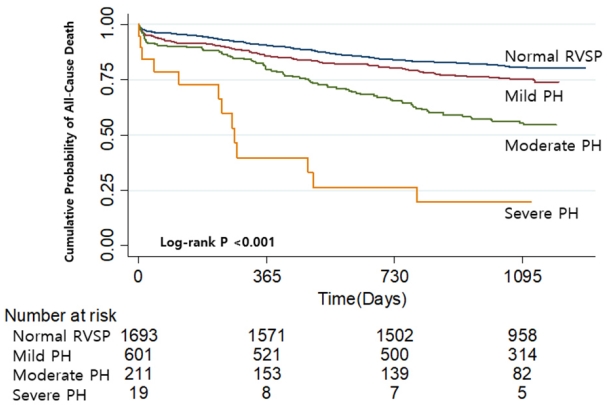
Figure 3.
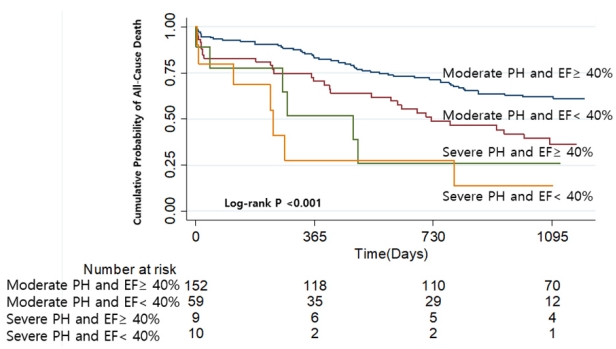
Figure 4.
Table 1.
Table 2.
Values are presented as number (%) or mean±standard deviation.
HDL, high-density lipoprotein; LDL, low-density lipoprotein; Hs-CRP, high-sensitivity C-reactive protein; CK, creatine kinase; CKMB, creatine kinase Myoglobin; NT-pro-BNP, N-terminal pro-brain natriuretic peptide; HbA1c, hemoglobin A1C; PRU, P2Y12 reaction units; ARU, aspirin reaction units; RVSP, right ventricular systolic pressure; PH, pulmonary hypertension.
Table 3.
Values are presented as number (%) or mean±standard deviation.
RVSP, right ventricular systolic pressure; PH, pulmonary hypertension; ACC, American College of Cardiology; AHA, American Heart Association; DES, dual eluting stent; PCI, percutaneous coronary intervention; TIMI, thrombolysis in myocardial infarction; ACEI, angiotensin-converting enzyme inhibitor; ARB, angiotensin II receptor blocker.
Table 4.
Values are presented as number (%) or mean±standard deviation.
LV EF, left ventricular ejection fraction; LVESD, left ventricular end-systolic dimension; LVEDD, left ventricular end-diastolic dimension; LAD, left atrial dimension; DT, Deceleration time; e', early septal mitral annular velocity; E/e', ratio of early transmitral velocity to early septal mitral annular velocity; RVSP, right ventricular systolic pressure; PH, pulmonary hypertension.
Table 5.
Table 6.
| Variable |
MACE |
|
||||
|---|---|---|---|---|---|---|
|
Univariate |
Multivariate |
|||||
| HRa | 95% CI | p-value | HRa | 95% CI | p-value | |
| Normal RVSP (reference) | 1 | 1 | ||||
| Mild PH | 1.350 | 1.109-1.642 | 0.003 | 1.077 | 0.879-1.318 | 0.473 |
| Moderate PH | 2.629 | 2.064-3.348 | < 0.001 | 1.663 | 1.283-2.154 | < 0.001 |
| Severe PH | 7.566 | 4.337-13.197 | < 0.001 | 2.943 | 1.650-5.246 | < 0.002 |
| Sex (male) | 1.371 | 1.153-1.628 | < 0.001 | 0.954 | 0.791-1.149 | 0.616 |
| Age > 65 | 2.200 | 1.836-2.636 | < 0.001 | 1.660 | 1.359-2.027 | < 0.001 |
| High Killip class (≥ III) | 2.708 | 2.219-3.305 | < 0.001 | 1.754 | 1.413-2.177 | < 0.001 |
| LV EF < 40% | 2.694 | 2.192-3.310 | < 0.001 | 1.767 | 1.408-2.216 | < 0.001 |
| E/e' ratio ≥ 15 | 1.714 | 1.441-2.037 | < 0.001 | 1.058 | 0.874-1.281 | 0.561 |
| Hypertension | 1.807 | 1.517-2.151 | < 0.001 | 1.362 | 1.128-1.644 | < 0.001 |
| Diabetes mellitus | 1.754 | 1.481-2.076 | < 0.001 | 1.329 | 1.128-1.644 | 0.002 |
Table 7.
| Variable |
All-cause death |
|
||||
|---|---|---|---|---|---|---|
|
Univariate |
Multivariate |
|||||
| HRa | 95% CI | p-value | HRa | 95% CI | p-value | |
| Normal RVSP (reference) | 1.000 | 1.000 | ||||
| Mild PH | 1.752 | 1.331-2.306 | < 0.001 | 1.163 | 0.877- 1.542 | 0.294 |
| Moderate PH | 4.224 | 3.111-5.734 | < 0.001 | 1.938 | 1.395-2.690 | < 0.001 |
| Severe PH | 11.782 | 6.188-22.433 | < 0.001 | 2.619 | 1.334-5.141 | 0.005 |
| Sex (male) | 1.698 | 1.342-2.146 | < 0.001 | 0.969 | 0.754-1.243 | 0.802 |
| Age > 65 (n/%) | 5.289 | 3.824-7.314 | < 0.001 | 3.719 | 2.634-5.249 | < 0.001 |
| High Killip class (≥ III) | 4.612 | 3.604-5.900 | < 0.001 | 2.390 | 1.824-3.130 | < 0.001 |
| LV EF < 40% | 4.703 | 3.659-6.042 | < 0.001 | 2.499 | 1.886-3.310 | < 0.001 |
| E/e' ratio ≥ 15 | 2.322 | 1.838-2.932 | < 0.001 | 1.076 | 0.833-1.388 | 0.573 |
| Hypertension | 2.012 | 1.566-2.583 | < 0.001 | 1.206 | 0.921-1.578 | 0.173 |
| Diabetes mellitus | 1.996 | 1.581-2.518 | < 0.001 | 1.310 | 1.027-1.671 | 0.030 |
| Dyslipidemia | 0.564 | 0.323-0.983 | 0.043 | 0.805 | 0.459-1.411 | 0.449 |



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




