 |
 |
| Korean J Med > Volume 96(2); 2021 > Article |
|
ņÜöņĢĮ
ļ¬®ņĀü
ņåīĒÖöļČłļ¤ēņØĆ ĒØöĒĢśĻ▓ī ņĀæĒĢśļŖö ņ”Øņāüņ£╝ļĪ£ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØĆ ņāüļČĆņ£äņןĻ┤Ć ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼, ĒśłņĢĪ Ļ▓Ćņé¼ ļśÉļŖö ņśüņāüņØśĒĢÖ Ļ▓Ćņé¼ņŚÉņä£ ĻĖ░ņ¦łņĀü ņøÉņØĖņØ┤ ņŚåņ£╝ļ®░, ņāüļ│ĄļČĆņŚÉ ļ░£ņāØĒĢśļŖö ļŗżņ¢æĒĢ£ ņ”ØņāüļōżņØś ļ│ĄĒĢ®ņ▓┤ņØ┤ļŗż. ļŗżņ¢æĒĢ£ ļ│æĒā£ņāØļ”¼ļź╝ ļ│┤ņØ┤ļŖö ņ¦łļ│æņØś ĒŖ╣ņä▒ ļĢīļ¼ĖņŚÉ ĻĖ░ņĪ┤ņØś ņ╣śļŻī ņĀäļץņŚÉ ļīĆĒĢ£ ĒÜ©Ļ│╝ļŖö Ēü¼ņ¦Ć ņĢŖļŗż. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņŚÉ Ļ┤ĆĒĢ£ ĻĖ░ņĪ┤ ņ¦Ćņ╣©ņØä ņĄ£ņŗĀ ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢśņŚ¼ ļ│┤ņÖäĒĢ©ņ£╝ļĪ£ ņØ╝ņäĀ ņ¦äļŻīņŚÉ ļÅäņøĆņØä ņŻ╝Ļ│Āņ×É ĒĢśņśĆļŗż.
ļ░®ļ▓Ģ
Ļ░£ļ░£ņ£äņøÉĒÜīļź╝ ĻĄ¼ņä▒ĒĢśņŚ¼, ņ¦äļŗ©Ļ│╝ ņ╣śļŻīņØś Ļ░ü ĒĢŁļ¬®ņŚÉ ļīĆĒĢ£ ņ┤łņĢłņØä ņ×æņä▒ĒĢśĻ│Ā ļŗżņ¢æĒĢ£ ņŚ░ĻĄ¼, ņ¦Ćņ╣©, ļ¼┤ņ×æņ£ä ļīĆņĪ░ņŗ£ĒŚśņŚÉ ļīĆĒĢ£ ņ▓┤Ļ│äņĀüņØĖ Ļ▓ĆĒåĀņÖĆ ļ®öĒāĆļČäņäØņØä ĒåĄĒĢ┤ ņ¦äļŗ©Ļ│╝ ņ╣śļŻīņŚÉ ļīĆĒĢ£ Ļ░ü ĒĢŁļ¬®ņØä ņÖäņä▒ĒĢśņśĆļŗż. ņäĀņĀĢļÉ£ ņĀäļ¼ĖĻ░ĆņŚÉ ņØśĒĢ┤ ņÖĖļČĆ Ļ▓ĆĒåĀĻ░Ć ņłśĒ¢ēļÉśņŚłļŗż. ņØ┤ļ▓ł ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ņ×äņāü ņ¦äļŻī ņ¦Ćņ╣©ņØĆ ļīĆĒĢ£ņåīĒÖöĻĖ░ĻĖ░ļŖźņä▒Ōŗģņ¦łĒÖśņÜ┤ļÅÖĒĢÖĒÜīĻ░Ć 2011ļģä ļ░£Ēæ£ĒĢ£ ĻĖ░ņĪ┤ņØś ņ×äņāü ņ¦Ćņ╣©ņØä ĻĖ░ļ│Ėņ£╝ļĪ£ ĒĢśņśĆņ£╝ļ®░, ĻĘĖ Ļ░£ņĀĢĒīÉņØś ņØśļ»ĖļĪ£ ņĄ£ĻĘ╝ ļ░£Ēæ£ļÉ£ ņŚ¼ļ¤¼ ņĄ£ņŗĀ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ ļ░öĒāĢņ£╝ļĪ£ ņÖäņä▒ļÉśņŚłļŗż.
Ļ▓░Ļ│╝
ņØ┤ ņ×äņāü ņ¦äļŻī ņ¦Ćņ╣©ņØĆ ļ¦īņä▒ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØ┤ ņ׳ļŖö ņä▒ņØĖņŚÉĻ▓ī ņĀüņÜ®ļÉśļ®░ ņ¦äļŗ©ņ£╝ļĪ£ ņāüļČĆņ£äņןĻ┤Ć ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ņØś ņŚŁĒĢĀ, ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ ņŖżĒü¼ļ”¼ļŗØņŚÉ ļīĆĒĢ┤ ļŗżļŻ©ņŚłņ£╝ļ®░, ņ╣śļŻīņŚÉņä£ļŖö 3Ļ░Ćņ¦Ć ņ╣śļŻī ļ░®ļ▓Ģ(ņ¢æņä▒ņ×ÉĒÄīĒöäņ¢ĄņĀ£ņĀ£, ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ╝ļĪ£ļ”¼ ņĀ£ĻĘĀ ņ╣śļŻīņÖĆ ņé╝ĒÖśĻ│ä ĒĢŁņÜ░ņÜĖņĀ£)ņŚÉ ļīĆĒĢ£ ņ▓┤Ļ│äņĀüņØĖ ļ¼ĖĒŚī Ļ▓ĆĒåĀņÖĆ ļ®öĒāĆļČäņäØņØä ĒåĄĒĢ┤ ņĄ£ņŗĀ ņ¦ĆĻ▓¼ņØä ņåīĻ░£ĒĢśņśĆļŗż. ĒŖ╣Ē׳, ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ĒĢśņ£ä ņ£ĀĒśĢņŚÉ ļö░ļźĖ ņ╣śļŻī ņĀäļץņØä ņĀ£ņŗ£ĒĢśņśĆĻ│Ā, ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£ņŚÉ ļīĆĒĢ£ ļČĆņ×æņÜ®ņØä ņåīĻ░£ĒĢśņŚ¼ ņĢĮļ¼╝ ņ╣śļŻīņØś ņŻ╝ņØśņé¼ĒĢŁņØä Ļ░ĢņĪ░ĒĢśņśĆļŗż.
Abstract
Background/Aims
Functional dyspepsia (FD) is a chronic upper gastrointestinal symptom complex that routine diagnostic work-up, such as endoscopy, blood laboratory analysis, or radiological examination, fails to identify a cause for. It is highly prevalent in the Korean population, and its response to the various available therapeutic strategies is only modest because of the heterogeneous nature of its pathogenesis. We constituted a guidelines development committee to review the existing guidelines on the management of FD.
Methods
This committee drafted statements and conducted a systematic review and meta-analysis of various studies, guidelines, and randomized control trials. External review was also conducted by selected experts. These clinical practice guidelines for FD were developed based on evidence recently accumulated with the revised version of FD guidelines released in 2011 by the Korean Society of Neurogastroenterology and Motility.
Results
These guidelines apply to adults with chronic symptoms of FD and include the diagnostic role of endoscopy, Helicobacter pylori screening, and systematic review and meta-analyses of the various treatment options for FD (proton pump inhibitors, Helicobacter pylori eradication, and tricyclic antidepressants), especially according to the FD subtype.
Conclusions
The purpose of these new guidelines is to aid understanding, diagnosis, and treatment of FD, and the targets of the guidelines are clinicians, healthcare workers at the forefront of patient care, patients, and medical students. The guidelines will continue to be revised and updated periodically.
ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø(functional dyspepsia)ņØĆ ņåīĒÖöņä▒ ĻČżņ¢æ, ņ£äņןĻ┤Ć ņĢģņä▒ņóģņ¢æ, ņ£äņŗØļÅäņŚŁļźś ņ¦łĒÖś ļśÉļŖö ņĘīļŗ┤ļÅä ņ¦łĒÖśĻ│╝ Ļ░ÖņØĆ ĻĖ░ņ¦łņĀüņØĖ ņ¦łĒÖśņØ┤ ņŚåņ£╝ļ®┤ņä£ ņ£äņןĻ┤Ć ņ”ØņāüņØ┤ ļ¦īņä▒ņĀü, ļ░śļ│ĄņĀüņ£╝ļĪ£ ļéśĒāĆļéśļŖö ņ”Øņāüņ”ØĒøäĻĄ░ņØ┤ļŗż. ņĀäĒśĢņĀüņØĖ ņ”Øņāüņ£╝ļĪ£ļŖö ļČłņŠīĒĢ£ ņŗØĒøä Ēżļ¦īĻ░É(bothersome postprandial fullness, ņ£ä ļé┤ņŚÉ ņØīņŗØņØ┤ Ļ│äņåŹ ļé©ņĢäņ׳ļŖö Ļ▓ā Ļ░ÖņØĆ ļČłĒÄĖĒĢ£ ņ”Øņāü), ļČłņŠīĒĢ£ ņĪ░ĻĖ░ ļ¦īļ│ĄĻ░É(bothersome early satiation, ņŗØņé¼ļź╝ ņŗ£ņ×æĒĢśņ×É Ļ│¦ ļ░░Ļ░Ć ļČĆļź┤Ļ│Ā ļŹö ņØ┤ņāü ņŗØņé¼ļź╝ ĒĢĀ ņłś ņŚåļŖö ļŖÉļéī), ļČłņŠīĒĢ£ ņāüļ│ĄļČĆ ĒåĄņ”Ø(bothersome epigastric pain)Ļ│╝ ļČłņŠīĒĢ£ ņāüļ│ĄļČĆ ņō░ļ”╝(bothersome epigastric burning)ņØ┤ ņ׳ļŗż. 2006ļģä Ļ░£ņĀĢļÉ£ ļĪ£ļ¦łĻĖ░ņżĆ IIIņŚÉ ļö░ļź┤ļ®┤ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØĆ ļæÉ Ļ░Ćņ¦Ć ņĢäĒśĢ, ņ”ē ņŗØĒøäĻ│ĀĒåĄņ”ØĒøäĻĄ░(postprandial distress syndrome, PDS)Ļ│╝ ļ¬ģņ╣śĒåĄņ”Øņ”ØĒøäĻĄ░(epigastric pain syndrome, EPS)ņ£╝ļĪ£ ļéśļēśĻ│Ā[1], ņØ┤ļŖö ļĪ£ļ¦łĻĖ░ņżĆ IVņŚÉņä£ļÅä ņ▒äĒāØļÉśņŚłļŗż[2]. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ļæÉ ņĢäĒśĢņØĆ ļ│æĒā£ņāØļ”¼ĻĖ░ņĀäņØ┤ ļŗżļź┤ļŗżĻ│Ā ņČöņĀĢļÉśļ®░ ņØ┤ņŚÉ ļö░ļØ╝ ņ╣śļŻī ņĀæĻĘ╝ļÅä ņ░©ņØ┤Ļ░Ć ņ׳ļŗż. ņŗØņé¼ Ēøä ņ£äņØś ņĀüņØæņןņĢĀ(dysaccommodation), ņ¦ĆņŚ░ļÉ£ ņ£ä ļ░░ņČ£(delayed gastric emptying)Ļ│╝ ļé┤ņן Ļ│╝ļ»╝ņä▒(visceral hypersensitivity)ņØ┤ EPSņÖĆ PDS ļ¬©ļæÉņŚÉ Ļ┤ĆņŚ¼ĒĢśļ®░, EPSņÖĆ PDSĻ░Ć ļÅÖņŗ£ņŚÉ ņ׳ļŖö ņżæļ│Ąņ”ØĒøäĻĄ░ņØś ĒśĢĒā£ļĪ£ ļéśĒāĆļéśĻĖ░ļÅä ĒĢ£ļŗż[2].
ņåīĒÖöļČłļ¤ē ņ”ØņāüņØ┤ ņ׳ļŖö ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ┤ļĪ£ļ”¼(Helicobacter pylori, H. pylori) ņ£äņŚ╝ ĒÖśņ×ÉņŚÉņä£ ņÜ░ņäĀņĀüņ£╝ļĪ£ ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ĒĢśĻ│Ā 6Ļ░£ņøö Ēøä ņ”Øņāü ĒśĖņĀäņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ļź╝ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Øņ£╝ļĪ£ ņĀĢņØśĒĢśļŖö ĻĄÉĒåĀ ĒĢ®ņØśļŖö ĻĄŁļé┤ ņä▒ņØĖņØś ļåÆņØĆ H. pylori ņ£Āļ│æļźĀ(~50%)Ļ│╝ ĒĢŁņāØņĀ£, ĒŖ╣Ē׳ clarithromycinņØś ļåÆņØĆ ļé┤ņä▒ņ£©ņØä Ļ░ÉņĢłĒĢĀ ļĢī, ĻĄŁļé┤ņŚÉņä£ ņłśņÜ®ĒĢśĻĖ░ņŚÉļŖö ĻĘĖ ĻĘ╝Ļ▒░Ļ░Ć ļČĆņĪ▒ĒĢśļŗż[3-5].
2005ļģäņŚÉ ļīĆĒĢ£ņåīĒÖöĻĖ░ĻĖ░ļŖźņä▒ņ¦łĒÖś┬ĘņÜ┤ļÅÖĒĢÖĒÜīļŖö ņĀäļ¼ĖĻ░Ć ņØśĻ▓¼ņØä ļ░öĒāĢņ£╝ļĪ£ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ņ¦äļŗ©Ļ│╝ ņ╣śļŻīņŚÉ ļīĆĒĢ£ ņ¦äļŻī ņ¦Ćņ╣©ņØä ļ░£Ēæ£ĒĢśņśĆĻ│Ā[6], 2011ļģäņŚÉ ņŗżņĀ£ ņ×äņāüņŚÉņä£ ņé¼ņÜ®ļÉĀ ņłś ņ׳ļÅäļĪØ ņ▓┤Ļ│äņĀü ļ¼ĖĒŚīĻ│Āņ░░ņØä ĒåĄĒĢśņŚ¼ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ņ╣śļŻīņŚÉ ļīĆĒĢ£ ņ¦äļŻī ņ¦Ćņ╣©ņØä Ļ░£ņĀĢĒĢśņśĆļŗż[7]. ņØ┤Ēøä ņČĢņĀüļÉ£ ĻĘ╝Ļ▒░ļź╝ ļ░öĒāĢņ£╝ļĪ£ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ņ¦äļŗ©Ļ│╝ ņ╣śļŻīņŚÉ ļīĆĒĢśņŚ¼ ņ¦äļŻī ņ¦Ćņ╣©ņØä Ļ░£ņĀĢĒĢśņŚ¼ 2019ļģä ņśüļ¼ĖĒīÉņ£╝ļĪ£ ņČ£Ļ░äĒĢśĻ▓ī ļÉśņŚłļŗż[8]. Ļ░£ņĀĢņĢłņØś ĒŖ╣ņ¦ĢņØĆ ņ▓½ņ¦Ė, ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ņ╣śļŻīņŚÉ ļīĆĒĢ£ ņ▓┤Ļ│äņĀüņØĖ ļ¼ĖĒŚī Ļ▓ĆņāēĻ│╝ ĻĘ╝Ļ▒░ ĒÅēĻ░Ćļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņ¢æņä▒ņ×ÉĒÄīĒöäņ¢ĄņĀ£ņĀ£(proton pump inhibitor, PPI)ņØś ĒÜ©Ļ│╝, H. pylori ņĀ£ĻĘĀ ņ╣śļŻīņØś ņ£ĀņÜ®ņä▒, ņé╝ĒÖśĻ│ä ĒĢŁņÜ░ņÜĖņĀ£(tricyclic antidepressant, TCA)ņØś ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢśņŚ¼ ļ®öĒāĆļČäņäØņØä ņŗżņŗ£ĒĢśņŚ¼ ĻĘ╝Ļ▒░ļź╝ ņĀ£ņŗ£ĒĢśņśĆļŗż. ļæśņ¦Ė, ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ņĢäĒśĢ(EPS, PDS)ņŚÉ ļö░ļźĖ ĻČīĻ│Āļ¼ĖņØä ņĀ£ņŗ£ĒĢśņśĆļŗż. ņģŗņ¦Ė, H. pyloriĻ░Ć ņåīĒÖöļČłļ¤ē ĒśĖņĀäņŚÉ ļ»Ėņ╣śļŖö ĒÜ©Ļ│╝ļź╝ ņä£ņ¢æĻ│╝ ļÅÖņ¢æņŚÉņä£ ņŗ£Ē¢ēļÉ£ ņŚ░ĻĄ¼ļź╝ ĻĄ¼ļČäĒĢśņŚ¼ ļ®öĒāĆļČäņäØņØä ņŗżņŗ£ĒĢśņśĆļŗż. ļäĘņ¦Ė, ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£ņØś ĒÜ©Ļ│╝ļ┐É ņĢäļŗłļØ╝ ļČĆņ×æņÜ®ņŚÉ ļīĆĒĢ£ ĻČīĻ│ĀņĢłņØä ĒåĄĒĢśņŚ¼ ņŗżņĀ£ ņ×äņāüņŚÉņä£ ņŻ╝ņØśĒĢĀ ņé¼ĒĢŁņØä ņĀ£ņŗ£ĒĢśņśĆļŗż.
Ļ░£ņĀĢ Ļ│╝ņĀĢņØĆ JNMņŚÉ ņČ£Ļ░äļÉ£ ņśüļ¼ĖĒīÉņŚÉ ņ×ÉņäĖĒ׳ ĻĖ░ņłĀĒĢśņśĆļŗż[8]. ņäĀņĀĢļÉ£ ļ¼ĖĒŚī ņżæ ļ¼┤ņ×æņ£ä ļīĆņĪ░ņŗ£ĒŚś(randomized controlled trials, RCT)ņØś ĒÄĖĒ¢ź ņ£äĒŚś(risk of bias)ņŚÉ ļīĆĒĢśņŚ¼ ņ¦łĒÅēĻ░Ćļź╝ ņŗżņŗ£ĒĢśņśĆļŗż[9]. ĻČīĻ│ĀņĢłņØś ĻČīĻ│Ā ļō▒ĻĖēĻ│╝ ņ”ØĻ▒░ ņłśņżĆņØĆ ņłśņĀĢļÉ£ Grading of Recommendations Assessment, Development, and EvaluationņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ļ▓░ņĀĢĒĢśņśĆļŗż(Table 1) [10]. ĻČīĻ│ĀņĢł ņ┤łņĢłņŚÉ ļīĆĒĢśņŚ¼ ņłśņĀĢ ļŹĖĒīīņØ┤ ļ░®ļ▓Ģņ£╝ļĪ£ ņĀäļ¼ĖĻ░Ć ĒĢ®ņØś ļÅäņČ£ņØä ņŗżņŗ£ĒĢśņśĆļŗż[11]. Ļ░£ņĀĢņĢłņØĆ ņ┤Ø 14Ļ░£ņØś ĻČīĻ│ĀņĢłņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņĪīņ£╝ļ®░, ņ╣śļŻīņŚÉ Ļ┤ĆļĀ©ļÉ£ 9Ļ░£ ĻČīĻ│ĀņĢłņŚÉ ļīĆĒĢśņŚ¼ 27ļ¬ģņØś ņåīĒÖöĻĖ░ļé┤Ļ│╝ ņĀäļ¼ĖņØśĻ░Ć Ēł¼Ēæ£ĒĢśņŚ¼ 7Ļ░£ņØś ĻČīĻ│ĀņĢł ļīĆĒĢ┤ņä£ ĒĢ®ņØśļź╝ ļÅäņČ£ĒĢśņśĆļŗż. ļ│ĖĻ│ĀņŚÉņä£ļŖö ņØ┤ļ▓ł Ļ░£ņĀĢļÉ£ ņśüļ¼ĖĒīÉ ņ¦äļŻī ņ¦Ćņ╣©ņØä ņÜöņĢĮ ņĀĢļ”¼ĒĢśņŚ¼ ņåīĻ░£ĒĢśĻ│Āņ×É ĒĢ£ļŗż. Ļ░ü ĻČīĻ│ĀņĢłņØś ņÜöņĢĮņØä Ēæ£ 2ņŚÉ ņĀĢļ”¼ĒĢśņśĆļŗż.
ņåīĒÖöļČłļ¤ēņØĆ ņāüļČĆņ£äņןĻ┤ĆņŚÉ ļéśĒāĆļéśļŖö ņ”Øņāüņ£╝ļĪ£, ļĪ£ļ¦łĻĖ░ņżĆ IVļŖö ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØä ļČłņŠīĒĢ£ ņŗØĒøä Ēżļ¦īĻ░É, ļČłņŠīĒĢ£ ņĪ░ĻĖ░ ļ¦īļ│ĄĻ░É, ļČłņŠīĒĢ£ ņāüļ│ĄļČĆ ĒåĄņ”Ø, ļČłņŠīĒĢ£ ņāüļ│ĄļČĆ ņō░ļ”╝ ņżæ ĒĢ£ Ļ░Ćņ¦Ć ņØ┤ņāüņØś ņ”ØņāüņØ┤ ņĄ£ņåī 6Ļ░£ņøö ņĀäļČĆĒä░ ņŗ£ņ×æļÉśĻ│Ā, ņĄ£ĻĘ╝ 3Ļ░£ņøö ņØ┤ļé┤ņŚÉ ņ׳ņØä ļĢīļĪ£ ņĀĢņØśĒĢśņśĆļŗż[2]. ņåīĒÖöļČłļ¤ē ĒÖśņ×É ņ╣śļŻīņŚÉ Ļ┤ĆĒĢ£ ļ»ĖĻĄŁĻ│╝ ņ║Éļéśļŗż ņåīĒÖöĻĖ░ ņĀäļ¼ĖņØś ĒśæĒÜī ņ×äņāüņ¦Ćņ╣©ņØĆ ņåīĒÖöļČłļ¤ēņØä ņĀüņ¢┤ļÅä 1Ļ░£ņøö ņØ┤ņāü ņ¦ĆņåŹļÉśļŖö ņāüļ│ĄļČĆ ļČłĒÄĖĻ░É, ĻĄ¼ņŚŁ, ĻĄ¼ĒåĀ, Ļ░ĆņŖ┤ņō░ļ”╝Ļ│╝ Ļ░ÖņØĆ ņ”ØņāüĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖö ņāüļ│ĄļČĆ ĒåĄņ”Øņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż[12,13]. Ēśäņ×¼ ņŚ¼ļ¤¼ ņ¦Ćņ╣©ņŚÉņä£ ņåīĒÖöļČłļ¤ēņØś ņĀĢņØśļŖö ņāüļ│ĄļČĆņØś ĒåĄņ”ØĻ│╝ ļČłĒÄĖĻ░ÉņØ┤ 1Ļ░£ņøö ņØ┤ņāüņØ┤ ņ׳ņØä ļĢīļĪ£ ņĀĢņØśĒĢśļ®░ ĻĄ¼ņ▓┤ņĀü ņ”ØņāüņØĆ ņŗØĒøä Ēżļ¦īĻ░É, ņĪ░ĻĖ░ ļ¦īļ│ĄĻ░É, ļ│ĄļČĆĒīĮļ¦ī, ĻĄ¼ņŚŁ ļśÉļŖö ĻĄ¼ĒåĀņØ┤ļŗż.
ļČłņØæņä▒ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØĆ ņĄ£ņåī 8 ņŻ╝ ņØ┤ņāü ņ”ØņāüņØ┤ ņ¦ĆņåŹļÉśĻ│Ā 2 Ļ░Ćņ¦Ć ņØ┤ņāüņØś ņ╣śļŻīņŚÉ ļ░śņØæĒĢśņ¦Ć ņĢŖņØä ļĢīļĪ£ ņĀĢņØśĒĢ£ļŗż[14]. ņĢäņŗ£ņĢä Ēā£ĒÅēņ¢æ ņ¦ĆņŚŁĻ│╝ ļ»ĖĻĄŁ ņ¦äļŻī ņ¦Ćņ╣©ņØĆ 4 ņŻ╝ ļÅÖņĢł ņ╣śļŻī ĒøäņŚÉ ņĀüņĀłĒĢ£ ņ╣śļŻī ĒÜ©Ļ│╝Ļ░Ć ļŗ¼ņä▒ļÉśņ¦Ć ņĢŖņ£╝ļ®┤ ļŗżļźĖ ņĢĮļ¼╝ļĪ£ ļ│ĆĻ▓ĮņØä ĻČīĻ│ĀĒĢśĻ│Ā ņ׳ļŗż[15,16]. ņØ╝ļ│Ė ņ╣śļŻī ņ¦Ćņ╣©ņØĆ 1ņ░©ņĀüņ£╝ļĪ£ ņ£äņé░ ļČäļ╣äņ¢ĄņĀ£ņĀ£ņÖĆ ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£ļĪ£ ņ╣śļŻīĒĢśņŚ¼ ļ░śņØæĒĢśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ 2ņ░© ņ╣śļŻīļĪ£ ņĀäĒåĄņØśĒĢÖ, ĒĢŁņÜ░ņÜĖņĀ£, H. pylori ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśĻ│Ā 2ņ░© ņ╣śļŻīņŚÉļÅä ļ░śņØæĒĢśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ļź╝ ļČłņØæņä▒ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØ┤ļØ╝Ļ│Ā ņĀ£ņĢłĒĢśņśĆļŗż[14]. ļČłņØæņä▒ņØ┤ļØ╝Ļ│Ā ņ¦äļŗ© ļé┤ļ”¼ĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņĘīļŗ┤ļÅä ņ¦łĒÖś ļ░Å ĻĖ░ĒāĆ ņāüļ│ĄļČĆ ņ”ØņāüņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŖö ļŗżļźĖ ĻĖ░ņ¦łņĀüņØĖ ņ¦łĒÖśņØä ļ░śļō£ņŗ£ ļ░░ņĀ£ĒĢ┤ņĢ╝ ĒĢ£ļŗż.
1. 40ņäĖ ņØ┤ņāüņØś ļ¦īņä▒ ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉņŚÉņä£ļŖö ĻĖ░ņ¦łņĀü ņøÉņØĖņØä ļ░░ņĀ£ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņāüļČĆņ£äņןĻ┤Ć ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ņĪ░ĻĖ░ņŚÉ ņŗ£Ē¢ēĒĢĀ Ļ▓āņØä ĻČīĻ│ĀĒĢ£ļŗż.
ŌĆó ĻČīĻ│Ā ļō▒ĻĖē: Ļ░ĢĒĢ©
ŌĆó ņ”ØĻ▒░ ņłśņżĆ: ļé«ņØī
ŌĆó ņĀäļ¼ĖĻ░Ć ņØśĻ▓¼: ņĀäņĀüņ£╝ļĪ£ ļÅÖņØśĒĢ©(70.4%), ļīĆņ▓┤ļĪ£ ļÅÖņØśĒĢ©(29.6%), ņØ╝ļČĆ ļÅÖņØśĒĢ©(0%), ļīĆņ▓┤ļĪ£ ļÅÖņØśĒĢśņ¦Ć ņĢŖņØī(0%), ņĀäņĀüņ£╝ļĪ£ ļÅÖņØśĒĢśņ¦Ć ņĢŖņØī(0%), ļ¬©ļź┤Ļ▓ĀņØī(0%)
ļ»ĖĻĄŁĻ│╝ ņ║Éļéśļŗż ņ¦äļŻī ņ¦Ćņ╣©ņŚÉņä£ļŖö ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉņŚÉņä£ ļé┤ņŗ£Ļ▓Įļ│┤ļŗżļŖö H. pylori Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ ņ¢æņä▒ņØĖ Ļ▓ĮņÜ░ ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśĻ│Ā, ņØ┤ĒøäņŚÉļÅä ņ”ØņāüņØ┤ ņ¦ĆņåŹļÉśļ®┤ ņ£äļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢĀ Ļ▓āņØä ĻČīĻ│ĀĒĢ£ļŗż[17]. ņØ┤ļŖö ņĪ░ĻĖ░ņŚÉ ņāüļČĆņ£äņןĻ┤Ć ļé┤ņŗ£Ļ▓ĮņØä ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░ņÖĆ ŌĆ£H. pylori Ļ▓Ćņé¼ Ēøä ņĀ£ĻĘĀ ņ╣śļŻīŌĆØļź╝ ļ╣äĻĄÉĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ņ”Øņāü ĒśĖņĀäņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØĆ ļ╣äņŖĘĒĢśņśĆņ£╝ļéś ŌĆ£H. pylori Ļ▓Ćņé¼ Ēøä ņĀ£ĻĘĀ ņ╣śļŻīŌĆØļź╝ ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░Ļ░Ć ļ╣äņÜ®-ĒÜ©Ļ│╝ņŚÉņä£ ņØ┤ļōØņØ┤ ņ׳ņŚłļŗżļŖö ņŚ░ĻĄ¼ļź╝ ĻĘ╝Ļ░äņ£╝ļĪ£ ĒĢśĻ│Ā ņ׳ļŗż[18-20]. ļśÉĒĢ£ ņĪ░ĻĖ░ņŚÉ ņ£äļé┤ņŗ£Ļ▓ĮņØä ņŗżņŗ£ĒĢ£ ĻĄ░Ļ│╝ Ļ▓ĮĒŚśņĀüņ£╝ļĪ£ ņ£äņé░ļČäļ╣äņ¢ĄņĀ£ņĀ£ļź╝ ņÜ░ņäĀņĀüņ£╝ļĪ£ ņé¼ņÜ®ĒĢ£ Ēøä ņ”Øņāü ĒśĖņĀäņŚÉ ļ»Ėņ╣śļŖö ĒÜ©Ļ│╝ļź╝ ļ╣äĻĄÉĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņ¢æĻĄ░Ļ░ä ļ╣äņŖĘĒĢ£ ņ”Øņāü ĒśĖņĀä ņĀĢļÅäļź╝ Ļ░ĆņĀĖņÖöņ£╝ļéś ņÜ░ņäĀņĀüņ£╝ļĪ£ ņ£äņé░ļČäļ╣äņ¢ĄņĀ£ņĀ£ļź╝ ņé¼ņÜ®ĒĢśļŖö Ļ▓ĮņÜ░ ļ╣äņÜ®-ĒÜ©Ļ│╝ņŚÉņä£ ņØ┤ļōØņØ┤ ņ׳ņŚłļŗż[21,22]. ņØ┤ļŖö ļ»ĖĻĄŁņØ┤ļéś ņ║Éļéśļŗż ļō▒ ņä£ĻĄ¼ĻČīņŚÉņä£ļŖö ņĢĮņĀ£ ņé¼ņÜ®ļ╣äļ│┤ļŗż ļé┤ņŗ£Ļ▓Į ļ╣äņÜ®ņØ┤ Ēø©ņö¼ ļåÆĻĖ░ ļĢīļ¼ĖņŚÉ ļé┤ņŗ£Ļ▓ĮņØä ņÜ░ņäĀņĀüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņØ┤ ļ╣äņÜ®-ĒÜ©Ļ│╝ļ®┤ņŚÉņä£ ļČłļ”¼ĒĢśĻĖ░ ļĢīļ¼ĖņØ╝ Ļ▓āņØ┤ļŗż. ĻĘĖļ¤¼ļéś ņä£ĻĄ¼ņÖĆ ļŗ¼ļ”¼ ņĢäņŗ£ņĢäļŖö ļé┤ņŗ£Ļ▓Į ļ╣äņÜ®ņØ┤ ņĀĆļĀ┤ĒĢśĻ│Ā ļ¼┤ņŚćļ│┤ļŗżļÅä ņ£äņĢö ņ£Āļ│æļźĀņØ┤ ļåÆņ£╝ļ®░ ļ░£ļ│æ ņŚ░ļĀ╣ļÅä ļé«ĻĖ░ ļĢīļ¼ĖņŚÉ ļŗżļźĖ ņĀæĻĘ╝ņØ┤ ĒĢäņÜöĒĢśļŗż. ņżæĻĄŁņŚÉņä£ ņåīĒÖöļČłļ¤ēņ£╝ļĪ£ ļé┤ņŗ£Ļ▓ĮņØä ņŗ£Ē¢ē ļ░øņØĆ 14,101ļ¬ģņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ 45ņäĖ ņØ┤ĒĢśņØś Ļ▓ĮĻ│Ā ņ”Øņāü(ņ▓┤ņżæĻ░Éņåī, ņŚ░ĒĢśĻ│żļ×Ć, ņ£äņןĻ┤Ć ņČ£Ēśł, ņ▓ĀĻ▓░ĒĢŹņä▒ ļ╣łĒśł, ļ│ĄļČĆ ņóģĻ┤┤, ņ¦ĆņåŹņĀüņØĖ ĻĄ¼ĒåĀ ļō▒)ņØ┤ ņŚåļŖö ņĮöĒśĖĒŖĖņŚÉņä£ ļé┤ņŗ£Ļ▓Į ļīĆņŗĀ ŌĆ£H. pylori Ļ▓Ćņé¼ Ēøä ņĀ£ĻĘĀ ņ╣śļŻīŌĆØļź╝ ņŗ£Ē¢ēĒĢśņśĆņØä ļĢī 18ļ¬ģņØś ņ£äņĢö ĒÖśņ×É ņżæ 13ļ¬ģ(72.2%)ņØä ņ¦äļŗ©ĒĢśņ¦Ć ļ¬╗ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż[23]. ņåīĒÖöļČłļ¤ēņ£╝ļĪ£ ļé┤ņŗ£Ļ▓ĮņØä ņŗ£Ē¢ē ļ░øņØĆ 17,894ļ¬ģņŚÉ ļīĆĒĢ£ ļīĆļ¦īņØś ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņ£äņĢö ĒÖśņ×ÉņØś 5.3% (12/225)Ļ░Ć 45ņäĖ ļ»Ėļ¦īņØ┤ņŚłĻ│Ā Ļ▓ĮĻ│Ā ņ”ØņāüņØ┤ ņŚåļŖö Ļ▓āņ£╝ļĪ£ ĒÖĢņØĖļÉśņ¢┤, Ļ▓Ćņé¼ļź╝ ļ░øņ¦Ć ņĢŖņØĆ ņåīĒÖöļČłļ¤ē(uninvestigated dyspepsia) ĒÖśņ×ÉņŚÉņä£ 40ņäĖ ņØ┤ņāüņØĖ Ļ▓ĮņÜ░ ņāüļČĆņ£äņןĻ┤Ć ļé┤ņŗ£Ļ▓ĮņØä ņÜ░ņäĀņĀüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢĀ Ļ▓āņØä ņĀ£ņŗ£ĒĢśņśĆļŗż[24].
ņÜ░ļ”¼ļéśļØ╝ļŖö ņ£äņĢö ļ░£ņāØļźĀņØ┤ ļåÆļŗż[25]. 1999-2010ļģäņØś ņ×ÉļŻīņŚÉņä£ļÅä ņ£äņĢö ļ░£ņāØļźĀņØĆ 20-39ņäĖņŚÉņä£ 10ļ¦ī ņØĖļģä(person-years) ļŗ╣ ļé©ņ×É 7.40ļ¬ģ, ņŚ¼ņ×É 8.33ļ¬ģņØ┤ ļ░£ņāØĒĢśņśĆņ£╝ļ®░, 40-54ņäĖņŚÉļŖö Ļ░üĻ░ü 73.11ļ¬ģ, 35.13ļ¬ģņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśņśĆļŗż[26]. International Agency for Research on CancerņØś GLOBOCAN 2012 ņ×ÉļŻīņŚÉņä£ļÅä ļéśņØ┤ņŚÉ ļö░ļźĖ ņ£äņĢöņØś Ēæ£ņżĆ ļ░£ņāØļźĀņØĆ ņØĖĻĄ¼ 10ļ¦ī ļ¬ģļŗ╣ 15-39ņäĖņŚÉ 5.7ļ¬ģņØ┤ņŚłĻ│Ā, 40-44ņäĖņŚÉļŖö 30ļ¬ģņ£╝ļĪ£ ĻĖēĻ▓®ĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆļŗż. ņÜ░ļ”¼ļéśļØ╝ ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉņŚÉņä£ ļéśņØ┤ņŚÉ ļö░ļźĖ ņ£äņĢö ļ░£ņāØļźĀņØä ņĪ░ņé¼ĒĢ£ ņŚ░ĻĄ¼ļŖö ņĢäņ¦ü ņŚåļŗż. Ļ▓ĮĻ│Ā ņ”ØņāüņØ┤ ņŚåļŖö 615ļ¬ģņØś ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉņŚÉņä£ H. pylori Ļ▓Ćņé¼ņØś ņ£ĀņÜ®ņä▒ņØä ņĢīņĢäļ│Ė ĻĄŁļé┤ ņŚ░ĻĄ¼ņŚÉņä£ 40ņäĖ ņØ┤ĒĢśņŚÉņä£ļŖö H.pylori Ļ░ÉņŚ╝ ņ£Āļ¼┤ņÖĆ ļ¼┤Ļ┤ĆĒĢśĻ▓ī ņ£äņĢöņØ┤ ļ░£Ļ▓¼ļÉśņ¦Ć ņĢŖņĢśļŗż[27].
ņĄ£ĻĘ╝ H. pylori ņÖĆ ņ£äņĢö ļ░£ņāØļźĀņØ┤ ļåÆņØĆ ņĢäņŗ£ņĢäņŚÉņä£ ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉņŚÉ ļīĆĒĢ£ ņ┤łĻĖ░ ņĀæĻĘ╝ ļ░®ļ▓Ģņ£╝ļĪ£ ņĪ░ĻĖ░ņŚÉ ņāüļČĆņ£äņןĻ┤Ć ļé┤ņŗ£Ļ▓ĮņØä ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņŚÉ ļīĆĒĢ£ ņĀüņĀłņä▒ņØä ņé┤ĒÄ┤ļ│┤ĻĖ░ ņ£äĒĢ£ ļ®öĒāĆļČäņäØ Ļ▓░Ļ│╝, ņ£äņĢö ĒÖśņ×É ņżæ 45ņäĖ ņØ┤ĒĢśĻ░Ć 17.8%, 35ņäĖ ļ»Ėļ¦īņŚÉņä£ 3.0%Ļ░Ć ļ░£ļ│æĒĢśņŚ¼ ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢ┤ņĢ╝ ĒĢśļŖö ņĀüņĀłĒĢ£ ļéśņØ┤ļź╝ 35ņäĖļĪ£ ņĀ£ņĢłĒĢśĻĖ░ļÅä ĒĢśņśĆļŗż[24]. 2014ļģä ņÜ░ļ”¼ļéśļØ╝ ĻĄŁĻ░ĆņĢöļō▒ļĪØņé¼ņŚģ ņŚ░ļĪĆ ļ│┤Ļ│Āņä£ņŚÉņä£ ļö░ļź┤ļ®┤ ņĀäņ▓┤ ņ£äņĢö ĒÖśņ×É 29,854ļ¬ģ ņżæ 35ņäĖ ļ»Ėļ¦īņØ┤ 1.2% (353ļ¬ģ), 40ņäĖ ļ»Ėļ¦īņØ┤ 3.1% (932ļ¬ģ), 45ņäĖ ļ»Ėļ¦īņØ┤ 7.5% (2,230ļ¬ģ)ļĪ£, ņÜ░ļ”¼ļéśļØ╝ 40ņäĖ ņØ┤ņāüņØś ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉļŖö ņ£äņĢöņØ┤ ļé┤ņĀ£ļÉśņ¢┤ ņ׳ņØä Ļ░ĆļŖźņä▒ņØ┤ ļåÆļŗż. ļö░ļØ╝ņä£ 40ņäĖ ņØ┤ņāüņØś ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉņŚÉņä£ ņ£äņĢöņØä ĒżĒĢ©ĒĢ£ ĻĖ░ņ¦łņĀü ņøÉņØĖņØä ļ░░ņĀ£ĒĢśĻĖ░ ņ£äĒĢ┤ ņĪ░ĻĖ░ņŚÉ ņāüļČĆņ£äņןĻ┤Ć ļé┤ņŗ£Ļ▓ĮņØä ņŗ£Ē¢ēĒĢĀ Ļ▓āņØä ĻČīĻ│ĀĒĢ£ļŗż.
2. ņé░ļČäļ╣äņ¢ĄņĀ£ņĀ£ļéś ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£ņŚÉ ļ░śņØæĒĢśņ¦Ć ņĢŖļŖö ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉĻ▓īņä£ ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ĒīīņØ┤ļĪ£ļ”¼ Ļ░ÉņŚ╝ Ļ▓Ćņé¼ļź╝ ĻČīĻ│ĀĒĢ£ļŗż.
ŌĆó ĻČīĻ│Ā ļō▒ĻĖē: ņĢĮĒĢ©
ŌĆó ņ”ØĻ▒░ ņłśņżĆ: ļ¦żņÜ░ ļé«ņØī
ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØĆ ļ│æĒā£ņāØļ”¼ĒĢÖņĀüņ£╝ļĪ£ ļŗżņ¢æĒĢ£ ņÜöņØĖļōżņØ┤ ļ│ĄĒĢ®ņĀüņ£╝ļĪ£ ņ×æņÜ®ĒĢśņŚ¼ ļ░£ĒśäļÉ£ļŗż. ņĢīļĀżņ¦ä ņÜöņØĖņ£╝ļĪ£ļŖö ņ£äņĀĆļČĆņØś ņł£ņØæļÅä Ļ░Éņåī, ņ£äļ░░ņČ£ļŖźņØś ņĀĆĒĢś, ņ£äņØś ļé┤ņן Ļ│╝ļ»╝ņä▒, ņ£äņé░ ļČäļ╣ä ņןņĢĀ, ņ£ĀņĀäņĀü ┬Ę ĒÖśĻ▓ĮņĀü ņÜöņØĖ, ņĀĢņŗĀņé¼ĒÜīņĀü ņÜöņØĖ, ņāØĒÖ£ ņŖĄĻ┤Ć ĻĘĖļ”¼Ļ│Ā H.pylori Ļ░ÉņŚ╝ ļō▒ņØ┤ ņ׳ļŗż[28]. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņŚÉņä£ H. pylori Ļ░ÉņŚ╝ņØ┤ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢśņŚ¼ ļ¦ÄņØĆ ņŚ░ĻĄ¼ļōżņØ┤ ņ¦äĒ¢ēļÉśņ¢┤ ņÖöņ¦Ćļ¦ī ņĢäņ¦üĻ╣īņ¦Ć ļ¬ģĒÖĢĒĢ£ Ļ┤ĆĻ│äļŖö ļ░ØĒśĆņĀĖ ņ׳ņ¦Ć ņĢŖļŗż. H. pylori Ļ░ÉņŚ╝ņØ┤ ņ£ä ņĀÉļ¦ēņŚÉ ņŚ╝ņ”ØņØä ņ£Āļ░£ĒĢśĻ│Ā, ņØ┤ļĪ£ ņØĖĒĢ┤ ņ£äņĢĪņØś ļČäļ╣ä ļ░Å ņ£äņןņÜ┤ļÅÖĻĖ░ļŖźņŚÉ ņןņĢĀļź╝ ņ£Āļ░£ĒĢśņŚ¼ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØä ņ£Āļ░£ĒĢ£ļŗżĻ│Ā ĒĢ£ļŗż[29].
17Ļ░£ RCT (n=3,500) ļ®öĒāĆļČäņäØ Ļ▓░Ļ│╝, ļīĆņĪ░ĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ H. pylori ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ņ”ØņāüņØ┤ ņ¦ĆņåŹļÉĀ ņāüļīĆņ£äĒŚśļÅä(relative risk, RR)Ļ░Ć 10% (95% ņŗĀļó░ĻĄ¼Ļ░ä [confidence interval, CI] 6.0-14.0%) Ļ░ÉņåīĒĢśņśĆņ£╝ļéś ĒÜ©Ļ│╝ ļ░£Ēśä ĒĢäņÜö ņ”ØļĪĆ ņłś(number needed to treat, NNT)ļŖö 14ļ¬ģ(95% CI = 10-25)ņ£╝ļĪ£ ĻĘĖ ĒÜ©Ļ│╝ņØś ņ░©ņØ┤Ļ░Ć Ēü¼ņ¦Ć ņĢŖņĢśļŗż[30]. ņśüĻĄŁņŚÉņä£ ņ¦äĒ¢ēĒĢ£ the Bristol Helicobacter ProjectņŚÉņä£ļŖö 60ņäĖ ņØ┤ĒĢśņØś ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×É 1,517ļ¬ģņØä H. pylori ņĀ£ĻĘĀ ņ╣śļŻīļ░øņØĆ ĻĄ░Ļ│╝ ņ£äņĢĮĻĄ░ņ£╝ļĪ£ ļéśļłäņ¢┤ ņČöņĀü Ļ┤Ćņ░░ĒĢśņśĆļŖöļŹ░, ņĀ£ĻĘĀ ņ╣śļŻī ņä▒Ļ│ĄĻĄ░ņØś 90%ņŚÉņä£ ņ”Øņāü Ļ░£ņäĀņŚÉ ĒÜ©Ļ│╝ļź╝ ļ│┤ņśĆļŗż(p< 0.05) [31].
ņä£ĻĄ¼ņŚÉ ļ╣äĒĢśņŚ¼ ĒĢ£ĻĄŁņØĆ H. pylori ņ£Āļ│æļźĀņØ┤ ļåÆņ£╝ļéś 2005ļģä 59.6%ņŚÉņä£ 2015ļģä 51.0%ļĪ£ Ļ░Éņåī ņČöņäĖļĪ£ ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒÖöļŖö 40ļīĆ ņØ┤ĒĢś ņĀŖņØĆ ņŚ░ļĀ╣ņĖĄņŚÉņä£ ļŹöņÜ▒ ļÜ£ļĀĘĒĢśļŗż[32,33]. ĒĢ£ĻĄŁņØä ĒżĒĢ©ĒĢ£ ņĢäņŗ£ņĢä ĻĄŁĻ░ĆņŚÉņä£ļŖö ņä£ņ¢æņŚÉ ļ╣äĒĢ┤ ņ£äņĢöņØ┤ ĒØöĒĢśĻ│Ā ļ░£ļ│æ ņŚ░ļĀ╣ņØ┤ ļé«ņĢä ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ ņןĻĖ░Ļ░ä ņé░ļČäļ╣äņ¢ĄņĀ£ņĀ£ļéś H. pylori ņĀ£ĻĘĀ ņ╣śļŻī ļō▒ Ļ▓ĮĒŚśņĀü ņĢĮļ¼╝ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņØĆ ĻĖ░ņ¦łņĀü ņ¦łĒÖśņØś ņ¦äļŗ©ņØä ņ¦ĆņŚ░ņŗ£Ēé¼ Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż. ļö░ļØ╝ņä£ ĻĄŁļé┤ņŚÉņä£ļŖö Ļ▓ĮĻ│Ā ņ”ØņāüņØ┤ ņŚåļŖö 40ņäĖ ļ»Ėļ¦īņØś ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉļōżņŚÉĻ▓ī ļ╣äņ╣©ņŖĄņĀüņØĖ ļ░®ļ▓ĢņØä ĒåĄĒĢ£ "H.pylori Ļ▓Ćņé¼ Ēøä ņ╣śļŻīŌĆØ ņŗ£Ē¢ēņØĆ Ļ│ĀļĀżĒĢĀ ņłś ņ׳ņ£╝ļéś 40ņäĖ ņØ┤ņāüņØ┤Ļ▒░ļéś Ļ▓ĮĻ│Ā ņ”ØņāüņØ┤ ņ׳ļŖö ĒÖśņ×ÉņŚÉĻ▓īļŖö ņÜ░ņäĀņĀüņ£╝ļĪ£ ņ£äļé┤ņŗ£Ļ▓ĮņØä ņŗżņŗ£ĒĢĀ Ļ▓āņØä ĻČīĻ│ĀĒĢśņśĆļŗż.
H. pylori Ļ░ÉņŚ╝ ņ¦äļŗ©ņŚÉ ņé¼ņÜ®ļÉśļŖö ļ╣äņ╣©ņŖĄņä▒ Ļ▓Ćņé¼ļŖö ņÜöņåīĒśĖĻĖ░ Ļ▓Ćņé¼, ļīĆļ│ĆĒĢŁņøÉ Ļ▓Ćņé¼, Ēśłņ▓Ł Ļ▓Ćņé¼Ļ░Ć ņ׳ļŗż. ņÜöņåīĒśĖĻĖ░ Ļ▓Ćņé¼ņÖĆ ļīĆļ│ĆĒĢŁņøÉ Ļ▓Ćņé¼ļŖö 90% ņØ┤ņāüņØś ļåÆņØĆ ļ»╝Ļ░ÉļÅäņÖĆ ĒŖ╣ņØ┤ļÅäļź╝ ļ│┤ņØ┤Ļ│Ā, ĒŖ╣Ē׳ ņÜöņåīĒśĖĻĖ░ Ļ▓Ćņé¼ļŖö ņŗ£Ē¢ēņØ┤ ņÜ®ņØ┤ĒĢśņŚ¼ H. pylori ņĀ£ĻĘĀ ņ╣śļŻī ņä▒Ļ│ĄņØä ĒÖĢņØĖĒĢśļŖö ļŹ░ ņ×äņāüņĀüņ£╝ļĪ£ Ļ░Ćņן ĒØöĒĢśĻ▓ī ņé¼ņÜ®ļÉ£ļŗż. Ēśłņ▓Ł Ļ▓Ćņé¼ļŖö H. pyloriņŚÉ ļīĆĒĢ£ ĒĢŁņ▓┤ļź╝ ņĖĪņĀĢĒĢśļŖö ļ░®ļ▓Ģņ£╝ļĪ£ ņĀĆļĀ┤ĒĢśĻ│Ā ņē¼ņÜ┤ ļ░®ļ▓ĢņØ┤ņ¦Ćļ¦ī, ĒĢŁņ▓┤ ņŚŁĻ░ĆĻ░Ć ļĢīļĪ£ļŖö ļ¬ć ļģä ļÅÖņĢł ņ¦ĆņåŹļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņĀ£ĻĘĀ ņ╣śļŻīņØś ņä▒Ļ│Ą ņŚ¼ļČĆļź╝ ļ░öļĪ£ ĒīÉņĀĢĒĢśĻĖ░ņŚÉļŖö ļČĆņĀüņĀłĒĢśņŚ¼ ņŻ╝ļĪ£ ņäĀļ│ä Ļ▓Ćņé¼ņÖĆ ņŚŁĒĢÖ ņŚ░ĻĄ¼ņŚÉ ņØ┤ņÜ®ļÉ£ļŗż. ņ╣©ņŖĄņĀü Ļ▓Ćņé¼ļĪ£ļŖö ņ£äļé┤ņŗ£Ļ▓ĮņØä ņŗ£Ē¢ēĒĢĀ ļĢī, ņ£äņĀÉļ¦ē ņĪ░ņ¦üņāØĻ▓ĆņØä ņ¦äĒ¢ēĒĢśņŚ¼ ņŗĀņåŹņÜöņåīļČäĒĢ┤ĒÜ©ņåī Ļ▓Ćņé¼(rapid urease test)ņÖĆ ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ņ¦äĒ¢ēĒĢĀ ņłś ņ׳ļŗż. ņŗĀņåŹņÜöņåīļČäĒĢ┤ĒÜ©ņåī Ļ▓Ćņé¼ļŖö H. pyloriĻ░Ć ļČäļ╣äĒĢśļŖö ņÜöņåīļČäĒĢ┤ĒÜ©ņåīņŚÉ ņØśĒĢśņŚ¼ ņāØņä▒ļÉ£ ņĢöļ¬©ļŗłņĢäĻ░Ć ņÜöņåīļ░░ņ¦ĆņØś pHļź╝ ņāüņŖ╣ņŗ£ĒéżļŖö Ļ▓āņØä ņāē ļ│ĆĒÖöļĪ£ ĒÖĢņØĖĒĢśļŖö Ļ▓Ćņé¼ņØ┤ļŗż. ņĪ░ņ¦ü Ļ▓Ćņé¼ļŖö H. pylori ņ¦äļŗ© ņÖĖņŚÉļÅä ņĀÉļ¦ēņØś ņŚ╝ņ”Ø, ņ£äņČĢ ĻĘĖļ”¼Ļ│Ā ņןņāüĒö╝ĒÖöņāØ ļō▒ņØś ņČöĻ░Ć ņĀĢļ│┤ļź╝ ņ¢╗ņØä ņłś ņ׳ļŖö ņןņĀÉņØ┤ ņ׳ļŗż.
3. ļ¦īņä▒ ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉĻ░Ć 40ņäĖ ņØ┤ņāüņØ┤Ļ▒░ļéś ņé╝Ēé┤Ļ│żļ×Ć, ņ¦ĆņåŹņĀü ĻĄ¼ĒåĀ, ļ╣äņĀĢņāüņĀü ņ▓┤ņżæĻ░Éņåī, ņČ£Ēśł ņ¦ĢĒøä, ņ£äņĢö Ļ░ĆņĪ▒ļĀźņØ┤ ņ׳Ļ▒░ļéś ņĄ£ĻĘ╝ ņ¦äĒåĄņåīņŚ╝ņĀ£ /ĒĢŁĒśłņĀäņĀ£ļź╝ ļ│ĄņÜ®ĒĢ£ Ļ▓ĮņÜ░ ĻĖ░ņ¦łņĀü ņ¦łĒÖśņØä Ļ░Éļ│äĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņČöĻ░Ć Ļ▓Ćņé¼ļź╝ ĻČīĻ│ĀĒĢ£ļŗż.
ŌĆó ĻČīĻ│Ā ļō▒ĻĖē: Ļ░ĢĒĢ©
ŌĆó ņ”ØĻ▒░ ņłśņżĆ: ļé«ņØī
ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØĆ ņĀäĒśĢņĀü ņ”ØņāüĻ│╝ ĒĢ©Ļ╗ś ņ£äņĢö, ņ£äĻČżņ¢æ ļō▒ ĻĖ░ņ¦łņĀü ņ¦łĒÖśņØä ļ░░ņĀ£ĒĢ£ Ēøä ņ¦äļŗ©ĒĢ£ļŗż. ņŚ¼ļ¤¼ ĻČīĻ│ĀņĢłņŚÉņä£ ņ£äĒŚś ņ¦ĢĒøäĻ░Ć ņ׳ļŖö Ļ▓ĮņÜ░(ņé╝Ēé┤Ļ│żļ×Ć, ņ¦ĆņåŹņĀü ĻĄ¼ĒåĀ, ļ╣äņĀĢņāüņĀü ņ▓┤ņżæĻ░Éņåī, ņČ£Ēśł ņ¦ĢĒøä ļ░Å ņ£äņĢö Ļ░ĆņĪ▒ļĀźņØ┤ ņ׳Ļ▒░ļéś ņĄ£ĻĘ╝ ņ¦äĒåĄņåīņŚ╝ņĀ£ ļśÉļŖö ĒĢŁĒśłņĀäņĀ£ļź╝ ļ│ĄņÜ®ĒĢ£ Ļ▓ĮņÜ░, ĻĖ░ņ¦łņĀü ņ¦łĒÖśņØä Ļ░Éļ│äĒĢśĻĖ░ ņ£äĒĢśņŚ¼ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢĀ Ļ▓āņØä ĻČīĻ│ĀĒĢ£ļŗż[14,16,34,35]. ĻĘĖļ¤¼ļéś ņ▓┤Ļ│äņĀü ļ¼ĖĒŚīĻ│Āņ░░ņŚÉ ļö░ļź┤ļ®┤ ņ£äĒŚś ņ”ØņāüņØ┤ļéś ņ¦ĢĒøäĻ░Ć ĻĖ░ņ¦łņĀü ņøÉņØĖņØä Ļ░Éļ│äĒĢśļŖö ļŹ░ ņĀ£ĒĢ£ņĀüņØ┤ņŚłļŗż[36]. 2017ļģä ļ░£Ēæ£ĒĢ£ ļ»ĖĻĄŁĻ│╝ ņ║Éļéśļŗż ņ¦äļŻī ņ¦Ćņ╣©ņŚÉņä£ļŖö 60ņäĖ ņØ┤ĒĢśņØś ĒÖśņ×ÉļōżņŚÉĻ▓ī ņ£äĒŚś ņ¦ĢĒøäĻ░Ć ņ׳ņ¢┤ļÅä ņāüļČĆņ£äņןĻ┤Ć ņŗĀņāØļ¼╝ņØä Ļ░Éļ│äĒĢśĻĖ░ ņ£äĒĢ£ ļé┤ņŗ£Ļ▓ĮņØä ĻČīĻ│ĀĒĢśņ¦Ć ņĢŖņĢśĻ│Ā, ņĘīņןļŗ┤ļÅä ņ¦łĒÖśņØ┤ ņØśņŗ¼ļÉśļŖö Ļ▓ĮņÜ░ņŚÉ ņśüņāüĒĢÖņĀü Ļ▓Ćņé¼ļź╝ ĻČīĻ│ĀĒĢśņśĆļŗż[17]. ĻĘĖļ¤¼ļéś ĒĢ£ĻĄŁņØĆ ņ£äņĢö ņ£Āļ│æļźĀņØ┤ ļåÆĻ│Ā[37], ņĢäņŗ£ņĢäņØĖņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņ▓┤Ļ│äņĀü ļ¼ĖĒŚīĻ│Āņ░░ņŚÉņä£ ņ£äĒŚś ņ¦ĢĒøäĻ░Ć ņĀŖņØĆ ņĢäņŗ£ņĢäņØĖņŚÉņä£ ĻĖ░ņ¦łņĀü ņ¦łĒÖśņØä Ļ░Éļ│äĒĢśļŖö ļŹ░ ņ£ĀņÜ®ĒĢśļŗżļŖö Ļ▓░Ļ│╝ļź╝ ņĀ£ņŗ£ĒĢśņŚ¼[38], ņØ┤ļ▓ł ņ¦Ćņ╣©ņŚÉņä£ļŖö ņ£äĒŚś ņ¦ĢĒøäĻ░Ć ņ׳ļŖö ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉņŚÉņä£ļŖö ļéśņØ┤ņÖĆ ļ¼┤Ļ┤ĆĒĢśĻ▓ī ņāüļČĆņ£äņןĻ┤Ć ļé┤ņŗ£Ļ▓Į ļō▒ņØä ņŗ£Ē¢ēĒĢĀ Ļ▓āņØä ĻČīĻ│ĀĒĢśņśĆļŗż.
ņåīĒÖöļČłļ¤ēņØś Ļ▓ĮĒŚśņĀü ņ╣śļŻīņŚÉ ļ░śņØæņØ┤ ņŚåļŖö ĒÖśņ×ÉļŖö ņ▓½ ņ¦äļŗ© ļŗ╣ņŗ£ ĒśłņĢĪ Ļ▓Ćņé¼ļź╝ ņŗżņŗ£ĒĢśņ¦Ć ņĢŖņĢśļŗżļ®┤ ņØ╝ļ░śĒśłņĢĪ Ļ▓Ćņé¼, ĒśłņĢĪĒÖöĒĢÖ Ļ▓Ćņé¼ņÖĆ Ļ░ÖņØĆ ĒśłņĢĪ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņØä ĻČīĻ│ĀĒĢ£ļŗż. ĒŖ╣Ē׳ Ļ░äņĢö ļśÉļŖö ņĘīņןņĢöņØś ņ£Āļ│æļźĀņØ┤ ļåÆņØĆ ņ¦ĆņŚŁņŚÉņä£ļŖö ņØ┤ļōż ņ¦łĒÖśņØ┤ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØä ļÅÖļ░śĒĢĀ ņłś ņ׳ņ£╝ļ»ĆļĪ£, ņāüļ│ĄļČĆ ņ┤łņØīĒīī ļśÉļŖö ļ│ĄļČĆ CTļź╝ Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢ£ļŗż[14,17,39,40].
4. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ ĒöäļĪ£ĒåżĒÄīĒöäņ¢ĄņĀ£ņĀ£ļŖö ņ”Øņāü ĒśĖņĀäņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ņ¢┤ņä£ 1ņ░© ņ╣śļŻīļĪ£ ĻČīĻ│ĀĒĢ£ļŗż.
ŌĆó ĻČīĻ│Ā ļō▒ĻĖē: Ļ░ĢĒĢ©
ŌĆó ņ”ØĻ▒░ ņłśņżĆ: ļåÆņØī
ŌĆó ņĀäļ¼ĖĻ░Ć ņØśĻ▓¼: ņĀäņĀüņ£╝ļĪ£ ļÅÖņØśĒĢ©(44.5%), ļīĆņ▓┤ļĪ£ ļÅÖņØśĒĢ©(37.0%), ņØ╝ļČĆ ļÅÖņØśĒĢ©(14.8%), ļīĆņ▓┤ļĪ£ ļÅÖņØśĒĢśņ¦Ć ņĢŖņØī(3.7%), ņĀäņĀüņ£╝ļĪ£ ļÅÖņØśĒĢśņ¦Ć ņĢŖņØī(0%), ļ¬©ļź┤Ļ▓ĀņØī(0%)
ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØĆ ņŗŁņØ┤ņ¦Ćņןļé┤ ņé░ ņ▓ŁņåīļŖź Ļ░ÉņåīļĪ£ ņØĖĒĢśņŚ¼ ņé░ļģĖņČ£ņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā ļé┤ņןĻ│╝ļ»╝ņä▒ņØ┤ ņ”ØĻ░ĆĒĢśļ®░ ņ£ä ņÜ┤ļÅÖņןņĢĀĻ░Ć ņ┤łļלļÉĀ ņłś ņ׳ļŗż. ļö░ļØ╝ņä£ ņ£äņé░ļČäļ╣äņ¢ĄņĀ£ņĀ£ļŖö ņŗŁņØ┤ņ¦Ćņןļé┤ņØś ņé░ļÅäļź╝ ņĀĢņāüĒÖöņŗ£ņ╝£ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ņ╣śļŻīņŚÉ ļÅäņøĆņØä ņŻ╝ļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ£ļŗż[41-43]. ņØ┤ļ¤¼ĒĢ£ ņĀÉņŚÉņä£ PPIļŖö ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ņżæņÜöĒĢ£ ņ╣śļŻīņĀ£ļĪ£ ņé¼ņÜ®ļÉśņ¢┤ ņÖöļŗż[44]. ņØ┤ļ▓ł ņ¦Ćņ╣©ņŚÉņä£ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ PPIņØś ņĀäļ░śņĀüņØĖ ņ”Øņāü ĒśĖņĀäņ£©ņØä ļ╣äĻĄÉĒĢ£ 8Ļ░£ RCT (n=2,216)ļź╝ ļīĆņāüņ£╝ļĪ£ ļ®öĒāĆļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż[45-52]. PPIļź╝ 2-8ņŻ╝Ļ░ä Ēł¼ņŚ¼ļ░øņØĆ ņ╣śļŻīĻĄ░ņŚÉņä£ ņ£äņĢĮĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ņ£ĀņØśĒĢśĻ▓ī ņ”Øņāü ĒśĖņĀäņ£©ņØ┤ ļåÆņĢśļŗż(36% vs. 30%, RR = 1.41, 95% CI = 1.07-1.87). ĻĘĖļ¤¼ļéś ņŚ░ĻĄ¼ņØś ņØ┤ņ¦łņä▒ņØ┤ ļåÆņĢśĻ│Ā(Žć2 = 17.76, p= 0.01, I2 = 61%) (Fig. 1), NNTļŖö 9 ļ¬ģņØ┤ņŚłļŗż(95% CI = 6-24). ĒĢśņ£ä ļČäņäØņŚÉņä£ PPIņØś ņ”Øņāü ņÖäĒÖöņŚÉ ļīĆĒĢ£ RRņØĆ 1.44ņśĆĻ│Ā, ņÖäņĀäĒĢ£ ņ”Øņāü ĒśĖņĀäņŚÉ ļīĆĒĢ£ RRņØĆ 1.26ņØ┤ņŚłļŗż(Fig. 2). ņ╣śļŻī ĻĖ░Ļ░äņŚÉ ļö░ļźĖ ļČäņäØņŚÉņä£ 8ņŻ╝ ļÅÖņĢł PPIļź╝ Ēł¼ņŚ¼ĒĢśņśĆņØä ļĢī ņ”Øņāü ĒśĖņĀäņØ┤ ļÜ£ļĀĘĒĢ£ ļ░śļ®┤(RR = 1.24, 95% CI = 1.03-1.49), (Žć2 = 0.33, p= 0.85, I2 = 0%) 4ņŻ╝ ļ»Ėļ¦īņ£╝ļĪ£ Ēł¼ņŚ¼ĒĢśņśĆņØä ļĢīļŖö ņ£äņĢĮĻĄ░Ļ│╝ ņ”Øņāü ĒśĖņĀäņŚÉ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(RR = 1.40, 95% CI = 0.99-1.97) (Fig. 3). ļö░ļØ╝ņä£ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ ņןĻĖ░ņĀüņØĖ ņ”ØņāüņØś ĒśĖņĀäņØä ņ£äĒĢ┤ņä£ 8ņŻ╝ ņØ┤ņāü PPI ņ╣śļŻīļź╝ ĻČīĻ│ĀĒĢ£ļŗż.
5. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ņĢäĒśĢ ņżæ ļ¬ģņ╣śĒåĄņ”Øņ”ØĒøäĻĄ░ ĒÖśņ×ÉņŚÉņä£ ĒöäļĪ£ĒåżĒÄīĒöäņ¢ĄņĀ£ņĀ£ļź╝ 1ņ░© ņ╣śļŻī ņĢĮņĀ£ļĪ£ ņÜ░ņäĀņĀüņ£╝ļĪ£ ĻČīĻ│ĀĒĢ£ļŗż.
ŌĆó ĻČīĻ│Ā ļō▒ĻĖē: Ļ░ĢĒĢ©
ŌĆó ņ”ØĻ▒░ ņłśņżĆ: ņżæļō▒ļÅä
ŌĆó ņĀäļ¼ĖĻ░Ć ņØśĻ▓¼: ņĀäņĀüņ£╝ļĪ£ ļÅÖņØśĒĢ©(25.9%), ļīĆņ▓┤ļĪ£ ļÅÖņØśĒĢ©(55.6%), ņØ╝ļČĆ ļÅÖņØśĒĢ©(18.5%), ļīĆņ▓┤ļĪ£ ļÅÖņØśĒĢśņ¦Ć ņĢŖņØī(0%), ņĀäņĀüņ£╝ļĪ£ ļÅÖņØśĒĢśņ¦Ć ņĢŖņØī(0%), ļ¬©ļź┤Ļ▓ĀņØī(0%)
PPIļŖö ļĪ£ļ¦łĻĖ░ņżĆ IIņŚÉ ļö░ļØ╝ ņāüļ│ĄļČĆ ĒåĄņ”ØņØä ņŻ╝ļĪ£ ĒśĖņåīĒĢśļŖö ĻČżņ¢æĒśĢĻ│╝ ņŚŁļźś ņ”ØņāüņØ┤ ņŻ╝ļĪ£ ļéśĒāĆļéśļŖö ņŚŁļźśĒśĢņØś ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņŚÉņä£ ĒÜ©Ļ│╝Ļ░Ć ņ׳ļŗżĻ│Ā ņĢīļĀżņĀĖ ņÖöĻ│Ā[53], ņØ┤ņĀä ņ¦äļŻī ņ¦Ćņ╣©ņŚÉņä£ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ņĢäĒśĢņŚÉ ļö░ļØ╝ PPI ņé¼ņÜ®ņØä ĻČīĻ│ĀĒĢśņśĆņ£╝ļéś[14,54,55], ĒÜ©Ļ│╝ņÖĆ Ļ┤ĆļĀ©ĒĢ┤ņä£ ļģ╝ņ¤üņØś ņŚ¼ņ¦ĆĻ░Ć ņ׳ļŗż[56-58]. ļĪ£ļ¦łĻĖ░ņżĆ III ņŚÉņä£ļŖö ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØä EPSņÖĆ PDSļĪ£ ļéśļłäĻ│Ā ņ׳ņ¦Ćļ¦ī, Ļ░ÖņØĆ ĒÖśņ×ÉņŚÉņä£ EPSņÖĆ PDSĻ░Ć ļÅÖņŗ£ņŚÉ ņżæļ│ĄĒĢ┤ņä£ ļéśĒāĆļéśļŖö Ļ▓ĮņÜ░Ļ░Ć ĒØöĒĢśļŗż[28,59]. ņØ┤ļ▓ł ņ¦Ćņ╣©ņŚÉņä£ ņŻ╝ņ”Øņāüņ£╝ļĪ£ ņāüļ│ĄļČĆ ĒåĄņ”ØĻ│╝ ņāüļ│ĄļČĆ ņō░ļ”╝ņØä ĒśĖņåīĒĢśļŖö EPSņĢäĒśĢ ĒÖśņ×ÉļōżņŚÉ ļīĆĒĢśņŚ¼ PPIņØś ĒÜ©Ļ│╝ļź╝ ļČäņäØĒĢ£ 4Ļ░£ RCTļź╝ ļīĆņāüņ£╝ļĪ£ ļ®öĒāĆļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż[47,48,50,51]. ĻĘĖ Ļ▓░Ļ│╝, PPIļŖö ņāüļ│ĄļČĆ ĒåĄņ”ØĻ│╝ ņāüļ│ĄļČĆ ņō░ļ”╝ ņ╣śļŻīņŚÉ ņ£äņĢĮĻĄ░ļ│┤ļŗż ĒÜ©Ļ│╝ņĀüņØ┤ļéś(RR = 1.22, 95% CI = 1.04-1.44, Žć2 = 0.02, p= 0.99, I2 =0%) ņŗØĒøä Ēżļ¦īĻ░ÉņØ┤ļéś ņĪ░ĻĖ░ ļ¦īļ│ĄĻ░ÉņØä ĒśĖņåīĒĢśļŖö PDSļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢśļŖö 2Ļ░£ņØś RCTņŚÉ ļīĆĒĢ£ ļ®öĒāĆļČäņäØņŚÉņä£ PPI ņ╣śļŻīĻ░Ć ņ£äņĢĮĻĄ░ņŚÉ ļ╣äĒĢśņŚ¼ ĒÜ©Ļ│╝ņĀüņØ┤ņ¦Ć ņĢŖņĢśļŗż(RR = 1.56, 95% CI = 0.91-2.70) (Fig. 4) [50,51]. ĻĘĖļ¤¼ļéś ņØ┤ ļ®öĒāĆļČäņäØņŚÉ ĒżĒĢ©ļÉ£ RCT ņŚ░ĻĄ¼ļ¦łļŗż ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ņĀĢņØśĻ░Ć ļŗ¼ļØ╝ ĻČīĻ│ĀņĢłņØś ĻĘ╝Ļ▒░ ņłśņżĆņØä ņżæļō▒ļÅäļĪ£ ļé«ņČöņŚłļŗż.
6. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ Ē׳ņŖżĒāĆļ»╝ ņłśņÜ®ņ▓┤ ĻĖĖĒĢŁņĀ£ļŖö ņ”Øņāü ĒśĖņĀäņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ļ»ĆļĪ£ ĻČīĻ│ĀĒĢ£ļŗż. ļŗ©, Ē׳ņŖżĒāĆļ»╝ ņłśņÜ®ņ▓┤ ĻĖĖĒĢŁņĀ£ļŖö ņןĻĖ░ ņé¼ņÜ®ņ£╝ļĪ£ ņĢĮĒÜ©Ļ░Ć Ļ░ÉņåīļÉĀ ņłś ņ׳ņ¢┤ ļŗ©ĻĖ░Ļ░ä ņé¼ņÜ®ņØä Ļ│ĀļĀżĒĢ£ļŗż.
ŌĆó ĻČīĻ│Ā ļō▒ĻĖē: ņĢĮĒĢ©
ŌĆó ņ”ØĻ▒░ ņłśņżĆ: ņżæļō▒ļÅä
ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ņ╣śļŻīņŚÉ ņ£äņé░ļČäļ╣äņ¢ĄņĀ£ņĀ£ļĪ£ H2RAĻ░Ć ņé¼ņÜ®ļÉĀ ņłś ņ׳ļŗż. 2,456ļ¬ģņØś ļ╣äĻČżņ¢æņä▒ ņåīĒÖöļČłļ¤ē ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ 12ĒÄĖņØś ņĮöĒü¼ļ×Ć ļ®öĒāĆļČäņäØņŚÉ ļö░ļź┤ļ®┤, H2RAļź╝ ņé¼ņÜ®ĒĢśņśĆņØä ļĢī ņ”ØņāüņØ┤ ļé©ņĢä ņ׳ņØä RRņØĆ 0.77 (95% CI=0.65-0.92)ņØ┤ņŚłņ£╝ļ®░, NNTļŖö 7ļ¬ģņØ┤ņŚłļŗż. ĻĘĖļ¤¼ļéś ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ņ╣śļŻīņŚÉ H2RAņØś ĻĘ╝Ļ▒░ļŖö ņČ®ļČäĒĢśņ¦Ć ņĢŖļŗż. ņØ┤ ļČäņäØņŚÉ ĒżĒĢ©ļÉ£ ņ×äņāüņŗ£ĒŚśņØś ņĀäļ░śņĀü ņ¦łņØĆ ļīĆņ▓┤ļĪ£ ļé«ņĢśņ£╝ļ®░, ļĪ£ļ¦łĻĖ░ņżĆIIIņØ┤ ļ¦łļĀ©ļÉśĻĖ░ ņĀäņŚÉ ņŗ£Ē¢ēļÉ£ ņŚ░ĻĄ¼ļōżļĪ£ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ĻĖ░ņżĆņĪ░ņ░© ļČäļ¬ģĒĢśņ¦Ć ņĢŖņĢśļŗż[60]. 2,456ļ¬ģņØś ņåīĒÖöļČłļ¤ē ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ 7Ļ░£ RCTļź╝ ļČäņäØĒĢ£ ņĄ£ĻĘ╝ņØś ļ®öĒāĆļČäņäØ ņŚ░ĻĄ¼ņŚÉņä£ PPIĒł¼ņŚ¼ĻĄ░Ļ│╝ H2RA Ēł¼ņŚ¼ĻĄ░ ņé¼ņØ┤ņŚÉ ņ”Øņāü ĒśĖņĀäņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ£╝ļéś(RR = 0.93, 95% CI = 0.76-1.16), PPIĻĄ░ņŚÉņä£ ļŹö ļåÆņØĆ ņ”Øņāü ĒśĖņĀäņØś Ļ▓ĮĒ¢źņØä ļ│┤ņśĆļŗż[17]. ļśÉĒĢ£ H2RAļŖö ņé¼ņÜ®ĒĢĀņłśļĪØ ņ▓śņØīļ│┤ļŗż ĒÜ©Ļ│╝Ļ░Ć Ļ░ÉņåīĒĢśļŖö ņåŹņä▒ļé┤ņä▒(tachyphylaxis)ņØ┤ ļ░£ņāØĒĢĀ Ļ░ĆļŖźņä▒ņØ┤ ņ׳ņ¢┤[61,62], ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ņ£Āņ¦Ćņ╣śļŻīņĀ£ļĪ£ H2RAņØś ņé¼ņÜ®ņØĆ ņĀ£ĒĢ£ņĀüņØ┤ļŗż[63]. ļ┐Éļ¦ī ņĢäļŗłļØ╝ H2RAļŖö ļ╣äĻĄÉņĀü ņĢłņĀäĒĢ£ ņĢĮņĀ£ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļéś ņĢäļéÖĒĢäļØĮņŗ£ņŖżļź╝ ĒżĒĢ©ĒĢ£ ļČĆņ×æņÜ®ņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż. ĻĄŁļé┤ ņŚ░ĻĄ¼ņŚÉņä£ ranitidineļĪ£ ņØĖĒĢ£ ņĢäļéÖĒĢäļØĮņŗ£ņŖżĻ░Ć ļ░£ņāØĒĢśņśĆļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ļŗż[64]. ļśÉĒĢ£ 2019ļģä 9ņøö ranitidineņŚÉņä£ ņåīļ¤ēņØś N-ļŗłĒŖĖļĪ£ņåīļ®öĒŗĖņĢäļ»╝ņØ┤ Ļ▓ĆņČ£ļÉśņ¢┤ ņŗ£ņןņŚÉņä£ Ēć┤ņČ£ļÉśņŚłļŗż.
7. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£ļŖö ņ”Øņāü ĒśĖņĀäņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ļ»ĆļĪ£ ĻČīĻ│ĀĒĢ£ļŗż.
ŌĆó ĻČīĻ│Ā ļō▒ĻĖē: Ļ░ĢĒĢ©
ŌĆó ņ”ØĻ▒░ ņłśņżĆ: ņżæļō▒ļÅä
ŌĆó ņĀäļ¼ĖĻ░Ć ņØśĻ▓¼: ņĀäņĀüņ£╝ļĪ£ ļÅÖņØśĒĢ©(35.7%), ļīĆņ▓┤ļĪ£ ļÅÖņØśĒĢ©(53.6%), ņØ╝ļČĆ ļÅÖņØśĒĢ©(10.7%), ļīĆņ▓┤ļĪ£ ļÅÖņØśĒĢśņ¦Ć ņĢŖņØī(0%), ņĀäņĀüņ£╝ļĪ£ ļÅÖņØśĒĢśņ¦Ć ņĢŖņØī(0%), ļ¬©ļź┤Ļ▓ĀņØī(0%)
ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£ļŖö ņ×æņÜ® ĻĖ░ņĀäņŚÉ ĻĖ░ņ┤łĒĢśņŚ¼ ļÅäĒīīļ»╝ D2 ņłśņÜ®ņ▓┤ ĻĖĖĒĢŁņĀ£, ņäĖļĪ£ĒåĀļŗī 4ĒśĢ(5-HT4) ņłśņÜ®ņ▓┤ ņ×æņÜ®ņĀ£, ļ¬©ĒŗĖļ”░ ņ×æņÜ®ņĀ£ļĪ£ ļČäļźśļÉ£ļŗż. ļÅäĒīīļ»╝ D2 ņłśņÜ®ņ▓┤ ĻĖĖĒĢŁņĀ£ņØĖ domperidoneņØĆ ļ®öĒāĆļČäņäØņŚÉņä£ 2-4ņŻ╝ ļÅÖņĢł ņé¼ņÜ®ĒĢ£ Ļ▓ĮņÜ░ ņ£äņĢĮĻ│╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī ĒīĮļ¦īĻ░ÉĻ│╝ ņĪ░ĻĖ░ ļ¦īļ│ĄĻ░É ņ”ØņāüņØś Ļ░£ņäĀņŚÉ ĒÜ©Ļ│╝ņĀüņØĖ Ļ▓āņ£╝ļĪ£ ļ░ØĒśĆņĪīļŗż[65]. MetoclopramideņÖĆ levosulpirideļŖö ņåīĒÖöļČłļ¤ē ņ”ØņāüņØä Ļ░£ņäĀņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż[66]. ĻĘĖļ¤¼ļéś ĒÜ©Ļ│╝ņĀüņØĖ D2 ĻĖĖĒĢŁņĀ£ņØĖ metoclopramide, levosulpirideņÖĆ domperidoneņØĆ ņČöņ▓┤ņÖĖļĪ£(extrapyramidal) ņ”ØņāüņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ņ¢┤ ĒĢ£ĻĄŁņŚÉņä£ļŖö Ēł¼ņĢĮ ĻĖ░Ļ░äņØś ņĀ£ĒĢ£ņØ┤ ņ׳ļŗż.
ļ¦Éņ┤łņĀüņ£╝ļĪ£ ņ×æņÜ®ĒĢśļŖö D2 ņłśņÜ®ņ▓┤ ĻĖĖĒĢŁņĀ£ņØĖ itoprideļŖö ņżæņŗ¼ ņłśņÜ®ņ▓┤ņÖĆ ņŚ░Ļ┤ĆļÉ£ ņČöņ▓┤ņÖĖļĪ£ ļČĆņ×æņÜ®ņØä Ēö╝ĒĢĀ ņłś ņ׳Ļ│Ā, ĒöäļĪ£ļØĮĒŗ┤ ĒśĖļź┤ļ¬¼ ņāüņŖ╣ļÅä ņĢäņŻ╝ ņĀüĻ▓ī ļéśĒāĆļé£ļŗż. ņØ┤ļ¤¼ĒĢ£ itoprideļŖö 9Ļ░£ ņŚ░ĻĄ¼, 2,620ļ¬ģņØä ļČäņäØĒĢ£ ļ®öĒāĆļČäņäØņŚÉ ņØśĒĢśļ®┤, ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ ņĀäļ░śņĀüņØĖ ņ”Øņāü, ņŗØĒøä Ēżļ¦īĻ░É, ņĪ░ĻĖ░ ļ¦īļ│ĄĻ░ÉņŚÉ ļīĆĒĢ┤ ĒÜ©Ļ│╝ņĀüņØ┤ņŚłļŗż[67]. ņØ┤ ņĢĮņĀ£ļŖö 3ņāü ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņŚÉņä£ ņśżņŗ¼ ņ”ØņāüņØĆ ņ£ĀņØśĒĢ£ ĒśĖņĀäņØä ļ│┤ņśĆņ£╝ļéś ņĀäļ░śņĀü ņåīĒÖöļČłļ¤ē ņ”Øņāü ĒśĖņĀäņØ┤ ņ£äņĢĮĻĄ░Ļ│╝ ņ░©ņØ┤Ļ░Ć ņŚåņ¢┤ ņśüĻĄŁĻ│╝ ļ»ĖĻĄŁņŚÉņä£ļŖö ņé¼ņÜ®ĒĢĀ ņłś ņŚåņ¦Ćļ¦ī ĒĢ£ĻĄŁņŚÉņä£ļŖö ņé¼ņÜ®ņØ┤ Ļ░ĆļŖźĒĢśļŗż[68].
5-HT4 ņłśņÜ®ņ▓┤ ņ×æņÜ®ņĀ£ ņżæ ļīĆĒæ£ņĀüņØĖ ņĢĮņĀ£ļŖö cisaprideņÖĆ tegaserodņØ┤ņ¦Ćļ¦ī ļČĆņĀĢļ¦źĻ│╝ ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖś ņ£Āļ░£ Ļ░ĆļŖźņä▒ņØ┤ ļ│┤Ļ│ĀļÉśņ¢┤ ļæÉ ņĢĮļ¼╝ ļ¬©ļæÉ Ēśäņ×¼ļŖö ņŗ£ņןņŚÉņä£ Ēć┤ņČ£ļÉ£ ņāüĒā£ņØ┤ļŗż. Ēśäņ×¼ ņé¼ņÜ®Ļ░ĆļŖźĒĢ£ 5-HT4 ņłśņÜ®ņ▓┤ ņ×æņÜ®ņĀ£ņØĖ mosaprideļŖö ļČĆņĀĢļ¦ź ņ£Āļ░£Ļ│╝ Ļ░ÖņØĆ ļČĆņ×æņÜ®ņØĆ ļ│┤Ļ│ĀļÉ£ ļ░ö ņŚåņ£╝ļ®░, ņ£äņןĻ┤Ć ņÜ┤ļÅÖĻ│╝ ņ£äļ░░ņČ£ņØä ņ┤ēņ¦äĒĢ£ļŗż[69]. MosaprideļŖö RCT ņŚ░ĻĄ¼ņŚÉņä£ ņĀäļ░śņĀüņØĖ ņéČņØś ņ¦łņØä Ļ░£ņäĀņŗ£ņ╝░ņ£╝ļéś ņĀäļ░śņĀü ņåīĒÖöļČłļ¤ē ņ”Øņāü Ļ░£ņäĀņØĆ ņ£äņĢĮņŚÉ ļ╣äĒĢśņŚ¼ ņÜ░ņøöĒĢ£ ĒÜ©Ļ│╝ļź╝ ļ│┤ņŚ¼ņŻ╝ņ¦Ć ļ¬╗ĒĢśņśĆļŗż[70,71]. ņĄ£ĻĘ╝ 13Ļ░£ņØś RCTņŚÉ ļīĆĒĢ£ mosapride ļ®öĒāĆļČäņäØņŚÉņä£ ņåīĒÖöļČłļ¤ē ņ”Øņāü Ļ░£ņäĀņŚÉ ņ£ĀņØśĒĢ£ ĒÜ©Ļ│╝ ņ░©ņØ┤Ļ░Ć ņŚåņŚłņ£╝ļéś ņŚ░ĻĄ¼ļ¦łļŗż ņ¦äļŗ©ĻĖ░ņżĆņØ┤ ļŗżļźĖ ņĀ£ĒĢ£ņĀÉņØ┤ ņ׳ņ¢┤ņä£ ņÜ░ņłśĒĢśĻ▓ī ĒåĄņĀ£ļÉ£ 4Ļ░£ņØś ņŚ░ĻĄ¼ņŚÉ ļīĆĒĢ£ ĒĢśņ£ä ļČäņäØ Ļ▓░Ļ│╝, mosaprideĻ░Ć ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ņŚłļŗż(RR = 1.11, 95% CI = 1.01-1.23, p=0.029) [72]. ĻĘĖļ¤¼ļ»ĆļĪ£ 5-HT4 ņłśņÜ®ņ▓┤ ņ×æņÜ®ņĀ£Ļ░Ć ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ņ╣śļŻīņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ļØ╝ļŖö ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆ ņŗżņĀ£ ņ×äņāüņŚÉņä£ ļČĆņ×æņÜ®ņØ┤ ņĀüļŗżļŖö ņĀÉņØä ņóģĒĢ®ņĀüņ£╝ļĪ£ Ļ│ĀļĀżĒĢĀ ļĢī, ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņŚÉ ņ׳ņ¢┤ mosaprideĻ░Ć ĻČīĻ│ĀļÉ£ļŗż[73-75].
ņĄ£ĻĘ╝ņŚÉļŖö ņä£ļ░®ĒśĢ 1ņØ╝ 1ĒÜī ņÜöļ▓Ģ(ĻĖ░ņĪ┤ņØś ĒĢśļŻ© 3ļ▓ł ņÜ®ļ▓ĢņŚÉņä£ Ļ░ÉņåīļÉ£)ņØś mosapride ņĀ£ĒśĢņØ┤ Ļ░£ļ░£ļÉśņŚłļŗż. ņĄ£ĻĘ╝ ņŚ░ĻĄ¼ņŚÉņä£ 138ļ¬ģņØś ĒÖśņ×Éļź╝ ļæÉ ĻĄ░ņ£╝ļĪ£ ļéśļłäņ¢┤ ņä£ļ░®ĒśĢ ņĀ£ņĀ£ņÖĆ ĻĖ░ņĪ┤ ņÜ®ļ▓Ģ ņĀ£ņĀ£ļź╝ Ēł¼ņŚ¼ĒĢ£ Ēøä, ņåīĒÖöļČłļ¤ē ņ”ØņāüņØś ĒśĖņĀäĻ│╝ ļČĆņ×æņÜ®ņØä ļ╣äĻĄÉĒĢśņśĆņØä ļĢī, 1ĒÜī ļ│ĄņÜ® ņä£ļ░®ņĀĢ Ēł¼ņŚ¼ļ▓ĢņØ┤ ĻĖ░ņĪ┤ ņÜ®ļ▓ĢņŚÉ ļ╣äĒĢ┤ņä£ ņŚ┤ļō▒ĒĢśņ¦Ć ņĢŖļŖö Ļ▓āņ£╝ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż. ņĢĮņĀ£ ņł£ņØæļÅä ņĖĪļ®┤ņØä Ļ│ĀļĀżĒĢśļ®┤ 1ĒÜī Ēł¼ņĢĮ ņÜ®ļ▓ĢņØĆ Ē¢źĒøä ņ×äņāüņŚÉņä£ ņóŗņØĆ ņäĀĒāØņØ┤ ļÉĀ Ļ▓āņØ┤ļŗż[76].
2007ļģä ļ░£Ēæ£ļÉ£ ļŗżņ¢æĒĢ£ ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£ļōżņØś ĒÜ©Ļ│╝ļź╝ ņŚ░ĻĄ¼ĒĢ£ ļ®öĒāĆļČäņäØ Ļ▓░Ļ│╝ļź╝ ļ│┤ļ®┤, ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£Ļ░Ć ņ£äņĢĮĻĄ░ņŚÉ ļ╣äĒĢ┤ņä£ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ņ¢╗ņØä ĒÖĢļźĀņØ┤ 30%Ļ░Ć ļŹö ļåÆņĢśļŗż(95% CI = 0.21-0.38, p< 0.001). ĒĢśņ¦Ćļ¦ī ļČĆņ×æņÜ®ņ£╝ļĪ£ ņØĖĒĢ┤ ļŹö ņØ┤ņāü ņé¼ņÜ®ļÉśņ¦Ć ņĢŖļŖö cisaprideĻ░Ć Ļ░Ćņן ļ¦ÄņØ┤ ĒżĒĢ©ļÉ£ ņŚ░ĻĄ¼ļĪ£ Ļ▓░Ļ│╝ ĒĢ┤ņäØņŚÉ ņŻ╝ņØśĻ░Ć ĒĢäņÜöĒĢśļŗż[77]. 38Ļ░£ ņŚ░ĻĄ¼ņŚÉ ļīĆĒĢ£ ļ®öĒāĆļČäņäØņŚÉņä£, ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£ļŖö ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ņä£ ņĀäļ░śņĀüņØĖ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ņ”ØņāüņØä ņØśļ»Ė ņ׳Ļ▓ī Ļ░Éņåīņŗ£ņ╝░Ļ│Ā(NNT = 7), ņéČņØś ņ¦łņØ┤ļéś ņĢĮņĀ£ ļČĆņ×æņÜ®ņŚÉļŖö ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż[78]. ļśÉĒĢ£ ņĄ£ĻĘ╝ 25Ļ░£ņØś ņŚ░ĻĄ¼(4,473ļ¬ģ)ņŚÉ ļīĆĒĢ£ ļ▓ĀņØ┤ņ¦ĆņĢł ļäżĒŖĖņøīĒü¼ ļČäņäØņØä ņØ┤ņÜ®ĒĢ£ ļ®öĒāĆļČäņäØ Ļ▓░Ļ│╝, ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£Ļ░Ć ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ ĒÜ©Ļ│╝ņĀüņØĖ ņ╣śļŻīņĀ£ņ×äņØä ĒÖĢņØĖĒĢśņśĆļŗż. ĒŖ╣Ē׳, league-to-league ļČäņäØļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī itoprideļéś acotiamideļ│┤ļŗż metoclopramide, trimebutine, mosapride, domperidone ņĢĮņĀ£ļōżņØ┤ ļŹö ņóŗņØĆ ĒÜ©Ļ│╝ļź╝ ļ│┤ņśĆļŗż[79].
DA-9701 (motilitone┬«)ņØĆ Pharbitidis semenĻ│╝ Corydalis tuberņŚÉņä£ ņČöņČ£ĒĢ£ ņĢĮņĀ£ļĪ£ ņ£äļ░░ņČ£ļŖź ļ░Å ņ£äņĀĆļČĆ ņĀüņØæļŖźļĀźņØä Ē¢źņāüņŗ£ĒéżĻ│Ā, ļé┤ņןĻ│╝ļ»╝ņä▒ņŚÉļÅä ĒÜ©Ļ│╝Ļ░Ć ņ׳ņŚłļŗż. 389ļ¬ģņØś ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×Éļź╝ ņäĖ ĻĘĖļŻ╣(motilitoneņ╣śļŻīĻĄ░, PPI ņ╣śļŻīĻĄ░, motilitone + PPI ņ╣śļŻīĻĄ░)ņ£╝ļĪ£ ļéśļłäņ¢┤ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī ļ¬©ļōĀ ĻĘĖļŻ╣ņŚÉņä£ ņåīĒÖöļČłļ¤ē ņ”ØņāüĻ│╝ ņéČņØś ņ¦łņØ┤ ņØśļ»Ė ņ׳Ļ▓ī ĒśĖņĀäļÉśņŚłļŗż[80].
ņ”Øņāü ņĪ░ņĀłņØ┤ ņל ļÉśņ¦Ć ņĢŖļŖö ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņØś Ļ▓ĮņÜ░, metoclopramideņÖĆ domperidoneĻ│╝ Ļ░ÖņØĆ ļæÉ ņóģļźśņØś ņ£äņןĻ┤Ć ņÜ┤ļÅÖ ņ┤ēņ¦äņĀ£ļź╝ ļ│æĒĢ®ĒĢśņŚ¼ ņé¼ņÜ®ĒĢśļŖö Ļ▓āļÅä ĒÜ©Ļ│╝Ļ░Ć ņ׳ņŚłļŗż[81,82]. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņŚÉ ļīĆĒĢ£ ņ£äņןĻ┤Ć ņÜ┤ļÅÖ ņ┤ēņ¦äņĀ£ņØś ĻĖ░ņĀä, ļ│ĄņÜ® ņÜ®ļ¤ē, ļČĆņ×æņÜ® ļō▒ņØĆ Ēæ£ 3ņŚÉ ņÜöņĢĮĒĢśņśĆļŗż.
8. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ņĢäĒśĢ ņżæ ņŗØĒøäĻ│ĀĒåĄņ”ØĒøäĻĄ░ ĒÖśņ×ÉņŚÉņä£ ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£ļź╝ 1ņ░© ņ╣śļŻī ņĢĮņĀ£ļĪ£ ņÜ░ņäĀņĀüņ£╝ļĪ£ ĻČīĻ│ĀĒĢ£ļŗż.
ŌĆó ĻČīĻ│Ā ļō▒ĻĖē: Ļ░ĢĒĢ©
ŌĆó ņ”ØĻ▒░ ņłśņżĆ: ļé«ņØī
ŌĆó ņĀäļ¼ĖĻ░Ć ņØśĻ▓¼: ņĀäņĀüņ£╝ļĪ£ ļÅÖņØśĒĢ©(32.2%), ļīĆņ▓┤ļĪ£ ļÅÖņØśĒĢ©(60.7%), ņØ╝ļČĆ ļÅÖņØśĒĢ©(7.1%), ļīĆņ▓┤ļĪ£ ļÅÖņØśĒĢśņ¦Ć ņĢŖņØī(0%), ņĀäņĀüņ£╝ļĪ£ ļÅÖņØśĒĢśņ¦Ć ņĢŖņØī(0%), ļ¬©ļź┤Ļ▓ĀņØī(0%)
ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×É ņżæ ņŗØĒøä Ēżļ¦īĻ░É ļśÉļŖö ņĪ░ĻĖ░ ļ¦īļ│ĄĻ░ÉņØä ĒśĖņåīĒĢśļŖö PDS ņ£ĀĒśĢņØĆ ļ¦żņÜ░ ĒØöĒĢśļŗż[83]. ņ£äņĀĢņ▓┤ ņ”Øņāü(gastric stasis symptom)ĻĄ░Ļ│╝ EPSĻĄ░ņ£╝ļĪ£ ļéśļłäņ¢┤ ļČäņäØĒĢ£ ņØ╝ļ│ĖņØś ļīĆĻĘ£ļ¬© mosapride ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤, ņ£äņĀĢņ▓┤ ņ”ØņāüĻĄ░ņŚÉņä£ mosapride Ēł¼ņŚ¼Ļ░Ć ņØśļ»Ė ņ׳ļŖö ņ”Øņāü Ļ░£ņäĀņØä ļ│┤ņśĆļŗż[73]. ļśÉĒĢ£ EPSĻĄ░Ļ│╝ PDSĻĄ░ņØ┤ ļ¬©ļæÉ ĒżĒĢ©ļÉ£ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ 1ņØ╝ 3ĒÜī ļ│ĄņÜ®ĒĢśļŖö mosaprideņÖĆ 1ņØ╝ 1ĒÜī ļ│ĄņÜ®ĒĢśļŖö ņä£ļ░®ĒśĢ mosaprideņØä ļ╣äĻĄÉĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£, PDSĻĄ░ņŚÉņä£ ļ¬©ļæÉ ņ”Øņāü ĒśĖņĀäņØä ļ│┤ņśĆņ£╝ļéś ļæÉ ņĢĮņĀ£ Ļ░ä ņ░©ņØ┤ļŖö ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż[76]. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņŚÉņä£ itoprideņØś ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ£ ļ®öĒāĆļČäņäØņŚÉņä£ domperidoneĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ itoprideĻ░Ć ņŗØĒøä Ēżļ¦īĻ░ÉĻ│╝ ņĪ░ĻĖ░ ļ¦īļ│ĄĻ░ÉņŚÉņä£ ņ£ĀņØśĒĢ£ ĒÜ©Ļ│╝ļź╝ ļ│┤ņśĆļŗż[67].
AcotiamideļŖö ņןĻ┤Ć ņŗĀĻ▓ĮĻ│äņŚÉņä£ M1 ļ░Å M2 ļ¼┤ņŖżņ╣┤ļ”░ ņłśņÜ®ņ▓┤ņØś ĻĖĖĒĢŁņ×æņÜ®Ļ│╝ ņĢäņäĖĒŗĖņĮ£ļ”░ ļČäĒĢ┤ĒÜ©ņåīņŚÉ ļīĆĒĢ£ ņ¢ĄņĀ£ņ×æņÜ®ņØä ĒåĄĒĢ┤ ņĢäņäĖĒŗĖņĮ£ļ”░ ļČäļ╣äļź╝ ņ”ØĻ░Ćņŗ£ņ╝£ ņ£äņןĻ┤Ć ņÜ┤ļÅÖ ĒÖ£ļÅÖņØä ņ┤ēņ¦äņŗ£ĒéżļŖö ņĢĮņĀ£ņØ┤ļŗż[84]. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ acotiamideļź╝ 4ņŻ╝ ļÅÖņĢł Ēł¼ņĢĮĒĢ£ RCT Ļ▓░Ļ│╝, ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØś ņżæņ”ØļÅäĻ░Ć ĒśĖņĀäļÉśņŚłĻ│Ā[85], ņØ┤ļŖö acotiamideĻ░Ć ņ£äņĀüņØæĻ│╝ ņ£äļ░░ņČ£ļŖźņØä ĒśĖņĀäņŗ£ņ╝£ ņ”Øņāü Ļ░£ņäĀņØä Ļ░ĆņĀĖņśżĻĖ░ ļĢīļ¼ĖņØ┤ļØ╝Ļ│Ā ņĢīļĀżņĀĖ ņ׳ļŗż[86]. 7Ļ░£ņØś RCTņŚÉ ĻĘ╝Ļ▒░ĒĢ£ ļ®öĒāĆļČäņäØņŚÉņä£ļÅä acotiamideĻ░Ć ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ņä£ PDSņŚÉ Ļ┤ĆļĀ©ļÉ£ ņ”Øņāü ĒśĖņĀäņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ņŚłņ£╝ļ®░[87], ņéČņØś ņ¦łņŚÉ ņØśļ»Ė ņ׳ļŖö ĒśĖņĀäņØä ļ│┤ņśĆļŗż[88,89]. ĻĘĖļ¤¼ļéś ņØ┤ ņĢĮņØĆ ĻĄŁļé┤ņŚÉņä£ ņĢäņ¦ü ņé¼ņÜ®ņØ┤ ļČłĻ░ĆļŖźĒĢśĻ│Ā, ļŗżļźĖ ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£ņÖĆņØś ļ╣äĻĄÉ ņŚ░ĻĄ¼Ļ░Ć ļČĆņĪ▒ĒĢ£ ņāüĒā£ņØ┤ļŗż. ErythromycinņØĆ ņ£äļ░░ņČ£ņØä ņ┤ēņ¦äņŗ£ĒéżļŖö ļŹ░ ĒÜ©Ļ│╝ņĀüņØĖ ļ¬©ĒŗĖļ”░ ņłśņÜ®ņ▓┤ ņ×æņÜ®ņĀ£ņØ┤ļ®░, ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒīĮļ¦īĻ░É Ļ┤ĆļĀ© ņ”ØņāüņØś ĒśĖņĀäņØä ļ│┤ņśĆļŗż[90]. ĻĘĖļ¤¼ļéś RCTņŚÉņä£ļŖö ņ£äņĢĮĻ│╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī erythromycin Ēł¼ņĢĮĻĄ░ņŚÉņä£ ņ£äļ░░ņČ£ņŚÉ ļīĆĒĢ┤ ĒåĄĻ│äņĀüņØĖ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśĻ│Ā, Ēśäņ×¼ ĻĄŁļé┤ņŚÉņä£ ņé¼ņÜ®ļÉśņ¦Ć ņĢŖĻ│Ā ņ׳ļŗż[91].
9. ņןĻĖ░Ļ░ä ļÅäĒīīļ»╝ņłśņÜ®ņ▓┤ ĻĖĖĒĢŁņĀ£ ļ│ĄņÜ®ņØĆ ļ╣äĻ░ĆņŚŁņĀüņØĖ ņĢĮņĀ£ ļČĆņ×æņÜ®ņØä ņĢ╝ĻĖ░ĒĢĀ ņłś ņ׳ņ£╝ļ»ĆļĪ£ ļŗ©ĻĖ░Ļ░äņØś ņĄ£ņåī ņé¼ņÜ®ņØä Ļ│ĀļĀżĒĢ£ļŗż.
ŌĆó ĻČīĻ│Ā ļō▒ĻĖē: Ļ░ĢĒĢ©
ŌĆó ņ”ØĻ▒░ ņłśņżĆ: ļé«ņØī
ņ£äņĢĮ ļīĆļ╣ä ĒÜ©Ļ│╝Ļ░Ć ņ”Øļ¬ģļÉ£ ļīĆļČĆļČäņØś ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£ļŖö D2 ņłśņÜ®ņ▓┤(dopamine receptor type 2) ĻĖĖĒĢŁņĀ£ņØ┤ļŗż. MetoclopramideļŖö ņāüņÜ®ļ¤ēņØś Ēł¼ņĢĮņ£╝ļĪ£ļÅä ĻĖēņä▒ ĻĘ╝ĻĖ┤ņןņØ┤ņāüļ░śņØæ(tardive dyskinesia)ņØä ņĢ╝ĻĖ░ĒĢĀ ņłś ņ׳ļŗż. ņČöņ▓┤ņÖĖļĪ£Ļ│ä ņ£ĀĒĢ┤ĒÜ©Ļ│╝ņØś ņ£äĒŚśļÅäļŖö ļłäņĀü ņÜ®ļ¤ēņŚÉ ļö░ļØ╝ ņ”ØĻ░ĆĒĢśļ®░, ņØ╝ļ░śņĀüņ£╝ļĪ£ ļ╣äĻ░ĆņŚŁņĀüņØĖ Ļ▓ĮņÜ░Ļ░Ć ļ¦Äņ£╝ļ®░ ņ▓ŁņåīļģäĻĖ░ ĒÖśņ×ÉņŚÉņä£ ļŹö ĒØöĒĢśĻ▓ī ļ░£ņāØĒĢ£ļŗż[92]. Ēśäņ×¼ ņŗØĒÆłņØśņĢĮĒÆłņĢłņĀäņ▓śņŚÉņä£ ļŗ©ĻĖ░Ļ░ä(ņĄ£ļīĆ 5ņØ╝ ņØ┤ļé┤)ņØś ņé¼ņÜ®ņØä ĻČīĻ│ĀĒĢśĻ│Ā ņ׳ļŗż.
DomperidoneņØĆ QT-Ļ░äĻ▓® ņŚ░ņן ņ”ØĒøäĻĄ░ ļ░Å ņ╣śļ¬ģņĀüņØĖ ļČĆņĀĢļ¦źņØä ņØ╝ņ£╝Ēé¼ ņłś ņ׳ļŗż[93,94]. ņŗØĒÆłņØśņĢĮĒÆłņĢłņĀäņ▓śļŖö ņØ╝ļ░śņĀüņØĖ ņåīĒÖöļČłļ¤ēņØś ņÖäĒÖö ļ¬®ņĀüņ£╝ļĪ£ ĒĢśļŻ© ņ┤Ø 30 mgņØä ņĄ£ļīĆ 1ņŻ╝Ļ╣īņ¦Ćļ¦ī ĒŚłņÜ®ĒĢśĻ│Ā ņ׳ļŗż. ļ¦īņØ╝ QT-Ļ░äĻ▓®ņŚ░ņןņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŖö ņĢĮļ¼╝ļōż(quinolone, clarithromycin, isoniazid, fluoxetine ļō▒)ņØä ļ│ĄņÜ® ņżæņØĖ ĒÖśņ×ÉņŚÉĻ▓ī domperidoneņØĆ ļŹöņÜ▒ ņ╣śļ¬ģņĀüņØ╝ ņłś ņ׳ļŗż. 5-10Ļ░£ņøö ļÅÖņĢł levosulpirideļź╝ ļ│ĄņÜ®ĒĢ£ 60ņäĖ ņØ┤ņāüņØś ĒÖśņ×É ņżæ ņØ╝ļČĆņŚÉņä£ ĒīīĒé©ņŖ©ņ”Ø, ļ¢©ļ”╝ Ļ░ÖņØĆ ņÜ┤ļÅÖ ņןņĢĀĻ░Ć ĒÖĢņØĖļÉśņŚłĻ│Ā, levosulpiride ņżæļŗ© ĒøäņŚÉļÅä ņØ┤ļ¤¼ĒĢ£ ņ”ØņāüņØ┤ ĒśĖņĀäļÉśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░Ļ░Ć ņ׳ņ¢┤ Ļ│ĀļĀ╣ ĒÖśņ×ÉņŚÉĻ▓ī ņןĻĖ░Ļ░ä Ēł¼ņŚ¼ĒĢĀ ļĢī ņŻ╝ņØśĻ░Ć ĒĢäņÜöĒĢśļŗż[95].
10. ĒŚ¼ļ”¼ņĮöļ░ĢĒä░ ņĀ£ĻĘĀ ņ╣śļŻīļŖö ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ņןĻĖ░ņĀüņØĖ ņ”Øņāü ņÖäĒÖöņŚÉ ļÅäņøĆņØ┤ ļÉśĻĖ░ ļĢīļ¼ĖņŚÉ ĻČīĻ│ĀĒĢ£ļŗż.
ŌĆó ĻČīĻ│Ā ļō▒ĻĖē: ņĢĮĒĢ©
ŌĆó ņ”ØĻ▒░ ņłśņżĆ: ļåÆņØī
ŌĆó ņĀäļ¼ĖĻ░Ć ņØśĻ▓¼: ņĀäņĀüņ£╝ļĪ£ ļÅÖņØśĒĢ©(18.5%), ļīĆņ▓┤ļĪ£ ļÅÖņØśĒĢ©(55.6%), ņØ╝ļČĆ ļÅÖņØśĒĢ©(25.9%), ļīĆņ▓┤ļĪ£ ļÅÖņØśĒĢśņ¦Ć ņĢŖņØī(0%), ņĀäņĀüņ£╝ļĪ£ ļÅÖņØśĒĢśņ¦Ć ņĢŖņØī(0%), ļ¬©ļź┤Ļ▓ĀņØī(0%)
ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉ ļīĆĒĢ£ H. pylori ņĀ£ĻĘĀ ņ╣śļŻīņØś ĒÜ©Ļ│╝ļź╝ ļČäņäØĒĢ£ RCTļź╝ ļīĆņāüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢ£ ļ®öĒāĆļČäņäØņŚÉ ļö░ļź┤ļ®┤, H. pylori ņĀ£ĻĘĀ ņ╣śļŻīĻĄ░ņŚÉņä£ 6Ļ░£ņøö ņØ┤ņāü ņןĻĖ░Ļ░ä ņČöņĀü Ļ┤Ćņ░░ņØä ĒĢśņśĆņØä ļĢī, ņ×æņ¦Ćļ¦ī ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņåīĒÖöļČłļ¤ē ņ”Øņāü Ļ░£ņäĀņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļéś[18,96], 3Ļ░£ņøöņØś ļŗ©ĻĖ░Ļ░ä ņČöņĀü Ļ┤Ćņ░░ ņŗ£ņŚÉ ĻĘĖ ĒÜ©Ļ│╝ļŖö ņ£ĀņØśĒĢśņ¦Ć ņĢŖņĢśļŗż[96]. 14Ļ░£ņØś RCTļź╝ ļČäņäØĒĢ£ ĒĢ£ ļ®öĒāĆļČäņäØņŚÉņä£ļŖö ņĀ£ĻĘĀ ņ╣śļŻīĻĄ░ņŚÉņä£ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØś ĒśĖņĀäņØä ļ│┤ņŚ¼ņŻ╝ņŚłņ£╝ļéś[18], 25Ļ░£ RCTļź╝ ļČäņäØĒĢ£ ļŗżļźĖ ļ®öĒāĆļČäņäØņŚÉņä£ļŖö ņ”Øņāü ĒśĖņĀäņØ┤ļéś ņéČņØś ņ¦łņØś ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåĻ│Ā ļČĆņ×æņÜ®ņØĆ ļåÆļŗżļŖö ņāüļ░śļÉ£ Ļ▓░Ļ│╝ļź╝ ļ│┤ņśĆļŗż[96]. ņ£Āļ¤ĮĻ│╝ ļ»ĖĻĄŁ ļ░Å ņ║ÉļéśļŗżņØś ņ¦äļŻī ņ¦Ćņ╣©ņŚÉņä£ļŖö ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ H.pylori ņĀ£ĻĘĀ ņ╣śļŻīļź╝ Ļ░ĢļĀźĒ׳ ĻČīĻ│ĀĒĢśĻ│Ā ņ׳ļŗż[12,17].
ņØ┤ļ▓ł Ļ░£ņĀĢĒīÉņŚÉņä£ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ H. pylori ņĀ£ĻĘĀ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢśņŚ¼ 1997ļģä 1ņøöļČĆĒä░ 2017ļģä 12ņøöĻ╣īņ¦Ć ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×Éļź╝ ņĀ£ĻĘĀ ņ╣śļŻī Ēøä 6Ļ░£ņøö ņØ┤ņāü ņČöņĀü Ļ┤Ćņ░░ĒĢ£ 18Ļ░£ņØś RCTņŚÉ ļīĆĒĢ£ ļ®öĒāĆļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż(Table 4, Figs. 4 and 5) [97-114]. H. pylori ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ĒĢ£ ĻĄ░ņŚÉņä£ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØ┤ ņ£ĀņØśĒĢśĻ▓ī Ļ░£ņäĀļÉśņŚłņ£╝ļéś(RR 1.18, 95% CI = 1.07-1.31) ņŚ░ĻĄ¼Ļ░ä ņØ┤ņ¦łņä▒ņØĆ ņżæĻ░ä ņĀĢļÅäņśĆĻ│Ā(Žć2 = 25.7, p= 0.08, I2 = 34%) (Fig. 5), NNTļŖö 14ļ¬ģ(95% CI = 11-18)ņ£╝ļĪ£ ĻĘĖ ņ╣śļŻī ĒÜ©Ļ│╝ļŖö Ēü¼ņ¦Ć ņĢŖņĢśļŗż. ņŚ░ĻĄ¼Ļ░Ć ņŗ£Ē¢ēļÉ£ ņ¦ĆņŚŁņŚÉ ļö░ļØ╝ ĒĢśņ£ä ļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŖöļŹ░, ņĢäņŗ£ņĢäņŚÉņä£ 5 Ļ░£ņØś RCTĻ░Ć ņ׳ņŚłĻ│Ā ņĢäņŗ£ņĢä ņØ┤ņÖĖ ņ¦ĆņŚŁņŚÉņä£ 13Ļ░£ņØś RCTĻ░Ć ņ׳ņŚłļŗż. H. pylori ņĀ£ĻĘĀ ņ╣śļŻīļŖö ņĢäņŗ£ņĢä ņØ┤ņÖĖ ņ¦ĆņŚŁņØś ņŚ░ĻĄ¼ņŚÉņä£ ĒśäņĀĆĒĢ£ ņØ┤ņ¦łņä▒(Žć2 = 18.1, p= 0.11, I2 = 33%) ņŚåņØ┤ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØä ņ£ĀņØśĒĢśĻ▓ī Ļ░£ņäĀņŗ£ņ╝░ļŗż(RR = 1.22; 95% CI = 1.08-1.38). ĻĘĖļ¤¼ļéś ņĢäņŗ£ņĢä ņ¦ĆņŚŁņŚÉņä£ ņłśĒ¢ēļÉ£ RCTļōżņØś ļ®öĒāĆļČäņäØ Ļ▓░Ļ│╝ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņŚÉ ļīĆĒĢ£ H.pylori ņĀ£ĻĘĀ ņ╣śļŻīņØś ĒÜ©Ļ│╝Ļ░Ć ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśņ¦Ć ņĢŖņĢśņ£╝ļ®░(RR = 1.10, 95% CI = 0.92-1.31), ņŚ░ĻĄ¼ Ļ░äņØś ņØ┤ņ¦łņä▒ļÅä ļé«ņĢśļŗż(Žć2 = 5.9, p= 0.21, I2 = 32%).
ņÜöņĢĮĒĢśļ®┤ ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉņŚÉņä£ H. pylori ņĀ£ĻĘĀ ņ╣śļŻīļŖö ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ”Øņāü ĒśĖņĀäņØä ļ│┤ņśĆņ£╝ļéś NNTĻ░Ć Ēü¼Ļ│Ā, ņĢäņŗ£ņĢäņŚÉņä£ ņłśĒ¢ēļÉ£ RCTļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ļ®öĒāĆļČäņäØņŚÉņä£ļŖö ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśņ¦Ć ņĢŖņĢä ļåÆņØĆ H. pylori ņ£Āļ│æļźĀ, ņĀ£ĻĘĀ ņ╣śļŻīļĪ£ ņØĖĒĢ£ ņĢĮņĀ£ ļ╣äņÜ® ļ░Å ņĢĮļ¼╝ ļČĆņ×æņÜ®, ļé┤ņä▒ĻĘĀņØś ņČ£Ēśä ņ£äĒŚś, ņ×¼Ļ░ÉņŚ╝ņØś ņ£äĒŚś ļō▒ņØä Ļ│ĀļĀżĒĢśņŚ¼ ņØ┤ļ▓ł ņ¦Ćņ╣©ņŚÉņä£ļŖö ņĢĮĒĢ£ ĻČīĻ│Āļź╝ ņäĀĒāØĒĢśņśĆļŗż.
11. ņ£ä ĻĖ░ņĀĆļČĆ ņØ┤ņÖäņĀ£ļŖö ņĀäļ░śņĀüņØĖ ņåīĒÖöļČłļ¤ē ņ”Øņāü, ņŗØĒøä Ēżļ¦īĻ░ÉĻ│╝ ņĪ░ĻĖ░ ļ¦īļ│ĄĻ░ÉņØś ĒśĖņĀäņŚÉ ļÅäņøĆņØ┤ ļÉśņ¢┤ ĻČīĻ│ĀĒĢ£ļŗż.
ŌĆó ĻČīĻ│Ā ļō▒ĻĖē: ņĢĮĒĢ©
ŌĆó ņ”ØĻ▒░ ņłśņżĆ: ņżæļō▒ļÅä
ņŗØĒøä ĻĘ╝ņ£äļČĆņØś ņØ┤ņÖä ņןņĢĀļŖö ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņØś ņĢĮ 40%ņŚÉņä£ ņ׳ņ£╝ļ®░, ņĪ░ĻĖ░ ļ¦īļ│ĄĻ░É, ņ▓┤ņżæĻ░Éņåī ļō▒ņØś ņ”ØņāüĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŖö ļ│æĒā£ņāØļ”¼ĻĖ░ņĀäņØ┤ļŗż[115]. BuspironeĻ│╝ tandospironeņØĆ 5-HT1 ņłśņÜ®ņ▓┤ ņ×æņÜ®ņĀ£ņØ┤ļ®░ ņ£ä ĻĖ░ņĀĆļČĆļź╝ ņØ┤ņÖäņŗ£ĒéżļŖö ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļéĖļŗż[116]. ĒĢ£ ņØ┤ņżæ ļ¦╣Ļ▓Ć ĻĄÉņ░©ņŚ░ĻĄ¼ņŚÉ ņØśĒĢśļ®┤ 4ņŻ╝ ļÅÖņĢłņØś buspirone Ēł¼ņŚ¼ļŖö ņ£ä ĻĖ░ņĀĆļČĆ ņØ┤ņÖäņØä ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░Ćņŗ£ĒéżĻ│Ā, ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ ņĀäļ░śņĀüņØĖ ņåīĒÖöļČłļ¤ē ņ”ØņāüņĀÉņłśņØś Ļ░£ņäĀĻ│╝ ņŗØĒøä Ēżļ¦īĻ░É, ņĪ░ĻĖ░ ļ¦īļ│ĄĻ░É, ļ│ĄļČĆĒīĮļ¦ī ļō▒ Ļ░£ļ│ä ņ”ØņāüņØś Ļ░£ņäĀņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ņŚłļŗż[117]. TandospironeņØä 4ņŻ╝ ļÅÖņĢł Ēł¼ņŚ¼ĒĢ£ RCT ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ tandospirone Ēł¼ņŚ¼ĻĄ░ņŚÉņä£ ļ│ĄļČĆ ņ”ØņāüĻ│╝ ņāüļ│ĄļČĆĒåĄņ”ØņØ┤ ņ£ĀņØśĒĢśĻ▓ī ĒśĖņĀäļÉśņŚłļŗż[118]. Cisapride, tegaserod, mosapride ļō▒ 5-HT4 ņłśņÜ®ņ▓┤ ņ×æņÜ®ņĀ£ļŖö ņŗØĒøä ņ£ä ĻĖ░ņĀĆļČĆ ņØ┤ņÖäņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļé┤ļ®░, ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņØś ņØ╝ļČĆņŚÉņä£ ņ”ØņāüņØä ĒśĖņĀäņŗ£Ēé©ļŗż[69,119-121]. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉĻĄ░ņŚÉņä£ acotiamideļź╝ Ēł¼ņŚ¼ĒĢ£ Ēøä ļ│ĄļČĆ ņ┤łņØīĒīīļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ£ä ĻĖ░ņĀĆļČĆ ņØ┤ņÖä ņĀĢļÅäļź╝ ņĖĪņĀĢĒĢśņśĆņØä ļĢī ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ņ£ä ĻĖ░ņĀĆļČĆ ņØ┤ņÖäņØä ņ”ØĻ░Ćņŗ£ņ╝░ļŗż[122]. ņ£ä ņŗĀĒŗ░ĻĘĖļלĒö╝ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢ£ ņ£äņĢĮ ļīĆņĪ░ĻĄ░ ņŚ░ĻĄ¼ņŚÉņä£ acotiamideļŖö ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ ņ£ä ĻĖ░ņĀĆļČĆ ņØ┤ņÖäņØä ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░Ćņŗ£ņ╝░ņ£╝ļ®░, ņ£äņןĻ┤Ć ņ┤Ø ņ”ØņāüņĀÉņłś ļ░Å ļČłņĢł ņĀÉņłśļź╝ ņ£ĀņØśĒĢśĻ▓ī ĒśĖņĀäņŗ£ņ╝░ļŗż[86]. ņØ╝ļČĆ ĒĢŁņÜ░ņÜĖņĀ£ļÅä ņ£ä ĻĖ░ņĀĆļČĆ ņØ┤ņÖäņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļéĖļŗż. ņØ┤ņżæ ļ¦╣Ļ▓Ć ņ£äņĢĮ ļīĆņĪ░ĻĄ░ ņŚ░ĻĄ¼ņŚÉņä£ amitriptylineĻ│╝ escitalopramņØä 12ņŻ╝ ļÅÖņĢł Ēł¼ņŚ¼ĒĢśļ®┤ņä£ ļŗ©ņØ╝ Ļ┤æņ×É ļ░®ņČ£ ņ╗┤Ēō©Ēä░ļŗ©ņĖĄņ┤¼ņśü(single-photon emission computed tomography)ņ£╝ļĪ£ ņ£ä ĻĖ░ņĀĆļČĆ ņØ┤ņÖäņØä ņĖĪņĀĢĒĢśņśĆņØä ļĢī, ņØ┤ ņĢĮņĀ£ļōżņØĆ ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ ņ£ä ĻĖ░ņĀĆļČĆ ņØ┤ņÖäņØä ņ£ĀņØśĒĢśĻ▓ī Ļ░£ņäĀņŗ£ņ╝░ļŗż[123].
12. ņé╝ĒÖśĻ│ä ĒĢŁņÜ░ņÜĖņĀ£ļŖö ņé░ļČäļ╣äņ¢ĄņĀ£ņĀ£, ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£ ļō▒ ĻĖ░ņĪ┤ņØś ņ╣śļŻīņŚÉ ļ░śņØæĒĢśņ¦Ć ņĢŖļŖö ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×É ņ╣śļŻīņŚÉ ļÅäņøĆņØä ņżä ņłś ņ׳ņ¢┤ ĻČīĻ│ĀĒĢ£ļŗż.
ŌĆó ĻČīĻ│Ā ļō▒ĻĖē: ņĢĮĒĢ©
ŌĆó ņ”ØĻ▒░ ņłśņżĆ: ņżæļō▒ļÅä
ŌĆó ņĀäļ¼ĖĻ░Ć ņØśĻ▓¼: ņĀäņĀüņ£╝ļĪ£ ļÅÖņØśĒĢ©(34.6%), ļīĆņ▓┤ļĪ£ ļÅÖņØśĒĢ©(53.9%), ņØ╝ļČĆ ļÅÖņØśĒĢ©(11.5%), ļīĆņ▓┤ļĪ£ ļÅÖņØśĒĢśņ¦Ć ņĢŖņØī(0%), ņĀäņĀüņ£╝ļĪ£ ļÅÖņØśĒĢśņ¦Ć ņĢŖņØī(0%), ļ¬©ļź┤Ļ▓ĀņØī(0%)
TCAļŖö ĻĖ░ļŖźņä▒ ņ£äņן ņןņĢĀĻ░Ć ņ׳ļŖö ĒÖśņ×ÉļōżņØś ņ”ØņāüņØä ĒśĖņĀäņŗ£ĒéżĻĖ░ ņ£äĒĢ┤ ņ×äņāüņŚÉņä£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż. ņĄ£ĻĘ╝ ĻĄŁļé┤ņŚÉņä£ ļ░£Ēæ£ļÉ£ Ļ│╝ļ»╝ņä▒ņןņ”ØĒøäĻĄ░ņØś ņ╣śļŻī ņ¦Ćņ╣©ņŚÉņä£ļÅä ĒĢŁņÜ░ņÜĖ ņ×æņÜ® ņØ┤ņÖĖņŚÉ ĒåĄņ”Ø ņĪ░ņĀł(pain modulation) ĻĖ░ņĀäņ£╝ļĪ£ ņ”ØņāüņØä ĒśĖņĀäņŗ£ņ╝£ TCA ņé¼ņÜ®ņØ┤ ĻČīĻ│ĀļÉ£ļŗżĻ│Ā ĻĖ░ņłĀĒĢśĻ│Ā ņ׳ļŗż[11]. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ TCAņÖĆ ņ£äņĢĮņØä ļ╣äĻĄÉĒĢ£ ļæÉ Ļ░£ņØś ņ▓┤Ļ│äņĀü ļ¼ĖĒŚīĻ│Āņ░░ ļģ╝ļ¼ĖņØ┤ ņĄ£ĻĘ╝ņŚÉ ļ░£Ēæ£ļÉśņŚłļŗż[124,125]. 4Ļ░£ņØś RCTļź╝ ĒżĒĢ©ĒĢ£ ņ▓½ ļ▓łņ¦Ė ļģ╝ļ¼ĖņŚÉņä£ TCAļŖö ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ ņ╣śļŻīņŚÉ ļ░śņØæņØ┤ ņŚåļŖö ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉļōżņØś ņłśļź╝ Ļ░Éņåīņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļ®░ (RR = 0.76; 95% CI = 0.62-0.94), NNTļŖö 7ļ¬ģņØ┤ņŚłļŗż(95% CI = 4-26) [124]. 3Ļ░£ņØś RCTļź╝ ĒżĒĢ©ĒĢ£ ļæÉ ļ▓łņ¦Ė ļģ╝ļ¼ĖņŚÉņä£ļÅä TCAļŖö ņåīĒÖöļČłļ¤ē ņ”ØņāüņØä ņżäņØ┤ļŖö ļŹ░ ĒÜ©Ļ│╝ņĀüņØĖ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļ®░(RR 0.74, 95% CI 0.61-0.91), NNTļŖö 6ļ¬ģņØ┤ņŚłļŗż(95% CI 6-18) [125]. ņĀĆņ×ÉļōżņØĆ ņ£äņØś ņŻ╝ņĀ£ņÖĆ Ļ┤ĆļĀ©ĒĢśņŚ¼ ņØ┤ņĀä ļ¼ĖĒŚīĻ│Āņ░░ņŚÉņä£ļŖö ĒżĒĢ©ļÉśņ¦Ć ņĢŖņĢśļŹś 1Ļ░£ņØś RCT [126]ļź╝ ĒżĒĢ©ĒĢśņŚ¼ ņ▓┤Ļ│äņĀü ļ¼ĖĒŚīĻ│Āņ░░Ļ│╝ ļ®öĒāĆļČäņäØņØä ĒĢśņśĆļŗż. ĻĘĖ Ļ▓░Ļ│╝, TCAļŖö ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉļōżņØś ņ”Øņāü ĒśĖņĀäņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ņŚłļŗż(RR = 0.78, 95% CI = 0.64-0.93, p= 0.008) (Fig. 6). ĻĘĖļ”¼Ļ│Ā TCAņØś ņé¼ņÜ®ņ£╝ļĪ£ ņØĖĒĢ┤ ļČĆņ×æņÜ®ņØ┤ ļ░£ņāØĒĢĀ ĒÖĢļźĀņØĆ ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ ļåÆņ¦Ć ņĢŖņØĆ Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż(RR = 1.56, 95% CI = 0.88-2.76, p= 0.13)(Fig. 7).
ņĢäņŗ£ņĢäņŚÉņä£ ņŗ£Ē¢ēļÉ£ ņŚ░ĻĄ¼ļōżļĪ£ļŖö ļČłņØæņä▒ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ TCAņÖĆ ņ£äņĢĮņØś ĒÜ©Ļ│╝ļź╝ ļ╣äĻĄÉĒĢ£ 2Ļ░£ņØś RCTĻ░Ć ņ׳ņŚłļŗż[126,127]. ņ▓½ ļ▓łņ¦Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö imipramineĻ│╝ ņ£äņĢĮņØä 12ņŻ╝Ļ░ä Ēł¼ņŚ¼ĒĢśņŚ¼ imipramineņØ┤ ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØś Ļ░£ņäĀņŚÉ ĒÜ©Ļ│╝Ļ░Ć ņ׳ņØīņØä ĒÖĢņØĖĒĢśņśĆļŗż[126]. NortriptylineĻ│╝ ņ£äņĢĮņØä 8ņŻ╝ ļÅÖņĢł Ēł¼ņŚ¼ĒĢ£ ļśÉ ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£ļŖö nortriptylineņØ┤ ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØä Ļ░Éņåīņŗ£Ēé┤ņØä ņ”Øļ¬ģĒĢśņ¦Ć ļ¬╗ĒĢśņśĆļŗż[127]. Talley ļō▒[128]ņØĆ TCAĻ░Ć PDS ņ”ØņāüņØ┤ ņ׳ļŖö ĒÖśņ×Éļōż ļ│┤ļŗżļŖö ņåīĒÖöņä▒ ĻČżņ¢æņØś ņ”ØņāüĻ│╝ Ļ░ÖņØĆ EPS ĒÖśņ×ÉļōżņŚÉņä£ ļŹö ĒÜ©Ļ│╝ņĀüņ×äņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņÜöņĢĮĒĢśļ®┤, TCAļŖö ĻĖ░ņĪ┤ņØś ņ╣śļŻīņŚÉ ļ░śņØæņØ┤ ņŚåļŖö ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ĻĖ░ļīĆĒĢĀ ņłś ņ׳ņ£╝ļ®░, ĒŖ╣Ē׳ EPS ņĢäĒśĢņØś ĒÖśņ×ÉļōżņŚÉĻ▓ī ļŹöņÜ▒ ĒÜ©Ļ│╝ņĀüņØ╝ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. ļ╣äļĪØ ņØ┤ ņŚ░ĻĄ¼ņŚÉņä£ļŖö TCAņØś ļČĆņ×æņÜ®ņØ┤ ņ£äņĢĮĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ĒåĄĻ│äņĀüņØĖ ņ░©ņØ┤Ļ░Ć ņŚåņŚłņ£╝ļéś, ņ×äņāüņŚÉņä£ TCAļź╝ ņé¼ņÜ®ĒĢĀ ļĢīņŚÉļŖö ņĢĮļ¼╝ ļČĆņ×æņÜ®ņŚÉ ļīĆĒĢ£ ņŻ╝ņØśļź╝ ĻĖ░ņÜĖņŚ¼ņĢ╝ ĒĢ£ļŗż.
17Ļ░£ņØś RCTņŚÉ ļīĆĒĢ£ ļ®öĒāĆļČäņäØņŚÉņä£, rebamipideļŖö ņ£äņĢĮ ļśÉļŖö ļīĆņĪ░ĻĄ░Ļ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØä 23% Ļ░£ņäĀĒĢśņśĆļŗż. ĒŖ╣Ē׳ ĻĖ░ņ¦łņĀüņØĖ ņøÉņØĖņØś ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ ņ”ØņāüņØ┤ 28% Ļ░ÉņåīĒĢśņŚ¼ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśņśĆņ¦Ćļ¦ī ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉļŖö ņ£ĀņØśĒĢ£ Ļ░£ņäĀņØ┤ ņŚåņŚłļŗż[129]. SucralfateļŖö ņĀ£ņé░ņĀ£ļĪ£, ļ╣äĻČżņ¢æņä▒ ņåīĒÖöļČłļ¤ē ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ 2Ļ░£ņØś ņ£äņĢĮ ļīĆņĪ░ĻĄ░ ņŚ░ĻĄ¼Ļ░Ć ņ׳ļŗż.ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ 3ņŻ╝ ļÅÖņĢłņØś sucralfateļŖö ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ ņ”Øņāü Ļ░£ņäĀņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ņ¦Ć ļ¬╗ĒĢśņśĆļŗż[130]. ļ░śļ®┤ ļŗżļźĖ ņŚ░ĻĄ¼ņŚÉņä£4ņŻ╝ ļÅÖņĢł sucralfate ļ│ĄņÜ®ņØĆ ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ ņØśļ»Ė ņ׳ļŖö ņ”Øņāü Ļ░£ņäĀņØä ļ│┤ņśĆļŗż[131]. 2Ļ░£ņØś ņŚ░ĻĄ¼ļź╝ ņóģĒĢ®ĒĢ£ ļČäņäØņŚÉņä£ sucralfateĻ░Ć ņ”ØņāüņØä ĒśĖņĀäņŗ£ņ╝░ņ¦Ćļ¦ī ĒåĄĻ│äņĀüņ£╝ļĪ£ ņØśļ»ĖļŖö ņŚåņŚłļŗż[132].
SimethiconeņŚÉ ļīĆĒĢ£ 2Ļ░£ņØś ņŚ░ĻĄ¼Ļ░Ć ņ׳ļŗż. Simethicone (80 mg 1ņØ╝ 3ĒÜī)Ļ│╝ cisapride (10 mg 1ņØ╝ 3ĒÜī)ļź╝ ļ¼┤ņ×æņ£äļĪ£ ļ╣äĻĄÉĒĢ£ Ļ▓░Ļ│╝ simethiconeņØĆ cisaprideļ│┤ļŗż 2ņŻ╝ņÖĆ 4ņŻ╝ņŚÉ ļ│ĄļČĆĒīĮļ¦ī ņ”ØņāüņŚÉ ļŹö ĒÜ©Ļ│╝ņĀüņØ┤ņŚłĻ│Ā, ņŚŁļźś ņ”ØņāüņØĆ 2ņŻ╝ņŚÉļ¦ī ĒÜ©Ļ│╝ņĀüņØ┤ņŚłļŗż[133]. ņØ┤ ņŚ░ĻĄ¼ņŚÉ ĻĘ╝Ļ▒░ĒĢśņŚ¼ 8ņŻ╝ ļÅÖņĢł ņĢĮņĀ£ļź╝ Ēł¼ņŚ¼ĒĢśĻ│Ā ņ”Øņāü ļ│ĆĒÖöļź╝ ĒÖĢņØĖĒĢśļŖö ņ£äņĢĮ ļīĆņĪ░ ņŚ░ĻĄ¼Ļ░Ć ņŗ£Ē¢ēļÉśņŚłļŗż[134]. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ simethiconeĻ│╝ cisaprideļŖö ņ£äņĢĮņŚÉ ļ╣äĒĢ┤ ņ”ØņāüņØä Ļ░£ņäĀņŗ£ņ╝░ņ£╝ļ®░, ĒŖ╣Ē׳ simethiconeņØĆ cisaprideņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ ņ▓½ 2ņŻ╝ ļÅÖņĢł ņ”ØņāüĻ░£ņäĀ ĒÜ©Ļ│╝Ļ░Ć ļŹö ņÜ░ņłśĒĢśņśĆļŗż. SimethiconeņØ┤ ņåīĒÖöļČłļ¤ēņŚÉ ņ×æņÜ®ĒĢśļŖö ĻĖ░ņĀäņØĆ ņĀĢĒÖĢĒ׳ ņĢīļĀżņĀĖ ņ׳ņ¦ĆļŖö ņĢŖņ£╝ļéś, simethiconeņØ┤ ņןņŚÉņä£ ĒØĪņłśļÉśņ¦Ć ņĢŖĻ│Ā, ņןļé┤ Ļ░ĆņŖżļź╝ Ļ░Éņåīņŗ£Ēéżļ»ĆļĪ£ ļé┤ņןĒåĄĻ░üĻ│╝ļ»╝(visceral hyperalgesia)Ļ│╝ Ļ┤ĆļĀ©ļÉ£ Ļ░ĆņŖżĒīĮņ░ĮņŚÉ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņ×æņÜ®ĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ£ļŗż.
13. ņĀĢņŗĀ ņ╣śļŻīļŖö ņĢĮļ¼╝ ņ╣śļŻīņŚÉ ļ░śņØæņØ┤ ņŚåļŖö ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņØś ņ”Øņāü ĒśĖņĀäņŚÉ ļÅäņøĆņØä ņŻ╝ļ»ĆļĪ£ ĻČīĻ│ĀĒĢĀ ņłś ņ׳ļŗż.
ŌĆó ĻČīĻ│Ā ļō▒ĻĖē: ņĢĮĒĢ©
ŌĆó ņ”ØĻ▒░ ņłśņżĆ: ņżæļō▒ļÅä
ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉļŖö ņ”ØņāüņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ļ│┤ļŗż ļČłņĢł, ņÜ░ņÜĖ, ņŗ¼ļ”¼ņĀü ņŖżĒŖĖļĀłņŖżņÖĆ Ļ░ÖņØĆ ņĀĢņŗĀņĀü ļ¼ĖņĀ£ļź╝ ļŹö ļ¦ÄņØ┤ Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż[135]. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉņŚÉ ļīĆĒĢ£ ņĀĢņŗĀ ņ╣śļŻīņŚÉļŖö ļÅÖņĀü ņĀĢņŗĀ ņ╣śļŻī(dynamic psychotherapy), ņĄ£ļ®┤ ņ╣śļŻī(hypnotherapy), Ē¢ēļÅÖ ņ╣śļŻī(behavioral treatments)ņÖĆ ņØĖņ¦Ć-Ē¢ēļÅÖ ņ╣śļŻī(cognitive-behavioral therapy)Ļ░Ć ĒżĒĢ©ļÉ£ļŗż[136-138]. ņĄ£ļ®┤ ņ╣śļŻīĻ░Ć ņØ╝ļ░ś ņ╣śļŻīņŚÉ ļ╣äĒĢ┤ ĒÜ©Ļ│╝ņĀüņØ┤ļØ╝ļŖö 1Ļ░£ņØś ņŚ░ĻĄ¼Ļ░Ć ņ׳ņ¦Ćļ¦ī, ņ▓┤Ļ│äņĀü ļ¼ĖĒŚīĻ│Āņ░░ņŚÉņä£ļŖö ļ╣äĻČżņ¢æņä▒ ņåīĒÖöļČłļ¤ēņŚÉ ļīĆĒĢ£ ņĀĢņŗĀ ņ╣śļŻīņØś ĒÜ©Ļ│╝Ļ░Ć ņ×ģņ”ØļÉśņ¦Ć ņĢŖņĢśļŗż[136,139].
ĒĢ£ RCT ņŚ░ĻĄ¼ņŚÉņä£ ņĀĢņŗĀ ņ╣śļŻīņÖĆ ĒĢ©Ļ╗ś 4Ļ░£ņøö ļÅÖņĢł Ļ░ĢĒÖöļÉ£ ņ╣śļŻī(ņÜ┤ļÅÖĻ│╝ Ļ░ÉĻ░ü ĻĖ░ļŖźņØś ņØ┤ņāüņŚÉ ļīĆĒĢ┤ Ļ▓Ćņé¼ĒĢśĻ│Ā ņØ┤ļź╝ ļ¬®Ēæ£ļĪ£ ņäżņĀĢĒĢśņŚ¼ ņĢĮļ¼╝ ņ╣śļŻī)ļź╝ ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņØ┤ ĻĖ░ņĪ┤ ņ╣śļŻīņŚÉ ļ░śņØæĒĢśņ¦Ć ņĢŖļŖö ņåīĒÖöļČłļ¤ē ņ”ØņāüņØä ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ Ļ░Éņåīņŗ£ņ╝░ļŗż. ņČöĻ░ĆņĀüņØĖ ņØĖņ¦Ć-Ē¢ēļÅÖ ņ╣śļŻīļŖö ļÅÖļ░śļÉ£ ļČłņĢłĻ│╝ ņÜ░ņÜĖ ņ”ØņāüņØä ņĪ░ņĀłĒĢśļŖö ļŹ░ ĒÜ©Ļ│╝ņĀüņØ╝ ņłś ņ׳Ļ▓Āļŗż[140]. ļŗżļźĖ ļ¼┤ņ×æņ£ä ļīĆņĪ░ĻĄ░ ņŚ░ĻĄ¼ņŚÉņä£ļŖö 10ņŻ╝ļÅÖņĢł ņĢĮļ¼╝ ņ╣śļŻīņÖĆ ĒĢ©Ļ╗ś ņĀĢņŗĀ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņØ┤ ņĢĮļ¼╝ ņ╣śļŻīļ¦ī ņŗ£Ē¢ēĒĢśļŖö Ļ▓ĮņÜ░ļ│┤ļŗż ņåīĒÖöļČłļ¤ē ņ”ØņāüĻ│╝ ņØ┤ņÖĆ ņŚ░Ļ┤ĆļÉ£ ņéČņØś ņ¦łņØä ĒśĖņĀäņŗ£ĒéżļŖö ļŹ░ ĒÜ©Ļ│╝ņĀüņØ┤ņŚłļŗż[141].
ņĄ£ĻĘ╝ ņ▓┤Ļ│äņĀü ļ¼ĖĒŚīĻ│Āņ░░ņŚÉņä£ļŖö ņĀĢņŗĀ ņ╣śļŻīĻ░Ć ņåīĒÖöļČłļ¤ē ņ”ØņāüņØä ņØśļ»Ė ņ׳Ļ▓ī ĒśĖņĀäņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż(RR = 0.53, 95% CI = 0.44-0.65, NNT 3). ņØ┤ Ļ│Āņ░░ņØĆ 789ļ¬ģņØś ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉņØś ņ”Øņāü Ļ░£ņäĀņØä ņØ┤ļČäļ▓Ģņ£╝ļĪ£ ĻĖ░ņłĀĒĢ£ ņŚ░ĻĄ¼ļōżņØä ĒżĒĢ©ĒĢśņśĆļŗż[17]. ņĀĢņŗĀ ņ╣śļŻīņØś Ļ▓░Ļ│╝ļŖö ņłśļ®┤ņØś ņ¦łņØ┤ ļéśņüśĻ▒░ļéś(OR = 7.68, 95% CI = 1.83-32.25) Ļ▓░Ēś╝ ņāüĒā£Ļ░Ć ņøÉĒÖ£ĒĢśņ¦Ć ļ¬╗ĒĢ£ Ļ▓ĮņÜ░(OR = 1.22, 95% CI = 1.10-1.36)ņÖĆ ļČĆņĀĢņĀüņØĖ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņśĆĻ│Ā, ņÖĖĒ¢źņĀüņØĖ ņä▒Ļ▓®ņØä ļ│┤ņØ┤ļŖö Ļ▓ĮņÜ░(OR = 0.86, 95% CI = 0.76-0.96)ņÖĆļŖö ĻĖŹņĀĢņĀüņØĖ ņŚ░Ļ┤Ćņä▒ņØä ļéśĒāĆļāłļŗż[142]. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļōżņØä Ļ│ĀļĀżĒĢśļ®┤ ņĀĢņŗĀ ņ╣śļŻīļŖö ņĢĮļ¼╝ ņ╣śļŻīņŚÉ ļ░śņØæĒĢśņ¦Ć ņĢŖĻ│Ā, ĒŖ╣Ē׳ ņĀĢņŗĀņĀü ņÜöņØĖĻ│╝ ņŚ░Ļ┤ĆļÉśņ¢┤ ļéśĒāĆļéĀ ņłś ņ׳ļŖö ņŗ¼ĒĢ£ ņ”ØņāüņØä ļ│┤ņØ┤ļŖö ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉņØś ņ╣śļŻīņŚÉ Ļ│ĀļĀżļÉĀ ņłś ņ׳Ļ▓Āļŗż.
14. Ļ│Āņ¦Ćļ░®ņŗØņØä Ēö╝ĒĢśļŖö ļō▒ ņŗØņØ┤ ņĪ░ņĀłņØĆ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ņ”Øņāü ĒśĖņĀäņŚÉ ļÅäņøĆņØä ņŻ╝ļ»ĆļĪ£ ĻČīĻ│ĀĒĢĀ ņłś ņ׳ļŗż.
ŌĆó ĻČīĻ│Ā ļō▒ĻĖē: ņĢĮĒĢ©
ŌĆó ņ”ØĻ▒░ ņłśņżĆ: ļé«ņØī
ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņŚÉņä£ ņŗØņØ┤ ņĪ░ņĀłņØĆ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢĀ Ļ▓āņ£╝ļĪ£ ĻĖ░ļīĆļÉ£ļŗż. ĻĘĖļ¤¼ļéś ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņŚÉņä£ ņØīņŗØĻ│╝ņØś ņŚ░Ļ┤Ćņä▒ņŚÉ ļīĆĒĢ£ ļ¼ĖĒŚīņ×ÉļŻīļŖö ņĢäņ¦ü ļČĆņĪ▒ĒĢśĻ│Ā ņØ╝ņ╣śļÉśņ¦Ć ņĢŖļŖö Ļ▓░Ļ│╝ļź╝ ļ│┤ņØĖļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØä ņ£Āļ░£ĒĢśļŖö ņØīņŗØņØĆ Ēö╝ĒĢśļŖö Ļ▓āņØ┤ ņóŗļŗż. ĒŖ╣Ē׳ Ļ│Āņ¦Ćļ░®ņŗØņØ┤ļŖö ņåīĒÖöļČłļ¤ē ņ”ØņāüņØä ņ£Āļ░£ĒĢśĻ▒░ļéś ņĢģĒÖöņŗ£Ēé¼ ņłś ņ׳ļŗż. ņŗŁņØ┤ņ¦Ćņןļé┤ ņ¦Ćļ░®ņØĆ ņ£ä ĒīĮņ░ĮņŚÉ ļīĆĒĢ£ ņśłļ»╝ļÅäļź╝ ņ”ØĻ░Ćņŗ£ņ╝£ ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉņŚÉņä£ ļ│ĄļČĆ ĒīĮļ¦īĻ│╝ ļČłĒÄĖĻ░ÉņØä ņ£Āļ░£ĒĢ£ļŗż[143]. ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ ņŗØĒøä Ēżļ¦īĻ░ÉņØ┤ļéś ĒīĮļ¦īĻ░ÉņØĆ Ļ│Āņ¦Ćļ░®ņŗØņØ┤ņÖĆ ņ¦üņĀæņĀüņØĖ ņŚ░Ļ┤Ćņä▒ņØä ļ│┤ņØĖļŗż[144]. ļśÉĒĢ£ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ Ļ│Āņ¦Ćļ░®ņŗØņØ┤ļŖö Ļ▒┤Ļ░ĢĒĢ£ ņé¼ļ×īņŚÉ ļ╣äĒĢ┤ ĻĄ¼ņŚŁĻ│╝ ļ│ĄĒåĄņØä ņ£Āļ░£ĒĢśņśĆļŗż[145]. ņÜ░ņ£Ā, ņ£ĀņĀ£ĒÆł, ļ░ĆĻ░ĆļŻ© ņØīņŗØ, ļ¦żņÜ┤ ņØīņŗØļÅä ņåīĒÖöļČłļ¤ē ņ”ØņāüņØä ņØ╝ņ£╝Ēé¼ ņłś ņ׳ņ£╝ļ®░[146,147], Ēāäņé░ ņØīļŻīļéś ņ╗żĒö╝ļÅä ņ”ØņāüņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŗż[147,148].
40ņäĖ ņØ┤ņāüņØś ņåīĒÖöļČłļ¤ē ĒÖśņ×ÉņŚÉņä£ ĻĖ░ņ¦łņĀü ņøÉņØĖ, ĒŖ╣Ē׳ ņ£äņĢöņØä ļ░░ņĀ£ĒĢśĻĖ░ ņ£äĒĢ┤ ņāüļČĆņ£äņןĻ┤Ć ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢ┤ņĢ╝ ĒĢ£ļŗż. ĻĖ░ņ¦łņĀü ņøÉņØĖņØä ļ░░ņĀ£ĒĢ£ ĒøäņŚÉ ņ”ØņāüņØ┤ ļ¦īņä▒ņØ┤Ļ▒░ļéś ļ░śļ│ĄļÉśļŖö Ļ▓ĮņÜ░, ņ”ØņāüņŚÉ ļö░ļØ╝ EPS ņĢäĒśĢĻ│╝ PDS ņĢäĒśĢņ£╝ļĪ£ ĻĄ¼ļČäĒĢśņŚ¼ ņ╣śļŻīĒĢ£ļŗż. EPS ņĢäĒśĢņØś ĒÖśņ×ÉļōżņØĆ ņÜ░ņäĀ PPIļĪ£ ņ╣śļŻīĒĢ£ļŗż. PDS ņĢäĒśĢņØś ĒÖśņ×ÉļōżņØĆ ļÅäĒīīļ»╝ D2 ņłśņÜ®ņ▓┤ ĻĖĖĒĢŁņĀ£ņÖĆ 5-HT4 ņłśņÜ®ņ▓┤ ņ×æņÜ®ņĀ£ņÖĆ Ļ░ÖņØĆ ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£ļź╝ ņé¼ņÜ®ĒĢ£ļŗż. ņØ╝ļČĆ ļÅäĒīīļ»╝ D2 ņłśņÜ®ņ▓┤ ĻĖĖĒĢŁņĀ£ļŖö ņןĻĖ░Ļ░ä ņé¼ņÜ®ĒĢśļŖö ļÅÖņĢł ļČĆņ×æņÜ®ņØä ņØ╝ņ£╝Ēé¼ ņłś ņ׳ņ£╝ļ»ĆļĪ£ ņŻ╝ņØśĒĢ┤ņä£ ņé¼ņÜ®ĒĢ┤ņĢ╝ ĒĢ£ļŗż. H. pylori ņĀ£ĻĘĀ ņ╣śļŻīņŚÉ ļīĆĒĢ£ ļ®öĒāĆļČäņäØņØĆ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØ┤ ņןĻĖ░ņĀüņ£╝ļĪ£ ĒśĖņĀäļÉśļŖö ĒÜ©Ļ│╝ļź╝ ļ│┤ņŚ¼ņż¼ņ¦Ćļ¦ī, ļÅÖņ¢æņØĖņØä ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĻĘĖ ĒÜ©Ļ│╝Ļ░Ć ļČłļČäļ¬ģĒĢśņŚ¼ ĻĄŁļé┤ņŚÉņä£ RCT ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż. H. pylori ņĀ£ĻĘĀ ņ╣śļŻīļŖö PPIņÖĆ ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£Ļ░Ć ĒÜ©Ļ│╝ņĀüņØ┤ņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ ļśÉļŖö ļ¦īņä▒ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØ┤ ņ׳ļŖö ņĀŖņØĆ ĒÖśņ×ÉņŚÉĻ▓ī ņĀüņÜ®ĒĢĀ ņłś ņ׳ļŗż. TCAļŖö ņé░ļČäļ╣äņ¢ĄņĀ£ņĀ£ļéś ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£ ļō▒ņŚÉ ļ░śņØæņØ┤ ņŚåņØä ļĢī ņé¼ņÜ®ĒĢśņŚ¼ ļ│╝ ņłś ņ׳Ļ│Ā ņ”Øņāü ĒśĖņĀäņŚÉ ĒÜ©Ļ│╝ņĀüņØ┤ļŗż. ļśÉĒĢ£ ņ”ØņāüņØś ņ×¼ļ░£ņØä Ēö╝ĒĢśĻĖ░ ņ£äĒĢ┤ ņĢĮļ¼╝ ņ╣śļŻīļ┐É ņĢäļŗłļØ╝ ņŗØņØ┤ ņĪ░ņĀłņØ┤ļéś ņŖżĒŖĖļĀłņŖż Ļ┤Ćļ”¼Ļ░Ć ņżæņÜöĒĢśĻ│Ā ļ¼┤ņŚćļ│┤ļŗż ĒÖśņ×ÉņŚÉĻ▓ī ņ¦łļ│æņØś ĒŖ╣ņä▒ņØä ĻĄÉņ£ĪĒĢśņŚ¼ ņĢłņŗ¼ņŗ£ĒéżĻ│Ā ņ¦łļ│æņØä ņØ┤ĒĢ┤ĒĢśļÅäļĪØ ĒĢśļŖö Ļ▓ā(reassurance)ņØ┤ ņżæņÜöĒĢśļŗż.
REFERENCES
1. Tack J, Talley NJ, Camilleri M, et al. Functional gastroduodenal disorders. Gastroenterology 2006;130:1466ŌĆō1479.


2. Stanghellini V, Chan FK, Hasler WL, et al. Gastroduodenal disorders. Gastroenterology 2016;150:1380ŌĆō1392.


3. Sugano K, Tack J, Kuipers EJ, et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut 2015;64:1353ŌĆō1367.



4. Hooi JKY, Lai WY, Ng WK, et al. Global prevalence of Helicobacter pylori infection: systematic review and meta-analysis. Gastroenterology 2017;153:420ŌĆō429.


5. Kim BJ, Kim HS, Song HJ, et al. Online registry for nationwide database of current trend of Helicobacter pylori eradication in Korea: interim analysis. J Korean Med Sci 2016;31:1246ŌĆō1253.



6. Bak YT. Evidence based guideline for diagnosis and treatment : therapeutic guideline for GERD. Kor J Neurogastroenterol Motil 2005;11:13ŌĆō17.
7. Jee SR, Jung HK, Min BH, et al. Guidelines for the treatment of functional dyspepsia. Korean J Gastroenterol 2011;57:67ŌĆō81.


8. Oh JH, Kwon JG, Jung HK, et al. Clinical practice guidelines for functional dyspepsia in Korea. J Neurogastroenterol Motil 2020;26:29ŌĆō50.



9. Higgins JP, Altman DG, G├Ėtzsche PC, et al. The Cochrane Collaboration's tool for assessing risk of bias in randomised trials. BMJ 2011;343:d5928.



10. Sch├╝nemann H, Bro┼╝ek J, Guyatt G, Oxman A. GRADE handbook for grading quality of evidence and strength of recommendations [Internet]. The GRADE Working Group. c2013 [cited 2020 Mar 27]. Available from: https://gdt.gradepro.org/app/handbook/handbook.html
11. Song KH, Jung HK, Kim HJ, et al. Clinical practice guidelines for irritable bowel syndrome in Korea, 2017 revised edition. J Neurogastroenterol Motil 2018;24:197ŌĆō215.

12. Malfertheiner P, Megraud F, O'Morain CA, et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report. Gut 2017;66:6ŌĆō30.


13. National Institutue for Health and Care Excellence (NICE). Gastro-oesophageal reflux disease and dyspepsia in adults: investigation and management [Internet]. London: NICE, c2014 [cited 2020 Mar 27]. Available from: https://www.nice.org.uk/guidance/cg184
14. Miwa H, Kusano M, Arisawa T, et al. Evidence-based clinical practice guidelines for functional dyspepsia. J Gastroenterol 2015;50:125ŌĆō139.


15. Talley NJ, Lam SK, Goh KL, Fock KM. Management guidelines for uninvestigated and functional dyspepsia in the Asia-Pacific region: first Asian Pacific working party on functional dyspepsia. J Gastroenterol Hepatol 1998;13:335ŌĆō353.


16. Talley NJ, Vakil N; Practice Parameters Committee of the American College of Gastroenterology. Guidelines for the management of dyspepsia. Am J Gastroenterol 2005;100:2324ŌĆō2337.


17. Moayyedi P, Lacy BE, Andrews CN, Enns RA, Howden CW, Vakil N. ACG and CAG clinical guideline: management of dyspepsia. Am J Gastroenterol 2017;112:988ŌĆō1013.


18. Zhao B, Zhao J, Cheng WF, et al. Efficacy of Helicobacter pylori eradication therapy on functional dyspepsia: a meta-analysis of randomized controlled studies with 12-month follow-up. J Clin Gastroenterol 2014;48:241ŌĆō247.


19. Lassen AT, Hallas J, Schaffalitzky de Muckadell OB. Helicobacter pylori test and eradicate versus prompt endoscopy for management of dyspeptic patients: 6.7 year follow up of a randomised trial. Gut 2004;53:1758ŌĆō1763.



20. Lassen AT, Pedersen FM, Bytzer P, Schaffalitzky de Muckadell OB. Helicobacter pylori test-and-eradicate versus prompt endoscopy for management of dyspeptic patients: a randomised trial. Lancet 2000;356:455ŌĆō460.


21. Bytzer P, Hansen JM, Schaffalitzky de Muckadell OB. Empirical H2-blocker therapy or prompt endoscopy in management of dyspepsia. Lancet 1994;343:811ŌĆō816.


22. Laheij RJ, Severens JL, Van de Lisdonk EH, Verbeek AL, Jansen JB. Randomized controlled trial of omeprazole or endoscopy in patients with persistent dyspepsia: a cost-effectiveness analysis. Aliment Pharmacol Ther 1998;12:1249ŌĆō1256.


23. Li XB, Liu WZ, Ge ZZ, Chen XY, Shi Y, Xiao SD. Helicobacter pylori "test-and-treat" strategy is not suitable for the management of patients with uninvestigated dyspepsia in Shanghai. Scand J Gastroenterol 2005;40:1028ŌĆō1031.


24. Liou JM, Lin JT, Wang HP, et al. The optimal age threshold for screening upper endoscopy for uninvestigated dyspepsia in Taiwan, an area with a higher prevalence of gastric cancer in young adults. Gastrointest Endosc 2005;61:819ŌĆō825.

25. Shin A, Kim J, Park S. Gastric cancer epidemiology in Korea. J Gastric Cancer 2011;11:135ŌĆō140.



26. Song M, Kang D, Yang JJ, et al. Age and sex interactions in gastric cancer incidence and mortality trends in Korea. Gastric Cancer 2015;18:580ŌĆō589.


27. Hwang IR, Kim JH, Lee KJ, Cho SW. Can Helicobacter pylori serology predict non-ulcer dyspepsia in young dyspeptic patients? Clin Endosc 2000;21:696ŌĆō703.
29. Suzuki H, Moayyedi P. Helicobacter pylori infection in functional dyspepsia. Nat Rev Gastroenterol Hepatol 2013;10:168ŌĆō174.


30. Delaney B, Ford AC, Forman D, Moayyedi P, Qume M. Initial management strategies for dyspepsia. Cochrane Database Syst Rev 2005;(4):CD001961.

31. Harvey RF, Lane JA, Nair P, et al. Clinical trial: prolonged beneficial effect of Helicobacter pylori eradication on dyspepsia consultations - the Bristol Helicobacter Project. Aliment Pharmacol Ther 2010;32:394ŌĆō400.


32. Lee JH, Choi KD, Jung HY, et al. Seroprevalence of Helicobacter pylori in Korea: a multicenter, nationwide study conducted in 2015 and 2016. Helicobacter 2018;23:e12463.



33. Eusebi LH, Zagari RM, Bazzoli F. Epidemiology of Helicobacter pylori infection. Helicobacter 2014;19 Suppl 1:1ŌĆō5.


34. Talley NJ, Vakil NB, Moayyedi P. American Gastroenterological Association technical review on the evaluation of dyspepsia. Gastroenterology 2005;129:1756ŌĆō1780.


35. Veldhuyzen van Zanten SJ, Bradette M, Chiba N, et al. Evidence-based recommendations for short- and long-term management of uninvestigated dyspepsia in primary care: an update of the Canadian Dyspepsia Working Group (CanDys) clinical management tool. Can J Gastroenterol 2005;19:285ŌĆō303.


36. Moayyedi P, Talley NJ, Fennerty MB, Vakil N. Can the clinical history distinguish between organic and functional dyspepsia? JAMA 2006;295:1566ŌĆō1576.


37. Jung KW, Won YJ, Kong HJ, Lee ES. Prediction of cancer incidence and mortality in Korea, 2018. Cancer Res Treat 2018;50:317ŌĆō323.



38. Chen SL, Gwee KA, Lee JS, et al. Systematic review with meta-analysis: prompt endoscopy as the initial management strategy for uninvestigated dyspepsia in Asia. Aliment Pharmacol Ther 2015;41:239ŌĆō252.


39. Miwa H, Ghoshal UC, Fock KM, et al. Asian consensus report on functional dyspepsia. J Gastroenterol Hepatol 2012;27:626ŌĆō641.


40. Ryu E, Kim K, Cho MS, Kwon IG, Kim HS, Fu MR. Symptom clusters and quality of life in Korean patients with hepatocellular carcinoma. Cancer Nurs 2010;33:3ŌĆō10.


41. Son HJ, Rhee PL, Kim JJ, Koh KC, Paik SW, Rhee JC. Hypersensitivity to acid in ulcer-like functional dyspepsia. Korean J Intern Med 1997;12:188ŌĆō192.



42. Samsom M, Verhagen MA, vanBerge Henegouwen GP, Smout AJ. Abnormal clearance of exogenous acid and increased acid sensitivity of the proximal duodenum in dyspeptic patients. Gastroenterology 1999;116:515ŌĆō520.


43. Lee KJ, Tack J. Duodenal implications in the pathophysiology of functional dyspepsia. J Neurogastroenterol Motil 2010;16:251ŌĆō257.



44. Pinto-Sanchez MI, Yuan Y, Hassan A, Bercik P, Moayyedi P. Proton pump inhibitors for functional dyspepsia. Cochrane Database Syst Rev 2017;11:CD011194.


45. Gerson LB, Triadafilopoulos G. A prospective study of oesophageal 24-h ambulatory pH monitoring in patients with functional dyspepsia. Dig Liver Dis 2005;37:87ŌĆō91.


46. van Zanten SV, Armstrong D, Chiba N, et al. Esomeprazole 40 mg once a day in patients with functional dyspepsia: the randomized, placebo-controlled "ENTER" trial. Am J Gastroenterol 2006;101:2096ŌĆō2106.


47. Talley NJ, Vakil N, Lauritsen K, et al. Randomized-controlled trial of esomeprazole in functional dyspepsia patients with epigastric pain or burning: does a 1-week trial of acid suppression predict symptom response? Aliment Pharmacol Ther 2007;26:673ŌĆō682.


48. van Rensburg C, Bergh├Čfer P, Enns R, et al. Efficacy and safety of pantoprazole 20 mg once daily treatment in patients with ulcer-like functional dyspepsia. Curr Med Res Opin 2008;24:2009ŌĆō2018.


49. Fletcher J, Derakhshan MH, Jones GR, Wirz AA, McColl KE. BMI is superior to symptoms in predicting response to proton pump inhibitor: randomised trial in patients with upper gastrointestinal symptoms and normal endoscopy. Gut 2011;60:442ŌĆō448.


50. Suzuki H, Kusunoki H, Kamiya T, et al. Effect of lansoprazole on the epigastric symptoms of functional dyspepsia (ELF study): a multicentre, prospective, randomized, double-blind, placebo-controlled clinical trial. United European Gastroenterol J 2013;1:445ŌĆō452.



51. Iwakiri R, Tominaga K, Furuta K, et al. Randomised clinical trial: rabeprazole improves symptoms in patients with functional dyspepsia in Japan. Aliment Pharmacol Ther 2013;38:729ŌĆō740.


52. Majewski M, Sarosiek I, Cooper CJ, et al. Gastric pH and therapeutic responses to exsomeprazole in patients with functional dyspepsia: potential clinical implications. Am J Med Sci 2016;352:582ŌĆō592.


53. Talley NJ, Meineche-Schmidt V, Par├® P, et al. Efficacy of omeprazole in functional dyspepsia: double-blind, randomized, placebo-controlled trials (the Bond and Opera studies). Aliment Pharmacol Ther 1998;12:1055ŌĆō1065.


54. Miwa H, Ghoshal UC, Gonlachanvit S, et al. Asian consensus report on functional dyspepsia. J Neurogastroenterol Motil 2012;18:150ŌĆō168.



55. Syam AF, Simadibrata M, Makmun D, et al. National consensus on management of dyspepsia and Helicobacter pylori infection. Acta Med Indones 2017;49:279ŌĆō287.

56. Moayyedi P, Delaney BC, Vakil N, Forman D, Talley NJ. The efficacy of proton pump inhibitors in nonulcer dyspepsia: a systematic review and economic analysis. Gastroenterology 2004;127:1329ŌĆō1337.


57. Pinto-Sanchez MI, Yuan Y, Bercik P, Moayyedi P. Proton pump inhibitors for functional dyspepsia. Cochrane Database Syst Rev 2017;3:CD011194.


59. Tack J, Bisschops R, Sarnelli G. Pathophysiology and treatment of functional dyspepsia. Gastroenterology 2004;127:1239ŌĆō1255.


60. Moayyedi P, Soo S, Deeks J, Delaney B, Innes M, Forman D. Pharmacological interventions for non-ulcer dyspepsia. Cochrane Database Syst Rev 2006;(4):CD001960.

61. Miner PB Jr, Allgood LD, Grender JM. Comparison of gastric pH with omeprazole magnesium 20.6 mg (Prilosec OTC) o.m. famotidine 10 mg (Pepcid AC) b.d. and famotidine 20 mg b.d. over 14 days of treatment. Aliment Pharmacol Ther 2007;25:103ŌĆō109.


62. McRorie JW, Kirby JA, Miner PB. Histamine2-receptor antagonists: Rapid development of tachyphylaxis with repeat dosing. World J Gastrointest Pharmacol Ther 2014;5:57ŌĆō62.



63. Hojo M, Nagahara A, Asaoka D, et al. A randomized, double-blind, pilot study of the effect of famotidine on acotiamide treatment for functional dyspepsia. Digestion 2017;96:5ŌĆō12.



64. Park KH, Pai J, Song DG, et al. Ranitidine-induced anaphylaxis: clinical features, cross-reactivity, and skin testing. Clin Exp Allergy 2016;46:631ŌĆō639.


65. Veldhuyzen van Zanten SJ, Jones MJ, Verlinden M, Talley NJ. Efficacy of cisapride and domperidone in functional (nonulcer) dyspepsia: a meta-analysis. Am J Gastroenterol 2001;96:689ŌĆō696.


66. Quigley EM. Prokinetics in the management of functional gastrointestinal disorders. J Neurogastroenterol Motil 2015;21:330ŌĆō336.



67. Huang X, Lv B, Zhang S, Fan YH, Meng LN. Itopride therapy for functional dyspepsia: a meta-analysis. World J Gastroenterol 2012;18:7371ŌĆō7377.



68. Talley NJ, Tack J, Ptak T, Gupta R, Gigu├©re M. Itopride in functional dyspepsia: results of two phase III multicentre, randomised, double-blind, placebo-controlled trials. Gut 2008;57:740ŌĆō746.

69. Kusunoki H, Haruma K, Hata J, et al. Efficacy of mosapride citrate in proximal gastric accommodation and gastrointestinal motility in healthy volunteers: a double-blind placebo-controlled ultrasonographic study. J Gastroenterol 2010;45:1228ŌĆō1234.


70. Hallerb├żck BI, Bommelaer G, Bredberg E, et al. Dose finding study of mosapride in functional dyspepsia: a placebo-controlled, randomized study. Aliment Pharmacol Ther 2002;16:959ŌĆō967.


71. Cho YK, Choi MG, Kim SH, et al. The effect of mosapride on quality of life in functional dyspepsia. Korean J Gastroenterol 2004;43:160ŌĆō167.

72. Bang CS, Kim JH, Baik GH, et al. Mosapride treatment for functional dyspepsia: a meta-analysis. J Gastroenterol Hepatol 2015;30:28ŌĆō42.

73. Hongo M, Harasawa S, Mine T, et al. Large-scale randomized clinical study on functional dyspepsia treatment with mosapride or teprenone: Japan Mosapride Mega-Study (JMMS). J Gastroenterol Hepatol 2012;27:62ŌĆō68.


74. Kinoshita Y, Hashimoto T, Kawamura A, et al. Effects of famotidine, mosapride and tandospirone for treatment of functional dyspepsia. Aliment Pharmacol Ther 2005;21 Suppl 2:37ŌĆō41.


75. Otaka M, Jin M, Odashima M, et al. New strategy of therapy for functional dyspepsia using famotidine, mosapride and amitriptyline. Aliment Pharmacol Ther 2005;21 Suppl 2:42ŌĆō46.


76. Yoon H, Lee DH, Lee YH, et al. Efficacy and safety of UI05MSP015CT in functional dyspepsia: a randomized, controlled trial. Gut Liver 2018;12:516ŌĆō522.



77. Hiyama T, Yoshihara M, Matsuo K, et al. Meta-analysis of the effects of prokinetic agents in patients with functional dyspepsia. J Gastroenterol Hepatol 2007;22:304ŌĆō310.


78. Pittayanon R, Yuan Y, Bollegala NP, et al. Prokinetics for functional dyspepsia: a systematic review and meta-analysis of randomized control trials. Am J Gastroenterol 2019;114:233ŌĆō243.


79. Yang YJ, Bang CS, Baik GH, et al. Prokinetics for the treatment of functional dyspepsia: bayesian network meta-analysis. BMC Gastroenterol 2017;17:83.



80. Jung HK, Lee KJ, Choi MG, et al. Efficacy of DA-9701 (Motilitone) in functional dyspepsia compared to pantoprazole: a multicenter, randomized, double-blind, non-inferiority study. J Neurogastroenterol Motil 2016;22:254ŌĆō263.



81. Parkman HP, Hasler WL, Fisher RS; American Gastroenterological Association. American Gastroenterological Association technical review on the diagnosis and treatment of gastroparesis. Gastroenterology 2004;127:1592ŌĆō1622.


82. Tatsuta M, Iishi H, Nakaizumi A, Okuda S. Effect of treatment with cisapride alone or in combination with domperidone on gastric emptying and gastrointestinal symptoms in dyspeptic patients. Aliment Pharmacol Ther 1992;6:221ŌĆō228.


83. Aziz I, Palsson OS, T├Črnblom H, Sperber AD, Whitehead WE, Simr├®n M. Epidemiology, clinical characteristics, and associations for symptom-based Rome IV functional dyspepsia in adults in the USA, Canada, and the UK: a cross-sectional population-based study. Lancet Gastroenterol Hepatol 2018;3:252ŌĆō262.


84. Tack J, Janssen P. Acotiamide (Z-338, YM443), a new drug for the treatment of functional dyspepsia. Expert Opin Investig Drugs 2011;20:701ŌĆō712.


85. Matsueda K, Hongo M, Tack J, Saito Y, Kato H. A placebo-controlled trial of acotiamide for meal-related symptoms of functional dyspepsia. Gut 2012;61:821ŌĆō828.


86. Nakamura K, Tomita T, Oshima T, et al. A double-blind placebo controlled study of acotiamide hydrochloride for efficacy on gastrointestinal motility of patients with functional dyspepsia. J Gastroenterol 2017;52:602ŌĆō610.


87. Xiao G, Xie X, Fan J, et al. Efficacy and safety of acotiamide for the treatment of functional dyspepsia: systematic review and meta-analysis. ScientificWorldJournal 2014;2014:541950.



88. Tack J, Pokrotnieks J, Urbonas G, et al. Long-term safety and efficacy of acotiamide in functional dyspepsia (postprandial distress syndrome)-results from the European phase 3 open-label safety trial. Neurogastroenterol Motil 2018;30:e13284.


89. Shinozaki S, Osawa H, Sakamoto H, Hayashi Y, Kawarai Lefor A, Yamamoto H. The effect of acotiamide on epigastric pain syndrome and postprandial distress syndrome in patients with functional dyspepsia. J Med Invest 2016;63:230ŌĆō235.


90. Arts J, Caenepeel P, Verbeke K, Tack J. Influence of erythromycin on gastric emptying and meal related symptoms in functional dyspepsia with delayed gastric emptying. Gut 2005;54:455ŌĆō460.



91. Janssens J, Peeters TL, Vantrappen G, et al. Improvement of gastric emptying in diabetic gastroparesis by erythromycin. Preliminary studies. N Engl J Med 1990;322:1028ŌĆō1031.


92. Basch E, Prestrud AA, Hesketh PJ, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol 2011;29:4189ŌĆō4198.



94. Frommeyer G, Fischer C, Ellermann C, et al. Severe proarrhythmic potential of the antiemetic agents ondansetron and domperidone. Cardiovasc Toxicol 2017;17:451ŌĆō457.


95. Shin HW, Kim MJ, Kim JS, Lee MC, Chung SJ. Levosulpiride-induced movement disorders. Mov Disord 2009;24:2249ŌĆō2253.


96. Du LJ, Chen BR, Kim JJ, Kim S, Shen JH, Dai N. Helicobacter pylori eradication therapy for functional dyspepsia: systematic review and meta-analysis. World J Gastroenterol 2016;22:3486ŌĆō3495.



97. McColl K, Murray L, El-Omar E, et al. Symptomatic benefit from eradicating Helicobacter pylori infection in patients with nonulcer dyspepsia. N Engl J Med 1998;339:1869ŌĆō1874.


98. Blum AL, Talley NJ, O'Mor├Īin C, et al. Lack of effect of treating Helicobacter pylori infection in patients with nonulcer dyspepsia. Omeprazole plus Clarithromycin and Amoxicillin Effect One Year after Treatment (OCAY) Study Group. N Engl J Med 1998;339:1875ŌĆō1881.


99. Talley NJ, Vakil N, Ballard ED 2nd, Fennerty MB. Absence of benefit of eradicating Helicobacter pylori in patients with nonulcer dyspepsia. N Engl J Med 1999;341:1106ŌĆō1111.


100. Talley NJ, Janssens J, Lauritsen K, R├Īcz I, BollingSternevald E. Eradication of Helicobacter pylori in functional dyspepsia: randomised double blind placebo controlled trial with 12 months' follow up. The Optimal Regimen Cures Helicobacter Induced Dyspepsia (ORCHID) Study Group. BMJ 1999;318:833ŌĆō837.



101. Koskenpato J, Farkkil├ż M, Sipponen P. Helicobacter pylori eradication and standardized 3-month omeprazole therapy in functional dyspepsia. Am J Gastroenterol 2001;96:2866ŌĆō2872.


102. Hsu PI, Lai KH, Tseng HH, et al. Eradication of Helicobacter pylori prevents ulcer development in patients with ulcer-like functional dyspepsia. Aliment Pharmacol Ther 2001;15:195ŌĆō201.


103. Bruley Des Varannes S, Fl├®jou JF, Colin R, Za├»m M, Meunier A, Bidaut-Mazel C. There are some benefits for eradicating Helicobacter pylori in patients with non-ulcer dyspepsia. Aliment Pharmacol Ther 2001;15:1177ŌĆō1185.


104. Froehlich F, Gonvers JJ, Wietlisbach V, et al. Helicobacter pylori eradication treatment does not benefit patients with nonulcer dyspepsia. Am J Gastroenterol 2001;96:2329ŌĆō2336.


105. Chiba N, Van Zanten SJ, Sinclair P, Ferguson RA, Escobedo S, Grace E. Treating Helicobacter pylori infection in primary care patients with uninvestigated dyspepsia: the Canadian adult dyspepsia empiric treatment-Helicobacter pylori positive (CADET-Hp) randomised controlled trial. BMJ 2002;324:1012ŌĆō1016.

106. Veldhuyzen van Zanten S, Fedorak RN, Lambert J, Cohen L, Vanjaka A. Absence of symptomatic benefit of lansoprazole, clarithromycin, and amoxicillin triple therapy in eradication of Helicobacter pylori positive, functional (nonulcer) dyspepsia. Am J Gastroenterol 2003;98:1963ŌĆō1969.


107. Malfertheiner P, MOssner J, Fischbach W, et al. Helicobacter pylori eradication is beneficial in the treatment of functional dyspepsia. Aliment Pharmacol Ther 2003;18:615ŌĆō625.


108. Gisbert JP, Cruzado AI, Garcia-Gravalos R, Pajares JM. Lack of benefit of treating Helicobacter pylori infection in patients with functional dyspepsia. Randomized one-year follow-up study. Hepatogastroenterology 2004;51:303ŌĆō308.

109. Mazzoleni LE, Sander GB, Ott EA, et al. Clinical outcomes of eradication of Helicobacter pylori in nonulcer dyspepsia in a population with a high prevalence of infection: results of a 12-month randomized, double blind, placebo-controlled study. Dig Dis Sci 2006;51:89ŌĆō98.


110. Ang TL, Fock KM, Teo EK, et al. Helicobacter pylori eradication versus prokinetics in the treatment of functional dyspepsia: a randomized, double-blind study. J Gastroenterol 2006;41:647ŌĆō653.


111. Gwee KA, Teng L, Wong RK, Ho KY, Sutedja DS, Yeoh KG. The response of Asian patients with functional dyspepsia to eradication of Helicobacter pylori infection. Eur J Gastroenterol Hepatol 2009;21:417ŌĆō424.


112. Mazzoleni LE, Sander GB, Francesconi CF, et al. Helicobacter pylori eradication in functional dyspepsia: HEROES trial. Arch Intern Med 2011;171:1929ŌĆō1936.


113. Sodhi JS, Javid G, Zargar SA, et al. Prevalence of Helicobacter pylori infection and the effect of its eradication on symptoms of functional dyspepsia in Kashmir, India. J Gastroenterol Hepatol 2013;28:808ŌĆō813.


114. Yazdanbod A, Salimian S, Habibzadeh S, Hooshyar A, Maleki N, Norouzvand M. Effect of Helicobacter pylori eradication in Iranian patients with functional dyspepsia: a prospective, randomized, placebo-controlled trial. Arch Med Sci 2015;11:964ŌĆō969.


115. Tack J, Piessevaux H, Coulie B, Caenepeel P, Janssens J. Role of impaired gastric accommodation to a meal in functional dyspepsia. Gastroenterology 1998;115:1346ŌĆō1352.


116. Van Oudenhove L, Kindt S, Vos R, Coulie B, Tack J. Influence of buspirone on gastric sensorimotor function in man. Aliment Pharmacol Ther 2008;28:1326ŌĆō1333.


117. Tack J, Janssen P, Masaoka T, Farr├® R, Van Oudenhove L. Efficacy of buspirone, a fundus-relaxing drug, in patients with functional dyspepsia. Clin Gastroenterol Hepatol 2012;10:1239ŌĆō1245.


118. Miwa H, Nagahara A, Tominaga K, et al. Efficacy of the 5-HT1A agonist tandospirone citrate in improving symptoms of patients with functional dyspepsia: a randomized controlled trial. Am J Gastroenterol 2009;104:2779ŌĆō2787.


119. Tack J, Broeckaert D, Coulie B, Janssens J. The influence of cisapride on gastric tone and the perception of gastric distension. Aliment Pharmacol Ther 1998;12:761ŌĆō766.


120. Tack J, Janssen P, Bisschops R, Vos R, Phillips T, Tougas G. Influence of tegaserod on proximal gastric tone and on the perception of gastric distention in functional dyspepsia. Neurogastroenterol Motil 2011;23:e32ŌĆōe39.


121. Amano T, Ariga H, Kurematsu A, et al. Effect of 5-hydroxytryptamine receptor 4 agonist mosapride on human gastric accommodation. Neurogastroenterol Motil 2015;27:1303ŌĆō1309.


122. Kusunoki H, Haruma K, Manabe N, et al. Therapeutic efficacy of acotiamide in patients with functional dyspepsia based on enhanced postprandial gastric accommodation and emptying: randomized controlled study evaluation by real-time ultrasonography. Neurogastroenterol Motil 2012;24:540ŌĆōe251.


123. Lacy BE, Saito YA, Camilleri M, et al. Effects of antidepressants on gastric function in patients with functional dyspepsia. Am J Gastroenterol 2018;113:216ŌĆō224.


124. Lu Y, Chen M, Huang Z, Tang C. Antidepressants in the treatment of functional dyspepsia: a systematic review and meta-analysis. PLoS One 2016;11:e0157798.



125. Ford AC, Luthra P, Tack J, Boeckxstaens GE, Moayyedi P, Talley NJ. Efficacy of psychotropic drugs in functional dyspepsia: systematic review and meta-analysis. Gut 2017;66:411ŌĆō420.


126. Cheong PK, Ford AC, Cheung CKY, et al. Low-dose imipramine for refractory functional dyspepsia: a randomised, double-blind, placebo-controlled trial. Lancet Gastroenterol Hepatol 2018;3:837ŌĆō844.


127. Kaosombatwattana U, Pongprasobchai S, Limsrivilai J, Maneerattanaporn M, Leelakusolvong S, Tanwandee T. Efficacy and safety of nortriptyline in functional dyspepsia in Asians: a randomized double-blind placebo-controlled trial. J Gastroenterol Hepatol 2018;33:411ŌĆō417.


128. Talley NJ, Locke GR, Saito YA, et al. Effect of amitriptyline and escitalopram on functional dyspepsia: a multicenter, randomized controlled study. Gastroenterology 2015;149:340ŌĆō9.e2.



129. Jaafar MH, Safi SZ, Tan MP, Rampal S, Mahadeva S. Efficacy of rebamipide in organic and functional dyspepsia: a systematic review and meta-analysis. Dig Dis Sci 2018;63:1250ŌĆō1260.


130. Gudj├│nsson H, Oddsson E, Bj├Črnsson S, et al. Efficacy of sucralfate in treatment of non-ulcer dyspepsia. A double-blind placebo-controlled study. Scand J Gastroenterol 1993;28:969ŌĆō972.


131. Kairaluoma MI, Hentilae R, Alavaikko M, et al. Sucralfate versus placebo in treatment of non-ulcer dyspepsia. Am J Med 1987;83:51ŌĆō55.


132. Moayyedi P, Soo S, Deeks J, et al. Systematic review: antacids, H2-receptor antagonists, prokinetics, bismuth and sucralfate therapy for non-ulcer dyspepsia. Aliment Pharmacol Ther 2003;17:1215ŌĆō1227.


133. Holtmann G, Gschossmann J, Karaus M, et al. Randomised double-blind comparison of simethicone with cisapride in functional dyspepsia. Aliment Pharmacol Ther 1999;13:1459ŌĆō1465.


134. Holtmann G, Gschossmann J, Mayr P, Talley NJ. A randomized placebo-controlled trial of simethicone and cisapride for the treatment of patients with functional dyspepsia. Aliment Pharmacol Ther 2002;16:1641ŌĆō1648.


135. Adibi P, Keshteli AH, Daghaghzadeh H, Roohafza H, Pournaghshband N, Afshar H. Association of anxiety, depression, and psychological distress in people with and without functional dyspepsia. Adv Biomed Res 2016;5:195.



136. Calvert EL, Houghton LA, Cooper P, Morris J, Whorwell PJ. Long-term improvement in functional dyspepsia using hypnotherapy. Gastroenterology 2002;123:1778ŌĆō1785.


137. Haug TT, Wilhelmsen I, Svebak S, Berstad A, Ursin H. Psychotherapy in functional dyspepsia. J Psychosom Res 1994;38:735ŌĆō744.


138. Hamilton J, Guthrie E, Creed F, et al. A randomized controlled trial of psychotherapy in patients with chronic functional dyspepsia. Gastroenterology 2000;119:661ŌĆō669.


139. Soo S, Forman D, Delaney BC, Moayyedi P. A systematic review of psychological therapies for nonulcer dyspepsia. Am J Gastroenterol 2004;99:1817ŌĆō1822.


140. Haag S, Senf W, Tagay S, et al. Is there a benefit from intensified medical and psychological interventions in patients with functional dyspepsia not responding to conventional therapy? Aliment Pharmacol Ther 2007;25:973ŌĆō986.


141. Orive M, Barrio I, Orive VM, et al. A randomized controlled trial of a 10 week group psychotherapeutic treatment added to standard medical treatment in patients with functional dyspepsia. J Psychosom Res 2015;78:563ŌĆō568.

142. Chen Y, Wang C, Wang J, et al. Association of psychological characteristics and functional dyspepsia treatment outcome: a case-control study. Gastroenterol Res Pract 2016;2016:5984273.



143. Barbera R, Feinle C, Read NW. Nutrient-specific modulation of gastric mechanosensitivity in patients with functional dyspepsia. Dig Dis Sci 1995;40:1636ŌĆō1641.

144. Pilichiewicz AN, Horowitz M, Holtmann GJ, Talley NJ, Feinle-Bisset C. Relationship between symptoms and dietary patterns in patients with functional dyspepsia. Clin Gastroenterol Hepatol 2009;7:317ŌĆō322.


145. Pilichiewicz AN, Feltrin KL, Horowitz M, et al. Functional dyspepsia is associated with a greater symptomatic response to fat but not carbohydrate, increased fasting and postprandial CCK, and diminished PYY. Am J Gastroenterol 2008;103:2613ŌĆō2623.

146. Feinle-Bisset C, Azpiroz F. Dietary and lifestyle factors in functional dyspepsia. Nat Rev Gastroenterol Hepatol 2013;10:150ŌĆō157.


Forest plot of randomized controlled trials comparing proton pump inhibitors to placebos in patients with functional dyspepsia. CI, confidence interval; PPI, proton pump inhibitor.
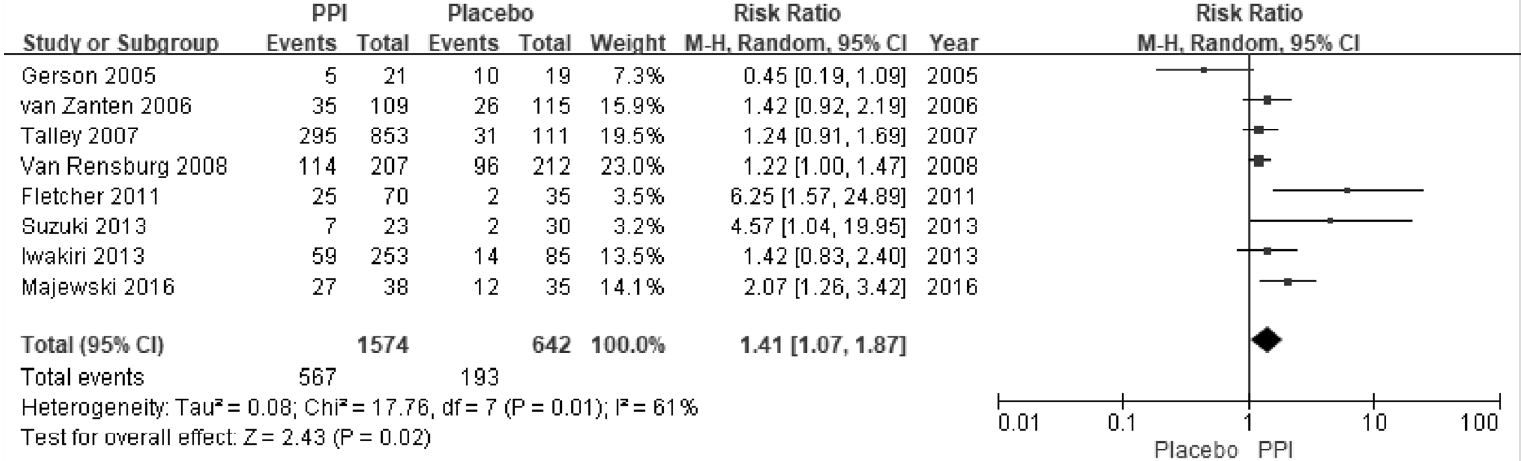
Figure┬Ā1.
Forest plot of randomized controlled trials comparing proton pump inhibitors to placebos in patients with functional dyspepsia in terms of global symptom relief. CI, confidence interval; PPI, proton pump inhibitor.
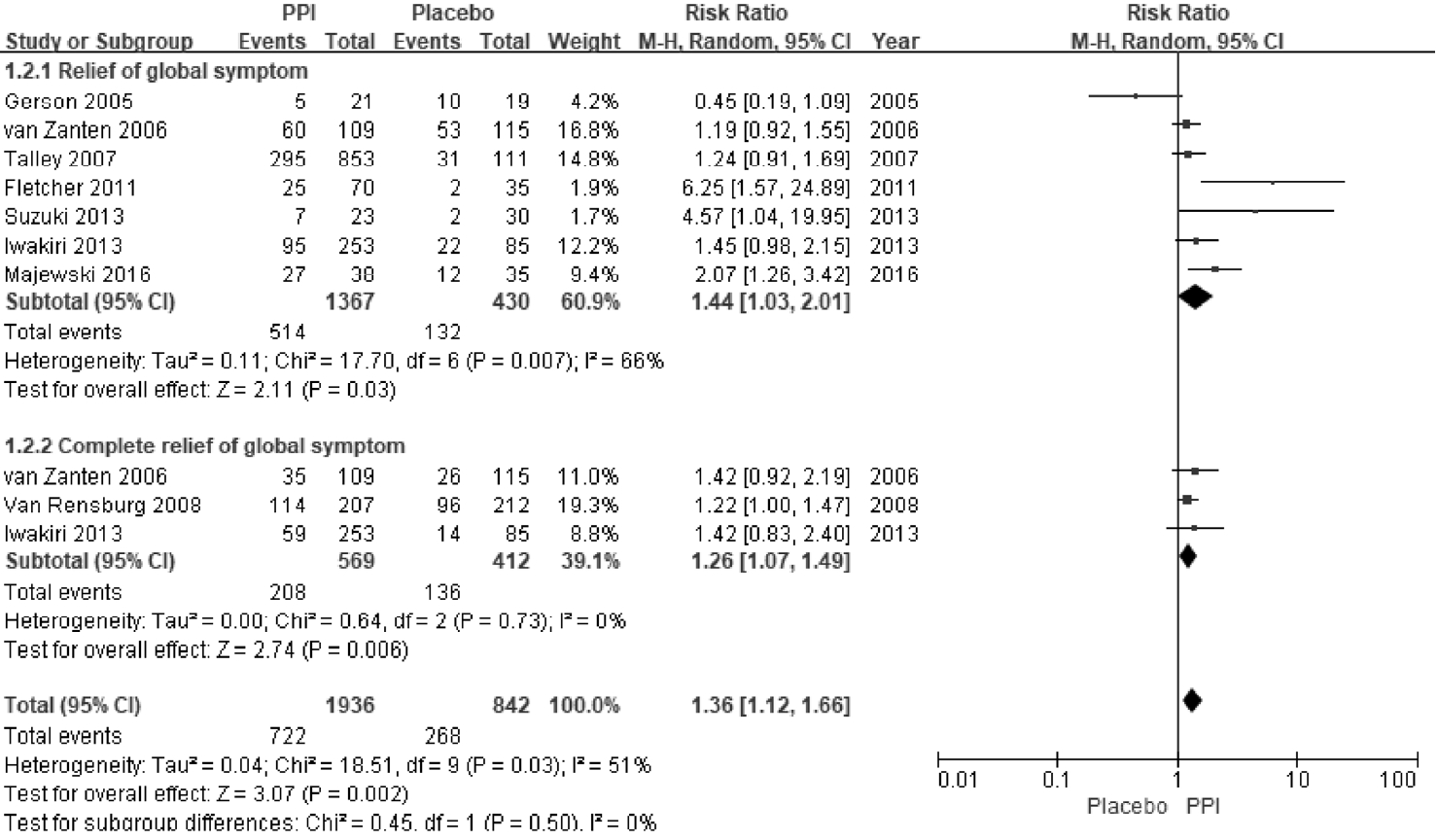
Figure┬Ā2.
Forest plot of randomized controlled trials comparing proton pump inhibitors to placebos in patients with functional dyspepsia patients by treatment duration. CI, confidence interval; PPI, proton pump inhibitor.
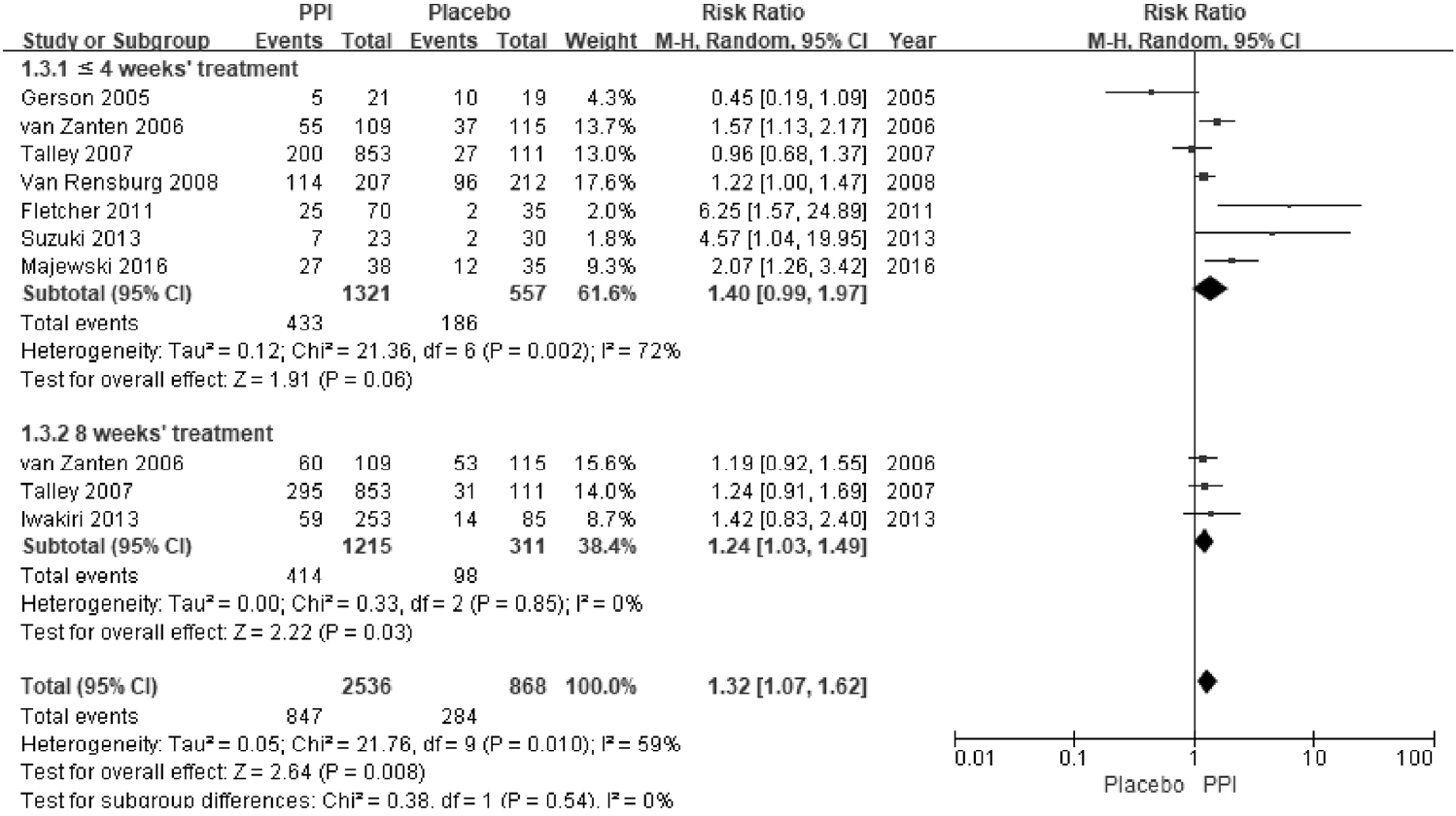
Figure┬Ā3.
Forest plot of randomized controlled trials comparing proton pump inhibitors to placebos by the predominant symptoms of patients with functional dyspepsia. CI, confidence interval; PPI, proton pump inhibitor.
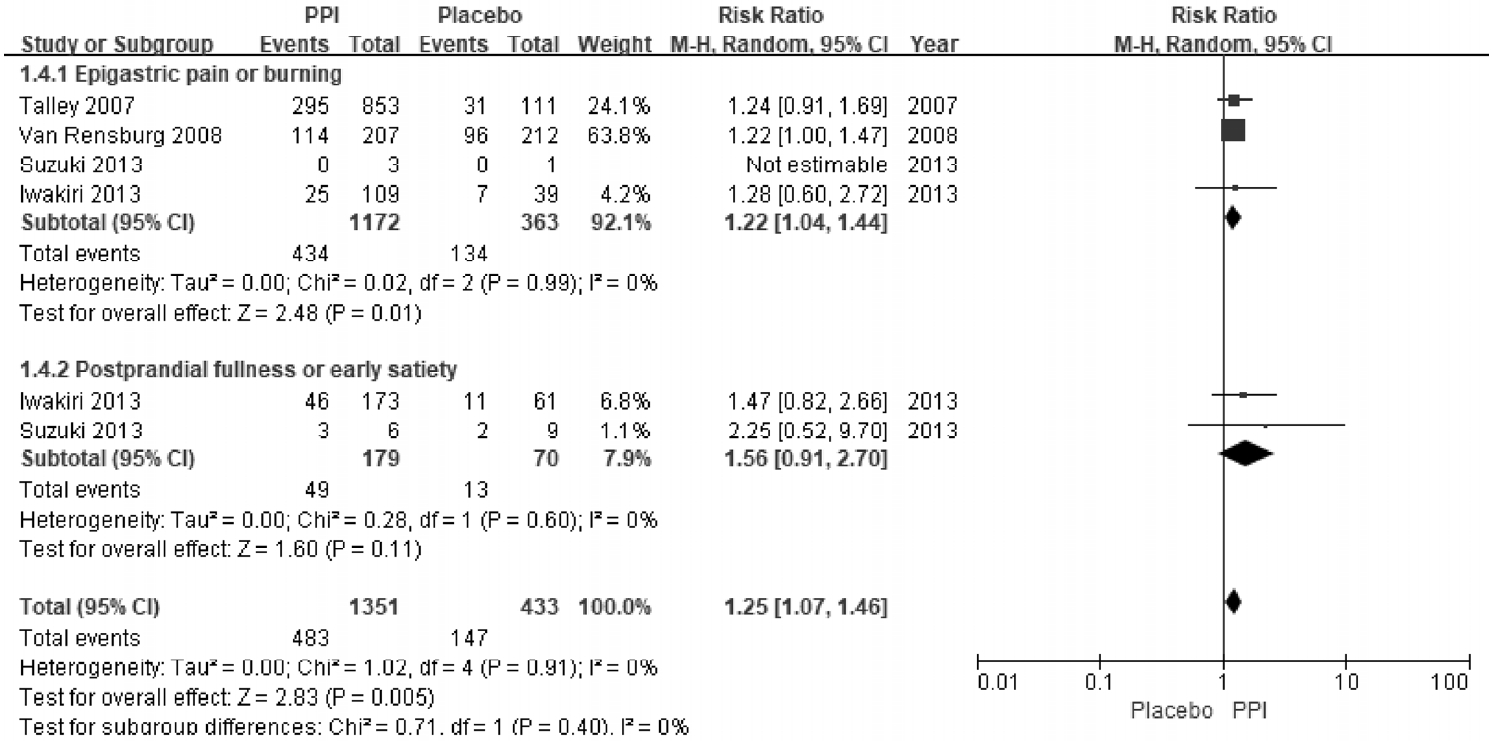
Figure┬Ā4.
Forest plot of randomized controlled trials comparing Helicobacter pylori eradication to placebo antibiotics in Helicobacter pylori-infected patients with functional dyspepsia. CI, confidence interval.
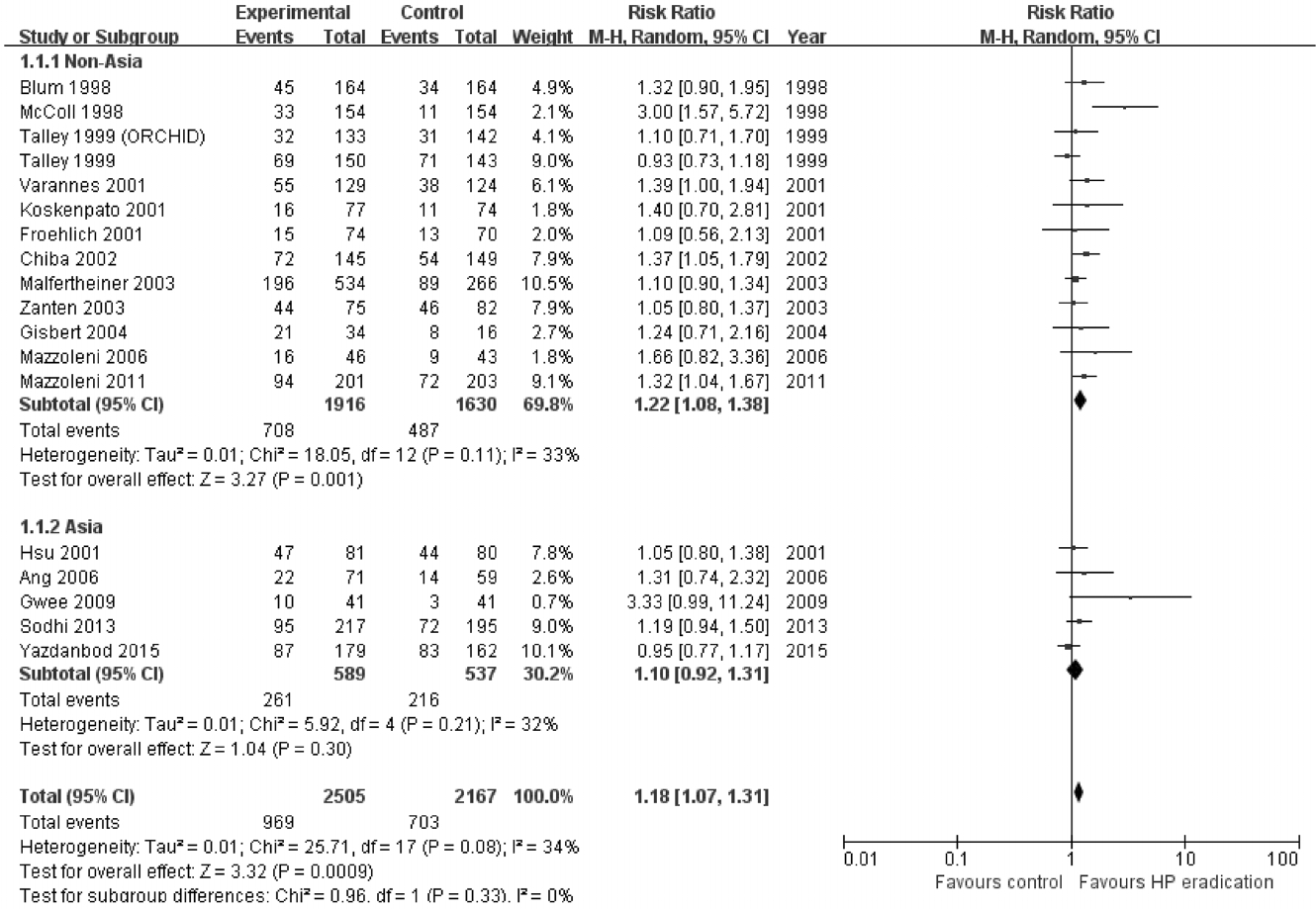
Figure┬Ā5.
Forest plot of randomized controlled trials comparing tricyclic antidepressants to placebos in patients with functional dyspepsia. CI, confidence interval; TCA, tricyclic antidepressant.
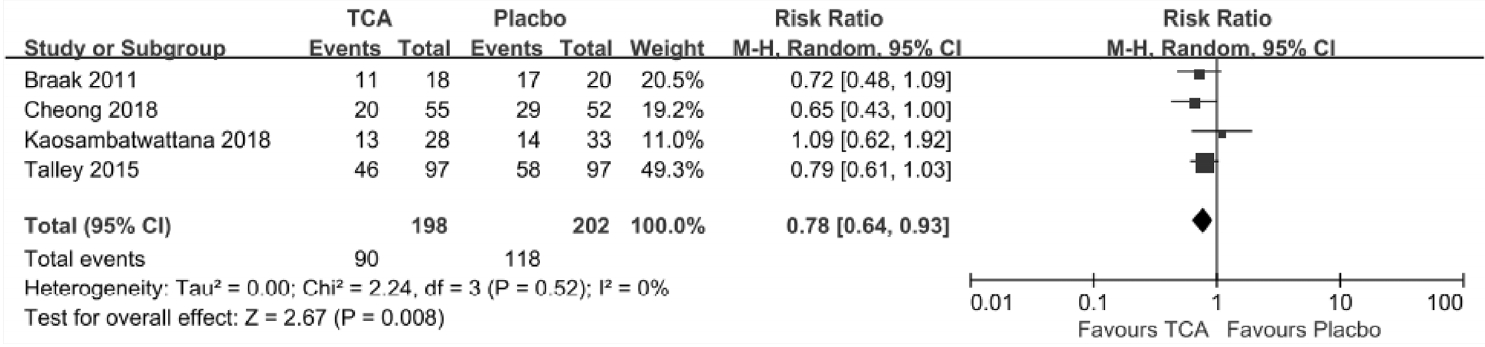
Figure┬Ā6.
Forest plot of adverse events in randomized controlled trials comparing tricyclic antidepressants to placebos in patients with functional dyspepsia. CI, confidence interval; TCA, tricyclic antidepressant.
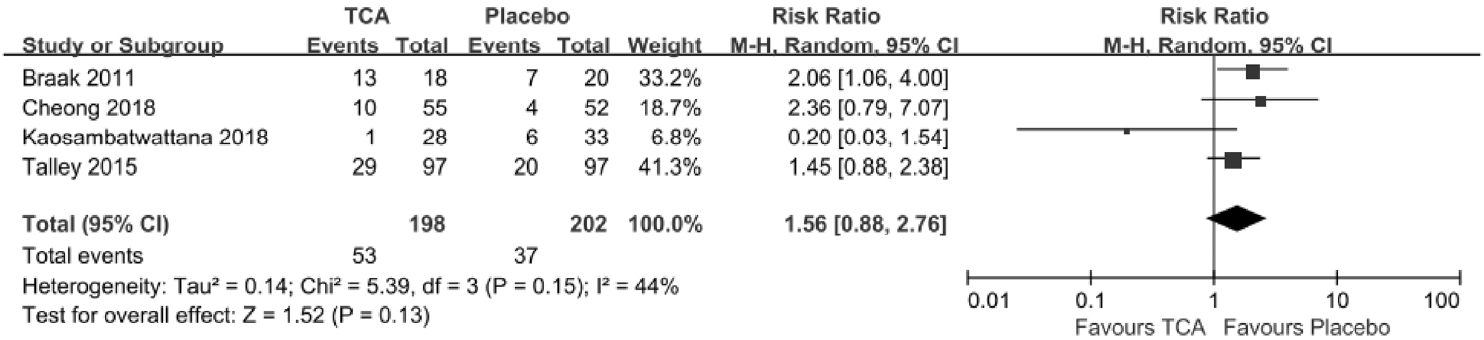
Figure┬Ā7.
Table┬Ā1.
Level of evidence and recommendations
Table┬Ā2.
Summary of the consensus statement
Table┬Ā3.
Prokinetic drugs used to treat functional dyspepsia
Table┬Ā4.
Studies included in a meta-analysis of the effect of Helicobacter pylori eradication on functional dyspepsia status
| Studies | Country | H. pylori prevalence (%) | Arms (regimens) | No. of patients | Mean age | Eradication rate (%) | Follow-up | Adverse event |
|---|---|---|---|---|---|---|---|---|
| McColletal. [97] (1998) | UK | 35.5 | OAM | 160 | 42.0 ┬▒ 12 | 85 | 12 M | NA |
| O | 158 | 42.2 ┬▒ 13 | 12 | 12 M | NA | |||
| Blumetal. [98] (1998) | Austria, Canada, Germany, Iceland, Ireland, Sweden, South Africa | 41.6 (mean) | OAC | 164 | 47 | 79 | 12 M | 12 (7) |
| O | 164 | 47 | 2 | 12 M | 2 (1) | |||
| Talley et al. [99] (1999) | US | 35.6 | OAC | 150 | 46.3 | 90 | 12 M | NA |
| Placebo | 143 | 46.5 | 2 | 12 M | NA | |||
| Talley et al. [100] (1999) (ORCHID) | Australia, New Zealand, and Europe | 28.0 (mean) | OAC | 133 | 51 | 85 | 12M | NA |
| Placebo | 142 | 47 | 4 | 12 M | NA | |||
| Koskenpato et al. [101] (2001) | Finland | 56.8 | OAM | 77 | 51.5 ┬▒ 9.5 | 82 | 12 M | NA |
| O | 74 | 51.8 ┬▒ 11.8 | 1 | 12 M | NA | |||
| Hsuetal. [102] (2001) | Taiwan | 53.9 | LMTe | 81 | 50.3 ┬▒ 15.1 | 78 | 12M | NA |
| L | 80 | 51.6 ┬▒ 16.4 | 0 | 12 M | NA | |||
| Varannes et al. [103] (2001) | France | 46.9 | RAC | 129 | 50 ┬▒ 16 | 69 | 12 M | 36 (28) |
| Placebo | 124 | 52 ┬▒ 14 | 18 | 12 M | 12 (10) | |||
| Froehlichetal. [104] (2001) | Switzerland | 18.9 | LAC | 92 | 43.6 ┬▒12.4 | 75 | 12 M | NA |
| L | 88 | 45.6 ┬▒ 14.2 | 4 | 12 M | NA | |||
| Chiba et al. [105] (2002) | Canada | 38.0 | OCM | 145 | 50 (18-82) | 75 | 12 M | 61 (42) |
| O | 149 | 49 (19-81) | 14 | 12 M | 62 (42) | |||
| Zanten et al. [106] (2003) | Canada | 38.0 | LAC | 75 | 47 ┬▒ 13 | 82 | 12 M | NA |
| Placebo | 82 | 49 ┬▒ 13 | 6 | 12 M | NA | |||
| Malfertheineret al. [107] (2003) | Germany | 35.3 | LAC | 247 | 46.1 ┬▒12.8 (30 mg) | 65.6 (30 mg) | 12 M | 18 (7) (30 mg) |
| (30 mg, n= 124, 15 mg, n= 123) | 46.9 ┬▒ 12.0 (15 mg) | 62.1 (15 mg) | 13 (5) (15 mg) | |||||
| L | 133 | 45.5 ┬▒12.6 | 4.5 | 12 M | 15(6) | |||
| Gisbertetal. [108] (2004) | Spain | 54.9 | OAC | 34 | 42 | 76 | 12 M | NA |
| R | 16 | 41 | 0 | 12 M | NA | |||
| Mazzoleni et al. [109] (2006) | Brazil | 71.2 | LAC | 46 | 43.2 ┬▒ 11.9 | 91.3 | 12 M | NA |
| L | 45 | 39.2 ┬▒ 13.8 | 0 | 12 M | NA | |||
| Angetal. [110] (2006) | Singapore | 40.8 | LAC | 71 | 38.6 | 73.2 | 52 wk | 4(6) |
| Prokinetic | 59 | 38.4 | 0 | 52 wk | 3(5) | |||
| 6wk | ||||||||
| Gweeetal. [111] (2009) | Singapore | 40.8 | OCTi | 41 | 44.7 ┬▒ 11.4 | 68.3 | 12M | NA |
| Placebo | 41 | 36.1 ┬▒ 12.1 | 4.9 | 12M | NA | |||
| Mazzoleni et al. [112] (2011) | Brazil | 71.2 | OAC | 201 | 46.1 ┬▒ 12.4 | 88.6 | 12M | 172 (93) |
| 203 | 46.0 ┬▒12.2 | 7.4 | 12M | 146 (82) | ||||
| Sodhi etal. [113] (2013) | India | 63.5 | OAC | 259 | 46 (25-65) | 69.9 | 12M | NA |
| O | 260 | 43 (20-68) | 5.0 | 12M | NA | |||
| Yazdanbod et al. [114] (2015) | Iran | 59.0 | OACB | 186 | 36.8 | 87.1 | 12M | NA |
| Omeprazole | 173 | 36.8 | 2.9 | 12M | NA |
Values are presented as mean ┬▒ standard deviation or number (%) or median (interquartile range).
H. pylori, Helicobacter pylori; NA, not applicable; M, months; Wk, weeks; O, omeprazole; A, amoxicillin; M, metronidazole; C, clarithromycin; R, ranitidine; L, lansoprazole; Te, Tetracycline; Ti, tinidazole; B, bismuth.
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 13,208 View
- 1,696 Download



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



