 |
 |
| Korean J Med > Volume 93(6); 2018 > Article |
|
당질코르티코이드는 포도당신합성, 당원 및 단백질분해 그리고 지방분해를 포함한 대사, 면역 반응, 심혈관계 활동, 뇌기능 등 다양한 생리적 활동 과정에 관여한다[2]. 정상인에서 혈장 코르티솔 농도는 혈장 adrenocorticotropic hormone (ACTH) 농도의 하루 주기 리듬에 따라 변동한다[2]. 코르티솔의 합성과 분비는 시상하부, 뇌하수체 그리고 부신과 연결된 축(hypothalamus-pituitary-adrenal neuroendocrine axis)을 통하여 조절된다[3]. 정상인의 오전 6시 혈장 코르티솔 농도는 10-20 μg/dL (275-555 nmol/L)로 하루 중 가장 높고, 오후 4시에는 3-10 μg/dL (85-275 nmol/L)로 떨어지고, 수면 1시간 후에는 5 μg/dL (140 nmol/L) 미만으로 떨어진다[2]. 쿠싱증후군에서는 혈장 코르티솔 분비의 하루 주기 리듬이 소실되므로 밤 중에도 혈장 코르티솔 농도는 증가되어 있다[4]. 따라서 쿠싱증후군의 선별 검사로 자정 혈장 코르티솔 농도가 이용되며, 그 농도가 7.5 μg/dL (207 nmol/L) 이상일 때 쿠싱증후군을 의심할 수 있다[5]. 하지만 기타 동반 질환, 심리적 스트레스, 채혈 등의 생리적 고코르티솔혈증에 의한 위양성이 있음을 알고 있어야 한다[6]. 측정 방법에는 여러 가지가 있으나 방사면역측정법이 현재 가장 많이 이용된다[2]. 주결합 단백질인 코르티솔-결합 글로불린 농도에 영향을 미치는 약제나 환경(에스트로겐, 임신) 그리고 덱사메타손의 대사에 영향을 끼치는 항경련제(예: 페니토인, 페노바비탈, 카바마제핀 등) 등에 의해서도 혈장 총 코르티솔 농도가 영향을 받기 때문에 진단시 고려하여야 한다(Table 1) [2,3].
반면, 전신 쇠약감, 피로감, 식욕부진, 구역, 구토 등 임상적으로 부신기능부전이 의심되는 경우 확진을 위하여 생화학적 검사를 시행하여야 한다[2]. 즉, 기저 혈장 코르티솔 농도와 소변 유리 코르티솔 농도가 종종 낮게 측정될 수 있으며, 때로 그 값이 정상 범위에 들어도 부신기능부전을 전적으로 배제할 수는 없다. 기저 코르티솔 농도가 14.5 μg/dL (400 nmol/L) 이상인 경우 시상하부-뇌하수체-부신 축은 정상이라고 진단할 수 있다. 따라서, 임상에서 종종 부신기능부전이 의심되는 경우 급속 부신피질자극호르몬 자극 검사를 시행하고 있다[3].
혈장 ACTH 농도는 ACTH 의존/비의존 쿠싱증후군을 감별하기 위한 유용한 검사이다[3]. 그리고 혈장 ACTH 농도는 혈장 코르티솔 농도와 동시에 측정하여야 올바른 진단을 할 수 있다. 혈장 ACTH 농도의 정상 범위는 아침에 0-60 pg/mL이며, 쿠싱병의 경우 보통 정상범위 내지는 약간 상승된 40-200 pg/mL 농도 범위에 있다. 이소성 ACTH 증후군의 경우 대부분 90 pg/mL 이상이며 65%의 환자에서는 200 pg/mL 이상 높게 측정된다. 일부에서 10,000 pg/mL 이상 높게 측정되는 경우도 있다[3]. 그러나 쿠싱병에서 측정되는 ACTH 농도와 이소성 ACTH 증후군에서 측정되는 농도가 많이 겹치므로 ACTH 농도 측정만으로 두 질환을 전적으로 감별할 수는 없다. 반면, 부신선종에 의한 쿠싱증후군의 경우 ACTH 농도는 10 pg/mL 이하로 억제되어 있다[3]. 대개 일차 부신기능저하증에서 혈장 ACTH 농도는 증가되어 있지만, 이차 부신기능저하증에서는 정상 혹은 감소되어 있다[2].
ACTH 농도는 방사면역측정법 또는 면역방사계측법으로 측정한다. 특히, ACTH는 실온에서 불안정하여 혈구세포와 혈소판에서 분비하는 효소에 의하여 쉽게 분해되며 유리 및 플라스틱의 표면에 잘 부착된다. 따라서 ethylenediaminetetraacetic acid (EDTA) 튜브에 채혈하여야 하고 곧바로 검사가 곤란한 경우, 미리 냉각된 EDTA 튜브에 채혈하여 원심 분리한 다음 혈장을 -20℃ 냉장고에 보관하여야 한다[7].
하룻밤 1 mg 덱사메타손 억제 검사는 쿠싱증후군이 의심되는 환자에서 외래에서 간단히 시행할 수 있는 검사이다. 덱사메타손 1 mg을 밤 11시와 자정 사이에 경구로 복용케하고 다음 날 아침 8시에서 9시 사이에 혈장 코르티솔 농도를 측정한다. 혈장 코르티솔 농도가 1.8 μg/dL (50 nmol/L) 미만이면 쿠싱증후군을 배제할 수 있고 1.8 μg/dL (50 nmol/L) 이상이면 쿠싱증후군을 의심할 수 있다[1]. 혈장 코르티솔 농도의 기준을 1.8 μg/dL (50 nmol/L)로 할 경우 95%의 높은 민감도와 80%의 특이도로 쿠싱증후군을 효과적으로 감별할 수 있으나 특이도가 낮으므로 추가 검사가 필요하다[8]. 하룻밤 1 mg 덱사메타손 억제 검사에서 양성인 경우 위양성을 감별하기 위하여 표준 저용량 덱사메타손 억제 검사를 시행한다. 0.5 mg 덱사메타손을 경구로 6시간 마다 총 8회 복용케한 후 투여 2일째 소변을 수집하여 24시간 소변 유리코르티솔 농도를 측정하고, 덱사메타손 마지막 용량 투여 후 6시간째에 혈장 코르티솔 농도를 측정한다[1].
급속 ACTH 자극 검사는 합성 부신피질자극호르몬제인 tetracosactrin 250 μg을 근육 혹은 정맥으로 주사한 후 0, 30, 60분에 혈장 코르티솔 농도를 측정하여 최대 자극치가 20 μg/dL (550 nmol/L) 이상인 경우 정상으로 판정한다[9]. 급속 ACTH 자극 검사에서 정상인 경우 일차성 부신피질기능부전증을 배제할 수 있으나 이차성의 경우 ACTH 자극에 의한 반응소실에 이어 부신피질 위축이 발생하기까지 4-6주의 기간이 소요되므로 질환의 초기에는 정상 반응을 보일 수 있으므로 진단시 참고하여야 한다. 만일 이차성 부신피질기능부전이 의심될 경우 인슐린 유발 저혈당 검사(insulin-induced hypoglycemia test)를 시행하여 뇌하수체에서 부신피질자극호르몬이 정상적으로 분비되는지를 확인하여야 한다[2,3].
고혈압, 자발적 또는 이뇨제 사용 후에 발생한 저칼륨혈증 그리고 부신우연종이 진단되는 경우 일차 알도스테론증을 배제하기 위하여 PRA와 혈장 알도스테론 농도(plasma aldosterone concentration, PAC)를 측정하고, 다음에 기술한 PAC와 PRA 비(PAC/PRA ratio)를 계산한다(Fig. 1) [1]. 혈장 레닌 농도를 정량적으로 측정하는 것보다 PRA를 측정하는 것이 진단을 위한 특이도가 높다. PRA는 일정 기간 동안 레닌의 기질인 안지오텐시노겐에 환자의 혈장을 첨가한 후 형성되는 안지오텐신Ⅰ을 방사면역측정법으로 측정하는 방법이다. 정상인의 PRA는 1-6 ng/mL/h (0.77-4.6 nmol/L/h)이며 염분 섭취와 자세에 따라 그 값이 변동한다[2,3].
PAC/PRA 비는 아침 기상 2시간 후 15분 동안 앉은 자세를 취한 후 측정하여야 한다. 검사 전 염분 섭취를 충분히 하고, 저칼륨혈증을 교정한 후에 측정하도록 한다. 검사 전 PAC와 PRA에 영향을 주는 약제의 복용 유무를 꼭 확인하여야 한다. 염류코르티코이드 수용체 길항제(spironolactone, eplerenone)는 최소 4주간 중단하여야 하고, 안지오텐신전환효소억제제, 안지오텐신수용체차단제, 칼륨 비보존성 이뇨제, 비스테로이드항염제, 중추성 알파2 아드레날린 수용체 작용제 등도 최소 2주 동안 중단한 후 검사하여야 한다(Table 1). 일차 알도스테론증을 의심할 수 있는 선별 검사의 기준치는 PAC/PRA 비가 20-30 (ng/dL per ng/mL/h) 이상이고, 동시에 PAC는 적어도 15 ng/dL 이상일 때로 정의하고 있다. PAC/PRA 비를 측정할 때 각 농도 값의 단위를 반드시 확인하여야 하고, PAC 값의 단위가 pmol/L인 경우 ng/dL로 환산한 후 계산하여야 한다[10].
정상인과 본태성 고혈압 환자에서 앙와위와 급속한 혈장 용적을 팽창시킬 경우 신장의 관류 증가로 인하여 레닌 분비는 감소한다. 그 결과 레닌에 의한 안지오텐시노겐의 안지오텐신Ⅰ, 안지오텐신Ⅱ로의 전환 감소로 알도스테론의 분비가 감소한다. 그러나 일차 알도스테론증 환자에서는 앙와위 혹은 급속한 혈장 용적 팽창에도 불구하고 PAC가 억제되지 않는다.
생리식염수 부하 검사는 PAC/PRA 비가 20-30 (ng/dL per ng/mL/h) 이상인 경우 또는 고혈압 환자에서 저칼륨혈증이 있고 PAC > 20 ng/dL일 때 PAC/PRA 비 검사를 하지 않고 바로 생리식염수 부하 검사를 시행한다[8]. 검사 시작 1시간 전부터 앉은 자세에서 기저 PAC, PRA를 채취하고 4시간 동안 누워 있는 상태에서 생리식염수 2 L를 정맥 주사한 다음 PAC를 측정한다. 생리식염수를 주입하는 동안 환자의 혈압과 심박수를 모니터링하여야 한다. 정상인에서는 PAC가 5 ng/dL 미만으로 억제되지만, 일차 알도스테론증에서는 혈장 PAC가 10 ng/dL 이상으로 측정되면서 억제되지 않는다. 잘 조절되지 않는 고혈압, 신기능저하, 심부전증, 부정맥 및 저칼륨혈증이 있는 환자에서는 금기이다[14].
저항성 고혈압, 두통, 심계항진, 발한 등 갈색세포종이 의심되는 경우 혈장 카테콜라민 농도 검사를 시행한다[15]. 혈장 카테콜라민은 종양에서 분비되는 호르몬의 분비 변화에 따라 급격한 농도 변화를 보이므로 혈장 카테콜라민 농도 측정은 민감도가 낮다. 하지만 카테콜라민 대사물인 노르메타네프린과 메타네프린은 종양에서 비교적 지속적으로 분비되므로, 혈장 유리 메타네프린 농도 측정은 스트레스에 의한 위양성 빈도가 낮아서 민감도는 96-100%, 특이도는 85-89%로 갈색세포종의 선별 검사를 위한 가장 적합한 검사로 알려져 있다[16,17]. 따라서, 혈장 유리 메타네프린 농도의 검사치가 정상 상한치의 2-3배 이상으로 증가된 경우 갈색세포종을 의심할 수 있다. 만일, 검사 결과가 2-3배 이하로 소폭 증가한 경우에는 기타 검사를 시행하거나 재검할 것을 권고하고 있다[16,17].
삼환계 항우울제, 레보도파, 아드레날린수용체 작용제, 암페타민, 향정신성 약물, 마약류, 알코올 등의 경우 카테콜라민 생성에 영향을 주므로 검사 전 약물을 조사하여 다른 약제로 대체한 후 검사하도록 한다(Table 1). 자세 또한 검사결과에 영향을 줄 수 있으므로 30분 이상 누운 상태에서 검사하도록 한다[18]. 특히 혈액투석을 받고 있는 신부전 환자의 경우 혈중 카테콜라민 농도가 2-3배 이상 상승해 있으므로 진단에 유의하여야 한다. 신부전 환자에서 노르에피네프린 농도가 3배 이상 증가되어 있거나 에피네프린이 정상의 상한치를 상회할 경우 갈색세포종을 의심할 수 있다[2,3].
최근 건강 검진 등 영상 검사가 시행이 잦아지면서 우연히 발견되는 부신 질환의 빈도가 증가하고 있다. 특히 부신우연종은 10% 이상에서 호르몬을 과분비하는 것으로 알려져 있다. 그러므로 부신우연종, 이차성 고혈압 등의 부신 질환이 의심되는 경우 기능성 유무를 감별하기 위하여 혈액 검사를 시행하게 되는데, 이때 혈장 코르티솔 및 ACTH, PAC, PRA, 유리 메타네프린 농도 등은 부신 질환의 진단 및 치료, 더 나아가 예후를 결정하는데 매우 중요하다. 본 논문에서는 부신 질환의 진단을 위한 혈액 검사의 의미와 검사 방법, 해석 방법 등에 관하여 살펴보았다. 특히 쿠싱증후군과 갈색세포종의 진단을 위해서는 혈액 검사 외 소변 검사도 필요하다. 의사는 임상 및 영상 소견에서 부신 질환이 의심될 경우, 선별 검사를 위하여 혈액을 채취하고 각각의 검사 결과를 해석할 수 있어야 한다.
REFERENCES
1. Lee JM, Kim MK, Ko SH, et al. Guidelines for the management of adrenal incidentaloma: the Korean Endocrine Society, committee for clinical practice guidelines. Korean J Med 2017;92:4–16.

2. Korean Endocrine Society. Textbook of endocrinology and metabolism. 2nd ed. Seoul: Koonja Press, 2011.
3. Kim SY, Min HK. Clinical endocrinology. 3rd ed. Seoul: Korea Medical Book Publishing Company, 2016.
4. Chung S, Son GH, Kim K. Circadian rhythm of adrenal glucocorticoid: its regulation and clinical implications. Biochim Biophys Acta 2011;1812:581–591.


5. Hur KY, Kim JH, Kim BJ, Kim MS, Lee EJ, Kim SW. Clinical guidelines for the diagnosis and treatment of Cushing's disease in Korea. Endocrinol Metab (Seoul) 2015;30:7–18.



6. Hansen AM, Garde AH, Christensen JM, Eller NH, Netterstrøm B. Evaluation of a radioimmunoassay and establishment of a reference interval for salivary cortisol in healthy subjects in Denmark. Scand J Clin Lab Invest 2003;63:303–310.


7. Jaffe BM, Behrman HR. Methods of hormone radioimmunoassay. 2nd ed. New York: Academic Press, 1978.
8. Nieman LK, Biller BM, Findling JW, et al. The diagnosis of Cushing's syndrome: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2008;93:1526–1540.



9. May ME, Carey RM. Rapid adrenocorticotropic hormone test in practice. Retrospective review. Am J Med 1985;79:679–684.


10. Weinberger MH, Fineberg NS. The diagnosis of primary aldosteronism and separation of two major subtypes. Arch Intern Med 1993;153:2125–2129.


11. Fujimoto K, Honjo S, Tatsuoka H, et al. Primary aldosteronism associated with subclinical Cushing syndrome. J Endocrinol Invest 2013;36:564–567.

12. Nakajima Y, Yamada M, Taguchi R, et al. Cardiovascular complications of patients with aldosteronism associated with autonomous cortisol secretion. J Clin Endocrinol Metab 2011;96:2512–2518.


13. Tang L, Li X, Wang B, et al. Clinical characteristics of aldosterone- and cortisol-coproducing adrenal adenoma in primary aldosteronism. Int J Endocrinol 2018;2018:4920841.



14. Holland OB, Brown H, Kuhnert L, Fairchild C, Risk M, Gomez-Sanchez CE. Further evaluation of saline infusion for the diagnosis of primary aldosteronism. Hypertension 1984;6:717–723.


15. Stein PP, Black HR. A simplified diagnostic approach to pheochromocytoma. A review of the literature and report of one institution's experience. Medicine (Baltimore) 1991;70:46–66.


16. Lenders JW, Pacak K, Walther MM, et al. Biochemical diagnosis of pheochromocytoma: which test is best? JAMA 2002;287:1427–1434.


17. Sawka AM, Jaeschke R, Singh RJ, Young WF Jr. A comparison of biochemical tests for pheochromocytoma: measurement of fractionated plasma metanephrines compared with the combination of 24-hour urinary metanephrines and catecholamines. J Clin Endocrinol Metab 2003;88:553–558.


18. Lenders JW, Duh QY, Eisenhofer G, et al. Pheochromocytoma and paraganglioma: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2014;99:1915–1942.


The algorithm used to choose hypokalemia treatment. hr, hour; PAC, plasma aldosterone concentration; PRA, plasma renin activity; sd., syndrome.
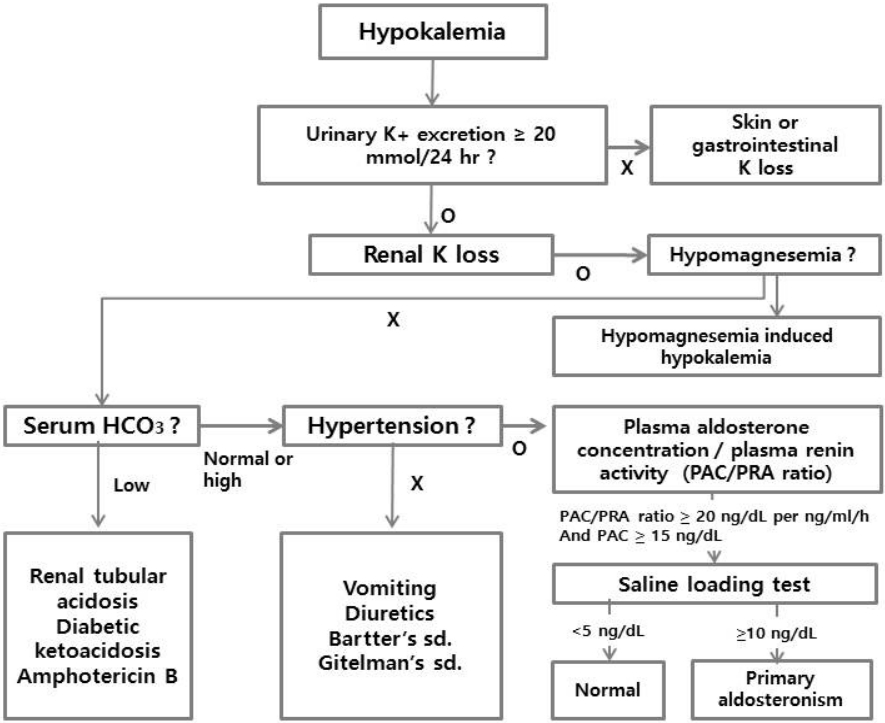
Figure 1.
Table 1.
Drugs that may affect the metabolism of plasma cortisol, aldosterone, renin, and catecholamines
| Adrenal hormone | Drug group | Drugs | Recommended withdrawal time |
|---|---|---|---|
| Plasma cortisol↓a after overnight DST | Drugs that increase metabolism by inducing CYP3A4 | Phenytoin, barbiturates, carbamazepine, rifampicin, alcohol, estrogen, mitotane | 2 weeks [7] |
| Plasma cortisol↑b after overnight DST | Drugs that decrease metabolism by inhibiting CYP3A4 | Itraconazole, ritonavir, diltiazem, cimetidine | 2 weeks |
| PAC/PRA ratio↓a [19] | Angiotensin-converting enzyme inhibitors | Captopril, enalapril, fosinopril, lisinopril, ramipril | 2 weeks |
| Angiotensin receptor blockers | Losartan, valsartan, irbesartan, candesartan, telmisartan, eprosartan, olmesartan, fimasartan | 2 weeks | |
| Dihydropyridine calcium channel blockers | Nifedipine, amlodipine | 2 weeks | |
| Mineralocorticoid antagonists | Spironolactone, eplerenone | 4 weeks | |
| Diuretics | Hydrochlorothiazide, furosemide, torsemide | 4 weeks | |
| PAC/PRA ratio↑b [19] | β-blockers | Atenolol, bisoprolol, metoprolol, nebivolol, esmolol, propranolol, carvedilol, labetalol, nadolol | 2 weeks |
| NSAIDs | Ibuprofen, dexibuprofen, naproxen, fenoprofen, ketoprofen, loxoprofen, ketorolac, aceclofenac, diclofenac, piroxicam, meloxicam | 2 weeks | |
| Renin inhibitor | Aliskiren | 2 weeks | |
| Central agonists | Clonidine, α-methyldopa | 2 weeks | |
| Plasma catecholamines [20] | Alpha-blockers | Phenoxybenzamine, doxazosin | 15 days |
| Tricyclic antidepressants | Amitriptyline, imipramine, nortriptyline | 3 days | |
| Antihistamine | Promethazine | 3 days | |
| Sympathomimetics | Salbutamol, terbutaline, bambuterol | 3 days | |
| Antipsychotics | Chlorpromazine, haloperidol, perphenazine, amisulpride, clozapine, olanzapine, quetiapine, risperidone | 10 days-1 month for depot |



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




