서 론
만성 변비는 서구의 경우 성인의 2-27%에서 볼 수 있으며[1-3] 우리나라에서도 16.5% 정도의 유병률을 보이는 아주 흔한 질환이다[4]. 남성보다 여성에서 더 흔하며[5] 65세 이상의 노인에서는 운동의 저하, 식이의 변화, 복용약물의 증가, 위장관 기능의 변화와 동반질환 혹은 장신경계의 변성 등으로 인하여 유병률이 30-40% 정도로 증가한다[6]. 또한 변비 환자들은 심각한 삶의 질의 저하를 호소한다[7].
만성 변비 환자의 대부분은 기질적 원인이 없는 특발성이며 드물게 다양한 이차적인 원인들에 의해서 변비가 유발된다. 여러 전신 질환 혹은 약물 복용 등이 변비의 원인이 될 수 있다. 변비를 일으키는 전신 질환으로는 당뇨병, 갑상선 기능 저하증, 고칼슘혈증을 초래하는 질환 등이 있다. 파킨슨병, 다발 경화증, 척추병 등의 신경 질환도 변비를 일으키며 우울증, 정신분열증 등의 정신질환도 변비의 원인이 된다. 마약성 진통제, 항콜린제, 제산제, 칼슘차단제 등 여러 약물들도 변비를 유발할 수 있다[2].
원인 규명이 가능한 이차성 변비나 기질성 변비가 배제되면 원발성 혹은 일차성 변비로 진단할 수 있으며 원발성 변비는 대장통과시간과 항문직장 기능검사(anorectal function test) 등의 배변과 관련된 대장과 항문직장의 운동생리 검사를 통하여 크게 세 가지형으로 분류할 수 있다. 배변장애형 변비, 정상통과시간형 변비, 서행성 변비로 나눌 수 있는데 항문직장의 배변 기구가 정상적으로 작동하지 않는 배변장애형은 항문직장의 배변 기구가 정상적으로 작동하지 않는 형인 항문경(anismus)과 골반저 근실조(pelvic floor dyssynergia)로 불리는 연축형(spastic) 배변장애와 과도한 회음부 하강(descending perineum syndrome)으로 분류되는 비연축형(flaccid)이 있다. 대장 항문의 운동 생리 검사에서 이상소견이 없는 경우는 대장통과시간에 따라 정상 통과 시간형과 서행형 변비로 구분된다[2].
이러한 배변 병태생리학적인 분류에 따라 치료방침이 달라지며 이러한 분류에 의거하여 맞춤치료를 하면 대개 만족스러운 치료 효과를 본다[8]. 배변장애형 변비는 바이오피드백을 비롯한 행동요법으로 치료하게 되며 배변장애가 동반되지 않은 정상통과시간형 변비와 서행성 변비는 약물치료를 한다. 그렇지만, 특발성 만성 변비 환자를 치료하는 단계적 접근법은 아직 확립되어 있지 않아서 의료기관마다 진단과 치료적 접근법이 상이하며 일반적인 치료에 반응하지 않는 심한 난치성 변비는 여전히 존재한다. 본고에서는 만성 특발성 변비의 치료에 대하여 2011년에 대한소화기학회지에 발표된 변비 치료에 관한 임상진료지침[9]을 참고하여 비약물적 치료, 약물 치료, 행동요법과 수술적 요법으로 나누어 기술하고자 하며 최근에 개발된 새로운 약제에 대해서도 소개하고자 한다.
비약물적 치료
만성 변비환자가 처음으로 내원하게 되면 우선 기질적 원인을 배제한 다음 운동을 포함한 환자 교육, 식이 섬유의 섭취 등을 포함한 식이의 변화 등을 통하여 치료를 시도하게 된다.
환자 교육
일단 환자를 안심시키고 정상적인 배변습관에 관하여 간단하게 설명해 준다. 하제 등을 자가로 투약하여 온 환자에게는 과도한 사용을 자제시키고 수분과 식이 섬유의 섭취를 증가시킨다. 환자에게 아침 식사 후 규칙적으로 배변을 시도하도록 교육시킨다.
생활 양식의 변화
운동을 포함한 육체적 활동이 변비 환자의 일부에서 증상을 호전시킨다고 알려져 왔지만[10-12], 연구대상이나 운동 강도에 따라서 다양한 결과를 보이며[13] 운동이 위장관 운동에 미치는 영향에 대한 연구결과도 서로 상이하다[14-21].
우리나라의 임상진료지침에서는 “운동이 일부 변비 환자에서 증상을 호전시키는 데 도움을 줄 수 있다”고 제시하고 있다[9].
식이 섬유
식이 섬유는 대장에서 상재균에 의해 발효되며 상재균의 성장을 유발하여 변괴를 크게 하고, 대장내에서 물, 이온과 결합하여 변을 부드럽게 하고 부피를 크게 함으로써 배변의 횟수와 대변의 양을 증가시켜 변비를 개선시킨다. 변비증상을 완화시키기 위해서 하루에 약 20-25 g 정도의 식이 섬유를 섭취하도록 권장하고 있다[2]. 하지만 식이 섬유가 변비 치료에 분명한 도움을 준다는 증거는 많지 않다.
우리나라의 임상진료지침에서는 “식이 섬유는 대변의 양을 증가시키고 장의 통과시간을 단축시키는 데 도움을 줄 수 있다.”고 제시하고 있다[9]. 식이 섬유의 변비 치료에 대한 효과는 미미하지만 쉽게 시행할 수 있고 부작용이 적고 값이 저렴하므로 초기 치료로 시도해 볼 만하다.
약물 치료
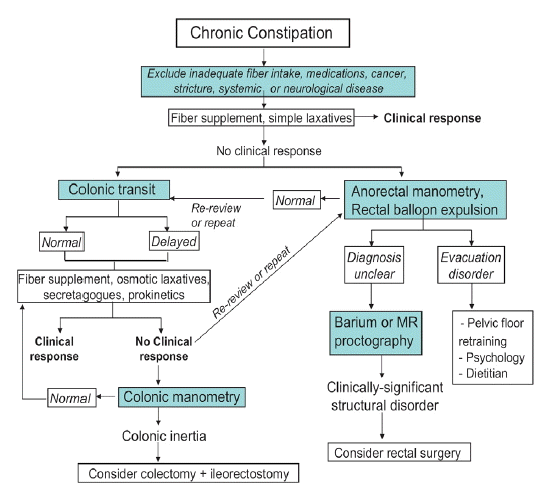
환자에 대한 교육, 생활양식의 변화와 식이 섬유 섭취의 증가 등에 호전되지 않으면 약물 치료를 시도하는데 약제 사용에 대한 표준화된 원칙은 없는 실정이다. 미국의 Mayo Clinic에서 최근에 제시한 알고리듬에 의하면 식이 섬유의 섭취를 증가시켜보고 변비의 증상이 개선되지 않으면 여러 가지 하제를 투여하게 된다. 이러한 치료에 반응이 없으면 대장통과시간, 항문직장 기능검사(anorectal function test)와 배변조영술을 시행하여 기능성 변비를 아형으로 분류하여 적절하게 치료하게 된다(Fig. 1) [8].
변비 치료에 이용되는 하제는 부피형성 하제, 삼투성 하제, 자극성 하제, 기타 하제 등으로 나눌 수 있으며 네 가지 작용기전이 있는데 각각의 약제는 한 가지 이상의 작용기전을 가진다(Table 1). 장관 내의 물과 결합하거나, 점막에서의 흡수와 분비를 변화시키거나, 세균총을 증가시키거나, 장점막을 자극하여 장운동을 증가시키는 등의 기전으로 나눌 수 있다. 하제 종류에 따른 치료 효과를 살펴보고자 한다.
부피형성 하제
부피형성 하제에는 차전자씨(psyllium, isphagula, plant seed), 해초, 한천(agar), 카라야(karaya, plant gums), 메틸셀룰로우스(methylcellulose) 유도체 및 폴리카보필(polycarbophil) 등이 있다. 부피형성 하제는 소장에서 흡수되지 않고 대장 세균에 의해서도 분해되지 않아 수분을 함유할 수 있다. 수분 유지에 의해 장관내 대변부피가 증가하면 대변량이 증가하고 대변이 부드러워져서 쉽게 배출된다. 하제의 일부는 장내세균에 의해 대사되어 이산화탄소나 수소와 같은 가스를 형성한다. 이로 인해 복부 팽만감이나 다량의 방귀를 유발한다. 충분한 양의 물과 함께 복용하는 것이 중요하며 장협착이나 장폐쇄 환자에서는 증상을 악화시킬 수 있으므로 투여해서는 안된다.
부피형성 하제들 간의 효과 차이에 대한 연구는 거의 없다. 변비 환자에서 psyllium은 위약[22-24]과 docusate [25]에 비하여 대변양을 증가시켰다. 또한 변비의 증상들인 복통, 배변시 힘주기, 배변통과 불완전배출감 등도 호전시켰다. 8주 이상 관찰한 연구는 없지만 임상 경험에 의하면 psyllium의 효과는 장기간 지속되는 것으로 보인다. 우리나라의 변비 혹은 변비우세형 과민성 장 증후군 환자에서 이루어진 개방형 연구에서 psyllium이 주성분인 아기오® 18 g을 매일 3주 동안 투여하였을 때 변비와 관련된 증상이 호전되고 대장통과시간도 단축되었다[26]. Psyllium을 제외한 메틸셀룰로우스와 폴리카보필에 대한 연구는 거의 없지만 임상 경험은 충분하여 효과적이면서 안전하게 투여할 수 있다고 알려져 있다. 다만 우리나라에서 시판되고 있는 부피형성 하제 중 일부는 센나(senna)와 같은 자극성 하제와 합성된 종류가 있으므로 이러한 약제는 장기 복용을 피하는 것이 좋다.
우리나라의 임상진료지침에서는 “부피형성 하제는 변비의 치료에 효과적이다.”라고 제시하고 있다[9]. 즉, 부피형성 하제는 장기간 투약하면서 관찰한 연구는 없지만 변비의 치료에 효과적이라고 말할 수 있다.
삼투성 하제
삼투성 하제는 삼투성의 활성 이온이나 분자로서 장관에서 흡수되지 않고 장관 내에서 수분을 저류시켜 배변을 용이하게 한다. 염류성 하제와 고삼투성 하제로 나눌 수 있다.
염류성 하제
염류성 하제에는 마그네슘 염과 나트륨 염이 있다. 마그네슘 염은 수산화 마그네슘, 구연산 마그네슘, 황산 마그네슘 등이 있고 나트륨 염으로는 인산 나트륨이 있다. 마그네슘 이온은 장에서 거의 흡수되지 않아서 수분의 저류효과로 장관내압이 증가하여 하제로 작용한다. 과량 복용 시 고마그네슘 혈증을 일으킬 수 있어 신기능 부전 환자와 소아에서는 주의하여 투여해야 한다. 성인의 일반적인 권장량은 수산화 마그네슘 2.4 g 내지 4.8 g이며 충분한 양의 물과 함께 복용해야 한다.
64명의 변비 환자에서 수산화 마그네슘 20 mL 투여군과 부피형성 하제와 sorbitol을 병합 투여한 군을 비교하였는데 수산화 마그네슘군이 병합 투여군에 비하여 배변횟수와 대변 굳기 정도가 더 나았다[27]. 우리나라에는 변비 환자를 대상으로 한 마그네슘 제제의 효과에 관한 연구는 없지만, 변비 환자에게 널리 사용되고 있는 실정이다. 최근에 대장내시경 검사의 전처치시 변비 환자에서 PEG (polyethylene glycol)에 수산화 마그네슘을 추가하여 PEG 단독 투여군보다 대장정결도가 더 나아졌다는 보고가 있다[28].
우리나라의 임상진료지침에서는 “마그네슘 제제는 변비의 치료에 효과적이다.” 라고 제시하고 있다[9].
고삼투성 하제
고삼투성 하제에는 락툴로우스(lactulose), 락티톨(lactitol), 솔비톨(sorbitol), 글리세린(glycerin), 폴리에틸렌 글리콜(polyethylene glycol, PEG) 등이 있다. 이들 하제는 식이 섬유나 부피 형성 하제에 반응이 없거나 이들을 잘 먹지 못하는 환자에게 투여할 수 있다.
PEG는 고삼투성 하제로서 장에서 흡수되지 않고 대장 내에서 높은 삼투압을 유지하여 체내로의 수분의 흡수가 일어나지 않아 액체 상태로 배변이 된다. 우리나라에는 PEG 3350 (마이락스)와 macrogel 4000 (폴락스,둘코락스 발란스) 등이 사용되고 있으며 콜로라이트산(colonlyte)과 코리트산은 폴리에틸렌 글리콜과 전해질의 복합성분으로 되어 있다.
500명 이상의 만성 변비환자를 대상으로 한 9개의 잘 계획된 연구에서 몇 가지 중요한 결과가 도출되었다[29-37]. 첫째, 매일 PEG를 투여하면 배변 횟수를 정상화시키고(number needed to treat, NNT = 2.4), 대변 굳기를 개선시킨다(NNT = 3.4). 둘째, 매일 PEG를 투여하면 다른 하제를 중단할 수 있고 (NNT = 3.1), 배변 시 힘주기를 감소시킨다(NNT = 3.2). 셋째, 6개월 동안 투여하여도 부작용이 없었다. 최근의 한 무작위 대조군 연구에서도 변비환자에서 PEG를 6개월 동안 투여하여도 심각한 부작용은 없었다[38]. 37명의 변비 환자에서 PEG와 락툴로우스의 효과를 비교한 무작위 대조군 시험에서 PEG가 락툴로우스에 비하여 배변횟수, 배변 시 힘주기, 부작용, 환자 만족도 등에서 유의하게 더 나았다. 또한 약제로 인하여 유발된 변비의 치료에도 안전하고 효과적이었다[39]. 우리나라 소아 변비 환자에서도 PEG를 6개월이상 투여하였을 때 심각한 부작용은 관찰되지 않았다[40].
우리나라의 임상진료지침에서는 “PEG (polyethylene glycol)는 변비의 치료에 효과적이다.”라고 제시하고 있다[9].
비흡수성다당류 하제는 고삼투성 하제로서 락툴로우스(lactulose), 락티톨(lactitol), 솔비톨(sorbitol), 글리세린(glycerine) 등이 있다. 락툴로우스는 갈락토스(galactose)와 프록토스(fructose)의 합성 이당체로서 소장에서 흡수되지 않고 대장내 세균에 의해 대사되어 삼투효과를 나타낸다.
락툴로우스는 갈락토스(galactose)와 프록토스(fructose)의 합성 이당제로 혈중으로 흡수되지 않아 전신 순환이 될 위험이 없어서 당뇨병 환자에서도 혈당을 높이지 않아서 당뇨병 환자의 변비 치료에도 이용될 수 있다. 성인에서 권장되는 용량은 시럽 15 mL씩 1일 2회 투여하고 필요에 따라 용량을 조절한다. 대장에서 가스를 형성하기 때문에 복부 팽만이나 방귀를 일으킬 수도 있고 맛이 너무 달아서 복용을 어려워하는 환자도 있다. 만성 변비 환자 150명에 대한 두 개의 무작위 대조군 시험[41,42]과 opiate와 연관되어 발생한 57명의 변비 환자에 대한 무작위 대조군 시험[43]에서 락툴로우스는 배변 횟수의 정상화와 대변 굳기의 호전을 보였다. 124명의 변비 환자에서 psyllium과 락툴로우스를 3주이상 투여하면서 효과와 부작용을 비교하였다. 변비 치료의 효과는 두 약제 간에 차이는 없었으나 락툴로우스가 psyllium에 비하여 더 맛이 좋아서 순응도를 높일 수 있다는 장점이 있다[44].
자극성 하제
자극성하제로는 디하이드로콜린산(dehydrocholic acid), 피마자기름(castor oil)과 같은 계면 활성제(surfactant laxative)와 센나(senna)나 카스카라(cascara)와 같은 안트라퀴논(anthraquinone) 제제, 페놀프탈레인(phenolphthalein)이나 비사코딜(bisacodyl)과 같은 폴리페놀(polyphenol) 등이 있다. 자극성하제의 작용 기전은 정확하게 알려져 있지 않지만 대장 내에서 수분 및 전해질의 흡수를 억제하고 대장의 근육신경총을 자극하여 축적하여 장운동을 촉진하는 것으로 알려져 있다.
일반적인 하제에 반응이 없는 변비 환자에게 단기간 동안 간헐적으로 자극성 하제를 투여해 볼 수 있다[45]. 대체적으로 자극성 하제는 위약에 비하여 더 효과적이다[46]. 하제에 대한 무작위 대조군 시험은 없으며 이전의 규모가 작고 환자군을 대상으로 한 증례 중심의 연구들이 있다[47-58]. 증거는 명확하지 않지만 전해질 불균형, 복통, 오심, 팽만감 등의 부작용이 발생할 수 있다. 비사코딜은 만성 변비 환자에서 장정결(bowel preparation) 시 일시적으로 사용한다는 보고[59,60] 이외에 변비 치료에 대한 몇몇 보고가 있다. 비사코딜은 위약에 비해 급성 변비 치료에 있어서 배변 횟수와 변 굳기에서 호전을 보이며 부작용은 유사한 정도로 보고되었고[61], 주로 상행결장의 장운동을 촉진시켜 효과를 나타내는 것으로 보고하고 있다[62].
Sodium picosulfate 또한 triarylmethane 계열로 비사코딜과 유사하게 작용한다. 액상형태로 복용하면 대장세균총에 의해 가수분해되어 복용 4-6시간 후에 작용을 나타낸다. 만성변비 환자에서 4주간 투약한 경우, 위약에 비해 배변 횟수와 삶의 질을 향상시켰다[63]. 변비 환자를 대상으로 비사코딜과 sodium picosulfate를 4주간 투약하면서 효과를 비교한 연구에서 두 약제는 동등한 효과를 나타냈다[64].
우리나라에는 변비 환자를 대상으로 한 자극성 하제의 효과에 관한 연구는 없지만, 일부 변비 환자에서 사용되고 있는 실정이다. 우리나라에서 사용되는 하제는 대부분 복합성분이어서 단기간 사용되어야 함에도 불구하고 약국 등에서 쉽게 구입하여 장기간 사용하고 있어서 문제가 될 수 있다. 우리나라의 임상진료지침에서는 “자극성 하제는 일부 변비 환자의 치료에 도움을 준다.”라고 제시하고 있다[9].
대변연화제
대변연화제에는 docusate, 디하이드로콜린산(dehydrocholic acid) 피마자기름(caster oil) 등이 있다. Docusate는 표면 장력을 줄여서 대변을 부드럽게 하고 소장과 대장에서 수분 흡수를 증가시켜 장내 액체에 의해 대변종괴를 이동시킨다.
15명의 노인성 변비 환자에서 docusate는 위약에 비하여 대변의 양을 더 증가시켰다[65]. 그렇지만 변비 환자와 정상인을 대상으로 한 다른 연구에서는 그런 효과는 없었다[66-68]. 또한 docusate는 psyllium과의 비교 연구에서 변비를 개선시키는 유의한 효과가 있었지만 psyllium보다 효과가 적었다[69].
변비 환자를 대상으로 한 대변연화제의 효과에 관한 연구는 우리나라에는 아직 없지만, 임상적으로 널리 사용되고 있는 실정이다. 우리나라의 임상진료지침에서는 “대변연화제(docusate)는 변비의 치료에 도움을 준다.”라고 제시하고 있다[9].
기타 하제
최근에 개발되어 임상에 도입되고 있는 약제들을 소개하고자 한다. 세로토닌 4형 수용체 작동체, 선택적 type-2 chloride channel (CIC-2) 자극제, guanylate cyclase C 작용제와 말초성 아편유사물질대항제 등이 있으며 아직 우리나라에 도입되지 않은 약제가 대부분이다.
Tegaserod
Tegaserod는 5-HT4 수용체에 선택적으로 작용하는 부분작용제로 소장에서 통과시간을 단축시키고 장관 분비를 증가시키며 내장 구심신경의 반응을 억제시킨다[70]. 이 약제는 변비형 과민성 장증후군을 보이는 여자 환자와 만성 변비 환자의 치료에 효과적이다[71,72]. 최근 우리나라에서도 변비형 과민성 장증후군을 보이는 81명의 여자 환자를 대상으로 4주간 tegaserod를 6 mg 하루 2회 복용하게 한 후 복용 전후 환자의 증상과 삶의 질의 변화를 비교하였는데 복부 불편감, 대변 굳기, 배변 시 힘주기, 불완전 배출감, 복부 팽만감 등의 증상 점수의 전반적인 호전을 가져왔고, 삶의 질 또한 향상되었다[73]. 842명의 만성 변비 환자를 대상으로 13개월 동안 tegaserod 복용을 관찰한 연구에서 약물로 인한 부작용은 복통, 설사와 두통이었으며, 심각한 부작용은 보고되지 않아 장기간 투여해도 안전한 약물이라고 보고되었으나[74], 11,614명의 복용 환자 중 13명에서 허혈성 심장 혈관 질환의 발생이 보고되면서 2007년 3월 이후 사용이 중단되어 우리나라에서 변비 치료제로 상용화되고 있지 않다. 최근 미국에서 보고된 6개월 관찰 연구는 52,229명의 tegaserod 복용군과 52,229명의 대조군 사이에 허혈성 심장 질환과 허혈성 뇌질환 발생위험에 차이가 없었다고 보고하였다[75].
Prucalopride
Prucalopride는 선택적으로 강력하게 5-HT4 수용체에 작용하는 작용제로 장운동을 증가시켜 만성 변비에 치료 효과를 보인다. 620명의 심한 만성 변비 환자에게 12주 동안 prucalopride 2 mg, 4 mg을 각각 투여한 군과 대조군을 비교하였는데 약제 투여군에서 대조군에 비해 주당 1회 이상의 완전 자발적 장 운동의 빈도가 유의하게 증가하였다[76]. 다른 연구에서도, 713명의 만성 변비 환자에게 prucalopride 2 mg과 4 mg을 복용한 경우, 주당 3회 이상의 완전 자발적 장 운동을 보인 빈도, 완전 배변감, 질병의 심각성 및 삶의 질이 호전되었다[77]. Quigley 등[78]도 prucalopride를 투여한 경우 대조군에 비해 환자의 만족도, 변비의 중증도 및 삶의 질이 호전되고 배변 횟수의 증가를 보여 만성 변비 치료에 효과적이라고 보고하였다. 가장 흔하게 보고되고 있는 부작용은 두통과 복통이며, 심혈관계 부작용은 보고되지 않았다. 또한, Camilleri 등[79]은 고령 환자를 대상으로 4주간 prucalopride 2 mg을 투여한 경우에도 활력 징후, QT 기간을 포함한 심전도의 변화가 없어 고령 환자의 변비 치료에 안전한 약제라고 보고하고 있다. 이러한 연구 결과들은 만성 변비 환자의 치료에 prucalopride를 안전하고 효과적으로 사용할 수 있음을 제시해 주고 있다. 현재 국내에서 사용할 수 없지만 조만간 도입되길 기대한다.
기타 enterokinetic 제제들
최근 5-HT4 수용체에 매우 선택적으로 작용하여 심장 부작용을 최소화하려는 여러 약제가 연구 단계에 있으며, ATI-7505 [80]와 Velusetrag (TD-5108) [81] 등이 대표적이다. ATI-7505은 cisapride와 유사하게 5-HT4 수용체에 작용하지만, 심장 부작용이 없고, cytochrome p 450에 의해 대사되지 않는다. 건강 자원자를 대상으로 9일 동안 ATI-7505를 각각 3, 10, 20 mg을 1일 3회로 복용한 연구에서 투약군에서 대조군에 비해 장 통과시간이 단축되었고, 특히 10 mg 복용군에서 상행 결장에서의 이동이 향상되었으며, 10 mg 복용군과 20 mg 복용군에서 대변의 굳기가 호전되었다[80]. 최근 연구에서 건강지원자와 만성 변비 환자에서 Velusetrag 1회 투여 후 장 통과시간이 빨라지는 결과를 보여 대장 운동 촉진제로서의 가능성이 제시되었다[81].
우리나라에서는 변비 환자에서 cisapride가 효과적이라는 보고가 있었으나[82], 현재 우리나라 변비 환자에서 5-HT4 수용체 작용제로 사용할 수 있는 약제는 없는 실정이다. 부작용이 적은 안전한 새로운 약제들이 개발되어 임상에 도입되고 있어서 향후 우리나라 변비 환자에서도 널리 사용될 것으로 예상된다. 우리나라의 임상진료지침에서는 “세로토닌 4형 수용체 작동제는 변비의 치료에 도움을 준다.”라고 제시하고 있다[9].
선택적 type-2 chloride channel (CIC-2) 자극제
Lubiprostone
Lubiprostone은 만성 변비 환자의 치료에 있어서 가장 최근에 FDA 승인을 받은 약제로 장상피 세포의 선택적 type 2 chloride channel (CIC-2) 자극제로 작용하여 장관 분비를 증가시켜 변비 증상을 호전시킨다[83]. 129명의 만성 변비 환자를 대상으로 3주간 lubiprostone을 각각 하루에 24, 48, 72 μg씩 복용하는 군과 위약을 복용하는 대조군으로 나누어 비교한 결과, 대조군에 비해 lubiprostone을 복용한 모든 군에서 자발적 장 운동 횟수가 의미있게 증가하였으며, 복용량이 증가함에 따라 점차적으로 증가하는 결과를 보였다[83]. Lubiprostone의 가장 흔한 부작용은 오심(31.7%)이었으며, 약 5%의 환자에서는 오심으로 인하여 약물 복용을 중단하였다. 다른 연구들에서도 lubiprostone 24 μg을 1일 2회 복용한 군에서 대조군에 비해 24시간 내에 자발적 장 운동을 보인 빈도가 증가하였고, 복용 1주일째 자발적 장 운동 횟수가 증가하였으며, 효과는 4주까지 지속되었다[84,85]. Lubiprostone의 가장 흔한 부작용은 오심(31.7%)이었으며, 약 5%의 환자에서는 오심으로 인하여 약물 복용을 중단하였다[84]. Lubiprostone은 복용 첫날부터 장 운동을 증가시키고, 전반적인 변비 증상을 호전시키며, 복용 중 지속적인 효과가 유지되어 만성 변비 치료에 효과적인 약제로 보고되고 있다. 향후 우리나라에도 도입되어 난치성 변비 환자의 치료에 도움을 줄 것으로 기대한다.
Guanylate cyclase C 작용제
Linaclotide
Linaclotide (MD-1100)는 guanylate cyclase C 작용제로 장상피세포의 guanylate cyclase-C 수용체와 결합하여 cyclic guanosine monophosphate를 증가시키고, 장관내로 chloride와 bicarbonate 분비를 증가시킨다. Linaclotide는 만성 변비 환자에서 4주간 투여하였을 때 용량 의존적으로 장 운동과 임상 증상의 호전을 보였다[86,87]. 최근 310명의 만성 변비 환자를 대상으로 4주 동안 linaclotide 75, 150, 300, 600 μg을 1일 1회 복용한 군과 위약을 복용한 대조군으로 구분하여 용량에 따른 효과 및 안정성을 보고하였다[87]. Linaclotide를 복용한 모든 군에서 대조군에 비해 주당 자발적 장 운동 횟수가 의미있게 증가하였으며 복용 24시간 이내에 75 μg을 복용한 경우를 제외한 모든 linaclotide 복용군에서 대조군에 비해 자발적 장 운동을 보이는 빈도가 유의하게 더 많았다. 또한, linaclotide 복용군에서 완전 자발적 장 운동의 증가와 대변 굳기, 과도한 힘주기, 복부 불편감, 더부룩함과 삶의 질의 호전을 가져왔다. 가장 흔한 부작용은 설사였으나, 빈도가 낮았고 고용량을 투여한 경우에 주로 나타났다. 아직 우리나라에 도입되지 않았지만 변비 환자에서 안전하고 효과적으로 투여할 수 있는 약제이다.
말초성 아편유사물질대항제
아편유사제(opioids)는 위배출을 지연시키고, 장의 연동운동을 감소시켜 장 운동을 느리게 하므로 만성적으로 아편유사제를 복용하는 경우 흔히 변비를 호소하게 된다. 수술 후에 흔히 볼 수 있는 장마비의 경우도 수술 전 후 여러 복합적인 요인과 더불어 통증 조절을 위해 사용하는 아편유사제에 의해 발생하거나 악화될 수 있다. 이러한 이유로 아편유사제를 복용하는 환자에게 발생한 변비를 치료하기 위해 아편유사물질대항제를 이용한 연구가 이루어졌다. 이상적인 약제는 장에 국소적으로 작용하여 변비와 관련된 증상을 호전시키면서 혈액-뇌 장벽을 통과하지 않아 아편유사제의 진통 효과를 유지할 수 있어야 한다. Alvimopan과 methylnaltrexone는 말초 μ-아편유사물질수용체(peripheral μ-opioid receptor)에 선택적으로 작용하는 대항제로서 이러한 선택적 효과가 입증되어 2008년 FDA 공인을 받았으며, 현재 활발히 연구되고 있다.
Alvimopan
Alvimopan는 말초-아편유사물질수용체에 선택적으로 작용함으로써 아편유사제로 유발된 더부룩함, 복부 불편감과 배변 횟수의 감소 등의 부작용을 호전시키면서 진통효과에는 영향을 주지 않는 약제로, 아편유사제와 관련된 변비와 급성 수술 후 장마비의 치료에 효과적이다[88-93]. 아편유사제로 인한 장기능 이상(opioid-induced bowel dysfunction, OBD)을 보이는 168명의 환자에게 21일 동안 alvimopan 1 mg, 0.5 mg 혹은 위약을 투여하여 효과를 비교하였는데 약물 투여 8시간 이내에 장 운동을 보이는 빈도는 각각 54.3%, 43%로, 대조군 29%에 비해 유의하게 더 많았다. 첫 장 운동까지 소요된 평균 시간은 alvimopan 1 mg 투여군에서 3시간으로 대조군 21시간에 비해 유의하게 짧았고 환자의 전반적인 만족도도 높았다[88]. Webster 등[89]은 OBD환자 522명을 대상으로 치료 용량에 대한 연구를 보고하였으며, 각각 alvimopan 0.5 mg 1일 2회, 1 mg 1일 1회, 1 mg 1일 2회 투여군과 위약을 투여한 대조군으로 나누어 6주간 복용한 결과, alvimopan 0.5 mg 1일 2회로 복용한 군이 대조군과 유사한 정도의 부작용을 보이면서 자발적 장 운동을 증가시키고, 과도한 힘주기, 대변 굳기, 불완전 배변감과 복부 불편감 등 전반적인 증상의 호전을 보여, OBD 치료에 가장 적절한 용량이라고 제시하였다. Alvimopan는 복부 수술 후 발생할 수 있는 수술 후 마비 치료에도 효과적으로 작용하며[90,91], 특히 환자 조절 정맥내 진통 장치(intravenous patient-controlled analgesia, PCA)를 사용하는 경우에 효과적이다[92]. Alvimopan의 가장 흔한 부작용은 오심, 구토 및 변비 등인데 그 빈도가 대조군과 유사하게 나타나서 아편유사제로 인한 장기능 이상 및 수술 후 마비 환자의 위장관 기능 회복에 효과적인 약제로 보고되고 있다[89,93].
Methylnaltrexone
Methylnaltrexone은 naltrexone으로부터 유래된약물로 장 근육세포에 국소적으로 작용하여 아편유사물질수용체를 막아 장의 기능을 정상화시키면서도 아편유사제의 진통 효과를 유지한다. 하제 복용에도 호전되지 않는 133명의 OBD 환자를 대상으로 2주 동안 methylnaltexone을 0.15 mg/kg로 2일에 1회 피하 주사하였더니 위약 대조군에 비해 첫 용량 투여 후 4시간 이내에 배변을 보인 빈도가 유의하게 더 많았고, 첫 용량 투여 후 배변까지 소요된 시간도 대조군에서 48시간 이상 소요된 것에 비해 평균 6.3시간으로 빠른 효과를 보여 주었다[94]. Portenoy 등[95]의 연구에 의하면, OBD 환자의 변비 치료에는 2일에 1회 최소 methylnaltrexone 5 mg 이상을 피하 주사하는 것이 효과적이며, 이 용량은 진통 효과의 감소를 초래하거나 아편유사제의 금단 증상을 유발하지 않았다. 최근 다른 연구들에서도 methylnaltrexone 0.15 mg/kg로 2일 1회 피하 주사하는 것이 아편유사제로 인한 변비 치료에 효과적이었다[96,97].
Neutrotrophins
Neutrotrophin-3는 신경세포의 생존과 분화를 조절하여 신경 조직체계를 관리한다. 제2상, 무작위, 이중맹검, 위약-대조군 연구에서 neutrotrophin-3를 피하주사 치료받은 기능성 변비 환자에서 배변 횟수, 완전 자발적 장 운동 및 대변 굳기가 호전되었다[98]. 그러나 약 30% 환자에서 주사 부위에 통증이 유발되었다.
행동 요법
바이오피드백은 전기 혹은 기계적 장치를 이용하여 생체내 반응을 인식하게 하는 교육 전략이다[99]. 만성 변비 환자에서 바이오피드백 치료는 배변 시 골반저 횡문근을 이완하게 훈련하고 소량의 대변에 의한 직장 팽창을 인식할 수 있게 하며 복압을 효과적으로 상승할 수 있도록 환자를 교육하는 것이다.
외과적 치료
천수 신경 자극(sacral nerve stimulation, SNS)
1980년대 초에 신경인성변비 환자에서 척수[111]와 천수 신경근[112]에 대한 전기 자극이 처음 시도되었다. 방광기능이상이나 변실금 환자에서 영구적으로 척수신경자극을 주었을 때 배변 횟수의 증가와 변비증상의 완화를 관찰하여 천수 신경 자극을 변비치료의 한 방법으로 시도하게 되었다[113]. 일반적인 치료에 반응하지 않는 변비 환자에서 척수 신경 자극 치료에 대한 소규모의 여러 연구들이 시행되었으나 치료 성적은 아주 다양하였다[112,114-121]. 아직까지 작용기전이 명확하게 밝혀진 것은 아니지만 일반적인 치료에 불응인 난치성 변비 환자에서 새로운 비침습적 치료법으로 시도해 볼 만하다.
결 론
변비는 비교적 흔한 질환이며 특히 노인과 여성에서 더 흔하다. 변비를 일으키는 뚜렷한 원인이 있는 이차성 변비는 그 원인에 대한 치료를 시행하게 되지만 원인이 불분명한 경우는 변비 증상의 완화를 위하여 여러 가지 방법으로 치료하게 된다. 우선 생활 습관의 변화나 고섬유소 식이 및 운동 등의 보존적 요법을 먼저 시도해 보고 이에 반응이 없는 경우에 약물치료를 시도하게 된다. 변비에 사용되는 하제는 여러 가지 종류가 있으며 작용기전도 서로 중첩되어 있기도 하다. 약제 투여에 대한 명확한 지침은 아직 없는 실정이며 임상의들은 경험적으로 단일 혹은 병용 처방을 하게 된다. 비약물적 치료와 약물치료에 반응이 없는 변비에 대해서는 대장 및 항문직장의 기능검사를 시행하여 아형으로 분류하여 적절하게 치료한다. 골반저기능부전이 동반된 변비 환자에서는 바이오피드백 요법이 도움이 된다. 이러한 치료에 반응이 없는 난치성 변비에 대하여 외과적 치료를 고려한다. 변비 치료로서 새로운 약제와 외과적 치료 방법들이 다각도로 연구가 활발히 이루어지고 있으며 일선 임상에서 더욱 더 효과적으로 변비 치료에 이용될 수 있기를 기대한다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






