 |
 |
| Korean J Med > Volume 79(6); 2010 > Article |
|
요약
저자들은 유전자 검사로 확진된 유전성 항트롬빈 결핍증을 가진 39세 남자 환자에서 만성 폐혈전색전성 폐동맥고혈압이 발생하여 혈전내막제거술을 시행한 증례를 국내 최초로 보고하는 바이다. 환자는 내원 시 NYHA class III의 심한 호흡곤란을 보였다. 검사 결과 환자는 폐혈전색전증 및 우심실 부전을 동반한 심한 폐동맥 고혈압을 가진 것으로 진단되었다. 유전자 검사로 SERPINC1 유전자에 새로운 돌연변이가 있는 것이 확인되었다. 환자는 하대정맥 필터 삽입과 폐동맥 혈전내막제거술을 받았다. 이후 1년의 경과관찰 동안 환자는 NYHA class I의 상태를 유지하였고, 우심실 기능의 정상화를 보여주었다.
Abstract
Presented is a case study of a 39-year-old man with chronic thromboembolic pulmonary hypertension (CTEPH) and an underlying antithrombin III (AT III) deficiency. The subject presented with severe dyspnea (NYHA functional class III). A diagnostic workup led to a diagnosis of pulmonary thromboembolism and severe pulmonary hypertension with right ventricular failure. Genetic analysis revealed a novel nonsense mutation (c.243G>A) in SERPINC1. Pulmonary thromboendarterectomy was performed following the insertion of an inferior vena cava filter. After one year, the subject remained in NYHA functional class I and exhibited normal right ventricular function. This is the first report of a genetically confirmed AT III deficiency complicated by CTEPH in Korea. (Korean J Med 79:691-696, 2010)
만성 폐혈전색전성 폐동맥고혈압(chronic thromboembolic pulmonary hypertension, CTEPH)은 급성 폐혈전색전증 발생의 약 0.1~0.5%에서 발생하는 드문 합병증이다. 폐동맥고혈압이 심할 경우 호흡곤란 및 우심실부전 등의 증상과 함께 사망에 이를 수 있으나, 폐동맥 혈전내막제거술(pulmonary thromboendarterectomy)이 조기에 성공적으로 이루어질 경우 치료가 가능한 질환이다1,2). 한편, 유전성 항트롬빈(antithrombin III) 결핍증은 유전성 혈전증의 하나로서 상염색체 우성으로 유전된다. 유전성 혈전증은 다른 원인으로 설명이 되지 않는 45세 미만의 비교적 젊은 연령에서 발생한 혈전증이나, 혈전증의 가족력이 있는 경우, 혈전증이 재발하는 경우 의심할 수 있다3). 유전성 혈전증에 의한 심부정맥 혈전증(deep vein thrombosis)과 폐혈전색전증(pulmonary thromboembolism)이 다른 원인에 의한 혈전증과 임상양상과 예후가 다른지는 잘 알려져 있지 않으며, 유전성 혈전증을 가진 환자에서 발생한 CTEPH에 대하여는 외국에서 소수의 예가 보고되어 있으며, 국내에는 보고된 바가 없다.
저자들은 유전성 항트롬빈 결핍증을 가진 39세 남자 환자에서 CTEPH가 발생하여 혈전내막제거술로 치료한 예를 경험하여 이에 보고하는 바이다.
환 자: 남자, 39세
주 소: 6개월 전부터 시작된 운동시 호흡곤란
과거력 및 현병력: 환자는 2년 전 우측 하지 부종으로 심부정맥 혈전증을 진단받고 와파린을 복용하다가 임의로 중단한 병력이 있었다. 6개월 전 환자는 운동시 호흡곤란 증세가 발생하여 타병원에 내원하여 중증의 폐혈전색전증 및 우심실의 혈전증을 진단받고 혈전용해제 치료를 받았으며, 이후 와파린을 복용하고 있었다. 환자는 이후에도 점차 악화되는 운동시 호흡곤란(NYHA functional class III)에 대하여 본원 순환기 내과 외래 진료 후 입원하였다.
가족력: 형이 38세에 하지의 심부정맥 혈전증을 진단받았고, 그 외 다른 가족에서는 심부정맥 혈전증, 폐혈전색전증을 포함한 혈전증에 대한 가족력은 없었다.
신체검사 소견: 내원 당시 혈압 121/86 mmHg, 맥박 분당 100회, 체온 36°C였고, 급성 병색없이 의식은 명료하였다. 환자에서 경미한 청색증이 관찰되었고, 청진시 P2 음의 항진과 함께 경한 수축기 심잡음 및 우측 폐의 호흡음 감소 소견이 보였다. 폐 청진시 CTEPH에서 특징적으로 관찰될 수 있는 잡음(flow murmurs)은 들리지 않았다. 양하지에서 중등도의 오목부종이 있었다. 6분 걷기 검사(6 minute walk test)에서 400 m 결과를 보였다.
검사 소견: 내원 당시 말초혈액 검사에서 혈색소 17.8 g/dL, 백혈구 6,000/μL, 혈소판 133,000/μL로 경한 혈색소 증가 소견이 보였다. 동맥혈가스 검사에서는 pH 7.436, PaO2 62.1 mmHg, PaCO2 28.7 mmHg, HCO3- 18.9 mEq/L, 산소포화도 92.5%로 저산소혈증과 저이산화탄소혈증을 보였다. 혈액화학 검사에서 총 빌리루빈 1.7 mg/dL, 알부민 3.4 g/dL, AST 51 U/L, ALT 39 U/L, BUN 19.5 mg/L, Creatinine 1.23 mg/dL, 요산 11.6 mg/dL 소견이 보였고, 전해질 이상은 없었다. NT-proBNP 수치가 1,778 pg/mL로 크게 증가되어 있었다. 와파린 복용 중 시행한 혈액응고 검사에서 PT INR은 3.27로 증가되었으며, 와파린 효과에 의하여 2차적으로 C-단백 활성도의 감소, S-단백 항원 감소, lupus anticoagulation 상승의 소견을 보였다. 혈중 농도가 와 파린의 영향을 받지 않는 항트롬빈 활성도(Antithrombin III activity)가 28%로 현저히 감소되어 항트롬빈 결핍증이 강력히 의심되었다(표 1). 유전자 검사를 통하여 항트롬빈 단백의 유전자인 SERPINC1 유전자의 두 번째 엑손에서 c.243G>A 변이를 발견하여 유전성 항트롬빈 결핍증을 확진할 수 있었다. 이는 항트롬빈 단백질(1st Met을 +1로 하여)의 81번째 아미노산인 tryptophan이 stop codon으로 바뀌는 heterozygous nonsense mutation으로 기존에 보고되지 않은 새로운 돌연변이이다.
단순방사선 및 심전도 소견: 흉부단순방사선 검사에서 심장비대 및 우측 폐의 섬유성변화와 우측 늑골횡경막각의 둔화를 볼 수 있었다(그림 1A). 심전도상 동율동으로 우측 편위와 양심방의 확장, 우심실 비대 소견이 관찰되었다(그림 2A).
심장 및 폐의 영상검사 소견: 경흉부심초음파 검사에서는 정상 좌심실박출계수(68%), 심한 우심실 수축력 저하, 우심방과 우심실의 확장, 높은 폐동맥 수축기압(109 mmHg), 중등도 삼천판 역류 및 소량의 심낭삼출액이 관찰되었다(그림 3A). 폐관류 스캔 검사에서 우측 상엽과 중엽에 걸친 심한 관류 결손이 보였다(그림 4A). 흉부컴퓨터단층촬영에서 우측 상엽 폐동맥의 완전 소실, 좌측 상엽과 하엽 폐동맥의 부분 폐색, 폐 실질의 비균질적 음영과 기관지 동맥의 비대를 관찰할 수 있었다(그림 5A). 심혈관도자술에서 폐동맥 혈압 115/43 mmHg, 평균 폐동맥압 68 mmHg, 폐동맥쐐기압 6 mmHg, 폐혈관 저항 36.7 Wood unit로 측정되었으며, 폐동맥 조영술에서 우측 상엽과 중엽의 폐동맥의 완전 폐색 및 좌측 하엽 폐동맥 분지를 포함한 여러 폐동맥 분지의 폐색이 관찰되었다(그림 5B). 하지 초음파촬영에서 양하지의 근위와 원위 정맥들에서 심부정맥 혈전증을 볼 수 있었다.
치료 및 임상경과: 환자는 입원 후 이뇨제와 항응고제의 약물 치료를 받으면서 검사를 하였고, 입원 7일째 하대정맥필터 삽입술을 받았다. 이후 흉부 외과로 전과되어 폐동맥 혈전내막제거술을 하였다. 수술 소견으로 좌측 폐동맥에 혈전이 보였고, 좌상엽과 좌하엽 폐동맥이 기질화혈전에 의해 좁아졌으며, 우측 폐동맥은 기질화혈전에 의해 우상엽 폐동맥이 완전히 막혀 있었다. 구역 동맥(segmental artery) 입구까지 내막을 박리하여 제거하였다. 또한 수술장에서 삼첨판륜의 확장과 삼첨판 역류를 확인하고, 삼첨판륜성형술을 함께 시행하였다. 수술 7일 후 시행한 심장초음파 검사에서 폐동맥 수축기압 35 mmHg로 호전되었다. 환자는 수술 후 호흡곤란이 크게 완화된 상태로 수술 10일째 퇴원하였고, 와파린 복용을 지속하면서 1년째 외래 경과관찰 중이다.
1년째 외래에서 시행한 6분 걷기 검사는 491 m로 증가되었고, 동맥혈가스 검사에서는 pH 7.396, PaO2 90.7 mmHg, PaCO2 38.0 mmHg, HCO3- 22.8 mEq/L, 산소포화도 97.6%로 저산소증이 소실되었으며, 혈중 NT-proBNP 수치는 수술 후 지속적으로 감소하여 1년째는 89.7 pg/mL로 측정되었다. 또한 흉부 단순방사선검사에서 심장비대의 호전과 심전도에서 우심실 비대의 소견이 정상화되었고(그림 1B, 2B), 심장초음파 검사에서 우심실 부전과 확장의 정상화, 폐동맥고혈압 소실 그리고 삼첨판 역류의 소실이 관찰되었다(그림 3B). 폐관류 스캔 검사에서 우측 상엽과 중엽에 걸친 관류 결손이 크게 호전 되었다(그림 4B).
CTEPH는 서서히 진행하여 우심실 기능부전으로 발전하여 사망에 이르는 질환이다. 색전증이 심한 경우 내과적인 치료만으로는 예후가 매우 불량하여 진단시 평균폐동맥고혈압이 30 mmHg 이상인 경우 평균 5년 생존율은 30%, 50 mmHg 이상인 경우는 10%로 보고되어 있다4). 본 환자의 심도자술상 평균폐동맥고혈압은 68 mmHg이었으며, NYHA functional class 3의 호흡곤란과 우심실부전 증상이 있어 예후는 매우 불량하였을 것으로 생각되었다. CTEPH 환자에서 색전이 근위부에 있는 경우 혈전내막제거술이 가능하고 수술이 성공적으로 이루어질 경우 CTEPH의 치료가 가능하므로, CTEPH의 정확한 진단과 수술 적응증을 판단하여 혈전내막제거술을 시행하는 것이 중요하다. 국내에서도 임 등은 CTEPH의 치료로서 혈전내막제거술을 시행한 후 임상적 경과를 보고한 논문에서 이 질환의 진단시에 적극적 수술적 치료가 시행되어야 한다는 결론을 보고하였다5).
본 증례의 환자는 CTEPH의 기저 질환으로 유전성 항트롬빈 결핍증이 유전자 검사에 의하여 확진되었다. 유전성 항트롬빈 결핍증은 유전성 혈전증의 하나이다. CTEPH 환자에서 유전성 혈전증인 항트롬빈 결핍증, C-단백 결핍증, S-단백 결핍증은 전체 혈전내막제거술 받은 환자의 약 5% 정도로 보고되고 있다6). 일본에서는 Takahashi 등이 항트롬빈 결핍증 환자에서 발생한 폐혈전색전증을 수술적 치료를 시행한 예를 보고한 적이 있으나, 본 증례와 달리 환자는 급성 폐혈전색전증 상태로 혈전색전제거술(thromboembolectomy)을 받고 호전된 경우였다7). 또한 Laczika 등은 유전성 항트롬빈 결핍증 및 프로트롬빈 G20210A 변이를 동시에 가지는 환자에서 발생한 편측 CTEPH를 혈전내막제거술로 치료한 증례를 보고한 바 있다8).
서양인에서 가장 흔한 유전성 혈전증인 factor V Leiden 결핍이나, 프로트롬빈 돌연변이는 국내에는 없거나 극소수인 것으로 알려져 있어 한국인의 심부정맥 혈전증이나, 급성 폐혈전색전증, CTEPH 환자에서 유전성 혈전증의 빈도는 서양인과 다를 것으로 예측된다. 국내에서는 항트롬빈 결핍증 환자에서 일반적인 정맥혈전색전증의 발현 형태인 하지 심부정맥 혈전증이나 폐혈전색전증이 아닌 경질막정맥동 혈전증, 창자간막 혈전증이나 심근경색으로 발현한 혈전증에 대한 보고들이 있었다9-11). 그러나 유전성 항트롬빈 결핍증 환자에서 발생한 CTEPH의 예는 국내에서 보고된 바 없다.
CTEPH는 급성 폐혈전색전증 환자의 약 0.1 내지 0.5%에서 발생하는 매우 드문 합병증이다. 급성 폐색전혈전증 후 CTEPH로 진행하는 위험 요인으로는 선행하는 폐색전혈전증 병력, 젊은 연령, 큰 관류 결손, 특발성 폐색전혈전증, 만성 염증성 질환 등 여러 요인이 보고되어 있다2,12). 이들 환자에서 폐혈전색전이 녹지 않고 남아 CTEPH로 이환되는지에 대해서는 잘 알려져 있지 않으나, 혈전성향이 증가된 경우 그 위험성이 더 높을 것으로 예측된다. CTEPH 환자의 30%에서 lupus anticoagulant가 양성임이 보고된 바 있다. 유전성 혈전증이 정맥 혈전증의 위험 요인으로는 잘 알려져 있지만, 이들에서 발생한 급성 폐혈전색전증의 경우 CTEPH으로의 진행이 더 흔하다는 증거는 부족하다12). 그러나 유전성 혈전증 환자에서 증상을 동반한 폐혈전색전증의 발생은 항트롬빈 결핍증의 경우 2.4배 증가하며, 프로트롬빈 돌연변이의 경우 1.5배 증가하고, factor V Leiden 결핍시에는 오히려 0.7배로 감소함이 보고되어 있다13). 본 증례의 경우에도 동반된 항트롬빈 결핍증이 급성 폐혈전색전증 발생 후 항응고 치료에도 불구하고 혈전이 녹지 않고 CTEPH로 진행된 중요 요인일 것으로 사료된다. 유전성 혈전증 환자에서 정맥혈전색전증이 더 흔히 발생하고, 재발이 흔하다는 기존 연구결과를 고려하면 이들에서 발생한 CTEPH는 유전성 혈전증이 없는 환자에서 발생한 CTEPH보다 예후가 나쁠 것으로 예상할 수 있다. 따라서 유전성 혈전증 환자에서 발생한 폐혈전색전증의 경우 초기 혈전용해요법, 와파린 치료시 더 높은 목표 INR 수치, CTEPH로 이환시 조기 수술과 같은 적극적인 치료가 필요한지에 대하여 전향적인 연구가 필요한 바이다.
REFERENCES
1. Auger WR, Kim NH, Kerr KM, Test VJ, Fedullo PF. Chronic thromboembolic pulmonary hypertension. Clin Chest Med 28:255–269, 2007.


2. Pengo V, Lensing AW, Prins MH, Marchiori A, Davidson BL, Tiozzo F, Albanese P, Biasiolo A, Pegoraro C, Iliceto S, Prandoni P. Incidence of chronic thromboembolic pulmonary hypertension after pulmonary embolism. N Engl J Med 350:2257–2264, 2004.


3. Christiansen SC, Cannegieter SC, Koster T, Vandenbroucke JP, Rosendaal FR. Thrombophilia, clinical factors, and recurrent venous thrombotic events. JAMA 293:2352–2361, 2005.


4. Yoshida M, Mukohara N, Obo H, Ozaki N, Shida T, Okita Y. Pulmonary thromboendarterectomy for chronic pulmonary thromboembolism in protein C deficiency. Jpn J Thorac Cardiovasc Surg 54:70–74, 2006.


5. Lim JY, Lee JW, Kim JW, Jung SH, Je HG, Song H, Chung CH, Choo SJ. Clinical results after pulmonary endarterectomy as a curative surgical method in chronic thromboembolic pulmonary hypertension: an approach to operative classification of thromboembolic disease. Korean J Thorac Cardiovasc Surg 41:591–597, 2008.
6. Jamieson SW, Nomura K. Indications for and the results of pulmonary thromboendarterectomy for thromboembolic pulmonary hypertension. Semin Vasc Surg 13:236–244, 2000.

7. Takahashi J, Ito M, Okude J, Gohda T, Wakamatsu Y, Sasaki S, Yasuda K. Pulmonary thromboembolectomy in congenital antithrombin III deficiency associated with acute pulmonary embolism: report of a case. Ann Thorac Cardiovasc Surg 9:192–196, 2003.

8. Laczika K, Lang IM, Quehenberger P, Mannhalter C, Muhm M, Klepetko W, Kyrle PA. Unilateral chronic thromboembolic pulmonary disease associated with combined inherited thrombophilia. Chest 121:286–289, 2002.


9. Kim JC, Kang SY, Song HS, Lee SA. Cerebral venous sinus thrombosis associated with antithrombin III deficiency: a case report. J Korean Neurol Assoc 18:637–641, 2000.
10. Kim KY, Moon KW, Jeon DS, Choi JY, Jeon DH, Kim JW, Lee JS, Choi MS, Lee GH, Lee MY. A case of hereditary antithrombin III deficiency manifested by myocardial infarction and deep vein thrombosis. Korean Circ J 32:521–525, 2002.
11. Eum MS, Park YH, Seol JI, Chae SY, You MB, Kang KH, Lee BS, Ha CE, Park JS, Jung YH, Ahn SH, Lee HJ. A case of combined deficiency of antithrombin III and protein C complicated by recurrent venous thrombosis. Korean J Med 62:570–574, 2002.
(A) Initial chest X-ray showing cardiomegaly and a fibrostreaky opacity in the right middle to lower lung zone and apex; the right costophrenic angle is blunted. (B) One-year follow-up chest X-ray showing improved cardiomegaly and remaining blunting of the right costophrenic angle due to pleural thickening.
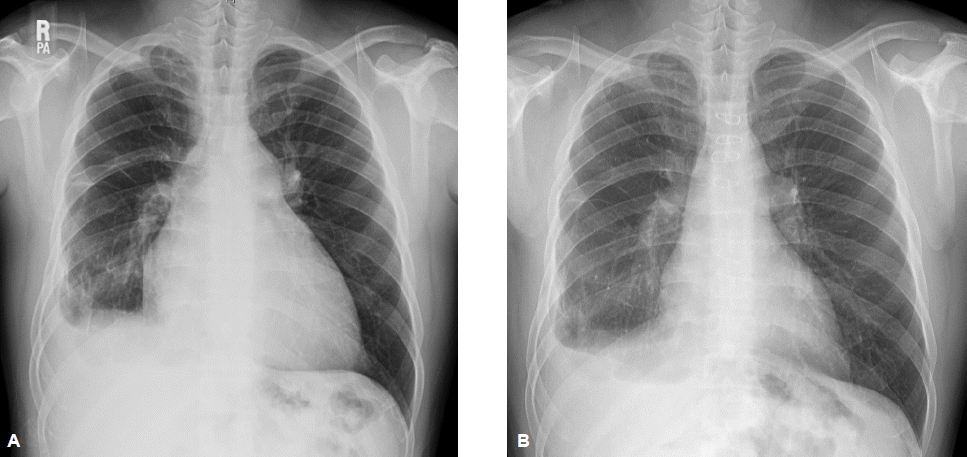
Figure 1.
(A) Initial ECG showing a normal sinus rhythm with a right axis deviation in conjunction with atrial enlargement and right ventricular hypertrophy. (B) One-year follow-up ECG showing cessation of the right axis deviation and right ventricular hypertrophy.
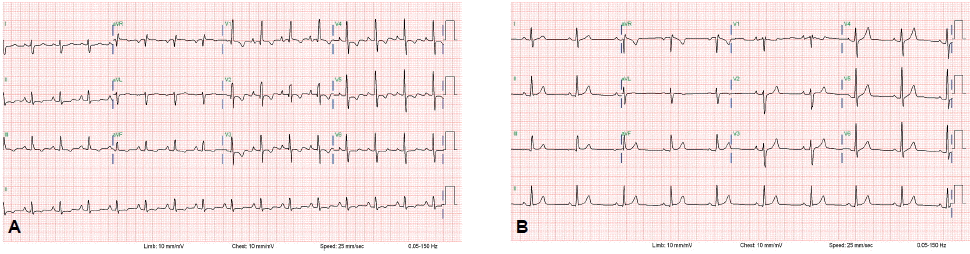
Figure 2.
(A) Apical four-chamber view (left) echocardiograph showing severe dilatation of the right atrium and right ventricle with moderate tricuspid regurgitation. The parasternal short-axis view (right) shows flattening of the interventricular septum (“D-shaped left ventricle”) and a hypertrophied right ventricle. A small amount of pericardial effusion is also present. (B) One-year follow-up echocardiograph showing a loss of right ventricular hypertrophy, pulmonary hypertension, and tricuspid regurgitation.
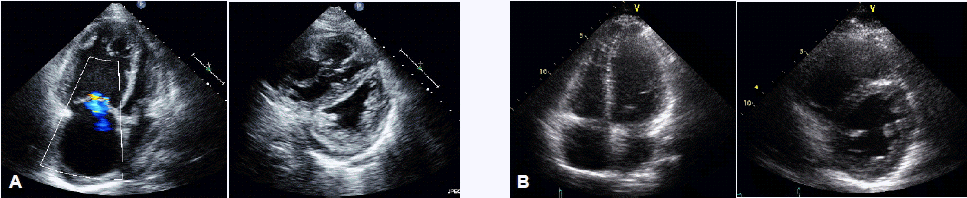
Figure 3.
(A) Lung perfusion scans showing a severe perfusion defect throughout the right upper and middle lobes. (B) One-year follow-up lung perfusion scans showing improved perfusion in both lungs.
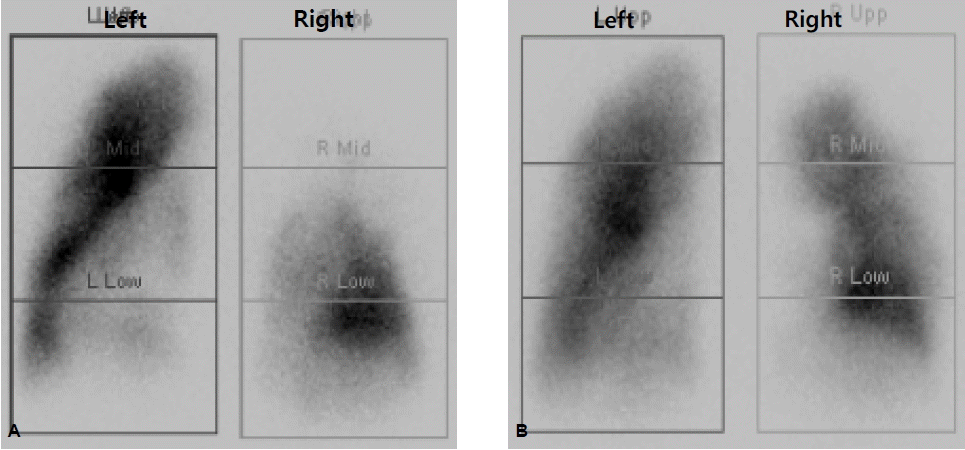
Figure 4.
(A) Coronal multiplanar reformatted images produced
by contrast-enhanced multidetector computed tomography (MDCT) showing obliteration of the right upper and middle lobar pulmonary arteries (white arrows). (B) Pulmonary artery angiograph showing near-total occlusion of the right upper and middle lobar pulmonary arteries (black arrows).
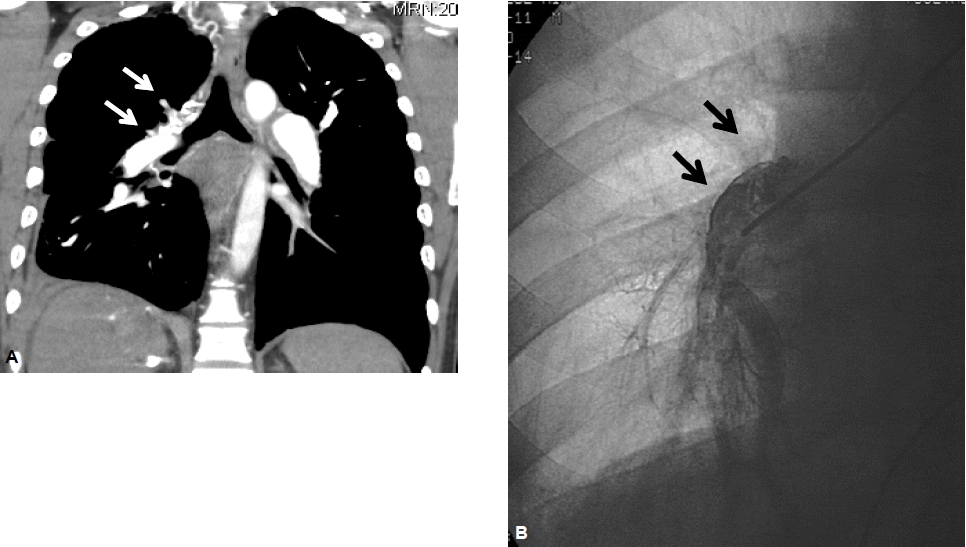
Figure 5.
Table 1.
Thrombotic profile of the patient compared to normal values
- TOOLS
-
 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link XML Download
XML Download Full text via DOI
Full text via DOI-
 Download Citation
Download Citation
 Print
Print-
Share :








