 |
 |
| Korean J Med > Volume 83(2); 2012 > Article |
|
мҡ”м•Ҫ
ліё мҰқлЎҖлҠ” көӯлӮҙм—җм„ң мІҳмқҢмңјлЎң л°қнҳҖ진 BMPR2 мң м „мһҗ лҸҢм—°ліҖмқҙм—җ мқҳн•ң нҸҗлҸҷл§Ҙ кі нҳҲм••мқј лҝҗ м•„лӢҲлқј м „ м„ёкі„м ҒмңјлЎңлҸ„ мІҳмқҢ л°ңкІ¬лҗң exon 8мқҳ c.1042_1047delGTTATT лҸҢм—°ліҖмқҙм—җ лҢҖн•ң ліҙкі мқҙлӢӨ. нҷҳмһҗлҠ” NYHA class III м •лҸ„мқҳ мҡҙлҸҷ мӢң нҳёнқЎкіӨлһҖ л°Ҹ к°қнҳҲлЎң лӮҙмӣҗн•ң 43м„ё лӮЁмһҗ нҷҳмһҗлЎңм„ң нҠ№л°ңм„ұ нҸҗлҸҷл§Ҙкі нҳҲм••мңјлЎң нҷ•м§„лҗҳм—ҲлӢӨ.
Abstract
Here, we describe the case of a 43-year-old male who was diagnosed with idiopathic pulmonary arterial hypertension and a mutation in the gene encoding bone morphogenetic protein receptor type 2 (BMPR2). The subject presented with hemoptysis and dyspnea on exertion and was diagnosed with pulmonary arterial hypertension. Genetic analysis revealed a novel deletion (c.1042_1047delGTTATT) in exon 8 of BMPR2. To the best of our knowledge, this is the first reported case of a BMPR2 mutation in a Korean patient with pulmonary arterial hypertension. (Korean J Med 2012;83:238-242)
нҸҗлҸҷл§Ҙ кі нҳҲм••мқҖ нҸҗмқҳ м„ёлҸҷл§Ҙ лӮҙн”јм„ёнҸ¬м—җ к·ёл¬јлӘЁм–‘лі‘н„°(plexiform lesion)лҘј мқјмңјмјң нҸҗлҸҷл§Ҙм••мқ„ мҰқк°ҖмӢңнӮҙмңјлЎңмҚЁ мҡ°мӢ¬л¶Җм „кіј н•Ёк»ҳ мӮ¬л§қмқ„ мҙҲлһҳн• мҲҳ мһҲлҠ” м§ҲнҷҳмқҙлӢӨ[1]. нҸҗлҸҷл§Ҙ кі нҳҲм••мқҳ м •мқҳлҠ” нҸҗм§Ҳнҷҳ, л§Ңм„ұнҳҲм „мғүм „м„ұнҸҗкі нҳҲм•• л“ұмқҙ мӣҗмқёмқҙ м•„лӢҢ нҸҗкі нҳҲм••мңјлЎңм„ң мӢ¬лҸ„мһҗлЎң мёЎм •н•ң нҸүк· нҸҗлҸҷл§Ҙм••мқҖ 25 mmHg мқҙмғҒ, нҸҗлӘЁм„ёнҳҲкҙҖ мҗҗкё°м••мқҖ 15 mmHg мқҙн•ҳмқҙлӢӨ. 1980л…„лҢҖ мҙҲ лҜёкөӯм—җм„ң 187лӘ…мқҳ нҠ№л°ңм„ұ нҸҗлҸҷл§Ҙкі нҳҲм•• нҷҳмһҗмқҳ м—ӯн•ҷ м—°кө¬м—җ мқҳн•ҳл©ҙ лӮЁм„ұліҙлӢӨ м—¬м„ұм—җм„ң нқ”н•ҳкі м§„лӢЁ лӢ№мӢң нҸүк· м—°л №мқҖ 35м„ёмқҙл©° м№ҳлЈҢн•ҳм§Җ м•ҠмқҖ кІҪмҡ° мӨ‘к°„ мғқмЎҙкё°к°„мқҖ 2.8л…„мқҙм—ҲлӢӨ[2]. нҸҗлҸҷл§Ҙ кі нҳҲм••мқҳ лі‘мқёлЎ мқҖ мһҳ л°қнҳҖм§Җм§Җ м•ҠмқҖ мғҒнғңмқҙм§Җл§Ң bone morphogenetic protein receptor type 2 (BMPR2) heterozygous лҸҢм—°ліҖмқҙк°Җ нҳ„мһ¬к№Ңм§Җ к°ҖмһҘ мһҳ м•Ңл Ө진 мң м „м Ғ мҶҢмқёмқҙлӢӨ. мқҙ BMPR2 лҸҢм—°ліҖмқҙлҠ” к°ҖмЎұм„ұ нҸҗлҸҷл§Ҙкі нҳҲм••мқҳ 70% мқҙмғҒ, нҠ№л°ңм„ұ нҸҗлҸҷл§Ҙкі нҳҲм••мқҳ 11-40%м—җм„ң л°ңкІ¬лҗңлӢӨ[3,4]. нҳ„мһ¬к№Ңм§Җ көӯлӮҙм—җм„ң BMPR2 лҸҢм—°ліҖмқҙк°Җ мҰқлӘ…лҗң л°”лҠ” м—Ҷм—Ҳмңјл©° ліё мҰқлЎҖлҠ” көӯлӮҙмқҳ мІ« ліҙкі мқҙлӢӨ.
нҷҳ мһҗ: лӮЁмһҗ, 43м„ё
мЈј мҶҢ: к°қнҳҲкіј мҡҙлҸҷ мӢң нҳёнқЎкіӨлһҖ(NYHA class III)
кіјкұ°л Ҙ л°Ҹ нҳ„лі‘л Ҙ: нҷҳмһҗлҠ” 2003л…„ нҸҗкІ°н•өмқ„ 진лӢЁл°ӣкі 6к°ңмӣ”к°„ н•ӯкІ°н•өм ң м№ҳлЈҢлҘј л§Ҳм№ң нӣ„ мҷ„м№ҳ нҢҗм •мқ„ л°ӣм•ҳлӢӨ. мқҙнӣ„ нҳёнқЎкё° мҰқмғҒ м—Ҷмқҙ м§ҖлӮҙлҚҳ мӨ‘ 2010л…„ 10мӣ” л‘җ м°ЁлЎҖ к°қнҳҲн•ҳм—¬ нғҖлі‘мӣҗм—җ л°©л¬ён•ҳмҳҖкі нқүл¶Җ м—‘мҠӨм„ кІҖмӮ¬м—җм„ң нҸҗлҸҷл§Ҙ нҒ¬кё° мҰқк°Җ мҶҢкІ¬мңјлЎң нқүл¶Җ м»ҙн“Ён„° лӢЁмёөмҙ¬мҳҒ, мӢ¬мҙҲмқҢнҢҢлҘј мӢңн–үн•ң нӣ„ нҸҗлҸҷл§Ҙ кі нҳҲм••мқҙ мқҳмӢ¬лҗҳм–ҙ ліёмӣҗ лӮҙмӣҗн•ҳмҳҖлӢӨ.
к°ҖмЎұл Ҙ: нҷҳмһҗмқҳ м–ҙлЁёлӢҲк°Җ м¶ңмӮ° нӣ„ мӢ¬мһҘмқҙ мўӢм§Җ м•ҠлӢӨлҠ” мқҙм•јкё°лҘј л“Өм—ҲмңјлӮҳ кІҖмӮ¬н•ҙ ліё м ҒмқҖ м—Ҷмңјл©° 65м„ём—җ мң л°©м•”мңјлЎң мӮ¬л§қн–ҲлӢӨ. м•„лІ„м§ҖлҠ” нҷҳмһҗк°Җ нғңм–ҙлӮ л¬ҙл ө м—°лқҪмқҙ лҒҠкІЁ нҷ•мқён• мҲҳ м—Ҷм—ҲлӢӨ. нҷҳмһҗмқҳ м—¬лҸҷмғқмқ„ 비лЎҜн•ҳм—¬ к·ё мҷё лӢӨлҘё к°ҖмЎұм—җм„ңлҠ” нҸҗлҸҷл§Ҙ кі нҳҲм••м—җ лҢҖн•ң к°ҖмЎұл ҘмқҖ м—Ҷм—ҲлӢӨ.
мӢ мІҙкІҖмӮ¬ мҶҢкІ¬: лӮҙмӣҗ лӢ№мӢң нҳҲм•• 135/85 mmHg, л§Ҙл°• 분лӢ№ 82нҡҢ, нҳёнқЎ 분лӢ№ 20нҡҢ, мІҙмҳЁ 36в„ғмҳҖкі , кёүм„ұ лі‘мғү м—Ҷмқҙ мқҳмӢқмқҖ лӘ…лЈҢн•ҳмҳҖлӢӨ. нқүл¶Җ 진찰м—җм„ң мҡ°мӢ¬мӢӨ мңөкё° мҶҢкІ¬мқҙ мһҲм—Ҳмңјл©° мІӯ진 мӢң P2 мқҢмқҳ н•ӯ진, мӮјмІЁнҢҗм—ӯлҘҳ мһЎмқҢмқҖ л“ӨлҰ¬м§Җ м•Ҡм•ҳкі лӘ©м •л§Ҙм••мқҖ м •мғҒмқҙм—Ҳмңјл©° к°„кІҪм •л§Ҙ л°ҳмӮ¬(hepatojugular reflex)к°Җ кҙҖм°°лҗҳм—ҲлӢӨ. нҸҗ мІӯ진 мӢң нҠ№мқҙ мҶҢкІ¬мқҖ м—Ҷм—Ҳмңјл©° м–‘ н•ҳм§Җмқҳ мҳӨлӘ©л¶Җмў…лҸ„ м—Ҷм—ҲлӢӨ.
кІҖмӮ¬ мҶҢкІ¬: л§җмҙҲнҳҲм•Ў кІҖмӮ¬м—җм„ң нҳҲмғүмҶҢ 15.9 g/dL, л°ұнҳҲкө¬ 9,700/ОјL, нҳҲмҶҢнҢҗ 160,000/ОјLлЎң лӘЁл‘җ м •мғҒмқҙм—ҲлӢӨ. лҸҷл§ҘнҳҲк°ҖмҠӨкІҖмӮ¬м—җм„ңлҠ” pH 7.40, PaO2 87.1 mmHg, PaCO2 32.8 mmHg, HCO3-20.4 mEq/L, мӮ°мҶҢнҸ¬нҷ”лҸ„ 97.0%мҳҖлӢӨ. нҳҲм•Ўнҷ”н•ҷ кІҖмӮ¬м—җм„ң к°„ л°Ҹ мӢ мһҘкё°лҠҘ мқҙмғҒмқҖ м—Ҷм—Ҳкі м „н•ҙм§ҲлҸ„ м •мғҒмқҙм—ҲлӢӨ. NT-proBNP мҲҳм№ҳк°Җ 125.2 pg/mLлЎң мҰқк°Җлҗҳм–ҙ мһҲм—Ҳкі 6분 кұ·кё° кІҖмӮ¬м—җм„ң 512 m кІ°кіјлҘј ліҙмҳҖлӢӨ.
лӢЁмҲңл°©мӮ¬м„ л°Ҹ мӢ¬м „лҸ„ мҶҢкІ¬: нқүл¶ҖлӢЁмҲңл°©мӮ¬м„ кІҖмӮ¬м—җм„ң мӢ¬мһҘ비лҢҖ л°Ҹ м–‘мёЎ нҸҗлҸҷл§Ҙмқҳ нҷ•мһҘ мҶҢкІ¬мқҙ мһҲм—ҲлӢӨ. мӢ¬м „лҸ„мғҒ лҸҷмңЁлҸҷмңјлЎң мҡ°мӢ¬мӢӨ비лҢҖк°Җ мһҲм—ҲлӢӨ.
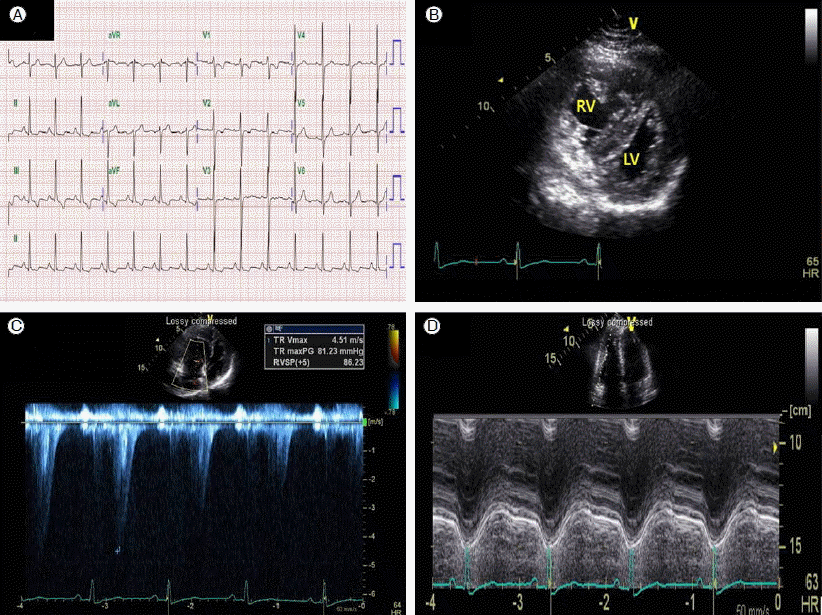
мӢ¬мһҘ л°Ҹ нҸҗ кІҖмӮ¬ мҶҢкІ¬: мӢ¬мҙҲмқҢнҢҢм—җм„ңлҠ” мўҢмӢ¬мӢӨмҲҳ축기м—җ мўҢмӢ¬мӢӨмӨ‘кІ©мқҙ лҲҢлҰ¬лҠ” DлӘЁм–‘ мўҢмӢ¬мӢӨ мҶҢкІ¬ л°Ҹ мҡ°мӢ¬мӢӨ 비нӣ„ мҶҢкІ¬мқҙ кҙҖм°°лҗҳм—Ҳмңјл©°, мӮјмІЁнҢҗл§үм—ӯлҘҳк°Җ м Ғм–ҙм„ң кіјмҶҢнҸүк°Җмқҳ к°ҖлҠҘм„ұмқҙ мһҲмқҢм—җлҸ„ л¶Ҳкө¬н•ҳкі нҸҗлҸҷл§Ҙм••л Ҙмқҙ 79 mmHgлЎң лҶ’кІҢ мёЎм •лҗҳм—ҲлӢӨ. м •мғҒ мўҢмӢ¬мӢӨл°•м¶ңкі„мҲҳ(59%), кІҪлҸ„мқҳ мҡ°мӢ¬мӢӨ нҷ•мһҘ л°Ҹ кІҪлҸ„мқҳ мҡ°мӢ¬мӢӨ кё°лҠҘ м Җн•ҳ(tricuspid annular plane systolic excursion = 19.5 mm)к°Җ кҙҖм°°лҗҳм—ҲлӢӨ(Fig. 1). мўҢмӢ¬мӢӨкё°лҠҘмқҖ м •мғҒмқҙм—ҲлӢӨ. нҸҗкё°лҠҘ кІҖмӮ¬м—җм„ң FEV1/FVC 72%, FVC 3.81 L (мҳҲмёЎм№ҳмқҳ 93%)лЎң м •мғҒ нҸҗкё°лҠҘмқ„ ліҙмҳҖмңјлӮҳ DLCo 64%лЎң кІҪлҸ„мқҳ нҷ•мӮ°лҠҘ м Җн•ҳлҘј ліҙмҳҖлӢӨ. нқүл¶Җ м „мӮ°нҷ”лӢЁмёөмҙ¬мҳҒм—җм„ң лҡңл ·н•ң нҸҗмғүм „мқҙлӮҳ кё°кҙҖм§ҖлҸҷл§Ҙмқҳ 비нӣ„лҠ” кҙҖм°°лҗҳм§Җ м•Ҡм•ҳмңјл©° мҡ°н•ҳм—Ҫм—җ кҙ‘лІ”мң„н•ң к°„мң лҰ¬ мқҢмҳҒмқҙ ліҙмҳҖлҠ”лҚ° мқҙлҠ” к°қнҳҲкіј кҙҖл Ён•ң нҸҗ лӮҙ м¶ңнҳҲмқ„ мӢңмӮ¬н•ҳмҳҖлӢӨ. мӢ¬лҸ„мһҗ кІҖмӮ¬м—җм„ң мҲҳ축기 нҸҗлҸҷл§Ҙм••л ҘмқҖ 100 mmHg, нҸүк· нҸҗлҸҷл§Ҙм••л ҘмқҖ 62 mmHg, нҸҗлӘЁм„ёнҳҲкҙҖнҸүк· м••мқҖ 6 mmHg, мӢ¬л°•м¶ңлҹү 4.7L/min, нҸҗлҸҷл§Ҙм Җн•ӯмқҖ 22.4 Wood unit/m2мңјлЎң мӨ‘мҰқмқҳ нҸҗлҸҷл§Ҙкі нҳҲм••м—җ н•©лӢ№н•ң мҶҢкІ¬мқҙм—ҲлӢӨ. мқјмӮ°нҷ”м§ҲмҶҢ нқЎмһ…мқ„ мқҙмҡ©н•ң кёүм„ұнҳҲкҙҖнҷ•мһҘкІҖмӮ¬м—җлҠ” л°ҳмқ‘мқҙ м—Ҷм—ҲлӢӨ.
мң м „мһҗ кІҖмӮ¬: BMPR2 мң м „мһҗ кІҖмӮ¬мғҒ exon 8мқҳ 1042-1047лІҲм§ё мҪ”лҸҲмқҳ кІ°мҶҗмңјлЎң 348лІҲм§ё м•„лҜёл…ёмӮ°мқё valineкіј 349лІҲм§ё м•„лҜёл…ёмӮ°мқё isoleucineмқҙ кІ°мҶҗлҗң мң м „мһҗ ліҖнҳ•(c.1042_1047del-GTTATT)мқҙ нҷ•мқёлҗҳм—ҲлӢӨ. мқҙлҠ” кё°мЎҙм—җ ліҙкі лҗҳм§Җ м•ҠмқҖ мғҲлЎңмҡҙ мң м „мһҗліҖнҳ•мқҙлӢӨ. нҷҳмһҗмқҳ к°ҖмЎұ мң м „мһҗ кІҖмӮ¬лҠ” мң мқјн•ң к°ҖмЎұмқё м—¬лҸҷмғқм—җкІҢм„ңл§Ң мӢңн–үлҗҳм—Ҳкі лҸҷмқј мң м „мһҗ ліҖнҳ•мқҖ кҙҖм°°лҗҳм§Җ м•Ҡм•ҳкё° л•Ңл¬ём—җ, м •мғҒ лҢҖмЎ°кө° н•ңкөӯмқё 50лӘ…мқ„ 분м„қн•ҳмҳҖлӢӨ. лҢҖмЎ°кө° 50лӘ… лӘЁл‘җм—җм„ң лҸҷмқј мң м „мһҗ ліҖнҳ•мқҖ кҙҖм°°лҗҳм§Җ м•Ҡм•„ c.1042_1047delGTTATTмқҙ ліё нҷҳмһҗм—җм„ң нҸҗлҸҷл§Ҙкі нҳҲм••мқ„ мқјмңјнӮЁ мӣҗмқё лҸҢм—°ліҖмқҙлЎң нҢҗлӢЁн•ҳмҳҖлӢӨ.
м№ҳлЈҢ л°Ҹ мһ„мғҒкІҪкіј: нҷҳмһҗлҠ” нҠ№л°ңм„ұ нҸҗлҸҷл§Ҙкі нҳҲм••мқ„ 진лӢЁл°ӣкі bosentan 62.5 mg 1мқј 2нҡҢ ліөмҡ©н•ҳкё° мӢңмһ‘н–Ҳкі лҸҷмӢңм—җ н•ӯмқ‘кі м ң м№ҳлЈҢлҘј лі‘н–үн•ҳмҳҖлӢӨ. м№ҳлЈҢ мӢңмһ‘ м „ 6분 ліҙн–үкІҖмӮ¬м—җм„ң 512 mлЎң мёЎм •лҗҳм—Ҳмңјл©° м№ҳлЈҢ к°ңмӢң 3к°ңмӣ” л’Ө 525 mлЎң мҰқк°Җн•ҳмҳҖлӢӨ. NT pro-BNPлҠ” 125 pg/mLм—җм„ң 40 pg/mLлЎң к°җмҶҢн•ҳмҳҖкі мҡҙлҸҷм„ұ нҳёнқЎкіӨлһҖмқҳ м •лҸ„к°Җ NYHA кё°лҠҘм„ұ 분лҘҳ IIIм—җм„ң IIлЎң нҳём „лҗҳм—ҲлӢӨ.
нҸҗлҸҷл§Ҙ кі нҳҲм••мқҖ 1) мӣҗмқёмқ„ м•Ң мҲҳ м—ҶлҠ” нҠ№л°ңм„ұ нҸҗлҸҷл§Ҙкі нҳҲм••, 2) мӣҗмқё мң м „мһҗк°Җ л°қнҳҖмЎҢкұ°лӮҳ к°ҖмЎұл Ҙмқҙ м•Ңл Ө진 мң м „м„ұ нҸҗлҸҷл§Ҙкі нҳҲм••, 3) мӢқмҡ•к°җнҮҙм ң л“ұмқҳ м•Ҫн’ҲмқҙлӮҳ лҸ…к·№л¬јм—җ л…ём¶ңлҗҳм–ҙ л°ңмғқн•ҳлҠ” кІҪмҡ°, 4) кё°м Җм§Ҳнҷҳкіј м—°кҙҖлҗң нҸҗлҸҷл§Ҙкі нҳҲм••(кІ°н•©мЎ°м§Ғлі‘, HIV к°җм—ј, л¬ёл§Ҙкі нҳҲм••, м„ мІңмӢ¬мһҘлі‘, мЈјнҳҲнқЎм¶©мҰқ[schistosomiasis], л§Ңм„ұ мҡ©нҳҲл№ҲнҳҲ)мңјлЎң кө¬л¶„лҗңлӢӨ[5]. нҸҗлҸҷл§Ҙ кі нҳҲм••мқҳ мӣҗмқё мң м „мһҗлЎңлҠ” transforming growth factor-ОІ (TGF-ОІ) superfamilyмқҳ мӢ нҳём „лӢ¬м—җ кҙҖм—¬н•ҳлҠ” лӢЁл°ұм§Ҳл“Өмқё BMPR2, activinlike kinase-type 1 (ALK1)кіј endoglin (ENG)мқҳ лҸҢм—°ліҖмқҙк°Җ ліҙкі лҗҳм—ҲлӢӨ. мқҙ мӨ‘ BMPR2 мң м „мһҗ лҸҢм—°ліҖмқҙлҠ” к°ҖмһҘ мң лӘ…н•ҳкі л№„көҗм Ғ нқ”нһҲ л°ңкІ¬лҗҳлҠ” ліҖмқҙлЎңм„ң, м „мІҙ нҸҗлҸҷл§Ҙ кі нҳҲм•• нҷҳмһҗмқҳ м•Ҫ 6% м •лҸ„лҘј м°Ём§Җн•ҳлҠ” мң м „м„ұ нҸҗлҸҷл§Ҙ кі нҳҲм•• нҷҳмһҗмқҳ м•Ҫ 70%м—җм„ң л°ңкІ¬лҗҳл©° нҠ№л°ңм„ұ нҸҗлҸҷл§Ҙкі нҳҲм•• нҷҳмһҗмқҳ м•Ҫ 10-40%м—җм„ң кҙҖм°°лҗңлӢӨ[2,4,6].
BMPR2 мң м „мһҗлҠ” мҙқ 13к°ңмқҳ exonмңјлЎң кө¬м„ұлҗҳм–ҙ мһҲмңјл©° м—¬кё°м„ң л§Ңл“Өм–ҙм§ҖлҠ” 1,038к°ңмқҳ м•„лҜёл…ёмӮ°мңјлЎң кө¬м„ұлҗң лӢЁл°ұм§ҲмқҖ лӢӨлҘё type II TGF-ОІ мҲҳмҡ©мІҙл“ӨмІҳлҹј мӢ нҳё нҺ©нғҖмқҙл“ң(signal peptide), лҰ¬к°„л“ң кІ°н•© лҸ„л©”мқё(ligand binding domain), single transmembrane domain, serine/threonine нӮӨлӮҳм•„м ң лҸ„л©”мқё л°Ҹ м„ёнҸ¬м§Ҳ лҸ„л©”мқё(cytoplasmic domain)мңјлЎң мқҙлЈЁм–ҙм ё мһҲлӢӨ. нҸҗлҸҷл§Ҙкі нҳҲм•• нҷҳмһҗмқҳ мң м „мһҗ кІҖмӮ¬ кІ°кіјк°Җ 축м ҒлҗЁм—җ л”°лқј м§ҖкёҲк№Ңм§Җ 298мў…лҘҳмқҳ лҸҢм—°ліҖмқҙк°Җ нҸҗлҸҷл§Ҙ кі нҳҲм•• нҷҳмһҗмқҳ BMPR2 мң м „мһҗ кІҖмӮ¬ кІ°кіј л°қнҳҖмЎҢлӢӨ[7]. мқҙл“Ө лҸҢм—°ліҖмқҙлҠ” м•„лҜёл…ёмӮ°мқ„ м „мӮ¬н•ҳлҠ” мҪ”лҸҲ(codon)мқҙ мң м „мһҗ м•”нҳён•ҙлҸ…(translation)мқ„ мў…кІ°н•ҳлҠ” мў…лЈҢ мҪ”лҸҲ(termination codon)мңјлЎң л°”лҖҢлҠ” nonsense mutation, лӢӨлҘё мў…лҘҳмқҳ м•„лҜёл…ёмӮ°мқ„ мҪ”л“ңн•ҳкІҢ лҗҳлҠ” missense mutation, н•ң к°ң лҳҗлҠ” л‘җ к°ңмқҳ лүҙнҒҙл ҲмҳӨнғҖмқҙл“ң(nucleotide) мӮҪмһ… л°Ҹ кІ°мҶҗм—җ мқҳн•ң frameshift mutation, мҠӨн”ҢлқјмқҙмӢұ кіјм •м—җ н•„мҡ”н•ң лүҙнҒҙл ҲмҳӨнғҖмқҙл“ңмқҳ лҸҢм—°ліҖмқҙлЎң мҠӨн”ҢлқјмқҙмӢұм—җ мқҙмғҒмқҙ мғқкё°лҠ” splice-site mutation, л„“мқҖ лІ”мң„м—җм„ң кІҢлҶҲ DNAмқҳ мӨ‘ліө лҳҗлҠ” кІ°мҶҗ(gene duplication/deletion mutation) л“ұмңјлЎң лӮҳлү мҲҳ мһҲлӢӨ. нҳ„мһ¬к№Ңм§Җ м•Ңл Ө진 298мў… лҸҢм—°ліҖмқҙмқҳ л№ҲлҸ„лҠ” nonsense mutation (85/298), frame-shift mutation (73/298), splice-site mutation (26/298), gene duplication/deletion mutation (19/298), missense mutation (95/298)мқҙлӢӨ[7]. лҸҢм—°ліҖмқҙлҠ” BMPR2 мң м „мһҗмқҳ лӘЁл“ exonм—җм„ң л°ңмғқн• мҲҳ мһҲлҠ”лҚ°, serine/threonine нӮӨлӮҳм•„м ң лҸ„л©”мқём—җм„ң к°ҖмһҘ л§ҺмқҖ лҸҢм—°ліҖмқҙк°Җ кҙҖм°°лҗҳкі лӢӨмқҢмңјлЎң лҰ¬к°„л“ң кІ°н•© лҸ„л©”мқёкіј м„ёнҸ¬м§Ҳ лҸ„л©”мқём—җм„ң л§ҺмқҖ лҸҢм—°ліҖмқҙк°Җ кҙҖм°°лҗңлӢӨ[6,7]. Missense mutationмқҖ л°”лҖҗ м•„лҜёл…ёмӮ°м—җ мқҳн•ҙ BMPR2 лӢЁл°ұм§Ҳмқҳ кё°лҠҘм—җ мқҙмғҒмқҙ мһҲлҠ” кІҪмҡ°м—җл§Ң BMPR2 мң м „мһҗмқҳ лҸҢм—°ліҖмқҙлЎң кө¬л¶„лҗңлӢӨ. Serine/threonine нӮӨлӮҳм•„м ң лҸ„л©”мқёкіј лҰ¬к°„л“ң кІ°н•© лҸ„л©”мқём—җ 80% мқҙмғҒмқҳ missense mutationмқҙ 집мӨ‘лҗҳм–ҙ мһҲлҠ” кІғмңјлЎң ліҙм•„ мқҙ л‘җ лҸ„л©”мқёмқҙ BMPR2 лӢЁл°ұм§Ҳмқҳ кё°лҠҘм—җ мӨ‘мҡ”н•ң м—ӯн• мқ„ н•ҳлҠ” кІғмқ„ м•Ң мҲҳ мһҲлӢӨ[4,6,7].
BMPR2 лҸҢм—°ліҖмқҙлҘј к°Җм§Җкі мһҲлҠ” нҷҳмһҗмқҳ нҳҲкҙҖм—җм„ңлҠ” BMPR2 л°ңнҳ„мқҙ нҳ„м ҖнһҲ к°җмҶҢлҗҳм–ҙ мһҲмңјл©°[8] мқҙлҹ¬н•ң BMPR2мқҳ к°җмҶҢлҠ” нҳҲкҙҖлӮҙн”јм„ёнҸ¬мқҳ м„ёнҸ¬мһҗл©ёмӮ¬(apoptosis)лҘј мҙү진н•ҳм—¬ лӘЁм„ёнҳҲкҙҖмқҙм „м„ёлҸҷл§Ҙмқ„ мһғкІҢ н•ҳкұ°лӮҳ мқҙлҹ¬н•ң м„ёнҸ¬мһҗл©ёмӮ¬м—җ м Җн•ӯн• мҲҳ мһҲлҠ” нҳҲкҙҖлӮҙн”јм„ёнҸ¬л“Өмқҳ л№„м •мғҒм Ғмқё мҰқмӢқмңјлЎң мқён•ң к·ёл¬јлӘЁм–‘лі‘н„°мқҳ нҳ•м„ұмқ„ мң лҸ„н•ҳлҠ” кІғмңјлЎң м¶”м •лҗңлӢӨ[9].
ліё мҰқлЎҖм—җм„ң л°ңкІ¬лҗң exon8мқҳ лҸҢм—°ліҖмқҙлҠ” BMPR2мқҳ л‘җ лҢҖлҰҪмң м „мһҗ(allele) мӨ‘ н•ң лҢҖлҰҪмң м „мһҗмқҳ нӮӨлӮҳм•„м ң лҸ„л©”мқёмқҳ 348, 349лІҲм§ё м•„лҜёл…ёмӮ° valineкіј isoleucineмқ„ мҪ”л“ңн•ҳлҠ” GTTATT м—јкё°м„ңм—ҙмқҙ кІ°мҶҗлҗҳм–ҙ л‘җ м•„лҜёл…ёмӮ°мқҙ м—Ҷм–ҙ진 BMPR2 лӢЁл°ұм§Ҳмқ„ л§Ңл“ӨкІҢ лҗҳлҠ” мғҲлЎңмҡҙ мң м „мһҗ ліҖнҳ•мқҙлӢӨ(Fig. 2) [10]. ліё м—°кө¬м§„мқҖ лӢӨмқҢмқҳ мқҙмң лЎң c.1042_1047delGTTATT ліҖмқҙк°Җ нҸҗлҸҷл§Ҙ кі нҳҲм••мқҳ мӣҗмқёмқё лҸҢм—°ліҖмқҙ мң м „мһҗлЎң кІ°лЎ мқ„ м§Җм—ҲлӢӨ. мІ«м§ё, кІ°мҶҗлҗң л‘җ м•„лҜёл…ёмӮ°мқҙ BMPR2 лӢЁл°ұм§Ҳм—җм„ң мӨ‘мҡ”н•ң м—ӯн• мқ„ н•ҳлҠ” нӮӨлӮҳм•„м ң лҸ„л©”мқём—җ мҶҚн•ңлӢӨ. л‘ҳм§ё, мқҙлҠ” м–ҙлҘҳм—җм„ңл¶Җн„° мӮ¬лһҢм—җ мқҙлҘҙкё°к№Ңм§Җ BMPR2 лӢЁл°ұм§Ҳм—җм„ң лҸҷмқјн•ҳкІҢ ліҙмЎҙлҗҳкі мһҲлҠ” м•„лҜёл…ёмӮ°л“ӨмқҙлӢӨ. м…Ӣм§ё, 348лІҲм§ё м•„лҜёл…ёмӮ°мқё valineмқҙ glutamic acidлЎң ліҖн•ң лҸҢм—°ліҖмқҙк°Җ кё°мЎҙмқҳ мң м „м„ұ нҸҗлҸҷл§Ҙ кі нҳҲм•• нҷҳмһҗмқҳ к°Җкі„м—җм„ң ліҙкі лҗң л°” мһҲлӢӨ[7]. л„·м§ё, ліё нҷҳмһҗмқҳ к°ҖмЎұ мӨ‘ нҸҗлҸҷл§Ҙ кі нҳҲм••мқ„ 진лӢЁл°ӣмқҖ к°ҖмЎұмқҖ м—Ҷм—ҲмңјлӮҳ нҸҗлҸҷл§Ҙкі нҳҲм••мқҙ мҰқлӘ…лҗҳм§Җ м•ҠмқҖ нҷҳмһҗмқҳ м—¬лҸҷмғқм—җ лҢҖн•ҙ BMPR2 мң м „мһҗмқҳ м§Ғм ‘ м—јкё°м„ңм—ҙмқ„ 분м„қн–ҲмңјлӮҳ нҷҳмһҗм—җм„ң л°ңкІ¬лҗң лҸҢм—°ліҖмқҙ(c.1042_1047-delGTTATT)лҠ” кҙҖм°°лҗҳм§Җ м•Ҡм•ҳлӢӨ. лӢӨм„Ҝм§ё, лҳҗн•ң м •мғҒ лҢҖмЎ°кө° н•ңкөӯмқё 50лӘ…мқҳ мң м „мһҗ 분м„қм—җм„ңлҸ„ лҸҷмқј лҸҢм—°ліҖмқҙлҠ” кҙҖм°°лҗҳм§Җ м•Ҡм•ҳлӢӨ. л”°лқјм„ң мғҒкё° м—јкё°м„ңм—ҙмқҳ ліҖнҷ”к°Җ ліё нҷҳмһҗм—җм„ң нҸҗлҸҷл§Ҙкі нҳҲм••мқ„ мқјмңјнӮЁ мӣҗмқё лҸҢм—°ліҖмқҙлЎң нҢҗлӢЁн•ҳмҳҖлӢӨ.
Acknowledgements
ліё м—°кө¬лҠ” "The prevalence of BMPR2 gene mutations and the effects of inhaled iloprost on hemodynamic response assessed by cardiopulmonary exercise test in Korean patients with pulmonary arterial hypertension (PILGRIM, ClinicalTrials.gov number, NCT-01054105)мқҳ м—°кө¬л№„ м§Җмӣҗмқ„ л°ӣм•ҳмқҢ.
REFERENCES
1. Fu LJ, Zhou AQ, Huang MR, et al. A novel mutation in the BMPR2 gene in familial pulmonary arterial hypertension. Chin Med J (Engl) 2008;121:399вҖ“404.


2. Rich S, Dantzker DR, Ayres SM, et al. Primary pulmonary hypertension: a national prospective study. Ann Intern Med 1987;107:216вҖ“223.


3. Sztrymf B, YaГҜci A, Girerd B, Humbert M. Genes and pulmonary arterial hypertension. Respiration 2007;74:123вҖ“132.


4. Lee YJ. Genetics in heritable pulmonary arterial hypertension. Korean J Med 2010;78:20вҖ“27.
5. Simonneau G, Robbins IM, Beghetti M, et al. Updated clinical classification of pulmonary hypertension. J Am Coll Cardiol 2009;54(1 Suppl):S43вҖ“S54.


6. Machado RD, Aldred MA, James V, et al. Mutations of the TGF-beta type II receptor BMPR2 in pulmonary arterial hypertension. Hum Mutat 2006;27:121вҖ“132.


7. Machado RD, Eickelberg O, Elliott CG, et al. Genetics and genomics of pulmonary arterial hypertension. J Am Coll Cardiol 2009;54(1 Suppl):S32вҖ“S42.



8. Atkinson C, Stewart S, Upton PD, et al. Primary pulmonary hypertension is associated with reduced pulmonary vascular expression of type II bone morphogenetic protein receptor. Circulation 2002;105:1672вҖ“1678.


Electrocardiogram (ECG) and echocardiography. (A) ECG suggested probable right ventricular (RV) hypertrophy, including right atrial enlargement, and a T wave abnormality suggesting RV strain. (B) Echocardiography revealed a dilated right ventricle, RV hypertrophy, and a D-shaped left ventricle. (C) The patientвҖҷs estimated systolic pulmonary arterial pressure was 81 mmHg, although the Doppler signal was poor. (D) The tricuspid annular plane systolic excursion was 19 mm, suggesting mild RV systolic dysfunction.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




