서 론
담관암은 그 발병률이 계속 증가추세를 보이는 암종으로, 양측 간내담관의 문합부 또는 총간관을 침범하는 간문부 담관암은 Klatskin 종양이라고도하며 전체 담관암의 60~80% 이상을 차지한다1,2). 담관벽을 따라 담관의 종축 방향으로 자라나는 담관암의 특성 때문에 대부분 진행된 상태에서 진단되는 경우가 많고, 근치적 치료보다는 보존적 치료만 가능한 경우가 많아 예후가 불량하다2,3). 수술적 절제가 유일한 근치적 치료 방법이지만 현재까지 간문부 담관암에 대한 수술 성적은 만족스럽지 않다4,5). 최근 multi-detector CT (MDCT)와 MRCP를 포함한 여러 영상학적 단층촬영 검사들은 간문부 담관암에 대한 비침습적인 진단 및 수술전 병기 결정을 가능하게 하지만, 조직학적 확진은 내시경 시술을 통하여 가능하다. 또한 영상학적 검사에서 불분명한 간문부의 담도 협착에 대한 악ㆍ양성의 정확한 감별 진단을 위해서는 내시경적 접근을 통한 검사들이 필수적이다2,3,6,7). 간문부 담관암의 정확한 진단 및 평가는 현재까지도 임상적인 어려움으로 남아있지만, 여러 가지 진보된 내시경적 방법들이 개발되고 연구되고 있고, 소규모의 연구이지만 일부 고무적인 결과들이 보고되고 있어 그 귀추가 주목된다.
내시경 역행성 담관조영술 (Endoscopic retrograde cholangiography, ERC)
내시경 역행성 담관조영술은 담관내 조영제를 주입하여 담도협착의 위치와 형태학적 특성을 평가하는 간문부 담관암 진단의 기본적인 검사로 여겨져 왔지만, 담관염이나 췌장염 등의 합병증이 발생할 수 있는 침습적인 검사 방법이다. 따라서 담관암에 대한 진단적 역할은 점차 비침습적이고 우수한 영상을 제공하는 영상학적 단층촬영 검사들이 대신하고 있어, 단순히 진단적 목적의 내시경 역행성 담관조영술은 점차 감소 추세이다8-10). 하지만 정확한 진단을 위한 조직 획득을 가능하게 하고, 관강내 세경초음파 검사나 담도내시경 검사 등 추가적인 진단적 시술이 가능하며, 진단적 검사 외에 담도배액술과 같은 치료적 시술을 함께 시행할 수 있어, 내시경 역행성 담관조영술은 현재까지도 간문부 담관암의 표준 검사 방법으로 되어있다2,8,10,11).
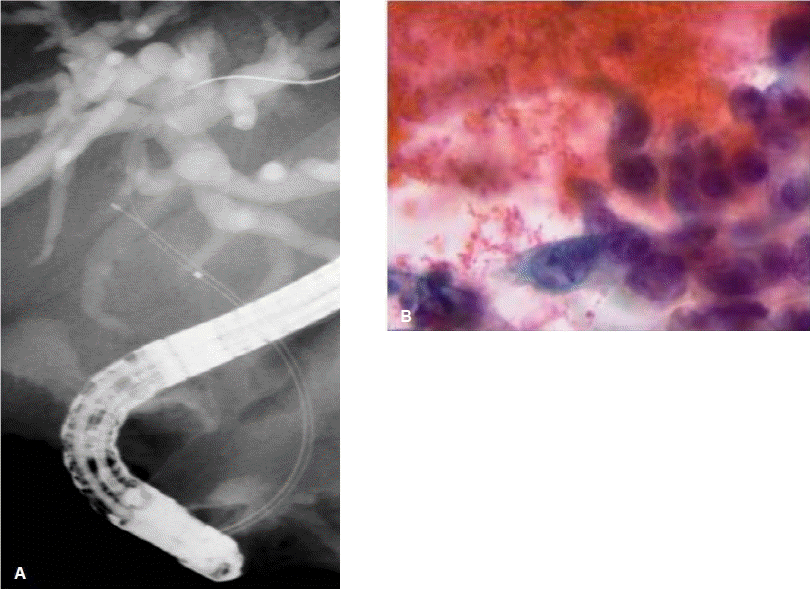
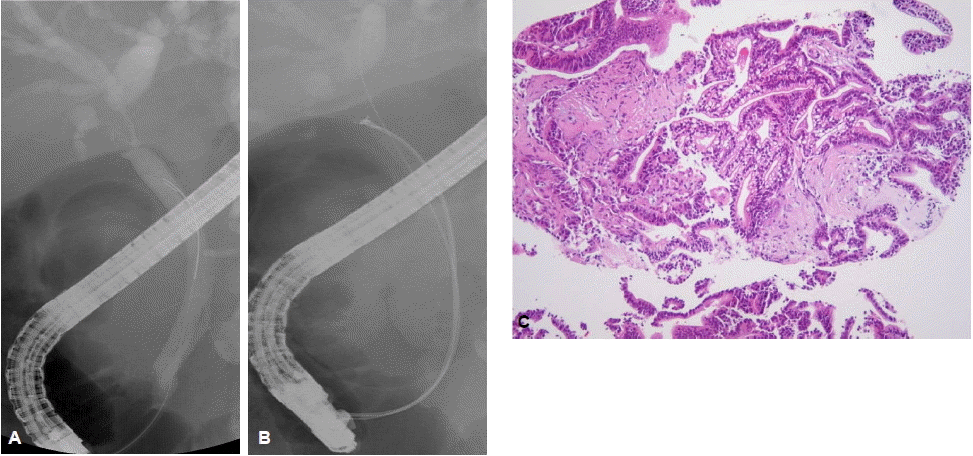
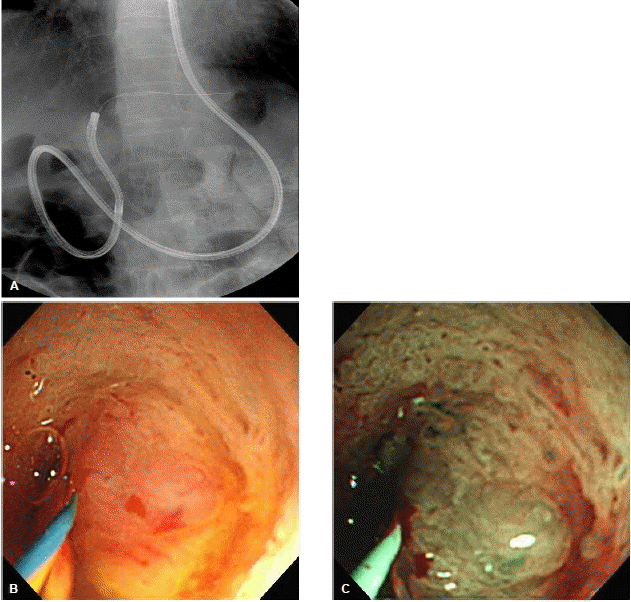
내시경 역행성 담관조영술을 통한 조직병리학적 검사는 통상적으로 방사선투시하에서 경유두적으로 솔질세포검사(brush cytology)나 겸자생검(forceps biopsy)을 통하여 이루어진다. 솔질세포검사는 담관조영술 중에 유도철선을 따라 비교적 쉽고 간편하게 적용할 수 있는 검사 방법으로 널리 시행되고 있지만(그림 1), 담관암의 세포성이 적고(paucicellular) 결합조직을 형성하는(desmoplastic) 특성으로 인하여 정확한 진단을 위해 필요한 충분한 양의 세포를 얻기가 쉽지 않아 암 진단의 민감도는 30~50% 정도로 만족스럽지 못하다12,13). 진단율을 향상시키기 위하여 여러 가지 방법들이 보고되었는데, de Bellis 등13)은 협착부위의 확장술 시행 전ㆍ후의 솔질세포검사를 비교하였고, 확장술 시행 후의 솔질세포검사에서 뚜렷한 진단적 이득은 없었지만 전ㆍ후의 검사를 함께 했을 때 진단율이 33%에서 44%로 향상되었다고 보고하였다. 이는 얻어진 조직의 양이 많을수록 진단율이 향상될 수 있음을 보여준다. 통상적인 솔질세포검사 외에 나사모양의 배액관 제거기(stent retriever)나 담석 제거에 사용되는 바스켓을 사용한 세포검사를 시행하여 통상적인 솔질세포검사보다 진단율이 높았다는 보고도 있다14,15). 방사선투시하에서 시행되는 경유두적 겸자생검은 40~80%의 다양한 민감도가 보고되고 있는데, 내시경 시술자의 경험과 겸자생검 당시 얻어진 조직의 양에 따라 결정된다(그림 2)2,16,17). 솔질세포검사나 겸자생검 모두 만족스러운 진단율을 보이지 못하지만 여러 연구에서 두 가지 이상의 조직획득 방법을 함께 시행하여 민감도가 증가됨을 보고하였다18-20). 따라서 담관암의 조직병리학적 확진을 얻기 위하여 내시경 역행성 담관조영술 중에 가능한 여러 방법을 동원하여 가능한 많은 조직을 얻도록 노력하는 것이 필요하다. 하지만 이러한 다양한 방법의 노력에도 간문부 담관암에서는 원위부 담관암과 비교하여 그 진단 민감도가 제한적이며 추가적인 진단적 기술의 개발과 적용이 필요하다21).
암세포의 이수성(aneuploidy)이 담관암의 80%에서 나타나는 것으로 알려져 있으며, 이러한 염색체 변화를 검출하는 진보된 세포 검사 기술을 담관암 진단에 적용하려는 연구들이 있어 왔다22,23). 디지털 이미지 분석(digital image analysis, DIA)은 DNA 성분을 정량화 하는 방법으로, 적은 양의 세포에서도 진단이 가능하다. 이러한 디지털 이미지 분석이 세포 검사의 진단율을 향상시킬 것으로 기대하였지만, 실제 보고된 결과에서 그 진단율 향상이 미미하였고, 최근 발표된 전향적 연구에서 다변량분석을 통해 담관암에 대한 진단적 가치가 인정되지 않고 있다24). 형광동소보합법(fluorescence in situ hydridization, FISH)은 형광물질을 부착한 DNA 탐침을 사용하여 염색체 이상을 검출하는 방법으로, 일반 솔질세포 검사와 비교하여 암 진단의 민감도가 높다고 보고되고 있다24,25). 특히 원발성 경화성 담관염(primary sclerosing cholangitis) 환자에서 담관암 진단에 대하여 민감도 47%, 특이도 100%, 양성 예측도 100% 그리고 음성 예측도 88%였다23). 다른 연구에서는 담관협착이 있는 환자를 대상으로 통상적인 세포 검사와 비교하였는데 담관암 진단의 민감도는 더 높았지만 특이도가 다소 떨어지고 가격이 비싼 단점이 있다고 하였다26).
내시경 초음파 검사(Endoscopic ultrasound, EUS)
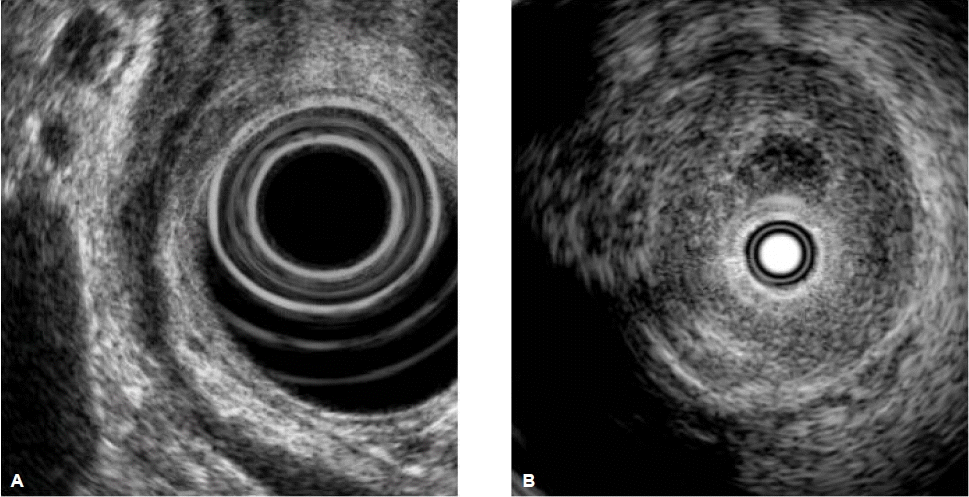
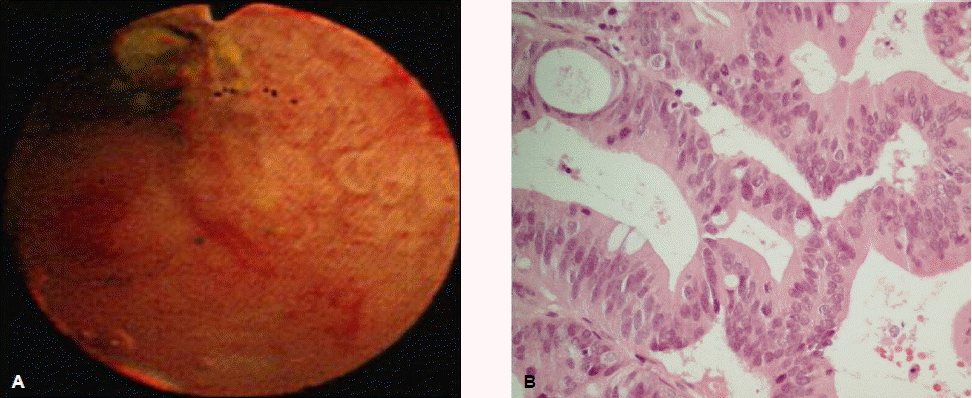
내시경 초음파 검사는 비교적 덜 침습적인 내시경 영상진단방법으로 담도 및 췌장 질환에 대한 우수한 영상을 제공하며, 담관암에 대하여 병변의 국소적 침범정도와 주변 임파선 전이를 평가하는데 유용하다(그림 3A). 영상학적으로 담관암이 의심되는 환자에서 내시경 초음파 검사의 진단적 민감도와 특이도는 각각 78%와 84% 정도로 보고된다11,27,28). 또한 내시경 초음파 검사의 장점은 비교적 안전하게 원발병소와 주변의 임파선에 대하여 세침흡인검사(fine needle aspiration, FNA)를 시행하여 조직을 얻을 수 있는 것이다(그림 4). 한 전향적 연구에서 영상학적으로 간문부 담관암이 의심되고 수술적 절제가 가능할 것으로 평가되었으나 내시경적 솔질세포검사에서 음성인 환자를 대상으로 내시경 초음파 유도하에 세침흡인검사를 시행하여 89%의 민감도, 100%의 특이도를 보였고, 61%의 환자에서 세침흡인검사의 결과에 따라 치료방침이 바뀌었다고 하였다29). 총담관암보다 간문부 담관암의 경우 해부학적 위치상 내시경 초음파 검사와 세침흡인검사가 제한될 것으로 생각되지만 보고자에 따라 25%에서 89%까지 다양한 결과가 보고되고 있다27,30). 최근에는 직시형 선형 내시경 초음파 기기(forward-viewing linear echoendoscope, FVL-EUS)가 개발되어 간문부 담관암 진단에 유용하게 사용될 것으로 기대된다31). 이와 같이 내시경 초음파 검사는 통상적인 내시경적 솔질세포검사나 경유두적 겸자생검 등을 통하여 조직학적 진단을 얻지 못하였을 때 유용하게 사용될 수 있지만, 내시경 시술자에 매우 의존적이며 충분한 교육과 경험이 필요하다. 또한 수술적 절제가 가능할 것으로 생각되는 경우에는 복강 내 파종 위험을 고려하여 추천하지 않고 있다10,32).
관강내 세경초음파 검사(Intraductal ultrasound, IDUS)
관강내 세경초음파 검사는 내시경 역행성 담관조영술 중에 유도선을 따라 쉽게 적용할 수 있는 내시경 영상진단방법으로, 20 MHz 이상의 높은 주파수와 0.07~0.18 mm의 뛰어난 해상력을 이용하여 담관벽과 주위 구조물에 대한 우수한 초음파 단층 영상을 제공한다(그림 3B)33). 종양의 위치에 상관없이 담관의 종축을 따라 간내담관에서 총간관 및 총담관, 그리고 유두부까지 담관벽과 종양의 침범정도의 관계를 자세히 관찰할 수 있으며, MRCP나 담관조영술에서 간과할 수 있는 조기 병변을 확인할 수 있다. 또한 담관 주변의 구조물, 특히 우측 간동맥, 간문맥의 종양 침범 여부를 확인하는데 유용하다34). 이는 간문부 담관암의 국소적 병기를 결정하는데 추가적인 정보를 제공하여 수술적 절제 등 치료방침을 결정하는데 유용할 수 있다. 악성을 시사하는 관강내 세경초음파 소견은 불규칙한 표면을 보이며 비대칭성으로 담도벽이 두꺼워진 경우, 저에코의 종양이 주변 구조물을 침범하는 경우, 비균질한 음영이 주변 조직을 침범하는 경우, 임파선이 보이는 경우, 그리고 혈관을 침범하는 경우 등이다. Stavropoulos 등35)은 내시경 역행성 담관조영술에 관강내 세경초음파 검사를 함께 시행하였을 때 진단 정확도가 58%에서 90%로 향상되었다고 하였고, 다른 여러 연구에서도 관강내 세경초음파 검사의 담관암에 대한 높은 진단 정확도와 진단적 유용성이 보고되었다36,37). 하지만 담관벽의 염증성 변화와 감별이 어려운 경우가 있어, 특히 원발성 경화성 담관염 환자에서는 진단 정확도가 떨어진다. 삼차원 관강내 세경초음파(3D-IDUS)는 실시간으로 담관과 주변구조물의 입체적 관찰이 가능하고 종양의 부피를 측정할 수 있어, 간문부 담관암의 진단 및 병기결정뿐만 아니라 치료효과 판정 등에도 유용하게 사용될 수 있다38).
담도내시경 검사(Cholangioscopy)
간문부 담관암의 구조적 특성은 영상학적 단층촬영이나 담관조영술을 통한 간접적인 평가가 주를 이루지만, 담도내시경 검사는 담관내 병변을 직접 내시경적으로 관찰할 수 있으며 필요한 경우 병변에 대한 표적 생검을 시행하여 조직학적 진단을 얻을 수 있다. 특히 유두상 담관암이나 점액분비성 담관암의 수술 전 병변의 침범 정도를 평가하고 수술 범위를 결정하는데 유용하고, 다른 진단적 검사에서 진단이 불분명한 담관협착에 대하여 결정적인 진단적 정보를 제공할 수 있다39,40). Fukuda 등41)은 악성 담도 협착에 대하여 일반적인 담관조영술 및 경유두적 조직검사 외에 경구적 담도내시경 검사를 시행하여 진단 민감도가 57.9%에서 100%로 향상되었다고 보고하였다. 또한 최근에 개발된 협대역 영상(narrow band imaging, NBI)과 같은 다양한 영상 증강 내시경 검사(image-enhanced endoscopy)를 담도내시경 검사 중에 적용하여 종양혈관과 같은 표재성 혈관구조나 담관 점막의 표면 구조를 보다 뚜렷하게 관찰함으로써 진단적 도움을 줄 수 있을것으로 기대된다42-44).
1. 경피경간 담도내시경 검사(Percutaneous transhepatic cholangioscopy, PTCS)
경피경간 담도배액술(PTBD)을 시행한 후 확장술을 시행하고 2~3주를 기다리면 경피경간 경로를 통하여 담도내시경 검사를 시행할 수 있다(그림 5). 하지만 출혈이나 담즙의 복강내 누출과 같은 합병증 위험이 있는 침습적인 방법이며, 경로가 형성되기까지 수주간 기다려야하고, 배액관을 유지하는 것이 환자에게 불편감을 초래하여 삶의 질이 저하될 수 있다. 또한 경피경간 경로를 통해 암세포가 퍼질 위험성도 있어, 수술 전에는 유의해서 시행하여야 한다.
2. 경구적 담도내시경 검사(Peroral cholangioscopy, POC)
경구적 담도내시경 검사는 과거 30여 년간 모자내시경 방식(Mother-baby endoscope system)이 표준으로 여겨졌다. 이는 모내시경(mother scope)의 겸자구를 통하여 자내시경(baby scope)을 담관 내로 삽입하는 방식으로 시술 전 유두부 절개술(sphincterotomy)이 필요하다. 하지만 현재까지도 제한된 기관에서만 제한적으로 시행되어 왔는데, 시술을 위해 2명의 숙련된 내시경 의사가 필요하고, 내시경 조작이 어려우며, 고가의 장비인 자내시경이 손상되기 쉽고, 일반 내시경에 비하여 영상의 해상도가 낮고, 자내시경의 겸자구가 1.2 mm로 작아 충분한 양의 조직을 획득하기가 어려운 단점들이 있다. 최근에는 여러 단점을 보완한 비디오 전자 형식의 새로운 자내시경 장비가 개발되어 담도 질환에 대한 유용성이 보고되기도 하였다45,46).
모자내시경 방식의 여러 단점을 극복하기 위해 1명의 내시경 의사가 시행할 수 있는 담도내시경 시스템들이 개발되어 왔는데, 최근에 SpyGlass direct visualization system이 개발되어 담도 질환에 대한 진단적 유용성이 보고되고 있다47,48). 하지만 SpyGlass 시스템은 기존의 내시경 장비와 호환되지 않고, 비교적 고가의 일회용 부속기구들이 필요하며, 영상 해상도가 낮고, 겸자구가 1.2 mm로 작은 단점들이 있다.
이러한 특수한 장비를 사용하는 방법 외에 소아의 상부위 장관 내시경 검사나 경비적(transnasal) 내시경 검사에 널리 사용되는 극세경 내시경(ultra-slim endoscope)을 경구적으로 담도 내에 직접 삽입하여 담도내시경 검사를 시행하는 방법이 고안되어 임상적 유용성이 보고되고 있다(그림 6)49,50). 직접 경구적 담도내시경(direct peroral cholangioscopy, DPOC) 검사는 5~6 mm 직경의 극세경 내시경을 사용하며 1명의 내시경 의사가 시술 가능하고, 일반 위내시경과 비슷한 우수한 영상 해상도를 제공하고, 겸자구 직경이 2.0 mm로 효과적인 조직검사 및 다양한 보조기구의 사용이 가능하고, 널리 사용되고 있는 내시경 장비를 이용하는 방식으로 다른 담도내시경 검사 방법과 비교하여 경제적인 이점이 있다. 하지만 담관의 해부학적 구조의 특성상 극세경 내시경의 담관으로의 삽관이나 담도내시경 검사 중 내시경의 위치를 지지할 보조기구가 필요하고, 원위부 총담관 부위에 협착이 없어야 하며, 내시경의 담관내 삽관을 위해서 유두부 절개술 및 유두부 확장술이 필요하다40,51).
간문부 담관암 진단을 위한 새로운 시도들
결 론
다양한 내시경 진단 방법의 발달에도 불구하고 내시경 검사상 간문부 담관암의 정확한 진단과 평가는 완전하지 않다. 가능한 방법을 통하여 조직학적 진단을 얻는 것이 필요하지만 내시경적으로 얻어진 조직 검체에서 악성 소견이 보이지 않더라도 악성의 가능성을 완전히 배제할 수 없다. 영상학적 단층촬영 후 내시경 역행성 담관조영술을 통한 관강내 세경초음파 검사나 내시경 초음파 검사를 통하여 종양의 국소침범정도를 평가할 수 있고, 경유두적 솔질세포검사 또는 겸자 생검을 시행하여 조직검사를 시행할 수 있다. 일반적인 내시경적 검사 방법으로 조직학적 진단이 얻어지지 않을 때, 내시경 초음파 유도하 세침흡인검사나 담도내시경 검사를 시행하여 추가적인 조직검사를 시행할 수 있다. 실제 임상에서 모든 방법들이 시행 가능할 수는 없지만, 가능한 진단 방법들을 함께 시행하여 정확한 진단과 평가가 이루어질 때 적절한 치료 방침을 결정할 수 있을 것이다. 내시경 기기와 다양한 진단 기술의 지속적인 발전과 함께 간문부 담관암에 대한 내시경의 진단적 가치는 더욱 커질 것으로 기대된다.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






