 |
 |
| Korean J Med > Volume 79(5); 2010 > Article |
|
요약
목적
본 연구는 파종성혈관내응고(disseminated intravascular coagulation, DIC)에 대한 점수체계를 이용하여 중증패혈증 및 패혈증쇼크 환자에게서 파종성혈관내응고의 발생률과 예후를 확인하고자 하였다.
방법
2008년 3월부터 2009년 2월까지 중증패혈증 및 패혈증쇼크으로 일개 3차 의료기관의 내과중환자실에 입원한 환자들을 대상으로 하였다. DIC 점수체계는 ISTH (International Society on Thrombosis and Haemostasis)를 이용하였으며, 연구기간 동안 각각 Day 0, Day 1, Day 2의 세 시점에서 계산하였다.
결과
총 111명의 환자 중에서 제외기준에 해당하는 22명을 제외하고, 89명의 환자가 연구에 포함되었다. 환자의 평균 DIC score는 3.3±1.3였으며, 입원 초기 48시간 동안에 현성 DIC (overt DIC; DIC score ≥ 5)의 발생 빈도는 33.8% (27/89)였다. Sequential Organ Failure Assessment (SOFA) score는 DIC score와 유의한 상관관계를 보여주었고, 현성 DIC 군에서 다른 환자군 보다 높은 점수를 보여주었다(p<0.05). 중환자실 사망과 병원 사망, 28일 사망률은 현성 DIC 군에서 각각 63.0%, 66.7%, 63.0%이었고, 이는 현성 DIC에 해당되지 않은 환자에 비해 통계적으로 유의하게 높았다. 다변량 분석에서는 Simplified Acute Physiology Score (SAPS) II가 병원 사망과 유의한 관련성을 보여주었고(p=0.002), 현성 DIC의 발생은 경계선상의 관련성을 보여주었다(p=0.043).
Abstract
Background/Aims
We investigated the incidence and prognosis of disseminated intravascular coagulation (DIC) using DICscoring system in patients with severe sepsis or septic shock.
Methods
Patients admitted to the intensive care unit (ICU) in a tertiary hospital for severe sepsis or septic shock were enrolledfrom Mar. 2008 to Feb. 2009. Using the International Society on Thrombosis and Haemostasis (ISTH) criteria, we calculated DICscore at three time points (Day 0, Day 1, and Day 2).
Results
Among 111 patients with severe sepsis or septic shock, 89 (severe sepsis, 8; septic shock, 81) were enrolled. Mean DICscore at ICU admission was 3.3±1.3 and the incidence of overt DIC (DIC score ≥ 5) during the first 48 hours was 33.8% (27/89).Sequential Organ Failure Assessment (SOFA) score was well correlated with DIC score and was higher in patients with overt DICthan in those without. The ICU, hospital and 28-day death rates in patients with overt DIC were 63.0%, 66.7%, and 63.0%, respectively,which were significantly higher than in those without overt DIC. In multivariate analysis, Simplified Acute PhysiologyScore (SAPS) II was significantly associated with hospital death (p=0.002), and the occurrence of overt DIC showed a borderlinesignificance (p=0.053).
파종성혈관내응고(disseminated intravascular coagulation, DIC)는 혈액응고체계가 활성화되면서 미세혈관 혈전증이 발생하는 질환이다. 이는 혈액응고인자의 과다한 소모로 인해 출혈성 경향을 보이고, 결국엔 다기관기능부전(multi-organ failure)에 이르게 되어 높은 사망률을 보일 수 있다1,2). 패혈증 혹은 패혈증쇼크에서는 여러 가지 내독소 및 조직인자에 의해서 혈액응고체계가 활성화 될 수 있는데, 이로 인해 DIC가 발생하고 다기관기능부전에 이를 수 있다3-5). 현재 중환자 치료의 많은 발전에도 불구하고 중증패혈증 환자의 사망률은 아직까지 30~50%에 이르고 있다6,7).
감염에 대한 인체 내에서의 염증반증(inflammatory response)과 응고인자(coagulation system)의 활성화는 밀접하게 연관되어 있다. Tumor necrosis factor α, interleukin-1β, interleukin-6 등의 염증성사이토카인들은 응고체계를 활성화시키고, 섬유소용해(fibrinolysis) 작용을 억제시키기도 하지만, 반대로 응고인자의 활성화가 여러 가지 염증성 경로를 활성화시키기도 한다. 이로 인해 결국 혈관손상이 일어나게 되고, 다기관기능부전이 발생하게 된다8-10).
중환자실에서 사용되고 있는 중증도 지표인 Simplified Acute Physiology Score II (SAPS II)와 Sequential Organ Failure Assessment (SOFA)는 여러 연구를 통해 그 타당성이 입증되었으나, 이들 점수체계에서 혈액응고 장애가 차지하는 비중은 높지 않다. 특히 중증도가 높은 환자들에게서 이들 점수 체계만으로는 DIC의 발생이 예후에 미치는 영향을 파악하기는 어렵다.
아직까지 DIC를 진단할 수 있는 표준화된 실험실 진단법은 없다. 2001년에 The International Society of Thrombosis and Haemostasis (ISTH)에 의해서 DIC의 진단을 위한 점수체계가 고안되었는데, 이후로 이 점수체계가 DIC의 진단에 민감도와 특이도가 높다는 연구도 발표되었다11,12). 패혈증 환자에게서는 DIC의 발생률이 7~16% 정도 되고, 패혈증쇼크에서는 많게는 73%까지 이를 수 있다13-16). 패혈증에서의 높은 사망률에도 불구하고, 아직 우리나라에서는 패혈증 및 패혈증쇼크 환자에서 DIC의 발생률에 대한 연구는 없다. 본 연구에서는 3차 기관의 내과중환자실에 입원한 중증패혈증 및 패혈증쇼크 환자를 대상으로 DIC의 발생률을 확인하고 이들과 장기부전 점수체계인 SOFA score 및 사망률과의 관련성을 알아보고자 하였다.
2008년 3월부터 2009년 2월까지 한림대학교성심병원 내과중환자실에 입원한 중증패혈증 및 패혈증쇼크 환자를 대상으로 하였다. 18세 이상의 환자를 대상으로 하였고, 항응고 치료를 받는 환자, 간부전(child class C)이나 혈액암 환자, 입원 시 심폐소생술을 받거나 적극적인 치료를 거부하는 환자는 본 연구에서 제외하였다. 본 연구는 1년 동안의 전향적인 연구로 한림대학교 성심병원 임상연구 심의위원회의 승인을 받았고, 본 연구에 참여하는 환자에 대해서는 환자 또는 보호자에게 동의서를 받았다.
연구자들은 본 연구에 등록된 환자들을 대상으로 나이, 성별 및 패혈증의 원인을 조사하였고, 입원 시 여러 가지 생화학 검사 및 lactic acid 수치와 SAPS II를 구하였다. 추가로, 혈액응고 검사를 통하여 입원 당시(Day 0), 입원 24시간(Day 1), 입원 48시간(Day 2)의 DIC score를 구하였고, 각각의 동일 시점에서의 SOFA score를 계산하여 DIC score와 비교하였다. 중증패혈증 및 패혈증쇼크의 정의는 2008년 Surviving Sepsis Campaign의 지침을 근거로 진단하였다17). DIC score는 2001년 Taylor 등에 의해 제안된 ISTH criteria를 이용하였고, 여기에는 혈소판(platelet), 섬유소 관련 인자(fibrin-related marker), 프로트롬빈 시간(prothrombin time), 섬유소원(fibrinogen)의 4개 요소로 구성되어 있다(표 1)12). 본 연구에서 섬유소 관련인자로는 D-dimer를 이용하였고, Bakhtiari 등의 연구에서와 같이 정상범위는 0점(<0.5 μg/mL), 정상범위의 10배 이내인 경우엔 1점(0.5~5 μg/mL), 10배 이상인 경우엔 2점을 주었다(>5 μ g/mL). 총 8점의 점수 중에서 5점 이상인 경우를 현성 DIC(overt DIC)로 진단하였다11).
DIC score와 여러 가지 생화학검사 및 SAPS II, SOFA 점수 간의 관련성을 조사하였고, 현성 DIC의 발생에 관련된 인자를 조사하였다. 중증패혈증 및 패혈증쇼크 환자에서 현성 DIC의 발생 빈도를 조사하였고, 쇼크의 회복여부, 중환자실 사망, 병원 사망, 28일 사망을 조사하여 현성 DIC 군을 비현성 DIC (non-overt DIC)군과 비교하였다.
통계적 분석에는 Microsoft Office Excel 2007과 SPSS 13.0 package (SPSS Inc. Chicago, IL, USA)를 이용하였다. 수치는 평균±표준편차로 표시하였고, 빈도는 %로 표시하였다. 연속형 변수는 Student’s t-test 혹은 Mann-Whitney U test를 이용하였고, 명목형 변수는 chi-square test 혹은 Fisher’s exact test를 이용하여 비교하였다. 단변량 분석에서 p<0.05인 변수를 이용해 다변량 분석(로지스틱 회귀분석)을 시행하였고, 병원 사망과의 관련인자를 조사하였다.
Correlation coefficient를 구하여 변수 간의 관련성을 조사하였고, receiver operating characteristics (ROC) curves를 이용하여 사망률 예측에 있어서의 ISTH criteria의 유용성을 알아보았다.
연구기간 동안 한림대학교성심병원 내과중환자실에 111명의 중증패혈증 및 패혈증쇼크 환자가 입원하였고, 제외기준에 포함된 22명(항응고 치료, 4명; 간부전[child class C], 5명; 혈액암, 3명; 심폐소생술, 5명; 치료 거부, 5명)을 제외한 총 89명의 환자가 선정기준에 해당되었다. 이 중 중증패혈증은 8명, 패혈증쇼크은 81명이었다. 환자들의 평균 나이는 69.3±13.9세였고, 남자가 52명(58.4%)이었다. 환자들의 입원 시 SAPS II의 평균점수는 53.8±15.3이었고, 패혈증의 원인으로는 폐렴 49명(55.1%), 요로 감염 13명(14.6%), 간담도계 감염 10명(11.2%), 소화기 감염 8명(9.0%), 중심정맥관 감염 3명(3.4%), 피부 및 연조직 감염 2명(2.2%), 기타 원인이 4명(4.5%)이었다. 입원 시 DIC score는 평균값이 3.3±1.3이었고, DIC score≥5점인 현성 DIC에 해당하는 환자의 비율은 Day 0, Day 1, Day 2에서 각각 18% (16/89), 30.7% (23/75), 22.4% (13/58)를 차지하였고(그림 1), 입원 48시간 동안 한 번 이상 DIC score≥5점인 경우는 27명(33.8%)이었다. 중증패혈증에서는 현성 DIC의 발생 빈도가 12.5% (1/8)이었고, 패혈증쇼크에서는 47.2%(26/81)로 훨씬 높았으나 두 군 간에 통계적 차이는 없었다.
입원 시의 활력징후, 생화학 검사, 중증도 지표와의 관련성을 조사한 결과 백혈구(p=0.030), hematocrit (p=0.003), 혈소판(p<0.001), blood urea nitrogen (p=0.023), lactic acid(p=0.010), SOFA 점수(p=0.001), SAPS II (p=0.043)가 현성 DIC의 발생과 의미있는 관련성을 보여주었고(표 2), 로지스틱 회귀분석을 이용한 다변량 분석에서는 혈소판(Odds ratio[OR], 0.965; 95% confidence interval [CI], 0.947~0.982; p<0.001)과 lactic acid (OR, 1.395; 95% CI, 1.004~1.938; p=0.043)가 현성 DIC의 발생과 의미있는 관련성을 보였다.
DIC score와 SOFA score의 상관관계 분석에서는 Day 0, Day 1, Day 2 모두에서 관련성을 보여주었고(r=0.384, p=0.009; r=0.538, p<0.001; r=0.543, p<0.001, respectively; 그림 2), 세 시점에서 현성 DIC 군이 비현성 DIC 군보다 평균 SOFA score가 유의하게 높았다(11.4±3.4 vs. 9.3±2.8, p=0.009; 12.1±3.6 vs. 7.3±3.0, p<0.001; 12.2±4.2 vs. 6.4±3.2, p<0.001, respectively).
생존군과 사망군 사이의 비교에서는 DIC score와 SOFA score 모두 세 시점(Day 0, Day 1 and Day 2)에서 의미있는 차이를 보여주었다(그림 3). 쇼크의 회복 및 병원 사망과 28일 사망을 비교한 결과에서는 현성 DIC 군에서 쇼크의 회복이 유의하게 낮았고, 중환자실 사망, 병원 사망, 28일 사망률도 비현성 DIC 군보다 유의하게 높았다(표 3). Surviving sepsis campaign’의 초기치료 지침(resuscitation bundle)에 따라 첫 6시간에 치료목표(i.e., central venous pressure≥8~12 mm Hg, mean arterial pressure≥65 mm Hg, urine output≥0.5 mL/kg/hr, and ScvO2≥70% or SvO2≥65%)에 도달한17) 환자의 비율은 현성 DIC 군에서 37.0% (10/27), 비현성 DIC 군에서 50% (31/62)로, 두 군 간의 유의한 통계적인 차이가 없었고, 생존군과 사망군 사이에서도 유의한 차이를 보이지 않았다.
생존군과 사망군 사이의 단변량 분석에서는 간담도계 패혈증(p=0.038), hematocrit (p=0.010), 혈소판(p<0.001), SOFA score (p=0.001), SAPS II (p<0.001), 현성 DIC (0.004)가 병원 사망과 의미있는 차이를 보여주었다. 이 변수들을 이용해 다변량 분석을 시행한 결과, SAPS II (OR, 1.064; 95% CI, 1.024~1.105; p=0.002)와 간담도계 패혈증(OR, 0.72; 95% CI, 0.006~0.920; p=0.043)이 의미있는 관련성을 보여주었고, 현성 DIC (OR, 3.121, 95% CI, 0.996~9.874; p=0.053)는 경계선 상의 관련성을 보여주었다.
Receiver operating characteristic (ROC) curve를 이용해 분석한 결과, 쇼크의 회복에 있어서 DIC score는 AUC (area under the curve) 값이 세 시점에서 각각 0.770 (p=0.005), 0.746(p=0.010), 0.787 (p=0.003)으로 전반적으로 높은 수치를 보여주었다(표 4). 중환자실 사망 및 병원 사망과 28일 사망에 대한 예측에서도 AUC 값이 대부분 0.7 이상으로 높은 수행 능력을 보여주었고, 특히 Day 0 보다는 Day 1과 Day 2에서의 AUC 값이 높게 나타났다(그림 4).
DIC는 중증의 패혈증이나 심한 외상에서 발생할 수 있는 현상으로 혈액응고체계의 활성화에 의해 섬유소와 미세혈관 혈전증이 발생하게 되고, 이로 인해 세포 및 조직에 손상을 가져오게 되어 다기관기능부전에 이르게 된다1,2). 패혈증은 중환자실의 주된 사망원인으로 패혈증에서의 DIC 발생률은 7~16% 정도이고, 패혈증쇼크에서는 73%까지 이를 수 있다는 보고가 있다13-16). 패혈증에서는 다기관기능부전이 발생할 수 있는데 정확한 병태생리에 대한 이해가 아직 부족하지만 혈액응고체계의 활성화가 중요한 기전으로 작용할 것으로 보고 있다. 우리나라에서는 패혈증쇼크에서 DIC의 발생률을 조사한 연구는 거의 없다. 또한, DIC의 임상적인 중요성에 대해서는 많은 이해가 이루어졌지만, 정확한 진단법에 대해서는 아직 확립된 것이 없다. 1990년대 일본의 Japnase Ministry of Health and Welfare (JMHW)에 의해서 DIC criteria가 제안된 바 있지만 임상적으로 유용성에 떨어진다는 단점이 있어 많이 이용되지는 않았다18,19). 2001년에는 International Society on Thrombosis and Heamostasis (ISTH)의 DIC 그룹이 JMHW의 기준을 수정하여 ISTH criteria를 발표하였다12). 이 그룹에서는 DIC를 ‘여러 원인에 의해 발생될 수 있고, 한 곳에 국한되지 않는 혈관내 응고체계의 활성화’로 정의하면서, 진단을 위해서는 패혈증과 같은 DIC가 발생하기 쉬운 기저질환이 있어야 한다고 주장하였다. 또, 혈액응고의 활성도를 직접 측정하는 것보다는 일반적인 혈액응고 검사가 응고인자의 소모 및 생성장애를 반영하는데 더 좋을 수 있다고 주장하였다. 이들의 ISTH criteria에서는 총 8점에서 5점 이상인 경우에 현성 DIC로 진단할 수 있는데, 최근 Bakhtiari 등에 의한 전향적 연구에서는 DIC score≥5점인 경우 민감도가 91%, 특이도가 97%로 그 임상적 유용성이 크다는 결과를 발표하였다11). 하지만 최근 Gando 등의 JAAM (Japanese Association for Acute Medicine) DIC 연구 그룹에서는 DIC의 발생에 SIRS(systemic inflammatory response syndrome)의 역할이 중요함을 강조하였고, 이를 진단기준에 포함시켜 새로운 scoring system(JAAM scoring system)을 만들었다. 이들은 274명의 중환자를 대상으로 JAAM scoring system과 기존의 JMHW와 ISTH criteria를 비교하였는데 JAAM scoring system을 이용한 경우 DIC의 진단률이 67.4%로 다른 두 가지(40.3% and 28.2%)보다 높았다고 보고하였다.
본 연구에서는 Taylor 등에 의한 ISTH criteria를 이용하여 중증패혈증 및 패혈증쇼크 환자에서 DIC의 빈도를 알아보았다. 본 연구의 결과를 보면 현성 DIC의 진단기준에 해당되는 환자는 Day 0, Day 1, Day 2에서 각각 18.0%. 30.7%, 22.4%였고, 입원 초기 48시간 동안의 현성 DIC의 발생률은 33.8%였다. 다기관기능부전을 나타내는 SOFA score와의 상관관계에서도 DIC score가 세 시점에서 유의한 관련성을 보여주었는데, 특히 현성 DIC 군에서 높은 SOFA score를 보여주었다. 이는 이전의 연구들에 부합되는 결과이고, 패혈증에서 발생하는 다기관기능부전이 DIC의 발생과 관련성이 있음을 시사한다고 볼 수 있다20). 다변량 분석에서는 혈소판과 lactic acid가 현성 DIC의 발생과 유의한 관련성을 보였는데, lactic acid의 증가가 패혈증에서 저산소증에 의한 조직손상과 관련이 있고, DIC에서는 미세혈관혈전증에 의한 다기관기능부전이 발생한다는 점을 고려한다면 현성 DIC가 lactic acid 증가와 관련성이 있다는 점이 설명될 수 있을 것으로 본다. 혈소판은 DIC score 안에 포함되는 변수로, 다변량 분석에서 현성 DIC와 유의한 관련성을 보인 것은 자연스런 결과라고 할 수 있겠다.
병원 사망에서는 간담도 패혈증과 입원 시의 SAPS II 점수가 유의한 관련성을 보였고, 현성 DIC는 경계선상의 유의성을 보였다. 본 연구에서 간담도 패혈증 환자가 낮은 사망률과 관련이 있는 것은 입원 시 중증도가 낮은 것과 관련이 있을 것으로 보이고, 현성 DIC의 발생이 병원 사망에 대해 비록 경계선상의 유의성을 보였으나, 더 광범위한 환자를 대상으로 연구를 시행한다면 유의한 결과를 기대할 수 있을 것으로 본다. 병원예후의 예측에 대한 ROC curves 분석에서는 DIC score가 쇼크의 회복과 중환자실 사망, 병원 사망, 28일 사망 등을 예측하는데 좋은 수행능력을 지녔음을 보여주었고, 이는 SOFA score와 비슷하였다(data not shown). 따라서 본 연구의 결과에 따르면 ISTH criteria가 환자의 장기부전의 진행 및 병원예후를 예측하는데 유용할 수 있다는 점을 확인할 수 있었다.
본 연구에서 다른 항응고인자에 대한 조사는 이루어지지 않았지만 Bakhtiari 등의 연구를 보면 DIC score가 증가할수록 antithrombin과 protein C activity가 감소하는 경향을 보여주었고, 28일 사망률도 증가하는 양상을 보여주었다11). 다기관기능부전의 측면에서도 Taylor 등의 ISTH 그룹은 DIC score 자체가 다기관기능부전을 나타내는 점수체계의 일부분이 될 수 있다고 말하였는데, Angstwurm 등의 연구를 보면 DIC score가 증가할수록 APACHE II score와 organ dysfunction score가 증가하는 경향을 보여주고 있어서, DIC score와 다기관기능부전 점수체계 사이에 상당한 관련성이 있음을 알 수 있었다20).
Taylor 등의 ISTH 그룹은, DIC scoring system이 DIC의 진단뿐만 아니라 환자의 중증도를 반영할 수 있다면, DIC 혹은 패혈증 치료에 있어서 혈액응고 체계(coagulation system)를 표적으로 하는 임상연구와 치료약 개발에 큰 도움이 될 수 있을 것이라고 주장한 바 있다12). 2001년 Bernard 등에 의해서는 중증패혈증 환자에서 drotrecogin alfa (recombinant human activated protein C, rhAPC)의 치료효과를 조사한 연구가 있었다8). 1,690명의 환자에 대해 무작위 대조군 연구를 시행하였는데 4일간의 drotrecogin alfa (rhAPC) 치료로 출혈의 빈도는 높았지만, rhAPC 치료군에서 D-dimer 및 interleukin-6 level이 감소하였고, 사망률이 의미있게 감소하였다는 결과를 보여주었다. 이후 Abraham 등에 의해는 위험도가 낮은(APACHE II<25 or one organ failure) 패혈증 환자에서 rhAPC가 치료효과가 없고, 오히려 심각한 출혈의 발생을 높일 수 있다는 결과를 발표하여, 현재는 APACHE II≥25이거나 다기관기능부전을 보이는 환자에게 제한적으로 사용이 권고되고 있다21). 추가적으로 Dhainaut 등이 위의 Bernard 등의 연구자료를 이용하여 사후분석을 시행하였는데, 흥미로운 점은 29%의 환자에서 ISTH criteria의 현성 DIC에 해당하였고, 이들에서의 rhAPC 치료에 의한 사망률 감소가 그렇지 않은 군(비현성 DIC)에서의 사망률 감소보다 더 컸다는 연구결과를 보여주었다(38% vs. 18%)22). 따라서 앞으로도 이른 시점에 DIC를 진단하고 치료한다면 패혈증을 포함한 많은 중증의 환자들에서 생존률을 향상시키는데 적지 않은 도움을 줄 수 있을 것으로 본다.
본 연구의 단점으로는 우선 일개의 대학병원에서 이루어진 소규모의 연구라는 점이다. 따라서 확인하지 못한 편이(bias)가 있을 것으로 판단되고, 본 연구에서의 현성 DIC의 빈도와 예후가 일개 병원의 결과임에 주의해야 할 것이다. 둘째, 결측치 자료가 있다는 점이다. Day 1과 Day 2에 DIC score를 측정하지 못한 환자가 각각 15.7%와 34.8%였다. 셋째, 본 연구에서는 protein C 활성도 및 antithrombin III 등 다른 응고인자들에 대한 검사가 이루어지지 않았다. 앞으로의 연구에서는 이러한 인자들에 대한 조사도 같이 이루어져야 할 것으로 보인다. 또한, APACHE II 점수체계에 대한 조사도 이루어 진다면 패혈증 환자에서 drotrecogin alfa (rhAPC)의 치료가 가능한 군에 대한 결과도 얻을 수 있을 것으로 본다. 하지만 지금까지 국내에서 패혈증 환자의 DIC 발생에 대한 연구는 없었기에 본 연구가 지니는 의미는 크다고 본다. 앞으로 drotrecogin alfa (rhAPC)와 같은 응고체계에 대한 표적 치료 연구가 활성화된다면 DIC가 발생한 패혈증 환자들의 생존율 향상을 기대해 볼 수도 있을 것으로 생각된다. 따라서 앞으로는 좀 더 광범위한 자료를 이용한 대규모 연구가 필요할 것으로 본다.
REFERENCES
2. Levi M, ten Cate H, van der Poll T, van Deventer SJ. Pathogenesis of disseminated intravascular coagulation in sepsis. JAMA 270:975–979, 1993.


3. Levi M, van der Poll T, ten Cate H, van Deventer SJ. The cytokine-mediated imbalance between coagulant and anticoagulant mechanisms in sepsis and endotoxaemia. Eur J Clin Invest 27:3–9, 1997.


5. Vervloet MG, Thijs LG, Hack CE. Derangements of coagulation and fibrinolysis in critically ill patients with sepsis and septic shock. Semin Thromb Hemost 24:33–44, 1998.


6. From the Centers for Disease Contro: increase in National Hospital Discharge Survey rates for septicemia-United States, 1979-1987. JAMA 263:937–938, 1990.
7. Angus DC, Birmingham MC, Balk RA, Scannon PJ, Collins D, Kruse JA, Graham DR, Dedhia HV, Homann S, MacIntyre N. E5 murine monoclonal antiendotoxin antibody in gram-negative sepsis: a randomized controlled trial: E5 study investigators. JAMA 283:1723–1730, 2000.


8. Bernard GR, Vincent JL, Laterre PF, LaRosa SP, Dhainaut JF, Lopez-Rodriguez A, Steingrub JS, Garber GE, Helterbrand JD, Ely EW, Fisher CJ Jr. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Engl J Med 344:699–709, 2001.


9. Conkling PR, Greenberg CS, Weinberg JB. Tumor necrosis factor induces tissue factor-like activity in human leukemia cell line U937 and peripheral blood monocytes. Blood 72:128–133, 1988.

10. Esmon CT, Taylor FB Jr, Snow TR. Inflammation and coagulation: linked processes potentially regulated through a common pathway mediated by protein C. Thromb Haemost 66:160–165, 1991.

11. Bakhtiari K, Meijers JC, de Jonge E, Levi M. Prospective validation of the International Society of Thrombosis and Haemostasis scoring system for disseminated intravascular coagulation. Crit Care Med 32:2416–2421, 2004.


12. Taylor FB Jr, Toh CH, Hoots WK, Wada H, Levi M. Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thromb Haemost 86:1327–1330, 2001.

13. Abraham E, Wunderink R, Silverman H, Perl TM, Nasraway S, Levy H, Bone R, Wenzel RP, Balk R, Allred R. Efficacy and safety of monoclonal antibody to human tumor necrosis factor alpha in patients with sepsis syndrome. A randomized, controlled, double-blind, multicenter clinical trial. TNF-alpha MAb Sepsis Study GroupJAMA 273:934–941, 1995.


14. Bone RC, Balk RA, Fein AM, Perl TM, Wenzel RP, Reines HD, Quenzer RW, Iberti TJ, Macintyre N, Schein RM. A second large controlled clinical study of E5, a monoclonal antibody to endotoxin: results of a prospective, multicenter, randomized, controlled trial. The E5 Sepsis Study Group. Crit Care Med 23:994–1006, 1995.


15. Fisher CJ Jr, Dhainaut JF, Opal SM, Pribble JP, Balk RA, Slotman GJ, Iberti TJ, Rackow EC, Shapiro MJ, Greenman RL. Recombinant human interleukin 1 receptor antagonist in the treatment of patients with sepsis syndrome. Results from a randomized, double-blind, placebo-controlled trial. Phase III rhIL-1ra Sepsis Syndrome Study Group. JAMA 271:1836–1843, 1994.


16. Rangel-Frausto MS, Pittet D, Costigan M, Hwang T, Davis CS, Wenzel RP. The natural history of the systemic inflammatory response syndrome (SIRS). A prospective study. JAMA 273:117–123, 1995.


17. Dellinger RP, Levy MM, Carlet JM, Bion J, Parker MM, Jaeschke R, Reinhart K, Angus DC, Brun-Buisson C, Beale R, Calandra T, Dhainaut JF, Gerlach H, Harvey M, Marini JJ, Marshall J, Ranieri M, Ramsay G, Sevransky J, Thompson BT, Townsend S, Vender JS, Zimmerman JL, Vincent JL. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Crit Care Med 36:296–327, 2008.


18. Gando S, Kameue T, Nanzaki S, Nakanishi Y. Disseminated intravascular coagulation is a frequent complication of systemic inflammatory response syndrome. Thromb Haemost 75:224–228, 1996.

19. Wada H, Gabazza EC, Asakura H, Koike K, Okamoto K, Maruyama I, Shiku H, Nobori T. Comparison of diagnostic criteria for disseminated intravascular coagulation (DIC): diagnostic criteria of the International society of thrombosis and hemostasis and of the Japanese ministry of health and welfare for overt DIC. Am J Hematol 74:17–22, 2003.


20. Angstwurm MW, Dempfle CE, Spannagl M. New disseminated intravascular coagulation score: a useful tool to predict mortality in comparison with Acute Physiology and Chronic Health Evaluation II and Logistic Organ Dysfunction scores. Crit Care Med 34:314–320, 2006.


21. Abraham E, Laterre PF, Garg R, Levy H, Talwar D, Trzaskoma BL, Francois B, Guy JS, Bruckmann M, Rea-Neto A, Rossaint R, Perrotin D, Sablotzki A, Arkins N, Utterback BG, Macias WL. Drotrecogin alfa (activated) for adults with severe sepsis and a low risk of death. N Engl J Med 353:1332–1341, 2005.


Distribution of DIC scores according to the ISTH (International Society on Thrombosis and Haemostasis) criteria in patients with severe sepsis or septic shock.
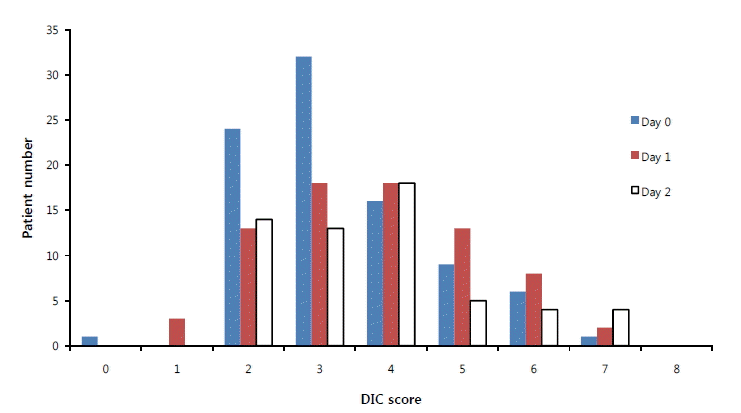
Figure 1.
Correlations between DIC and SOFA scores. The DIC scores were relatively well correlated with the SOFA scores on Days 0 (A), 1 (B), and 2 (C) (r=0.384, p=0.009; r=0.538, p<0.001; r=0.543, p<0.001, respectively).
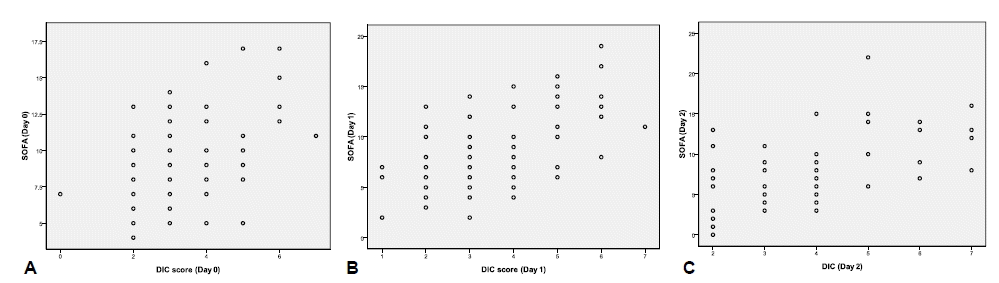
Figure 2.
Comparison of DIC and SOFA scores between survivors and non-survivors. The DIC scores were significantly higher in survivors than in non-survivors on Days 0, 1, and 2 (p=0.004, p<0.001, and p=0.001, respectively) (A). The SOFA scores were significantly higher in survivors than in non-survivors on Days 0, 1, and 2 (p=0.001, p<0.001, and p=0.001, respectively) (B).
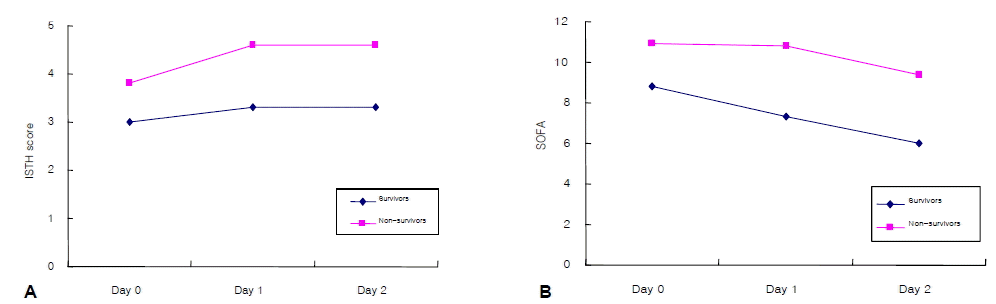
Figure 3.
Receiver operating characteristic (ROC) curves for the DIC score for predicting hospital outcome. The values of the area under the curves (AUC) for predicting shock recovery on Days 0 (-), 1 (…), and 2 (-·-) were 0.770, 0.746, and 0.787, respectively (A). The AUC values for predicting ICU death were 0.702, 0.732, and 0.753, respectively (B). The AUC values for predicting hospital death were 0.692, 0.726, and 0.767, respectively (C). The AUC values for predicting 28-day death were 0.718, 0.753, and 0.780, respectively (D).
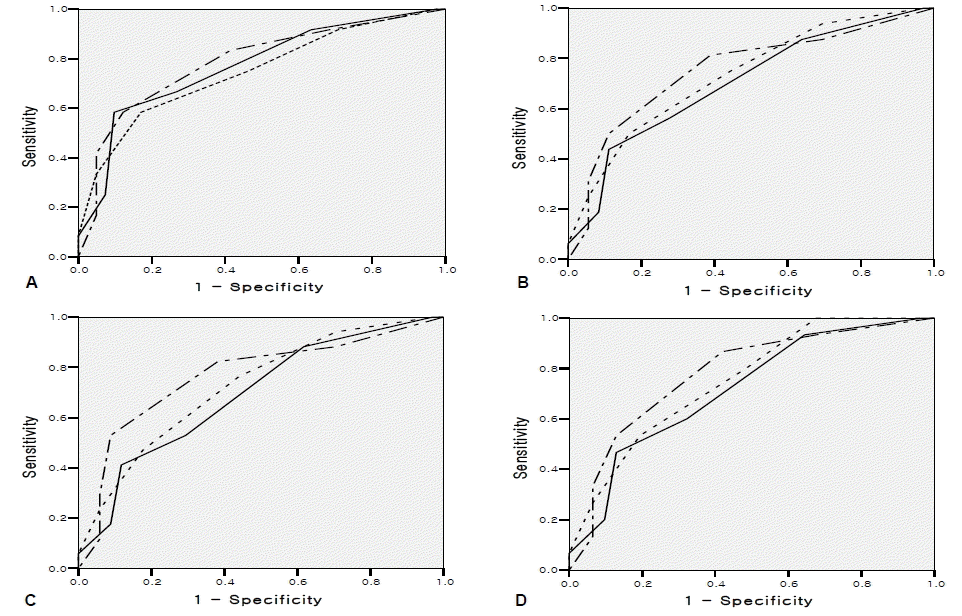
Figure 4.
Table 1.
Table 2.
Baseline characteristics of the patients with and without overt DIC
Table 3.
Comparison of the hospital outcomes between patients with and without overt DIC
Table 4.
Univariate analyses of predictors of hospital death
- TOOLS
-
 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link XML Download
XML Download Full text via DOI
Full text via DOI-
 Download Citation
Download Citation
 Print
Print-
Share :








