 |
 |
| Korean J Med > Volume 82(3); 2012 > Article |
|
мҡ”м•Ҫ
мҰқлЎҖлҠ” Aнҳ• лҢҖлҸҷл§Ҙл°•лҰ¬лЎң мҲҳмҲ н•ң нҷҳмһҗм—җм„ң лӮЁм•„ мһҲлҚҳ нқүліөл¶ҖлҢҖлҸҷл§Ҙмқҳ Bнҳ• л°•лҰ¬м„ұ лҢҖлҸҷл§ҘлҘҳмқҳ кұ°м§“лӮҙк°• лӮҙ кіјлҸ„н•ң нҳҲм „нҳ•м„ұм—җ мқҳн•ң көӯмҶҢм Ғмқё мқ‘кі мһҘм• лЎң мқён•ҳм—¬ м „мӢ м ҒмңјлЎң DICк°Җ л°ңмғқн•ҳмҳҖкі , DICмқҳ м№ҳлЈҢлҘј мң„н•ҙ м Җ분мһҗлҹүн—ӨнҢҢлҰ° мӮ¬мҡ© мӨ‘ л‘җк°ңлӮҙм¶ңнҳҲ л°ңмғқн•ҳм—¬ лӢЁл°ұ분н•ҙнҡЁмҶҢм–өм ңм ң м№ҳлЈҢ нӣ„ DICк°Җ нҳём „лҗң мҳҲмқҙлӢӨ. лӢЁл°ұ분н•ҙнҡЁмҶҢм–өм ңм ңлҠ” лҢҖлҸҷл§Ҙл°•лҰ¬ нӣ„ л°ңмғқн•ҳлҠ” DIC м№ҳлЈҢм—җ кё°мЎҙмқҳ м№ҳлЈҢм—җ л°ҳмқ‘н•ҳм§Җ м•Ҡкұ°лӮҳ, л‘җк°ңлӮҙм¶ңнҳҲкіј к°ҷмқҙ м¶ңнҳҲмқ„ лҸҷл°ҳн•ң н•©лі‘мҰқмқҙ мһҲм–ҙ н•ӯмқ‘кі м ңмқҳ мӮ¬мҡ©мқҙ л¶Ҳк°Җн•ң кІҪмҡ° DIC м№ҳлЈҢлЎң кі л Өн• мҲҳ мһҲлӢӨ.
Abstract
Disseminated intravascular coagulation (DIC) is a rare complication of aortic dissection. We report an unusual case of a 64-year-old woman with DIC associated with chronic aortic dissection who developed catastrophic intracranial hemorrhage. Computed tomography (CT) revealed partially thrombosed false lumen in the chronic dissected aneurysm of the thoracoabdominal aorta, which remained after surgery for acute type A aortic dissection. The laboratory profile showed features of DIC, including thrombocytopenia, hypofibrinogenemia, and increased D-dimer levels. Bleeding diathesis, including ecchymosis and coagulopathy, showed improvement following treatment with protease inhibitors (nafamostat and camostat). (Korean J Med 2012;82:341-346)
нҢҢмў…м„ұнҳҲкҙҖлӮҙмқ‘кі (disseminated intravascular coagulation, DIC)лҠ” нҳҲмҶҢнҢҗ, нҳҲм•Ўмқ‘кі мқёмһҗл“Өмқҳ кіјмҶҢлӘЁлЎң м¶ңнҳҲмқ„ мқјмңјнӮӨлҠ” лі‘м Ғмқё мғҒнғңлҘј л§җн•ҳл©°, к·ё мӣҗмқёмңјлЎңлҠ” к°җм—ј, м•…м„ұ мў…м–‘, к°„л¶Җм „, мӢ¬н•ң нҷ”мғҒ, мӮ°кіјм§Ҳнҷҳ л“ұмқҙ мһҲлӢӨ. лҢҖлҸҷл§Ҙл°•лҰ¬мҷҖ м—°кҙҖлҗң DICлҠ” Fine л“ұ[1]мқҙ л°•лҰ¬м„ұ лҢҖлҸҷл§ҘлҘҳмҷҖ DIC кҙҖкі„лҘј ліҙкі н•ң мқҙнӣ„ мҲҳмӢӯ мҳҲмқҳ ліҙкі [2-8]к°Җ мһҲм—Ҳмңјл©° көӯлӮҙм—җлҸ„ Yoon л“ұ[9]мқҙ ліҙкі н•ң мҳҲк°Җ мһҲлӢӨ. л°ңмғқкё°м „мқҖ лӘ…нҷ•н•ҳм§Җ м•ҠмңјлӮҳ нҳҲкҙҖлӮҙлІҪмқҳ ліҖнҷ”лЎң мқён•ҙ нҳҲм•Ўмқ‘кі кі„к°Җ нҷңм„ұнҷ”лҗҳм–ҙ мқ‘кі мқёмһҗк°Җ кіјмҶҢлӘЁ лҗҳм–ҙ л°ңмғқн•ңлӢӨлҠ” к°Җм„Ө[10] л“ұмқҙ мһҲлӢӨ. лҢҖлҸҷл§Ҙл°•лҰ¬мҷҖ м—°кҙҖлҗң DICмқҳ м№ҳлЈҢлҠ” мӣҗмқёмқҙ лҗҳлҠ” лҢҖлҸҷл§Ҙл°•лҰ¬мқҳ мҲҳмҲ мқ„ кі л Өн•ҳм§Җл§Ң м¶ңнҳҲ мң„н—ҳм„ұмңјлЎң мқён•ҙ мҲҳмҲ мқҙ м–ҙл Өмҡҙ кІҪмҡ°м—җлҠ” нҳҲкҙҖ лӮҙ мҠӨн…җнҠё мӮҪмһ…мҲ лҳҗлҠ” мҲҳнҳҲмқ„ нҶөн•ң мқ‘кі мһҘм• көҗм • л°Ҹ н•ӯмқ‘кі м ң л“ұмқҳ м•Ҫл¬јм№ҳлЈҢлІ•мқҙ мһҲлӢӨ. мқҙлҹ¬н•ң м№ҳлЈҢк°Җ л¶Ҳк°ҖлҠҘн•ҳкұ°лӮҳ л°ҳмқ‘н•ҳм§Җ м•Ҡмқ„ кІҪмҡ° мөңк·ј лӢЁл°ұм§Ҳ분н•ҙнҡЁмҶҢм ңлҘј нҲ¬м—¬к°Җ мӢңлҸ„лҗҳкі мһҲмңјл©°, мқҙлҘј мқҙмҡ©н•ң лҢҖлҸҷл§Ҙл°•лҰ¬мҷҖ м—°кҙҖлҗң DICмқҳ м№ҳлЈҢлҠ” 2мҳҲмқҳ ліҙкі [7,8]к°Җ мһҲмқ„ лҝҗмқҙл©° көӯлӮҙм—җ ліҙкі лҗң мҳҲлҠ” м—ҶлӢӨ.
м Җмһҗл“ӨмқҖ 64м„ё м—¬мһҗ нҷҳмһҗм—җм„ң Aнҳ• лҢҖлҸҷл§Ҙл°•лҰ¬лЎң мғҒн–үлҢҖлҸҷл§Ҙ мҲҳмҲ нӣ„ лӮЁм•„ мһҲлҚҳ н•ҳн–үлҢҖлҸҷл§Ҙмқҳ л§Ңм„ұ Bнҳ• лҢҖлҸҷл§Ҙл°•лҰ¬мҷҖ м—°кҙҖлҗң DICлЎң м Җ분мһҗлҹүн—ӨнҢҢлҰ°мқ„ нҶөн•ң ліҙмЎҙм Ғ м№ҳлЈҢ мӨ‘ лҮҢм¶ңнҳҲмқҙ л°ңмғқн•ҳмҳҖкі , м§ҖмҶҚлҗҳлҠ” DIC м№ҳлЈҢ мң„н•ҙ лӢЁл°ұм§Ҳ분н•ҙнҡЁмҶҢм–өм ңм ңлҘј мӮ¬мҡ©н•ҳм—¬ нҳём „лҗң мҳҲлҘј көӯлӮҙ мІ« кІҪн—ҳн•ҳм—¬ ліҙкі н•ҳлҠ” л°”мқҙлӢӨ.
нҷҳ мһҗ: 64м„ё, м—¬мһҗ
мЈј мҶҢ: м „мӢ мқҳ л°ҳмғҒм¶ңнҳҲ
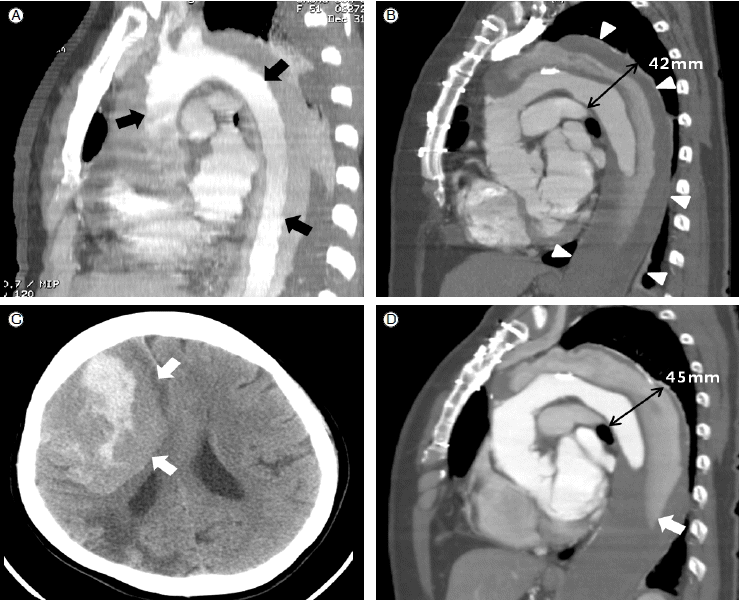
кіјкұ°л Ҙ л°Ҹ нҳ„лі‘л Ҙ: нҷҳмһҗлҠ” 1998л…„ кёүм„ұ Aнҳ• лҢҖлҸҷл§Ҙл°•лҰ¬(Fig. 1A)лЎң мғҒн–үлҢҖлҸҷл§Ҙм№ҳнҷҳмҲ мқ„ мӢңн–ү нӣ„ нҠ№мқҙ мҰқмғҒ м—Ҷмқҙ мҷёлһҳ 추м Ғ кҙҖм°°н•ҳлҚҳ мӨ‘ 2006л…„ 9мӣ” мүҪкІҢ л©Қмқҙ л“ңлҠ” мҰқмғҒкіј мһҮлӘё м¶ңнҳҲлЎң мҷёлһҳ лӮҙмӣҗн•ҳмҳҖлӢӨ. кІҖмӮ¬мӢӨ кІ°кіј fibrinogen 142 mg/dL, FDP 80 ug/dL, D-dimer 25.8 ug/mLлЎң м¶ңнҳҲм„ұ кІҪн–Ҙмқ„ ліҙмҳҖлӢӨ(Table 1). м»ҙн“Ён„° лӢЁмёөмҙ¬мҳҒмғҒ мғҒн–үлҢҖлҸҷл§ҘмқҖ мқёмЎ°нҳҲкҙҖмңјлЎң м№ҳнҷҳлҗҳм–ҙ мһҲм—Ҳмңјл©°, лҢҖлҸҷл§Ҙнҷңкіј н•ҳн–үлҢҖлҸҷл§Ҙмқҳ мһ”лҘҳ Bнҳ• л°•лҰ¬м„ұ лҢҖлҸҷл§ҘлҘҳ(м§ҒкІҪ 42 mm)мқҳ кұ°м§“лӮҙк°•(false lumen)м—җлҠ” лӢӨлҹүмқҳ нҳҲм „мқҙ нҳ•м„ұлҗҳм–ҙ мһҲм—ҲлӢӨ(Fig. 1B). л§Ңм„ұ л°•лҰ¬м„ұ лҢҖлҸҷл§ҘлҘҳм—җ лҸҷл°ҳлҗң DIC 진лӢЁн•ҳм—җ м Җ분мһҗлҹүн—ӨнҢҢлҰ° н”јн•ҳмЈјмӮ¬ м№ҳлЈҢн•ҳл©ҙм„ң кІҪкіјкҙҖм°° мӢңн–үн•ҳмҳҖлӢӨ. нҷҳмһҗлҠ” к·ё нӣ„м—җлҸ„ мҲҳ м°ЁлЎҖ мһҗм—°м Ғмқё л°ҳмғҒм¶ңнҳҲ л°Ҹ м—үлҚ©мқҙ, лҢҖнҮҙл¶Җ, мў…м•„лҰ¬ л“ұмқҳ нҳҲмў…мңјлЎң к°„н—җм Ғмқё мӢ м„ лғүлҸҷнҳҲмһҘ мҲҳнҳҲкіј м§ҖмҶҚм Ғмқё enoxaparin 60 mg 2мқјм—җ н•ңлІҲ н”јн•ҳмЈјмӮ¬ м№ҳлЈҢлҘј л°ӣм•„ мҷ”лӢӨ. 2009л…„ 3мӣ” к°‘мһ‘мҠӨлҹ¬мҡҙ л‘җнҶөкіј н•Ёк»ҳ мўҢмёЎ нҺёл§Ҳ비 нҳёмҶҢн•ҳм—¬ ліёмӣҗ мқ‘кёүмӢӨ лӮҙмӣҗн•ҳмҳҖлӢӨ.
к°ҖмЎұл Ҙ: м•„лІ„м§Җк°Җ мӢ¬мһҘл§Ҳ비лЎң мӮ¬л§қн•ҳмҳҖмңјл©° м–ҙлЁёлӢҲлҠ” лӢ№лҮЁмҷҖ кі нҳҲм•• м№ҳлЈҢлҘј л°ӣм•ҳлӢӨ.
мӢ мІҙ кІҖмӮ¬ мҶҢкІ¬: мӢ мІҙ징нӣ„лҠ” нҳҲм••мқҙ 125/54 mmHg, л§Ҙл°• 분лӢ№ 76нҡҢ, мІҙмҳЁ 36.4в„ғмҳҖкі , мқҳмӢқмқҖ нҳјлҜён•ҳмҳҖлӢӨ(Glasgow coma scale E3V1M5). лҲҲ мЈјмң„, н„ұ, м–ҙк№Ё, нҢ”, к°ҖмҠҙ л°Ҹ ліөл¶Җм—җ л°ҳмғҒм¶ңнҳҲмқ„ ліҙмҳҖлӢӨ.
кІҖмӮ¬ мҶҢкІ¬: л§җмҙҲнҳҲм•Ў кІҖмӮ¬мғҒ л°ұнҳҲкө¬ 10,890/uL, нҳҲмғүмҶҢ 8.5 g/dL, нҳҲмҶҢнҢҗ 53,000/uLмқҳ мҶҢкІ¬мқ„ ліҙмҳҖлӢӨ. нҳҲм•Ўмқ‘кі кІҖмӮ¬м—җм„ң prothrombin time 17.7 sec, APTT 38.8 sec, fibrinogen 66 mg/dL, D-dimer 16.6 ug/mLмқҙм—ҲлӢӨ(Table 1). нҳҲм•Ўнҷ”н•ҷ кІҖмӮ¬м—җм„ң total bilirubin 1.5 mg/dL, albumin 3.5 g/dL, AST 25 U/L, ALT 26 U/L, BUN 27.2 mg/dL, creatinine 0.8 mg/dLмқҙм—Ҳкі , м „н•ҙм§Ҳ мқҙмғҒмқҖ м—Ҷм—ҲлӢӨ.
мҳҒмғҒн•ҷм Ғ кІҖмӮ¬мҶҢкІ¬: лҮҢ м»ҙн“Ён„° лӢЁмёөмҙ¬мҳҒмғҒ л‘җк°ңлӮҙ м¶ңнҳҲ мҶҢкІ¬ ліҙмҳҖлӢӨ(Fig. 1C). нқүліөл¶ҖлҢҖлҸҷл§Ҙ м»ҙн“Ён„° лӢЁмёөмҙ¬мҳҒм—җм„ңлҠ” мғҒн–үлҢҖлҸҷл§Ҙмқҳ лҢҖлҸҷл§Ҙл°•лҰ¬ мҲҳмҲ л¶Җмң„ л°Ҹ лҢҖлҸҷл§Ҙнҷңл¶Җн„° мҡ°мёЎ мҳЁм—үлҚ©лҸҷл§Ҙк№Ңм§Җмқҳ лҢҖлҸҷл§Ҙл°•лҰ¬лҠ” мқҙм „кіј нҒ° ліҖнҷ”к°Җ м—Ҷм—ҲлӢӨ. 2006л…„ CT мҶҢкІ¬м—җ 비н•ҳм—¬ н•ҳн–үлҢҖлҸҷл§Ҙмқҳ мһ”лҘҳ л°•лҰ¬м„ұ лҢҖлҸҷл§ҘлҘҳмқҳ мөңлҢҖ м§ҒкІҪмқҖ 45 mmлЎң мҰқк°Җлҗҳм—Ҳкі , кұ°м§“лӮҙк°• лӮҙмқҳ нҳҲм „лҸ„ мҰқк°Җлҗҳм—ҲлӢӨ(Fig. 1D). нҳҲм „мқҖ кұ°м§“лӮҙк°• лӮҙл¶Җмқҳ кіөк°„мқ„ лӢӨ мұ„мҡ°м§Җ лӘ»н•ң мғҒнғңлЎң м»ҙн“Ён„° лӢЁмёөмҙ¬мҳҒмғҒ Hounsfield units (HU)мқҖ 57-89 HUмңјлЎң мҳӨлһҳлҗң нҳҲм „кіј мӢ м„ нҳҲм „(fresh thrombus)мқҙ м„һм—¬ мһҲлҠ” м–‘мғҒмқ„ ліҙмқҙкі мһҲм—ҲлӢӨ.
м№ҳлЈҢ л°Ҹ мһ„мғҒкІҪкіј: мӢ м„ лғүлҸҷнҳҲмһҘ 3 units, нҳҲмҶҢнҢҗ 8 units мҲҳнҳҲ нӣ„ мқ‘кёү к°ңл‘җмҲ л°Ҹ нҳҲмў…м ңкұ°мҲ мӢңн–үн•ҳмҳҖлӢӨ. мҲҳмҲ нӣ„м—җлҸ„ мӢ м„ лғүлҸҷнҳҲмһҘкіј нҳҲмҶҢнҢҗ мҲҳнҳҲмқ„ кі„мҶҚн•ҳмҳҖмңјлӮҳ м¶ңнҳҲм„ұ кІҪн–Ҙ л°Ҹ м „мӢ мқҳ л°ҳмғҒм¶ңнҳҲмқҖ м§ҖмҶҚлҗҳм—ҲлӢӨ(Fig. 2A-2D).
мқ‘кі мқёмһҗ л°Ҹ нҳҲмҶҢнҢҗмқҳ мҲҳнҳҲлЎң м№ҳлЈҢлҗҳм§Җ м•ҠлҠ” лҢҖлҸҷл§Ҙл°•лҰ¬мҷҖ м—°кҙҖлҗң DIC м•…нҷ”лЎң нҢҗлӢЁн•ҳм—¬ мҲҳмҲ нӣ„ 11мқјл¶Җн„° nafamostat 100 mg/day м •л§ҘмЈјмӮ¬ мӢңн–үн•ҳмҳҖлӢӨ. Nafamostat м •л§ҘмЈјмӮ¬ мӢңн–ү нӣ„ DIC кІҖмӮ¬кІ°кіј м җм°Ё нҳём „лҗҳл©ҙм„ң(Table 1), лҲҲ мЈјмң„ л°Ҹ м „мӢ м—җ кұём№ң л°ҳмғҒм¶ңнҳҲлҸ„ нҳём „лҗҳлҠ” м–‘мғҒмқ„ ліҙмҳҖлӢӨ. Nafamostat м •л§ҘмЈјмӮ¬ м№ҳлЈҢ 21мқјм§ё nafamostatм—җм„ң кІҪкө¬нҲ¬м—¬ к°ҖлҠҘн•ң camostat 600 mg/dayлЎң ліҖкІҪн•ҳмҳҖлӢӨ. CamostatмңјлЎң ліҖкІҪн•ң мқҙнӣ„м—җлҸ„ DIC нҳём „лҗҳлҠ” 추세 ліҙмҳҖмңјл©° лҲҲ мЈјмң„ л°Ҹ м „мӢ мқҳ л°ҳмғҒм¶ңнҳҲмқҖ кұ°мқҳ мҶҢмӢӨлҗҳм—ҲлӢӨ(Fig. 2E-2H). нҷҳмһҗмқҳ мһ„мғҒкІҪкіј л°Ҹ м№ҳлЈҢм—җ л”°лҘё кІҖмӮ¬кІ°кіјмқҳ ліҖлҸҷмқ„ к·ёлҰј 3м—җ н‘ңмӢңн•ҳмҳҖлӢӨ. DICмқҳ к·јліё мӣҗмқёмқё л§Ңм„ұ лҢҖлҸҷл§Ҙл°•лҰ¬м—җ лҢҖн•ҙ 추нӣ„ мҲҳмҲ лҳҗлҠ” мҠӨн…җнҠё мӮҪмһ…мҲ мқ„ кі л Өн•ҳкё°лЎң н•ҳкі м№ҳлЈҢ 25мқјм§ё нҮҙмӣҗн•ҳмҳҖлӢӨ.
DICлҠ” лӢӨм–‘н•ң мһ„мғҒм Ғ мӣҗмқём—җ мқҳн•ҙ л°ңмғқн•ҳлҠ” мҶҢлӘЁм„ұ мқ‘кі мҰқ(consumption coagulopathy)мңјлЎң к°җм—ј, м•…м„ұ мў…м–‘, к°„л¶Җм „, мӢ¬н•ң нҷ”мғҒ, мӮ°кіјм§Ҳнҷҳ л“ұмқҳ мӣҗмқёкіј м—°кҙҖлҗҳм–ҙ мһҲлӢӨ. лҢҖлҸҷл§Ҙл°•лҰ¬мҷҖ м—°кҙҖлҗң DICлҠ” лҢҖлҸҷл§Ҙл°•лҰ¬мқҳ л“ңл¬ё н•©лі‘мҰқмңјлЎңм„ң 1967л…„ л°•лҰ¬м„ұ лҢҖлҸҷл§ҘлҘҳлҘј к°Җ진 нҷҳмһҗм—җм„ң м¶ңнҳҲм„ұ кІҪн–Ҙмқ„ ліҙмқё кІғмқ„ Fine л“ұ[1]мқҙ мөңмҙҲлЎң ліҙкі н•ң мқҙнӣ„ лҢҖлҸҷл§Ҙл°•лҰ¬мҷҖ м—°кҙҖлҗң DICм—җ лҢҖн•ҳм—¬ м „ м„ёкі„м ҒмңјлЎң м•Ҫ 40мҳҲмқҳ ліҙкі к°Җ мһҲлӢӨ.
ліё мҰқлЎҖлҠ” Aнҳ• лҢҖлҸҷл§Ҙл°•лҰ¬ мҲҳмҲ нӣ„ лӮЁм•„мһҲлҚҳ Bнҳ• лҢҖлҸҷл§Ҙл°•лҰ¬мқҳ кұ°м§“лӮҙк°• лӮҙмқҳ көӯмҶҢм„ұнҳҲкҙҖлӮҙмқ‘кі (localized intravascular coagulation)м—җ мқҳн•ң м „мӢ м Ғмқё DICк°Җ л°ңмғқн•ң мҳҲлЎң м „мӢ мқҳ мһҗм—°м Ғмқё л°ҳмғҒм¶ңнҳҲ л°Ҹ нҳҲмў…мқҳ л°ңмғқм—җ лҢҖн•ҳм—¬ н•ӯмқ‘кі м ң л°Ҹ мқ‘кі мқёмһҗ мҲҳнҳҲлЎң м№ҳлЈҢн•ҙ мҳӨлҚҳ мӨ‘ л‘җк°ңлӮҙ м¶ңнҳҲмқҙ л°ңмғқн•ҳмҳҖкі , кё°мЎҙ м№ҳлЈҢлЎңлҠ” м¶ңнҳҲм„ұ м„ұн–Ҙмқҳ нҳём „мқҙ м—Ҷм–ҙ лӢЁл°ұм§Ҳ분н•ҙнҡЁмҶҢм–өм ңм ңлЎң мӮ¬мҡ©н•ҳм—¬ м№ҳлЈҢн•ң көӯлӮҙ мІ« ліҙкі мҳҲмқҙлӢӨ.
лҢҖлҸҷл§Ҙл°•лҰ¬мҷҖ м—°кҙҖлҗң DIC л°ңмғқкё°м „мқҖ лӘ…нҷ•н•ҳм§Җ м•ҠмңјлӮҳ Ten Cate л“ұ[10]мқҖ кёүм„ұлҢҖлҸҷл§Ҙл°•лҰ¬ м§Ғнӣ„ л°ңмғқн•ҳлҠ” кёүм„ұ DICмқҳ мӣҗмқёмқҖ лҢҖлҸҷл§Ҙл°•лҰ¬лЎң л…ём¶ңлҗң лӮҙн”јл°‘мЎ°м§Ғ(subendothelial tissue) лҳҗлҠ” нҳҲм „мғқм„ұл¬јм§ҲлЎң мқён•ҙ нҳҲм•Ўмқ‘кі кі„к°Җ нҷңм„ұнҷ”лҗҳм–ҙ мқ‘кі мқёмһҗк°Җ мҶҢлӘЁлҗҳкё° л•Ңл¬ёмқҙлқјлҠ” к°Җм„Өмқ„ м ңмӢңн•ҳмҳҖлӢӨ. Nakajima л“ұ[2]мқҖ Aнҳ• лҢҖлҸҷл§Ҙл°•лҰ¬ мҲҳмҲ нӣ„ л°ңмғқн•ң л§Ңм„ұ DICмқҳ л°ңмғқкё°м „мқҖ кұ°м§“лӮҙк°• лӮҙмқҳ лӮңлҘҳ(turbulent flow)лЎң мқён•ҙ мқ‘кі мқёмһҗк°Җ нҢҢкҙҙлҗҳм–ҙ л°ңмғқн•ҳмҳҖмқ„ кІғмқҙлқјкі мЈјмһҘн•ҳмҳҖкі , нҠ№нһҲ DIC л°ңмғқмқҖ л°•лҰ¬лҗң лҢҖлҸҷл§Ҙмқҳ кёёмқҙліҙлӢӨлҠ” лҠҳм–ҙлӮң м§ҒкІҪкіј лҚ” м—°кҙҖлҗҳм—Ҳмқ„ кІғмқҙлқј ліҙкі н•ҳмҳҖлӢӨ. ліё мҰқлЎҖм—җм„ң нҷҳмһҗлҠ” кёүм„ұ Aнҳ• лҢҖлҸҷл§Ҙл°•лҰ¬мқҳ мғҒн–үлҢҖлҸҷл§Ҙ мҲҳмҲ нӣ„ н•ҳн–үлҢҖлҸҷл§Ҙм—җ мһ”лҘҳ л§Ңм„ұ лҢҖлҸҷл§Ҙл°•лҰ¬к°Җ мһҲм—Ҳкі , кұ°м§“лӮҙк°•мқҳ 3분мқҳ 2м •лҸ„ нҳҲм „мқҙ м°Ём§Җн•ҳл©ҙм„ң, нҳҲм „мқҳ м–‘мғҒмқҙ м»ҙн“Ён„° лӢЁмёөмҙ¬мҳҒмғҒ мҳӨлһҳлҗң кё°м§Ҳнҷ”нҳҲм „кіј мӢ м„ нҳҲм „мқҙ нҳјмһ¬лҗң м–‘мғҒмқ„ ліҙмҳҖлӢӨ. мқҙлҠ” кұ°м§“лӮҙк°• лӮҙм—җ нҳҲм „мқҙ м§ҖмҶҚм ҒмңјлЎң нҳ•м„ұ вҶ’ мҡ©н•ҙ вҶ’ нҳ•м„ұмқҳ кіјм •мқ„ л°ҳліөн•ҳл©ҙм„ң мҡ°лҰ¬ лӘёмқҳ мқ‘кі мқёмһҗлҘј кіјлҸ„н•ҳкІҢ мҶҢлӘЁн•ҳм—¬ мҶҢлӘЁм„ұ мқ‘кі м§Ҳнҷҳм—җ мқҳн•ң DICк°Җ л°ңмғқлҗҳм—Ҳмқ„ кІғмңјлЎң м¶”м •лҗңлӢӨ. мқҙлҹ¬н•ң DICлҠ” лҢҖлҸҷл§Ҙл°•лҰ¬мқҳ кұ°м§“лӮҙк°•мқҙ мҷ„м „нһҲ нҳҲм „мңјлЎң мұ„мӣҢм§Җкұ°лӮҳ лҢҖлҸҷл§Ҙл°•лҰ¬мқҳ мң мһ…л¶Җ(entry site)мҷҖ мһ¬мң мһ…л¶Җ(reentry site)к°Җ мң м§Җлҗҳм–ҙ кұ°м§“лӮҙк°• лӮҙлЎң нҳҲлҘҳк°Җ мһҗмң лЎңмқҙ нқҗлҘҙл©ҙ л°ңмғқн•ҳм§Җ м•Ҡмқ„ кІғмңјлЎң мғқк°Ғн•ңлӢӨ. л”°лқјм„ң ліё мҳҲм—җм„ңмҷҖ к°ҷмқҙ мһ¬мң мһ…л¶ҖлҠ” л§үнҳҖ мһҲм–ҙ нҳҲм „мқҖ нҳ•м„ұлҗҳкі мң мһ…л¶ҖлЎңлҠ” м§ҖмҶҚм ҒмңјлЎң нҳҲлҘҳк°Җ мң мһ…лҗҳм–ҙ нҳҲм „мқҳ мғқм„ұкіј мҶҢл©ёмқҙ л°ҳліөлҗ кІҪмҡ° DICк°Җ нҳёл°ңлҗ кІғмңјлЎң мҳҲмёЎлҗңлӢӨ.
лҢҖлҸҷл§Ҙл°•лҰ¬мҷҖ м—°кҙҖлҗң DICмқҳ м№ҳлЈҢлҠ” мҲҳмҲ м Ғ л°©лІ•кіј м•Ҫл¬јмҡ”лІ•мқҙ мһҲлӢӨ. к·јліём Ғмқё м№ҳлЈҢлҠ” DICмқҳ мӣҗмқё м§Ҳнҷҳмқё лҢҖлҸҷл§Ҙл°•лҰ¬лҘј көҗм •н•ҳлҠ” кІғмңјлЎң лҢҖлҸҷл§Ҙл°•лҰ¬м—җ лҢҖн•ң мҲҳмҲ [3,8] лҳҗлҠ” нҳҲкҙҖ лӮҙ мҠӨн…җнҠё мӮҪмһ…мҲ [11] м№ҳлЈҢ нӣ„ DICк°Җ нҳём „лҗң ліҙкі к°Җ мһҲлӢӨ.
м•Ҫл¬ј м№ҳлЈҢлҠ” мӣҗмқё м§Ҳнҷҳмқҳ м№ҳлЈҢм—җ ліҙмЎ°м ҒмңјлЎң мӮ¬мҡ©лҗҳлӮҳ мҲҳмҲ мқҙ м–ҙл өкұ°лӮҳ нҳҲм—ӯн•ҷм ҒмңјлЎң л¶Ҳм•Ҳм •н•ң нҷҳмһҗмқҳ кІҪмҡ° мҡ°м„ м ҒмңјлЎң мӮ¬мҡ©лҗңлӢӨ. м•Ҫл¬ј м№ҳлЈҢлЎңлҠ” мІ«м§ё, кІ°н•Қлҗң нҳҲмҶҢнҢҗ л°Ҹ мқ‘кі мқёмһҗлҘј мҲҳнҳҲлЎң ліҙ충н•ҳм—¬ мЈјкұ°лӮҳ л‘ҳм§ё, мқ‘кі мқёмһҗмқҳ л¶ҖмЎұмқ„ н•ҙкІ°н•ҳкё° мң„н•ҳм—¬ м¶ңнҳҲм„ұ кІҪн–Ҙмқҙ мһҲмқҢм—җлҸ„ л¶Ҳкө¬н•ҳкі н—ӨнҢҢлҰ° л“ұмқҳ н•ӯмқ‘кі м ңлҘј нҲ¬м—¬н•ҳм—¬ нҳҲм „нҳ•м„ұ м–өм ңлҘј нҶөн•ң мқ‘кі мқёмһҗмқҳ мҶҢлӘЁлҘј л§үлҠ” л°©лІ•мқҙ мһҲлӢӨ. н•ӯмқ‘кі м ңлЎңлҠ” н—ӨнҢҢлҰ°, м Җ분мһҗлҹүн—ӨнҢҢлҰ°, мҷҖнҢҢлҰ°, м•„мҠӨн”јлҰ° л“ұмқҙ мӮ¬мҡ©лҗңлӢӨ[5-7]. н•ҳм§Җл§Ң н—ӨнҢҢлҰ° л“ұмқҳ н•ӯмқ‘кі м ңлҠ” м¶ңнҳҲмқ„ м•…нҷ”мӢңнӮӨлҠ” л¶Җмһ‘мҡ©мқҙ мһҲм–ҙ л§Ңм„ұ DICм—җм„ң м¶ңнҳҲмқҙ мһҲлҠ” нҷҳмһҗм—җм„ңмқҳ м№ҳлЈҢм—җ мӮ¬мҡ©н•ҳлҠ” кІғм—җ мқҙкІ¬мқҙ л§ҺлӢӨ. ліё мҰқлЎҖм—җм„ңлҸ„ л§Ңм„ұ DICк°Җ мһҲкі мқҙлҘј мЎ°м Ҳн•ҳкё° мң„н•ҙ м Җ분мһҗлҹүн—ӨнҢҢлҰ°мқ„ мӮ¬мҡ©н•ҳмҳҖмңјлӮҳ мҲҳ м°ЁлЎҖ мһҗм—°м Ғмқё л°ҳмғҒм¶ңнҳҲ л°Ҹ м—үлҚ©мқҙ, лҢҖнҮҙл¶Җ, мў…м•„лҰ¬ л“ұмқҳ нҳҲмў…мқҙ мһ¬л°ңн•ҳмҳҖлӢӨ. мҰү м Җ분мһҗлҹүн—ӨнҢҢлҰ° м№ҳлЈҢлЎң м¶ңнҳҲм„ұ кІҪн–Ҙмқҳ мЎ°м Ҳмқҙ м•Ҳ лҗҳм—Ҳмқ„ л•Ң к·јліём Ғмқё м№ҳлЈҢмқё лҢҖлҸҷл§Ҙл°•лҰ¬м—җ лҢҖн•ң мҲҳмҲ мқҙлӮҳ мҠӨн…җнҠё мӮҪмһ…мҲ мқ„ ліҙлӢӨ мқјм°Қ мӢңн–үн–ҲлҚ”лқјл©ҙ лҮҢм¶ңнҳҲкіј к°ҷмқҖ м№ҳлӘ…м Ғмқё м¶ңнҳҲм„ұ н•©лі‘мҰқ мҳҲл°©мқҙ к°ҖлҠҘн•ҳмҳҖмқ„ мҲҳлҸ„ мһҲлӢӨ.
ліё мҰқлЎҖмқҳ л‘җк°ңлӮҙм¶ңнҳҲкіј к°ҷмқҙ нҷңлҸҷм„ұ м¶ңнҳҲлЎң мқён•ҳм—¬ н•ӯмқ‘кі м ңлҘј мӮ¬мҡ©н•ҳм§Җ лӘ»н•ҳкұ°лӮҳ кё°мЎҙ м№ҳлЈҢм—җлҸ„ л¶Ҳкө¬н•ҳкі м¶ңнҳҲм„ұ кІҪн–Ҙмқҙ м§ҖмҶҚлҗ кІҪмҡ° лӢЁл°ұ분н•ҙнҡЁмҶҢм–өм ңм ңк°Җ м№ҳлЈҢмқҳ мғҲлЎңмҡҙ лҢҖм•ҲмңјлЎң м ңмӢңлҗҳкі мһҲлӢӨ. лӢЁл°ұ분н•ҙнҡЁмҶҢм–өм ңм ңлЎңлҠ” nafamostat mesilate, gabexate mesilate, camostat mesilate л“ұмқҙ мһҲлӢӨ. Nafamostat mesilateмқҳ мһ‘мҡ© кё°м „мқҖ thrombin, plasmin к°ҷмқҖ serine лӢЁл°ұ분н•ҙнҡЁмҶҢ л°Ҹ нҷңм„ұнҳ• мқ‘кі мқёмһҗ(XIIa, Xa), ліҙмІҙ(C1r, C1s), kalikrein к·ёлҰ¬кі trypsinмқ„ м–өм ңн•ҳм—¬ 섬мң мҶҢ분н•ҙ(fibrinolysis)лҘј м–өм ңн•ЁмңјлЎңмҚЁ DIC л°ңмғқмқ„ л§үлҠ” кІғмқҙлӢӨ. нҠ№нһҲ м•Ҫл¬јмһ‘мҡ©м—җ мһҲм–ҙ antithrombin IIIк°Җ н•„мҡ”н•ҳм§Җ м•Ҡкі , н—ӨнҢҢлҰ°кіј лӢ¬лҰ¬ м§Ғм ‘м ҒмңјлЎң нҳҲмҶҢнҢҗ мқ‘집мқ„ м–өм ңн•ҳл©°, нҳҲм•Ў лӮҙм—җм„ңмқҳ м•Ҫл¬ј л°ҳк°җкё°к°Җ н—ӨнҢҢлҰ°ліҙлӢӨ 짧아 м¶ңнҳҲ мң„н—ҳмқҙ м Ғмңјл©ҙм„ң нҡЁкіјк°Җ мўӢмқҖ кІғмңјлЎң м•Ңл Өм ё мһҲлӢӨ. л°ҳл©ҙм—җ кі м№јлҘЁнҳҲмҰқ л“ұ н•©лі‘мҰқмқҙ мһҲкі м•Ҫл¬јнҡЁкіјк°Җ мқјмӢңм Ғмқҙкі м№ҳлЈҢ мӨ‘лӢЁ нӣ„ DICк°Җ лӢӨмӢң м•…нҷ”лҗҳкё°лҸ„ н•ҳл©° мһҘкё°к°„ нҲ¬м—¬н•ҳкё° мўӢмқҖ кІҪкө¬нҳ• м ңм ңк°Җ м—ҶлӢӨлҠ” кІғмқҙ лӢЁм җмқҙлӢӨ. Yamamoto л“ұ[8]мқҖ л§Ңм„ұ лҢҖлҸҷл§Ҙл°•лҰ¬лҘј к°Җ진 нҷҳмһҗм—җм„ң мҲҳмҲ м „ nafamostatлҘј мӮ¬мҡ©н•ҳм—¬ DICлҘј нҡЁкіјм ҒмңјлЎң мЎ°м Ҳн•ң нӣ„ лҢҖлҸҷл§Ҙм№ҳнҷҳмҲ мқ„ н•ң мҳҲлҘј ліҙкі н•ҳмҳҖлӢӨ. Miyahara л“ұ[7]мқҖ мҲҳмҲ л¶Ҳк°ҖлҠҘн•ң л°•лҰ¬м„ұ лҢҖлҸҷл§ҘлҘҳм—җ мқҳн•ң л§Ңм„ұ DICмқҳ кёүм„ұ м•…нҷ”лҗң нҷҳмһҗм—җм„ң nafamostatлҘј мӮ¬мҡ©н•ҳм—¬ DIC мЎ°м Ҳн•ң мҳҲлҘј ліҙкі н•ҳмҳҖлӢӨ. ліё мҰқлЎҖм—җм„ңлҸ„ лӢЁл°ұ분н•ҙнҡЁмҶҢм–өм ңм ңмқё nafamostat м •л§Ҙ лӮҙ нҲ¬м—¬ нӣ„ л°ҳмғҒм¶ңнҳҲ л°Ҹ нҳҲм•Ўмқ‘кі кІҖмӮ¬кІ°кіјк°Җ нҳ„м ҖнһҲ нҳём „лҗң м–‘мғҒмқ„ ліҙмҳҖкі мқҙнӣ„ кІҪкө¬нҲ¬м—¬ к°ҖлҠҘн•ң camostatмңјлЎң ліҖкІҪ нӣ„м—җлҸ„ мқ‘кі кІҖмӮ¬ л°Ҹ мһ„мғҒмҰқмғҒ нҳём „мқҖ м§ҖмҶҚлҗҳм—ҲлӢӨ.
REFERENCES
1. Fine NL, Applebaum J, Elquezabal A, Castleman L. Multiple coagulation defects in association with dissecting aneurysm. Arch Intern Med 1967;119:522вҖ“526.


2. Nakajima T, Kin H, Minagawa Y, Komoda K, Izumoto H, Kawazoe K. Coagulopathy associated with residual dissection after surgical treatment of type A aortic dissection. J Vasc Surg 1997;26:609вҖ“615.


3. Kuo MC, Duun P, Wang PN, Shieh HC, Hung CF. Dissecting aortic aneurysm complicated with acute disseminated intravascular coagulation: case report. Changgeng Yi Xue Za Zhi 1999;22:138вҖ“142.

4. Sakakibara Y, Takeda T, Hori M, Mitsui T, Ijima H. Disseminated intravascular coagulation in aortic aneurysms: assessment of consumption site using labeled-platelet scintigraphy. Thorac Cardiovasc Surg 1999;47:162вҖ“165.


5. Majumdar G. Long-term management of chronic DIC associated with inoperable aortic aneurysm with low molecular weight heparin. Hematol J 2004;5:447вҖ“448.


6. Ontachi Y, Asakura H, Arahata M, et al. Effect of combined therapy of danaparoid sodium and tranexamic acid on chronic disseminated intravascular coagulation associated with abdominal aortic aneurysm. Circ J 2005;69:1150вҖ“1153.


7. Miyahara S, Yasu T, Yamada Y, Kobayashi N, Saito M, Momomura S. Subcutaneous injection of heparin calcium controls chronic disseminated intravascular coagulation associated with inoperable dissecting aortic aneurysm in an outpatient clinic. Intern Med 2007;46:727вҖ“732.

8. Yamamoto K, Ito H, Hiraiwa T, Tanaka K. Effects of nafamostat mesilate on coagulopathy with chronic aortic dissection. Ann Thorac Surg 2009;88:1331вҖ“1333.


9. Yoon SH, Cho YS, Park CY, Chung CH. Disseminated intravascular coagulation associated with aortic dissecting aneurysm. Korean J Intern Med 2004;19:134вҖ“136.


(A) Computed tomography (CT) showed type A aortic dissection (black arrows) in December 1998. (B) Follow-up CT in September 2006. The ascending aorta was replaced with a prosthetic graft. The descending thoracic aorta of the remaining type B aortic dissection was enlarged with aneurysm formation (diameter 42 mm). The false lumen was partially occluded with thrombus formation (arrowheads). (C) CT showed a large amount of intracranial hemorrhage in the right frontal area (white arrows). (D) Follow-up CT in March 2009. The aneurysm of the descending thoracic aorta increased in size (diameter 45 mm). The morphology of the thrombus in the false lumen had changed from that in Figure 1B. The proximal part of the descending thoracic aorta showed partial dissolution but the thrombus in the distal part propagated proximally (white arrow).
FigureВ 1.
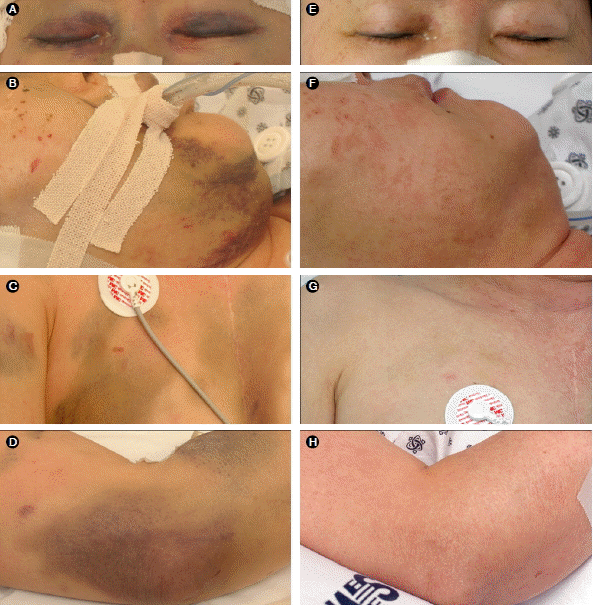
Photographs taken before and after treatment with protease inhibitors. (A) Periorbital bruise. (B) Erythematous purpura on the face. (C) Ecchymosis on the chest. (D) Purpura on the elbow. (E-H) Skin lesions improved after protease inhibitor treatment.
FigureВ 2.
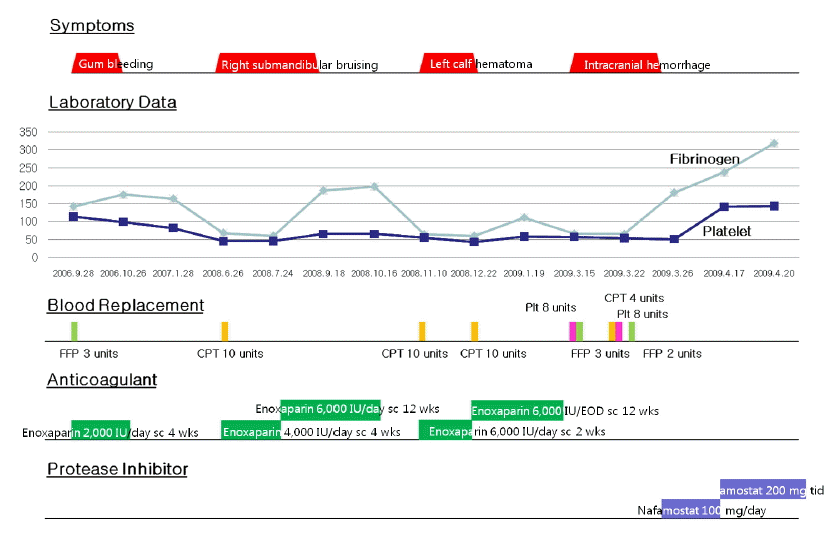
Clinical course from development of bleeding tendency in September 2006. Clinical symptoms and changes in fibrinogen and platelet levels are shown in the upper columns. Treatments are shown in the lower columns. Spontaneous bleeding improved after enoxaparin treatment, but relapsed twice after cessation of enoxaparin. Intracranial hemorrhage developed in March 2009. Symptoms and coagulation profiles improved after protease inhibitor treatment. FFP, fresh frozen plasma; CPT, cryoprecipitate; Plt, platelet; EOD, every other day.
FigureВ 3.
TableВ 1.
Coagulation profile of the patient compared to normal values



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




