서 론
제2형 다발성 내분비 선종(multiple endocrine neoplasia type 2, MEN2)은 상염색체 우성으로 유전되는 악성 종양 증후군으로 한 환자에게서 갑상선수질암, 편측 혹은 양측 갈색세포종, 다른 내분비 조직의 과형성 혹은 종양 형성을 특징으로 하는 희귀한 질환이다1). MEN2는 세계적으로 대략 500에서 1,000예의 가족력이 보고되었고, 유병률은 2.5:100,000으로 평가되고 있다2). MEN2는 갑상선수질암, 갈색세포종, 부갑상선 기능 항진증 등을 특징으로 하는 제 2A형 다발성 내분비 선종과, 부갑상선 기능 항진증은 드물면서 골격기형, 말판양외모, 점막성 신경종, 장관의 신경절종 등을 특징으로 하는 제 2B형 다발성 내분비 선종과 가족성 갑상선수질암 등으로 구분된다2,3). MEN2가 다른 종양들과 병발한 예는 매우 드문 경우로, 저자들은 갑상선수질암, 갈색세포종으로 진단된 제2형 다발성 내분비 선종환자에게서 동반된 유방암 1예를 경험하였기에 문헌고찰과 함께 보고한다.
증 례
환 자: 변〇희, 27세, 여자
주 소: 좌측 유방 및 우측 어깨의 종괴 촉지
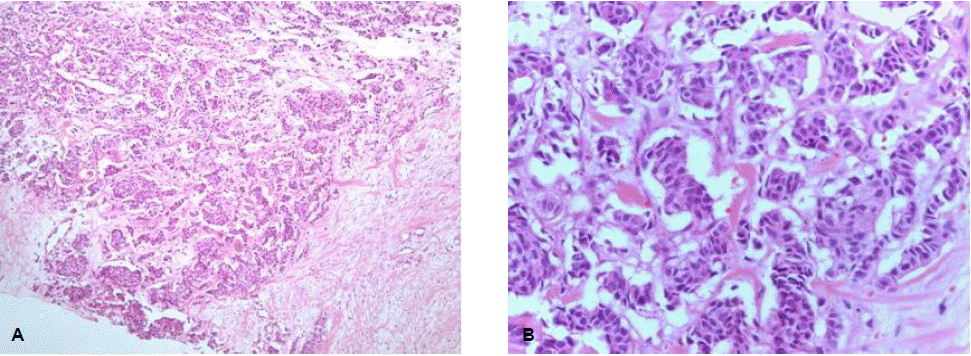
현병력: 상기 여자 환자는 6개월 전부터 커지는 좌측 유방과 우측 어깨의 종괴로 내원하였다. 유방 초음파를 시행하면서 중심부 바늘 생검을 시행한 결과 유관상피내암으로 진단되었으며(그림 1), 우측 어깨의 펀치 생검에서는 갑상선수질암의 림프절 전이로 진단되어 항암 치료를 위해 내원하였다.
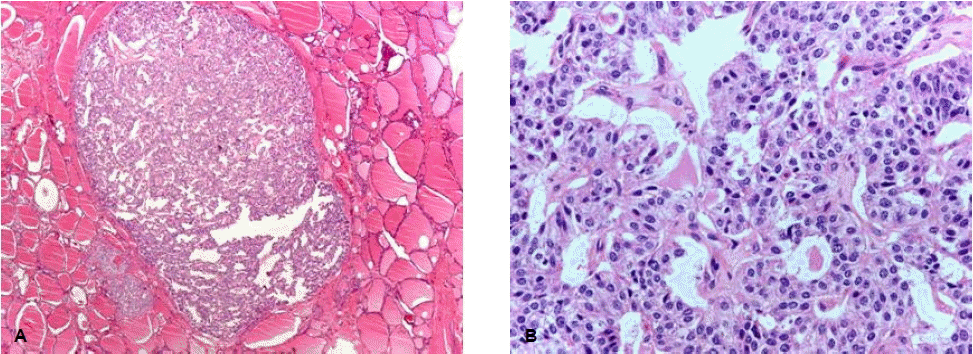
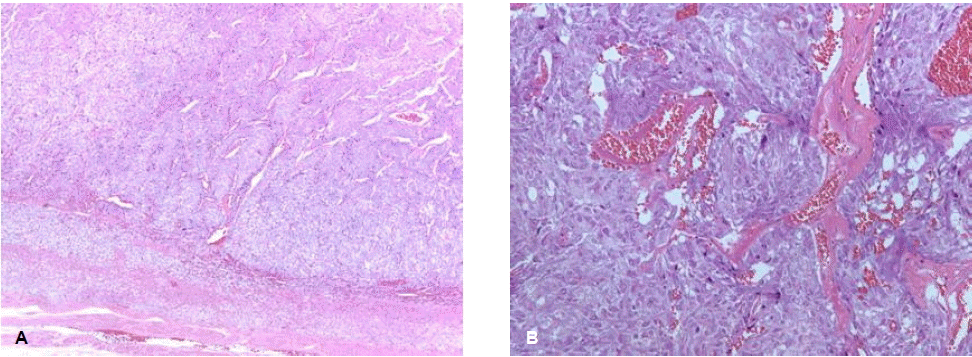
과거력: 8년 전에 갑상선 수질암(그림 2)으로 타 병원에서 우측 갑상선 절제술을 받았다. 이후 경과관찰 중 시행한 갑상선 초음파검사에서 좌측 림프절 비대 및 결절이 발견되는 재발 소견이 있었으며, 3년 전 본원 내원하여 갑상선 전절제술과 중심구역 림프절 절제(cervicocentral neck dissection) 및 변형 근치적 경부 곽청술(modified radical neck dissection)을 시행받은 후 갑상선 호르몬제를 복용하며 외래 추적관찰 중이었다. 이후 2년 전 우측 부신에 2.5 cm 크기의 종괴가 발견되고 혈청 칼시토닌의 농도가 상승되어, 전이 의심하에 복강경하 우측 부신 절제술을 받았으나 조직검사에서 갈색세포종(그림 3)으로 진단되었다.
가족력: 환자의 언니, 어머니, 아버지 모두 특이 병력은 없었다.
진찰 소견: 환자는 만성 병색을 띄고 있었으며 의식은 명료하였고, 혈압은 113/55 mmHg, 맥박수는 80회/분, 호흡수는 18회/분, 체온은 36.5℃였으며, 두경부 촉진에서 갑상선 수술을 받은 흉터는 있었으나 경부 림프절의 비대는 없었으며 압통도 촉지되지 않았다. 이외에 피부 및 골격계에 특이 병변은 관찰되지 않았다.
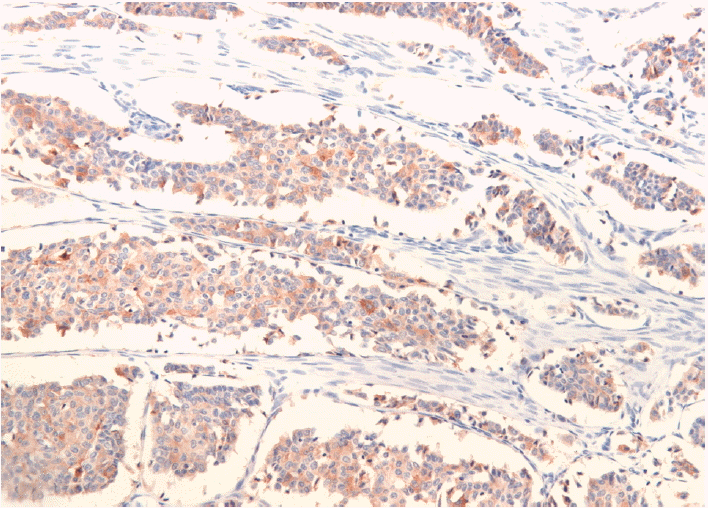
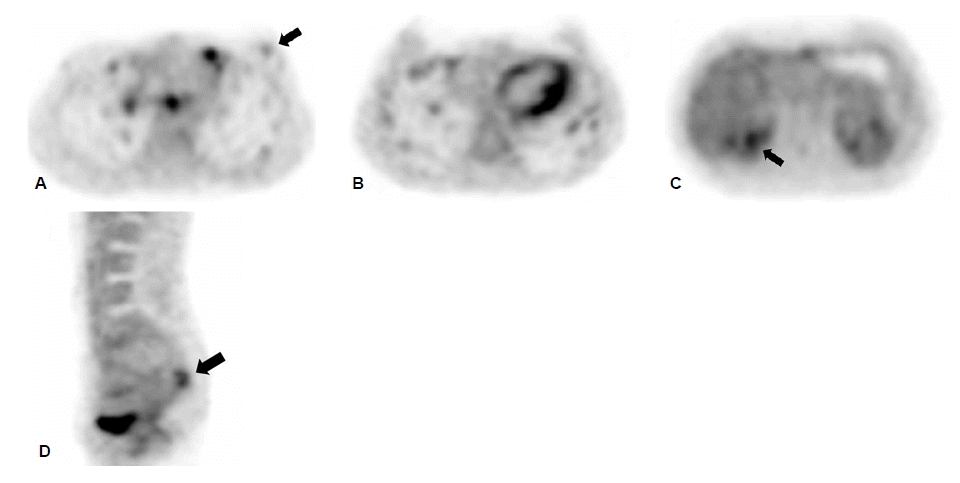
검사 소견: 입원 당시에 시행한 말초혈액검사에서 백혈구 8,160/mm3, 헤모글로빈 10.7 g/dL, 혈소판 185,000/mm3이었고, 혈청 전해질검사에서 나트륨 138 mEq/L, 칼륨 4.5 mEq/L, 염소 105 mEq/L, 혈액요소질소 12.2 mg/dL, 크레아티닌 0.6 mg/dL이었다. 생화학 검사결과, 공복혈당 77 mg/dL, 칼슘 7.9 mg/dL, 인 4.4 mg/dL이었다. 부갑상선 호르몬은 61.7 pg/mL(정상범위: 13~104 pg/mL)이었고, 갑상선 기능 검사는 T3 87.2 ng/dL, 유리 T4 1.4 ng/dL, TSH 22.64 μIU/mL이었다. 자극없이 시행한 혈중 칼시토닌은 4,800.00 pg/mL (정상범위: 10 pg/mL 이하), 기저 혈장 ACTH 152.0 pmol/L (정상범위 : 3.5~13.2 pmol/L), 코르티솔 16.6 ug/dL (정상범위: 6.2~19.4 μ g/dL)이었다. 갑상선 조직에 대한 면역화학 검사에서 RET 양성 소견을 확인하였으며(그림 4), 그 밖에 시행한 면역화학 검사에서 칼시토닌 및 CEA 양성 소견을 보였으나 콩고레드, 아밀로이드에 대한 활성은 음성이었다. 종양표지자 검사에서 CEA 285 ng/mL (정상범위: 0.2~5 ng/mL), CA 15~3 21.4 U/mL (정상범위: 3.8~18.9 ng/mL)이었고, 유방 초음파검사에서 좌측에 1.15×10.0 cm 크기의 불규칙한 저에코의 종괴 음영이 관찰되었다. 흉부 전산화단층촬영에서도 양측 폐에 다수의 혈행성 림프절 전이가 관찰되었으며 복부 전산화단층 촬영에서는 오른쪽 부신 절제술 시행받은 상태로 간에 다수의 종괴가 발견되어 원격 전이를 시사하였다. 전이 여부를 확인하기 위하여 시행한 전신 PET 컴퓨터 단층 촬영에서 좌측 유방, 양 폐하, 간의 오른쪽 엽, 꼬리뼈 등을 침범하는 다발성 원격 전이가 있었다(그림 5).
치료 및 경과: 유방암 및 갑상선수질암의 다발성 원격 전이로 3주 간격으로 두 번의 adriamycin과 cyclophosphamide 항암 화학 치료를 하였다. 이후에 시행한 컴퓨터단층촬영에서 유방의 종양 크기는 줄어들었으나 간전이 및 폐전이의 악화 소견을 보여 항암제를 교체하여 2번의 Taxol 단독 치료를 하였다. 다시 시행한 복부 컴퓨터단층촬영에서 폐전이와 림프절 전이의 악화 소견을 보여 항암제를 교체하고, 8번째 Xeloda와 Cisplatin 항암치료를 하였다. 또 이어서 시행한 컴퓨터단층촬영에서 간 전이, 폐 전이의 악화 소견을 보여 항암제를 교체하여 Gemzar 단독 치료를 하였으나 폐 전이의 악화로 인한 호흡부전으로 사망하였다.
고 찰
제2형 다발성 내분비 선종은 1961년 Sipple 등에 의해 최초로 기술된 희귀한 유전적 악성 종양 증후군으로 내분비계와 비내분비계에서 다양한 종양을 발생시킨다. 이 질환의 유전자 변형은 매우 젊은 나이에서도 다발성, 진행성, 원발성 종양을 발생시킬 수 있으며4), 본 증례의 경우도 19세에 처음 갑상선수질암을 진단받았다. MEN2는 세 가지 아형을 가지는데, 이는 제 2A형 다발성 내분비 선종, 제 2B형 다발성 내분비 선종, 가족성 갑상선수질암 등으로 구성된다. MEN2A는 2형 중 가장 흔한 형태로 모든 MEN2의 80% 이상에 해당된다1). MEN2A의 임상 증후군에는 95% 이상에서 동반되는 양측성, 다중심성 갑상선수질암과, 30~50%에서 동반되는 편측 혹은 양측성 갈색세포종, 15~30%에서 동반되는 부갑상선 세포의 과증식 혹은 선종으로 인한 일차성 부갑상선 기능항진증 등이 포함된다1,4-6). 갑상선수질암은 일반적으로 나타나는 MEN2A의 가장 첫 번째 특징이며 보통 5세에서 25세 사이에 갑상선수질암의 생화학적 특징이 나타난다2). MEN2A의 드문 변형에서는 부종양증후군, 피부 태선 아밀로이드증, 과도한 부신피질자극호르몬의 생성 등이 발생하는 것으로 보고되었다1). MEN2A의 일부 환자에서는 Hirschsprung's 질병이 발생하며 이것은 원위결장 부교감 신경얼기의 자율 신경절 세포의 결함으로 거대결장과 만성 장 폐쇄를 유발한다1). 또한 MEN2A 환자의 20~30%에서 일차성 부갑상선 기능 항진증이 증상없이 발생한다7). 진단은 생화학적으로 혈청내에 증가한 부갑상선 호르몬과 칼슘을 통해 선별할 수 있으며 본 증례에서는 부갑상선 기능의 이상은 관찰되지 않았다.
MEN2B는 제2형 다발성 내분비 선종 중에서 가장 침습적인 유형으로 전체 MEN2의 5%에 해당된다. MEN2B는 MEN2A보다 10년 이상 조기에 발생하며 갑상선수질암, 갈색세포종과 다발 신경종(multiple neuromas) 등으로 진행하며 위장점막에 전반적인 신경절신경종증(ganglioneuromatosis)을 일으킨다(40%)1,8). 위장관의 신경절신경종증은 복부팽만, 거대결장, 변비 및 설사를 동반하며 MEN2B 환자들은 상체 대 하체의 비율 감소, 척추후측만증이나 척추전만증과 같은 골격계 기형, 관절이완(joint laxity), 말판양 외모와 각막신경의 수질화와 같은 기형을 동반하기도 한다1). 일반적으로는 부갑상선을 침범하지 않아 부갑상선 기능 항진증은 동반하지 않으나 드물게 침범한 보고가 있다9). MEN2B 환자에게서는 MEN2A보다 갑상선수질암이 10년 이상 빨리 발생하므로 1년 이내에 갑상선 절제술을 시행하지 않으면 조기에 전이성 갑상선수질암으로 진행하여 이환율과 치사율이 높다1,4).
갑상선수질암은 대부분의 MEN2에서 처음 발생하는 임상 특징이며 조기에 전이된다는 특성을 가진다. 1970년대에는 칼슘이나 펜타가스트린 자극을 통한 칼시토닌 검사가 조기에 갑상선수질암을 찾는데 많은 도움을 주었고, 이후 1993년에 RET 돌연변이와 MEN2의 연관성이 발견되어 DNA에 기초한 RET 유전자 검사를 시행하여 종양으로 발현하기 전에 예방적인 갑상선 절제술을 시행할 수 있게 되었다. MEN2A와 MEN2B의 모든 갑상선수질암에서 수술이 가장 좋은 치료이며 수술시에는 악성으로 진행하기 전에 갑상선 전절제술과 중심 림프절 곽청술을 시행하여야 한다4). MEN2와 다른 암이 동반되어 발생한 증례가 흔하지 않은 것은 조기에 전이되는 갑상선 수질암의 특성으로 인해 발병 전에 사망한 때문으로 생각된다. 본 증례의 경우 갑상선 조직에 대한 콩고레드 염색에서 아밀로이드의 활성이 음성 소견을 보였는데, 이는 갑상선수질암에서 40~80%만이 아밀로이드 양성 소견을 보이는 것으로 알려져 있으며, 아밀로이드의 활성 여부와 예후와의 관련성은 명확하지 않다10,11).
1993년에 처음으로 MEN2의 유전적 중요성이 입증되면서 최근 10년간 많은 유전적 검사를 통해 염색체 10q12.2의 RET원종양 유전자의 생식세포 돌연변이가 연관되어 있다고 보고되었다8). RET 원종양 유전자는 신경능의 발달과 분화에 관여하는 티로신 인산화 수용체를 기호화하는 유전자이며, 이 수용체는 시스테인 아미노산이 풍부한 세포 외 분획, 세포막 통과 분획과 티로신 인산화효소인 세포 내 분획의 세 부분으로 구성된다8,12). RET 돌연변이는 신경능 세포에서 기원한 갑상선 C 세포, 부갑상선 세포, 부신의 크롬친화성 세포와 장의 부교감 자율신경총에 영향을 끼치며, 갑상선수질암, 갈색세포종, 부갑상선 선종, 점막 신경종, 장의 신경절종 등의 종양을 발생시킨다13,14). 제2형 다발성 내분비 선종은 매우 강한 유전자형-표현형 상관관계가 있다. MEN2 환자의 98%에서 RET의 생식세포 돌연변이를 확인하였으며, 이러한 돌연변이 중에서 RET의 시스테인이 풍부한 세포 외 영역의 6개의 시스테인 중 1개가 다른 아미노산으로 치환되는 과오 돌연변이가 가장 많이 일어나는 것으로 알려져 있다1,14-16). 이러한 과오 돌연변이가 MEN2A에서는 93~98%, 가족성 갑상선수질암에서는 80~96%와 연관이 있다1,17).
RET 돌연변이의 비신경내분비 기원 종양에 대해서는 알려진 바가 거의 없으나 RET를 통한 세포 신호전달 체계의 변화에 따른 것으로 생각되고 있다18). 최근 Boulay 등은 RET 돌연변이가 in vitro에서 에스트로겐 수용체 신호와 연관하여 에스트로겐 유발성 유방 증식을 유도한다고 하여, RET 돌연변이와 유방암 발생의 연관성에 대해 새로운 가설을 제시하였다18). Esseghir 등도 RET와 Glial cell line-derived neurotrophic factor (GDNF) receptor family alpha-1 (GFR alpha-1)이 에스트로겐 수용체 양성 종양에서 과발현되는 것을 보고하여, RET 돌연변이와 GFR alpha-1 수용체가 GDNF의 표현을 증가시켜 종양세포를 유발한다고 하였으며19), 이는 RET 돌연변이가 유방암을 유발할 수 있는 가능성을 시사한다. 그러나 이러한 연구 결과들은 in vitro 연구로서, 임상적으로 RET 돌연변이가 유방암을 유발하는지에 대한 보고는 없다.
본 증례에서는 갑상선수질암으로 진단된 후에 편측 갑상선 절제술을 받았고, 5년 후에 갑상선수질암이 재발하여 갑상선 전절제술을 받았다. 수술 후에도 증가하는 칼시토닌을 평가하는 과정에서 복부 전산화단층촬영을 통해 우측 부신증식증이 발견되었으며, 병리 소견에서 갈색 세포종으로 나타나 제2형 다발성 내분비 선종으로 진단되었다. 이후에 시행한 면역화학 검사에서 RET 양성 소견을 확인하였으며 환자에게서 위장관 침범 및 제 2B형의 특징이 나타나지 않아 제 2A형으로 진단하였다. 혈액 및 조직 DNA에서 RET 분석이 필요하였으나 환자 및 보호자가 강력히 거부하여 시행하지 못하였다. 향후에는 최근에 활발히 진행되고 있는 RET 돌연변이의 다른 종양 유발 기전 및 유방암에 대한 유전적 접근이 필요할 것으로 생각된다. 본 증례는 MEN2A 환자에게서 유방암이 발생한 매우 드문 예로 생각되며 국내에서는 처음으로 문헌고찰과 함께 보고한다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






