서 론
조기대장암(early colon cancer)은 암세포가 점막 또는 점막하층까지 침윤한 대장암을 의미한다1). 조기대장암의 치료 목표는 환자의 몸에서 암세포를 가능한 완전히 제거하는 것이며 이를 통해 완치를 기대할 수 있다. 점막층에 국한된 조기대장암은 림프절을 포함하여 원격전이 없이 원발 병소에만 암세포가 머물러 있으므로 원발 종양만 완전 절제하면 완치될 수 있다2-4). 한편, 점막하층을 침윤한 조기대장암은 10% 내외에서 림프절 전이를 보이므로5-7), 이들은 림프절박리 등을 포함한 외과 수술이 필요하며, 림프절 전이가 없는 나머지 경우에는 원발 병소만 제거하는 치료법을 적용할 수 있다. 내시경절제술은 이와 같이 림프절을 포함하여 원격전이가 없는 조기대장암에서 원발 병소를 효과적으로 제거할 수 있는 기법이다. 본고에서는 조기대장암의 상당 부분에 있어 완치 목표로 시행될 수 있는 내시경절제술에 대해 그 적응증, 기술적 방법 및 내시경절제 후 추가 치료 필요성 판정에 대해 고찰하고자 한다.
내시경절제술 적응증 여부 판단
조기대장암의 완치 목표로 내시경절제술을 적용하려면, 전술한 바와 같이 림프절 전이가 없어야 한다. 따라서 림프절 전이 가능성을 판단하는 것이 내시경절제술 적응 여부를 판단하는 데 있어 가장 중요하다. 림프절 전이 여부의 판단을 위해 사용될 수 있는 방법들을 살펴보면 다음과 같다8).
1. 영상의학 검사
림프절 전이 자체를 관찰하기 위해 CT나 MRI 등의 영상의학 검사를 시행할 수 있다. 그러나 이들 검사는 림프절 크기의 증가로 전이 여부를 판정하기 때문에 정확도나 민감도가 낮아 진행대장암을 포함한 연구에서도 정확도는 각각 62, 64%, 민감도는 48%, 22%에 불과하였다9). 내시경초음파의 조기대장암 림프절 전이 여부 진단에 대한 연구는 부족한데, 정확도 및 민감도가 각각 24%, 50%라고 보고한 연구 결과를 고려할 때 만족스럽지 못할 것으로 생각된다10). 즉, CT, MRI, 내시경초음파 등의 영상의학 검사법으로 림프절을 직접 관찰하여 조기대장암 전이를 추정하고, 내시경절제술 적응증 여부를 판정하는 것은 크게 유용해 보이지는 않다.
2. 내시경 검사
조기대장암의 림프절 전이 위험도는 원발종양의 암세포 침윤 깊이와 비례한다. 다기관연구를 통해 865예의 점막하침윤암을 분석한 일본의 연구에서 점막하 침윤 깊이가 1,000 μm 이내인 경우에는 림프절 전이 가능성이 없었다11). 따라서 조기대장암의 내시경 소견 특징을 관찰하여 점막하 침윤 깊이가 1,000 μm 이내로 추정되는 경우를 내시경절제술 적응증으로 생각할 수 있다.
일반 내시경 육안 소견 중 조기대장암이 1,000 μm 이상 깊은 점막하층까지 침윤했을 것으로 유추할 수 있는 특징은 단단함, 종양 중심부의 팽창, 주름집중, 무구조 함몰면 등이다12). 색소내시경 후 확대 관찰하면 점막표면 선구형태(pit pattern)를 판정할 수 있는데, 이때 VN형 선구형태를 보이면 1,000 μm 이상 깊은 점막하층까지 침윤했을 가능성이 높다8). 최근 시행되고 있는 협대역영상내시경(narrow band imaging, NBI)은 표면 미세혈관 구조를 잘 파악할 수 있는 기법인데, 선구형태가 깨져 있으면서 굵은 미세혈관이 불규칙하게 주행하거나 혈관 분포가 균일하지 않으면서 무혈관부가 관찰되는 경우에 1,000 μm 이상 깊은 점막하층까지 침윤했을 가능성이 높다고 보고되었다13). 한편, 실제 내시경절제술을 위해 점막하층에 생리식염수 등의 용액을 주입하였을 때 종양 아래 점막하층 부위가 잘 부풀어오르지 않는 non-lifting sign을 보이는 경우에도 깊은 점막하층 침윤의 가능성이 높다12).
지금까지 기술한 내용을 정리해보면, 조기대장암이 의심되는 경우 내시경절제술의 적응증은 전이가 없는 경우이다. CT 및 MRI 등의 영상의학 검사법은 원격전이를 판정하는 데에는 유용하지만 주변 림프절 전이 판정에는 큰 도움을 주지 못한다. 내시경 육안 소견 및 색소내시경, NBI 소견 등은 원발종양의 침윤 깊이를 추정하는 데 도움을 줄 수 있으며, 이를 통해 림프절 전이 위험도를 간접적으로 유추할 수 있다. 내시경초음파는 보조적으로 사용할 수 있다. 따라서 이상의 소견들을 바탕으로 림프절 전이 위험도가 낮다고 판단되는 조기대장암이 내시경절제술의 적응증이 된다.
조기대장암의 내시경절제술 기법
대장종양의 내시경절제술 기법은 크게 올가미절제술(snare polypectomy)과 내시경점막하박리술(endoscopic submucosal dissection, ESD)로 나눌 수 있다. 올가미절제술은 종양 아래 점막하층에 용액을 주입 후 시행할 수도 있고, 주입 없이 시행할 수도 있다. 또한, 종양이 큰 경우에는 일괄절제하지 않고 분할절제(endoscopic piecemeal mucosal resection, EPMR) 할 수도 있다.
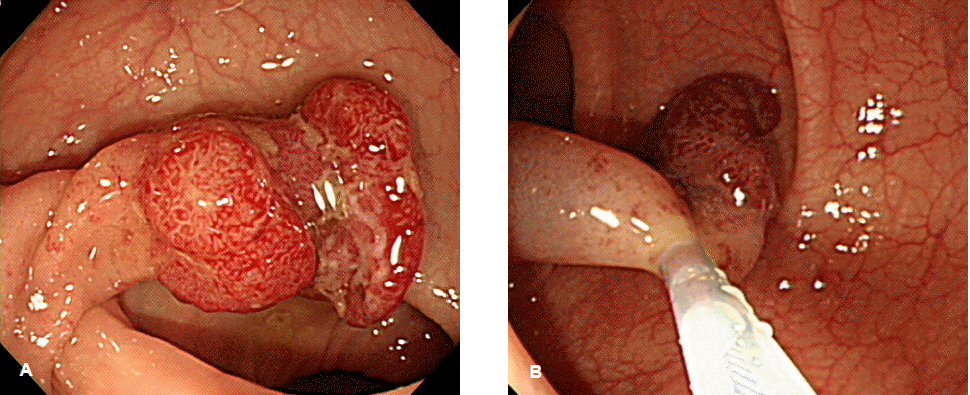
이런 기법들 중 조기대장암의 내시경절제술로 어떤 술식을 선택할 것인지는 조기대장암의 치료 원칙을 고려해서 판단해야 한다. 내시경절제술로 조기대장암의 완치를 기대하려면 충분한 절제변연(tumor-free resection margin)을 확보해야 하며, 절제된 조직이 정확한 병리학적 검토에 적합해야 한다. 이를 위해서는 일괄절제가 중요하다. 일괄절제 되어야 국소 재발을 예방하고, 절단면의 적절한 조직병리학적 평가가 가능하기 때문이다14-16). 이러한 조기대장암 내시경치료 원칙의 관점에서 볼 때 병변의 크기가 1~2 cm 이하로 작거나 뚜렷한 경(stalk)이 있는 경우에는 올가미절제술로도 일괄절제가 가능하므로 올가미절제술을 시행해 볼 수 있다(그림. 1)12). 그러나 병변의 크기가 2~3 cm 이상이면서 무경성인 경우에 올가미절제술을 시도하면, 일괄절제되지 못하고 분할절제되거나 절단면에 종양이 남는 경우가 49~79%나 된다12,16,17). 이와 같이 분할절제될 경우, 절제 표본 재구축의 어려움으로 정확한 조직병리 검사가 어려워 절단면 및 점막하층 암세포 침윤 판정 오류를 초래할 수 있다. 그러므로 조기대장암의 내시경절제술 기법으로 분할절제는 적절하지 않다18,19). 따라서 일본 대장암연구회에서도 조기대장암이 의심되면서 2cm 이상으로 큰 경우에는 완전절제의 가능성을 신중히 고려하여 내시경절제술 기법을 선택하도록 권고하고 있다20).
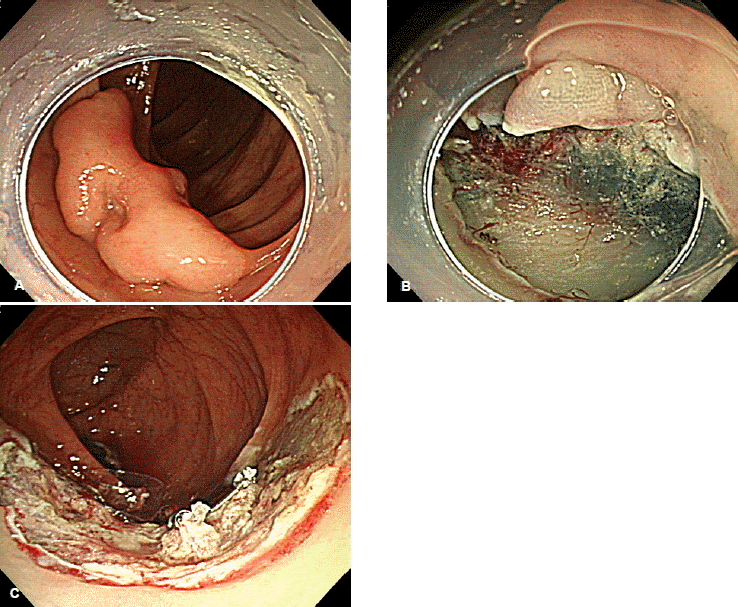
내시경점막하박리술은 점막하 용액 주입 후 절개도를 이용해 점막하층을 박리하여 종양을 절제해 내는 방법이므로 이론적으로는 병변의 크기에 상관 없이 일괄절제가 가능하다. 실제 여러 연구에서도 큰 대장종양에 대한 내시경점막하박리술의 일괄절제율은 80~90% 정도로 높게 보고되고 있다21). 그러나 대장벽은 매우 얇아 내시경점막하박리술을 시행할 경우 5% 전후의 비교적 높은 천공 위험성이 있으며, 점막하박리술을 이용한 일괄절제에 걸리는 시간도 적지 않다는 문제가 있다22-24). 따라서 대장에서의 내시경점막하박리술이 가장 활발히 이루어지고 있는 일본에서는 조기대장암이 의심되면서, 2 cm 이상으로 크고, 올가미를 이용한 전통적인 내시경절제술 기법들로는 일괄절제가 불가능해 보이는 경우에 한해 내시경점막하박리술을 시행하도록 권고하고 있다(그림. 2)25). 최근에는 종양을 박리되는 반대면으로 당겨서 시술을 쉽게 하기 위한 부속기기 개발26,27), sodium hyaluronate 점막하 주입액 도입28), 대장 확장으로 인한 불편감 최소화 위해 CO2 사용29) 등과 같은 새로운 시도들이 지속되면서, 대장 내시경점막하박리술이 과거에 비해 용이해지고 있는 실정이다.
최근에는 다양한 내시경절제술 기법들이 소개되어 있어 대부분의 조기대장암에 대한 내시경절제가 기술적으로는 가능하게 되었다. 그러나 여전히 내시경절제술로 절제하기에는 어려운 조기대장암도 존재한다. 그런데 이와 같이 기술적으로 내시경절제가 어려운 조기대장암을 무리하여 내시경절제 시도하는 것은 옳지 못하다. 분할절제될 경우 후술하는 병리 검토가 어려워져 추가 치료 방침 결정에 곤란을 초래할 수 있고, 천공 등 합병증이 발생할 수도 있으며, 다 절제하지 못하고 일부 병변을 남길 경우 섬유화의 진행으로 인해 다시 내시경절제를 시도할 때 점막하층이 용액 주입 후에도 떠오르지 않아 어려움을 겪게 될 수 있기 때문이다. 따라서 내시경절제술로 일괄절제가 어렵다고 판단되면, 처음부터 외과수술을 고려하거나 보다 경험이 많고 숙련된 내시경의사에게 의뢰하는 것이 추후 적절한 치료 방침 수립에 유리하다고 생각한다.
조기대장암 내시경절제 후 추가 치료 계획
조기대장암의 내시경절제 후 완치를 기대하려면, 전술한 바와 같이 림프절을 비롯하여 전이가 없어야 한다. 비록, 내시경 육안 소견, 색소내시경 소견, 내시경초음파 소견 등을 종합하여 림프절 전이가 없을 것으로 판단되는 조기대장암에 한해 내시경절제술을 시행하였다 하더라도 이상의 검사법들이 림프절 전이 여부를 완벽하게 추정할 수는 없으므로 여전히 림프절 전이의 위험성에 대한 우려가 남게 된다. 그런데 절제된 조직의 병리학적 검토를 통해 조직병리학적 특성을 파악하면 림프절 전이 가능성을 보다 확실히 추정할 수 있어 림프절 박리를 위한 추가 외과수술이 필요한지 여부를 판정하는 데 매우 유용하다.
대장의 점막층에 국한된 조기대장암은 전술한 바와 같이 림프절 전이가 없으므로 내시경절제술로 원발종양을 완전절제했다면, 재발 가능성은 없고 치료는 종료된다. 한편, 점막 하 침윤 조기대장암은 10% 정도에서 림프절 전이가 있으므로 내시경절제술로 절제된 조직의 병리 결과에 따라 림프절전이 위험이 있다고 판단되면 림프절 박리를 포함한 외과수술을 추가해야 한다. 림프절 전이 위험도를 예측할 수 있는 절제 조직의 병리학적 특성들에 대한 많은 연구들을 정리하여 American College of Gastroenterology (ACG)에서는 표 1과 같은 조건을 모두 만족하는 조기대장암은 국소 재발이나 림프절 전이 위험성이 낮아 추가적 대장절제술이 필요 없다고 권고하였다30).
결 론
우리나라에서도 선진국형 암이라고 할 수 있는 대장암이 급속히 증가하고 있다. 특히, 선별대장내시경이 도입되면서 과거에 비해 초기의 대장종양 즉, 양성 대장폴립 및 조기대장암의 진단이 증가할 것으로 생각된다. 따라서 조기대장암에 대한 임상의사의 관심이 요구되는 시점이라 할 수 있다. 전이가 없는 조기대장암은 원발종양에 대한 완전절제 즉, 내시경절제술을 통해 완치를 기대할 수 있다. 그러므로, 조기대장암이 의심되는 경우, 세심하고 다양한 내시경 관찰법을 통해 림프절 전이의 위험도를 예상하고, 림프절 전이 위험도가 낮다고 판단되는 경우에 내시경절제술을 시행해야 한다. 조기대장암은 충분한 절제변연을 확보한 채 일괄절제하는 것이 중요하므로 병변의 모양 및 크기에 따라 다양한 내시경절제술 기법들 중 적절한 방법을 선택해야 한다. 한편, 절제 후에는 절제된 조직의 정확한 병리 검토를 통해 림프절전이 위험도를 한번 더 판정하고, 이를 바탕으로 추가 외과수술의 필요성을 결정해야 한다. 최근 많은 연구 결과들이 발표되고 있는 NOTES (natural orifice transluminal endoscopic surgery) 등의 발전과 함께 보다 효과적인 조기대장암 치료 지침이 마련될 미래를 기대해 본다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






