 |
 |
| Korean J Med > Volume 85(2); 2013 > Article |
|
ņÜöņĢĮ
ļ¬®ņĀü:
ņ┤łņ╣śļŻī ļ¦īņä▒ BĒśĢĻ░äņŚ╝ ĒÖśņ×ÉļōżņŚÉņä£ ņŚöĒģīņ╣┤ļ╣äņ¢┤ņØś ņ╣śļŻī ĒÜ©Ļ│╝ņÖĆ ĻĘĖ ņśłņĖĪņØĖņ×ÉņŚÉ ļīĆĒĢ┤ ļČäņäØĒĢśņśĆļŗż.
ļ░®ļ▓Ģ:
2007ļģä 3ņøöļČĆĒä░ 2011ļģä 5ņøöĻ╣īņ¦Ć Ļ│╝Ļ▒░ ĒĢŁļ░öņØ┤ļ¤¼ņŖżņĀ£ ņ╣śļŻī Ļ▓ĮĒŚśņØ┤ ņŚåļŖö ļ¦īņä▒ BĒśĢĻ░äņŚ╝ ĒÖśņ×ÉļĪ£ņä£ ņŚöĒģīņ╣┤ļ╣äņ¢┤ 0.5 mgņØä ļ¦żņØ╝ ņĄ£ņåī 48ņŻ╝ ņØ┤ņāü ļ│ĄņÜ®ĒĢ£ ĒÖśņ×É 77ļ¬ģņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ņĪ░ņé¼ĒĢśņśĆļŗż. ņŚöĒģīņ╣┤ļ╣äņ¢┤ Ēł¼ņŚ¼ ņżæ Ēśłņ▓Ł HBV DNAņ╣śĻ░Ć 116 copies/mL ņØ┤ĒĢśļĪ£ Ļ░ÉņåīĒĢśņŚ¼ Ļ▓ĆņČ£ļÉśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ņØĖ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻ│╝ Ēśłņ▓Ł ALTņ╣śņØś ņĀĢņāüĒÖöļÉśļŖö Ļ▓ĮņÜ░ņØĖ ņāØĒÖöĒĢÖņĀü ļ░śņØæ, HBeAgņØś Ēśłņ▓Ł ņåīņŗżĻ│╝ Ēśłņ▓ŁņĀäĒÖśņØä Ļ░üĻ░ü ĒÅēĻ░ĆĒĢśņśĆļŗż.
Ļ▓░Ļ│╝:
ņ╣śļŻī 12, 24, 48, 96, 144ņŻ╝ņŚÉ ļīĆĒĢ£ ļłäņĀü ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæļźĀņØĆ Ļ░üĻ░ü 59.7%, 82%, 88.3%, 89.6%, 93.1%ņśĆļŗż; ļłäņĀü ņāØĒÖöĒĢÖņĀü ļ░śņØæļźĀņØĆ Ļ░üĻ░ü 51.9%, 74%, 84.4%, 94.8%, 98.3%ņśĆļŗż; HBeAgņØś ļłäņĀü Ēśłņ▓Ł ņåīņŗżļźĀņØĆ 10.5%, 18.4%, 28.9%, 36.8, 47.4%ņśĆļŗż; ļłäņĀü HBeAg Ēśłņ▓Ł ņĀäĒÖśņ£©ņØĆ 7.9%, 18.4%, 21.1%, 28.9%, 39.5%ņśĆļŗż. ļŗżļ│Ćļ¤ē ļČäņäØņØä ņŗ£Ē¢ēĒĢ£ Ļ▓░Ļ│╝ Ēśłņ▓Ł HBV DNA ņØīņĀäĻ│╝ Ļ┤ĆļĀ©ļÉ£ ļÅģļ”ĮņĀü ņśłņĖĪņØĖņ×ÉļŖö ĻĖ░ņĀĆ HBeAg ņØīņä▒(p= 0.006)Ļ│╝ ņ╣śļŻī 12ņŻ╝ Ēøä ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæņØĖ ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(p= 0.027)ņØ┤ņŚłļŗż. ļśÉĒĢ£ HBeAg Ēśłņ▓Ł ņåīņŗżĻ│╝ Ļ┤ĆļĀ©ļÉ£ ļÅģļ”ĮņĀü ņśłņĖĪņØĖņ×ÉļÅä ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(p= 0.001)ņØ┤ņŚłļŗż.
Ļ▓░ļĪĀ:
ņŚöĒģīņ╣┤ļ╣äņ¢┤ļŖö ņ┤łņ╣śļŻī ļ¦īņä▒ BĒśĢĻ░äņŚ╝ ĒÖśņ×ÉņŚÉņä£ ļø░ņ¢┤ļé£ ņāØĒÖöĒĢÖņĀü ļ░śņØæĻ│╝ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæņØä ļ│┤ņśĆļŗż. ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæņØĆ Ēśłņ▓Ł HBV DNA ņØīņĀäĻ│╝ HBeAg Ēśłņ▓Ł ņåīņŗżņØä ņśłņĖĪĒĢĀņłś ņ׳ļŖö ļÅģļ”ĮņĀü ņØĖņ×ÉļĪ£ ĒÖĢņØĖļÉśņ¢┤ ņ╣śļŻī ņżæ ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæņØ┤ ņŚöĒģīņ╣┤ļ╣äņ¢┤ņØś ņןĻĖ░ņĀüņØĖ ņ╣śļŻī ļ░śņØæņØä ņśłņĖĪĒĢśļŖö ļŹ░ ņ£ĀņÜ®ĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
Abstract
Background/Aims:
The aims of this study were to characterize the treatment response to entecavir and to examine factors affectingthat response.
Methods:
A total of 77 nucleoside-na├»ve patients with chronic hepatitis B who had received entecavir (0.5 mg daily) for at least 48weeks were consecutively enrolled between March 2007 and March 2011. The rates of virological response (hepatitis B virus[HBV] DNA < 116 copies/mL), biochemical response (alanine aminotransferase Ōēż upper limit of normal), hepatitis B e antigen(HBeAg) loss, and seroconversion were retrospectively analyzed.
Results:
The cumulative rates of virological response at 12, 24, 48, 96, and 144 weeks were 59.7%, 82%, 88.3%, 89.6%, and93.1%, respectively; biochemical response rates were 51.9%, 74%, 84.4%, 94.8%, and 98.3%, respectively; HBeAg loss rates were10.5%, 18.4%, 28.9%, 36.8%, and 47.4%, respectively; and HBeAg seroconversion rates were 7.9%, 18.4%, 21.1%, 28.9%, and39.5%, respectively. In multivariate analysis, independent predictors associated with HBV DNA polymerase chain reaction (PCR)negativity were the absence of HBeAg at baseline (p= 0.006) and early virological response (HBV DNA < 2,000 copies/mL after12 weeks of therapy; p= 0.027). In univariate analysis, early virological response was an independent factor predicting HBeAg loss(p= 0.001).
Conclusions:
Entecavir induced excellent biochemical and virological responses in nucleoside-naïve patients with chronichepatitis B. Early virological response was an independent factor predicting HBV PCR negativity and HBeAg loss, and can be usedto predict long-term treatment response to entecavir. (Korean J Med 2013;85:157-166)
ņĀä ņäĖĻ│äņĀüņ£╝ļĪ£ ņĢĮ 20ņ¢Ą ļ¬ģņØ┤ ļ¦īņä▒ BĒśĢĻ░äņŚ╝ņŚÉ Ļ░ÉņŚ╝ļÉśņ¢┤ ņ׳Ļ│Ā 3ņ¢Ą 6ņ▓£ļ¦ī ļ¬ģņØ┤ ļ¦īņä▒ BĒśĢĻ░äņŚ╝ņŚÉ ņØśĒĢ£ ļ¦īņä▒Ļ░äņ¦łĒÖśņØä Ļ░¢Ļ│Ā ņ׳ņ£╝ļ®░, ĒĢ┤ļ¦łļŗż 60ļ¦ī ļ¬ģņØ┤ HBVņÖĆ Ļ┤ĆļĀ©ļÉ£ Ļ░äņ¦łĒÖśņ£╝ļĪ£ ņé¼ļ¦ØĒĢ£ļŗż[1]. ņÜ░ļ”¼ļéśļØ╝ņŚÉņä£ļŖö 10ņäĖ ņØ┤ņāüņŚÉņä£ 3.7%ļĪ£ ļé©ņ×ÉņØś ņĢĮ 4.3%, ņŚ¼ņ×ÉņØś ņĢĮ 3.2%Ļ░Ć HBVņŚÉ ļ¦īņä▒ Ļ░ÉņŚ╝ļÉśņ¢┤ ņ׳ļŗż[2]. Ēśłņ▓Ł BĒśĢĻ░äņŚ╝ ļ░öņØ┤ļ¤¼ņŖż(hepatitis B virus, HBV) DNA ņłśņ╣śļŖö ļ¦īņä▒ BĒśĢĻ░äņŚ╝Ļ│╝ Ļ┤ĆļĀ©ļÉ£ Ļ░äņ¦łĒÖśņØś ņ×ÉņŚ░Ļ▓ĮĻ│╝ņÖĆ ņŚ░Ļ┤ĆļÉśņ¢┤ ņ׳ņ£╝ļ®░ ņ╣śļŻīĒĢśņ¦Ć ņĢŖņØĆ ļ¦īņä▒ BĒśĢĻ░äņŚ╝ ĒÖśņ×Éļź╝ 11ļģä ļÅÖņĢł Ļ┤Ćņ░░ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ Ēśłņ▓Ł HBV DNAņ╣śĻ░Ć 106 copies/mL ņØ┤ņāüņØĖ ĒÖśņ×ÉņØś 36.2%Ļ░Ć Ļ░äĻ▓Įļ│Ćņ”Øņ£╝ļĪ£ ņ¦äĒ¢ēĒĢ£ ļ░śļ®┤, 300 copies/mL ļ»Ėļ¦īņØĖ ĒÖśņ×ÉņŚÉņä£ļŖö 4.5%ņŚÉņä£ļ¦īņØ┤ Ļ░äĻ▓Įļ│Ćņ”ØņØ┤ ļ░£ņāØĒĢśņśĆļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ļŗż[3]. ļśÉĒĢ£ Ēśłņ▓Ł HBV DNAĻ░Ć ņāüņŖ╣ļÉśņ¢┤ ņ׳ļŖö Ļ▓ĮņÜ░(Ōēź 10,000 copies/mL)ņŚÉļŖö BĒśĢĻ░äņŚ╝ eĒĢŁņøÉ(hepatitis e antigen, HBeAg) ņ¢æņä▒ ļ¦īņä▒ Ļ░äņŚ╝ ĒÖśņ×É, Ēśłņ▓Ł ņĢäņŖżĒīīļź┤ĒģīņØ┤ĒŖĖ ņĢäļ»ĖļģĖņĀäņØ┤ĒÜ©ņåī(aspartate aminotransferase, AST) ļ░Å ņĢīļØ╝ļŗī ņĢäļ»ĖļģĖņĀäņØ┤ĒÜ©ņåī(alanine aminotransferase, ALT) ņłśņ╣śĻ░Ć ņ”ØĻ░ĆĒĢ£ ĒÖśņ×É, Ļ░äĻ▓Įļ│Ćņ”ØņØä ļÅÖļ░śĒĢ£ ĒÖśņ×ÉļōżņŚÉņä£ ļÅģļ”ĮņĀüņ£╝ļĪ£ Ļ░äņäĖĒżņĢöņóģņØś ļ░£ņāØņ£äĒŚśņØ┤ ļåÆļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ļŗż[4]. ļ¦īņä▒ BĒśĢĻ░äņŚ╝ņØś ņ╣śļŻī ļ¬®Ēæ£ļŖö ņןĻĖ░Ļ░ä ļ░öņØ┤ļ¤¼ņŖżņØś ņ”ØņŗØņØä ņ¢ĄņĀ£ĒĢ©ņ£╝ļĪ£ņŹ© Ļ░äĻ▓Įļ│Ćņ”ØņØ┤ļéś Ļ░äņĢöņ£╝ļĪ£ņØś ņ¦äĒ¢ēņØä ļ¦ēĻ│Ā ĒĢ®ļ│æņ”ØĻ│╝ ņé¼ļ¦ØļźĀņØä Ļ░Éņåīņŗ£Ēéżļ®░ ņéČņØś ņ¦łņØä Ē¢źņāüņŗ£ĒéżļŖöļŹ░ ņ׳ļŗż. ņŚöĒģīņ╣┤ļ╣äņ¢┤ļŖö HBV DNA polymeraseņØś Ļ░ĢļĀźĒĢ£ ņ¢ĄņĀ£ņĀ£ļĪ£ņä£ ņŚöĒģīņ╣┤ļ╣äņ¢┤ņÖĆ ļØ╝ļ»ĖļČĆļöśņØś ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ļ╣äĻĄÉĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ 48ņŻ╝ Ēøä HBV DNA ņØīņĀäņ£©(67% vs. 36%)ņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśņ£╝ļ®░ ņĪ░ņ¦üĒĢÖņĀü ĒśĖņĀä(72% vs. 62%) ļ░Å ALT ņĀĢņāüĒÖöņ£©(68% vs. 60%)ļÅä ļØ╝ļ»ĖļČĆļöśļ│┤ļŗż ņÜ░ņłśĒĢśņśĆļŗż[5]. ņĢäļŹ░Ēżļ╣äņ¢┤ņÖĆņØś ļ╣äĻĄÉņŚ░ĻĄ¼ņŚÉņä£ļÅä ņŚöĒģīņ╣┤ļ╣äņ¢┤ļŖö Ļ░ĢļĀźĒĢ£ ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ņ¢ĄņĀ£ĒÜ©Ļ│╝Ļ░Ć ņ׳ņŚłĻ│Ā ņ╣śļŻī 52ņŻ╝ Ēøä Ēśłņ▓Ł HBV DNAņØś Ļ░Éņåī ĒÜ©Ļ│╝Ļ░Ć ņĢäļŹ░Ēżļ╣äņ¢┤ļ│┤ļŗż ņÜ░ņłśĒĢśņśĆļŗż[6]. ļśÉĒĢ£ ļē┤Ēü┤ļĀłņśżņé¼ņØ┤ļō£ ņ£Āņé¼ņ▓┤ ņ╣śļŻī Ļ▓ĮĒŚśņØ┤ ņŚåļŖö ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ 5ļģä ļÅÖņĢł ņŚöĒģīņ╣┤ļ╣äņ¢┤ļź╝ Ēł¼ņŚ¼ĒĢ£ ĒĢ┤ņÖĖ ņŚ░ĻĄ¼ņŚÉņä£ ņŚöĒģīņ╣┤ļ╣äņ¢┤ņŚÉ ļīĆĒĢ£ ļłäņĀü ļé┤ņä▒ļźĀņØĆ ņĢĮ 1%ņśĆĻ│Ā HBV DNAĻ░Ć Ļ▓ĆņČ£ĒĢ£Ļ│ä ļ»Ėļ¦īņ£╝ļĪ£ ņ£Āņ¦ĆļÉ£ ĒÖśņ×ÉļŖö 93%ņśĆļŗż[7]. ļØ╝ļ»ĖļČĆļöś ļé┤ņä▒ņØ┤ ņ╣śļŻī 1ļģä Ēøä 16-32%, ņ╣śļŻī 4ļģä Ēøä 71%Ļ╣īņ¦Ć ļéśĒāĆļéśļŖö Ļ▓āņØä Ļ│ĀļĀżĒĢĀ ļĢī[8] ņŚöĒģīņ╣┤ļ╣äņ¢┤ļŖö Ļ░ĢļĀźĒĢ£ ĒĢŁļ░öņØ┤ļ¤¼ņŖż ĒÜ©Ļ│╝ņÖĆ ĒĢ©Ļ╗ś ļé«ņØĆ ļé┤ņä▒ ļ░£ņāØļźĀņØä ļ│┤ņØ┤ļ»ĆļĪ£ ļ¦īņä▒ BĒśĢĻ░äņŚ╝ ĒÖśņ×ÉņŚÉņä£ ņ┤łņ╣śļŻī ņĢĮņĀ£ļĪ£ņä£ ĻČīņןļÉśĻ│Ā ņ׳ņ£╝ļéś, ĻĄŁļé┤ņŚÉņä£ļŖö ņĢäņ¦ü ņŚöĒģīņ╣┤ļ╣äņ¢┤ņØś ņé¼ņÜ® ĻĖ░Ļ░äņØ┤ ņČ®ļČäĒĢśņ¦Ć ņĢŖņĢä ņØ┤ņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļČĆņĪ▒ĒĢ£ ņŗżņĀĢņØ┤ļŗż. ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ņØś ņĀĆņ×ÉļōżņØĆ Ļ│╝Ļ▒░ ĒĢŁļ░öņØ┤ļ¤¼ņŖżņĀ£ ņ╣śļŻī Ļ▓ĮĒŚśņØ┤ ņŚåĻ│Ā ņŚöĒģīņ╣┤ļ╣äņ¢┤ 0.5 mgņØä ņĄ£ņåī 48ņŻ╝ ņØ┤ņāü Ēł¼ņŚ¼ ļ░øņØĆ ņ┤łņ╣śļŻī ļ¦īņä▒ BĒśĢĻ░äņŚ╝ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ņŚöĒģīņ╣┤ļ╣äņ¢┤ņØś ņןĻĖ░Ļ░ä ņ╣śļŻī ĒÜ©Ļ│╝ņÖĆ ņ╣śļŻī ļ░śņØæĻ│╝ Ļ┤ĆļĀ©ļÉ£ ņśłņĖĪņØĖņ×ÉņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Ā ļé┤ņä▒ ļ░£ņāØļźĀņØä ĒÅēĻ░ĆĒĢśĻ│Āņ×É ĒĢśņśĆļŗż.
2007ļģä 3ņøöļČĆĒä░ 2012ļģä 3ņøöĻ╣īņ¦Ć ņČ®ļé©ļīĆĒĢÖĻĄÉļ│æņøÉņŚÉ ļé┤ņøÉĒĢ£ Ļ│╝Ļ▒░ ĒĢŁļ░öņØ┤ļ¤¼ņŖżņĀ£ ņ╣śļŻī Ļ▓ĮĒŚśņØ┤ ņŚåļŖö ļ¦īņä▒ BĒśĢĻ░äņŚ╝ ĒÖśņ×ÉļĪ£ņä£ ņŚöĒģīņ╣┤ļ╣äņ¢┤ 0.5 mgņØä ļ¦żņØ╝ ņĄ£ņåī 48ņŻ╝ ņØ┤ņāü ļ│ĄņÜ®ĒĢ£ 96ļ¬ģņŚÉ ļīĆĒĢśņŚ¼ ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŗż. ņŚöĒģīņ╣┤ļ╣äņ¢┤ļŖö 2007ļģä ļ¦īņä▒ BĒśĢĻ░äņŚ╝ņØś ņ╣śļŻīņŚÉ ļīĆĒĢ£ ļīĆĒĢ£Ļ░äĒĢÖĒÜī Ļ░ĆņØ┤ļō£ļØ╝ņØĖņŚÉ ļö░ļØ╝ Ļ░äņ¦łĒÖśņØś ņ¦äĒ¢ē ņĀĢļÅäĻ░Ć ļ¦īņä▒ Ļ░äņŚ╝ņØś ļŗ©Ļ│äņŚÉ ņ׳ļŖö ĒÖśņ×ÉļŖö Ēśłņ▓ŁHBV DNAĻ░Ć ņØ╝ņĀĢņłśņżĆ(HBeAg ņ¢æņä▒ņØś Ļ▓ĮņÜ░ Ōēź 20,000 IU/mL, HBeAg ņØīņä▒ņØś Ļ▓ĮņÜ░ Ōēź 2,000 IU/mL) ņØ┤ņāü ņ”ØĻ░ĆĒĢ┤ ņ׳Ļ│Ā Ēśłņ▓Ł AST ļśÉļŖö ALTņ╣śĻ░Ć ņĀĢņāü ņāüĒĢ£ņ╣śņØś ļæÉ ļ░░ ņØ┤ņāüņØ┤Ļ▒░ļéś ļæÉ ļ░░ ļ»Ėļ¦īņØ┤ņ¦Ćļ¦ī Ļ░äņāØĻ▓ĆņŚÉņä£ ņżæļō▒ļÅä ņØ┤ņāüņØś ņŚ╝ņ”ØĻ┤┤ņé¼ ņåīĻ▓¼ņØ┤ļéś ļ¼Ėļ¦źņŻ╝ļ│ĆļČĆ ņä¼ņ£ĀĒÖö ļŗ©Ļ│ä ņØ┤ņāüņØś Ļ░ä ņä¼ņ£ĀĒÖöļź╝ ļ│┤ņØ┤ļŖö Ļ▓ĮņÜ░ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśņśĆļŗż. ļīĆņāüņä▒ Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉļŖö HBeAg ņ£Āļ¼┤ņŚÉ Ļ┤ĆĻ│äņŚåņØ┤ Ēśłņ▓Ł HBV DNAĻ░Ć Ōēź 2,000 IU/mL (Ōēź 11,200 copies/mL)ņØ┤ļ®░ Ēśłņ▓Ł AST, ALTņ╣śĻ░Ć ņĀĢņāü ņāüĒĢ£ņ╣ś ņØ┤ņāüņØĖ Ļ▓ĮņÜ░ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśņśĆĻ│Ā Ēśłņ▓Ł AST, ALTņ╣śĻ░Ć ņĀĢņāüņØĖ Ļ▓ĮņÜ░ ĒÖśņ×ÉņØś ņāüĒā£ņŚÉ ļö░ļØ╝ ņ╣śļŻīļź╝ Ļ▓░ņĀĢĒĢśņśĆļŗż. ļ╣äļīĆņāüņä▒ Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉļŖö Ēśłņ▓Ł HBV DNAĻ░Ć ņ¢æņä▒ņØĖ Ļ▓ĮņÜ░ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśņśĆļŗż[9]. Ļ░äĻ▓Įļ│Ćņ”ØņØĆ ņ×äņāüņĀüņ£╝ļĪ£ ņ¦äļŗ©ĒĢśņśĆņ£╝ļ®░ Ļ░äņØś ļ╣äļīĆņāüņä▒ ņĀĢļÅä(ļ│Ąņłś, Ļ░äņä▒ Ēś╝ņłś ņ£Āļ¼┤, ĒÖ®ļŗ¼ ļ░Å ņāüļČĆņ£äņןĻ┤Ć ņČ£Ēśł) ļō▒Ļ│╝ ņśüņāüĻ▓Ćņé¼ Ļ▓░Ļ│╝ ĒĢ®ļŗ╣ĒĢ£ ņåīĻ▓¼ņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░, ņāüļČĆņåīĒÖöĻ┤Ć ļé┤ņŗ£Ļ▓ĮĻ▓Ćņé¼ņŚÉņä£ ņŗØļÅä ņĀĢļ¦źļźśļéś ņ£äņĀĢļ¦źļźś ļō▒ņØś ļ¼Ėļ¦źĻ│ĀĒśłņĢĢņØś ņ”ØĻ▒░ ļśÉļŖö ļ¦Éņ┤ł ĒśłņĢĪ Ļ▓Ćņé¼ņŚÉņä£ ĒśłņåīĒīÉ ņłś < 100,000/mm3 ļō▒ ļ╣äņןĻĖ░ļŖź ĒĢŁņ¦äņ”ØņØś ņ”ØĻ▒░Ļ░Ć ņ׳ļŖö Ļ▓ĮņÜ░ļĪ£ ĒĢśņśĆļŗż. CĒśĢĻ░äņŚ╝ ĒÖśņ×É, ņĢīņĮöņś¼Ļ░äņŚ╝ ĒÖśņ×É, ņ×ÉĻ░Ćļ®┤ņŚŁĻ░äņŚ╝ ĒÖśņ×É, ĻĘĖļ”¼Ļ│Ā ņØ┤ņĀäņŚÉ ņØĖĒä░ĒÄśļĪĀņØ┤ļéś ļØ╝ļ»ĖļČĆļöś, ļśÉļŖö ņĢäļŹ░Ēżļ╣äņ¢┤ ņ╣śļŻīļź╝ ļ░øņØĆ Ļ│╝Ļ▒░ļĀźņØ┤ ņ׳ļŖö ĒÖśņ×É ļō▒ņØĆ ļ│Ė ņŚ░ĻĄ¼ņØś ļīĆņāüĻĄ░ņŚÉņä£ ņĀ£ņÖĖĒĢśņśĆļŗż.
ņäĀņĀĢ ĻĖ░ņżĆņŚÉ ņĀüĒĢ®ĒĢ£ ĒÖśņ×ÉņØś ņØśļ¼┤ĻĖ░ļĪØņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆĻ│Ā, Ēł¼ņŚ¼ Ļ░£ņŗ£ ņĀä ņØ┤ĒĢÖņĀü Ļ▓Ćņé¼, Ļ░äĻĖ░ļŖź Ļ▓Ćņé¼, Ēśłņ▓Ł HBeAg, anti-HBe, HBV DNA ņĀĢļ¤ē Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░ ņØ┤Ēøä 3Ļ░£ņøö Ļ░äĻ▓®ņ£╝ļĪ£ ņČöņĀüĻ┤Ćņ░░ĒĢśņśĆļŗż. Ēśłņ▓Ł HBV DNAņØś ņĀĢļ¤ēņØĆ COBAS AmpliPrep/COBAS TaqManņØä ņØ┤ņÜ®ĒĢ┤ real-time PCRļĪ£ ņĖĪņĀĢĒĢśņśĆņ£╝ļ®░ Ļ▓ĆņČ£ ĒĢ£Ļ│äļŖö 116-989,400,000 copies/mL (20-170,000,000 IU/mL)ņśĆļŗż. Ēśłņ▓Ł HBV DNAļŖö ņāüņÜ®ļĪ£ĻĘĖ Ļ░Æņ£╝ļĪ£ ļ│ĆĒÖś(1 IU/mL = 5.82 copies/mL)ĒĢśņŚ¼ ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░ ļö░ļØ╝ņä£ HBV DNAĻ░Ć Ļ▓ĆņČ£ĒĢ£Ļ│äņØś ņāüĒĢ£ņ╣śļź╝ ļäśļŖö Ļ▓ĮņÜ░ļŖö 8 log10 copies/mLļĪ£ ĒĢśĒĢ£ņ╣ś ņØ┤ĒĢśņØĖ Ļ▓ĮņÜ░ļŖö 116 copies/mLļĪ£ ņé░ņĀĢĒĢśņŚ¼ ļČäņäØĒĢśņśĆļŗż.
ņŚöĒģīņ╣┤ļ╣äņ¢┤ņØś ņ╣śļŻī ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ£ ĒÅēĻ░ĆļŖö ņŚöĒģīņ╣┤ļ╣äņ¢┤ Ēł¼ņŚ¼ ņżæ Ēśłņ▓Ł HBV DNAņ╣śĻ░Ć 116 copies/mL ņØ┤ĒĢśļĪ£ Ļ░ÉņåīĒĢśņŚ¼ Ļ▓ĆņČ£ļÉśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ļź╝ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(virologic response, VR)ņ£╝ļĪ£ Ēśłņ▓Ł ALTņ╣śņØś ņĀĢņāüĒÖöļź╝ ņāØĒÖöĒĢÖņĀü ļ░śņØæ(biochemical response)ņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆĻ│Ā HBeAgņØś Ēśłņ▓Ł ņåīņŗżĻ│╝ Ēśłņ▓ŁņĀäĒÖśņØä ĒÅēĻ░ĆĒĢśņśĆļŗż. ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(early virologic response, EVR)ņØĆ ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ╣śļŻī 12ņŻ╝ņŚÉ Ēśłņ▓Ł HBV DNAĻ░Ć 2,000 copies/mL ļ»Ėļ¦īņ£╝ļĪ£ Ļ░ÉņåīĒĢ£ Ļ▓ĮņÜ░ļĪ£, ļČĆļČä ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(partial virologic response, PVR)ņØĆ ņ╣śļŻī 48ņŻ╝ņŚÉ Ēśłņ▓Ł HBV DNAĻ░Ć real-time PCR Ļ▓Ćņé¼ņŚÉņä£ 2 log10 IU/mL ņØ┤ņāü Ļ░ÉņåīĒĢśņśĆņ¦Ćļ¦ī ņ¦ĆņåŹņĀüņ£╝ļĪ£ Ļ▓ĆņČ£ļÉśļŖö Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż. ņØ╝ņ░© ņ╣śļŻī ņŗżĒī©(primary non- responder)ļŖö ņŚöĒģīņ╣┤ļ╣äņ¢┤ļź╝ 24ņŻ╝ ļÅÖņĢł Ēł¼ņŚ¼ ĒøäņŚÉļÅä Ēśłņ▓Ł HBV DNAĻ░Ć ņ╣śļŻī ņĀäņŚÉ ļ╣äĒĢ┤ 2 log10 ņØ┤ņāü Ļ░ÉņåīĒĢśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆĻ│Ā ļ░öņØ┤ļ¤¼ņŖż ļÅīĒīī(virologic breakthrough)ļŖö ņ╣śļŻī ņżæ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæņØä ļ│┤ņśĆņ£╝ļéś ņØ┤Ēøä Ēśłņ▓Ł HBV DNAĻ░Ć 2ļ▓łņØś ņŚ░ņåŹļÉ£ Ļ▓Ćņé¼ņŚÉņä£ ņØ┤ņĀä Ļ▓Ćņé¼ Ļ▓░Ļ│╝(ņĄ£ņĀĆņ╣ś, nadir)ļ│┤ļŗż 1 log10 ņØ┤ņāü ņ”ØĻ░ĆĒĢśļŖö Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż.
ļČĆļČä ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░(PVR)Ļ│╝ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░(VR), Ēśłņ▓Ł HBeAg ņ¢æņä▒ĻĄ░Ļ│╝ ņØīņä▒ĻĄ░ņØś ņ╣śļŻī ņĀä ņ×äņāüņ¢æņāüļōżņØä ļ╣äĻĄÉĒĢśĻĖ░ ņ£äĒĢ┤ ņŚ░ņåŹĒśĢ ļ│ĆņłśļŖö StudentŌĆÖs t-testļź╝ ņØ┤ņÜ®ĒĢśņśĆĻ│Ā ļ▓öņŻ╝ĒśĢ ļ│ĆņłśļŖö chi-square testļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż. ļśÉĒĢ£ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ, ņāØĒÖöĒĢÖņĀü ļ░śņØæ, HBeAg Ēśłņ▓Ł ņåīņŗż ļ░Å Ēśłņ▓ŁņĀäĒÖśņØś ņŗ£Ļ░äņŚÉ ļīĆĒĢ£ ļłäņĀüļ╣äņ£©ņØä ĻĄ¼ĒĢśĻĖ░ ņ£äĒĢ┤ Kaplan-Meierļ▓ĢņØä ņØ┤ņÜ®ĒĢśņśĆĻ│Ā Ļ░üĻ░üņØś ņØĖņ×ÉņŚÉ ļīĆĒĢ┤ņä£ļŖö log rankļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ļ╣äĻĄÉĒĢśņśĆļŗż. ņ╣śļŻī ļ░śņØæņŚÉ ļÅģļ”ĮņĀüņØĖ ņśłņĖĪņØĖņ×Éļź╝ ņĪ░ņé¼ĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ļ©╝ņĀĆ ļŗ©ļ│Ćļ¤ē ļČäņäØņŚÉņä£ ņ£ĀņØśĒĢ£ ļ│ĆņłśļōżņØä ļīĆņāüņ£╝ļĪ£ ļŗżņŗ£ ļŗżļ│Ćļ¤ē ļĪ£ņ¦ĆņŖżĒŗ▒ ĒÜīĻĘĆļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. p Ļ░ÆņØ┤ 0.05 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ļź╝ ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉņĀĢĒĢśņśĆĻ│Ā ļ¬©ļōĀ ļČäņäØņØĆ SPSS 18 (SPSS Inc., Chicago, IL, USA)┬«ņØä ņØ┤ņÜ®ĒĢśņśĆļŗż.
2007ļģä 3ņøöļČĆĒä░ 2011ļģä 5ņøöĻ╣īņ¦Ć ļ│ĖņøÉņŚÉ ļé┤ņøÉĒĢ£ Ļ│╝Ļ▒░ ĒĢŁļ░öņØ┤ļ¤¼ņŖżņĀ£ ņ╣śļŻī Ļ▓ĮĒŚśņØ┤ ņŚåļŖö ļ¦īņä▒ BĒśĢĻ░äņŚ╝ ĒÖśņ×ÉļĪ£ņä£ ļ¦żņØ╝ ņŚöĒģīņ╣┤ļ╣äņ¢┤ 0.5 mgņØä ņĄ£ņåī 48ņŻ╝ ņØ┤ņāü ļ│ĄņÜ®ĒĢ£ ņ┤Ø 96ļ¬ģņØś ĒÖśņ×É ņżæ ņČöņĀüĻ┤Ćņ░░ņØ┤ ņåīņŗżļÉśĻ▒░ļéś ņé¼ļ¦ØĒĢ£ ĒÖśņ×Éļź╝ ņĀ£ņÖĖĒĢ£ ļéśļ©Ėņ¦Ć 77ļ¬ģņØä ļ│Ė ņŚ░ĻĄ¼ņŚÉ ĒżĒĢ©ņŗ£ņ╝░ļŗż. ļīĆņāü ĒÖśņ×ÉĻĄ░ņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 43.5ņäĖņśĆĻ│Ā ĻĘĖ ņżæ ļé©ņ×ÉļŖö 48ļ¬ģ(62.3%), ņ╣śļŻī ņĀä Ēśłņ▓Ł HBeAgņ¢æņä▒ņØĖ ĒÖśņ×ÉļŖö 38ļ¬ģ(49.4%), Ļ░äĻ▓Įļ│Ćņ”ØņØä ļÅÖļ░śĒĢ£ ĒÖśņ×ÉļŖö 24ļ¬ģ(31.2%)ņØ┤ņŚłļŗż. ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ╣śļŻī ņĀä Ēśłņ▓Ł ASTņØś ņżæņĢÖĻ░ÆņØĆ 78 IU/L, Ēśłņ▓Ł ALTņØś ņżæņĢÖĻ░ÆņØĆ 121 IU/L, Ēśłņ▓Ł ņĢīļČĆļ»╝ņØś ņżæņĢÖĻ░ÆņØĆ 4.3 g/dL, ĒśłņåīĒīÉņØś ņżæņĢÖĻ░ÆņØĆ 164.6 ├Ś 103/mm3, ĻĘĖļ”¼Ļ│Ā Ēśłņ▓Ł HBV DNAņØś ņżæņĢÖĻ░ÆņØĆ 6.38 log10 copies/mLņśĆļŗż. ņ╣śļŻī ņĀä Ēśłņ▓Ł HBV DNAĻ░Ć > 8 log10 copies/mLņØĖ ĒÖśņ×ÉļŖö 2ļ¬ģ(2.6%)ņØ┤ņŚłĻ│Ā, Ōēż 8 log10 copies/mLņØĖ ĒÖśņ×ÉļŖö ļéśļ©Ėņ¦Ć 75ļ¬ģ(97.4%)ņØ┤ņŚłļŗż. ĒÅēĻĘĀ ņČöņĀüĻ┤Ćņ░░ĻĖ░Ļ░äņØĆ 133.7ņŻ╝ņśĆņ£╝ļ®░ Ļ┤Ćņ░░ĻĖ░Ļ░äņØ┤ Ļ░Ćņן ņ¦¦ņØĆ ĒÖśņ×ÉļŖö 64ņŻ╝, ņĄ£ņן ĻĖ░Ļ░äņØĆ 180ņŻ╝ņśĆļŗż(Table 1).
ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ╣śļŻī ņĀä Ēśłņ▓Ł HBeAg ņ¢æņä▒ņØĖ 38ļ¬ģņØś ĒÖśņ×É ņżæ HBeAg Ēśłņ▓ŁņĀäĒÖśņØĆ 24ņŻ╝ņŚÉ 7ļ¬ģ/38ļ¬ģ(18.4%), 48ņŻ╝ņŚÉ 8ļ¬ģ/38ļ¬ģ(21.1%)ņŚÉņä£ Ļ┤Ćņ░░ļÉśņŚłĻ│Ā, HBeAg Ēśłņ▓Ł ņåīņŗżņØĆ Ļ░üĻ░ü 7ļ¬ģ/38ļ¬ģ(18.4%), 11ļ¬ģ/38ļ¬ģ(28.9%)ņŚÉņä£ Ļ┤Ćņ░░ļÉśņŚłļŗż. 96ņŻ╝Ļ╣īņ¦Ć ņŚöĒģīņ╣┤ļ╣äņ¢┤ļź╝ Ēł¼ņŚ¼ĒĢ£ Ļ▓ĮņÜ░ HBeAg Ēśłņ▓ŁņĀäĒÖśņØĆ 11ļ¬ģ/38ļ¬ģ(28.9%), Ēśłņ▓ŁņåīņŗżņØĆ 14ļ¬ģ/38ļ¬ģ(36.8%)ņŚÉņä£ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņŚöĒģīņ╣┤ļ╣äņ¢┤ Ēł¼ņŚ¼ Ēøä HBV DNA ņØīņĀä(< 116 copies/mL)ņØĆ ņ╣śļŻī 24ņŻ╝, 48ņŻ╝, 96ņŻ╝ņŚÉ Ļ░üĻ░ü 54ļ¬ģ(70.1%), 59ļ¬ģ(76.6%), 63ļ¬ģ(86.3%)ņŚÉņä£ Ļ┤Ćņ░░ļÉśņŚłļŗż. ņŚöĒģīņ╣┤ļ╣äņ¢┤ Ēł¼ņŚ¼ Ēøä Ēśłņ▓Ł ALTņ╣śĻ░Ć ņĀĢņāüĒÖöļÉ£ ĒÖśņ×ÉļŖö ņ╣śļŻī 24ņŻ╝, 48ņŻ╝, 96ņŻ╝ņŚÉ Ļ░üĻ░ü 55ļ¬ģ(71.4%), 63ļ¬ģ(81.8%), 70ļ¬ģ(95.9%)ņØ┤ņŚłļŗż. ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ╣śļŻī ĻĖ░Ļ░ä ļÅÖņĢł ņØ╝ņ░© ņ╣śļŻī ņŗżĒī©ļŖö ņŚåņŚłĻ│Ā ļ░öņØ┤ļ¤¼ņŖż ļÅīĒīīĒśäņāüņØĆ 6ļ¬ģņŚÉņä£ ņØ╝ņ¢┤ļé¼ļŗż.
ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ╣śļŻīļź╝ ļ░øņØĆ 77ļ¬ģņØś ĒÖśņ×É ņżæ 71ļ¬ģņØ┤ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(VR)ņØä ļ│┤ņśĆņ£╝ļ®░ ļłäņĀü ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæļźĀņØĆ 12ņŻ╝ņŚÉ 59.7%, 24ņŻ╝ņŚÉ 82%, 48ņŻ╝ņŚÉ 88.3%, 96ņŻ╝ņŚÉ 89.6%, 144ņŻ╝ņŚÉ 93.1%ņśĆļŗż(Fig. 1). 77ļ¬ģņØś ĒÖśņ×É ņżæ 75ļ¬ģņØ┤ ņāØĒÖöĒĢÖņĀü ļ░śņØæņØä ļ│┤ņśĆņ£╝ļ®░, ļłäņĀü ņāØĒÖöĒĢÖņĀü ļ░śņØæļźĀņØĆ 12ņŻ╝ņŚÉ 51.9%, 24ņŻ╝ņŚÉ 74%, 48ņŻ╝ņŚÉ 84.4%, 96ņŻ╝ņŚÉ 94.8%, 144ņŻ╝ņŚÉ 98.3%ņśĆļŗż(Fig. 2). ņ╣śļŻī ņŗ£ņ×æ ļŗ╣ņŗ£ Ēśłņ▓Ł HBeAg ņ¢æņä▒ ļ░śņØæņØä ļ│┤ņØĖ 38ļ¬ģņØś ļłäņĀü HBeAg Ēśłņ▓Ł ņåīņŗżļźĀņØĆ 12ņŻ╝ņŚÉ 10.5%, 24ņŻ╝ņŚÉ 18.4%, 48ņŻ╝ņŚÉ 28.9%, 96ņŻ╝ņŚÉ 36.8%, 144ņŻ╝ņŚÉ 47.4%ņśĆĻ│Ā(Fig. 3), ļłäņĀü HBeAg Ēśłņ▓Ł ņĀäĒÖśņ£©ņØĆ 12ņŻ╝ņŚÉ 7.9%, 24ņŻ╝ņŚÉ 18.4%, 48ņŻ╝ņŚÉ 21.1%, 96ņŻ╝ņŚÉ 28.9%, 144ņŻ╝ņŚÉ 39.5%ņśĆļŗż(Fig. 4).
ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ╣śļŻī 48ņŻ╝ņŚÉ ļČĆļČä ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░(PVR, n = 9)Ļ│╝ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░(VR, n = 68)ņŚÉņä£ ļæÉ ĻĄ░ Ļ░äņØś ņ╣śļŻī ņĀä ļéśņØ┤, ņä▒ļ│ä, Ēśłņ▓Ł HBeAgņØś ņ£Āļ¼┤, Ēśłņ▓Ł AST ļ░Å ALTņ╣ś, ņĢīļČĆļ»╝ņ╣ś, ĒśłņåīĒīÉņ╣ś, Ēśłņ▓Ł HBV DNA, Ļ░äĻ▓Įļ│Ćņ”ØņØś ļÅÖļ░ś ņ£Āļ¼┤ ĻĘĖļ”¼Ļ│Ā ņČöņĀüĻ┤Ćņ░░ĻĖ░Ļ░äņØä ļ╣äĻĄÉĒĢśņśĆļŗż. ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░ņŚÉņä£ ļČĆļČä ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ╣śļŻī ņĀä ĒÅēĻĘĀ ļéśņØ┤Ļ░Ć ņ£ĀņØśĒĢśĻ▓ī ļ¦ÄņĢśļŗż(p= 0.006). ļśÉĒĢ£ ņ╣śļŻī ņĀä Ēśłņ▓Ł HBeAg ņ¢æņä▒ļźĀņØ┤ ļČĆļČä ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░ņŚÉņä£ļŖö 31.0%, ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░ņŚÉņä£ļŖö 13.2%ļĪ£ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░ņŚÉņä£ņØś Ēśłņ▓Ł HBeAg ņ¢æņä▒ļźĀņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļé«ņĢśļŗż(p= 0.001). ņ╣śļŻī ņĀä ĒśłņåīĒīÉņØś ĒÅēĻĘĀĻ░ÆņØĆ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░ņŚÉņä£ ļŹö ļé«ņĢśņ£╝ļ®░ ņŚŁņŗ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŗż(159.0 ├Ś 103/mm3 vs. 208.8 ├Ś 103/mm3, p= 0.026). ņ╣śļŻī ņĀä Ļ░äĻ▓Įļ│Ćņ”ØņØä ļÅÖļ░śĒĢ£ ĒÖśņ×ÉļŖö ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░ņŚÉņä£ 24ļ¬ģ(35.3%)ņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż(p= 0.032). ņ╣śļŻī ņĀä Ēśłņ▓Ł HBV DNAņØś ĒÅēĻĘĀĻ░ÆņØĆ ļČĆļČä ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░ņŚÉņä£ 7.1 log10 copies/mLņśĆĻ│Ā ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░ņŚÉņä£ 6.1 log10 copies/mLļĪ£ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░ņŚÉņä£ ņ£ĀņØśĒĢśĻ▓ī ļé«ņĢśļŗż(p= 0.041). ĻĘĖ ņÖĖ ņä▒ļ│ä, Ēśłņ▓Ł AST ļ░Å ALTņ╣ś, ņĢīļČĆļ»╝ņ╣ś ĻĘĖļ”¼Ļ│Ā ņČöņĀüĻ┤Ćņ░░ĻĖ░Ļ░äņØĆ ļæÉ ĻĄ░ Ļ░äņŚÉ ņØśļ»Ė ņ׳ļŖö ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(Table 2).
ņ╣śļŻī ņĀä Ēśłņ▓Ł HBeAg ņ¢æņä▒ĻĄ░ņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØĆ 40.5ņäĖ(Ēæ£ņżĆĒÄĖņ░© = 13.0)ļĪ£ HBeAg ņØīņä▒ĻĄ░ņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ 46.4ņäĖ(Ēæ£ņżĆĒÄĖņ░© = 9.7)ļ│┤ļŗż ņ£ĀņØśĒĢśĻ▓ī ļé«ņĢśņ£╝ļ®░(p= 0.027), HBeAg ņ¢æņä▒ĻĄ░ņØś ņ╣śļŻī ņĀä Ēśłņ▓Ł HBV DNAĻ░ÆņØĆ ĒÅēĻĘĀ 6.8 log10 copies/mLļĪ£ HBeAg ņØīņä▒ĻĄ░ņØś ĒÅēĻĘĀ 5.7 log10 copies/mL ļ│┤ļŗż ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż(p= 0.000). Ļ░äĻ▓Įļ│Ćņ”ØņØä ļÅÖļ░śĒĢ£ ĒÖśņ×ÉļŖö HBeAg ņ¢æņä▒ĻĄ░ņŚÉņä£ 6ļ¬ģ(15.8%)ņ£╝ļĪ£ HBeAg ņØīņä▒ĻĄ░ņØś 18ļ¬ģ(46.2%)ļ│┤ļŗż ņ£ĀņØśĒĢśĻ▓ī ļé«ņĢśņ£╝ļ®░(p= 0.004), ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(EVR)ņØĆ HBeAg ņ¢æņä▒ĻĄ░ņŚÉņä£ 18ļ¬ģ(47.4%)ņ£╝ļĪ£ HBeAg ņØīņä▒ĻĄ░ņØś 32ļ¬ģ(82.1%)ļ│┤ļŗż ņ£ĀņØśĒĢśĻ▓ī ļé«ņĢśļŗż(p= 0.001). ĒśłņåīĒīÉņ╣śņØś ĒÅēĻĘĀĻ░ÆņØĆ HBeAg ņØīņä▒ĻĄ░ņØĆ 155.1 ├Ś 103/mm3ņØ┤Ļ│Ā, HBeAg ņ¢æņä▒ĻĄ░ņØĆ 174.8 ├Ś 103/mm3ļĪ£ HBeAg ņØīņä▒ĻĄ░ņŚÉņä£ ļŹö ļé«ņØĆ ņłśņ╣śļź╝ ļ│┤ņśĆņ£╝ļéś ĒåĄĻ│äĒĢÖņĀü ņ£ĀņØśņä▒ņØĆ ņŚåņŚłļŗż(p= 0.173). ĻĘĖ ņÖĖ ņä▒ļ│ä, ņ╣śļŻī ņĀä Ēśłņ▓Ł AST ļ░Å ALTņ╣ś, ņĢīļČĆļ»╝ņ╣ś ĻĘĖļ”¼Ļ│Ā ņČöņĀüĻ┤Ćņ░░ ĻĖ░Ļ░äņØĆ ļæÉ ĻĄ░ Ļ░äņŚÉ ņØśļ»Ė ņ׳ļŖö ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(Table 3).
ņ╣śļŻī ņĀä Ēśłņ▓Ł HBeAg ņ¢æņä▒ĻĄ░ņØś ļłäņĀü ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæļźĀņØĆ 12ņŻ╝ņŚÉ 42.1%, 24ņŻ╝ņŚÉ 68.4%, 48ņŻ╝ņŚÉ 81.6%, 96ņŻ╝ņŚÉ 84.2%, 144ņŻ╝ņŚÉ 92.1%ņśĆĻ│Ā, HBeAg ņØīņä▒ĻĄ░ņØś ļłäņĀü ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæļźĀņØĆ 12ņŻ╝ņŚÉ 76.9%, 24ņŻ╝ņŚÉ 94.9%ļĪ£ HBeAg ņØīņä▒ĻĄ░ņØś ļłäņĀü ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæļźĀņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż(p= 0.008, Fig. 5). ļłäņĀü ņāØĒÖöĒĢÖņĀü ļ░śņØæļźĀņØĆ HBeAg ņ¢æņä▒ĻĄ░ņŚÉņä£ 12ņŻ╝ņŚÉ 44.7%, 24ņŻ╝ņŚÉ 68.4%, 48ņŻ╝ņŚÉ 81.6%, 96ņŻ╝ņŚÉ 92.1%ņśĆĻ│Ā HBeAg ņØīņä▒ĻĄ░ņŚÉņä£ 12ņŻ╝ņŚÉ 59%, 24ņŻ╝ņŚÉ 79.5%, 48ņŻ╝ņŚÉ 87.2%, 96ņŻ╝ņŚÉ 97.4%ļĪ£ HBeAg ņØīņä▒ĻĄ░ņØś ļłäņĀü ņāØĒÖöĒĢÖņĀü ļ░śņØæļźĀņØ┤ ļŹö ļåÆņĢśņ£╝ļéś ĒåĄĻ│äņĀüņØĖ ņØśņØśļŖö ņŚåņŚłļŗż(p= 0.296, Fig. 6).
ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ╣śļŻī 48ņŻ╝ Ēøä Ēśłņ▓Ł HBV DNA ņØīņĀäņŚÉ ņśüĒ¢źņØä ņżĆ ņØĖņ×ÉļōżņŚÉ ļīĆĒĢśņŚ¼ ļĪ£ņ¦ĆņŖżĒŗ▒ ĒÜīĻĘĆļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļŗ©ļ│Ćļ¤ē ļČäņäØ(univariate analysis) Ļ▓░Ļ│╝ ĒÖśņ×ÉņØś ĒÅēĻĘĀ ļéśņØ┤Ļ░Ć ļ¦ÄņØĆ Ļ▓ĮņÜ░(p= 0.007), ļé©ņ×ÉņØĖ Ļ▓ĮņÜ░(p= 0.036), ņ╣śļŻī ņĀä ĒśłņåīĒīÉņ╣śĻ░Ć ļé«ņØĆ Ļ▓ĮņÜ░(p= 0.013), ņ╣śļŻī ņĀä HBeAg ņØīņä▒ ļ¦īņä▒ Ļ░äņŚ╝(p= 0.000)ņØĖ Ļ▓ĮņÜ░, ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(EVR)ņØ┤ ņØ╝ņ¢┤ļé£ Ļ▓ĮņÜ░(p= 0.000)ņŚÉ Ēśłņ▓Ł HBV DNA ņØīņĀäņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļ¦ÄņĢśļŗż. HBV DNA ņØīņĀäņØ┤ ņØ╝ņ¢┤ļé£ ĻĄ░ņŚÉņä£ ņ╣śļŻī ņĀä Ēśłņ▓Ł HBV DNA ĒÅēĻĘĀĻ░ÆņØ┤ ļŹö ļé«ņØĆ(6.0 vs. 7.0 log10 copies/mL, p= 0.002) Ļ▓ĮĒ¢źņØä ļ│┤ņśĆņ£╝ļéś ļŗżļ│Ćļ¤ē ļČäņäØņŚÉņä£ ĒåĄĻ│äņĀü ņ£ĀņØśņä▒ņØĆ ņŚåņŚłļŗż(p= 0.214). ļŗżļ│Ćļ¤ē ļČäņäØ(multivariate analysis) Ļ▓░Ļ│╝ ņ╣śļŻī ņĀä Ēśłņ▓Ł HBeAg ņØīņä▒[p= 0.006, odd ratio(OR) (95% CI) = 11.369 (2.031-63.639)]Ļ│╝ ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(EVR) [p= 0.027, odd ratio(OR) (95% CI) = 0.198 (0.047-0.835)]ņØ┤ ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ╣śļŻī 48ņŻ╝ņŚÉ HBV DNA ņØīņĀäņØä ņśłņĖĪĒĢĀ ņłś ņ׳ļŖö ļÅģļ”ĮņĀüņØĖ ņØĖņ×ÉņśĆļŗż(Table 4).
ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ╣śļŻī 48ņŻ╝ Ēøä HBeAg Ēśłņ▓Ł ņåīņŗżņŚÉ ņśüĒ¢źņØä ņżĆ ņØĖņ×ÉļōżņŚÉ ļīĆĒĢśņŚ¼ ļ╣äļ¬©ņłś Ļ▓ĆņĀĢļČäņäØņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ļŗ©ļ│Ćļ¤ē ļČäņäØ(univariate analysis) Ļ▓░Ļ│╝ ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(EVR)ņØ┤ ņØ╝ņ¢┤ļé£ Ļ▓ĮņÜ░(p= 0.001)ņŚÉļ¦ī HBeAg Ēśłņ▓Ł ņåīņŗżņØ┤ Ēśłņ▓ŁņĀäĒÖśņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļ¦ÄņĢäņä£ HbeAg Ēśłņ▓Ł ņåīņŗżņŚÉ ļīĆĒĢ£ ļÅģļ”ĮņĀüņØĖ ņśłņĖĪņØĖņ×ÉņśĆļŗż(Table 5).
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņ┤Ø 77ļ¬ģņØś ļ¦īņä▒ BĒśĢĻ░äņŚ╝ ĒÖśņ×ÉņŚÉĻ▓ī ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ┤łņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢ£ Ļ▓░Ļ│╝ Ēśłņ▓Ł HBV DNA ņØīņĀä(< 116 copies/mL), Ēśłņ▓Ł ALTņ╣śņØś ņĀĢņāüĒÖö, HBeAgņØś Ēśłņ▓Ł ņåīņŗż ļ░Å Ēśłņ▓ŁņĀäĒÖśņØ┤ ņ╣śļŻī 48ņŻ╝ņŚÉ Ļ░üĻ░ü 88.3%, 84.4%, 28.9%, 21.1%ļĪ£ ļéśĒāĆļé¼ņ£╝ļ®░ 144ņŻ╝Ļ╣īņ¦Ć ņ╣śļŻīļ░øņØĆ 31ļ¬ģņØś ĒÖśņ×ÉņŚÉņä£ļŖö Ļ░üĻ░ü 93.1%, 98.3%, 47.4%, 39.5%ļĪ£ Ļ┤Ćņ░░ļÉśņ¢┤ ņ╣śļŻī ĻĖ░Ļ░äņØ┤ ĻĖĖņ¢┤ņ¦łņłśļĪØ ņŚöĒģīņ╣┤ļ╣äņ¢┤ņØś ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ, ņāØĒÖöĒĢÖņĀü ļ░śņØæ ĻĘĖļ”¼Ļ│Ā HBeAg Ēśłņ▓Ł ļ░śņØæļźĀņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ĻĄŁļé┤ņŚÉņä£ļŖö Song ļō▒[10]ņØ┤ 97ļ¬ģņØś Ēśłņ▓Ł HBeAg ņ¢æņä▒ ļ¦īņä▒ Ļ░äņŚ╝ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ĒÅēĻĘĀ 60ņŻ╝ņØś ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ╣śļŻī Ēøä, Ēśłņ▓Ł ALTņ╣śņØś ņĀĢņāüĒÖöņ£©ņØĆ 83.5%, ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæņØĆ 75.3%, HBeAg Ēśłņ▓Ł ņåīņŗżņØĆ 27.8%ļĪ£ ļ│┤Ļ│ĀĒĢśņśĆļŗż. 296ļ¬ģņØś HBeAg ņØīņä▒ ĒÖśņ×Éļ¦īņØä ļīĆņāüņ£╝ļĪ£ ņŚöĒģīņ╣┤ļ╣äņ¢┤ņØś ĒÜ©Ļ│╝ļź╝ ņĪ░ņé¼ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ Ēśłņ▓Ł ALTņ╣śņØś ņĀĢņāüĒÖöņ£©Ļ│╝ HBV DNA ņØīņĀäņ£©ņØ┤ ņ╣śļŻī 48ņŻ╝ Ēøä Ļ░üĻ░ü 78%, 90%ņśĆĻ│Ā 24Ļ░£ņøöņ¦ĖļŖö Ļ░üĻ░ü 89%, 94%ļĪ£ HBeAg ņ¢æņä▒ ĒÖśņ×ÉņŚÉ ļ╣äĒĢśņŚ¼ ņ¢æĒśĖĒĢ£ Ļ▓░Ļ│╝ļź╝ ļ│┤Ļ│ĀĒĢśņśĆļŗż[11]. ņØ┤ņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļÅä ņ╣śļŻī 48ņŻ╝ Ēøä Ēśłņ▓Ł HBV DNA ņØīņĀäņ£©ņØ┤ HBeAg ņØīņä▒ ĒÖśņ×ÉņŚÉņä£ļŖö 94.9%, ņ¢æņä▒ ĒÖśņ×ÉņŚÉņä£ļŖö 57.9%ļĪ£ ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ╣śļŻī ņĀä Ēśłņ▓Ł HBeAg ņØīņä▒ņØĖ ĒÖśņ×ÉņŚÉņä£ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(VR)ņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ╣śļŻī 48ņŻ╝ņŚÉ ļČĆļČä ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░(PVR)Ļ│╝ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░(VR)ņØä ļ╣äĻĄÉĒĢ£ Ļ▓░Ļ│╝ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæĻĄ░ņŚÉņä£ ļīĆņāü ĒÖśņ×ÉņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØ┤ ļåÆņĢśĻ│Ā(p= 0.006), ņ╣śļŻī ņĀä Ēśłņ▓Ł HBeAg ņ¢æņä▒ļźĀ(p= 0.001) ļ░Å ĒśłņåīĒīÉ ņłśņ╣ś(p= 0.026), Ēśłņ▓Ł HBV DNA ņłśņ╣ś(p= 0.041)Ļ░Ć ļŹö ļé«ņĢśņ£╝ļ®░ Ļ░äĻ▓Įļ│Ćņ”ØņØä ļÅÖļ░śĒĢśĻ│Ā ņ׳ļŖö Ļ▓ĮņÜ░Ļ░Ć ļŹö ļ¦ÄņĢśļŗż(p= 0.032). ņ╣śļŻī 48 ņŻ╝ņŚÉ HBeAg ņØīņä▒ĻĄ░ņØĆ 94.9%ņØś ļłäņĀü ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæļźĀņØä ļ│┤ņŚ¼ HBeAg ņ¢æņä▒ĻĄ░ņØś ļłäņĀü ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæļźĀņØĖ 81.6%ļ│┤ļŗż ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŖöļŹ░(p= 0.008) ņØ┤ļŖö ĻĖ░ņĪ┤ņØś ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆ ļČĆĒĢ®ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņØ┤ļōż ĒÖśņ×ÉĻĄ░ņØś ņ╣śļŻī ņĀä Ēśłņ▓Ł HBV DNAĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ļé«ņØīĻ│╝ Ļ┤ĆļĀ©ļÉśļŖö ĒśäņāüņØ┤ļØ╝ ņāØĻ░üļÉ£ļŗż[5]. ļśÉĒĢ£ ņ╣śļŻī 48ņŻ╝ņŚÉ Ēśłņ▓Ł HBV DNA ņØīņĀäņ£©ņØ┤ HBeAg ņØīņä▒ĻĄ░ņŚÉņä£ 94.9%, ņ¢æņä▒ ĒÖśņ×ÉņŚÉņä£ļŖö 57.9%ļĪ£, HBeAg ņØīņä▒ĻĄ░ņŚÉņä£ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŹś Ļ▓░Ļ│╝ņÖĆļÅä ņØ╝ņ╣śĒĢśņśĆļŗż.
HBeAg Ēśłņ▓ŁņĀäĒÖśņØä ņśłņĖĪĒĢĀ ņłś ņ׳ļŖö ņØĖņ×ÉļĪ£ ņØĖĒä░ĒÄśļĪĀ ņ╣śļŻīņØś Ļ▓ĮņÜ░ņŚÉļŖö ļåÆņØĆ ALTņ╣ś, ņĪ░ņ¦üņØś ņŚ╝ņ”Ø ņĀĢļÅäĻ░Ć ņŗ¼ĒĢ£ Ļ▓ĮņÜ░, ļé«ņØĆ Ēśłņ▓Ł HBV DNA, Ļ░äņŚ╝ ņ£ĀņĀäņ×É AņÖĆ BĒśĢņØ┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ņ£╝ļ®░[12-14] ļØ╝ļ»ĖļČĆļöś ņ╣śļŻī ņŗ£ņŚÉļŖö ALTņ╣śĻ░Ć ļåÆņØäņłśļĪØ HBeAg Ēśłņ▓ŁņĀäĒÖśņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ļŗż[15]. ņĢäļŹ░Ēżļ╣äņ¢┤ņØś Ļ▓ĮņÜ░ ņ£ĀņĀäņ×ÉĒśĢņŚÉ ļö░ļźĖ Ēśłņ▓Ł ņĀäĒÖśņ£©ņØś ņ░©ņØ┤ļŖö ņŚåņ£╝ļéś[16] ALTņ╣śĻ░Ć ļåÆĻ▒░ļéś HBeAg ņØīņä▒ņØĖ ĒÖśņ×ÉņŚÉņä£ ņ╣śļŻī ļ░śņØæņØ┤ ņ¢æĒśĖĒĢśņśĆļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ļŗż[17]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ╣śļŻīņŗ£ HBeAg ņ¢æņä▒ĻĄ░ņŚÉ ļ╣äĒĢ┤ HBeAg ņØīņä▒ĻĄ░ņØś ĒÅēĻĘĀ ņŚ░ļĀ╣ņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśĻ│Ā(p= 0.027) Ļ░äĻ▓Įļ│Ćņ”ØņØś ļÅÖļ░śļÅä ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśņ£╝ļ®░(p= 0.004) ņ╣śļŻī ņĀä Ēśłņ▓Ł HBV DNAĻ░ÆņØĆ ļé«ņĢśĻ│Ā(p= 0.000) ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(EVR)ņØĆ ļŹö ļåÆĻ▓ī ņØ╝ņ¢┤ļé¼ļŖöļŹ░(p= 0.001) ņØ┤Ļ▓ā ļśÉĒĢ£ ņØ╝ļ░śņĀüņ£╝ļĪ£ ņĢīļĀżņ¦ä ļ░öņÖĆ ņØ╝ņ╣śĒĢśņśĆļŗż[18-20].
ļŗ©ļ│Ćļ¤ē ļČäņäØņØä ĒåĄĒĢ┤ ņŚöĒģīņ╣┤ļ╣äņ¢┤ Ēł¼ņŚ¼ ņĀä ĒśłņåīĒīÉ ņłśņ╣śĻ░Ć ļé«ņØĆ Ļ▓ĮņÜ░, Ļ░äĻ▓Įļ│Ćņ”ØņØä ļÅÖļ░śĒĢ£ Ļ▓ĮņÜ░, ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(EVR)ņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ņŚÉ HBeAgņØś Ēśłņ▓Ł ņåīņŗż ļśÉļŖö Ēśłņ▓Ł ņĀäĒÖśņ£© ņØ┤ ļåÆņØä Ļ▓āņ£╝ļĪ£ ņśłņĖĪĒĢĀ ņłś ņ׳ņŚłļŗż. ļśÉĒĢ£ ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ╣śļŻī 48ņŻ╝ņŚÉ Ēśłņ▓Ł HBV DNA ņØīņĀäņØś ņśłņĖĪņØĖņ×ÉļōżņŚÉ ļīĆĒĢśņŚ¼ ļŗ©ļ│Ćļ¤ē ļČäņäØņØä ņŗ£Ē¢ēĒĢ£ Ļ▓░Ļ│╝ ĒÖśņ×ÉņØś ĒÅēĻĘĀ ļéśņØ┤Ļ░Ć ļ¦ÄņØäņłśļĪØ, ļé©ņä▒ņØĖ Ļ▓ĮņÜ░ ņ╣śļŻī ņĀä ĒśłņåīĒīÉ ņłśņ╣śĻ░Ć ļé«ņØĆ Ļ▓ĮņÜ░, Ēśłņ▓Ł HBeAg ņØīņä▒ņØĖ Ļ▓ĮņÜ░, ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(EVR)ņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░Ļ░Ć ļåÆņØĆ HBV DNA ņØīņĀäņØä ņśłņĖĪĒĢĀ ņłś ņ׳ļŖö ņ£ĀņØśĒĢ£ ņØĖņ×ÉļĪ£ ĒīÉļ¬ģļÉśņŚłļŗż. ļŗ©ļ│Ćļ¤ē ļČäņäØ Ļ▓░Ļ│╝ ņ╣śļŻī ņĀä Ēśłņ▓Ł HBeAg ņØīņä▒ņØĖ Ļ▓ĮņÜ░ņÖĆ ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(EVR)ņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░Ļ░Ć ņ╣śļŻī 48ņŻ╝ Ēøä HBV DNA ņØīņĀäņŚÉ ļīĆĒĢ£ ļÅģļ”ĮņĀüņØĖ ņśłņĖĪņØĖņ×ÉņśĆļŗż. ņ╣śļŻī 12ņŻ╝ Ēøä ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæņØĖ ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(EVR)ņØĆ ļŗ©ļ│Ćļ¤ē ļČäņäØņŚÉņä£ HBeAgņØś Ēśłņ▓Ł ņåīņŗżņØś ļÅģļ”ĮņĀü ņśłņĖĪņØĖņ×ÉņśĆņ£╝ļ®░ ĒŖ╣Ē׳ ņ╣śļŻī 48ņŻ╝ Ēøä HBV DNA ņØīņĀäņØś ļÅģļ”ĮņĀü ņśłņĖĪņØĖņ×ÉļĪ£ļÅä ĒÖĢņØĖļÉśņ¢┤ ņ╣śļŻī ņżæ ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(EVR)ņØ┤ ņןĻĖ░ņĀüņØĖ ņ╣śļŻī ļ░śņØæņØä ņśłņĖĪĒĢśļŖö ļŹ░ ņ£ĀņÜ®ĒĢĀ Ļ▓āņØ┤ļŗż.
ĒĢ£ĒÄĖ, ņØ┤ļ▓ł ņŚ░ĻĄ¼ņŚÉņä£ ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ£ĀņĀäņ×ÉĒśĢ ļé┤ņä▒(genotypic resistance)ņØĆ ļ░öņØ┤ļ¤¼ņŖż ļÅīĒīīĒśäņāü(viral breakthrough)ņØä ļ│┤ņØĖ ĒÖśņ×É 6ļ¬ģ ņżæ BĒśĢ Ļ░äņŚ╝ ļ░öņØ┤ļ¤¼ņŖżņØś ņ£ĀņĀäņ×ÉĒśĢ ļé┤ņä▒ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢ£ ņśżņ¦ü 1ļ¬ģņŚÉņä£ļ¦ī ļ░£Ļ▓¼ļÉśņŚłņ£╝ļ®░ ļ░£ņāØĒĢ£ ļ│ĆņØ┤ļŖö rtT184, rtS202ņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ ļ│ĆņØ┤ļŖö ņŚöĒģīņ╣┤ļ╣äņ¢┤ņŚÉ ļīĆĒĢ£ ņ£ĀņĀäņ×ÉĒśĢ ļé┤ņä▒ ņżæ ņĢĮņĀ£ Ļ░Éņłśņä▒ņØä Ļ░Éņåīņŗ£ĒéżļŖö ļŹ░ Ļ░Ćņן Ēü░ ņŚŁĒĢĀņØä ĒĢśļŖö ņŚ╝ĻĖ░ņä£ņŚ┤ņØś ļÅīņŚ░ļ│ĆņØ┤ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[21]. Tenney ļō▒[7]ņØĆ ļØ╝ļ»ĖļČĆļöśņŚÉ ļé┤ņä▒ņØä ļ│┤ņØ┤ļŖö ĒÖśņ×ÉņŚÉĻ▓ī ņŚöĒģīņ╣┤ļ╣äņ¢┤ļź╝ Ēł¼ņŚ¼ĒĢĀ Ļ▓ĮņÜ░ ļ░öņØ┤ļ¤¼ņŖż ļÅīĒīīĒśäņāüņØś ļłäņĀüļ░£ņāØļźĀņØ┤ 1, 2, 3, 4, 5ļģäņŚÉ 1.4%, 10.0%, 27.0%, 39.5%, 43.0%, ņ£ĀņĀäņ×ÉĒśĢ ļé┤ņä▒ņØś ļłäņĀü ļ░£ņāØļźĀņØĆ 1, 2, 3, 4, 5ļģäņŚÉ 6%, 15%, 36%, 46%, 51%ļĪ£ ņ£ĀņĀäņ×ÉĒśĢ ļé┤ņä▒ņØ┤ ļ░öņØ┤ļ¤¼ņŖż ļÅīĒīīĒśäņāüļ│┤ļŗż ņ╣śļŻīĻĖ░Ļ░äņŚÉ ļö░ļØ╝ 1.2-4.3ļ░░ ļŹö ļ¦ÄņØ┤ ļ░£ņāØĒ¢łņ£╝ļ®░ ļīĆļČĆļČä ņ£ĀņĀäņ×ÉĒśĢ ļé┤ņä▒ņØ┤ ļ░£ņāØĒĢ£ ĒÖśņ×ÉņŚÉņä£ ļ░öņØ┤ļ¤¼ņŖż ļÅīĒīīĒśäņāüņØ┤ ļ░£ņāØĒ¢łļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļŗżļźĖ ņŚ░ĻĄ¼ļōżņŚÉņä£ļÅä ņĢĮņĀ£ ņł£ņØæļÅäĻ░Ć ņóŗņØĆļŹ░ļÅä ļČłĻĄ¼ĒĢśĻ│Ā ļ░£ņāØĒĢ£ ļ░öņØ┤ļ¤¼ņŖż ļÅīĒīīĒśäņāüņØś ņøÉņØĖņØĆ ņ£ĀņĀäņ×ÉĒśĢ ļé┤ņä▒ņØ┤ ĻĘĖ ņøÉņØĖņØ┤ļØ╝Ļ│Ā ļ│┤Ļ│ĀĒĢśĻ│Ā ņ׳ļŗż[22,23]. ļö░ļØ╝ņä£ Ēśäņ×¼ ņ╣śļŻī Ļ▓ĮĻ│╝ ņżæ ņĢĮņĀ£ ļé┤ņä▒ņØä ļ░£Ļ▓¼ĒĢśĻĖ░ ņ£äĒĢ┤ Ēśłņ▓Ł HBV DNAĻ░Æņ£╝ļĪ£ ļ░öņØ┤ļ¤¼ņŖż ļÅīĒīīĒśäņāüņØä ļ¬©ļŗłĒä░ļ¦üĒĢśĻ│Ā ņ׳ļŖöļŹ░ ļ░öņØ┤ļ¤¼ņŖż ļÅīĒīīĒśäņāü ļ░£Ļ▓¼ ņŗ£ ĒÖśņ×ÉļŖö ņØ┤ļ»Ė ņ£ĀņĀäņ×ÉĒśĢ ļé┤ņä▒ņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗżĻ│Ā ļ│┤ņĢäļÅä ļ¼┤ļ░®ĒĢśļŗżĻ│Ā ņāØĻ░üļÉ£ļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŚöĒģīņ╣┤ļ╣äņ¢┤ ņ┤łņ╣śļŻī ņŗ£ ļ░öņØ┤ļ¤¼ņŖż ļÅīĒīīĒśäņāüņØś ļłäņĀü ļ░£ņāØļźĀņØ┤ 1ļģä, 2ļģä, 3ļģäņŚÉ 1.3%, 11.5%, 16.1%ņśĆļŗż. ņØ┤ļŖö ņØ┤ņĀäņŚÉ ļØ╝ļ»ĖļČĆļöśņØ┤ļéś ņĢäļŹ░Ēżļ╣äņ¢┤ ļō▒ņØś ĒĢŁļ░öņØ┤ļ¤¼ņŖżņĀ£ ņ╣śļŻīļź╝ ļ░øņ¦Ć ņĢŖĻ│Ā ņŚöĒģīņ╣┤ļ╣äņ¢┤ļź╝ ņ┤łņ╣śļŻīļĪ£ ņŗ£Ē¢ēĒĢ£ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ Ē¢łļŗżļŖö ņĀÉĻ│╝ ĒÅēĻĘĀ ņČöņĀüĻĖ░Ļ░äņØ┤ 133.7ņŻ╝ļĪ£ ņ¦¦ļŗżļŖö ņĀÉņŚÉņä£ ņ¦ĆĻĖłĻ╣īņ¦Ć ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņØś ļé┤ņä▒ ļ░£ņāØļźĀĻ│╝ļŖö Ēü░ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. Ē¢źĒøä ļŹö ļ¦ÄņØĆ ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ņČöņĀüĻĖ░Ļ░äņØä ļŹö ĻĖĖĻ▓ī ļ│┤ņĢśņØä ļĢīļŖö ļŗżļźĖ Ļ▓░Ļ│╝Ļ░Ć ļéśņś¼ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņśłņāüļÉ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņØś ĒĢ£Ļ│äņĀÉņØĆ ļŗ©ņØ╝ĻĖ░Ļ┤ĆņØś ĒøäĒ¢ź ņŚ░ĻĄ¼ļØ╝ļŖö ņĀÉ, ņČöņĀüĻ┤Ćņ░░ Ļ░äĻ▓®ņØ┤ ĒÖśņ×Éļ¦łļŗż ņ░©ņØ┤Ļ░Ć ņ׳ņ¢┤ ĒŖ╣ņĀĢ ņŗ£ņĀÉņŚÉņä£ Ēśłņ▓Ł HBV DNAņØś Ļ░ÉņåīĒÅŁņØä ņĀĢĒÖĢĒĢśĻ▓ī ĒīīņĢģĒĢĀ ņłś ņŚåņŚłĻ│Ā ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæņØä ĒÅēĻ░ĆĒĢśļŖö ņČöņĀüĻ┤Ćņ░░ĻĖ░Ļ░äņØ┤ ņ¦¦ņĢä ļé┤ņä▒ ļ░£ņāØņŚÉ ļīĆĒĢ£ ļČäņäØņŚÉ ĒĢ£Ļ│äĻ░Ć ņ׳ļŗżļŖö ņĀÉ ļō▒ņ£╝ļĪ£ ņāØĻ░üĒĢ£ļŗż. ļśÉĒĢ£ ņÜ░ļ”¼ļéśļØ╝ņØś ņŚöĒģīņ╣┤ļ╣äņ¢┤ņØś ļÅäņ×ģ ņŗ£ĻĖ░Ļ░Ć 2007ļģä 3ņøöļĪ£ ĻĘĖ ĻĖ░Ļ░äņØ┤ ĻĖĖņ¦Ć ņĢŖņĢä ņ╣śļŻī ĻĖ░Ļ░äņØ┤ 48ņŻ╝ņŚÉņä£ 96ņŻ╝ņØĖ ĒÖśņ×ÉļōżņØ┤ ļŗżņłś ĒżĒĢ©ļÉśņŚłņ£╝ļ®░ ņØ┤ļĪ£ ņØĖĒĢ┤ Ļ▓░Ļ│╝ņØś ĒĢ┤ņäØņŚÉ Ēś╝ļ×ĆņØ┤ ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ£ļŗż. ļ╣äļ¦īņØĆ ļ¦īņä▒ BĒśĢĻ░äņŚ╝ņØ┤ ņŚåļŖö ņé¼ļ×īņŚÉņä£ļÅä Ļ░äņłśņ╣ś ņāüņŖ╣Ļ│╝ ņŚ░Ļ┤ĆņØ┤ ņ׳Ļ│Ā ļ╣äļ¦īĻ│╝ Ļ┤ĆļĀ©ļÉ£ ļ╣äņĢīņĮ£ņä▒ ņ¦Ćļ░®Ļ░äņØ┤ ļ¦īņä▒ BĒśĢĻ░äņŚ╝ ĒÖśņ×ÉņŚÉņä£ļÅä ļÅÖļ░śļÉĀ ņłś ņ׳ņ£╝ļéś[24,25] ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ╣äļ¦īĻ│╝ ņŚ░Ļ┤ĆļÉ£ ņ▓┤ņ¦łļ¤ē ņ¦Ćņłś(BMI)ņŚÉ ļīĆĒĢ┤ņä£ļŖö ĒīīņĢģĒĢśņ¦Ć ļ¬╗ ĒĢśņśĆļŗż. ļ╣äļ¦īņØ┤ ņŚöĒģīņ╣┤ļ╣äņ¢┤ņØś ņ╣śļŻī ĒÜ©Ļ│╝ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢśņŚ¼ ņČöĒøä ļŹö ļ¦ÄņØĆ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ£ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£ ņŚöĒģīņ╣┤ļ╣äņ¢┤ļŖö ņ┤łņ╣śļŻī ļ¦īņä▒ BĒśĢĻ░äņŚ╝ ĒÖśņ×ÉņŚÉņä£ ņÜ░ņłśĒĢ£ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ļ│┤ņØ┤ļ®░ ņ╣śļŻī ĻĖ░Ļ░äņØ┤ ĻĖĖņ¢┤ņ¦łņłśļĪØ ņŚöĒģīņ╣┤ļ╣äņ¢┤ņØś ņāØĒÖöĒĢÖņĀü ļ░śņØæ, ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ ļ░Å Ēśłņ▓Ł ļ░śņØæļźĀņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ņ╣śļŻī 12ņŻ╝ Ēøä ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæņØĖ ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(EVR)ņØĆ HBeAgņØś Ēśłņ▓Ł ņåīņŗżņØ┤ļéś Ēśłņ▓ŁņĀäĒÖśņØś ļÅģļ”ĮņĀü ņśłņĖĪņØĖņ×ÉņśĆņ£╝ļ®░ ĒŖ╣Ē׳ Ēśłņ▓Ł HBV DNA ņØīņĀäņØś ļÅģļ”ĮņĀü ņśłņĖĪņØĖņ×ÉļĪ£ļÅä ĒÖĢņØĖļÉśņ¢┤ ņ╣śļŻī ņżæ ņ┤łĻĖ░ ļ░öņØ┤ļ¤¼ņŖż ļ░śņØæ(EVR)ņØ┤ ņŚöĒģīņ╣┤ļ╣äņ¢┤ņØś ņןĻĖ░ņĀüņØĖ ņ╣śļŻī ļ░śņØæņØä ņśłņĖĪĒĢśļŖöļŹ░ ņ£ĀņÜ®ĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üĒĢ£ļŗż.
REFERENCES
1. Shepard CW, Simard EP, Finelli L, Fiore AE, Bell BP. Hepatitis B virus infection: epidemiology and vaccination. Epidemiol Rev 2006;28:112ŌĆō125.


2. Korea centers for disease control and prevention: the fourth Korea National Health and Nutrition Examination Survey 2007. 2008.
3. Iloeje UH, Yang HI, Su J, Jen CL, You SL, Chen CJ. Predicting cirrhosis risk based on the level of circulating hepatitis B viral load. Gastroenterology 2006;130:678ŌĆō686.


4. Chen CJ, Yang HI, Su J, et al. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level. JAMA 2006;295:65ŌĆō73.


5. Chang TT, Gish RG, de Man R, et al. A comparison of entecavir and lamivudine for HBeAg-positive chronic hepatitis B. N Engl J Med 2006;354:1001ŌĆō1010.


6. Leung N, Peng CY, Hann HW, et al. Early hepatitis B virus DNA reduction in hepatitis B e antigen-positive patients with chronic hepatitis B: a randomized international study of entecavir versus adefovir. Hepatology 2009;49:72ŌĆō79.


7. Tenney DJ, Rose RE, Baldick CJ, et al. Long-term monitoring shows hepatitis B virus resistance to entecavir in nucleoside-na├»ve patients is rare through 5 years of therapy. Hepatology 2009;49:1503ŌĆō1514.


8. Lok AS, Lai CL, Leung N, et al. Long-term safety of lamivudine treatment in patients with chronic hepatitis B. Gastroenterology 2003;125:1714ŌĆō1722.


9. The Korean Association for the Study of the Liver (KASL). KASL Clinical Practice Guidelines: management of chronic hepatitis B. Clin Mol Hepatol 2012;18:109ŌĆō162.

10. Song BC, Chae HB, Kim YN, Lee BS, Cho YK. Pretreatment levels of HBV DNA and early virological response during entecavir therapy predicts HBeAg loss in HBeAgpositive chronic hepatitis B patients. Korean J Hepatol 2009;15(Supp1 3):S42.

11. Lai CL, Shouval D, Lok AS, et al. Entecavir versus lamivudine for patients with HBeAg-negative chronic hepatitis B. N Engl J Med 2006;354:1011ŌĆō1020.


12. Janssen HL, van Zonneveld M, Senturk H, et al. Pegylated interferon alfa-2b alone or in combination with lamivudine for HBeAg-positive chronic hepatitis B: a randomised trial. Lancet 2005;365:123ŌĆō129.



13. Perrillo RP, Schiff ER, Davis GL, et al. A randomized, controlled trial of interferon alfa-2b alone and after prednisone withdrawal for the treatment of chronic hepatitis B: the Hepatitis Interventional Therapy Group. N Engl J Med 1990;323:295ŌĆō301.


14. Lok AS, Wu PC, Lai CL, et al. A controlled trial of interferon with or without prednisone priming for chronic hepatitis B. Gastroenterology 1992;102:2091ŌĆō2097.



15. Tseng TC, Liu CJ, Wang CC, et al. A higher alanine aminotransferase level correlates with earlier hepatitis B e antigen seroconversion in lamivudine-treated chronic hepatitis B patients. Liver Int 2008;28:1034ŌĆō1041.


16. Westland C, Delaney W 4th, Yang H, et al. Hepatitis B virus genotypes and virologic response in 694 patients in phase III studies of adefovir dipivoxil1. Gastroenterology 2003;125:107ŌĆō116.


17. Fung SK, Chae HB, Fontana RJ, et al. Virologic response and resistance to adefovir in patients with chronic hepatitis B. J Hepatol 2006;44:283ŌĆō290.


18. Hadziyannis SJ, Papatheodoridis GV. Hepatitis B e antigen-negative chronic hepatitis B: natural history and treatment. Semin Liver Dis 2006;26:130ŌĆō141.


19. Papatheodoridis GV, Dimou E, Dimakopoulos K, et al. Outcome of hepatitis B e antigen-negative chronic hepatitis B on long-term nucleos(t)ide analog therapy starting with lamivudine. Hepatology 2005;42:121ŌĆō129.


20. Zarski JP, Marcellin P, Cohard M, Lutz JM, Bouche C, Rais A. Comparison of anti-HBe-positive and HBe-antigenpositive chronic hepatitis B in France: French Multicentre Group. J Hepatol 1994;20:636ŌĆō640.


21. Tenney DJ, Levine SM, Rose RE, et al. Clinical emergence of entecavir-resistant hepatitis B virus requires additional substitutions in virus already resistant to Lamivudine. Antimicrob Agents Chemother 2004;48:3498ŌĆō3507.



22. Degertekin B, Lok AS. Monitoring antiviral resistance in patients receiving nucleos(t)ide analog therapies for hepatitis B: which method should be used? J Hepatol 2008;48:892ŌĆō894.


23. Lok AS, Zoulim F, Locarnini S, et al. Antiviral drugresistant HBV: standardization of nomenclature and assays and recommendations for management. Hepatology 2007;46:254ŌĆō265.


Cumulative rates of virological response during entecavir therapy (59.7%, 82%, 88.3%, 89.6%, and 93.1% at weeks 12, 24, 48, 96, and 144, respectively).
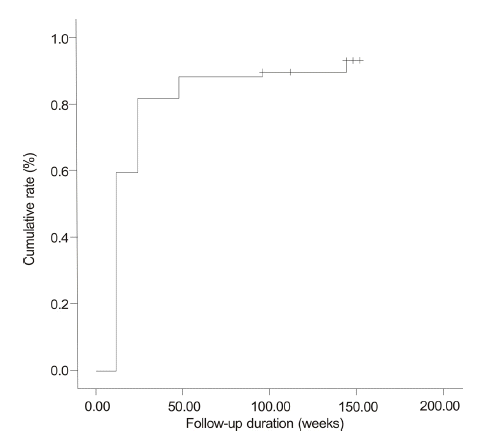
Figure┬Ā1.
Cumulative rates of biochemical response during entecavir therapy (51.9%, 74%, 84.4%, 94.8%, and 98.3% at weeks 12, 24, 48, 96, and 144, respectively).
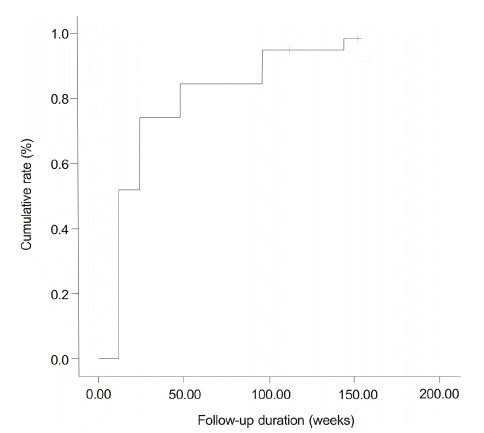
Figure┬Ā2.
Cumulative rates of hepatitis B e antigen (HBeAg) loss during entecavir therapy (10.5%, 18.4%, 28.9%, 36.8%, and 47.4% at weeks 12, 24, 48, 96, and 144, respectively).
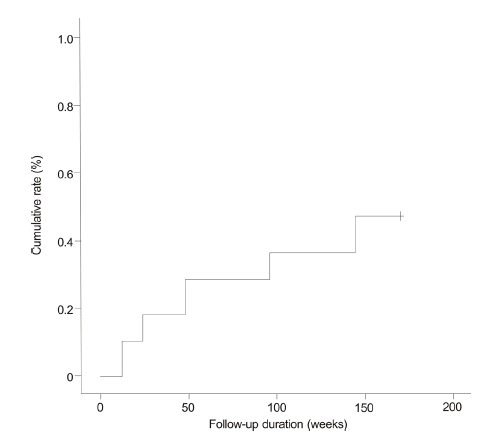
Figure┬Ā3.
Cumulative rates of hepatitis B e antigen (HBeAg) seroconversion during entecavir therapy (7.9%, 18.4%, 21.1%, 28.9%, and 39.5% at weeks 12, 24, 48, 96 and 144, respectively).
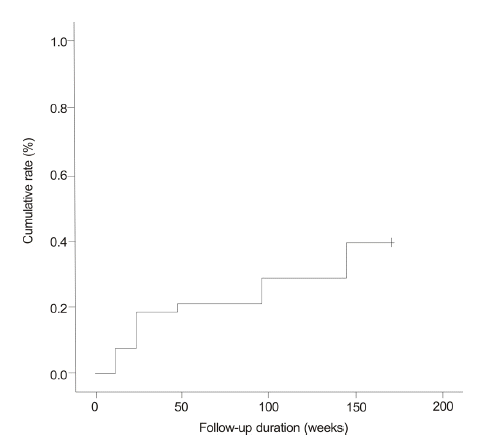
Figure┬Ā4.
Comparison of virological responses in hepatitis B e antigen (HBeAg)-positive and HBeAg-negative patients. The cumulative virological response rates at weeks 12, 24, 48, 96, and 144 were 42.1%, 68.4%, 81.6%, 84.2%, and 92.1%, respectively, in HBeAg-positive patients and those at weeks 12 and 24 were 76.9% and 94.9%, respectively, in HBeAg-negative patients (p = 0.008).

Figure┬Ā5.
Comparison of biochemical responses in hepatitis B e antigen (HBeAg)-positive and HBeAg-negative patients. The cumulative biochemical response rates at weeks 12, 24, 48, and 96 were 44.7%, 68.4%, 81.6%, and 92.1%, respectively, in HBeAg-positive patients and 59%, 79.5%, 87.2%, and 97.4%, respectively, in HBeAg-negative patients (p = 0.296).
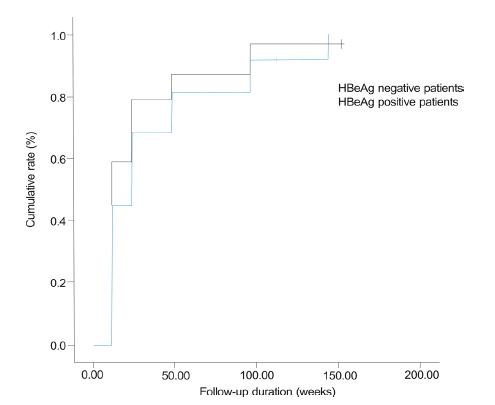
Figure┬Ā6.
Table┬Ā1.
Baseline characteristics of 77 nucleoside-naïve patients with chronic hepatitis B who received entecavir therapy
Table┬Ā2.
Comparison of baseline characteristics between partial virological responders (PVRs) and virological responders (VRs) at week 48
Table┬Ā3.
Comparison of baseline characteristics between hepatitis B e antigen (HBeAg)-positive and HBeAg-negative patients
Table┬Ā4.
Factors associated with hepatitis B virus (HBV) DNA negativity after 48 weeks of entecavir therapy, as determined by polymerase
chain reaction (PCR)
Table┬Ā5.
Factors associated with hepatitis B e antigen (HBeAg) loss after 48 weeks of entecavir therapy in 38 HBeAg-positive patients



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




