 |
 |
| Korean J Med > Volume 84(6); 2013 > Article |
|
Abstract
Autoimmune pancreatitis (AIP) is a unique type of chronic pancreatitis in which pathogenesis involves autoimmune mechanism. During the past decade, several different diagnostic criteria for AIP have been reported from various countries. A set of international consensus diagnostic criteria and algorithm for AIP has recently been proposed by a consensus of expert opinion. The goal of the international consensus diagnostic criteria and algorithm for AIP is to develop criteria that can be applied worldwide, taking into consideration the marked differences in clinical practice patterns between countries. They also aim at diagnosing AIP nonsurgically and avoiding misdiagnosis of pancreatobiliary malignancies as AIP. This review discusses the recent advances in the diagnosis and management of AIP based on the international consensus diagnostic criteria. We also suggest modified algorithm for diagnosing AIP for Korean practice. (Korean J Med 2013;84:789-797)
자가면역성 췌장염은 특이한 형태의 만성췌장염으로 혈중 IgG4의 증가, 췌장 조직 내 림프구와 형질세포의 침윤, 스테로이드치료에 대한 좋은 반응 등을 특징으로 한다[1,2]. 국제적으로는 1961년 Sarles 등[3]이 고감마글로불린혈증을 동반하는 특이한 형태의 췌장염을 보고하였고 1995년 Yoshida 등[4]이 자가면역성 췌장염(autoimmune pancreatitis)이라는 용어를 처음으로 사용하였다. 자가면역성 췌장염은 드문 질환으로 국내에서는 2002년 Kim 등[5]이 자가면역성 췌장염을 처음으로 보고한 이래 우리나라 전국적으로는 200예 정도가 보고되어 있다.
자가면역성 췌장염은 췌장암과 비슷한 임상양상을 보이지만 적절하게 진단된다면 스테로이드 투여로 극적인 호전을 볼 수 있기에 임상의에게 진단의 기쁨을 줄 수 있는 질환이다. 그러나 췌장암을 자가면역성 췌장염으로 오인한다면 병이 진행하여 수술시기를 놓칠 수 있기 때문에 올바른 진단과 치료를 위한 노력이 필요하다. 어떤 질환에 대한 올바른 이해를 돕고 적절히 진단하기 위해서는 진단기준을 명확히 설정하는 것이 중요한데 자가면역성 췌장염의 진단기준의 목적으로는 자가면역성 췌장염을 적절하게 진단하는 것뿐만 아니라 췌장암을 자가면역성 췌장염으로 오인하는 것을 피하는 것도 중요하다고 할 수 있다[2].
자가면역성 췌장염의 진단기준은 2002년 일본췌장학회에서 최초로 진단기준을 발표하였고, 2006년 개정판을 발표하였다[6,7]. 서구에서는 Mayo Clinic에서 2006년 HISORt 진단기준(histology, imaging, serology, other organ involvement, response to steroid therapy, HISORt)을 발표하였고, 2009년에 개정된 HISORt 진단기준을 발표하여서 서구에서 널리 쓰이고 있다[8,9]. 그 외에도 이태리와 독일에서도 각 나라의 실정에 맞게 진단기준을 제정하여 사용하고 있다[10,11]. 국내에서는 서울아산병원에서 2006년에 Kim 진단기준[12,13]을 발표한 이후 2007년에 대한췌담도학회에서 자가면역성 췌장염의 진단기준[14]을 제정하였는데 우리나라 진단기준의 특징은 임상에서 자가면역성 췌장염의 진단을 수월하게 하고 진단율을 높일 수 있도록 한 것이다. 국제적 합의진단기준의 필요가 대두된 이후 2008년에 우리나라와 일본이 주축이 되어 아시아 진단기준[15]을 발표하였고, 2011년에 세계췌장학회에서 자가면역성 췌장염에 대한 국제진단기준(international consensus diagnostic criteria for autoimmune pancreatitis)을 발표하였다[2]. 국제진단기준을 제정하기 위하여 세계췌장학회는 이전에 발표된 각 나라의 진단기준을 모두 검토하여서 서로의 장점을 받아들였고 국가별로 다른 임상관행에 모두 적용될 수 있도록 하였다. 이에 저자들은 자가면역성 췌장염에 대한 최신지견을 국제진단기준을 중심으로 소개하고자 한다.
자가면역성 췌장염은 병리소견 및 임상양상에 따라서 두 개의 아형으로 나눌 수 있다. 제 1형 자가면역성 췌장염은 병리적으로 lymphoplasmacytic sclerosing pancreatitis (LPSP)에 해당하며 전신 IgG4 연관질환(IgG4-related systemic disease)의 스펙트럼에 속한다[16]. 제2형 자가면역성 췌장염은 병리적으로 idiopathic duct-centric chronic pancreatitis (IDCP)에 해당하며 전신 IgG4 연관질환의 스펙트럼에 속하지 않는다[17].
국제진단기준에서는 자가면역성 췌장염의 진단을 위한 기준으로 5개의 주요한 특징(cardinal features)을 선정하였는데 (1) 영상소견(췌장실질 및 췌관), (2) 혈청소견(혈청 IgG4),(3) 췌장 외 장기침범(other organ involvement), (4) 췌장의 병리소견, 그리고 (5) 스테로이드에 대한 반응이 그것들이며 각각 특징들에 대하여 진단에 대한 신뢰수준을 2단계로 나누었다(level 1 vs. level 2) [2]. 영상소견과 스테로이드에 대한 반응은 제1형과 제2형 자가면역성 췌장염에서 똑같은 것으로 알려져 있으며, 혈청소견, 췌장 외 장기침범 및 췌장의 병리소견은 각 아형 간에 차이를 보인다(Table 1) [2,18-20]. 동양에서는 서양에 비하여 제2형 자가면역성 췌장염은 덜 발생하는 것으로 알려져 있지만 우리나라에서도 제2형 자가면역성 췌장염의 보고가 증가하고 있으므로 각 아형 간의 차이에 대해 아는 것도 필요하다[20]. 국제진단기준에서는 제1형과 제2형의 진단기준을 따로 마련하여 각각을 구분하여 진단할 수 있도록 하였으며 아형을 구분할 수 없는 경우는 ‘달리 분류되지 않는 자가면역성 췌장염(autoimmune pancreatitisnot otherwise specified)’로 진단하도록 하였다(Tables 2 and 3).
자가면역성 췌장염의 특징적인 영상소견은 췌장이 소시지 모양으로 종대된 것과 주췌관의 불규칙한 협착이다[21]. 이러한 영상소견은 CT나 자기공명영상과 같은 영상검사에 의한 췌장실질에 대한 영상과 내시경적 역행성 담췌관 조영술(endoscopic retrograde cholangiopancreatography, ERCP) 또는 자기공명 담췌관 조영술에 의한 췌관에 대한 영상으로 나눌 수 있다.
CT와 같은 단면영상 검사에서 자가면역성 췌장염의 전형적인 소견은 췌장의 미만성 종대가 있고 저음영 띠가 췌장 가장자리에 관찰되며 균일한 조영증강(homogeneous enhancement)이 관찰되는 경우이다. 이러한 전형적인 영상소견이 있는 경우는 보고에 따라 다른데 30-80% 정도로 보고되며 비교적 쉽게 자가면역성 췌장염을 의심할 수 있다[8,22,23]. 자가면역성 췌장염의 비전형적인 영상소견은 췌장의 국소종대, 췌장종괴, 췌관확장 등이 있으며 이런 경우에는 특히 췌장암을 배제하는 것이 자가면역성 췌장염의 진단에 있어서 필수적이다[9].
국제진단기준에서는 자가면역성 췌장염의 진단에서 췌장실질의 영상소견이 전형적인지 비전형적인지에 따라서 진단에 필요한 이차적인 췌관영상, 혈청소견, 병리소견, 췌장 외 장기침범의 정도가 다르도록 하였고 영상소견과 아형에 따라서 각각 다른 알고리듬을 통하여 진단을 돕도록 하였다[2].
자가면역성 췌장염의 특징적인 췌관 조영술 소견은 다음과 같다. 첫째는 주췌관의 긴 협착(전체 주췌관 길이의 1/3 이상 또는 3 cm 이상)이고, 둘째는 협착 상류 주췌관의 확장의 부재(주췌관의 직경이 5 mm 이하)이며, 셋째는 다발성 주췌관 협착이 존재하는 경우이다[24]. 최근 ERCP의 진단능에 대한 국제적 다기관 연구에 따르면 이중 첫 번째와 두 번째 소견이 같이 있으면 특이도가 100%로 매우 특징적인 소견이었으므로 췌장암과의 감별에 중요한 도움이 될 수 있다[25]. 자가면역성 췌장염의 비특이적인 췌관 조영술 소견으로는 국소적 췌관협착이나 협착 상류 주췌관의 확장도 드물게 관찰될 수 있다. 최근의 연구에 따르면 제1형과 제2형 자가면역성 췌장염에서 ERCP 소견은 유사한 것으로 보고되었다[20]. 제2형 자가면역성 췌장염은 혈청소견이나 췌장 외 장기침범에서 진단에 도움을 얻기 어려우므로 ERCP가 진단에 있어서 중요한 역할을 할 것으로 생각한다[26].
우리나라와 일본에서는 자가면역성 췌장염이 의심되는 경우 대부분 ERCP를 시행하지만 서구에서는 ERCP를 대부분 시행하지 않는다[2]. 이러한 임상관행은 진단기준에도 반영되어 있는데 아시아 진단기준에서 췌관 조영술은 진단에 있어서 필수적 항목이지만 서구의 개정된 HISORt 진단기준에는 췌관 조영술이 진단기준에 아예 포함되어 있지 않다[9,15]. 국제진단기준에서는 췌관 조영술을 포함하였으나 필수적이지는 않게 함으로써 임상관행에 상관없이 자가면역성 췌장염을 진단할 수 있도록 하였다. 췌관 조영술은 췌장실질영상이 비특이적이거나, 혈청소견에 특이점이 없고 췌장 외 장기 침범이 없는 경우 특히 진단에 유용하다.
초기 보고에 의하면 자가면역성 췌장염의 혈청소견으로 특징적인 것은 감마글로불린의 증가이었으나 세분화된 검사들이 연구되면서 그 다음에는 혈청 IgG의 증가, 그 중에서도 혈청 IgG4의 증가가 진단에 있어서 더 중요하다는 연구결과들이 보고되었다[27]. 진단기준도 그에 따라 변화하였는데 아시아 진단기준에서는 혈청 IgG 또는 IgG4의 증가 또는 자가항체(autoantibody)의 존재이었으며 개정된 HISORt 진단기준에서는 혈청 IgG4의 증가만 인정되었다. 비록 자가면역성 췌장염에서 혈청 IgG의 증가 및 항핵항체(antinuclear antibody)와 같은 자가항체의 존재가 흔히 발견되지만, 혈청 IgG, IgG4와 자가항체를 혈청진단기준에 모두 포함한다면 특이도가 높지 않아서 췌장암과의 감별에 오히려 장애가 될 수 있다[2]. 결과적으로 국제진단기준에서는 혈청 IgG4의 증가만이 자가면역성 췌장염의 혈청소견으로 인정되었다. 이러한 혈청 IgG4의 증가는 제1형 자가면역성 췌장염의 특징으로서 제2형 자가면역성 췌장염에서는 특징적인 혈청소견이 아직 보고되지 않았다. 또한 췌장암이나 담도암에서도 혈청 IgG4의 증가가 많게는 5-10%에서 보고되므로 특히 췌장의 종괴 같은 비전형적 영상에서는 혈청 IgG4의 증가만으로는 자가면역성 췌장염을 진단할 수 없다는 것도 알아야 한다[9,28,29].
제1형 자가면역성 췌장염은 전신 IgG4 연관질환의 스펙트럼에 속하는 질환으로서 담관, 타액선, 신장, 후복강, 폐, 심낭, 전립선, 갑상선, 임파선, 뇌하수체 등 전신의 대부분의 장기를 침범할 수 있다[16,30]. 아시아 진단기준에서는 췌장외 장기침범이 빠져 있었으나 국제진단기준에서는 받아들여져서 췌장 외 장기침범 역시 자가면역성 췌장염의 진단에 이용할 수 있도록 하였다. 국제진단기준에서는 췌장 외 장기침범의 진단을 위하여 병리적으로는 전신 IgG4 연관질환에 합당한 소견을 보일 때, 영상에 의해서는 근위담관협착, 후복강섬유화, 타액성종대 및 신장침범을 선정하여 췌장암과의 감별에 도움이 되도록 하였다[2].
제2형 자가면역성 췌장염에서는 이러한 췌장 외 장기침범은 관찰되지 않지만 궤양성 대장염이 잘 동반되는 것으로 알려져 있다[19].
제1형 자가면역성 췌장염의 병리소견은 LPSP로서 이것의 특징은 (1) periductal lymphoplasmacytic infiltrate, (2) obliterative phlebitis, (3) storiform fibrosis, 그리고 (4) abundant IgG4-positive cells이다. 제2형 자가면역성 췌장염의 병리소견은 IDCP로서 이것의 특징은 granulocytic infiltration of duct wall (GEL) with or without granulocytic acinar inflammation이며 또 다른 용어로는 GEL양성 자가면역성 췌장염이라고도 한다. 이전 아시아 진단기준에서는 수술적으로 절제한 검체를 통한 병리검사에서만 자가면역성 췌장염의 확진을 인정하였으나 국제진단기준에서는 수술을 통한 검체뿐만 아니라 생검을 통하여 얻은 검체를 이용한 자가면역성 췌장염의 확진을 인정하였다.
스테로이드 치료에 대한 반응 여부는 우리나라와 미국의 진단기준에는 포함되어 있었지만 일본의 진단기준에는 빠져있었다. 일본췌장학회가 경계하였던 것은 자가면역성 췌장염과 췌장암과의 감별진단을 위해서 췌장암을 감별하기 위한 다른 검사를 시행하지 않고 비교적 쉬운(facile) 스테로이드 투여를 택하여 스테로이드 반응여부를 관찰하는 동안 예후가 극히 불량한 췌장암의 진단 및 치료가 늦어지는 것이었다[7]. 국제진단기준에서는 자가면역성 췌장염의 진단을 위하여 스테로이드 시험(steroid trial)을 시행할 때에는 반드시 악성종양을 배제하기 위하여 내시경초음파 유도하 세침흡인검사 등을 스테로이드 투여 전에 하여야 한다고 설명하였다. 자가면역성 췌장염의 진단을 위하여 스테로이드를 적절하게 이용하기 위해서는 (1) 조심스러운 환자 선택, (2) 스테로이드 반응에 대한 객관적 지표의 설정 그리고 (3) 2주 뒤 스테로이드 반응평가가 필요하다[26].
진단을 위하여 스테로이드 치료에 대한 반응을 이용하기 위해서는 먼저 환자에게 자가면역성 췌장염을 의심할 만한 충분한 근거가 있어야 한다. 이 근거들은 영상소견, 혈청소견, 췌장 외 장기침범, 병리소견에서 자가면역성 췌장염을 진단할 수는 없지만 의심할 수 있는 소견을 의미한다. 이러한 근거들이 있는 환자에서 췌담도암을 배제하기 위한 검사들을 시행한 후 암세포가 보이지 않는다면 스테로이드에 대한 치료반응을 이용할 수 있다. 또한 임상의들은 자가면역성 췌장염이 췌담도암에 비하여 훨씬 드문 질환이라는 사실을 인지하고 있어야 한다.
국제진단기준에서는 스테로이드에 대한 양성반응을 췌장 또는 췌장 외 장기의 영상소견의 소실 또는 현저한 호전이 있는 경우로 정의하였다. 증가되었던 혈청 IgG4의 감소는 스테로이드 반응에 대한 지표로 이용하지 못하는데 췌장암 환자에서도 증가되었던 혈청 IgG4의 감소는 관찰되기 때문이다[2]. 또한 췌장암과 동반된 폐쇄성췌장염(obstructive pancreatitis)에 의한 췌장종대 또한 스테로이드 투여에 의하여 호전될 수 있으므로 스테로이드 반응 판정 시에 주의하여야한다[2,31]. 그러므로 췌장암과의 감별이 필요한 경우 스테로이드 반응에 대한 평가지표로는 주췌관 협착의 소실 및 췌장종괴의 소실 또는 현저한 호전으로 엄격하게 정의하여야 한다[31].
자가면역성 췌장염 진단을 위한 내시경 검사들 자가면역성 췌장염의 진단을 위해 중요한 내시경 검사는 ERCP와 내시경초음파 검사이다.
위에서 기술한 것과 같이 ERCP는 동양에서 특히 관행적으로 시행되며 특징적인 췌관소견이 관찰되는 경우 자가면역성 췌장염의 진단에 도움이 된다. ERCP는 췌관의 조영뿐만 아니라 담관을 조영할 수 있으며 또한 조직 검사를 같이 시행할 수 있어서 매우 중요한 역할을 한다. 담관암과의 감별이 필요한 경우는 우선 ERCP를 통하여서는 담관에 대한 생검 및 쇄자세포진(brush cytology)을 시행하여야 한다. ERCP를 통한 생검 및 쇄자세포진 검사의 민감도는 평균 60-70%정도로 아주 높지는 않지만 폐쇄성 황달이 동반된 경우에는 감황(relief of jaundice)을 시행하기 위하여 ERCP를 우선적으로 시행하므로 ERCP를 통한 생검 또는 쇄자세포진 검사를 우선적으로 추천한다[26,32]. 또한 담관 및 십이지장 주유두에 대한 생검을 시행한 후 IgG4 면역염색을 시행한다면 자가면역성 췌장염의 진단에 도움을 줄 수 있다[33,34].
전형적인 자가면역성 췌장염의 내시경초음파 소견은 전반적인 췌장의 종대와 함께 저에코소견 및 불균일하고 거친 소견을 보이는 것이나 이런 소견들은 다른 췌장염에서도 관찰될 수 있는 비특이적인 소견이다[35]. 최근에는 조영증강 내시경초음파(contrast-enhanced endoscopic ultrasonography) 또는 내시경초음파를 이용한 탄성초음파영상(elastography)을 이용하여서 췌장암과 자가면역성 췌장염을 감별할 수 있다는 보고가 있으나 아직 보고된 사례가 많지 않아서 널리 사용되기 위해서는 추가적인 연구가 필요하다[36-38]. 현재 자가면역성 췌장염의 진단에서 내시경초음파 검사의 가장 큰 역할은 췌장내 종괴를 묘출하고 조직 검사를 통하여 진단의 정확성을 올리는 것이다[21]. 내시경초음파 유도하에서 시행할 수 있는 조직 검사로는 미세침세포흡인 검사와 총생검술(core biopsy)이 있다.
현재 췌장암을 감별하기 위해 현재 가장 좋은 검사는 내시경초음파 유도하 세침세포흡인 검사이며 췌장암 진단에 대한 민감도는 평균 83%정도이다[39]. 그러나 세포진 검사(aspiration cytology)로는 표본의 크기가 작고 조직구조를 볼 수 없어서 자가면역성 췌장염은 진단할 수 없다[40]. 그러므로 자가면역성 췌장염의 병리진단을 위하여서는 총생검술을 통하여 조직을 획득하여야 한다. 내시경초음파 유도하 총생검술은 특히 췌두부의 병변에 대하여는 기술적인 어려움이 있었지만 최근 개발된 내시경초음파용 생검세침으로 이러한 어려움은 극복될 수 있을 것으로 기대된다[40,41]. 총생검술의 자가면역성 췌장염의 진단에 대한 민감도는 평균 68% 정도이며 내시경초음파 유도하 총생검술의 시행이 용이하지 않은 센터에서는 복부 초음파나 CT유도하 총생검술을 시행할 수 있다[26]. 특히 제2형 자가면역성 췌장염은 특이한 혈청소견이나 췌장 외 장기침범이 없어서 병리소견 없이는 확진할 수 없으므로 제2형 자가면역성 췌장염이 의심되면 췌장에 대한 총생검술을 먼저 시행하는 것이 추천된다.
국제진단기준의 발표에 의하면 각 아형과 영상소견의 특징에 따라서 세 개의 알고리듬으로 구분하여서 자가면역성 췌장염을 진단하도록 하였으나 여러 국가의 실정을 모두 고려하였기 때문에 매우 복잡하게 되어 있어서 실제 임상에서의 사용에 어려움이 있을 수 있다. 이에 우리나라의 임상관행에 맞게 간소화된 알고리듬을 제시하고자 한다(Fig. 1). 다만 비전형적인 영상소견을 보이는 자가면역성 췌장염의 진단은 많은 임상경험을 필요로 하므로 가급적이면 축적된 지식이 있고 다양한 검사방법을 보유한 3차 병원으로 전원하는 것을 권고한다.
자가면역성 췌장염은 스테로이드 치료에 아주 좋은 반응을 보이지만 40% 정도의 환자에서 재발을 하게 되며 담관과 같은 췌장 외 장기에서 재발하는 경우도 드물지 않다[42-45]. 재발은 주로 제1형 자가면역성 췌장염에서 발생하며 제2형에서는 드문 것으로 보고되었다[20,22]. 현재 재발된 자가면역성 췌장염의 치료에는 세 가지 방법이 있다. 첫 번째는 경구 스테로이드의 재투여가 있고 두 번째는 스테로이드와 면역 조절제를 같이 사용하는 방법이며, 세 번째로는 CD20항원을 표적으로하는 rituximab을 사용하는 것이다[46]. 재발된 환자에서의 유지요법은 통상적으로 초치료보다 더 높은 용량을 보다 오래 사용하는 것이 추천된다[47,48].
자가면역성 췌장염을 보다 쉽게 진단하고 췌장암과의 감별진단에 도움을 주고 여러 진단기준에 대한 국제적 합의를 위하여 최근 자가면역성 췌장염의 국제진단기준이 발표되었다. 자가면역성 췌장염에는 두 개의 아형이 있는데 제1형만 전신 IgG4 연관질환의 스펙트럼에 속한다. 자가면역성 췌장염의 전형적인 영상소견이 있는 경우 혈청소견, 췌장 외 조직침범 등의 방증(collateral evidence)이 있으면 자가면역성 췌장염으로 진단할 수 있다. 비전형적인 영상소견의 경우는 췌장암과의 감별이 필요하여서 자가면역성 췌장염의 진단을 위한 검사를 진행하기 위해서는 적절한 검사(대부분은 내시경초음파)를 이용하여 세포진 검사 또는 생검을 이용하여 악성종양이 없는 것을 확인하여야 한다. 비전형적인 영상소견의 경우 췌장암과의 감별을 위한 다른 검사들을 시행한 이후 스테로이드 시험을 조심스럽게 시행할 수 있다. 자가면역성 췌장염은 경구 스테로이드치료에 극적인 호전을 보이지만 40%의 환자에서 재발을 보인다. 국제진단기준은 국제적 합의에 의해 국가별로 다른 임상관행에 모두 적용될 수 있게 하였지만 복잡하다는 단점이 있다. 향후 추가적인 연구들에 의하여 더 간단하면서도 적절하게 자가면역성 췌장염을 진단할 수 있기를 기대한다.
REFERENCES
1. Kim KP, Kim MH, Song MH, Lee SS, Seo DW, Lee SK. Autoimmune chronic pancreatitis. Am J Gastroenterol 2004;99:1605–1616.


2. Shimosegawa T, Chari ST, Frulloni L, et al. International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the International Association of Pancreatology. Pancreas 2011;40:352–358.


3. Sarles H, Sarles JC, Muratore R, Guien C. Chronic inflammatory sclerosis of the pancreas: an autonomous pancreatic disease? Am J Dig Dis 1961;6:688-698. Am J Dig Dis 1961;6:688–698.

4. Yoshida K, Toki F, Takeuchi T, Watanabe S, Shiratori K, Hayashi N. Chronic pancreatitis caused by an autoimmune abnormality: proposal of the concept of autoimmune pancreatitis. Dig Dis Sci 1995;40:1561–1568.


5. Kim JY, Chang HS, Kim MH, et al. A case of autoimmune chronic pancreatitis improved with oral steroid therapy. Korean J Gastroenterol 2002;39:304–308.
6. Members of the Criteria Committee for Autoimmune Pancreatitis of the Japan Pancreas Society. Diagnostic criteria for autoimmune pancreatitis by the Japan Pancreas Society. J Jpn Pan Soc (Suizou) 2002;17:585–587.
7. Okazaki K, Kawa S, Kamisawa T, et al. Clinical diagnostic criteria of autoimmune pancreatitis: revised proposal. J Gastroenterol 2006;41:626–631.



8. Chari ST, Smyrk TC, Levy MJ, et al. Diagnosis of autoimmune pancreatitis: the Mayo Clinic experience. Clin Gastroenterol Hepatol 2006;4:1010–1016.


9. Chari ST, Takahashi N, Levy MJ, et al. A diagnostic strategy to distinguish autoimmune pancreatitis from pancreatic cancer. Clin Gastroenterol Hepatol 2009;7:1097–1103.


10. Pearson RK, Longnecker DS, Chari ST, et al. Controversies in clinical pancreatology: autoimmune pancreatitis: does it exist? Pancreas 2003;27:1–13.


12. Kim KP, Kim MH, Kim JC, Lee SS, Seo DW, Lee SK. Diagnostic criteria for autoimmune chronic pancreatitis revisited. World J Gastroenterol 2006;12:2487–2496.


13. Kwon S, Kim MH, Choi EK. The diagnostic criteria for autoimmune chronic pancreatitis: it is time to make a consensus. Pancreas 2007;34:279–286.


14. Ryu JK, Chung JB, Park SW, et al. Review of 67 patients with autoimmune pancreatitis in Korea: a multicenter nationwide study. Pancreas 2008;37:377–385.


15. Otsuki M, Chung JB, Okazaki K, et al. Asian diagnostic criteria for autoimmune pancreatitis: consensus of the Japan-Korea symposium on autoimmune pancreatitis. J Gastroenterol 2008;43:403–408.


18. Moon SH, Kim MH. The role of endoscopy in the diagnosis of autoimmune pancreatitis. Gastrointest Endosc 2012;76:645–656.


19. Sah RP, Chari ST, Pannala R, et al. Differences in clinical profile and relapse rate of type 1 versus type 2 autoimmune pancreatitis. Gastroenterology 2010;139:140–148.


20. Song TJ, Kim JH, Kim MH, et al. Comparison of clinical findings between histologically confirmed type 1 and type 2 autoimmune pancreatitis. J Gastroenterol Hepatol 2012;27:700–708.


21. Moon SH, Kim MH. The role of endoscopic examination for making the diagnosis of autoimmune pancreatitis. Korean J Gastrointest Endosc 2008;37:237–242.
22. Kamisawa T, Chari ST, Giday SA, et al. Clinical profile of autoimmune pancreatitis and its histological subtypes: an international multicenter survey. Pancreas 2011;40:809–814.


23. Kamisawa T, Kim MH, Liao WC, et al. Clinical characteristics of 327 Asian patients with autoimmune pancreatitis based on Asian diagnostic criteria. Pancreas 2011;40:200–205.


24. Kim JH, Kim MH, Byun JH, et al. Diagnostic strategy for differentiating autoimmune pancreatitis from pancreatic cancer: is an endoscopic retrograde pancreatography essential? Pancreas 2012;41:639-647. Pancreas 2012;41:639–647.


25. Sugumar A, Levy MJ, Kamisawa T, et al. Endoscopic retrograde pancreatography criteria to diagnose autoimmune pancreatitis: an international multicentre study. Gut 2011;60:666–670.


26. Moon SH, Kim MH. Autoimmune pancreatitis; role of endoscopy in diagnosis and treatment. Gastrointest Endosc Clin N Am 2013;(non-published data).


27. Hamano H, Kawa S, Horiuchi A, et al. High serum IgG4 concentrations in patients with sclerosing pancreatitis. N Engl J Med 2001;344:732–738.


28. Ghazale A, Chari ST, Smyrk TC, et al. Value of serum IgG4 in the diagnosis of autoimmune pancreatitis and in distinguishing it from pancreatic cancer. Am J Gastroenterol 2007;102:1646–1653.


29. Raina A, Krasinskas AM, Greer JB, et al. Serum immunoglobulin G fraction 4 levels in pancreatic cancer: elevations not associated with autoimmune pancreatitis. Arch Pathol Lab Med 2008;132:48–53.


30. Umehara H, Okazaki K, Masaki Y, et al. Comprehensive diagnostic criteria for IgG4-related disease (IgG4-RD), 2011. Mod Rheumatol 2012;22:21–30.


31. Moon SH, Kim MH, Park DH, et al. Is a 2-week steroid trial after initial negative investigation for malignancy useful in differentiating autoimmune pancreatitis from pancreatic cancer? a prospective outcome study. Gut 2008;57:1704–1712.


32. Tamada K, Ushio J, Sugano K. Endoscopic diagnosis of extrahepatic bile duct carcinoma: advances and current limitations. World J Clin Oncol 2011;2:203–216.



33. Kawakami H, Zen Y, Kuwatani M, et al. IgG4-related sclerosing cholangitis and autoimmune pancreatitis: histological assessment of biopsies from Vater's ampulla and the bile duct. J Gastroenterol Hepatol 2010;25:1648–1655.


34. Moon SH, Kim MH, Park do H, et al. IgG4 immunostaining of duodenal papillary biopsy specimens may be useful for supporting a diagnosis of autoimmune pancreatitis. Gastrointest Endosc 2010;71:960–966.


35. Hoki N, Mizuno N, Sawaki A, et al. Diagnosis of autoimmune pancreatitis using endoscopic ultrasonography. J Gastroenterol 2009;44:154–159.


36. Dietrich CF, Hirche TO, Ott M, Ignee A. Real-time tissue elastography in the diagnosis of autoimmune pancreatitis. Endoscopy 2009;41:718–720.


37. Hocke M, Ignee A, Dietrich CF. Contrast-enhanced endoscopic ultrasound in the diagnosis of autoimmune pancreatitis. Endoscopy 2011;43:163–165.


38. Kitano M, Kudo M, Yamao K, et al. Characterization of small solid tumors in the pancreas: the value of contrast-enhanced harmonic endoscopic ultrasonography. Am J Gastroenterol 2012;107:303–310.


39. Hartwig W, Schneider L, Diener MK, Bergmann F, Büchler MW, Werner J. Preoperative tissue diagnosis for tumours of the pancreas. Br J Surg 2009;96:5–20.


40. Levy MJ, Wiersema MJ, Chari ST. Chronic pancreatitis: focal pancreatitis or cancer? is there a role for FNA/biopsy? autoimmune pancreatitis. Endoscopy 2006;38(Suppl 1):S30–35.


41. Iglesias-Garcia J, Poley JW, Larghi A, et al. Feasibility and yield of a new EUS histology needle: results from a multicenter, pooled, cohort study. Gastrointest Endosc 2011;73:1189–1196.


42. Chari ST, Murray JA. Autoimmune pancreatitis, part II: the relapse. Gastroenterology 2008;134:625–628.


43. Ghazale A, Chari ST. Optimising corticosteroid treatment for autoimmune pancreatitis. Gut 2007;56:1650–1652.



44. Kamisawa T, Shimosegawa T, Okazaki K, et al. Standard steroid treatment for autoimmune pancreatitis. Gut 2009;58:1504–1507.


45. Hart PA, Kamisawa T, Brugge WR, et al. Long-term outcomes of autoimmune pancreatitis: a multicentre, international analysis. Gut 2012 Dec 11 [Epub]. http://dx.doi.org/10.1136/gutjnl-2012-303617



46. Hart PA, Topazian MD, Witzig TE, et al. Treatment of relapsing autoimmune pancreatitis with immunomodulators and rituximab: the Mayo Clinic experience. Gut 2012 Sep 16 [Epub]. http://dx.doi.org/10.1136/gutjnl-2012-302886


47. Moon SH, Kim MH, Park DH. Treatment and relapse of autoimmune pancreatitis. Gut Liver 2008;2:1–7.



48. Okazaki K, Kawa S, Kamisawa T, Shimosegawa T, Tanaka M; Research Committee for Intractable Pancreatic Disease and Japan Pancreas Society. Japanese consensus guidelines for management of autoimmune pancreatitis: I. concept and diagnosis of autoimmune pancreatitis. J Gastroenterol 2010;45:249–265.


A practical approach to the diagnosis of AIP in Korean patients. AIP, autoimmune pancreatitis; MPD, main pancreatic duct; LPSP, lymphoplasmacytic sclerosing pancreatitis; IDCP, idiopathic duct-centric chronic pancreatitis. Adapted from reference [26].
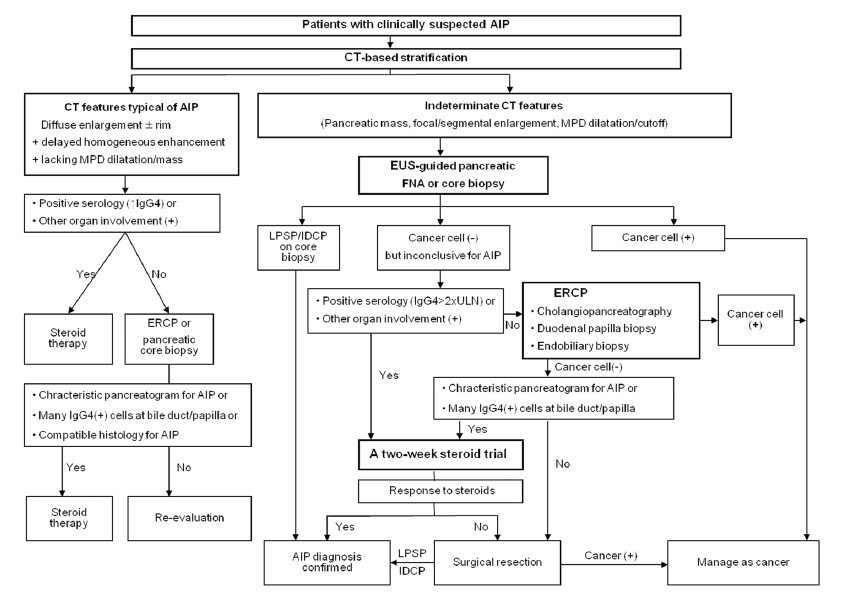
Figure 1.
Table 1.
Differences between clinicopathological profiles of type 1 and type 2 AIP
Table 2.
International consensus diagnostic criteria for type 1 AIP [2]
| Criterion | Level 1 | Level 2 |
|---|---|---|
| Parenchymal imaging (P) | Typical: Diffuse enlargement with delayed enhancement | Indeterminate (including atypical imaging such as pancreatic mass): |
| Segmental/focal enlargement with delayed enhancement | ||
| Ductal imaging (D) | Long (> 1/3 length of the main pancreatic duct) or multiple strictures without marked upstream dilatation | Segmental/focal narrowing without marked upstream dilatation |
| Serology (S) | IgG4, > 2 × upper limit of normal value | IgG4, 1-2 × upper limit of normal value |
| Other organ involvement (OOI) | a or b | a or b |
| a. Compatible histology of extrapancreatic organs | a. Suggestive histology of extrapancreatic organs | |
| LPSP like histology | Marked lymphoplasmacytic infiltration with abundant IgG4-positive cells | |
| b. Typical radiological evidence | b. Physical or radiological evidence | |
| (1) Segmental/multiple proximal or proximal and distal bile duct stricture or | (1) Symmetrically enlarged salivary/lachrymal glands or | |
| (2) Retroperitoneal fibrosis | (2) Radiological evidence of renal involvement | |
| Histology of the pancreas (H) | LPSP (core biopsy/resection) | LPSP (core biopsy) |
| At least 3 of the characteristics of LPSPa | Any 2 findings of the characteristics of LPSPa | |
| Response to steroid (Rt) | Rapid (≤ 2 weeks) radiologically demonstrable resolution or marked improvement in pancreatic/extrapancreatic manifestations | |
| Diagnosis | Definitive type 1 AIP | 1. Histology based diagnosis |
| ㆍLevel 1 H | ||
| 2. Imaging based diagnosis | ||
| ㆍTypical imaging + any non-D level 1/level 2 CE | ||
| ㆍIndeterminate imaging + two or more from level 1 CE | ||
| ㆍIndeterminate imaging + level 2 D + level 1 S/OOI | ||
| ㆍIndeterminate imaging + level 1S/OOI + Rt | ||
| ㆍIndeterminate imaging + level 1D + level 2 S/OOI/H + Rt | ||
| Probable type 1 AIP | Indeterminate imaging + level 2 S/OOI/H + Rt |
Table 3.
International consensus diagnostic criteria for type 2 AIP and AIP-not otherwise specified [2]



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




