 |
 |
| Korean J Med > Volume 84(2); 2013 > Article |
|
Abstract
Hematopoietic stem cell transplantation (HSCT) has improved the outcome of numerous malignant and non-malignant diseases. However, infectious diseases (IDs) still contributes the burden of morbidity and mortality significantly after both autologous and allogeneic HSCTs. IDs are usually classified by the time periods after HSCT; pre-engraftment period, immediate and late post-engraftment period. Kinds of IDs and their frequencies and distribution are dependent not only on the stem cell sources, conditioning regimens, presence of graft-versus-host diseases, but also on the region, prophylactic antibiotics, and so on. In this article, the common IDs after HSCT according to the time periods are reviewed. Additionally, it is tried to focus the recent Korean perspectives, for examples, tuberculosis, herpes zoster, respiratory virus infection-especially hope to be of help for the non-transplant specialists and/or primary physicians. (Korean J Med 2013;84:158-167)
조혈모세포이식은 크게 두 가지 범주의 질환을 치료하는데 이용된다. 첫 번째 범주는 골수 혹은 골수유래 세포의 기능부전으로 재생불량성빈혈, 골수이형성증후군, 각종 면역결핍증후군(중증복합면역결핍병 혹은 만성육아종병 등), 유전 질환(점액다당류증, 당원축적병 등), 혈색소병증(지중해빈혈, 겸상적혈구빈혈 등) 등으로 결손된 조직을 대체하기 위해 이식을 시행하는 것이다. 두 번째는 급ㆍ만성 백혈병, 다발골수종, 림프종, 골수증식 질환 등의 혈액종양으로 아래 두 가지 목적으로 이식을 시행한다. 세포독성치료(강력한 항암치료, 전신방사선조사 등)로 인한 골수억제 혹은 골수파괴(myeloablation) 효과를 반전시키고, 종양특이 혹은 종양 관련 항원들이 표현되는 암세포를 공격하는 면역세포를 제공하는 것이다[1,2].
1970년대에 시도되기 시작한 조혈모세포이식은 공여자에 따라 자가 혹은 동종으로 구분하고, 최근 동종이식은 조혈모세포의 종류(골수, 말초, 제대혈, 중간엽세포 등), 공여자(형제, 타인, 홑배수동종[haploidentical]), 전처치(표준[골수파괴], 저강도) 등에 따라 다양해지고 있다. 조혈모세포이식의 기술뿐만 아니라 수혈, 집락자극인자, 항생제 등 지지치료방법 역시 발달하였고, 다양한 조기 진단 및 치료 기술이 개발되어 이식의 성적이 현격히 개선되었으나 감염 질환은 조혈모세포이식 후의 환자들의 예후에 여전히 많은 영향을 미치고 있다. 특히 이식의 종류, 이식편대숙주병의 정도에 따라 환자의 면역기능 회복이 다양하여 이에 따라 발생하는 감염 질환의 종류와 역학이 다를 수 있다[3,4].
국내에서는 1983년 처음으로 조혈모세포이식이 시작되었고, 지난 30여 년간 이식 건수가 급격히 증가하였고, 다양한 질환에서 시도되고 있다[5]. 이식을 시행한 환자들은 이식 당시의 면역기능저하로 감염에 취약할 뿐만 아니라 생착 후 장기간에 걸쳐 면역기능의 회복이 이식의 종류, 면역억제제 사용, 이식편대숙주병에 따라 다양하게 나타나고, 감염 질환의 종류도 지역과 시대에 따라 변하고 있어, 이에 따른 최신지견이 필요하다.
본고에서는 조혈모세포이식 후의 감염 질환을 시기에 따라 분류하고(Table 1), 흔히 발생하는 질환, 특히 국내자료에서 나타난 호발하는 질환에 대해 기술하고자 한다.
생착 전 시기에 발생하는 감염 질환의 위험인자는 1) 점막피부 손상, 2) 호중구감소증으로 인한 포식작용 손실, 3) 전처치와 관련된 기관장애 등이다[2]. 이식, 공여자, 조혈모세포의 종류, 전처치의 강도에 따라 회복의 정도가 달라지고, 이 시기에 발생하는 감염 질환은 항암치료 후 호중구감소성 발열과 거의 비슷하다[1,2].
호중구는 인체에 침투하는 미생물에 대해 일차적으로 방어작용에 나서는 선천면역(innate immunity) 중에서도 매우 중요한 요소로 호중구수가 감소한다는 것은 감염에 취약하게 됨을 의미한다. 또한 호중구감소증 환자는 염증반응을 나타내는데 필요한 백혈구가 수적으로 부족하기 때문에 정상 백혈구수를 가진 환자들에서 흔히 나타나는 염증 소견이 발열 이외에는 잘 나타나지 않는 경우가 많아서 진단이 어렵고 치료 시작의 적절한 시점을 놓칠 우려가 많다[6].
호중구감소성 발열 환자의 원인균 분포는 지역에 따라 다를 수 있다. 미국, 유럽의 경우 그람양성균이 미생물학적으로 확인된 감염의 60-70%를 차지하고 있으나 2000년대 초반까지의 국내 연구에서 아직까지 그람음성균이 더 흔하며 이는 대부분의 아시아-태평양 지역의 일반적인 특징이다[7]. 그람양성균 중에는 Enterococcus, Streptococcus, Staphylcoccus 등이 흔하고 그람음성균 중에는 Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa 등 장내세균이 흔히 보고된다[8-12]. 과거에 비해 P. aeruginosa가 동정되는 빈도가 급감한 것은 fluoroquinolone을 예방적 항생제로 사용한 것과 관련이 있고, 반면 E. coli에 대한 fluoroquinolone의 내성률은 증가했다. 표 2는 저자가 근무하고 있는 혈액종양병동에서 호중구감소증 시기에 동정된 균들을 정리한 것이다. 같은 호중구감소증 시기지만 항암치료 병동과 조혈모세포이식 병동간 동정된 균주의 차이가 있고, 그람음성균, 양성균의 비율도 다르다[13]. 또한 호중구감소성 발열의 원인균에 대한 항생제 내성률도 병원마다 다양할 수 있다. S. aureus 중 methicillin 내성 S. aureus (MRSA) 비율은 38-77%, E. coli의 fluoroquinolone 내성은 16-93%, 3세대 cephalosporin 내성은 0-7%로 보고하고 있다[8-11]. 따라서 각 병원에서 흔히 검출되는 균의 종류와 그 감수성 결과를 참고하여 초기 경험적 항균제를 선택하는 것이 필요하다. 지금까지 많은 치료 가이드라인이 나와 있지만 지역에 따라 호발하는 세균의 종류, 항생제 감수성 결과가 다를 수 있음을 알아야 한다[6,7,14].
호중구감소증 시기에 호발하는 진균감염은 칸디다증과 아스페르길루스증이다. 점막피부 손상과 호중구감소증, 광범위 항생제 사용, 기관장애, 고밀도의 효모집락형성 등이 침습성 칸디다증의 위험인자가 된다[2,4]. 이식 중 예방적 항진균제(특히 fluconazole)를 사용하는 기관이 많아지면서 칸디다증의 역학도 과거와는 많이 달라지고 있다[15]. Fluco-nazole에 감수성을 보이던 Candida albicans의 빈도가 감소하고 있어, 항진균제를 선택할 때 주의를 요한다[15,16]. 한 가지 흥미로운 것은 저자의 병원에서 경험하듯이 항진균제를 예방으로 사용하고 있는 호중구감소증 시기에는 칸디다혈증은 비교적 많지 않다는 것이다[13]. 칸디다혈증이 발생한 경우 카테터 제거를 고려할 수 있으나 호중구감소증 시기에는 카테터관련감염, 위장관감염 등에 의한 것인지 감별이 어렵고, 파종될 위험이 있어 안과 등과의 협진이 필요하다. 음전되는 시기와 항진균제 투여기간을 알기 위해 주기적인 혈액배양 검사 추적이 필요하다[16].
침습성 아스페르길루스증은 지난 20여 년 동안 발생률과 사망률이 급속히 증가한 질환 중 하나이다. 모든 장기를 침범하나 폐와 부비동에서 가장 호발한다. 균사가 혈관을 침범하는 특징이 있어 혈관내 혈전과 조직경색 및 응고성괴사가 특징적이다. 배양과 조직검사가 아스페르길루스증을 확인하는 것이 1차적인 진단방법이나 호중구감소 및 혈소판감소 등의 면역저하 환자여서 진단에 어려움이 많다. 칸디다증과 마찬가지로 예방적 항진균제 사용, 종류에 따라, 시대에 따라 역학이 달라지고 있어 지속적인 감시가 필요하다[10-12,15]. 2008년 EORTC/MSG (European Organization for Research and Treatment of Cancer/Mycoses Study Group)에서 암 및 조혈모세포이식 환자의 침습성 진균감염에 대한 국제기준을 제시한 바 있고 현재 가장 널리 쓰인다[17]. 전통적인 미생물학적 진단방법 이외에 최근 보조진단법으로 사용되는 방법은 CT와 galactomannan이다.
침습성 폐 아스페르길루스증은 조기에 흉부 단순 X-선 검사에서 보이지 않지만 CT에서 1개 이상의 결절이 관찰될 수 있다. 달무리징후(halo sign)은 결절이나 침윤 주위의 흐릿함(haziness)으로 혈관침습성인 미생물에 의한 감염 시 나타나는 특징적인 CT소견이며 장기간 지속되는 호중구감소증 환자에서 아스페르길루스증을 예측하는 데 도움이 되지만 모든 환자 나타나는 것은 아니고, 아스페르길루스증에서만 나타나는 것이 아니다. 호중구감소증에서 회복되면서 초승달징후(crescent sign)이 나타나기도 한다(Fig. 1). 비(非)-배양적 검사실 생물표지자로 galactomannan, 1, 3-β-D-glucan (BDG), PCR, nucleic acid sequence based amplification assay (NASBA) 등이 알려져 있고 진단의 보조적 방법, 고위험군에서의 감시(증상이 나타나기 전 조기진단을 위해), 항진균제 치료 후 반응을 모니터하기 위해 사용된다. 특히 galactomannan은 아스페르길루스 세포벽에 있는 고유성분으로 균사가 증식활동을 시작할 때 떨어져 나와 침습성 아스페르길루스증을 진단하는데 유용하게 사용되고 있다[18].
호중구감소증 시기의 항진균제는 주로 경험적, 선제적 치료로 진균감염이 확인되기 전부터 사용되는 경우가 많다. 조혈모세포이식을 시행하는 환자는 과거 항암치료를 수차례 받았을 가능성이 많고, 전처치 등의 강력한 항암치료를 시행했으며, 면역억제제 등으로 인해 신독성의 위험이 매우 높은 환자들이다. 이런 환자들에게 항진균제의 선택은 매우 중요하고, 그동안의 많은 가이드라인에서 신독성이 적은 항진균제를 선택하도록 제시하고 있다[6,19-23]. 또한 침습성 아스페르길루스증이 확인되지 않은 상태라 하더라도, 장기간 지속되는 호중구감소증, 생물표지자 양성, 폐 침윤 등의 소견을 종합하여 전문의의 소견으로 사용할 수 있어야 하나, 국내 현실은 불행히도 제한된 보험기준에 따라 사용하는 것이 현실이다[24]. 조기진단, 보조 치료법의 개선 등으로 Herbrecht 등[25]이 보고한 2002년 보다 사망률은 더 감소하였고, 특히 조혈모세포이식 환자의 침습성 폐 아스페르길루스증에서 voriconazole을 1차로 사용한 시기와 사용하지 않은 시기로 나누어 분석했을 때 사망률이 통계학적으로 의미 있게 차이가 있었다는 보고가 있었다[26]. 앞으로 환자의 생존을 높일 수 있는 개선책이 마련되어야 하는 시점이다.
그 외의 진균감염으로 털곰팡이증, 푸사륨, Alternaria, Scedosporium 등이 호중구감소증이 지속되는 시기에 발생할 수 있고, 특히 최근 사상진균에 효과적인 항진균제를 예방으로 사용하기 시작하면서 점차 증가하고 있다는 보고가 있다.
조혈모세포이식 중 호중구감소증 시기에 발생하는 가장 흔한 바이러스 감염으로 HSV가 알려져 있다. 대부분 점막염의 형태로 나타나지만 식도염, 기관기관지염, 폐렴 등도 발생한다[2]. 동종 조혈모세포이식 환자에서 HSV에 대한 예방적 항바이러스제를 사용하지 않는 경우 HSV IgG 혈청 검사 양성인 환자의 62-80% 정도에서 HSV 재활성화가 발생하는 것으로 알려져 있다. 자가 조혈모세포이식의 경우 항바이러스제 예방을 하지 않으면 2-6% 정도에서 HSV에 의한 병변이 발생하는 것으로 알려져 있다[27]. 따라서 동종 조혈모세포이식 환자, 자가 조혈모세포이식 환자 중 점막염 발생 위험이 높은 환자 중에서 HSV에 대한 혈청 검사 양성인 경우 예방적 항바이러스제 사용이 권장된다. 1990년대 초 국내 HSV type 1에 대한 항체 보유율은 30대 이상 인구에서 100%였고 20대의 경우 91%, 10대의 경우 82%으로[28] 국내에서는 대부분 항바이러스제 예방이 권장된다[3,6].
전처치 항암제의 종류와 골수파괴 유무에 따라 정도는 달라지지만 세포면역기능 저하가 있는 시기이고, 동종이식의 경우 급성 이식편대숙주병의 정도에 따라 기회감염의 확률이 증가한다. 자가이식은 동종이식에 비해 면역기능회복이 빠르다.
CMV는 조혈모세포이식 후 재활성화 또는 재감염되어 발열, 호중구감소, 간염, 폐렴, 식도염, 위염,장염, 망막염 등의 CMV 질환(disease)을 일으키며, 질병이 발행한 경우 적극적인 항바이러스 치료에도 치명적이다[29,30]. 지난 수십 년간 적극적인 예방과 질환의 조기진단을 위한 모니터링 방법들이 연구되었고, CMV pp65 항원혈증 검사, 실시간 정량적 PCR 등이 현재 감시와 선제치료를 위해 사용되고 있다[31,32]. 조혈모세포이식의 경우 CMV 부하(load)와 CMV 질환과의 관계는 고형장기이식과는 달리 중등도의 상관(correlation)만을 모여 CMV 질환이 발생해도 항원혈증이나 DNA 혈증이 선행되지 않거나 동반되지 않기도 하여 이런 표지자들이 질환은 예측하지 못할 수 있다. 따라서 CMV 질환의 조기 진단과 치료를 위해서는 위험군을 찾고 각 침범 장기별 CMV 질환의 임상양상을 알고 있는 것이 중요하다.
국내 한 보고에서 동종이식의 2.9%, 자가이식의 0.5%에서 CMV 질환이 발생하였고, 폐렴(38.6%), 망막염(36.4%), 장관염(15.9%), 순이었으며 증상발현 시기는 이식 후 평균 90일 이었으나 12-936일로 넓은 범위였다[33]. CMV DNA혈증이 있는 환자를 대상으로 한 최근 연구에서 > 75,000 copies/mL이면 망막염 발생위험이 높아진다고 보고하였다[34].
대부분의 이식센터에서 선제치료를 도입하고 있지만 성인 CMV 항체양성률이 95-100%인 국내는 조혈모세포이식이 항체 양성자에서 항체 양성자로 이루어지는 환경이고 이식 후 증상을 동반한 CMV 감염의 빈도가 10-50%에 이른다[30]. 최근 적극적인 CMV 모니터링과 선제치료로 이식 직후 발생하는 CMV 감염빈도는 줄었으나 이식 3개월 이후 발생하는 후기 CMV 감염이 증가하고 있는 추세이고 특히 만성 이식편대숙주병으로 CMV 특이 T세포 면역기능이 회복되지 않았을 때 많이 발생한다[2]. Alemtuzumab 등의 단클론항체를 사용하거나[35] 이식편대숙주병이 있는 경우 빈도가 높아지고, 이식편대숙주병과 구별이 안되거나 공존하고 있는 경우도 있어 진단이 어렵고, 진단이 늦어질 경우 ganciclovir, foscarnet, cidofovir 등의 항바이러스제에 반응이 없을 수도 있어 보다 적극적인 진단과 치료, 경험이 필요하다.
이 시기에는 호중구감소증과 점막피부 손실이 회복되어 칸디다 감염의 위험은 감소하나, 아스페르길루스증의 위험은 여전히 존재한다[1,2]. 호중구감소증 시기의 아스페르길루스증은 면역반응 감소로 인한 혈관침범(angioinvasiveness)이 주요 발생기전이지만 호중구감소증에서 회복되었고 장기간 스테로이드, 면역억제제를 사용하는 시기에 발생하는 아스페르길루스증은 혈관침범에 의한 것보다는 국소 염증(예를 들어 기도를 통한 전파[airway invasiveness])이 주요 기전이다[18]. 자가이식보다는 동종이식에서 빈도가 더 높고, 급성 이식편대숙주병과 스테로이드 사용이 위험인자이다[3,19].
진단은 생착 전 시기와 크게 다르지 않으나 최근 혈액질환 환자 중 침습성 폐 아스페르길루스증의 CT 소견은 호중구감소증이 있는 시기와 이식 후 호중구가 회복된 시기에 따라 다를 수 있으므로 진단기준을 재정립해야 한다는 의견이 제시되고 있어[36], 현재의 진단기준을 적용하는 데 주의가 필요하겠다. 치료 역시 생착 전 시기와 다르지 않다.
폐포자충 폐렴의 주 증상은 화농성 가래보다는 발열, 호흡곤란, 마른 기침 등이다. 전형적인 방사선 소견은 양측 폐문부 주위에서 시작하는 양측 미만성 침윤이지만 초기엔 정상이거나 상엽에 구역 경화(segmental consolidation), 기흉 등 비전형적 소견이 있을 수 있다. 대개 이식 후 6개월 이내에 호발하나 만성 이식편대숙주병 등으로 장기간 면역억제제를 복용하고 있는 환자들에서 6개월 이후에도 발생한다[3,4]. CT, 기관지내시경 및 기관지폐포세척 등이 조기에 적극적으로 시도되어야 한다. 동반된 감염 질환 특히 CMV, 아스페르길루스 등 중복감염이 있을 수 있고 이 경우 예후가 나쁘다[37]. 증상이 심할 경우 steroid를 보조적으로 사용할 수 있다. Trimethoprim/sulfamethoxazole 예방으로 발생빈도가 현격히 줄었고, 동종이식의 경우 이식 후 적어도 6개월 혹은 면역억제제 중지할 때까지 예방이 필요하다[3,6].
EBV 감염은 만성 이식편대숙주병이 있는 환자에서 3-5개월 후 발생하지만 질환으로 진행하는 일은 비교적 드물다. 전염단핵구증과 비슷한 증상으로 발열, 호중구감소증이 있을 수 있고, 그 외에 재생불량성빈혈, 구강모백반증(oral hairy leukoplakia), 이식후림프세포증식병(post-transplantation lymphoproliferative disease, PTLD) 등이 나타난다[2]. 조혈모세포이식 후 PTLD는 다른 고형장기이식에 비해 그 빈도가 낮으나 타인간 동종이식, T세포를 제거한 조혈모세포이식, 만성 이식편대숙주병, 이식편대숙주병 예방을 위해 항-림프구 항체를 사용한 경우 등에서 나타날 수 있다[38].
다른 헤르페스바이러스 중 human herpes virus 6 (HHV6)가 뇌수막염, 출혈성 방광염 등의 원인이 될 수 있다[39].
조혈모세포이식 후 발생하는 출혈성 방광염은 시기에 따라 구분할 수 있고, 이식 후 7일 이내에 발생하는 경우는 대개 비-감염성 원인이다. 비 감염성 원인으로는 cyclophosphamide, ifosphamide, busulfan, etoposide 등 항암제와 방사선치료가 주이고, 후기 출혈성 방광염은 바이러스에 의한 감염을 감별해야 한다. Adenovirus, polyomavirus (BK, JC virus), CMV, HSV, HHV6 등이 원인으로 보고되고 있다[40,41]. BK virus DNA정량검사를 시행하여 소변에서 > 1010 copies/mL, 혈액에서 > 104 copies/mL 이상이면 출혈성 방광염으로 진행할 확률이 높다는 보고가 있었다[42,43]. 이식편대숙주병이 출혈성 방광염의 위험인자이고, 감염에 의한 출혈성 방광염 치료의 시작은 가능하면 초기에 면역억제제를 최소화하는 것이다. 대부분 수액공급, 방광세척 등의 보존적 요법으로 호전되지만 Adenovirus, CMV, BK virus는 cidofovir가 효과적일 수 있고, 3등급(육안혈뇨 + 혈액응고) 이상이고 보존적 치료에 반응이 없는 경우 항바이러스제 치료를 고려할 수 있다[40,44]. 호전되지 않으면 급성신손상이 진행할 수 있고, 방광내 alum, formalin, prostaglandin 주입, 혈관 색전술 등을 고려한다[40].
자가이식의 경우 면역계가 재구성되어 회복되는 시기이고, 동종이식 후 만성 이식편대숙주병이 있는 시기와 일치한다. 따라서 자가이식 환자는 이 시기가 되면 기회감염의 위험이 거의 사라지나, 만성 이식편대숙주병으로 면역억제제를 장기가 복용하고 있는 동종이식 환자에선 여전히 감염의 위험이 있다.
생착 전 및 초기 생착 후 시기에 발생하는 감염 질환이 계속 발생할 수 있으나 특히 만성이식편대숙주병과 관련된 체액면역 결손으로 Streptococcus pneumoniae, Haemophilus influenzae, Neisseria meningitidis 등의 피막세균에 의한 중증 감염 위험이 있다[2,3]. 만성, 중증 이식편대숙주병이 있는 환자에서 IgG2, IgG4 subclass 결손이 보고되고 있고, 이는 폐렴알균에 의한 중증 폐렴, 뇌수막염, 패혈증과 관련이 된다[45]. 조기 진단 및 치료가 필수적이고, 그 외에 예방접종이 강조된다. 3개 균 모두 백신이 있고, 최근 예방접종시기가 이식 후 1년에서 3-6개월, 6-12개월 등으로 당겨졌으며 최근 도입된 단백결합백신이 기존의 다당류 백신보다 면역원성이 더 높다고 알려져 있다[3,46].
호중구감소증 시기에도 발생할 수 있고, 지역사회에서의 유행과 계절변화와 관련이 된다. Respiratory Syncytial Virus(RSV), parainfluenza virus 1, 2, 3, influenza virus A, B, rhinovirus, coronavirus, adenovirus 등이 흔하고 최근 human metapneumovirus, bocavirus, parvovirus B19, KI and WU polyoma virus 등이 새로이 보고되고 있다[1-3]. 조혈모세포이식을 시행한 환자들에서 호흡기 바이러스 감염은 상부 호흡기 감염에 국한되지 않고 폐렴 등의 하부 호흡기 감염으로 진행될 확률이 높고, 일부 바이러스에 대해서만 치료약제가 있다는 문제가 있다[47,48]. 최근 호흡기바이러스 정량 검사에 대한 연구가 진행 중이다[49].
국내에서 조혈모세포이식 후 호흡기 바이러스 감염에 대한 연구는 거의 없는 상태지만[50], 최근 저자의 조혈모세포이식센터의 4년간 자료에서 RSV, influenza virus, parainfluenza virus, rhinovirus, adenovirus 등의 순으로 검출되었고, 12월-2월에 호발하였다(Fig. 2). 림프구감소증, 폐렴이 동반되었을 때 사망률이 증가하였다. 호흡기바이러스 중 인플루엔자는 이환된 후 2차 세균성 폐렴이 발생할 수 있어 주의해야 하고, 백신이 가능하다. 최근의 가이드라인에서는 매년 불활화 인플루엔자 백신 접종을 권장하고 있고 이식 4-6개월 후 접종이 가능하다. 또한 환자의 가족, 밀접한 접촉자, 환자를 돌보는 의료인의 예방접종을 권장한다[46].
대상포진은 수두대상포진바이러스(Varicella-Zoster virus, VZV) 초감염 후 후근신경절에 잠복되어 있던 바이러스가 재활성화되어 발생하는 질환이다. 국내에서는 성인의 경우 대부분 자연감염을 통해 VZV를 획득하여 향후 대상포진이 발생할 수 있는 위험군이 된다[51]. 임상특징은 피부 병변이 시작되기 2-3일 전에 피부분절을 통해 이상한 감각 혹은 통증이 생기고, 홍반성 반점구진, 그 후 빠르게 수포가 형성된다. 수포는 터져서 궤양을 형성하고 가피가 생긴 후 마르게 된다. 통증과 대상포진 후 신경통이 큰 문제이다. 대부분 하나의 피부분절을 편측으로 침범하나 조혈모세포이식 후와 같은 면역저하상태에서는 2-3개 이상의 피부분절을 침범하거나 파종되고, 내장, 중추신경계 등을 침범할 수 있다[2]. 치료는 크게 항바이러스제 투여와 급성 통증 및 대상포진 후 신경통을 감소시키기 위한 보조요법으로 나눌 수 있다. 발진 발생 72시간 후 항바이러스 투여가 효과적이지는 명확하지 않으나 새로운 수포성 발진이 계속 생기고 있는 경우, 눈, 피부 및 신경학적 합병증이 동반된 경우, 중증의 증상을 보이는 경우는 발진 발생 72시간 이후라도 항바이러스제를 투여한다.
저자가 근무하고 있는 센터의 최근 경험은 2004-2005년 동종이식을 시행한 230명의 환자에서 79명(34.3%)에서 대상포진이 발생했다. 누적 발생률은 1년째 22%, 2년째 30.8%, 3년째 38.6%, 4년째 41.2%였다. 흉부 피부분절이 가장 많았고(43.8%), 11.4%가 파종성이었다. 내장을 침범한 경우는 없었고, 대상포진으로 사망한 경우도 없었다. 현재 사용가능한 대상포진 백신은 생백신으로 이들 이식 환자에게는 사용할 수 없는 상황에서 최근 acyclovir 예방을 생착 때까지 만이 아니고 면역억제제를 중지할 때까지 장기간 사용할 경우 대상포진을 줄일 수 있다는 보고가 있었다[52].
조혈모세포이식 후 결핵은 흔하지 않는 질환이나 국내 결핵 발병률, 유병률은 선진국에 비해 높아 주의가 필요하다. 만성 이식편대숙주병, 과거 결핵을 앓았던 병력, 이식 전처치로 전신 방사선 조사 시행, T세포 제거 등이 결핵의 위험인자로 알려져 있다[3]. 이식 후 결핵보고는 많지 않으나 반 정도가 아시아에서 보고되고 있고[53] 국내는 한 후향적 보고에서 3.1% 발생하였다. 이식 후 평균 257.2일에 발병하나 21-1410일로 범위가 다양하다[54].
저자가 근무하고 있는 센터의 최근 경험은 2004년 1월에서 2011년 3월 기간 동종 조혈모세포이식을 시행한 846명 중 19명(2.25%)에서 평균 331일 후에 결핵이 발생하였다. 이는 일반인구 표준 발생률의 11.86배(95% 신뢰구간 10.27-13.69)로 만성 이식편대숙주병이 있는 군에서 없는 군에 비해 약 3배 더 많이 발생하였다. 침범부위는 폐가 가장 흔하지만 폐외결핵이 42%로 국내 일반인의 폐외결핵 분포(15-20%)보다 높았고, 평균 1년 치료하였다.
조혈모세포이식은 다양한 악성 혈액종양과 면역 질환을 치료하기 위한 방법으로 널리 시행되고 있고, 의학의 발전과 함께 더 많은 질환을 치료하기 위한 다양한 기법이 개발되고 있다. 보존치료 역시 발전하여 환자들의 생존율이 개선되었으나, 감염 질환은 여전히 유병률, 사망률에 많은 부분을 차지하고 있다. 이식 후 감염 질환은 이식의 종류, 면역억제제, 이식편대숙주병 등에 따라, 시기에 따라 다를 수 있고, 특히 지역과 계절에 따라서도 특징을 가지게 된다. 이식 혹은 감염전문의 뿐만 아니라 1차 진료를 담당하는 의사들도 이식 후 감염 질환을 이해하는 것이 환자와 가족의 건강을 개선하는 지름길이라 믿고, 앞으로 관련있는 많은 사람들이 관심을 가지고 더욱 발전이 있기를 기대한다.
REFERENCES
1. Wingard JR, Hsu J, Hiemenz JW. Hematopoietic stem cell transplantation: an overview of infection risks and epidemiology. Infect Dis Clin North Am 2010;24:257–272.


2. Dropulic LK, Lederman HM. Overview of infections in the immunocompromised host. In: Hayden RT, Carroll KC, Tang YW, Wolk DM, eds. Diagnostic Microbiology of the Immunocompromised Host. 1st ed. Washinton, DC: ASM Press, 2009:3–43.
3. Tomblyn M, Chiller T, Einsele H, et al. Guidelines for preventing infectious complications among hematopoietic cell transplantation recipients: a global perspective. Biol Blood Marrow Transplant 2009;15:1143–1238.



4. Safdar A, Armstrong D. Infections in patients with hematologic neoplasms and hematopoietic stem cell transplantation: neutropenia, humoral, and splenic defects. Clin Infect Dis 2011;53:798–806.


5. Lee JW, Kim CC. The activity of hematopoietic stem cell transplantation in Korea. Bone Marrow Transplant 2008;42(Suppl 1):S92–95.


6. Lee DG, Kim SH, Kim SY, et al. Evidence-based guidelines for empirical therapy of neutropenic fever in Korea. Korean J Intern Med 2011;26:220–252.



7. Jun HX, Zhixiang S, Chun W, et al. Clinical guidelines for the management of cancer patients with neutropenia and unexplained fever. Int J Antimicrob Agents 2005;26(Suppl 2):S128–132.


8. Choi SM, Lee DG, Park YH, et al. Infections in patients with acute leukemia: comparison of induction chemotherapy group and reinduction chemotherapy group. Infect Chemother 2003;35:78–85.
9. Kim HB, Park SW, Kim US, et al. Infections in Patients with Acute Leukemia (1993-1996). Korean J Hematol 1999;34:359–365.
10. Yoo JH, Lee DG, Choi SM, et al. Infectious complications and outcomes after allogeneic hematopoietic stem cell transplantation in Korea. Bone Marrow Transplant 2004;34:497–504.


11. Park SH, Choi SM, Lee DG, et al. Current trends of infectious complications following hematopoietic stem cell transplantation in a single center. J Korean Med Sci 2006;21:199–207.



12. Kim SH, Kee SY, Lee DG, et al. Infectious complications following allogeneic stem cell transplantation: reduced-intensity vs. myeloablative conditioning regimens. Transpl Infect Dis 2012 Sep 24 [Epub]. http://dx.doi.org/10.1111/tid.12003


13. Kwon JC, Kim SH, Choi JK, et al. Epidemiology and clinical features of bloodstream infections in hematology wards: one year experience at the Catholic blood and marrow transplantation center. Infect Chemother 2013 [in press].



14. Freifeld AG, Bow EJ, Sepkowitz KA, et al. Clinical practice guideline for the use of antimicrobial agents in neutropenic patients with cancer: 2010 update by the infectious diseases society of America. Clin Infect Dis 2011;52:e56–93.

15. Leventakos K, Lewis RE, Kontoyiannis DP. Fungal infections in leukemia patients: how do we prevent and treat them? 2010;50:405-4. Clin Infect Dis 2010;50:405–415.


16. Pappas PG, Kauffman CA, Andes D, et al. Clinical practice guidelines for the management of candidiasis: 2009 update by the Infectious Diseases Society of America. Clin Infect Dis 2009;48:503–535.


17. De Pauw B, Walsh TJ, Donnelly JP, et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis 2008;46:1813–1821.

18. Marchetti O, Lamoth F, Mikulska M, Viscoli C, Verweij P, Bretagne S. ECIL recommendations for the use of biological markers for the diagnosis of invasive fungal diseases in leukemic patients and hematopoietic SCT recipients. Bone Marrow Transplant 2012;47:846–854.


19. Walsh TJ, Anaissie EJ, Denning DW, et al. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America. Clin Infect Dis 2008;46:327–360.


20. Michallet M, Ito JI. Approaches to the management of invasive fungal infections in hematologic malignancy and hematopoietic cell transplantation. J Clin Oncol 2009;27:3398–3409.


21. Maschmeyer G, Beinert T, Buchheidt D, et al. Diagnosis and antimicrobial therapy of lung infiltrates in febrile neutropenic patients: guidelines of the infectious diseases working party of the German Society of Haematology and Oncology. Eur J Cancer 2009;45:2462–2472.


22. Pagano L, Caira M, Valentini CG, Posteraro B, Fianchi L. Current therapeutic approaches to fungal infections in immunocompromised hematological patients. Blood Rev 2010;24:51–61.


23. Maertens J, Marchetti O, Herbrecht R, et al. European guidelines for antifungal management in leukemia and hematopoietic stem cell transplant recipients: summary of the ECIL 3: 2009 update. Bone Marrow Transplant 2011;46:709–718.


24. Choi SM, Park SH, Lee DG, Choi JH, Yoo JH, Shin WS. Current antimicrobial usage for the management of neutropenic fever in Korea: a nationwide survey. J Korean Med Sci 2008;23:941–947.



25. Herbrecht R, Denning DW, Patterson TF, et al. Voriconazole versus amphotericin B for primary therapy of invasive aspergillosis. N Engl J Med 2002;347:408–415.


26. Upton A, Kirby KA, Carpenter P, Boeckh M, Marr KA. Invasive aspergillosis following hematopoietic cell transplantation: outcomes and prognostic factors associated with mortality. Clin Infect Dis 2007;44:531–540.


27. Schubert MM, Peterson DE, Flournoy N, Meyers JD, Truelove EL. Oral and pharyngeal herpes simplex virus infection after allogeneic bone marrow transplantation: analysis of factors associated with infection. Oral Surg Oral Med Oral Pathol 1990;70:286–293.


28. Lee JT, Kim YT. Prevalence of antibody to herpes simplex virus. Korean J Dermatol 1993;31:38–46.
29. Ljungman P, Griffiths P, Paya C. Definitions of cytomegalovirus infection and disease in transplant recipients. Clin Infect Dis 2002;34:1094–1097.


30. Ljungman P, Reusser P, de la Camara R, et al. Management of CMV infections: recommendations from the infectious diseases working party of the EBMT. Bone Marrow Transplant 2004;33:1075–1081.


31. Choi SM, Lee DG, Lim J, et al. Comparison of quantitative cytomegalovirus real-time PCR in whole blood and pp65 antigenemia assay: clinical utility of CMV real-time PCR in hematopoietic stem cell transplant recipients. J Korean Med Sci 2009;24:571–578.



32. Choi SM, Lee DG, Choi JH, et al. Risk-adapted preemptive therapy for cytomegalovirus disease after allogeneic stem cell transplantation: a single-center experience in Korea. Int J Hematol 2005;81:69–74.


33. Choi SM, Lee DG, Park SH, et al. Characteristics of cytomegalovirus diseases among hematopoietic stem cell transplant recipients: a 10-year experience at an university hospital in Korea. Infect Chemother 2009;41:9–19.

34. Jeon S, Lee WK, Lee Y, Lee DG, Lee JW. Risk factors for cytomegalovirus retinitis in patients with cytomegalovirus viremia after hematopoietic stem cell transplantation. Ophthalmology 2012;119:1892–1898.


35. Park SH, Choi SM, Lee DG, et al. Infectious complications associated with alemtuzumab use for allogeneic hematopoietic stem cell transplantation: comparison with anti-thymocyte globulin. Transpl Infect Dis 2009;11:413–423.


36. Bergeron A, Porcher R, Sulahian A, et al. The strategy for the diagnosis of invasive pulmonary aspergillosis should depend on both the underlying condition and the leukocyte count of patients with hematologic malignancies. Blood 2012;119:1831–1837.


37. Ju JH, Choi JH, Lee DG, et al. Pneumocystis carinii pneumonia following stem cell transplantation. Korean J Infect Dis 2001;33:273–279.
38. Park SH, Choi SM, Lee DG, et al. Clinical characteristics and outcomes of posttransplant lymphoproliferative disorders following allogeneic hematopoietic stem cell transplantation in Korea. J Korean Med Sci 2006;21:259–264.



39. Kim YJ, Kim DW, Lee DG, et al. Human herpesvirus-6 as a possible cause of encephalitis and hemorrhagic cystitis after allogeneic hematopoietic stem cell transplantation. Leukemia 2002;16:958–959.


40. Dropulic LK, Jones RJ. Polyomavirus BK infection in blood and marrow transplant recipients. Bone Marrow Transplant 2008;41:11–18.



42. Leung AY, Suen CK, Lie AK, Liang RH, Yuen KY, Kwong YL. Quantification of polyoma BK viruria in hemorrhagic cystitis complicating bone marrow transplantation. Blood 2001;98:1971–1978.


43. Erard V, Kim HW, Corey L, et al. BK DNA viral load in plasma: evidence for an association with hemorrhagic cystitis in allogeneic hematopoietic cell transplant recipients. Blood 2005;106:1130–1132.



44. Kim SY, Lee JW, Lee KM, et al. Viruria in adult hemorrhagic cystitis patients following allogeneic hematopoietic stem cell transplantation and implication of antiviral treatment. Korean J Hematol 2007;42:114–121.

45. Hammarström V, Pauksen K, Svensson H, et al. Serum immunoglobulin levels in relation to levels of specific antibodies in allogeneic and autologous bone marrow transplant recipients. Transplantation 2000;69:1582–1586.


46. Lee DG, Yoo JH. Hematopoietic stem cell transplantation.In: Cheong HJ, ed. Vaccination for adults. 2nd ed. Seoul: MIP Press, 2012:380–388.
47. Weigt SS, Gregson AL, Deng JC, Lynch JP 3rd, Belperio JA. Respiratory viral infections in hematopoietic stem cell and solid organ transplant recipients. Semin Respir Crit Care Med 2011;32:471–493.


48. Kumar D, Humar A. Respiratory viral infections in transplant and oncology patients. Infect Dis Clin North Am 2010;24:395–412.


49. Campbell AP, Chien JW, Kuypers J, et al. Respiratory virus pneumonia after hematopoietic cell transplantation (HCT): associations between viral load in bronchoalveolar lavage samples, viral RNA detection in serum samples, and clinical outcomes of HCT. J Infect Dis 2010;201:1404–1413.



50. Lee DG, Park ST, Na BK, et al. Characteristics of respiratory tract infection in the hematopoietic stem cell transplantation population. Korean J Infect Dis 2001;33:419–429.
51. Choi WS, Noh JY, Huh JY, et al. Seroprevalence of varicella-zoster virus in Korea. J Med Virol 2010;82:2123–2126.


52. Kim DH, Kumar D, Messner HA, et al. Clinical efficacy of prophylactic strategy of long-term low-dose acyclovir for Varicella-Zoster virus infection after allogeneic peripheral blood stem cell transplantation. Clin Transplant 2008;22:770–779.


53. Russo RL, Dulley FL, Suganuma L, França IL, Yasuda MA, Costa SF. Tuberculosis in hematopoietic stem cell transplant patients: case report and review of the literature. Int J Infect Dis 2010 2010;14(Suppl 3):e187–191.


54. Lee J, Lee MH, Kim WS, et al. Tuberculosis in hematopoietic stem cell transplant recipients in Korea. Int J Hematol 2004;79:185–188.


55. Joint Committee for the Development of Korean Guidelines for Tuberculosis, Korea Centers for Disease Control and Prevention. Korean Guidelines for Tuberculosis [Internet]. Seoul: Joint Committee for the Development of Korean Guidelines for Tuberculosis, Korea Centers for Disease Control and Prevention, c2011 [cited Jan 28 2013]. Available from: http://www.lungkorea.org/thesis/file/결핵진료지침-최종20110608.pdf
(A) CT halo sign. The ground glass attenuation surrounding the nodule was considered typical halo sign. (B) CT air-crescent sign. Crescent like pattern was appeared in the nodule during the recovery from neutropenia.
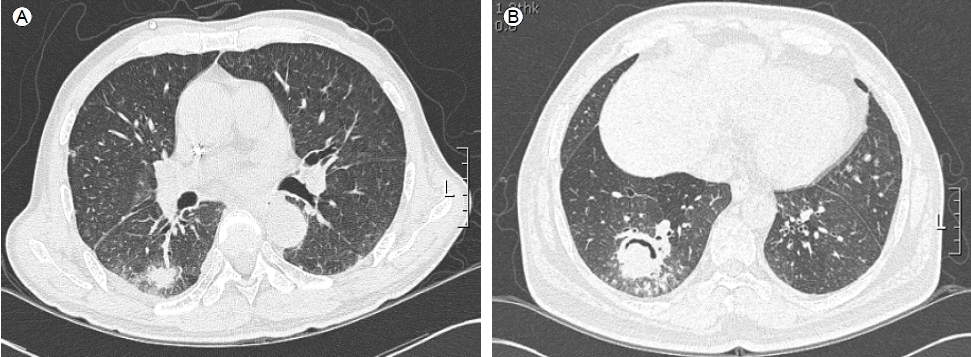
Figure 1.
Seasonal distribution of respiratory viral infection in hematopoietic stem cell transplant recipients (data from Catholic BMT center, Jan/2007-Dec/2010).
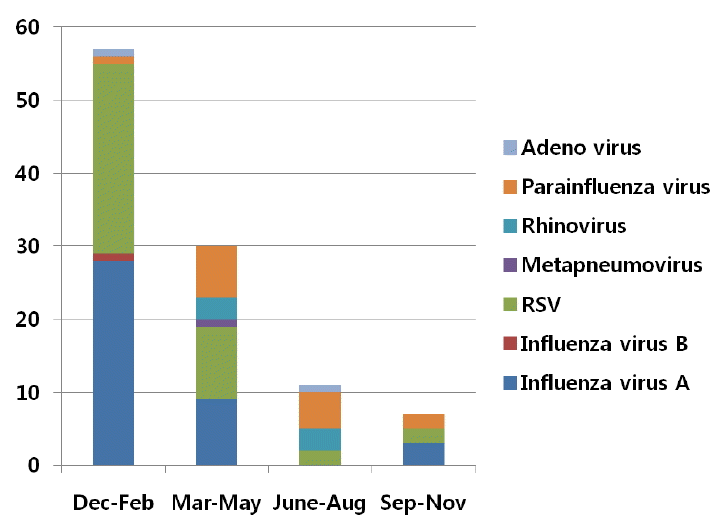
Figure 2.
Table 1.
Types of infectious diseases and risk factors according to the various time periods after hematopoietic stem cell transplantation
Table 2.
Microbiologic classification of bloodstream isolates during neutropenia from chemotherapy ward and hematopoietic stem cell transplantation ward (data from Catholic BMT center, Jun/2009-May/2010) adapted from Kwon et al. [13]
| Microorganisms (n = 243) | Chemotherapy ward | HSCT ward | Total (%) |
|---|---|---|---|
| Gram positives (n = 122) | (n = 108) | (n = 14) | |
| Staphylococcus aureus | 9 | 2 | 11 (4.5) |
| Coagulase negative staphylococci | 14 | 0 | 14 (5.8) |
| viridans streptococci | 39 | 5 | 44 (18.1) |
| Streptococcus pneumoniae | 2 | 0 | 2 (0.8) |
| Rothia mucilaginosa | 5 | 0 | 5 (2.1) |
| Enterococcus spp. | 27 | 7 | 34 (14.0) |
| Corynebacterium spp. | 4 | 0 | 4 (1.6) |
| Bacillus spp. | 3 | 0 | 3 (1.2) |
| Othersa | 5 | 0 | 5 (2.1) |
| Gram negatives (n = 119) | (n = 100) | (n = 19) | |
| Escherichia coli | 58 | 14 | 72 (29.6) |
| Klebsiella pneumoniae | 28 | 3 | 31 (12.8) |
| Pseudomonas spp. | 4 | 1 | 5 (2.1) |
| Enterobacter spp. | 3 | 1 | 4 (1.6) |
| Stenotrophomonas maltophilia | 4 | 0 | 4 (1.6) |
| Othersb | 3 | 0 | 3 (1.2) |
| Fungus (n = 2) | (n = 2) | (n = 0) | |
| Candida tropicalis | 1 | 0 | 1 (0.4) |
| Trichosporon asahii | 1 | 0 | 1 (0.4) |
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 12,283 View
- 317 Download



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



