ņä£ ļĪĀ
1988ļģä 10ņøö 5ņäĖ ļÉ£ ĒīÉņĮöļŗłļ╣łĒśł ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņäĖĻ│ä ņĄ£ņ┤łņØś ņĀ£ļīĆĒśłņØ┤ņŗØņØ┤ ņä▒Ļ│ĄņĀüņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦ä ņØ┤Ēøä Ēśäņ×¼Ļ╣īņ¦Ć ņäĖĻ│äņĀüņ£╝ļĪ£ ņĢĮ 3ļ¦ī Ļ▒┤ ņØ┤ņāüņØś ņĀ£ļīĆĒśłņØ┤ņŗØņØ┤ ņŗ£Ē¢ēļÉśņŚłļŗż[1]. ĻĄŁļé┤ņŚÉņä£ļŖö 1998ļģä ņåīņĢä ĻĖēņä▒ļ”╝ĒöäĻĄ¼ņä▒ļ░▒Ēśłļ│æ ĒÖśņ×ÉņŚÉĻ▓ī ņĄ£ņ┤łļĪ£ ņĀ£ļīĆĒśłņØ┤ņŗØņØ┤ ņä▒Ļ│ĄĒĢśņśĆĻ│Ā 2003ļģäņŚÉ 15ņäĖ ņØ┤ĒĢśņØś ņåīņĢä ĒÖśņ×ÉļōżņŚÉĻ▓ī Ļ▒┤Ļ░Ģļ│┤ĒŚśņØ┤ ņĀüņÜ®ļÉśĻĖ░ ņŗ£ņ×æĒĢśļ®┤ņä£ ņŻ╝ļĪ£ ņåīņĢä ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņĀ£ļīĆĒśłņØ┤ņŗØņØ┤ ĒÖ£ļ░£Ē׳ ņŗ£Ē¢ēļÉśļŖö Ļ│äĻĖ░Ļ░Ć ļÉśņŚłļŗż[2].2009ļģäļČĆĒä░ļŖö ļ╣äļĪ£ņä£ ņä▒ņØĖņØä ĒżĒĢ©ĒĢ£ ņĀä ņŚ░ļĀ╣ņØä ļīĆņāüņ£╝ļĪ£ ņĀ£ļīĆĒśłņØ┤ņŗØņØś Ļ▒┤Ļ░Ģļ│┤ĒŚśņØ┤ ņĀüņÜ®ļÉśĻĖ░ ņŗ£ņ×æĒĢśņśĆņ£╝ļéś ņĢäņ¦üļÅä ĻĄŁļé┤ņŚÉņä£ļŖö ļīĆļČĆļČäņØś ņĀ£ļīĆĒśłņØ┤ņŗØņØ┤ ņåīņĢä ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ņ׳ļŖö ļ░ö, ņØ┤ļŖö ņä▒ņØĖ ĒÖśņ×Éļź╝ ņ╣śļŻīĒĢśļŖö ņØ┤ņŗØ ņĀäļ¼ĖņØśļōżņØ┤ Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŖö ņĀ£ļīĆĒśłņØ┤ņŗØņŚÉ ļīĆĒĢ£ ļČĆņĀĢņĀü ņŗ£Ļ░üņØä ļ░śņśüĒĢ£ļŗż. ĻĘĖļ┐Éļ¦ī ņĢäļŗłļØ╝ 2004ļģäņŚÉ ņĀäņ▓┤ ĻĄŁļé┤ ļ╣äĒśłņŚ░ņØ┤ņŗØņØś 24%ļź╝ ņ░©ņ¦ĆĒĢśļŹś ņĀ£ļīĆĒśłņØ┤ņŗØņØ┤ 2011ļģäņŚÉļŖö 4.4%ļĪ£ Ļ░ÉņåīĒĢśņŚ¼ ĻĄŁļé┤ņŚÉņä£ ņĀ£ļīĆĒśłņØ┤ņŗØņØ┤ ņĀÉņĀÉ ņ£äņČĢļÉśĻ│Ā ņ׳ņØīņØä ņĢī ņłś ņ׳ļŗż(personal communication with Korean Marrow Donor Program, February 1, 2013). ļ░śļ®┤ ņØ┤ņøā ņØ╝ļ│ĖņØś Ļ▓ĮņÜ░ ņĀ£ļīĆĒśłņØ┤ņŗØņØ┤ ņĀäņ▓┤ ļ╣äĒśłņŚ░ņØ┤ņŗØņØś 40% ņØ┤ņāüņØä ņ░©ņ¦ĆĒĢĀ ņĀĢļÅäļĪ£ ĒÖ£ļ░£Ē׳ ņŗ£Ē¢ēļÉśĻ│Ā ņ׳ņØä ļ┐Éļ¦ī ņĢäļŗłļØ╝ ņä▒ņØĖ ĒÖśņ×ÉĻ░Ć ņ░©ņ¦ĆĒĢśļŖö ļ╣äņ£©ņØ┤ ļŹö ļ¦ÄņĢä ĻĄŁļé┤ņÖĆļŖö ĻĘ╣ļ¬ģĒĢ£ ļīĆņĪ░ļź╝ ņØ┤ļŻ¼ļŗż[3]. ņĀ£ļīĆĒśłņØ┤ņŗØņØś Ļ░Ćņן Ēü░ ĒĢ£Ļ│äļĪ£ ņØĖņŗØļÉśĻ│Ā ņ׳ļŖö ļåÆņØĆ ļ╣äņ×¼ļ░£ņä▒ņé¼ļ¦ØļźĀ(non-relapse mortality, NRM)ņØ┤ļéś ņØ┤ņŗØĻ┤ĆļĀ©ņé¼ļ¦ØļźĀ(transplant-related mortality, TRM)ņØä ĻĘ╣ļ│ĄĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņØ┤ņŗØņŚÉ ņĀüĒĢ®ĒĢ£ ņĄ£ņĀüņØś ņĀ£ļīĆĒśłņØä ņäĀĒāØĒĢśļŖö Ļ▓āņØ┤ ņĄ£ņÜ░ņäĀņĀüņØĖ ņÜöĻ▒┤ņØ┤ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ĒÆŹļČĆĒĢ£ ņäĖĒż ņłśņÖĆ ņé¼ļ×īļ░▒ĒśłĻĄ¼ĒĢŁņøÉ(human leukocyte antigen, HLA)ņØś ņØ╝ņ╣śļÅäĻ░Ć ļåÆņØĆ ņĀ£ļīĆĒśłņØ┤ ņÜ░ņäĀņĀüņ£╝ļĪ£ ņäĀĒāØļÉ£ļŗż. ņĄ£ĻĘ╝ņŚÉļŖö ņäĖĒż ņłśņÖĆ HLA ņØ╝ņ╣śļÅä ņÖĖņŚÉļÅä ļŗżņ¢æĒĢ£ ĻĖ░ņżĆļōżņØ┤ ņä▒Ļ│ĄņĀüņØĖ ņĀ£ļīĆĒśłņØ┤ņŗØņØä ņ£äĒĢ┤ Ļ│ĀļĀżļÉśĻ│Ā ņ׳ņ£╝ļ®░ ņä£ĻĄ¼ņØś ņŚ¼ļ¤¼ ņØ┤ņŗØ ĻĖ░Ļ┤ĆņØ┤ļéś ļĀłņ¦ĆņŖżĒŖĖļ”¼ņŚÉņä£ ļéśļ”äņØś ņ▓┤Ļ│äņĀüņØĖ ņĀ£ļīĆĒśł ņäĀĒāØ ĻĖ░ņżĆņØä ļ¦łļĀ©ĒĢśņŚ¼ ņ¦Ćņ╣©ņØä ņŻ╝Ļ│Ā ņ׳ļŗż[4-7]. ĒĢ£ĒÄĖ, ņĢäņ¦üĻ╣īņ¦Ć ĻĄŁļé┤ņŚÉņä£ļŖö ņĀ£ļīĆĒśł ņäĀĒāØņØś Ēæ£ņżĆ ņ¦Ćņ╣©ņØ┤ Ļ░£ļ░£ļÉśņ¦Ć ņĢŖņĢä ņ┤łņ░ĮĻĖ░ņŚÉ ņĀ£ļīĆĒśłņØ┤ņŗØņŚÉ ņŗżĒī©ļź╝ Ļ▓ĮĒŚśĒĢ£ ņØ┤ņŗØ ņĀäļ¼ĖņØśļōżņØ┤ ņĀ£ļīĆĒśłņØ┤ņŗØņØä ļŹöņÜ▒ Ļ║╝ļ”¼Ļ▓ī ļÉśļŖö ĒśäņāüņØ┤ ņØ╝ņ¢┤ļéśĻ│Ā ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. ņØ┤ņŚÉ ņĀĆņ×ÉļŖö ņĀ£ļīĆĒśł ņäĀĒāØ ņ¦Ćņ╣©ņŚÉ ļīĆĒĢ£ ņĄ£ĻĘ╝ņØś ņŚģļŹ░ņØ┤ĒŖĖļÉ£ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ļ░Å ņĀĆņ×É ļō▒ņŚÉ ņØśĒĢ┤ ļČäņäØļÉ£ ĻĄŁļé┤ ņ×ÉļŻīļź╝ ņåīĻ░£ĒĢśĻ│Ā ĻĄŁļé┤ ĒśäņŗżņØ┤ Ļ│ĀļĀżļÉśņ¢┤ Ļ░£ļ░£ļÉ£ ņŗżņÜ®ņĀüņØĖ ņĀ£ļīĆĒśł ņäĀĒāØ ņĢīĻ│Āļ”¼ņ”śĻ│╝ ņäĖļČĆ ņäĀĒāØ ņ¦Ćņ╣©ņŚÉ ļīĆĒĢ┤ ņĀ£ņ¢ĖĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ņäĖĒżņłś(cell dose)ņÖĆ HLA ņØ╝ņ╣śļÅä
ņĀ£ĒĢ£ņĀüņØĖ ņäĖĒżņłśļŖö ņĀ£ļīĆĒśłņØś ĻĘ╝ļ│ĖņĀüņØĖ ļŗ©ņĀÉņØ┤ņ¦Ćļ¦ī ņĀ£ļīĆĒśłņØś ņĪ░Ēśłļ¬©ņäĖĒżļŖö Ēü┤ļĪĀņøÉņä▒ ņ×Āņ×¼ļĀź(clonogenic potential)ņØ┤ ļŗżļźĖ Ļ│ĄĻĖēņøÉņŚÉ ļ╣äĒĢ┤ ņÜ░ņłśĒĢ┤ ņāüļīĆņĀüņ£╝ļĪ£ ņĀüņØĆ ņłśļĪ£ļÅä ņłśĒś£ņ×ÉņØś Ļ│©ņłśņŚÉ ņāØņ░®ņØ┤ Ļ░ĆļŖźĒĢśļŗż. ĻĘĖļ¤¼ļéś ĒÖśņ×ÉņØś ņ▓┤ņżæņØ┤ ļ¦ÄņØäņłśļĪØ ņāüļīĆņĀüņ£╝ļĪ£ ņ▓┤ņżæļŗ╣ ņäĖĒżņłśļŖö ņżäņ¢┤ļōż ņłśļ░¢ņŚÉ ņŚåņ£╝ļ»ĆļĪ£ ņ▓┤ņżæņØ┤ ļ¦ÄņØ┤ ļéśĻ░ĆļŖö ņ▓ŁņåīļģäņØ┤ļéś ņä▒ņØĖņŚÉņä£ļŖö ņĀüņØĆ ņäĖĒżņłśļĪ£ ņØĖĒĢ£ ņāØņ░® ņ¦ĆņŚ░Ļ│╝ ņāØņ░® ļČĆņĀäņØ┤ ņä▒Ļ│ĄņĀü ņØ┤ņŗØņØä ņ£äĒĢ£ Ēü░ ņןņĢĀļ¼╝ļĪ£ ņ×æņÜ®ĒĢ£ļŗż. ļö░ļØ╝ņä£ ņäĖĒż ņłśļŖö ņĀ£ļīĆĒśłņØä ņäĀĒāØĒĢ©ņŚÉ ņ׳ņ¢┤ņä£ Ļ░Ćņן ņÜ░ņäĀņĀüņ£╝ļĪ£ Ļ│ĀļĀżļÉśļŖö ĻĖ░ņżĆņØ┤ļŗż. ļīĆĻ░£ ņ┤Ø ņ£ĀĒĢĄņäĖĒżņłś(total nucleated cells, TNC)ļź╝ ĻĖ░ņżĆņ£╝ļĪ£ ĒĢśļ®░ ņĄ£ņåī 2.5-3.0 ├Ś 107/kg ņØ┤ņāüņØ┤ ļÉśļŖö ņĀ£ļīĆĒśłņØä ņäĀĒāØĒĢĀ Ļ▓āņØ┤ ĻČīņןļÉśĻ│Ā ņ׳ļŗż[8]. Ļ│©ņłśņÖĆ Ļ░ĆļÅÖĒÖöļÉ£ ļ¦Éņ┤łĒśłņĢĪņØś Ļ▓ĮņÜ░ņ▓śļ¤╝ ņĀ£ļīĆĒśłņØ┤ņŗØņŚÉņä£ļÅä CD34 ņ¢æņä▒ņäĖĒżņłśļź╝ ņäĀĒāØ ĻĖ░ņżĆņ£╝ļĪ£ ņé╝ļŖö Ļ▓ĮņÜ░ļÅä ņ׳ņ¦Ćļ¦ī CD34ņ¢æņä▒ņäĖĒż ņłś ņĖĪņĀĢļ▓ĢņØś Ēæ£ņżĆĒÖö ļ¼ĖņĀ£ļĪ£ ņĀ£ļīĆĒśłņØ┤ņŗØņŚÉņä£ļ¦īĒü╝ņØĆ ņĢäņ¦ü TNCņØś ĻĖ░ņżĆņØ┤ ļŹö ļ│┤ĒÄĖņĀüņ£╝ļĪ£ ņØ┤ņÜ®ļÉśĻ│Ā ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņØ┤ļĪĀņĀüņ£╝ļĪ£ TNCļ│┤ļŗżļŖö CD34ņ¢æņä▒ņäĖĒżņłśĻ░Ć ĻĖ░ļŖźņĀüņØĖ ņĪ░Ēśłļ¬©ņäĖĒżņØś ĒĢ©ļ¤ēņØä ļŹö ņל ļ░śņśüĒĢśļŖö Ļ▓āņØ┤ ņé¼ņŗżņØ┤ļ»ĆļĪ£ ņØ┤ņŚÉ ļīĆĒĢ£ Ļ│ĀļĀżļÅä ĒĢ©Ļ╗ś ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ņ׳ņ£╝ļ®░ ņØ╝ļ░śņĀüņ£╝ļĪ£ ĒĢ┤ļÅÖ ņĀä 1.5 ├Ś 105/kg ņØ┤ņāüņØ┤ ļÉśļŖö ņĀ£ļīĆĒśłņØä ņäĀĒāØĒĢĀ Ļ▓āņØ┤ ĻČīņןļÉ£ļŗż[8].
ĒÖśņ×ÉņÖĆ Ļ│ĄņŚ¼ ņĀ£ļīĆĒśłĻ░ä HLA ņØ╝ņ╣śļÅäņŚÉ ļīĆĒĢ£ Ēśäņ×¼ņØś Ēæ£ņżĆņØĆ A, BļŖö ĒĢŁņøÉ ņłśņżĆ(antigen level; low or intermediate resolution), DRB1ņØĆ ņ£ĀņĀäņ×É ņłśņżĆ(allele level; high resolution)ņ£╝ļĪ£ ĒĢśņŚ¼ ņ┤Ø 6ņ×Éļ”¼ņŚÉņä£ņØś ņØ╝ņ╣śļÅäļź╝ ĻĖ░ņżĆņ£╝ļĪ£ ĒĢśĻ│Ā ņ׳ļŗż. ņØ┤ ņżæ ņĄ£ņåī 4ņ×Éļ”¼ ņØ┤ņāüņØ┤ ņØ╝ņ╣śĒĢśļŖö ņĀ£ļīĆĒśłņØä ņé¼ņÜ®ĒĢ┤ņĢ╝ ĒĢśļ®░ ļČłņØ╝ņ╣ś ņłśĻ░Ć ļŖśņ¢┤ļéĀņłśļĪØ ļŹö ļ¦ÄņØĆ ņäĖĒż ņłśĻ░Ć ņÜöĻĄ¼ļÉ£ļŗż[9]. ļśÉĒĢ£ ļ╣äņĢģņä▒ņ¦łĒÖśņØś Ļ▓ĮņÜ░ ņØ┤ņŗØĒÄĖņØä Ļ▒░ļČĆĒĢĀ ņłś ņ׳ļŖö ĒלņØ┤ ņāüļīĆņĀüņ£╝ļĪ£ ļŹö Ļ░ĢĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņä▒Ļ│ĄņĀüņØĖ ņāØņ░®ņØä ņ£äĒĢ┤ņä£ļŖö ņĢģņä▒ņ¦łĒÖśņŚÉ ļ╣äĒĢ┤ ļŹö ļ¦ÄņØĆ ņäĖĒżļź╝ ņØ┤ņŗØĒĢ┤ ņŻ╝ņ¢┤ņĢ╝ ĒĢ£ļŗż[8]. ļö░ļØ╝ņä£ ĒÖśņ×ÉņØś ņ¦łĒÖśĻ│╝ HLA ņØ╝ņ╣śļÅäļź╝ ĒĢ©Ļ╗ś Ļ│ĀļĀżĒĢśņŚ¼ ņĀ£ļīĆĒśłņØ┤ņŗØņŚÉ ĒĢäņÜöĒĢ£ ņĄ£ņåī ņäĖĒż ņłśļź╝ ņĀ£ņŗ£ĒĢśļŖö ņ¦Ćņ╣©ņØ┤ ĒĢäņÜöĒĢśļŗż.
HLA ņØ╝ņ╣śļÅä Ļ░£ļģÉņØś ļ░£ņĀä
ļ╣äĒśłņŚ░ Ļ│©ņłśņØ┤ņŗØņŚÉ ņ׳ņ¢┤ņä£ļŖö HLA-CņØś ļČłņØ╝ņ╣śĻ░Ć A, B, DRB1 ļō▒Ļ│╝ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņØ┤ņŗØ Ļ▓░Ļ│╝ņŚÉ ņĢģņśüĒ¢źņØä ļ»Ėņ╣©ņØ┤ ņØ┤ļ»Ė 2004ļģäņŚÉ ļ│┤Ļ│ĀļÉśņŚłĻ│Ā[10] Ēśäņ×¼ļŖö Ļ│ĄņŚ¼ņ×É ņäĀĒāØ ĻĖ░ņżĆņŚÉ HLA-C ņØ╝ņ╣ś ņŚ¼ļČĆļÅä ļ│┤ĒÄĖņĀü ĻĖ░ņżĆņ£╝ļĪ£ ĒżĒĢ©ļÉśņ¢┤ ņ׳ļŗż. ĒĢ£ĒÄĖ ņĀ£ļīĆĒśłņØ┤ņŗØņŚÉņä£ļŖö HLA-C ņØ╝ņ╣ś ņŚ¼ļČĆņØś ņżæņÜöņä▒ņØĆ ņĄ£ĻĘ╝ņŚÉņĢ╝ ņĀ£ņŗ£ļÉ£ ļ░ö, ļČłņØ╝ņ╣ś ņŗ£ ļŹö ļåÆņØĆ TRMĻ│╝ ļé«ņØĆ ļ¼┤ņé¼Ļ▒┤ņāØņĪ┤ņ£©ņØä ļ│┤ņ×äņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż[11]. ĻĘĖļ¤¼ļéś ņØ┤ ļ│┤Ļ│Ā ņØ┤ĒøäņŚÉļŖö HLA-C ņ×Éņ▓┤ņØś ņØśļ»Ėļź╝ Ļ▓Ćņ”ØĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ņŚåļŖöļŹ░, ņØ┤ļŖö ĻĖ░ņĪ┤ņŚÉ 6ņ×Éļ”¼ļź╝ ĻĖ░ņżĆņ£╝ļĪ£ ĒĢ£ Ēæ£ņżĆ HLA ņØ╝ņ╣śļÅäņŚÉņä£ ļŗ©ņł£Ē׳ HLA-C ņØ╝ņ╣ś ņŚ¼ļČĆņØś ņØśļ»Ėļź╝ ņČöĻ░ĆļĪ£ ļ│┤ļŖö Ļ▓āņŚÉņä£ ļéśņĢäĻ░Ć ņ┤Ø 8ņ×Éļ”¼(HLA-A, B, C, DRB1) ļ¬©ļæÉ ņ£ĀņĀäņ×É ņłśņżĆ, ņ”ē Ļ│ĀĒĢ┤ņāüļÅä HLA ļČäņäØļ▓ĢņŚÉ ņØśĻ▒░ĒĢ£ Ļ▓░Ļ│╝ļĪ£ ņĀ£ļīĆĒśłĻ│╝ ĒÖśņ×É Ļ░äņØś HLA ņØ╝ņ╣śļÅäļź╝ Ļ│ĀļĀżĒĢśļĀżļŖö ņŗ£ļÅä ļĢīļ¼ĖņØĖ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. Eapen ļō▒[12]ņØĆ ņĄ£ĻĘ╝ ņĀ£ļīĆĒśłņØ┤ņŗØņŚÉņä£ 8 ņ×Éļ”¼ņŚÉņä£ ņ£ĀņĀäņ×É ņłśņżĆņØś ņØ╝ņ╣śļÅäĻ░Ć ņØ┤ņŗØ Ļ▓░Ļ│╝ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņŚÉ ļīĆĒĢ┤ ļ│┤Ļ│ĀĒĢśņśĆļŗż. 1,568ņśłņØś ļŗ©ļŗ©ņ£ä(single unit) ņĀ£ļīĆĒśłņØ┤ņŗØņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ļČäņäØĒĢśņśĆļŖöļŹ░, ņØ┤ ņżæ 8/8 ņØ╝ņ╣śļŖö 7%ņŚÉ ļČłĻ│╝ĒĢśņśĆĻ│Ā 7/8 ņØ╝ņ╣ś 15%, 6/8 ņØ╝ņ╣ś 26%, 5/8 ņØ╝ņ╣ś 30%, 4/8 ņØ╝ņ╣ś 16%ņØ┤ņŚłņ£╝ļ®░ 3/8 ņØ╝ņ╣śņØĖ Ļ▓ĮņÜ░ļÅä 5%ņŚÉ ļŗ¼Ē¢łļŗż. 1-2 allele ļČłņØ╝ņ╣śņØś Ļ▓ĮņÜ░ allele ņØ╝ņ╣ś ņØ┤ņŗØĻ│╝ ņāØņ░® ņåŹļÅäņŚÉ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ£╝ļéś, 3-5 allele ļČłņØ╝ņ╣ś ņØ┤ņŗØņŚÉņä£ļŖö Ļ░üĻ░ü allele ņØ╝ņ╣ś ņØ┤ņŗØņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ĒśĖņżæĻĄ¼ ņāØņ░®ņØ┤ ņ¦ĆņŚ░ļÉśņŚłļŗż. 3-5 allele ļČłņØ╝ņ╣ś ņŗ£ 1-2 allele ļČłņØ╝ņ╣śņÖĆ ļ╣äĻĄÉĒĢ┤ļÅä ņ£ĀņØśĒĢśĻ▓ī ņāØņ░® ņ¦ĆņŚ░ņØä ļ│┤ņśĆļŗż. ļśÉĒĢ£ ļ¬©ļōĀ allele ņØ╝ņ╣ś ņŗ£ NRMņØ┤ 9%ņŚÉ ļČłĻ│╝ĒĢśņśĆņØīņŚÉ ļ╣äĒĢ┤ 1-2 allele ļČłņØ╝ņ╣ś 26%, 3 allele ļČłņØ╝ņ╣ś 34%, 4 allele ļČłņØ╝ņ╣ś 37%, 5 allele ļČłņØ╝ņ╣ś 41% ļō▒ņ£╝ļĪ£ allele ļČłņØ╝ņ╣śļÅäĻ░Ć ņ”ØĻ░ĆĒĢĀņłśļĪØ NRMņØ┤ ņ”ØĻ░ĆĒĢśļŖö Ļ▓ĮĒ¢źņØä ļ│┤ņśĆļŗż. ņāØņĪ┤ņ£©ņØĆ ļ¬©ļōĀ allele ņØ╝ņ╣ś ņŗ£ 52%ļĪ£ Ļ░Ćņן ņóŗņĢśĻ│Ā 1-4 allele ļČłņØ╝ņ╣śĻĄ░ Ļ░äņŚÉļŖö 41-47%ļĪ£ ļ╣äņŖĘĒĢśņśĆņ£╝ļ®░ 5 allele ļČłņØ╝ņ╣ś ņŗ£ 34%ļĪ£ Ļ░Ćņן ņĀĆņĪ░ĒĢśņśĆļŗż. ņØ┤ Ļ▓░Ļ│╝ļŖö 1-2 allele ļČłņØ╝ņ╣ś ņŗ£ 3-4 allele ļČłņØ╝ņ╣śņŚÉ ļ╣äĒĢ┤ ĒÖśņ×ÉņØś ĒĢ®ļ│æņ”ØņØ┤ ņĀüņ£╝ļ®░ 5 allele ļČłņØ╝ņ╣ś ņĀ£ļīĆĒśłņØĆ ņé¼ņÜ®ĒĢśņ¦Ć ņĢŖņĢäņĢ╝ ĒĢ£ļŗżļŖö Ļ▓āņØä ļ│┤ņŚ¼ņżĆļŗż. ņØ┤ļ¤¼ĒĢ£ ļ░░Ļ▓ĮņŚÉņä£ Ēśäņ×¼ ņ£Āļ¤Į ĻĘĖļŻ╣ņŚÉņä£ļŖö Ļ░ĆļŖźĒĢśļ®┤ 6/8 allele ņØ╝ņ╣śļÅä ņØ┤ņāüņØä ļ│┤ņØ┤ļŖö ņĀ£ļīĆĒśłņØä ņäĀĒāØĒĢśļĀżļŖö ņČöņäĖņØ┤ļŗż(personal communication with Dr. Rocha, November 23, 2013).
ļ╣äņ£ĀņĀäļÉ£ ņ¢┤ļ©Ėļŗł ĒĢŁņøÉ
HLA ĒĢŁņøÉņØĆ ļČĆļ¬©ļĪ£ļČĆĒä░ Ēā£ņĢäņŚÉĻ▓ī Ļ░üĻ░ü ņØ╝ļ░░ņ▓┤ĒśĢ(haplotype)ņ£╝ļĪ£ ņ£ĀņĀäļÉ£ļŗż. ļČĆļ¬©ļĪ£ļČĆĒä░ ņ£ĀņĀäļÉ£ ĒĢŁņøÉņØĆ Ļ░üĻ░ü ņ£ĀņĀäļÉ£ ņĢäļ▓äņ¦Ć ĒĢŁņøÉ(inherited paternal antigen, IPA)Ļ│╝ ņ£ĀņĀäļÉ£ ņ¢┤ļ©Ėļŗł ĒĢŁņøÉ(inherited maternal antigen, IMA)ņ£╝ļĪ£ ļ¬ģļ¬ģļÉ£ļŗż. ļ░śļ®┤ ņ£ĀņĀäļÉśņ¦Ć ņĢŖņØĆ ļČĆļ¬©ņØś ĒĢŁņøÉņØä Ļ░üĻ░ü ļ╣äņ£ĀņĀäļÉ£ ņĢäļ▓äņ¦Ć ĒĢŁņøÉ(non-inherited paternal antigen, NIPA)Ļ│╝ ļ╣äņ£ĀņĀäļÉ£ ņ¢┤ļ©Ėļŗł ĒĢŁņøÉ(non-inherited maternal antigen, NIMA)ņ£╝ļĪ£ ņ╣ŁĒĢ£ļŗż. Ēā£ņĢäļŖö Ļ▓ĮĒā£ļ░ś ņØ┤ļÅÖ(transplacental trafficking)ņØä ĒåĄĒĢ┤ ņ¢┤ļ©ĖļŗłņØś ņäĖĒżņŚÉ ļģĖņČ£ļÉśņ¢┤ NIMAņŚÉ ļīĆĒĢ£ ņĪ░ņĀł T ņäĖĒż(regulatory T cells)ļź╝ ĒśĢņä▒ĒĢśĻ▓ī ļÉ£ļŗż[13]. ņśłļź╝ ļōżņ¢┤ ĒÖśņ×ÉņÖĆ ņĀ£ļīĆĒśłņØś HLAĻ░Ć A ĒĢŁņøÉņŚÉņä£ ĒĢ£ ņ×Éļ”¼ ļČłņØ╝ņ╣śļØ╝Ļ│Ā Ļ░ĆņĀĢĒĢśņ×É(e.g. ĒÖśņ×É A1, A2; ņĀ£ļīĆĒśł A1, A3). ņØ┤ Ļ▓ĮņÜ░ ļ¦īņØ╝ ņĀ£ļīĆĒśłņØś ņ¢┤ļ©ĖļŗłĻ░Ć A2 ĒĢŁņøÉņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗżļ®┤ ļ╣äļĪØ ņĀ£ļīĆĒśłņŚÉļŖö ĒÖśņ×ÉĻ░Ć Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŖö A2 ĒĢŁņøÉņØ┤ ņŚåņ¦Ćļ¦ī ņĀ£ļīĆĒśł ļé┤ņŚÉļŖö NIMAņŚÉ ĒĢ┤ļŗ╣ĒĢśļŖö A2 ĒĢŁņøÉņŚÉ ļīĆĒĢ£ ņĪ░ņĀł T ņäĖĒżĻ░Ć ņ׳ņØä Ļ▓āņØ┤ļ»ĆļĪ£ ĒÖśņ×ÉņØś A2 ĒĢŁņøÉņŚÉ ļīĆĒĢ┤ ņ¢┤ļŖÉ ņĀĢļÅäņØś Ļ┤ĆņÜ®(tolerance)ņØä Ļ░¢Ļ▓ī ļÉ©ņ£╝ļĪ£ņŹ© ņØ┤ņŗØ ĒøäņØś ļ®┤ņŚŁĒĢÖņĀü Ļ░łļō▒ņØ┤ ņĀüņ¢┤ņ¦ł ņłś ņ׳ļŗżļŖö Ļ░£ļģÉņØ┤ļŗż. ņØ┤ļ¤¼ĒĢ£ NIMA ĒÜ©Ļ│╝ļŖö ņØ┤ļ»Ė Ļ▓Ćņ”ØļÉśņ¢┤ HLA ļČłņØ╝ņ╣ś ņĀ£ļīĆĒśłņØ┤ņŗØņŚÉņä£ NIMA ņØ╝ņ╣śņØĖ Ļ▓ĮņÜ░ TRMņØ┤ ļé«Ļ│Ā ņāØņ░®ņØ┤ ļ╣Āļź┤ļ®░ ļŹö ļåÆņØĆ ņāØņĪ┤ņ£©ņØä ļ│┤ņØ┤Ļ│Ā ņ׳ļŗż[14,15].
ĒĢŁ HLA ĒĢŁņ▓┤
ņĀ£ļīĆĒśłņØ┤ņŗØņŚÉņä£ ĒĢŁ HLA ĒĢŁņ▓┤(anti-HLA antibody)ņØś ņŚŁĒĢĀņØĆ ņĄ£ĻĘ╝ Ēü¼Ļ▓ī ņŻ╝ļ¬® ļ░øĻ│Ā ņ׳ļŖö ņØ┤ņŖłņØ┤ļŗż. 2010ļģä ņØ╝ļ│Ė ĻĘĖļŻ╣ņØ┤ ņĄ£ņ┤łļĪ£ ļ│┤Ļ│ĀĒĢśņśĆļŖöļŹ░[16], ņØ┤ņŗØ ņĀä ņŗ£Ē¢ēĒĢ£ Ļ▓Ćņé¼ņŚÉņä£ ĒÖśņ×ÉĻ░Ć ĒĢŁ HLA ĒĢŁņ▓┤ļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŖö Ļ▓ĮņÜ░ņŚÉ ĻĘĖļĀćņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ņŚÉ ļ╣äĒĢ┤ ĒśĖņżæĻĄ¼ņÖĆ ĒśłņåīĒīÉņØś ņāØņ░®ņØ┤ ņ¦ĆņŚ░ļÉśĻ│Ā ņāØņĪ┤ņ£©ļÅä ļé«ņØĆ Ļ▓ĮĒ¢źņØä ļ│┤ņśĆļŗż. ĒŖ╣Ē׳, ĒĢŁ HLA ĒĢŁņ▓┤Ļ░Ć ņĀ£ļīĆĒśłņØś HLAņŚÉ ĒŖ╣ņØ┤ņĀüņØ┤ņŚłļŹś Ļ▓ĮņÜ░ ĻĘĖ ņ░©ņØ┤Ļ░Ć ļŹöņÜ▒ ĒśäņĀĆĒĢśņśĆļŗż. ņØ┤ļĀćĻ▓ī ņĀ£ļīĆĒśł HLAņŚÉ ĒŖ╣ņØ┤ņĀüņØĖ ĒÖśņ×ÉņØś ĒĢŁ HLA ĒĢŁņ▓┤ļź╝ Ļ│ĄņŚ¼ņ×É ĒŖ╣ņØ┤ņĀü ĒĢŁ HLA ĒĢŁņ▓┤(donor-specific anti-HLA antibody, DSA)ļØ╝Ļ│Ā ĒĢśļŖöļŹ░, DSAĻ░Ć ļ»Ėņ╣śļŖö ņĢģņśüĒ¢źņØĆ ņØ┤ļŗ©ņ£ä(double unit) ņĀ£ļīĆĒśłņØ┤ņŗØņŚÉņä£ļÅä ņ”Øļ¬ģņØ┤ ļÉśņŚłļŗż. Culter ļō▒[17]ņØś ļ│┤Ļ│ĀņŚÉ ņØśĒĢśļ®┤ DSAĻ░Ć ņŚåņØä ļĢī, 1Ļ░£ņØś ņĀ£ļīĆĒśłņŚÉ ļīĆĒĢ┤ņä£ļ¦ī ņ׳ņØä ļĢī, ļæÉ Ļ░£ņØś ņĀ£ļīĆĒśłņŚÉ ļīĆĒĢ┤ ļ¬©ļæÉ ņ׳ņØä ļĢī ļō▒ņØś ņāØņ░®ļČĆņĀäņ£©ņØ┤ Ļ░üĻ░ü 5.5%, 18.2%, 57.1% ļō▒ņ£╝ļĪ£ Ēü░ ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŗż. ļæÉ Ļ░£ņØś ņĀ£ļīĆĒśłņŚÉ ļīĆĒĢ┤ņä£ ļ¬©ļæÉ DSAĻ░Ć ņ׳ņØä Ļ▓ĮņÜ░ļŖö ņé¼ļ¦ØĒĢśĻ▒░ļéś ņ×¼ļ░£ĒĢĀ Ļ░ĆļŖźņä▒ļÅä 71.4%ņŚ¼ņä£ 1Ļ░£ņŚÉ ļīĆĒĢ┤ DSAļź╝ Ļ░Ćņ¦ĆļŖö Ļ▓ĮņÜ░ņØś 36.4%ņÖĆ DSAĻ░Ć ņŚåņØä ļĢīņØś 23.6%ņŚÉ ļ╣äĒĢ┤ ĒśäņĀĆĒĢśĻ▓ī ļåÆņĢśļŗż. ņĄ£ĻĘ╝Ļ╣īņ¦ĆļÅä DSAņØś ņĪ┤ņ×¼Ļ░Ć ņāØņ░® ļ░Å ņāØņĪ┤ņ£©ņŚÉ ņĢģņśüĒ¢źņØä ļü╝ņ╣śļŖö Ļ▓āņØ┤ ņØ╝Ļ┤ĆņĀüņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŖö ļ░ö[18], ĒÖśņ×ÉņŚÉĻ▓ī ņĪ┤ņ×¼ĒĢśļŖö ĒĢŁ HLA ĒĢŁņ▓┤ņŚÉ ĒŖ╣ņØ┤ņĀüņØĖ HLA ĒĢŁņøÉņØä Ļ░Ćņ¦ĆļŖö ņĀ£ļīĆĒśłņØĆ ņäĀĒāØņŚÉņä£ ļ░░ņĀ£ļÉśņ¢┤ņĢ╝ ĒĢ£ļŗż.
ĻĄŁļé┤ ņĀ£ļīĆĒśł ņäĀĒāØņØś Ēśäņŗż
ĻĄŁļé┤ņŚÉņä£ ņĀ£ļīĆĒśłņØ┤ņŗØņØ┤ Ļ│╝Ļ▒░ņŚÉ ļ╣äĒĢ┤ ņ£äņČĢļÉśņ¢┤ ņ׳ļŖö ĒśäņŗżĻ│╝ Ļ┤ĆļĀ©ĒĢ┤ņä£ļŖö ļ¬ć Ļ░Ćņ¦Ć ņØ┤ņŖłļōżņØ┤ ņ׳ļŗż. ļåÆņØĆ ņāØņ░® ņŗżĒī©ņ£©, ĻĖ░ļīĆļ│┤ļŗż ļåÆņØĆ ņØ┤ņŗØĒÄĖļīĆņłÖņŻ╝ļ│æ(graft-versus-host disease, GVHD) ļ╣łļÅäņÖĆ ņżæņ”ØļÅä ĻĘĖļ”¼Ļ│Ā Ļ│©ņłśļéś Ļ░ĆļÅÖĒÖö ļ¦Éņ┤łĒśłņĢĪņØä ņØ┤ņÜ®ĒĢ£ ņØ┤ņŗØļ│┤ļŗż ļīĆņ▓┤ņĀüņ£╝ļĪ£ ļé«ņØĆ ņāØņĪ┤ņ£© ļō▒ņØ┤ ĻĘĖĻ▓āņØ┤ļŗż. Yoo ļō▒[2]ņØ┤ ĻĄŁļé┤ ņåīņĢä ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ 236ņśłņØś ņĀ£ļīĆĒśłņØ┤ņŗØ Ļ▓░Ļ│╝ļź╝ 2011ļģä ļ│┤Ļ│ĀĒĢ£ ļ░öņŚÉ ņØśĒĢśļ®┤ ĒśĖņżæĻĄ¼ņØś ĒÜīļ│ĄļźĀņØĆ 90.7%, ĻĖēņä▒ ļ░Å ļ¦īņä▒ GVHD ļ╣łļÅäĻ░Ć Ļ░üĻ░ü 41.1%ņÖĆ 36.1%, 5ļģä ņāØņĪ┤ņ£©ņØ┤ 47.5%ņØ┤ņŚłļŗż. ļŗ©ļŗ©ņ£ä ņØ┤ņŗØņŚÉņä£ HLA ļČłņØ╝ņ╣śļÅäļź╝ ļ│┤ļ®┤ 1ņ×Éļ”¼ ļČłņØ╝ņ╣śĻ░Ć 73.5%ļĪ£ Ļ░Ćņן ļ¦ÄņĢśņ£╝ļéś ņØ┤ļŖö 6ņ×Éļ”¼ ļ¬©ļæÉ ĒĢŁņøÉ ņłśņżĆņØä ĻĖ░ņżĆņ£╝ļĪ£ ĒĢ£ Ļ▓āņ£╝ļĪ£, ņĀäņłĀĒĢ£ Ēśäņ×¼ņØś ņäĖĻ│äņĀü Ēæ£ņżĆ(A, B ļŖö ĒĢŁņøÉ ņłśņżĆ, DRB1ņØĆ ņ£ĀņĀäņ×É ņłśņżĆ)Ļ│╝ļŖö ņ░©ņØ┤Ļ░Ć ņ׳ļŗż. ņ”ē, Ēśäņ×¼ņØś Ēæ£ņżĆ ĻĖ░ņżĆņØä ņĀüņÜ®ĒĢĀ Ļ▓ĮņÜ░ ļČłņØ╝ņ╣śļÅäĻ░Ć ļŹö ļåÆņĢäņ¦ł Ļ▓āņ×äņØä ņØśļ»ĖĒĢ£ļŗż. ņä£ĻĄ¼ņØś ļ│┤Ļ│ĀļōżņŚÉ ļ╣äĒĢ┤ ņāüļīĆņĀüņ£╝ļĪ£ GVHDņØś ļ╣łļÅäĻ░Ć ļåÆņØĆ Ļ▓āļÅä ņŗżņĀ£ņĀüņØĖ HLA ļČłņØ╝ņ╣śļÅäĻ░Ć ļåÆņØä Ļ▓āņ×äņØä ņČöņĀĢĒĢśļ®┤ ņäżļ¬ģņØ┤ Ļ░ĆļŖźĒĢśļŗż. ļö░ļØ╝ņä£ ņĀ£ļīĆĒśł ņäĀĒāØ ĻĖ░ņżĆņØä Ļ░ĢĒÖöĒĢśņŚ¼ ļŹö ņóŗņØĆ ņĀ£ļīĆĒśłņØä ņäĀĒāØĒĢśļÅäļĪØ ĒĢśļŖö ņĀĢņ▒ģņ£╝ļĪ£ ņĀ£ļīĆĒśłņØ┤ņŗØņØś ņä▒ņĀüņØä ņ¢┤ļŖÉ ņĀĢļÅä Ē¢źņāüņŗ£Ēé¼ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ĻĖ░ļīĆĒĢĀ ņłś ņ׳ļŗż. ņĄ£ĻĘ╝ņŚÉļŖö ĻĄŁļé┤ņŚÉņä£ļÅä ļ¦ÄņØĆ ĻĖ░Ļ┤ĆņŚÉņä£ HLA ņØ╝ņ╣śļÅäļź╝ ņäĖĻ│äņĀü Ēæ£ņżĆ ĻĖ░ņżĆņŚÉ ļö░ļź┤Ļ│Ā ņ׳ļŗż. HLA 8Ļ░£ ņ×Éļ”¼ ļ¬©ļæÉ ņ£ĀņĀäņ×É ņłśņżĆņØä Ļ│ĀļĀżĒĢśņŚ¼ ņĀ£ļīĆĒśłņØś ņäĀĒāØ ĻĖ░ņżĆņ£╝ļĪ£ ņé╝ĻĖ░ņŚÉļŖö ņĢäņ¦ü ĻĄŁļé┤ Ļ│ĄņŚ¼ ņĀ£ļīĆĒśłņØś poolņØ┤ ņĀ£ĒĢ£ņĀüņØ┤Ļ│Ā ļ╣äņÜ®Ļ│╝ ņŗ£Ļ░äņØś ņĖĪļ®┤ņØä Ļ│ĀļĀżĒĢĀ ļĢī ĒśäņŗżņĀüņØĖ ņĀ£ņĢĮņØ┤ ņ׳ļŗż. ĒĢ£ĒÄĖ NIMAņÖĆ ĒĢŁ HLA ĒĢŁņ▓┤ņØś Ļ▓ĮņÜ░ļÅä ĻĄŁļé┤ņØś ĒśäņŗżņĀü ņĀ£ņĢĮ ļĢīļ¼ĖņŚÉ ņĢäņ¦ü ņĀ£ļīĆĒśł ņäĀĒāØņØä ņ£äĒĢ£ ņŗżņ¦łņĀü ĻĖ░ņżĆņŚÉ Ļ│ĀļĀżļÉśņ¦Ć ļ¬╗ĒĢśĻ│Ā ņ׳ļŗż. NIMAņŚÉ ļīĆĒĢ£ ņĀĢļ│┤ļź╝ ĒÖĢļ│┤ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņĀ£ļīĆĒśłņØĆĒ¢ēņŚÉ Ļ│ĄņŚ¼ ņĀ£ļīĆĒśłņØś ņé░ļ¬© ĒśłņĢĪņØ┤ ļ│┤Ļ┤ĆļÉśņ¢┤ ņ׳ņ¢┤ņĢ╝ ĒĢśļ®░ ņØ┤ņŚÉ ļīĆĒĢ£ Ļ▓Ćņé¼ļź╝ ņ£äĒĢ£ ļ╣äņÜ®ņØ┤ ĒÖĢļ│┤ļÉśņ¢┤ņĢ╝ ĒĢśļŖö ļ¼ĖņĀ£Ļ░Ć ņ׳ļŗż. ĒĢŁ HLA ĒĢŁņ▓┤ Ļ▓Ćņé¼ļŖö Ēśäņ×¼ ņŗ£Ē¢ēņØ┤ Ļ░ĆļŖźĒĢ£ ņØ╝ļČĆ ĻĖ░Ļ┤Ćļ┐É ņĢäļŗłļØ╝ ņĀ£ļīĆĒśłņØ┤ņŗØņØ┤ Ļ░ĆļŖźĒĢ£ ļ¬©ļōĀ ĻĖ░Ļ┤ĆņØś Ļ▓Ćņé¼ņŗżņŚÉņä£ ņŗ£Ē¢ē Ļ░ĆļŖźĒĢśĻ▓ī ļÉśļÅäļĪØ ņĀüĻĘ╣ ļÅģļĀżĒĢĀ ĒĢäņÜöņä▒ņØ┤ ņČ®ļČäĒĢśļŗż.
ņĀ£ļīĆĒśł ņäĀĒāØ ņĢīĻ│Āļ”¼ņ”ś ļ░Å ņ¦Ćņ╣© Ļ░£ļ░£
ņĄ£ņĀüņØś ņĀ£ļīĆĒśłņØä ņäĀĒāØĒĢśļŖö Ļ▓āņØĆ ņĀ£ļīĆĒśłņØ┤ņŗØņØś ņä▒Ēī©ļź╝ ņóīņÜ░ĒĢśļŖö Ļ░Ćņן ņżæņÜöĒĢ£ ņÜöĻ▒┤ņØ┤ļŗż. ņĀĆņ×É ļō▒ņØĆ ĻĄŁļé┤ ĒśäņŗżņŚÉ ļ¦×ļŖö ņĀ£ļīĆĒśł ņäĀĒāØ ņĢīĻ│Āļ”¼ņ”ś ļ░Å ņ¦Ćņ╣©ņØä Ļ░£ļ░£ĒĢśĻ│Āņ×É ĒĢśļŖö ļ¬®ņĀüņ£╝ļĪ£ ļ¼ĖĒŚī Ļ│Āņ░░Ļ│╝ ĒĢ©Ļ╗ś ĻĄŁļé┤ 3Ļ░£ņØś ņØ┤ņŗØĻĖ░Ļ┤Ć(ņé╝ņä▒ņä£ņÜĖļ│æņøÉ, ņä£ņÜĖļīĆĒĢÖĻĄÉņ¢┤ļ”░ņØ┤ļ│æņøÉ, ņĀäļé©ļīĆĒĢÖĻĄÉĒÖöņł£ļ│æņøÉ)ņŚÉņä£ 2002ļģäļČĆĒä░ 2011ļģäĻ╣īņ¦Ć ņŗ£Ē¢ēļÉ£ 189ņśłņØś ņåīņĢä ņĀ£ļīĆĒśłņØ┤ņŗØņŚÉ ļīĆĒĢ┤ ļČäņäØĒĢśņśĆļŗż(ļ»ĖņČ£ĒīÉ ņ×ÉļŻī). ņĀ£ļīĆĒśłņØś ļāēļÅÖ ņĀäĻ│╝ ĒĢ┤ļÅÖ ĒøäņØś ņäĖĒż ņłśļź╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī TNCņÖĆ CD34ņ¢æņä▒ ņäĖĒż ņłśļŖö Ļ░üĻ░ü ĒÅēĻĘĀ 80.4%ņÖĆ 66.7%ņØś ĒÜīļ│ĄļźĀņØä ļ│┤ņśĆļŗż(Table 1). ļö░ļØ╝ņä£ ņØ┤ņŗØĻĖ░Ļ┤ĆņŚÉņä£ļŖö ņĀ£ļīĆĒśłņØś ĒĢ┤ļÅÖ Ēøä ņäĖĒżņłśņØś ņåīņŗżņØä Ļ░ÉņĢłĒĢśņŚ¼ ņŗżņĀ£ ņŻ╝ņ×ģļÉĀ ņäĖĒżņłśļź╝ ņČöņĀĢĒĢ┤ņĢ╝ ĒĢ£ļŗż. ņŗżņĀ£ ņŻ╝ņ×ģļÉ£ ņäĖĒż ņłśņŚÉ ļö░ļźĖ ņāØņ░® ņåŹļÅäļź╝ ļ╣äĻĄÉĒĢ┤ ļ│┤ņĢśņØä ļĢī TNCļŖö ņāüĻ┤ĆĻ┤ĆĻ│äļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ£╝ļ®░ CD34ņ¢æņä▒ņäĖĒżņłśĻ░Ć 1.0 ├Ś 105/kg ņØ┤ņāüņØ╝ ļĢī ĻĘĖ ņØ┤ĒĢśņśĆļŹś ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ļ╣ĀļźĖ ņāØņ░®ņØä ļ│┤ņśĆļŗż(p = 0.0044). ļ░śļ®┤, CD34ņ¢æņä▒ņäĖĒżņłśĻ░Ć 2.0 ├Ś 105/kg ņØ┤ņāüņØ┤ņ¢┤ļÅä 1.0-2.0 ├Ś 105/kg ņØ┤ņŚłļŹś Ļ▓ĮņÜ░ņÖĆ ĒåĄĻ│äņĀü ņ░©ņØ┤ļŖö ņŚåņŚłļŗż. ņØ┤ļŖö ņŗżņĀ£ ĒĢ┤ļÅÖ Ēøä ņŻ╝ņ×ģļÉ£ CD34ņ¢æņä▒ņäĖĒżņłś 1.0 ├Ś 105/kgĻ░Ć ļ╣ĀļźĖ ņāØņ░®ņØä ņ£äĒĢ£ ņĄ£ņåī ņÜöĻĄ¼ļ¤ēņØś ĻĖ░ņżĆņ£╝ļĪ£ ņé¼ņÜ®ļÉĀ ņłś ņ׳ņØīņØä ņŗ£ņé¼ĒĢ£ļŗż. ņØ┤ ĻĖ░ņżĆņØĆ ĒĢ┤ļÅÖ ņĀä CD34ņ¢æņä▒ņäĖĒżņłśņØś ņØ╝ļ░śņĀüņØĖ ņĄ£ņåī ĻČīņןņ╣śņØĖ 1.5 ├Ś 105/kgņŚÉņä£ ĒĢ┤ļÅÖ Ēøä 33.3%ņØś ņåīņŗżņØä Ļ░ÉņĢłĒĢśņŚ¼ Ļ│äņé░ļÉ£ ņłśņ╣śņÖĆ ņĀĢĒÖĢĒ׳ ņØ╝ņ╣śĒĢ£ļŗż.
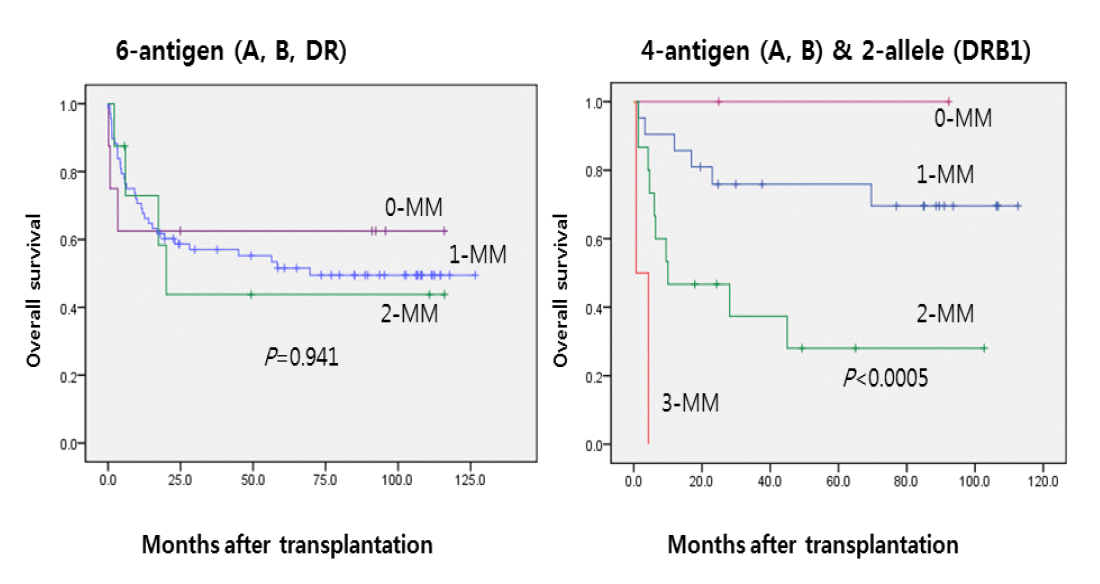
ļŗ©ļŗ©ņ£ä ņĀ£ļīĆĒśłņØ┤ņŗØ 85ņśł ņżæ 40ņśłļ¦īņØ┤ HLA ņØ╝ņ╣śļÅä Ēæ£ņżĆĻĖ░ņżĆ(A, BļŖö ĒĢŁņøÉ ņłśņżĆ, DRB1ņØĆ ņ£ĀņĀäņ×É ņłśņżĆ)ņ£╝ļĪ£ ļČäņäØņØ┤ Ļ░ĆļŖźĒ¢łļŖöļŹ░, ļ¬©ļæÉ ĒĢŁņøÉ ņłśņżĆņŚÉņä£ ĒÅēĻ░ĆĒĢśņśĆņØä ļĢīļŖö HLA ņØ╝ņ╣śļÅäņŚÉ ļö░ļźĖ ņāØņĪ┤ņ£©ņØś ņ░©ņØ┤Ļ░Ć ņŚåņŚłņ£╝ļéś Ēæ£ņżĆ ĻĖ░ņżĆņ£╝ļĪ£ ņĀüņÜ®ĒĢśņśĆņØä ļĢī ĻĘ╣ļ¬ģĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņŚ¼ņŻ╝ņŚłļŗż(Fig. 1). ļśÉĒĢ£, 1-2 ņ×Éļ”¼ ļČłņØ╝ņ╣ś ņØ┤ņŗØ ņżæņŚÉņä£ HLA-C ņĀĢļ│┤Ļ░Ć ĒÖĢņØĖ Ļ░ĆļŖźĒ¢łļŹś 24ņśł ņżæņŚÉļŖö HLA-CĻ░Ć ņØ╝ņ╣śĒĢśņśĆļŹś Ļ▓ĮņÜ░(n = 5)ņÖĆ ļČłņØ╝ņ╣śĒĢśņśĆļŹś Ļ▓ĮņÜ░(n = 19)ņØś ņāØņĪ┤ņ£©ņØ┤ Ļ░üĻ░ü 100%ņÖĆ 46.8%ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŗż(p = 0.025). ņĀäņ▓┤ 5ļģä ņāØņĪ┤ņ£©ņØĆ 56.8%, ļ¼┤ņé¼Ļ▒┤ņāØņĪ┤ņ£©ņØĆ 48.6%ņśĆĻ│Ā ņØ┤ļŗ©ņ£ä ņØ┤ņŗØ(n = 104)ņØ┤ ļŗ©ļŗ©ņ£ä ņØ┤ņŗØņŚÉ ļ╣äĒĢ┤ ņāØņĪ┤ņ£©ņØ┤ ļŗżņåī ļåÆņØĆ Ļ▓ĮĒ¢ź(60.7% vs. 52.6%)ņØ┤ ņ׳ņŚłņ£╝ļéś ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśņ¦ĆļŖö ņĢŖņĢśļŗż(p = 0.293).
ļ│Ė ļČäņäØņØĆ ļ╣äĻĄÉņĀü ļīĆņāü ĒÖśņ×ÉņłśĻ░Ć ņĀüņØĆ ņĀÉ, HLA-DRB1ņŚÉ ļīĆĒĢ£ Ļ│ĀĒĢ┤ņāüļÅä Ļ▓Ćņé¼Ļ░Ć ļīĆņāü ĒÖśņ×ÉĻĄ░ ņżæņŚÉ ņĀ£ĒĢ£ņĀüņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņĀĖ ņ׳ļŗżļŖö Ļ▓ā ĻĘĖļ”¼Ļ│Ā NIMA ļ░Å ĒĢŁ HLA ĒĢŁņ▓┤ņŚÉ ļīĆĒĢ£ ņ×ÉļŻīĻ░Ć ņĀäļ¼┤ĒĢ£ ņĀÉ ļō▒ņØś ĒĢ£Ļ│äļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż. ļö░ļØ╝ņä£ Ēśäņ×¼ļĪ£ņä£ļŖö ĻĄŁļé┤ņØś ņ×ÉļŻīņŚÉļ¦ī ĻĘ╝Ļ▒░ļź╝ ļæö ņĀ£ļīĆĒśł ņäĀĒāØ ņ¦Ćņ╣©ņØä ļ¦łļĀ©ĒĢśļŖö Ļ▓āņØĆ ļČłĻ░ĆļŖźĒĢ┤ ļ│┤ņØĖļŗż. ņØ┤ņŚÉ Ļ▓Ćņ”ØļÉ£ ĒĢ┤ņÖĖ ņ×ÉļŻīļōżņØä ņ░ĖĻ│ĀĒĢśņŚ¼ ĻĄŁļé┤ ĒśäņŗżņØä ļ░śņśüĒĢ£ Ļ░äļŗ©ĒĢśĻ│Ā ņŗżņÜ®ņĀüņØĖ ņĀ£ļīĆĒśł ņäĀĒāØ ņĢīĻ│Āļ”¼ņ”śĻ│╝ ņäĖļČĆ ņ¦Ćņ╣©ņØä Ļ░£ļ░£ĒĢśņśĆļŗż(Fig. 2). ņŻ╝ļ¬®ĒĢĀ Ļ▓āņØĆ ņäĖĒżņłśņØś ĻĖ░ņżĆņØä TNC ļīĆņŗĀ CD34ņ¢æņä▒ņäĖĒżņłśļĪ£ ņĀĢĒĢ£ Ļ▓āņØĖļŹ░, ņØ┤ļŖö ņĢ×ņä£ ņåīĻ░£ĒĢ£ ĻĄŁļé┤ ņ×ÉļŻī ļČäņäØ Ļ▓░Ļ│╝ļź╝ ļ░śņśüĒĢ£ Ļ▓āņØ┤ļŗż. ļ│Ė ņ¦Ćņ╣©ņŚÉļŖö NIMAĻ░Ć ļ░░ņĀ£ļÉśņ¢┤ ņ׳ļŖö Ļ▓āņØĆ ĒśäņŗżņĀüņ£╝ļĪ£ ņäĀĒāØ ĻĖ░ņżĆņ£╝ļĪ£ ņé╝ĻĖ░Ļ░Ć ļČłĻ░ĆļŖźĒĢśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ĻĘĖļ¤¼ļéś Ļ│ĄĻ│Ą ņĀ£ļīĆĒśłņØĆĒ¢ēņŚÉņä£ Ļ│ĄņŚ¼ ņĀ£ļīĆĒśł ņ¢┤ļ©ĖļŗłņØś ĒśłņĢĪņØä ņĀüĻĘ╣ņĀüņ£╝ļĪ£ ņ£Āņ╣śĒĢśĻ│Ā ņØ┤ņŚÉ ļīĆĒĢ£ HLA Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ļÅäļĪØ ņĢłņĀĢņĀüņØĖ ņ×¼ņøÉņØ┤ ļ¦łļĀ©ļÉ£ļŗżļ®┤ Ē¢źĒøä ĻĄŁļé┤ņŚÉņä£ļÅä NIMA ņØ╝ņ╣ś ņŚ¼ļČĆĻ░Ć ņĀ£ļīĆĒśł ņäĀĒāØ ņ¦Ćņ╣©ņŚÉ ĒżĒĢ©ļÉĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
Ļ▓░ ļĪĀ
ņĀ£ļīĆĒśłņØĆ HLA ņØ╝ņ╣ś ĒśłņŚ░ Ļ│ĄņŚ¼ņ×ÉĻ░Ć ņŚåļŖö ĒÖśņ×ÉņŚÉĻ▓ī Ļ│©ņłśļéś Ļ░ĆļÅÖĒÖöļÉ£ ļ¦Éņ┤łĒśłņĢĪĻ│╝ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņ£ĀņÜ®ĒĢ£ ļ╣äĒśłņŚ░ņØ┤ņŗØņØś Ļ│ĄņŚ¼ņøÉņ£╝ļĪ£ ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŗż. ļŗżļ¦ī ņĀ£ļīĆĒśłņØ┤ Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŖö ĻĘ╝ļ│ĖņĀü ļŗ©ņĀÉņØä ĻĘ╣ļ│ĄĒĢśĻĖ░ ņ£äĒĢ┤ Ļ░ü ĒÖśņ×ÉņØś ņāüĒÖ®ņŚÉ ļö░ļźĖ ņĄ£ņĀüņØś ņĀ£ļīĆĒśłņØä ņäĀĒāØĒĢśļŖö Ļ▓āņØ┤ ļ¦żņÜ░ ņżæņÜöĒĢśļŗż. ņØ┤ļ¤¼ĒĢ£ ņŗ£ļīĆņĀü ņÜöĻĄ¼ļź╝ ļ░śņśüĒĢśņŚ¼ ĻĄŁļé┤ņŚÉņä£ ņĄ£ņ┤łļĪ£ ņåīņĢäņÖĆ ņä▒ņØĖ ĒÖśņ×É ļ¬©ļæÉņŚÉĻ▓ī ļæÉļŻ© ņĀüņÜ® Ļ░ĆļŖźĒĢ£ ņĀ£ļīĆĒśł ņäĀĒāØ ņĢīĻ│Āļ”¼ņ”śĻ│╝ ņ¦Ćņ╣©ņØä Ļ░£ļ░£ĒĢśņśĆļŗż. ļ│Ė ņ¦Ćņ╣©ņØś ņĀüĻĘ╣ņĀü ĒÖ£ņÜ®ņ£╝ļĪ£ ņĄ£ņĀüņØś ņĀ£ļīĆĒśł ņäĀĒāØņŚÉ ļÅäņøĆņØ┤ ļÉśĻ│Ā ļéśņĢäĻ░Ć ĻĄŁļé┤ ņĀ£ļīĆĒśłņØ┤ņŗØ ĒÖ£ņä▒ĒÖöņÖĆ ņä▒ņĀüņØś Ē¢źņāüņ£╝ļĪ£ ņØ┤ņ¢┤ņ¦ĆĻĖĖ ĻĖ░ļīĆĒĢśļŖö ļ░öņØ┤ļŗż.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






