작은 관상동맥질환 환자에서 약물 용출 풍선과 약물 용출 스텐트 시술 후 임상 경과의 비교
Comparison of Clinical Outcomes between Drug-Eluting Balloons and Drug-Eluting Stents in Patients with Small Coronary Artery Disease
Article information
Abstract
목적
약물 용출 풍선(drug-eluting balloon, DEB)은 작은 관상동맥 질환 환자를 위한 새로운 치료 전략이나 약물 용출 스텐트(drug-eluting stent, DES)에 비하여 임상적 효과에 관한 연구가 더 많이 필요한 실정이다. 본 연구에서는 작은 혈관 병변을 동반한 환자를 대상으로 DEB와 DES 시술 후 1년간의 임상 효과를 비교 분석하였다.
방법
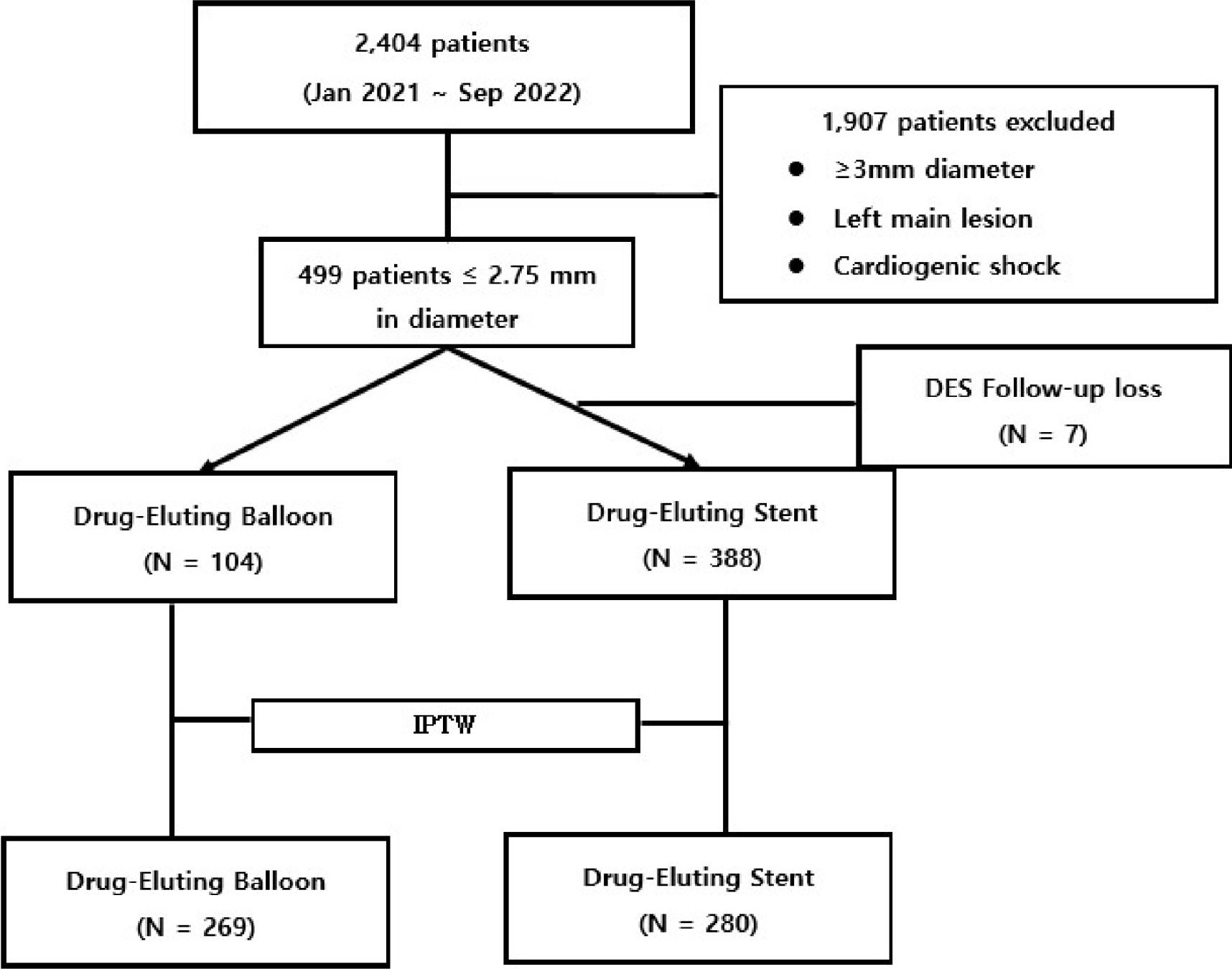
2021년 1월부터 2022년 9월까지 2.75 mm 미만의 작은 관상동맥 병변을 가진 492명의 환자(67.9 ± 11.0세; 남자 339명)를 시술 후 1년간 추적 관찰하여 주요 심장 사건(major adverse cardiac events, MACE)을 분석하였다. MACE는 모든 원인 사망, 표적 혈관 재관류(target vessel revascularization, TVR), 표적 병변 재관류(target lesion revascularization, TLR), 스텐트 혈전증(stent thrombosis, ST), 심근경색증(myocardial infarction, MI)으로 하였다. 대상 환자 중 DEB를 사용한 환자 를 I군(104명; 67.2 ± 10.7세; 남자 83명), DES를 사용한 환자를 II군(388명; 68.0 ± 11.1세; 남자 254명)으로 분류하여 비교 분석을 하였고 역처리 확률 가중법(inverse probability of treatment weighting, IPTW)을 실시하여 I군 269명과 II군 280명을 추가 분석하였다.
결과
위험 요인 중 흡연이 I군이 II군보다 많았다(23명[22.1%] vs. 36명[9.3%]; p < 0.001). 시술 도자의 길이는 I군이 II군보다 짧았고(22.4 ± 5.9 vs. 27.4 ± 9.3 mm; p < 0.001) 시술 도자의 직경도 I군이 II군보다 작았으며(2.4 ± 0.1 vs. 2.6 ± 0.1 mm; p < 0.001) 좌심실 구혈률은 I군이 II군보다 낮았다(53.8% ± 12.6% vs. 58.6% ± 11.9%; p < 0.001). IPTW 시행 후에는 I군과 II군의 좌심실 구혈률의 차이는 보이지 않았고 시술 도자의 길이는 I군이 II군보다 짧았으며(21.9 ± 5.9 vs. 26.9 ± 9.2 mm; p < 0.001) 시술 도자의 직경도 I군이 II군보다 작았다(2.5 ± 0.2 vs. 2.6 ± 0.1 mm; p < 0.001). 일 년간 추적 관찰 시에 모든 원인 사망(0.4% vs. 1.1%; p = 0.450), TLR (2.4% vs. 1.1%; p = 0.444), TVR (2.2% vs. 4.9%; p= 0.333) 및 ST (0.0% vs. 0.4%; p = 0.330)는 I군과 II군에서 차이가 없었으며 MACE 발생률도 I군과 II군 간의 유의한 차이를 보이지 않았다(5.0% vs. 7.5%; p = 0.513).
결론
작은 관상동맥 질환의 치료에서 DEB의 사용은 DES 와 비교하여 1년간 관찰한 임상 경과에 유의한 차이가 없었다.
Trans Abstract
Background/Aims
Drug-eluting balloons (DEBs) represent a novel therapeutic approach for patients with small coronary artery disease. However, further studies are needed to compare the clinical efficacy of DEBs versus drug-eluting stents (DESs).
Methods
In total, 492 patients (age, 67.9 ± 11.0 years; 339 men) with small coronary artery lesions (diameter < 2.75 mm) were randomly assigned to group I (DEB) (n = 104; age, 67.2 ± 10.7 years; 83 men) and group II (DES) (n = 388; age, 68.0 ± 11.1 years; 254 men). For inverse probability of treatment weighting (IPTW) analysis, the study population was stratified into groups I (n = 269) and II (n = 280). We compared the incidences of major adverse cardiac events (MACE) between the two groups during 12 months of clinical follow-up.
Results
Group I had shorter device lengths (22.4 ± 5.8 mm) compared with group II (27.4 ± 9.3 mm; p < 0.001). Additionally, devices in group I were smaller in diameter (2.4 ± 0.1 mm) compared with those in group II (2.6 ± 0.1 mm; p < 0.001). Left ventricular ejection fraction (LVEF) was lower in group I (53.8% ± 12.6%) than in group II (58.6% ± 11.9%; p < 0.001). After IPTW, no significant differences in LVEF were observed between groups I and II. During 12 months of follow-up, the incidence of total MACE did not differ between the two groups.
Conclusions
No significant differences were observed in clinical efficacy between DEB and DES for the treatment of small coronary artery disease. Therefore, DEB can be considered a viable alternative to DES in patients with small coronary artery disease.
서 론
경피적 관상동맥중재술(percutaneous coronary intervention, PCI)은 관상동맥 질환 환자의 치료에 활발하게 사용되고 있다. 하지만 작은 직경을 가진 관상동맥 질환은 중재적 시술 시 극복해야 할 문제점 중 하나이다[1]. 약물 용출 스텐트(drug-eluting stent, DES)는 PCI에 가장 많이 사용되는 치료 방법 중 하나이다[2,3]. 그러나 DES는 작은 관상동맥 질환에서는 혈전 및 재협착의 발생률이 비교적 높아서 극복하여야 할 문제점으로 남아있다[4]. 작은 관상동맥혈관 병변은 당뇨병 환자, 미만성 긴 병변을 가진 환자 그리고 만성 심부전증 환자에서 주로 관찰되며 PCI 시술 이후에 스텐트 재협착(in-stent restenosis, ISR)의 발생이 높다는 결과가 보고되고 있다[5]. 기존의 보고에 따르면 작은 관상동맥 병변에서 DES 사용이 주요 심장 사건(major adverse cardiac event, MACE)의 높은 위험도와 관련이 있음이 보고되었다[6-8]. 약물 용출 풍선(drug-eluting balloon, DEB)은 관상동맥 질환 치료를 위한 새로운 개념이며 금속성 스텐트(bare-metal stent, BMS) 및 DES의 재협착 병변에 대하여 효과적인 치료 방법 중의 하나로 알려져 왔다[9].
DEB 사용은 DES에 비하여 항혈소판제 복용을 단축 혹은 감량시켜 출혈 위험이 있는 환자에서 유용한 방법이 될 수 있다. 이러한 장점에도 불구하고 DEB는 ISR이 발생하였을 경우 주로 시술하고 있으며[10] DEB의 작은 혈관 병변에 대한 효과는 더 많은 임상 연구가 필요한 실정이다.
대상 및 방법
연구 대상 환자
2021년 1월부터 2022년 9월까지 전남대학교병원에 내원하여 관상동맥중재술을 받은 2,404명의 환자 중에서 혈관 직경이 2.75 mm 이하인 병변을 가진 환자들 가운데 혈관 직경의 크기가 3 mm 이상, 좌주간지 병변(left main disease)을 동반한 환자, 심인성 쇼크를 동반한 환자 등을 제외한 492명(64.9 ± 10.6세; 남자 339명)의 환자를 대상으로 하였다. 그 중 DEB를 시술받은 I군(104명; 67.2 ± 10.7세; 남자 83명)과 DES를 시술받은 II군(388명; 68.0 ± 11.1세; 남자 254명)으로 분류하여 분석하였다(Fig. 1).
연구 방법
본 연구에서 작은 혈관의 기준은 선행 연구의 기준에 따라서 2.75 mm 이하로 정의하였으며[11] 양 군에서 성별 및 연령, 관상동맥 질환 위험인자(고혈압, 당뇨병, 흡연, 고지혈증), 임상 진단명, 좌심실 구혈률, 저밀도 지단백 콜레스테롤, 고밀도 지단백 콜레스테롤, 총 콜레스테롤, 당화혈색소, 만성 신장 질환, 조영제 사용량, 분지혈관의 침범, 다혈관 질환, 총 방사선의 양과 방사선 조사 시간의 차이를 비교하였다. 또한 PCI 시술 과정에서 혈전흡입술 및 죽상경화반절제술 유무를 양 군 간에 비교하였다. 병변의 유의한 협착은 내경 동맥이 70% 이상 좁아진 경우로 정의하였다. 혈류의 정도는 thrombolysis in myocardial infarction (TIMI) flow를 사용하여 분류하였다[12]. DEB와 DES 중 시술 방법의 선택은 시술자의 판단에 의하여 결정하였으며 시술 전 풍선확장술 후에 TIMI II 이하 또는 잔여 협착이 30% 이상인 경우 또는 내막박리가 발생한 경우에는 DEB 시술보다 DES 시술을 하였다[13]. 성공적인 재관류는 관동맥의 혈류가 TIMI III로 유지되고 잔여 협착이 25% 이하인 경우로 정의하였다[14]. 연구 결과를 확인하기 위하여 1년간 양 군에서 MACE의 발생률을 비교하였으며 이때 MACE는 all cause death, target vessel revascularization (TVR), target lesion revascularization (TLR), stent thrombosis (ST), myocardial infarction (MI)으로 하였다. All cause death는 환자의 발생 수가 적기 때문에 시술 후 환자의 모든 사망으로 정의하였고 TLR은 스텐트 내 혹은 상하 5 mm 이내의 50% 이상의 재협착으로 인하여 재관류술이 필요한 경우로 정의하였다. 또한 TVR은 시술받은 병변으로 하였으며 모든 MACE의 발생은 시술받은 날의 혈관조영 검사 영상과 시술받은 날부터 1년 이내의 혈관조영 검사 영상을 확인하였고 정확한 분석을 위하여 inverse probability of treatment weighting (IPTW)을 시행하였다. 또한 1차 임상 종말점을 TVR, TLR, ST로 하였으며 2차 임상 종말점을 all cause death, MACE로 하였다. 즉 작은 혈관 병변을 보이는 관상동맥 질환 환자를 대상으로 DES와 DEB 시술 후에 1년간의 MACE 발생에 대한 임상적 효과를 후향적으로 등록하여 분석하였다.
사용된 balloon 종류
사용된 balloon 개수는 총 104개로 SeQuent® Please Neo Balloon (B. Braun, Melsungen, Germany) 99명(95.1%), Pantera® Lux Balloon (BIOTRONIK, Berlin, Germany) 5명(4.8%) 등이 었다.
사용된 stent 종류
사용된 stent 개수는 총 388개로 Synergy StentTM (Boston Scientific, Marlborough, MA, USA) 129명(33.2%), Cre8TM EVO Stent (DIO Medical, Seoul, Korea) 105명(27.0%), BioMime StentTM (Meril Life, Gujarat, India) 41명(10.5%), Xience Sierra StentTM (Abbott, Lake County, IL, USA) 40명(10.3%), Firehawk StentTM (MicroPort, Shanghai, China) 29명(7.4%), Resolute Onyx StentTM (Medtronic, Dublin, Ireland) 21명(5.4%), Orsiro Mission StentTM (BIOTRONIK) 15명(3.8%), Biofreedom UltraStentTM (Biosensors International, Singapore) 6명(1.5%), Ultimaster Tansei StentTM (Terumo, Tokyo, Japan) 1명(0.2%), D-Storm StentTM (CGBio, Seoul, Korea) 1명(0.2%) 등이었다.
통계 분석
각 군 간의 비교는 SPSS (version 25.0; IBM, Armonk, NY, USA) 통계 프로그램을 사용하여 분석하였다. 모든 자료는 평균 ± 표준편차로 나타내었다. 독립 변수는 chi-square 검정으로 분석하였고 연속변수는 독립표본 t-test를 시행하였으며 생존율은 life table analysis를 이용하였고 생존곡선인 Kaplan-Meier curve를 이용하여 분석하였다. 통계 분석 시 연속변수의 경우 정규분포 여부를 확인하여 분석을 진행하였고 정규성 만족 시 t-test, 만족하지 못한 경우 Wilcoxon rank test로 분석하였다. 범주형 변수의 경우에도 각 변수의 기대변수를 고려하여 Pearson chi-square test, Fisher’s exact test로 각각 분석하였다. 또한 나이, 성별, 저밀도 지단백 콜레스테롤, 고밀도 지단백 콜레스테롤, 총 콜레스테롤, 당화혈색소, creatine, estimated glomerular filtration rate, 진단명으로 stable angina pectoris (SAP), unstable angina pectoris (UAP), ST-elevation myocardial infarction (STEMI), non-STEMI (NSTEMI), 위험인자로 고혈압, 당뇨, 고지혈증, 흡연, 좌심실 구혈률, pre-TIMI flow, 천자 접근 방법, 분지 혈관, 다혈관 질환을 가지고 있는 환자들을 보정하였고 성향 점수 매칭(propensity score matching)에 의하여 치료변수 수준 간 설명변수의 균형이 이루어졌음을 확인한 뒤 IPTW를 통하여 치료 효과를 추정하였다.
결 과
대상 환자의 임상적 특징
대상 환자는 총 492명으로 I군 104명(21.1%), II군 388명 (78.9%)이었다. 성별에서 남성은 I군 83명(79.8%), II군 254명 (65.5%)으로 I군에서 비율이 높았다(p= 0.005). 위험 요인으로 고지혈증 I군 13명(12.5%), II군 82명(21.1%)으로 I군이 II보다 적었고(p= 0.048) 흡연 I군 23명(22.1%), II군 36명(9.3%)으로 I군이 II군보다 많았다(p< 0.001). 질환별 분포를 보면 SAP I군 6명(5.8%), II군 6명(1.5%)으로 I군이 II군보다 많았고(p= 0.013) UAP I군 29명(27.9%), II군 178명(45.9%)으로 II군이 I군보다 많았다(p< 0.001). NSTEMI는 I군 49명(47.1%), II군 113명(29.5%)으로 I군이 II군보다 많았다(p< 0.001). 심초음파 검사에서 좌심실 구혈률은 I군이 II군보다 낮았다(53.8% ± 12.6% vs. 58.6% ± 11.9%; p< 0.001). I군과 II군의 IPTW를 시행한 결과 총 549명을 I군 269명, II군 280명으로 분류하여 비교 분석하였고 모든 임상적 특징에서 통계적으로 유의한 차이를 보이지 않았다(Table 1).
대상 환자의 병변과 중재술 소견
관상동맥조영술에서 분지 혈관 병변 I군 56명(53.8%), II군 259명(66.8%)으로 I군이 II군에 비해 적었다(p= 0.015). 조영제 사용량은 I군이 II군보다 많았다(157.7 ± 55.8 vs. 140.9 ± 45.2 mL; p= 0.002). 전체 방사선 조사 시간은 I군이 II군보다 길었다(17.4 ± 10.3 vs. 14.7 ± 9.6 min; p= 0.013). 중재술에 사용된 치료 도자의 평균 길이는 I군이 II군보다 짧았다(22.4 ± 5.9 vs. 27.4 ± 9.3 mm; p< 0.001). 치료 도자의 평균 직경은 I군이 II군보다 작았다(2.4 ± 0.1 vs. 2.6 ± 0.1 mm; p< 0.001). I군과 II군의 IPTW를 시행한 결과 중재술에 사용된 치료 도자의 평균 길이는 I군이 II군보다 짧았다(21.9 ± 5.9 vs. 26.9 ± 9.2 mm; p< 0.001). 치료 도자의 평균 직경은 I군이 II군보다 작았다(2.5 ± 0.2 vs. 2.6 ± 0.1 mm; p< 0.001) (Table 2).
PCI 후 1년간 MACE
1년간 MACE의 발생으로 TVR은 I군 3명(2.9%), II군 6명(1.5%)이고 TLR은 I군 2명(1.9%), II군 3명(0.8%)으로 차이가 없었으며 모든 원인 사망은 I군 1명(1.0%), II군 6명(1.5%)이고 stent thrombosis는 I군 0명(0.0%) II군 1명(0.3%)로 차이가 없었다. 전체 MACE는 I군 6명(5.8%), II군 16명(4.1%)으로 차이는 없었다. I군과 II군의 IPTW을 시행한 결과 PCI 후 1년간 MACE는 차이가 없었다(Table 3). 생명표를 이용한 Kaplan-Meier curve 분석을 보면 TVR과 TLR은 차이가 없었고 모든 원인 사망률과 전체 MACE는 두 군 간에 차이가 없었다. IPTW 시행 결과에서도 두 군 간에 차이는 없었다(Figs. 2, 3).

One-year MACE according to treatment group: Before and after inverse probability of treatment weighting
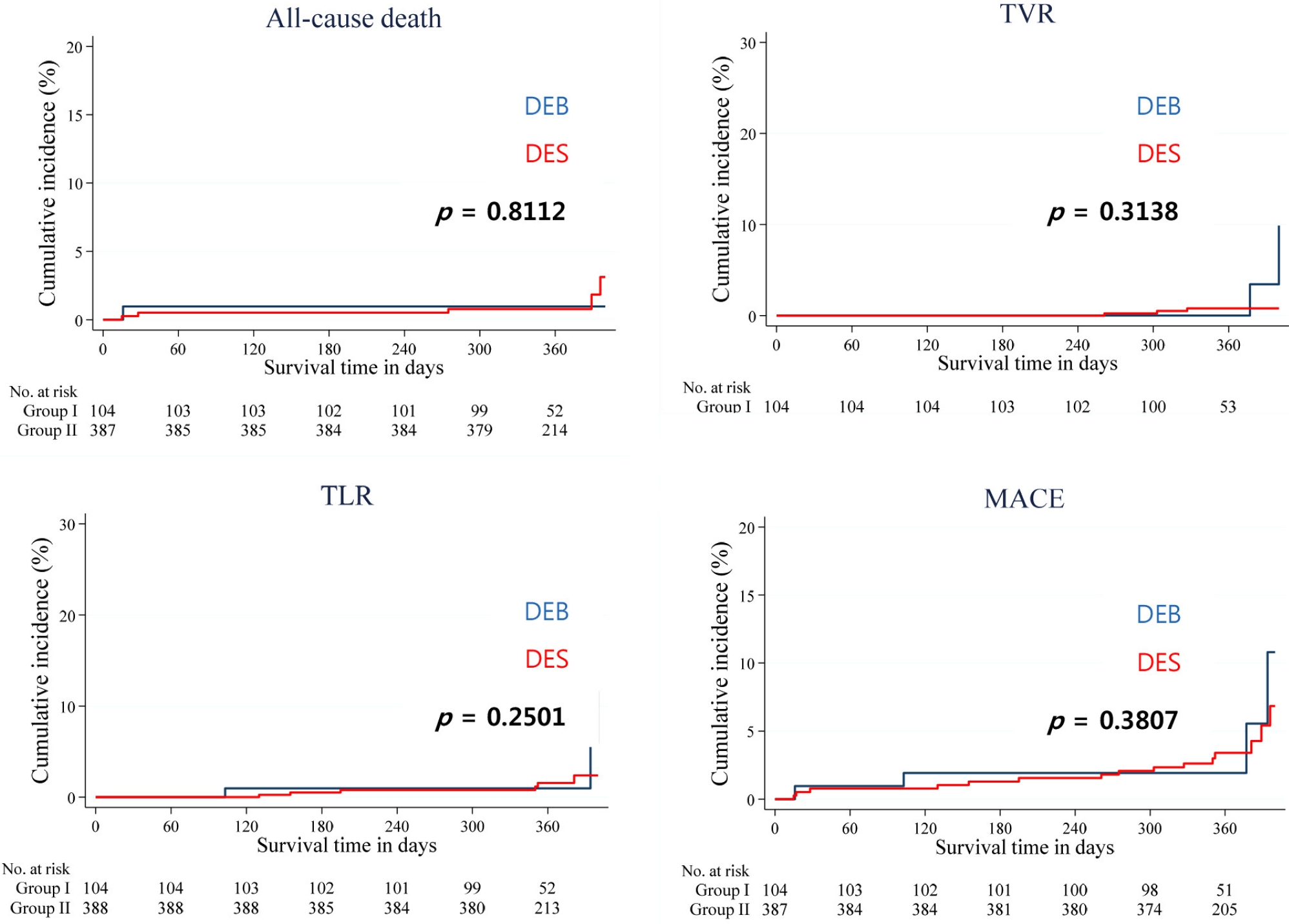
Comparison of all-cause mortality, target lesion revascularization (TLR), target vessel revascularization (TVR), and major adverse cardiac events (MACE) at the 1-year follow-up between groups I (DEB) and II (DES). DEB, drug-eluting balloon; DES, drug-eluting stent.

Comparison of all-cause death, target lesion revascularization (TLR), target vessel revascularization (TVR), and major adverse cardiac events (MACE) at the 1-year follow-up between groups I (DEB) and II (DES) with inverse probability of treatment weighting. DEB, drug-eluting balloon; DES, drug-eluting stent.
고 찰
본 연구에서 심혈관 질환을 가지고 있는 환자 중 작은 관상동맥 병변을 대상으로 하여 DEB의 임상적 효과를 관찰하고자 DES와 비교 연구를 진행하였다. 일 년간의 비교 분석을 통하여 DEB와 DES를 시술받은 환자에서 양 군 간에 임상 경과는 차이가 없었다. 이를 통하여 DEB는 작은 관상동맥 질환을 가지고 있는 환자에게 DES를 대체하여 사용이 가능하다고 사료된다.
심혈관계 환자에서 병변의 길이가 길고 직경이 작은 만성 심부전 환자에서 MACE의 발생이 높은 결과를 보였고[15] 관상동맥의 직경이 작은 환자가 직경이 큰 관상동맥을 가진 환자보다 관상동맥에 스텐트 시술 후 임상 결과가 좋지 않다는 연구가 있다[16]. 작은 관상동맥을 가진 환자는 사망 및 심근경색이 높은 것으로 알려져 있으며 큰 직경의 관상동맥을 가진 환자에 비하여 재협착률이 1.5배 이상 높았다[17].
DEB는 BMS와 DES의 재협착 치료에 효과적으로 사용되지만[18] 작은 관상동맥 질환에서 DEB와 DES의 효능과 안전성을 평가한 많은 임상 연구가 필요한 실정이다[19]. DES는 재협착이 발생하기 쉬운 관상동맥 병변에 대한 표준 치료법으로 자리 잡고 있다[20]. 그러나 DES는 여러 가지 단점이 있다. 첫째, 염증 반응을 억제시키는 약물 효과가 없어지는 시점에서 신생내막의 증식이 일어나는 late catch-up 연상이 발생할 수 있다. 둘째, 손상된 혈관의 내막세포의 재생이 이루어지지 않아 후기 혈전증 발생의 가능성도 있다[21-23]. 이러한 문제를 해결하기 위하여 DEB를 도입하여 사용하지만 시술자들 사이에서 직경이 작은 관상동맥 병변에 DES 시술과 DEB 시술의 결정에 어려움이 있다.
DEB의 장점으로는 항혈소판제의 복용을 줄일 수가 있어 출혈의 위험성을 감소시키며[24] 혈관벽으로 빠르게 약물을 전달할 수 있고 혈관벽의 신속한 치료가 가능하다는 점이 있다[25]. DEB에 사용할 수 있는 항증식제 중에서는 paclitaxel이 잘 연구되었으며[26] 많은 풍선 도자에 사용되어 왔고 보험 고시에도 언급되어 있는데 2.75 mm 이하의 스텐트 시술을 받지 않는 작은 혈관인 de novo 병변에 사용된다고 되어 있다. 본 연구는 이를 충족하여 작은 관상동맥 병변을 치료하는 데 paclitaxel이 도포된 풍선 기구인 SeQeunt® Please Neo와 Pantera® Lux Balloon을 사용하였고 현재까지도 널리 이용되고 있는 기구로써 DES를 대처할 수 있는 시술로 많이 활용되고 있다. Paclitaxel을 사용한 DEB와 DES의 비교 연구를 보면 6개월 후 혈관조영에서 혈관의 직경 협착을 비교해 본 결과 두 군 간에 대등한 결과를 보였고 36개월 후 두 그룹에서 유사한 사건 발생률을 보였다[27]. 한 연구에서는 마찬가지로 작은 관상동맥 질환을 가진 환자의 DEB와 DES를 비교하는 다기관, 다국적 무작위 임상시험을 하였고 두 전략 모두 임상 효과에서의 차이가 없었다[28]. 또 다른 연구에서는 초기 풍선 도자를 사용하여 혈관 박리가 발생했을 때 DEB 전략에서 DES 전략으로 변경하여 연구를 진행하였지만 DEB의 사용 전과 후의 치료 결과는 상관관계가 없었음을 보였다[29]. 이와 반대로 한 연구에서 분석한 결과를 보면 DEB가 DES보다 혈관의 재협착과 심근경색증의 발생이 더 높다는 연구 결과를 보였고 혈전의 발생과 모든 원인 사망 발생률은 차이를 보이지 않았다[30]. 이를 통하여 DEB는 DES 시술이 불가능한 환자에게는 선택적으로 사용 가능하고 이를 효율적으로 운영할 수 있다고 본다. 본 연구에서도 작은 관상동맥 병변을 가진 환자에서 DEB과 DES의 임상 효과를 비교 분석하였는데 두 군 간의 보고자 하였던 MACE 발생에는 차이가 없었고 정확한 분석을 하고자 IPTW를 시행한 결과도 양 군 간에 차이가 없었다. 또한 DEB 시술 전과 후를 관찰하여 혈관 박리로 인한 TIMI flow의 감소 현상을 보이지 않는다면 DES 시술로 변경하지 않고 DEB 시술을 하였다. 시술 도자의 길이와 직경에 관해서는 보정을 하였음에도 불구하고 IPTW 전과 후에 통계적으로 유의한 차이를 보였다. DES가 DEB와 비교할 때 시술 도자의 길이가 더 길게 나오기 때문에 차이가 있을 수밖에 없었으며 직경의 차이는 환자 수의 차이로 인하여 발생한 문제로 보인다. DEB군과 DES군에서의 당화혈색소의 차이는 없었지만 연구를 진행함에 있어 많은 당뇨병 환자가 포함되었다. 이러한 관점에서 보았을 때도 두 군 간의 차이는 보이지 않았다. 본 연구에서 비교 분석하고자 한 DEB과 DES의 1년간의 임상 효과를 보았을 때 두 군 간의 차이가 없었다. 이를 통하여 작은 관상동맥 병변을 가진 환자에서 DES 시술을 대신하여 더욱 적극적으로 DEB의 사용도 가능할 것으로 사료된다.
본 연구의 제한점은 후향적 연구로 이루어졌기 때문에 추적 기간 중 일부 환자가 누락되어 모든 환자를 대상으로 검사가 이루어지지 못하였다는 점이다. 또한 DES의 경우에 다양한 스텐트를 사용하여 다양한 약물이 포함되었다. 그러나 DEB 사용 후 약물에 대한 reference가 없다는 점에서 DES와 DEB를 사용한 모든 환자에서 aspirin과 clopidogrel이 사용되었고 두 군에서의 항혈소판제의 투여 기간을 구별하기 어려운 점이다. 다혈관 질환 환자뿐만 아니라 긴 병변을 가지고 있는 환자에서의 DES와 DEB를 모두 사용하는 경우가 많은 점, 전체의 병변 길이를 예측하기는 힘들다는 점도 있다. 하지만 사용된 기구의 길이로 병변의 길이를 예측할 수 있어 미만성 긴 병변을 유추할 수 있다고 본다. 작은 혈관의 정의는 2.5 mm 이하이지만 본 연구에서는 2.5 mm 이하의 환자 수가 많지 않아서 혈관 병변의 직경은 2.75 mm 이하로 하였다.
본 연구는 2021년 1월부터 2022년 09월까지 2.75 mm 이하의 작은 관상동맥 병변에 대해 PCI를 시술받았던 환자 중 492명의 환자를 대상으로 DEB와 DES로 분류하여 1년간의 MACE 발생의 차이를 비교 분석하였다. DEB군 104명과 DES군 388명에 대하여 IPTW 시행 후 1년간 발생한 MACE는 두 군 간의 유의한 차이가 없었다. 따라서 작은 관상동맥 혈관 질환을 가지고 있는 환자에서 DEB는 DES를 대신하여 사용할 수 있으며 DEB의 사용으로 인하여 항혈소판제 복용 기간을 단축하고 출혈의 위험성을 개선시키며 경제적인 이득을 얻을 수 있을지에 대한 더 많은 연구가 필요할 것으로 사료된다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
None.
AUTHOR CONTRIBUTIONS
MSK and MHJ designed the study.
SHP, SO, DYH, YHL, JHA, KHC, MCK, DSS, YJH, JHK, YA, MHJ filled up data.
SHP, SO, SHL, YHL, KHC, YJH, JHK, YA, MHJ interpreted the data and performed statistical analysis.
MSK, KHC, YJH, MHJ wrote the paper.
Acknowledgements
This work was supported in part, by the Chonnam National University Hospital Research Fund.