 |
 |
| Korean J Med > Volume 99(3); 2024 > Article |
|
Abstract
Despite medical and invasive advancements, cardiovascular mortality attributable to ischemic heart disease, including acute coronary syndrome (ACS), persists at a substantial level. Clinical guidelines have been issued by the European Society of Cardiology (ESC) and American College of Cardiology/American Heart Association to support clinicians in making appropriate decisions and improving the prognosis of ACS patients. ESC recently introduced a new ACS guideline in August 2023. This review discusses the recent modification in the diagnosis and management of early-phase ACS in the 2023 ESC guideline.
ΊΧεΆ╡φ ΊΗ╡Ά│ΕΉ▓φ ΉηΡΈμΝΉΩΡ ΈΦ░Έξ┤Έσ┤ ΉΜυΆ╖╝Ά▓╜ΉΔΚΉοζΉζΕ Έ╣ΕΈκψΊΧε ΊΩΙΊαΙΉΕ▒ ΉΜυΉπΙΊβαΉε╝Έκε Ήζ╕ΊΧε ΉΓυΈπζΈξιΉζΑ ΉΩυΉιΕΊηΙ ΈΗΤΉε╝Έσ░ Ήζ┤ΈΛΦ ΈΜνΈξ╕ Ά╡φΆ░ΑΉΩΡΉΕεΈΠΕ Έ╣ΕΉΛ╖ΊΧε ΉΜνΉιΧΉζ┤ΈΜν[1,2]. ΈΦ░Έζ╝ΉΕε ΉΩυΈθυ Ά╡φΆ░ΑΉζα ΉΜυΉηξΊΧβΊγΝΈΓα ΊαΣΊγΝΉΩΡΉΕεΈΛΦ Ά╕ΚΉΕ▒Ά┤ΑΈΠβΈπξΉοζΊδΕΆ╡░(acute coronary syndrome, ACS)Ήζα Έ│ΣΉδΡ ΈΓ┤ ΉΓυΈπζΈξι Έ░Π ΉηξΆ╕░ ΉαΙΊδΕΈξ╝ ΊΨξΉΔΒΉΜεΊΓνΆ╕░ ΉεΕΊΧαΉΩυ ΉηΕΉΔΒ Έ░Π Έ░σΈ▓ΧΈκι ΉιΕΈυ╕Ά░ΑΆ░Α Ήμ╝Ή╢ΧΉζ┤ ΈΡε ΉπΕΈμΝΉπΑΉ╣ρΉζΕ ΉιεΉηΣΊΧαΆ│ι Έ░εΊΣεΊΧ┤ΉβΦΈΜν[3]. ΉπΕΈμΝΉπΑΉ╣ρΉζα Ά░ΑΉηξ ΉνΣΉγΦΊΧε ΈςσΉιΒΉζΑ ACS ΊβαΉηΡ Ή╣αΈμΝΈξ╝ ΈΜ┤ΈΜ╣ΊΧαΈΛΦ ΉηΕΉΔΒΉζαΆ░Α ΊαΕ ΉΔΒΊβσΉΩΡΉΕε Ή╡εΉΕιΉζα ΉπΕΈμΝ Ία╣ΉζΑ Ή╣αΈμΝ ΉιΕΈη╡ΉζΕ ΉΙαΈο╜ΊΧι ΉΙα ΉηΙΈΠΕΈκζ Ά╕╕ΉζΕ ΉιεΉΜεΊΧαΈΛΦ ΈΞ░ ΉηΙΈΜν. 2023ΈΖΕ 8ΉδΦ ΈΕνΈΞεΈηΑΈΥε ΉΧΦΉΛνΊΖΝΈξ┤ΈΜ┤ΉΩΡΉΕε Ά░εΉ╡εΈΡε ΉειΈθ╜ΉΜυΉηξΊΧβΊγΝ(European Society of Cardiology)ΉΩΡΉΕε Έ░εΊΣεΈΡε ACS ΉπΕΈμΝΉπΑΉ╣ρΉζΑ Ά╕░Ήκ┤Ήζα Έψ╕Ά╡φ Έ░Π ΉειΈθ╜ ΉπΑΉ╣ρΆ│╝ ΉΩυΈθυ Έσ┤ΉΩΡΉΕε ΈπΟΉζΑ Έ│ΑΊβΦΆ░Α ΉηΙΉΩΙΈΜν[4-6]. Έ│╕ ΈΖ╝Έυ╕ΉΩΡΉΕεΈΛΦ Ή┤ΙΆ╕░ ΉΜεΉιΡΉζα ACS ΉπΕΈΜρΆ│╝ Ή╣αΈμΝΉΩΡ ΉηΙΉΨ┤ Ήζ┤Έ▓Ι ΉπΑΉ╣ρΉΩΡΉΕε ΉΔΙΈκφΆ▓Ν Έ░ΦΈΑΡ ΉιΡΉΩΡ ΈΝΑΊΧ┤ ΉΧΝΉΧΕΈ│┤Ά│ι Ά╖╕ Έ░░Ά▓╜Ά│╝ Ά╖╝Ά▒░Ά░Α ΈΡε ΉηΕΉΔΒ ΉΩ░Ά╡υΉΩΡ ΈΝΑΊΧ┤ ΉιΧΈουΊΧ┤ Έ│┤Ά│ιΉηΡ ΊΧεΈΜν.
Ά╕░Ήκ┤Ήζα Έψ╕Ά╡φΆ│╝ ΉειΈθ╜ ΉπΑΉ╣ρΉζΑ ΉΜυΉιΕΈΠΕΉζα STΈ╢ΕΉιΙ ΉΔΒΉΛ╣ ΉΩυΈ╢ΑΉΩΡ ΈΦ░Έζ╝ ACSΈξ╝ STΈ╢ΕΉιΙ ΉΔΒΉΛ╣ ΉΜυΆ╖╝Ά▓╜ΉΔΚΉοζ(ST-elevation myocardial infarction, STEMI)Ά│╝ Έ╣ΕSTΈ╢ΕΉιΙ ΉΔΒΉΛ╣ Ά╕ΚΉΕ▒Ά┤ΑΈΠβΈπξΉοζΊδΕΆ╡░(nonST-elevation acute coronary syndrome, NSTE-ACS) ΈΣαΈκε ΈΓαΈΙΕΉΨ┤ Ά░ΒΆ░ΒΉΩΡ ΈΝΑΊΧε ΉπΕΈμΝΉπΑΉ╣ρΉζΕ ΉιεΉΜεΊΧαΉαΑΈΜν. 2023ΈΖΕ ACS ΉπΑΉ╣ρΉζΑ Ήζ┤ΈΥνΉζΕ ΈςρΈΣΡ ΉΧΕΉγ░Έξ┤ΈΛΦ ΉιΡΉζ┤ Ά╕░Ήκ┤Ήζα ΉπΑΉ╣ρΆ│╝ Ά░ΑΉηξ ΊΒ░ Ή░ρΉζ┤ ΉνΣ ΊΧαΈΓαΉζ┤ΈΜν. ΉοΚ ACS ΉιΕΈ░αΉζΕ ΊΧαΈΓαΉζα ΉΛνΊΟβΊΛ╕Έθ╝ΉζΕ Ά░ΑΉπΑΈΛΦ ΉπΙΊβαΉε╝Έκε Ήζ┤ΊΧ┤ΊΧαΆ│ι ΊΗ╡ΊΧσΉιΒΉε╝Έκε ΉιΣΆ╖╝ΊΧ┤ΉΧ╝ ΊΧεΈΜνΈΛΦ Ά░εΈΖΡΉΩΡΉΕε Ή╢εΈ░εΊΧαΆ│ι ΉηΙΈΜν. ΈαΡΊΧε ΉηΕΉΔΒΉζαΉζα Ά┤ΑΉιΡΉΩΡΉΕε ACSΆ░Α ΉζαΉΜυΈΡαΈΛΦ ΊβαΉηΡΉΩΡ ΈΝΑΊΧ┤ abnormal electrocardiogram (EKG)? (A), clinical context? (C), stable patients? (S)Έζ╝ΈΛΦ Έυ╝ΉζΝΉε╝Έκε Ήγ░ΉΕιΉιΒΉζ╕ ΊΠΚΆ░ΑΈξ╝ ΊΧαΈΠΕΈκζ ΊΧαΉαΑΉε╝Έσ░ Ά╖╕ Ήζ┤ΊδΕ Ά┤ΑΉΔΒΈΠβΈπξΉκ░ΉαΒΉΙι(coronary angiogram, CAG)Ά│╝ Ά░βΉζΑ Ή╣ρΉΛ╡ΉιΒΉζ╕ Ή╣αΈμΝ ΉιΕΈη╡(invasive strategy)Ά│╝ ΊΧφΊαΙΉιΕΉιε Ή╣αΈμΝ(antithrombotic therapy), ΉηυΆ┤ΑΈξαΉΙι(revascularization) Έ░σΈ▓Χ, Ήζ┤Ή░ρ ΉαΙΈ░σ(secondary prevention)ΉζΕ ΉΨ┤ΈΨ╗Ά▓Ν ΊΧι Ά▓ΔΉζ╕ΉπΑΉΩΡ ΈΝΑΊΧε ΊζΡΈοΕΉζΕ ΉιεΉΜεΊΧαΈσ┤ΉΕε Ή╣αΈμΝ ΉιΕΈ░αΉΩΡ ΈΝΑΊΧε ΊΠυΆ┤ΕΉιΒΉζ┤Έσ┤ΉΕε ΉΜνΉγσΉιΒΉζ╕ ΉπΑΉ╣ρΉζΕ ΉιεΉΜεΊΧαΈινΆ│ι ΊΧαΉαΑΈΜν(Table 1).
ACSΉζα ΉπΕΈΜρΆ│╝ Ή╣αΈμΝΉΩΡ ΉηΙΉΨ┤ CAGΈξ╝ ΉΜεΊΨΚΊΧι ΈΝΑΉΔΒΆ│╝ ΉΜεΉιΡΉζΕ Ά▓░ΉιΧΊΧαΈΛΦ Ά▓ΔΉζΑ ΉηΕΉΔΒΉζαΉΩΡΆ▓Ν ΉηΙΉΨ┤ ΈπνΉγ░ ΉνΣΉγΦΊΧε Έ╢ΑΈ╢ΕΉζ┤ΈΜν. CAGΈΛΦ ACS Έ░εΉΔζΉζα ΉδΡΉζ╕Ήζ┤ Ά┤ΑΉΔΒΈΠβΈπξΉπΙΊβαΉζ╕ΉπΑΈξ╝ Έ╣ΕΆ╡ΡΉιΒ ΉιΧΊβΧΊΧαΆ▓Ν ΊΝΝΉΧΖΊΧι ΉΙα ΉηΙΆ│ι Ά▓╜ΊΦ╝ΉιΒ Ά┤ΑΉΔΒΈΠβΈπξΉνΣΉηυΉΙι(percutaneous coronary intervention, PCI)Ήζ┤ΈΓα Ά┤ΑΉΔΒΈΠβΈπξΉγ░ΊγΝΈκεΉΙι(coronary artery bypass graft, CABG)Ά│╝ Ά░βΉζΑ revascularization ΉΩυΈ╢ΑΉΩΡ ΈΝΑΊΧε Ά▓░ΉιΧ Έ░Π Ή╣αΈμΝΆ░Α Έ░ΦΈκε Ά░ΑΈΛξΊΧαΈΜνΈΛΦ ΉηξΉιΡΉζ┤ ΉηΙΈΜν. ΊΧαΉπΑΈπΝ ΈΠβΉΜεΉΩΡ ΈΝΑΈΠβΈπξΈ░ΧΈουΉοζΉζ┤ΈΓα ΊΠΡΈΠβΈπξΉΔΚΉιΕΉοζΆ│╝ Ά░βΉζΑ Ά┤ΑΉΔΒΈΠβΈπξ Ήβ╕ ΉδΡΉζ╕Ήε╝Έκε ACSΆ░Α Έ░εΉΔζΊΧε ΊβαΉηΡΉΩΡΉΕεΈΛΦ ΉανΊηΙΈιν ΉπΕΈΜρΆ│╝ Ή╣αΈμΝΆ░Α ΉπΑΉΩ░ΈΡι ΉΙα ΉηΙΆ│ι CAG ΉηΡΉ▓┤ΈΠΕ ΊΧσΈ│ΣΉοζΉζΕ ΈΠβΈ░αΊΧι ΉΙα ΉηΙΉε╝ΈψΑΈκε ΉΜεΊΨΚΊΧι ΈΝΑΉΔΒΉζΕ Ήηα ΉΕιΊΔζΊΧαΆ│ι Ά╖╕ ΉΜεΉιΡΉζΕ Ήηα ΉηκΉΧΕΉΧ╝ ΊΧεΈΜν[6].
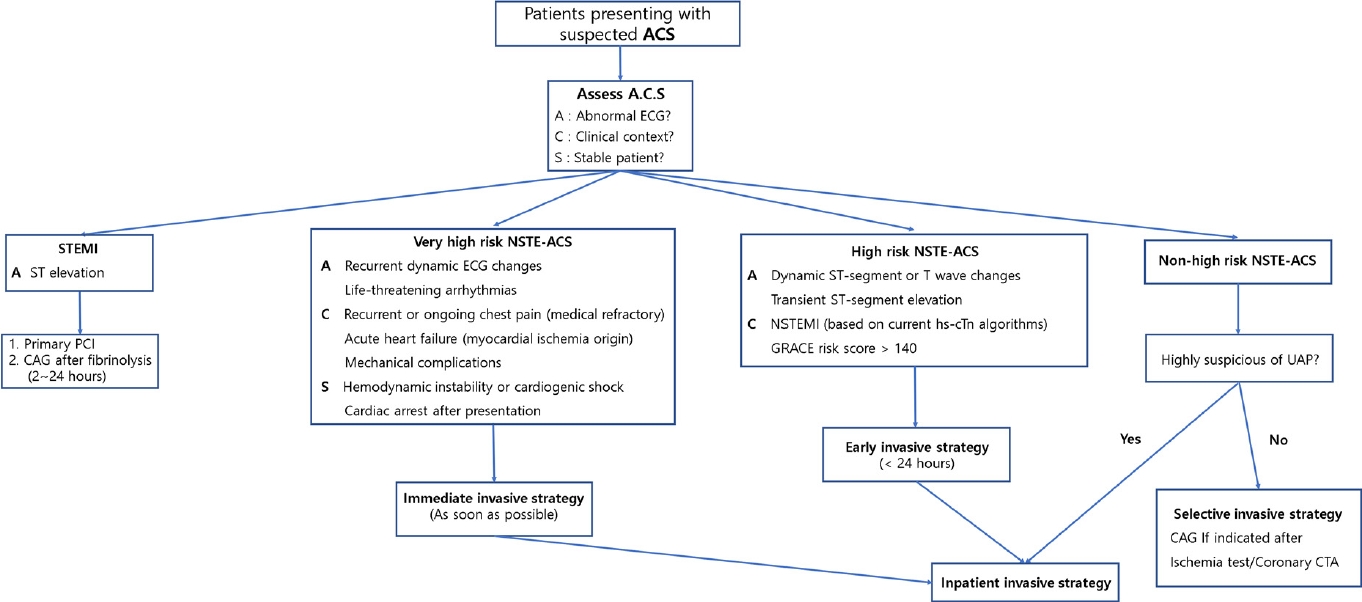
ΉΜυΉιΕΈΠΕΉΩΡΉΕε STΈ╢ΕΉιΙ ΉΔΒΉΛ╣Ήζ┤ ΉηΙΉΨ┤ STEMIΆ░Α ΉζαΉΜυΈΡαΈΛΦ Ά▓╜Ήγ░ΉΩΡΈΛΦ ΉαΙΉιΕ ΉπΑΉ╣ρΆ│╝ ΊΒ░ Ή░ρΉζ┤ ΉΩΗΉζ┤ PCIΆ░Α Ά░ΑΈΛξΊΧε Έ│ΣΉδΡΉΩΡΉΕεΈΛΦ ΉΜεΆ░Ε ΉπΑΉΩ░ΉζΕ Ή╡εΉΗΝΊβΦΊΧαΉΩυ primary PCIΈξ╝ ΉεΕΊΧ┤ CAGΈξ╝ ΉΜεΊΨΚΊΧαΈΠΕΈκζ ΊΧαΆ│ι PCIΆ░Α Ά░ΑΈΛξΊΧαΉπΑ ΉΧΛΉζΑ Έ│ΣΉδΡΉΩΡΉΕεΈΛΦ PCIΆ░Α Ά░ΑΈΛξΊΧε Έ│ΣΉδΡΉε╝Έκε ΉοΚΉΜε Ήζ┤ΉΗκΊΧαΈΡα ΉιΕΉδΡ ΊδΕ PCIΆ░Α 2ΉΜεΆ░Ε Ήζ┤ΈΓ┤ΉΩΡ ΉΜεΊΨΚΈΡαΆ╕░ ΉΨ┤ΈινΉγ╕ Ά▓╜Ήγ░ ΉΕυΉειΉΗΝ ΉγσΊΧ┤(fibrinolysis)Έξ╝ ΉΜεΊΨΚΊΧαΆ│ι Ήζ┤ΉΗκΊΧαΈΠΕΈκζ Ά╢ΝΆ│ιΊΧαΉαΑΈΜν. ΉΕυΉειΉΗΝ ΉγσΊΧ┤Ήζα ΉΕ▒Ά│╡ ΉΩυΈ╢ΑΉβΑ Ά┤ΑΆ│ΕΉΩΗΉζ┤ 2-24ΉΜεΆ░Ε Ήζ┤ΈΓ┤ΉΩΡ CAGΆ░Α Ά╢ΝΉηξΈΡεΈΜν[7,8]. NSTE-ACS ΊβαΉηΡΉΩΡΉΕεΈΛΦ ΉεΕΆ╕ΚΈΠΕΉβΑ Ά┤ΑΉΔΒΈΠβΈπξΉπΙΊβα Ά┤ΑΈιρ Ά░ΑΈΛξΉΕ▒ΉζΕ Ά░ΡΉΧΙΊΧαΉΩυ Ή┤ΙΆ│ιΉεΕΊΩαΆ╡░(very high risk), Ά│ιΉεΕΊΩαΆ╡░(high risk), Ήζ╝Έ░αΉεΕΊΩαΆ╡░(non-high risk)Ήε╝Έκε Ά╡υΈ╢ΕΊΧαΉΩυ CAG ΉΜεΉιΡΉζΕ Ά╢ΝΆ│ιΊΧαΉαΑΈΜν(Fig. 1). ΊαΙΉΩφΊΧβΉιΒ Έ╢ΙΉΧΙΉιΧΉΕ▒Ήζ┤ ΉηΙΆ▒░ΈΓα Ή╣αΈςΖΉιΒ Έ╢ΑΉιΧΈπξ, ΉΜυΆ╖╝ΊΩΙΊαΙΈκε Ήζ╕ΊΧε Ά╕ΚΉΕ▒ ΉΜυΈ╢ΑΉιΕΉζ┤ΈΓα Ά╕░Ά│ΕΉιΒ ΊΧσΈ│ΣΉοζΉζ┤ ΉζαΉΜυΈΡαΈΛΦ Ά▓╜Ήγ░ Ή┤ΙΆ│ιΉεΕΊΩαΆ╡░Ήε╝Έκε ΉΕνΉιΧΊΧαΆ│ι Ή╡εΈΝΑΊΧε Έ╣ρΈου CAGΈξ╝ ΉΜεΊΨΚΊΧαΈΠΕΈκζ Ά╢ΝΆ│ιΊΧαΉαΑΈΜν. ΉαΙΉιΕ ΉπΑΉ╣ρΉΩΡΉΕεΈΛΦ 2ΉΜεΆ░Ε Ήζ┤ΈΓ┤Έκε STEMIΉΩΡ ΉνΑΊΧαΉΩυ CAGΈξ╝ ΉΜεΊΨΚΊΧαΈΠΕΈκζ ΊΧαΉαΑΉε╝ΈΓα Ήζ┤Έ▓Ι ΉπΑΉ╣ρΉΩΡΉΕεΈΛΦ Ή╡εΈΝΑΊΧε Έ╣ρΈου ΉΜεΊΨΚΊΧαΈζ╝ΈΛΦ ΉιΧΈΠΕΈκε ΉΜεΆ░Ε ΈςΖΉΜεΈξ╝ ΊΧαΉπΑ ΉΧΛΉΧαΆ│ι ΉΜυΉιΕΈΠΕΉΩΡΉΕε ΉλΝΉμ╝Ά░ΕΈ╢Α Έ│ΣΈ│Α Ία╣ΉζΑ ΈΜνΊαΙΆ┤ΑΉπΙΊβαΉζΕ ΉΜεΉΓυΊΧαΈΛΦ 6Ά░ε Ήζ┤ΉΔΒΉζα ΉειΈΠΕΉΩΡΉΕε STΈ╢ΕΉιΙ ΊΧαΆ░Χ(inferolateral ST depression)Ά│╝ aVR and/or V1Ήζα STΈ╢ΕΉιΙ ΉΔΒΉΛ╣Ήζ┤ Έ│┤Ήζ┤ΈΛΦ Ά▓╜Ήγ░ ΈαΡΊΧε Ή┤ΙΆ│ιΉεΕΊΩαΆ╡░ΉΩΡΉΕε ΉιεΉβ╕ΊΧαΉαΑΈΜν. ΉπΑΉ╣ρΉζα Έ│╕Έυ╕ΉΩΡΉΕε Ά╢ΝΆ│ιΈυ╕Ήζα Έ│ΑΆ▓╜ Ήζ┤ΉειΈξ╝ ΈςΖΊβΧΊΧαΆ▓Ν ΉιεΉΜεΊΧαΉπΑΈΛΦ ΉΧΛΉΧαΉε╝ΈΓα ΉοΚΆ░ΒΉιΒΉζ╕ ΉνΣΉηυ ΉΜεΉΙι ΉΜεΊΨΚΉΩΡ ΈΝΑΊΧε ΊαΕΉΜνΉιΒΉζ╕ ΉΩυΆ▒┤Ήζα Ά│ιΈινΉβΑ ΉΜυΊΧε Ή╢εΊαΙΉζ┤ΈΓα ΈΘΝΉκ╕ΉνΣ ΈΥ▒Ήε╝Έκε Ήζ╕ΊΧε Ά┤ΑΉΔΒΈΠβΈπξ Έ│ΣΈ│Α Ήβ╕ ΊΩΙΊαΙ ΉΔΒΊβσΉΩΡΉΕεΈΠΕ Ήζ┤ΈθυΊΧε ΉΜυΉιΕΈΠΕΆ░Α Ά┤ΑΉ░░ΈΡι ΉΙα ΉηΙΈΛΦ ΉιΡΉζΕ Ά░ΡΉΧΙΊΧαΉαΑΆ╕░ ΈΧΝΈυ╕Ήζ┤Έζ╝ ΉΔζΆ░ΒΈΡεΈΜν. ΉΜυΉιΕΈΠΕΈΓα ΉηΕΉΔΒ ΉΔΒΊβσΉΩΡΉΕε ΉΜυΊΧε ΊΩΙΊαΙΉζ┤ ΉζαΉΜυΈΡαΈΛΦ Ά▓╜Ήγ░ Ά╕ΚΉΕ▒ Ά┤ΑΉΔΒΈΠβΈπξΊΠΡΉΔΚ ΉΩυΈ╢ΑΈξ╝ ΊΠΚΆ░ΑΊΧαΆ╕░ ΉεΕΊΧ┤ 2023ΈΖΕ ΉπΑΉ╣ρΉΩΡΉΕεΈΛΦ ΉζΣΆ╕Κ ΉΜυΉ┤ΙΉζΝΊΝΝΈξ╝ ΉΜεΊΨΚΊΧαΉΩυ Έ▓╜Ήγ┤ΈΠβΉηξΉΧι ΉΩυΈ╢ΑΈξ╝ Ά┤ΑΉ░░ΊΧαΈΛΦ Ά▓ΔΉζΕ ΉιΕΈυ╕Ά░Α ΊΧσΉζα ΉΙαΉνΑΉε╝Έκε Ά╢ΝΆ│ιΊΧαΉαΑΈΜν[4]. Ά│ιΉεΕΊΩαΆ╡░ΉΩΡ ΈΝΑΊΧ┤ΉΕεΈΛΦ 24ΉΜεΆ░Ε Ήζ┤ΈΓ┤ CAGΈξ╝ Ά╢ΝΆ│ιΊΧαΉαΑΈΛΦΈΞ░, ΉΩυΆ╕░ΉΕε Ά│ιΉεΕΊΩαΆ╡░Ήζα ΉιΧΉζαΈΛΦ ΉΜυΆ╖╝Ά▓╜ΉΔΚΉοζΉε╝Έκε ΊβΧΉιΧ ΉπΕΈΜρΉζ┤ ΈΡε Ά▓╜Ήγ░, ΉΜυΉιΕΈΠΕΉΩΡΉΕε STΈ╢ΕΉιΙΉζα Ήζ╝ΉΜεΉιΒ ΉΔΒΉΛ╣Ήζ┤ Έ│┤Ήζ┤Ά▒░ΈΓα STΈ╢ΕΉιΙΆ│╝ TΊΝΝΉζα ΉΩφΈΠβΉιΒΉζ╕ Έ│ΑΊβΦΆ░Α Ά┤ΑΉ░░ΈΡαΈΛΦ Ά▓╜Ήγ░, Global Registry of Acute Coronary Events (GRACE) ΉιΡΉΙαΆ░Α 140ΉιΡ Ήζ┤ΉΔΒΉζ╕ Ά▓╜Ήγ░Έξ╝ ΈπΡΊΧεΈΜν. Ά╕░Ήκ┤ ΉπΑΉ╣ρΆ│╝ ΈΜνΈξ╕ ΉιΡΉζΑ class IΉΩΡΉΕε class IIaΈκε Ά╢ΝΆ│ι Ά░ΧΈΠΕΈξ╝ ΈΜνΉΗΝ ΊΧαΊΨξ Ήκ░ΉιΧΊΧε ΉιΡΉζ┤ΈΜν. Ά╖╕ Ήζ┤ΉειΈΛΦ Ά╢ΝΆ│ιΉζα Έ░ΦΊΔΧΉζ┤ ΈΡαΈΛΦ ΉΩ░Ά╡υΈΥν Ά░Ε CAG ΉΜεΉιΡΉΩΡ ΈΝΑΊΧε ΉιΧΉζαΈΥνΉζ┤ ΉΕεΈκε Ή░ρΉζ┤Ά░Α ΉηΙΆ│ι Ά│ιΉεΕΊΩαΆ╡░ΉΩΡ ΈΝΑΊΧε early invasive strategyΉζα ΉηΕΉΔΒΉιΒΉζ╕ ΊγρΆ│╝Ά░Α ΉΓυΈπζΉζ┤ΈΓα ΉΜυΆ╖╝Ά▓╜ΉΔΚΉοζΉζα ΉηυΈ░εΉζΕ ΉνΕΉζ┤ΈΛΦ ΊγρΆ│╝Έ│┤ΈΜνΈΛΦ Ήμ╝Έκε Ή╢ΦΆ░ΑΉιΒΉζ╕ ΉΜεΉΙιΉζΕ ΉνΕΉζ┤ΈΛΦ Ά▓ΔΉΩΡ ΉηΙΉΩΙΆ╕░ ΈΧΝΈυ╕Ήζ┤ΈΜν.
Ή┤ΙΆ│ιΉεΕΊΩαΆ╡░Ήζ┤ΈΓα Ά│ιΉεΕΊΩαΆ╡░Ήζ┤ ΉΧΕΈΜΝ Ήζ╝Έ░αΉεΕΊΩαΆ╡░ΉΩΡΉΕε Ά░ΑΉηξ ΊΒ░ Έ│ΑΊβΦΈΛΦ ΉΜυΉηξ computed tomography (CT)Ήζα ΉΩφΊΧιΉζ┤ Ή╢ΧΉΗΝΈΡε ΉιΡΉζ┤ΈΜν. 2020ΈΖΕ ΉπΑΉ╣ρΉΩΡΉΕεΈΛΦ ΉοζΉΔΒΉζ┤ Ία╕ΉιΕΈΡαΆ│ι ΉειΉζαΈψ╕ΊΧε ΉΜυΉιΕΈΠΕΉζα Έ│ΑΊβΦΆ░Α ΉΩΗΈΛΦ Έ╢ΙΉΧΙΉιΧΊαΧ ΊαΣΉΜυΉοζ(unstable angina) ΊβαΉηΡΉΩΡΉΕε ΉΜυΉηξCTΈΓα Έ╣ΕΆ┤ΑΊαΙΉιΒ ΊΩΙΊαΙ Ά▓ΑΉΓυ(non-invasive ischemic test)Έξ╝ ΉΜεΊΨΚΊΧε ΊδΕ ΊΧΕΉγΦΊΧε Ά▓╜Ήγ░ CAGΈξ╝ ΉΜεΊΨΚΊΧαΈΛΦ ΉΕιΊΔζΉιΒΉζ╕ Ή╣ρΉΛ╡ΉιΒ ΉιΕΈη╡(selective invasive strategy)ΉζΕ Ά░ΧΈιξΊΧαΆ▓Ν Ά╢ΝΆ│ιΊΧαΉαΑΈΜν. Έ░αΈσ┤ΉΩΡ Ήζ┤Έ▓Ι ΉπΑΉ╣ρΉΩΡΉΕεΈΛΦ Ά┤ΑΉΔΒΈΠβΈπξ ΉδΡΉζ╕ Ά░ΑΈΛξΉΕ▒Ήζ┤ ΈΗΤΉζΑ ΊβαΉηΡΈΛΦ CAGΈξ╝ ΉΜεΊΨΚΊΧαΆ│ι Ά╖╕ΈιΘΉπΑ ΉΧΛΉζΑ ΊβαΉηΡΉΩΡ ΊΧεΊΧαΉΩυ ΉΜυΉηξCTΈΓα non-invasive ischemic testΈξ╝ Ά╢ΝΆ│ιΊΧαΆ│ι ΉηΙΈΜν[4,6]. ΉΜυΉηξCTΈΛΦ CAGΉβΑ Έ╣ΕΆ╡ΡΊΧαΉΩυ ΈΝΑΈΠβΈπξΈ░ΧΈουΉοζ, ΊΠΡΈΠβΈπξΉΔΚΉιΕΉοζ, Ά╕░ΊζΚ ΈΥ▒ Ά┤ΑΉΔΒΈΠβΈπξ Ήβ╕ ΉδΡΉζ╕ΉζΕ Ά░ΡΈ│ΕΊΧαΈΛΦ ΈΞ░ Ά░ΧΉιΡΉζ┤ ΉηΙΉε╝ΈΓα ΉπΕΈΜρΈπΝ Ά░ΑΈΛξΊΧι Έ┐Ρ ΉοΚΆ░ΒΉιΒΉζ╕ Ή╣αΈμΝΈΓα revascularization ΉΩυΈ╢ΑΈξ╝ Ά▓░ΉιΧΊΧαΆ╕░ΉΩΡΈΛΦ ΈΜνΉΗΝ Έ╢ΑΉκ▒ΊΧε Ά▓ΑΉΓυΉζ┤Ά│ι Έ╣ΙΈπξΉζ┤ ΉηΙΆ▒░ΈΓα Ά┤ΑΉΔΒΈΠβΈπξ ΈΓ┤ ΉΕζΊγΝΊβΦΆ░Α ΉΜυΊΧαΆ▒░ΈΓα ΉΛνΊΖΡΊΛ╕ ΉΓ╜ΉηΖΉζ┤ ΈΡε ΊβαΉηΡΉΩΡΉΕεΈΛΦ Ά┤ΑΉΔΒΈΠβΈπξΉπΙΊβαΉΩΡ ΈΝΑΊΧε ΊΠΚΆ░ΑΆ░Α ΉΨ┤ΈινΉγ┤ ΉιΡΉζ┤ ΉηΙΆ╕░ ΈΧΝΈυ╕Ήζ╕ Ά▓ΔΉε╝Έκε ΉΓυΈμΝΈΡεΈΜν. ΉαΙΉιΕ ΉπΑΉ╣ρΉΩΡΉΕεΈΛΦ ACS ΉιεΉβ╕ ΉπΕΈΜρ ΈςσΉιΒΉε╝Έκε ΉΜυΉηξCTΈξ╝ Ήζ╝Έ░αΉεΕΊΩαΆ╡░ΉΩΡΉΕε ΊΠφΈΕΥΆ▓Ν Ά╢ΝΆ│ιΊΧαΉαΑΈΜνΈσ┤ Ήζ┤Έ▓Ι ΉπΑΉ╣ρΉΩΡΉΕεΈΛΦ ACSΆ░Α ΉζαΉΜυΈΡαΈΛΦ ΊβαΉηΡΉΩΡΉΕε Ήκ░Ά╕░ΉΩΡ Ήζ╝ΉΔΒΉιΒΉε╝Έκε(routine) ΉΜυΉηξCTΈξ╝ ΉΜεΊΨΚΊΧαΉπΑ ΉΧΛΈΠΕΈκζ Ά╢ΝΆ│ιΊΧαΉαΑΈΜν. Ήζ┤ Ά╢ΝΆ│ιΉζα Ά╖╝Ά▒░ΈΛΦ RAPID-CTCA ΉΩ░Ά╡υΈκε ACSΉζα ΉνΣΈΥ▒ΈΠΕ ΉεΕΊΩαΆ╡░(GRACE ΉιΡΉΙα ΊΠΚΆ╖ι 115ΉιΡ) 1,748ΈςΖΉζα ΊβαΉηΡΈξ╝ Έυ┤ΉηΣΉεΕ Έ░░ΉιΧΊΧαΉΩυ CTΈξ╝ Ήγ░ΉΕιΉε╝Έκε ΉΜεΊΨΚΊΧε Ά╡░(877ΈςΖ)Ά│╝ Ά╕░Ήκ┤ΈΝΑΈκε Ή╣αΈμΝΊΧε Ά╡░(871ΈςΖ)Ήε╝Έκε ΈΓαΈΙΕΉΨ┤ Έ╣ΕΆ╡ΡΊΧαΉαΑΈΜν. ΉΜυΉηξCTΈξ╝ Ήγ░ΉΕι ΉΜεΊΨΚΊΧαΈσ┤ CAGΉζα Έ╣ΙΈΠΕΈΛΦ ΉνΕΉζ╝ ΉΙα ΉηΙΉΩΙΉπΑΈπΝ revascularizationΉζΕ Έ╣ΕΈκψΊΧε Ή╣αΈμΝΉζα Έ╣ΙΈΠΕΈΓα ΊβαΉηΡΉζα ΉαΙΊδΕΉΩΡΈΛΦ ΉειΉζαΊΧε Ή░ρΉζ┤Ά░Α ΉΩΗΉΩΙΆ│ι ΉηΖΉδΡ Ά╕░Ά░ΕΈπΝ ΈΛαΈουΈΛΦ Ά▓░Ά│╝Έξ╝ Έ│┤ΉαΑΈΜν[9]. ΊΛ╣ΊηΙ ΊΧεΆ╡φΉΩΡΉΕεΈΛΦ CAGΆ░Α ΈΜνΈξ╕ ΈΓαΈζ╝ΉβΑ Έ╣ΕΆ╡ΡΊΧαΉΩυ ΉιΑΈι┤ΊΧαΆ│ι ΉΜεΊΨΚΉζα Έυ╕ΊΕ▒Ήζ┤ ΈΗΤΉπΑ ΉΧΛΆ╕░ ΈΧΝΈυ╕ΉΩΡ ΉζΣΆ╕ΚΉΜν Ή░ρΉδΡΉΩΡΉΕεΈΠΕ CAGΈξ╝ ΈΝΑΉ▓┤ΊΧαΈΛΦ ΉΙαΈΜρΉε╝ΈκεΉΞρ ΉΜυΉηξCTΉζα ΉειΉγσΉΕ▒ΉζΑ ΈΗΤΉπΑ ΉΧΛΉζΕ Ά▓ΔΉε╝Έκε ΉΔζΆ░ΒΈΡεΈΜν.
Έ│ΣΉδΡ Ήβ╕ ΉΜυΉιΧΉπΑ(out-of-hospital cardiac arrest, OHCA)Ήζα Ά░ΑΉηξ ΊζΦΊΧε ΉδΡΉζ╕ΉζΑ ACSΉζ┤ΈψΑΈκε Ήζ┤ΉΩΡ ΈΝΑΊΧε Ή▓αΉ╣αΉβΑ Ή╣αΈμΝ ΉΩφΉΜε ACS ΉπΕΈμΝΉπΑΉ╣ρΉΩΡΉΕε ΉνΣΉγΦΊΧε Έ╢ΑΈ╢ΕΉζ┤ΈΜν[10]. ΉαΙΉιΕ ΉπΑΉ╣ρΆ│╝ ΈπΙΉ░υΆ░ΑΉπΑΈκε ΊαΕΊΨΚ ΉπΑΉ╣ρΉΩΡΉΕεΈΠΕ OHCAΈκε ΉΜυΊΠΡΉΗΝΉΔζΉΙι Έ░Π ΉηΡΈ░ε ΉΙεΊβα ΊγΝΈ│╡(return of spontaneous circulation, ROSC)Ήζ┤ ΈΡε ΊβαΉηΡΉζα ΉΜυΉιΕΈΠΕΉΩΡΉΕε STΈ╢ΕΉιΙ ΉΔΒΉΛ╣Ήζ┤ ΉηΙΆ▒░ΈΓα ΊαΙΉΩφΊΧβΉιΒΉε╝Έκε Έ╢ΙΉΧΙΉιΧΊΧαΆ▒░ΈΓα Έ│ΣΉδΡ ΈΓ┤ΉΩΡΉΕε ΈΜνΉΜε ΉΜυΉιΧΉπΑΆ░Α Έ░εΉΔζΊΧε Ά▓╜Ήγ░ΉΩΡΈΛΦ ΉοΚΆ░ΒΉιΒΉζ╕ CAGΈξ╝ ΉΜεΊΨΚΊΧι Ά▓ΔΉζΕ Ά╢ΝΆ│ιΊΧαΆ│ι ΉηΙΈΜν. 2008ΈΖΕ ΉΩυΈθυ ΈΜρΉ▓┤Ήζα ΉιΕΈυ╕Ά░ΑΈΥνΉζ┤ Έ░εΊΣεΊΧε ΉιΕΈυ╕Ά░Α ΊΧσΉζαΈυ╕ΉΩΡΉΕεΈΛΦ ΉΜυΉιΧΉπΑ ΊβαΉηΡΉΩΡΉΕεΈΛΦ ΉΜυΉιΕΈΠΕΉΩΡΉΕε STΈ╢ΕΉιΙΉζα ΉΔΒΉΛ╣ ΉΩυΈ╢ΑΈΓα ΉηΕΉΔΒ ΉΨΣΉΔΒΆ│╝ ΉΔΒΆ┤ΑΉΩΗΉζ┤ ΉοΚΆ░ΒΉιΒΉζ╕ CAGΈξ╝ Ά╢ΝΆ│ιΊΧαΉαΑΈΜν[11]. Ά╖╕ Ά╖╝Ά▒░ΈκεΈΛΦ ΉΜυΉιΕΈΠΕΉζα STΈ╢ΕΉιΙ ΉΔΒΉΛ╣ ΉΩυΈ╢ΑΆ░Α Ά┤ΑΉΔΒΈΠβΈπξΊΠΡΉΔΚΉζα ΉειΉζαΈψ╕ΊΧε ΉαΙΉ╕κ Ήζ╕ΉηΡΆ░Α ΉΧΕΈΜΙΈζ╝ΈΛΦ ΉΩ░Ά╡υΉΩΡ Ά╕░Έ░αΊΧαΉαΑΈΜν[12]. ΊΧαΉπΑΈπΝ Ήζ┤ΈΛΦ ΉιΧΊβσ Ά╖╝Ά▒░Έξ╝ Ά╕░Έ░αΉε╝Έκε ΊΧε ΉιΕΈυ╕Ά░ΑΈΥνΉζα ΊΗ╡ΈΖΡΉΩΡ Ά░ΑΆ╣ζΆ╕░ ΈΧΝΈυ╕ΉΩΡ Ήηα Ήκ░ΉπΒΈΡε Έυ┤ΉηΣΉεΕ ΉΩ░Ά╡υΈξ╝ ΊΗ╡ΊΧ┤ Ή╣αΈμΝΉβΑ ΉαΙΊδΕΉζα Ήζ╕Ά│╝Ά┤ΑΆ│ΕΈξ╝ ΈςΖΊβΧΊΧαΆ▓Ν Ά╖εΈςΖΊΧαΈΛΦ Ά▓ΔΉζ┤ ΊΧΕΉγΦΊΧαΉαΑΈΜν[13]. COACT ΉΩ░Ά╡υΉΩΡΉΕεΈΛΦ 552ΈςΖΉζα STΈ╢ΕΉιΙ ΉΔΒΉΛ╣ΉζΕ ΈΠβΈ░αΊΧαΉπΑ ΉΧΛΉζΑ ΉΜυΉιΧΉπΑ ΊβαΉηΡΉΩΡΉΕε ΉοΚΆ░ΒΉιΒΉζ╕ CAGΈξ╝ ΉΜεΊΨΚΊΧε Ά╡░(immediate angiography group)Ά│╝ ΉΜιΆ▓╜ΊΧβΉιΒ ΊγΝΈ│╡Ήζ┤ ΈΡε ΊδΕ CAGΈξ╝ ΉΜεΊΨΚΊΧε Ά╡░(delayed angiography group)ΉζΕ Έ╣ΕΆ╡ΡΊΧαΉαΑΈΜν. ΉΛνΊΒυΈουΈΜζ ΉΜεΉΩΡ ΉΧ╜Έυ╝ Ή╣αΈμΝΉΩΡΈΠΕ 30Έ╢Ε Ήζ┤ΉΔΒ ΉΙαΉ╢ΧΆ╕░ ΊαΙΉΧΧΉζ┤ 90 mmHg Έψ╕ΈπΝΉε╝Έκε ΊαΙΉΩφΊΧβΉιΒΉε╝Έκε Έ╢ΙΉΧΙΉιΧΊΧε ΊβαΉηΡΈΓα ΉΜυΉιΧΉπΑΆ░Α ΉΜυΉηξ ΉδΡΉζ╕Ήζ┤ ΉΧΕΈΜΝ Ά▓ΔΉε╝Έκε ΊΝΡΈςΖΈΡε ΊβαΉηΡΈΛΦ ΉιεΉβ╕ΊΧαΉαΑΈΜν. Delayed CAGΈξ╝ ΉΜεΊΨΚΊΧε Ά╡░ΉζΑ 121ΉΜεΆ░Ε ΉιΧΈΠΕΆ░Α ΉνΣΉΧβΆ░ΤΉζ┤ΉΩΙΆ│ι immediate CAGΈξ╝ ΉΜεΊΨΚΊΧε Ά╡░ΉζΑ ΉνΣΉΧβΆ░ΤΉζ┤ 2ΉΜεΆ░Ε ΉιΧΈΠΕΉαΑΈΜν. Delayed CAGΈξ╝ ΉΜεΊΨΚΊΧε ΊβαΉηΡΉζα 22% ΉιΧΈΠΕΉΩΡΉΕεΈΛΦ ΉΔΒΊΔεΆ░Α ΈΓαΈ╣ιΉι╕ΉΕε Ά╕┤Ά╕ΚΊΧαΆ▓Ν PCIΈξ╝ ΉΜεΊΨΚΊΧαΉαΑΈΜν. 90Ήζ╝ ΈΠβΉΧΙ ΉΓυΈπζΈξιΆ│╝ ΉΜιΆ▓╜ΊΧβΉιΒ ΉΔΒΊΔε Ή╕κΈσ┤ΉΩΡΉΕε ΈΣΡ Ά╡░ Ά░Ε ΉειΉζαΊΧε Ή░ρΉζ┤ΈΛΦ ΉΩΗΉΩΙΈΜν[14]. ΈαΡΊΧε 2ΈΖΕ ΊδΕ Έ░εΊΣεΈΡε TOMAHAWK ΉΩ░Ά╡υΉΩΡΉΕεΈΛΦ delayed CAGΆ╡░Ήζα ΉιΧΉζαΈξ╝ COACT ΉΩ░Ά╡υΉβΑ ΈΜνΉΗΝ ΈΜνΈξ┤Ά▓Ν ΉΕνΉιΧΊΧαΉαΑΈΜν. 24ΉΜεΆ░Ε Ήζ┤ΊδΕΈκε CAGΈξ╝ ΉΜεΊΨΚΊΧαΈΠΕΈκζ ΊΧαΈΡα Ά╕ΚΉΕ▒ ΉΜυΆ╖╝ΊΩΙΊαΙ ΉΜεΉΓυ ΉΗΝΆ▓υΉζ┤ ΉηΙΈΜνΈσ┤ 24ΉΜεΆ░Ε Ήζ┤ΈΓ┤Έκε ΊΧαΈΠΕΈκζ ΊΧαΉαΑΈΜν. Ά╖╕ Ά▓░Ά│╝ delayed CAGΈξ╝ ΉΜεΊΨΚΊΧε Ά╡░ΉζΑ 46.9ΉΜεΆ░Ε ΉιΧΈΠΕΆ░Α ΉνΣΉΧβΆ░ΤΉε╝Έκε COACT ΉΩ░Ά╡υΈ│┤ΈΜν ΉππΉΧαΈΜν. TOMAHAWK ΉΩ░Ά╡υΉΩΡΉΕεΈΠΕ 30Ήζ╝ ΈΠβΉΧΙ ΉΓυΈπζΈξι Ή╕κΈσ┤ΉΩΡΉΕε ΈΣΡ Ά╡░ Ά░Ε ΉειΉζαΊΧε Ή░ρΉζ┤Ά░Α ΉΩΗΉΩΙΆ│ι ΉανΊηΙΈιν immediate CAGΆ╡░ΉΩΡΉΕε ΉΓυΈπζ Ία╣ΉζΑ ΉΜυΊΧε ΉΜιΆ▓╜ΊΧβΉιΒ Ά▓░ΉΗΡΉζα Έ░εΉΔζ Έ╣ΕΉερΉζ┤ ΉειΉζαΊΧαΆ▓Ν ΈΗΤΉΧαΈΜν[15]. 2020ΈΖΕ ΉπΑΉ╣ρΉΩΡΉΕεΈΛΦ OHCA ΊδΕ STΈ╢ΕΉιΙ ΉΔΒΉΛ╣Ήζ┤ ΉΩΗΆ│ι ΊαΙΉΩφΊΧβΉιΒΉε╝Έκε ΉΧΙΉιΧΈΡε ΊβαΉηΡΉΩΡΉΕε COACT ΉΩ░Ά╡υΈξ╝ Ά╖╝Ά▒░Έκε immediateΈ│┤ΈΜν delayed CAGΈξ╝ Ά╢ΝΆ│ιΊΧαΉαΑΆ│ι 2023ΈΖΕ ΉπΑΉ╣ρΉΩΡΉΕεΈΛΦ TOMAHAWK ΉΩ░Ά╡υΆ╣ΝΉπΑ ΊΠυΊΧρΊΧαΉΩυ Ήζ┤Έθ░ ΊβαΉηΡΉΩΡΉΕε Ήζ╝ΉΔΒΉιΒΉε╝Έκε(routine) immediate CAGΈξ╝ ΉΜεΊΨΚΊΧαΈΛΦ Ά▓ΔΉζ┤ ΈΥζΈ│┤ΈΜν ΉΜνΉζ┤ ΈπΟΈΜνΆ│ι ΊΝΡΈΜρΊΧαΉΩυ ΉΜεΊΨΚΊΧαΉπΑ ΉΧΛΈΠΕΈκζ Ά░ΧΈιξΊΧαΆ▓Ν Ά╢ΝΆ│ιΊΧαΉαΑΈΜν(class III, level of evidence A). ROSC ΊδΕ ΉζαΉΜζ ΊγΝΈ│╡Ήζ┤ ΈΡαΉπΑ ΉΧΛΉζΑ ΊβαΉηΡΉΩΡ ΈΝΑΊΧ┤ Ήζ┤ΉιΕ ΉπΑΉ╣ρΉΩΡΉΕεΈΛΦ Ή▓┤ΉαρΉζΕ 32έΕΔΉΩΡΉΕε 36έΕΔ ΉιΧΈΠΕΈκε ΉειΉπΑΊΧαΈΛΦ ΉιΑΉ▓┤Ήαρ Ή╣αΈμΝ(therapeutic hypothermia)Έξ╝ Ά╢ΝΆ│ιΊΧαΉαΑΉε╝ΈΓα TTM2 ΉΩ░Ά╡υΈξ╝ Έ╣ΕΈκψΊΧε Έυ┤ΉηΣΉεΕ ΉΩ░Ά╡υΈΥνΉΩΡΉΕε ΉιΧΉΔΒ Ή▓┤Ήαρ ΉειΉπΑ Ή╣αΈμΝ(normothermia)ΉβΑ ΉειΉζαΊΧε Ή░ρΉζ┤Έξ╝ ΉηΖΉοζΊΧαΉπΑ Ές╗ΊΧαΉΩυ Ήζ┤Έ▓Ι ΉπΑΉ╣ρΉΩΡΉΕεΈΛΦ normothermiaΈξ╝ Ά╢ΝΆ│ιΊΧαΉαΑΈΜν[16,17].
ΉΧΦΉζΑ ΊαΙΉιΕ ΉΔζΉΕ▒Ά│╝ Ή╢εΊαΙ ΉΓυΆ▒┤ Έ░εΉΔζΉΩΡ ΈςρΈΣΡ ΉαΒΊΨξΉζΕ Έψ╕Ή╣αΈΛΦ Ά▓ΔΉε╝Έκε ΉΧΝΈινΉι╕ ΉηΙΈΜν[18,19]. PCI ΉΜεΊΨΚ ΊδΕ ΉΧΦ ΊβαΉηΡΉΩΡΉΕε ΉΜυΆ╖╝Ά▓╜ΉΔΚΉοζ Έ░Π ΉΛνΊΖΡΊΛ╕ΊαΙΉιΕΉοζΆ│╝ Ά░βΉζΑ ΊΩΙΊαΙ ΉΓυΆ▒┤Ά│╝ Ή╢εΊαΙ ΉΓυΆ▒┤ ΈςρΈΣΡ ΉΧΦ ΊβαΉηΡΆ░Α ΉΧΕΈΜΝ ΊβαΉηΡΉβΑ Έ╣ΕΆ╡ΡΊΧ┤ΉΕε ΉειΉζαΊΧαΆ▓Ν ΉΔΒΉΛ╣ΊΧεΈΜνΈΛΦ Έ│┤Ά│ιΈΠΕ ΉηΙΈΜν[20]. ΉΧΦ ΊβαΉηΡΈΛΦ ΉηΕΉΔΒΉιΒΉε╝Έκε ΉνΣΉγΦΊΧε ΊβαΉηΡΆ╡░ΉηΕΉΩΡΈΠΕ Έ╢ΙΆ╡υΊΧαΆ│ι ΉΧΦ ΉηΡΉ▓┤Ά░Α ACSΉΩΡ ΈΝΑΊΧε Έυ┤ΉηΣΉεΕ ΉΩ░Ά╡υΉΩΡΉΕε ΉιεΉβ╕ Ά╕░ΉνΑΉζ┤ ΈΡαΉΨ┤ ΉΧΦΉζΕ ΈΠβΈ░αΊΧε ACS ΊβαΉηΡΉΩΡ ΈΝΑΊΧε Ά╖╝Ά▒░Ά░Α Έ╢ΑΉκ▒ΊΧαΈΜν. ΈΦ░Έζ╝ΉΕε ΉπΕΈμΝΉπΑΉ╣ρΉΩΡΉΕε Ά╢ΝΆ│ιΈυ╕ΉζΕ ΈΓ┤ΈουΆ╕░ ΉΨ┤ΈινΉγ┤ ΉΜνΉιΧΉζ┤ΈΜν. Ήζ┤Έ▓Ι ΉπΑΉ╣ρΉΩΡΉΕεΈΛΦ Ά╖╝Ά▒░ΈΛΦ Έ╢ΑΉκ▒ΊΧαΉπΑΈπΝ ΉιΕΈυ╕Ά░Α ΉζαΆ▓υ ΉΙαΉνΑΉζα Ά╢ΝΆ│ιΈξ╝ ΊΗ╡ΊΧ┤ ΉηΕΉΔΒΉζαΉΩΡΆ▓Ν ΈΠΕΉδΑΉζΕ Ήμ╝Ά│ιΉηΡ ΊΧαΉαΑΆ│ι ACS Ά│ιΉεΕΊΩαΆ╡░ΉΩΡ ΈΝΑΊΧε Ήκ░Ά╕░ CAGΈΛΦ 6Ά░εΉδΦ Ήζ┤ΉΔΒΉζα ΉΩυΈςΖΉζ┤ ΉαΙΉΔΒΈΡαΈΛΦ ΉΧΦ ΊβαΉηΡΉΩΡΆ▓Ν Ά╢ΝΉειΊΧαΉαΑΈΜν. 6Ά░εΉδΦ Έψ╕ΈπΝΉζα ΉΩυΈςΖΉζ┤ ΉαΙΉΔΒΈΡαΆ▒░ΈΓα Ή╢εΊαΙ ΉεΕΊΩαΉζ┤ ΈπνΉγ░ ΈΗΤΉζΑ ΉΧΦ ΊβαΉηΡΉΩΡΉΕεΈΛΦ ACS Έ░εΉΔζ ΉΜε Έ│┤ΈΜν Έ│┤Ήκ┤ΉιΒΉζ╕ Έ░σΊΨξΉε╝Έκε Ή╣αΈμΝΈξ╝ Ά╢ΝΆ│ιΊΧαΉαΑΈΜν. ΈαΡΊΧε ΉΧΦ Ή╣αΈμΝΆ░Α ACSΉζα ΉειΈ░ε ΉγΦΉζ╕Ήζ┤Έζ╝Έσ┤ ΉΧΦ Ή╣αΈμΝΉζα Ήζ╝ΉΜεΉιΒΉζ╕ ΉνΣΈΜρΈΠΕ Ά╢ΝΉειΊΧαΉαΑΈΜν. ΉΧΦ ΊβαΉηΡΉΩΡΉΕε ΉΧΕΉΛνΊΦ╝Έο░ΉζΑ ΊαΙΉΗΝΊΝΡ 10,000/┬╡L Έψ╕ΈπΝΉζ┤Έσ┤, clopidogrelΉζΑ ΊαΙΉΗΝΊΝΡ 30,000/┬╡L Έψ╕ΈπΝΉζ┤Έσ┤ ΉΓυΉγσΊΧαΉπΑ ΉΧΛΉζΕ Ά▓ΔΉζΕ Ά╢ΝΆ│ιΊΧαΉαΑΆ│ι ACS Έ░εΉΔζ ΉΜε ΊαΙΉΗΝΊΝΡΉζ┤ 50,000/┬╡L Έψ╕ΈπΝΉζ┤Έσ┤ ΊΜ░Ή╣┤Ά╖╕ΈηιΈθυΈΓα ΊΦΕΈζ╝ΉΙαΆ╖╕ΈιΡΆ│╝ Ά░βΉζΑ Ά░ΧΈιξΊΧε P2Y12ΉΙαΉγσΉ▓┤ΉΨ╡ΉιεΉιεΈΛΦ ΉΓυΉγσΊΧαΉπΑ ΉΧΛΈΠΕΈκζ Ά╢ΝΆ│ιΊΧαΉαΑΈΜν.
2023ΈΖΕ ACSΉΩΡ ΈΝΑΊΧε ΉειΈθ╜ ΉπΑΉ╣ρΉζΑ ΉηΕΉΔΒΉζαΈΥνΉζ┤ ΉΜνΉιε ΊβαΉηΡ ΉπΕΈμΝΉΩΡ ΉηΙΉΨ┤ΉΕε ΈΞΦ ΉΜνΉγσΉιΒΉε╝Έκε Ήζ┤ΉγσΊΧι ΉΙα ΉηΙΈΠΕΈκζ ΊΧαΈΛΦ Ά▓ΔΉΩΡ Ήμ╝ΉΧΙΉιΡΉζΕ ΈΣΡΉΩΙΈΜν. ACSΈξ╝ working diagnosisΈκε ΊΧαΆ│ι ΉΜυΉιΕΈΠΕ, ΉηΕΉΔΒ ΉΨΣΉΔΒ, ΊαΙΉΩφΊΧβΉιΒ ΉΧΙΉιΧΉΕ▒Ήζα ΉΕ╕ Ά░ΑΉπΑΉΩΡ Ήμ╝ΉΧΙΉιΡΉζΕ ΈπηΉ╢ΦΉΨ┤ ΉπΕΈΜρΆ│╝ Ή╣αΈμΝΉζα ΈΜρΆ│ΕΈξ╝ ΉπΕΊΨΚΊΧι ΉΙα ΉηΙΈΠΕΈκζ Ήζ╝ΈςσΉγΦΉΩ░ΊΧαΆ▓Ν ΉιΧΈουΊΧαΉαΑΈΜν. ΈαΡΊΧε ΊβαΉηΡΉζα ΉεΕΊΩα ΉιΧΈΠΕΉβΑ ΉΔΒΊβσΉΩΡ ΈΦ░Έζ╝ CAGΉβΑ Ά░βΉζΑ Ά┤ΑΊαΙΉιΒΉζ╕ Ά▓ΑΉΓυΉζα ΉΜεΉιΡΆ│╝ ΉΧΙΉιΧΉιΒΉζ╕ ΊβαΉηΡΉΩΡΉΕε Έ╣ΕΆ┤ΑΊαΙΉιΒΉζ╕ Ά▓ΑΉΓυΈΥνΉζΕ ΉΨ┤ΈΨ╗Ά▓Ν ΉιΒΉγσΊΧιΉπΑΉΩΡ ΈΝΑΊΧε ΊΝΡΈΜρ Ά╕░ΉνΑΈΠΕ Ήηα ΉιεΉΜεΊΧαΆ│ι ΉηΙΈΜν. ΉΧΦ ΊβαΉηΡΉ▓αΈθ╝ Ά╖╝Ά▒░ Έ╢ΑΉκ▒Ήε╝Έκε Ά╕░Ήκ┤ ΉπΑΉ╣ρΉΩΡΉΕε ΊΒυΆ▓Ν ΈΜνΈμρΉπΑ Ές╗ΊΨΙΈΞα ΊβαΉηΡΆ╡░ΉΩΡ ΈΝΑΊΧ┤ΉΕεΈΠΕ Ή╡εΈΝΑΊΧεΉζα Ά╢ΝΆ│ιΉΧΙΉζΕ ΉιεΉΜεΊΧαΉΩυ ΉηΕΉΔΒΉζαΈΥνΉζ┤ ΉΨ┤ΈΛΡ ΉιΧΈΠΕΉζα Ά╕░ΉνΑΉζΕ ΈπΙΈιρΊΧι ΉΙα ΉηΙΆ▓Ν ΊΧε ΉιΡ ΉΩφΉΜε ΉνΣΉγΦΊΧε Ή▓τΆ▒╕ΉζΝΉζ┤Έζ╝Ά│ι ΉΔζΆ░ΒΊΧεΈΜν.
REFERENCES
1. Lee SW, Kim HC, Lee HS, Suh I. Thirty-year trends in mortality from cardiovascular diseases in Korea. Korean Circ J 2015;45:202έΑΥ209.



2. Kim RB, Kim JR, Hwang JY. Epidemiology of myocardial infarction in Korea: hospitalization incidence, prevalence, and mortality. Epidemiol Health 2022;44:e2022057.



3. Kim HK, Ahn Y, Chang K, et al. 2020 Korean Society of Myocardial Infarction expert consensus document on pharmacotherapy for acute myocardial infarction. Korean Circ J 2020;50:845έΑΥ866.



4. Byrne RA, Rossello X, Coughlan JJ, et al. 2023 ESC guidelines for the management of acute coronary syndromes. Eur Heart J 2023;44:3720έΑΥ3826.

5. O'Gara PT, Kushner FG, Ascheim DD, et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association task force on practice guidelines. J Am Coll Cardiol 2013;61:e78έΑΥe140.

6. Collet JP, Thiele H, Barbato E, et al. 2020 ESC guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J 2021;42:1289έΑΥ1367.

7. Bae JW. The 2017 update of the clinical guidelines for STsegment elevation myocardial infarction of the European Society of Cardiology. Korean J Med 2018;93:25έΑΥ32.

8. Chang K, Ahn Y, Lim S, et al. 2021 Korean Society of Myocardial Infarction expert consensus document on revascularization for acute myocardial infarction. Korean Circ J 2021;51:289έΑΥ307.



9. Gray AJ, Roobottom C, Smith JE, et al. Early computed tomography coronary angiography in patients with suspected acute coronary syndrome: randomised controlled trial. BMJ 2021;374:n2106.



10. Patterson T, Perkins GD, Hassan Y, et al. Temporal trends in identification, management, and clinical outcomes after outof-hospital cardiac arrest: insights from the myocardial ischaemia national audit project database. Circ Cardiovasc Interv 2018;11:e005346.

11. Neumar RW, Nolan JP, Adrie C, et al. Post-cardiac arrest syndrome: epidemiology, pathophysiology, treatment, and prognostication. A consensus statement from the International Liaison Committee on Resuscitation (American Heart Association, Australian and New Zealand Council on Resuscitation, European Resuscitation Council, Heart and Stroke Foundation of Canada, InterAmerican Heart Foundation, Resuscitation Council of Asia, and the Resuscitation Council of Southern Africa); the American Heart Association Emergency Cardiovascular Care Committee; the Council on Cardiovascular Surgery and Anesthesia; the Council on Cardiopulmonary, Perioperative, and Critical Care; the Council on Clinical Cardiology; and the Stroke Council. Circulation 2008;118:2452έΑΥ2483.

12. Spaulding CM, Joly LM, Rosenberg A, et al. Immediate coronary angiography in survivors of out-of-hospital cardiac arrest. N Engl J Med 1997;336:1629έΑΥ1633.


13. Fanaroff AC, Califf RM, Harrington RA, et al. Randomized trials versus common sense and clinical observation: JACC review topic of the week. J Am Coll Cardiol 2020;76:580έΑΥ589.


14. Lemkes JS, Janssens GN, van der Hoeven NW, et al. Coronary angiography after cardiac arrest without ST-segment elevation. N Engl J Med 2019;380:1397έΑΥ1407.

15. Desch S, Freund A, Akin I, et al. Angiography after out-of-hospital cardiac arrest without ST-segment elevation. N Engl J Med 2021;385:2544έΑΥ2553.

16. Dankiewicz J, Cronberg T, Lilja G, et al. Hypothermia versus normothermia after out-of-hospital cardiac arrest. N Engl J Med 2021;384:2283έΑΥ2294.

17. Wolfrum S, Roedl K, Hanebutte A, et al. Temperature control after in-hospital cardiac arrest: a randomized clinical trial. Circulation 2022;146:1357έΑΥ1366.


18. Gomes M, Khorana AA. Risk assessment for thrombosis in cancer. Semin Thromb Hemost 2014;40:319έΑΥ324.


Selection of invasive strategy in patients with ACS. ACS, acute coronary syndrome; ECG, electrocardiogram; STEMI, ST-elevation myocardial infarction; PCI, percutaneous coronary intervention; CAG, coronary angiogram; NSTE-ACS, non-ST elevation acute coronary syndrome; NSTEMI, non-ST elevation myocardial infarction; hs-cTn, high-sensitivity cardiac troponin; GRACE, Global Registry of Acute Coronary Events; UAP, unstable angina pectoris; CTA, computed tomography angiogram.
Figure┬ι1.
Table┬ι1.
Changes from the 2020 ESC guideline



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




