 |
 |
| Korean J Med > Volume 99(2); 2024 > Article |
|
Abstract
Chronic Kidney Disease (CKD) is a major global health burden. Sodium-glucose cotransporter-2 (SGLT2) inhibitors have demonstrated potential in slowing CKD progression. We evaluated the expanding role of SGLT2 inhibitors, emphasizing their renoprotective benefits in diabetic and non-diabetic CKD patients. We also investigated the underlying mechanisms, including the reduction of glomerular hypertension via modulation of tubuloglomerular feedback. Our study critically analyzed current indications for SGLT2 inhibitor therapy based on recent clinical trial data. To optimize patient outcomes, we present a comprehensive analysis of practical considerations for the prescription of SGLT2 inhibitors, including the potential initial decline in the estimated glomerular filtration rate and a review of adverse events.
Sodium-glucose cotransporter-2 (SGLT2) 억제제는 근래 심혈관계 및 신장 질환에서 중요한 치료제로 가장 주목받는 약물 중 하나이다. 처음에는 혈당 강하 효과를 위해 개발되었으나, 여러 연구에서 심혈관 사망률 및 콩팥병 진행을 개선시키는 효과가 밝혀졌으며 단백뇨 감소와 체중 감소 효과 또한 입증되었다. 이에 SGLT2 억제제는 metformin과 더불어 당뇨 환자의 초치료제로 추천될 만큼 그 역할이 커졌다. 최근에는 당뇨병과 무관하게 발생한 심부전 혹은 만성 콩팥병에서도 중요한 치료제로 자리 잡고 있다.
본 논문에서는 SGLT2 억제제의 전반적인 약리 기전과 주요 임상시험 결과를 요약하고, 신장 보호 효과를 갖는 약제로서 최근의 적응증과 약물 안전성에 대해 설명하고자 한다.
우리 몸의 포도당 대사 과정 중 콩팥의 근위세관에 있는 SGLT2는 사구체에서 여과된 포도당을 재흡수 조절을 하면서 포도당 항상성 유지에 기여한다[1]. 혈중 포도당 농도가 정상일 때 사구체에서 여과된 포도당은 근위곱슬세관(proximal convoluted tubule)에 위치한 SGLT2에 의해 90% 이상 재흡수되고 나머지는 근위곧은세관(proximal straight tubule)에 위치한 SGLT1을 통해 재흡수된다[2]. 따라서 정상적으로는 사구체에서 여과된 포도당은 모두 재흡수되어 요 중 포도당 배설이 없다.
그러나 당뇨병에서는 혈당이 증가함에 따라 사구체에서 여과되는 포도당 또한 증가하므로 포도당 재흡수를 위해 SGLT2 활성이 증가한다. 비정상적으로 SGLT2가 항진되면 NaCl 재흡수 또한 증가하므로 원위세관의 치밀반(macula densa)에 도달하는 NaCl이 감소하게 된다. 그러면 세뇨관사구체되먹임(tubuloglomerular feedback)에 의해 사구체들세동맥(afferent arteriole)이 확장되고 사구체여과율이 증가하여 사구체과여과(glomerular hyperfiltration)와 사구체고혈압이 초래된다[3]. 당뇨병성 신증에서는 이러한 사구체과여과로 인하여 알부민뇨가 증가하고 결국 신장 손상을 유발한다[4].
SGLT2 억제제의 주된 기전은 비정상적인 SGLT2 활성을 차단하여 포도당을 배설시키고 나트륨 또한 배설시킴으로써 혈당 강하 효과뿐만 아니라 세뇨관사구체 되먹임을 억제하여 사구체과여과와 사구체고혈압을 완화시킨다[5]. 그리고 사구체 내 압력의 감소로 인하여 알부민뇨를 감소시킴으로써 신장 보호 효과 역시 유발한다.
초기에는 주로 2형 당뇨병 환자를 대상으로 SGLT2 억제 제의 심혈관계 안정성을 조사하고자 임상시험이 시행되었다. Empagliflozin, canagliflozin 및 dapagliflozin에 대한 연구에서 저명하게 심혈관계 예후를 개선시키는 연구 결과가 보고되었고, 2차 결과 분석 혹은 사후 분석을 통해 신장 결과(renal outcome)의 효과 또한 입증하였다(Table 1).
EMPA-REG OUTCOME 연구는 추정사구체여과율(estimated glomerular filtration rate)이 30 mL/min/1.73 m2 이상인 7,020명의 2형 당뇨병 환자를 대상으로 시행하였다. 연구 결과 empagliflozin을 사용한 군에서 위약 대조군에 비해 혈청 크레아티닌 2배 증가를 44% 낮추었고 말기 콩팥병으로 진행하여 투석 혹은 신장 이식을 받는 위험을 55% 감소시켰다[11]. 알부민뇨의 경우 164주 후까지 추적 관찰하였을 때 정상 알부민뇨증에서는 7%, 미세 알부민뇨증에서는 25%, 거대 알부민뇨증에서는 32%의 알부민뇨 감소 효과가 입증되었다[12].
CANVAS program은 심혈관계 질환 위험이 높은 10,142명의 추정사구체여과율이 30 mL/min/1.73 m2 이상인 2형 당뇨병 환자를 대상으로 연구를 시행하였고 추정사구체여과율 40% 저하, 신대체 요법 시작 혹은 신장 질환에 의한 사망을 합하여 평가하였을 때 canagliflozin 투여군에서 그 위험도를 40% 감소시킨다는 결과를 보고하였다. 다만 이 연구에서는 canagliflozin 투여군에서 주로 발가락의 절단 빈도가 증가하였다[13]. DECLARETIMI 58 연구에서는 추정사구체여과율이 60 mL/min/1.73 m2 이상인 17,160명의 2형 당뇨병 환자를 대상으로 시행하였고 추정사구체여과율 40% 저하, 신대체 요법 시작 혹은 신장 질환에 의한 사망을 합하여 평가하였을 때 dapagliflozin 투여군에서 그 위험도를 47% 감소시켰다[14].
이러한 연구 결과들에 힘입어 CREDENCE와 DAPA-CKD 연구에서는 신장 기능 보호 효과를 1차 결과 지표로 조사하였다(Table 1). CREDENCE 연구는 알부민뇨(microalbumin-to-creatinine ratio [ACR] 300-5,000 mg/g)를 동반하고 추정사구체여과율이 30-90 mL/min/1.73 m2인 4,401명의 2형 당뇨병 환자를 대상으로 시행하였고, 혈청 크레아티닌 2배 증가, 말기 콩팥병 발생, 신장 혹은 심혈관계 원인에 의한 사망을 모두 합한 1차 결과는 canagliflozin 투여군에서 그 위험도를 30% 감소시켰다. CANVAS program과 달리 이 연구에서는 canagliflozin 투여군에서 당뇨병 발의 절단 위험은 증가하지 않았다[15]. DAPA-CKD 연구는 당뇨병 환자와 비당뇨병 환자를 모두 포함하여 연구를 진행하였다. 추정사구체여과율이 25-75 mL/min/1.73 m2이면서 알부민뇨(ACR 200-5,000 mg/g)를 동반한 4,304명의 환자를 대상으로 지속적인 추정사구체여과율 50% 이상 감소, 말기 콩팥병 발생, 신장 혹은 심혈관계 원인에 의한 사망을 모두 합하여 1차 결과를 확인하였다[16]. 그 결과 dapagliflozin 투여군에서 1차 결과의 위험도가 39% 감소하였다. 이러한 효과는 2형 당뇨병 환자에서는 위험도가 36% 감소하고 비당뇨병 환자에서는 50% 감소하여 당뇨병 유무와 상관없이 신장 기능 보호 효과가 있음이 확인되었다. 연구 참여자들의 평균 기저 추정사구체여과율은 43 mL/min/1.73 m2였으며, 기준선에서 30개월까지의 추정사구체여과율 감소 기울기는 dapagliflozin 투여군의 경우 연간 -2.86 mL/min/1.73 m2, 위약군의 경우 연간 -3.79 mL/min/1.73 m2으로 두 그룹 간 차이는 연간 0.93 mL/min/1.73 m2였다. 또한 사후 분석 결과에서 콩팥의 기저질환에 따라 구분하였을 때, 1차 결과 지표의 위험도가 당뇨병성 신증에서는 37%, 사구체신염에서는 57% 감소하였다[17]. CREDENCE와 DAPA-CKD 연구는 모두 당뇨병 상태와 관계없이 알부민뇨가 있는 만성 콩팥병 환자에서의 SGLT2 억제제의 인상적인 효과를 보여줌으로써 신장학 분야에서 SGLT2 억제제를 도입하게 되는 강력한 발판이 되었다.
가장 최근에 발표된 연구 결과로는 2023년 발표된 EMPAKIDNEY 연구가 있다[18]. 이 연구는 당뇨병 유무와 상관없이 추정사구체여과율이 20-45 mL/min/1.73 m2거나 추정사구체여과율이 45-90 mL/min/1.73 m2면서 알부민뇨(ACR ≥ 200 mg/g)를 동반하는 만성 콩팥병 환자 6,609명을 대상으로 시행하였다. 1차 결과 지표를 말기 콩팥병 발생, 추정사구체여과율이 지속적으로 10 mL/min/1.73 m2 미만으로 감소 혹은 기저치에 비해 40% 이상 감소, 신장 질환으로 인한 사망, 심혈관계 원인으로 인한 사망으로 정의하였으며, empagliflozin 사용군에서 위약 대조군에 비하여 위험도가 28% 감소하였다. 추정사구체여과율의 감소 기울기는 empagliflozin 사용군이 더 완만하였으며 위약군과의 차이는 연간 0.75 mL/min/1.73 m2였다.
위의 대규모 연구들을 토대로 만성 콩팥병 4기 환자들을 대상으로 약제의 효과와 안정성에 대한 연구가 추가로 진행되었다. DAPA-CKD 연구에 참여한 293명의 만성 콩팥병 4기 환자를 대상으로 dapagliflozin을 투여하였을 때 대조군에 비해 1차 결과의 위험도가 27% 감소하였으며, 위해 사건의 위험도는 증가하지 않았다[19].
사구체신염에서는 궁극적으로 면역 억제제 치료가 필요하지만 장기적인 손상에 의한 만성 콩팥병 진행의 경우 사구체과여과와 같은 공통적인 손상이 초래되므로 SGLT2 억제제 사용이 이득이 될 수 있다. DIAMOND 연구는 당뇨병이 없고 추정사구체여과율 25 mL/min/1.73 m2 이상이면서 알부민뇨(ACR 500-3,500 mg/g)를 동반한 만성 콩팥병 환자 53명을 대상으로 시행하였으며 이 중 immunoglobulin A (IgA) 신병증 환자는 25명, 초점분절사구체경화증 환자는 11명이 포함되었다[20]. Dapagliflozin 사용군에서 위약 대조군에 비해 체중 감소의 효과는 있었으나 단백뇨 감소의 효과는 통계적으로 유의하게 나타나지 않았다.
DAPA-CKD 연구에는 총 695명의 사구체신염 환자가 등록되었으며 이 중 270명의 IgA 신병증 환자를 대상으로 신장 보호 효과를 살펴보았다[21]. 평균 추정사구체여과율 43.8 mL/min/1.73 m2, 평균 알부민뇨 ACR 900 mg/g이었으며 dapagliflozin 사용군이 1차 결과 지표상 그 위험도를 71% 감소시켰고 알부민뇨 또한 26% 감소시켰다. 기준선에서 36개월까지의 추정사구체여과율 감소 기울기는 dapagliflozin 투여군의 경우 연간 -3.5 mL/min/1.73 m2, 위약군의 경우 연간 -4.7 mL/min/1.73 m2로 두 그룹 간 차이는 연간 1.2 mL/min/1.73 m2였다.
DIAMOND와 DAPA-CKD 연구의 사구체신염 환자들은 모두 최대 허용 용량의 레닌-안지오텐신-알도스테론 시스템 차단제(renin-angiotensin-aldosterone system inhibitor)를 투여 중인 환자들이었다. 만성 사구체신염 환자를 대상으로 한 DAPA-CKD의 긍정적인 결과를 바탕으로 SGLT2 억제제는 단백뇨를 동반한 사구체신염 환자에서 보존적 치료로 사용해 볼 수 있겠다.
EMPA-KIDNEY 연구는 일차 콩팥병인 사구체신염 및 당뇨병성 신증뿐만 아니라 이차 콩팥병인 고혈압 신경화증 혹은 허혈 신병증 또한 포함되어 있다. 이 중 사구체신염 환자는 총 1,669명이 등록되었으며 1차 결과 지표에 대해 empagliflozin 사용군에서 위약 대조군에 비하여 위험도가 23% 감소하였다[22].
SGLT2 억제제가 빈혈 개선의 효과가 있을 수 있다는 기대가 대두되고 있다. 여러 임상 연구에서는 SGLT2 억제제를 투여하면 심혈관계 또는 신장 질환 환자에서 헤모글로빈이 개선되는 효과를 보고하였다[23]. 콩팥에서 소모되는 에너지의 많은 부분이 기저막에 위치한 Na+/K+-ATPase가 작동하는 세관의 나트륨 이동에 할애되는데, SGLT2 억제제를 투여하면 나트륨 이동의 부하를 근위곧은세관과 굵은오름가지(thick ascending limb)로 이동시켜 바깥속질(outer medulla)의 저산 소증을 유발할 수 있다. 이것이 저산소증 유도 인자(hypoxiainducible factor 1)를 활성화시켜 적혈구 생성을 자극하는 것일 가능성이 있다.
최근의 연구에서는 SGLT2 억제제가 암에 미치는 영향에 대해서도 보고하고 있다. 암세포는 glycolysis 작용에 크게 의존하며 고혈당 상태에서는 암세포가 더 잘 생존하고 증식할 수 있다. SGLT2 억제제는 당뇨 배설(glycosuria)을 통해 혈당을 조절하는데, SGLT2가 폐암, 전립선암, 췌장암 등에 발현함이 밝혀지면서 항암 역할(anticancer effect)의 가능성이 대두되기 시작하였다[24]. SGLT2 억제제 사용 시 암세포 증식이 억제되고 암세포 괴사가 유도된다는 결과들이 여러 연구에서 보고되고 있어 향후 잠재적 가능성이 기대되는 바이다(Fig. 1) [25-27].
SGLT2 억제제의 약리 기전 특성상 당뇨 배설(glycosuria)을 유발하기 때문에 요로 감염의 위험도가 2-4배가량 증가한다[28]. 이러한 위험도는 위약 대조군뿐만 아니라 다른 항고혈당제를 사용한 군과 비교하여도 증가한다는 연구 결과들이 보고된 바 있다[29]. 한 후향적 분석 연구에 따르면 요로 감염은 SGLT2 억제제를 사용하기 시작한 첫 달에 가장 흔했으며, 여성, 고령 그리고 이전에 요로 감염력이 있는 환자에서 더 흔했다[30]. 요로 감염의 위험을 줄이기 위해 SGLT2 억제제를 사용하기 시작하는 환자에게 생식기를 청결하게 관리하도록 교육해야 하며 소변을 참지 말고 자주 보도록 설명해야 한다. 요로 감염 발생 시 나타나는 증상들에 대해 설명해 주고 증상 발생 시 바로 병원에 내원하여 검사를 받도록 교육하는 것이 중요하겠다.
SGLT2 억제제는 드물지만 정상 혈당 당뇨병성 케톤산증(euglycemic diabetic ketoacidosis)과 연관이 있으며 이에 대해 2015년 미국 식품의약청에서 경고한 바 있다. 미국 식품의약청에 보고된 위해 사건을 분석한 결과 2형 당뇨병 환자에서 SGLT2 억제제 사용군은 dipeptidyl peptidase 4 (DPP4) 억제제 사용군에 비해 7배가량 당뇨병성 케톤산증의 위험도가 높았으며, 그중 71%는 정상혈당 당뇨병성 케톤산증이었다[31]. SGLT2 억제제는 혈장 포도당 농도를 감소시켜 인슐린 수치를 낮춤으로써 혈장 글루카곤 수치가 증가하게 된다. 또한 SGLT2 억제제는 췌장의 α-세포를 억제함으로써 글루카곤의 방출을 유발한다. 이 외에 SGLT2 억제제로 인한 체중 감소는 체내에서 지질 산화를 증가시킨다. 이러한 요인들로 인해 간에서 케톤산증이 유도된다[32,33].
SGLT2 억제제 관련 케톤산증의 위험 요인은 20% 이상의 인슐린 용량 감소, 저체중, 여성, 수술, 외상, 알코올 남용 및 성인 잠복 자가면역당뇨병 환자 등이 있다[32]. 따라서 SGLT2 억제제를 사용하는 환자는 수술과 같은 상황에서는 2-3일 전부터 약물 복용을 중단하는 것을 권장하며, 환자에게 급성 병색, 구토, 설사가 나타나거나 음식을 복용하지 못하는 상황일 때에는 SGLT2 억제제 복용을 중단할 것을 교육하는 것이 중요하겠다.
CANVAS program에서는 canagliflozin 복용 시 당뇨병 발절단의 위험도가 올라가는 것으로 보고되었으나 CREDENCE 연구에서는 그 위험도가 증가하지 않았다. Canagliflozin과 다른 항고혈당제를 비교한 실제 메타 분석에서는 절단과의 연관성이 발견되지 않았고, 이에 2020년에는 절단에 대한 경고문이 삭제되었다[34].
SGLT2 억제제가 만성 콩팥병 진행을 지연시키는 것으로 생각되는 주요 메커니즘은 사구체과여과 및 세뇨관사구체 되먹임의 감소를 통한 것이다. SGLT2 억제제는 사구체고혈압의 감소를 통해 사구체여과율의 급성 일시적 저하를 초래함은 잘 알려져 있다. 약제 사용 초기에 혈청 크레아티닌 상승으로 인해 SGLT2 억제제를 중단해야 하는지에 대한 고민을 임상 상황에서 마주칠 수 있으나, SGLT2 억제제의 심혈관 및 신장 보호 효과를 고려하여 환자에게 약제를 유지하도록 노력하는 것이 중요하겠다. 실제 여러 연구를 통해 SGLT2 억제제는 오히려 장기적으로 급성 신장 손상의 발생률을 낮춤이 보고된 바 있다[35].
SGLT2 억제제 시작 직후 혈청 크레아티닌 변화를 언제 모니터링해야 하는지 정립된 바는 없으나 고령이거나 이전에 급성 신장 손상 병력이 있거나 체액 고갈이 우려되는 등의 고위험 환자는 약제 시작 1개월 후에 신장 기능을 확인하는 것이 안전하겠다. 만약 혈청 크레아티닌 수치가 30% 이상 증가한 경우 환자의 체액 상태 등을 재평가하고 일시 중단해야 하는지 결정을 내려야 하며, 적절한 경우에 재투여를 고려해야 한다[36].
항고혈당 약제로서의 SGLT2 억제제 사용은 2023년 이전에는 metformin과 2제 요법만 급여가 인정되었고 dapagliflozin만 sulfonylurea와 2제 요법이 인정되었다. 2023년 4월 1일부터 병용 급여 기준이 확대되어 단독 요법으로 2-4개월 이상 투약해도 효과가 부족하거나 당화혈색소 ≥ 7.5%의 경우 2제 요법이 인정되며, metformin을 투여할 수 없는 경우 모든 SGLT2 억제제에서 sulfonylurea와 병용 요법이 인정된다. 3제 요법은 2제 요법을 2-4개월 이상 투여해도 당화혈색소가 7% 이상인 경우 metformin + SGLT2 억제제 + DPP4 억제제 혹은 metformin + SGLT2 억제제 + thiazolidinedione의 조합으로 인정된다.
그러나 항고혈당 약제로서의 사용이 아닌 심부전 혹은 신장질환에서의 사용은 아직 제한적이다. 우리나라에서는 dapagliflozin과 empagliflozin이 2024년 2월 1일부터 좌심실 박출률이 40% 이하인 만성 심부전 환자에서 요양 급여가 인정되었다. 그러나 2024년 2월 기준 좌심실 박출률이 보존된 심부전 및 만성 콩팥병 치료에 대해서는 적응증은 허가는 받았으나 보험 급여는 인정되지 않아 비급여로만 처방이 가능하다. 2023년 12월에 한국 아스트라제네카의 포시가(성분명 dapagliflozin)가 국내 시장에서 철수하기로 결정되어 2024년 상반기부터는 사용이 어려울 것으로 전망되며, 아직 포시가의 제네릭 의약품에 대해서는 심부전 및 만성 콩팥병 치료에 대해 사용 허가가 인정되지 않은 상황이다. 향후 보험 기준의 변화에 주목할 필요가 있겠다.
SGLT2 억제제는 당뇨병 유무에 관계없이 알부민뇨 환자의 만성 콩팥병 진행을 예방하는 핵심 치료법으로 등장했다. 여러 대규모 연구에서 뛰어난 신장 및 심혈관계 보호 효과가 입증되어 최근 처방률 또한 획기적으로 증가하였다. 그러나 약제의 특성상 요로 감염, 체액 결핍, 당뇨병성 케톤산증 등의 위해 사건에 대한 염려 또한 동반되므로 환자의 전신 컨디션을 고려하여 이득과 손해를 따져 처방하는 것이 중요하겠다. 또한 환자에게 급성 병색, 구토, 설사 증세가 나타나거나 음식을 복용하지 못하는 상황일 때에는 SGLT2 억제제 복용을 중단할 것을 교육하는 것이 중요하겠다.
SGLT2 억제제에 대한 적응증이 급속히 확대되었지만 신장 이식 환자나 말기 신부전 환자에 대한 데이터는 여전히 부족하며 향후 연구에서는 이러한 환자에 대한 안전성과 유효성을 평가해야 한다. 향후에는 후속 연구 결과를 통한 SGLT2 억제제의 사용 범위 확장 및 보험 기준의 개선을 기대해 본다.
Notes
REFERENCES
2. Wright EM, Loo DD, Hirayama BA. Biology of human sodium glucose transporters. Physiol Rev 2011;91:733–794.


3. Zehra T, Cupples WA, Braam B. Tubuloglomerular feedback synchronization in nephrovascular networks. J Am Soc Nephrol 2021;32:1293–1304.



4. Tonneijck L, Muskiet MH, Smits MM, et al. Glomerular hyperfiltration in diabetes: mechanisms, clinical significance, and treatment. J Am Soc Nephrol 2017;28:1023–1039.



5. Vallon V, Thomson SC. Targeting renal glucose reabsorption to treat hyperglycaemia: the pleiotropic effects of SGLT2 inhibition. Diabetologia 2017;60:215–225.



6. Cherney DZI, Cooper ME, Tikkanen I, et al. Pooled analysis of phase III trials indicate contrasting influences of renal function on blood pressure, body weight, and HbA1c reductions with empagliflozin. Kidney Int 2018;93:231–244.


7. Heerspink HJL, de Zeeuw D, Wie L, Leslie B, List J. Dapagliflozin a glucose-regulating drug with diuretic properties in subjects with type 2 diabetes. Diabetes Obes Metab 2013;15:853–862.



8. Cherney DZ, Perkins BA, Soleymanlou N, et al. The effect of empagliflozin on arterial stiffness and heart rate variability in subjects with uncomplicated type 1 diabetes mellitus. Cardiovasc Diabetol 2014;13:28.



9. Mihai S, Codrici E, Popescu ID, et al. Inflammation-related mechanisms in chronic kidney disease prediction, progression, and outcome. J Immunol Res 2018;2018:2180373.



10. Dekkers CCJ, Petrykiv S, Laverman GD, Cherney DZ, Gansevoort RT, Heerspink HJL. Effects of the SGLT-2 inhibitor dapagliflozin on glomerular and tubular injury markers. Diabetes Obes Metab 2018;20:1988–1993.



11. Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015;373:2117–2128.


12. Cherney DZI, Zinman B, Inzucchi SE, et al. Effects of empagliflozin on the urinary albumin-to-creatinine ratio in patients with type 2 diabetes and established cardiovascular disease: an exploratory analysis from the EMPA-REG OUTCOME randomised, placebo-controlled trial. Lancet Diabetes Endocrinol 2017;5:610–621.


13. Neal B, Perkovic V, Mahaffey KW, et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med 2017;377:644–657.


14. Wiviott SD, Raz I, Bonaca MP, et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2019;380:347–357.


15. Perkovic V, Jardine MJ, Neal B, et al. Canagliflozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med 2019;380:2295–2306.


16. Heerspink HJL, Stefánsson BV, Correa-Rotter R, et al. Dapagliflozin in patients with chronic kidney disease. N Engl J Med 2020;383:1436–1446.


17. Wheeler DC, Stefánsson BV, Jongs N, et al. Effects of dapagliflozin on major adverse kidney and cardiovascular events in patients with diabetic and non-diabetic chronic kidney disease: a prespecified analysis from the DAPA-CKD trial. Lancet Diabetes Endocrinol 2021;9:22–31.


18. The EMPA-KIDNEY Collaborative Group, Herrington WG, Staplin N, et al. Empagliflozin in patients with chronic kidney disease. N Engl J Med 2023;388:117–127.



19. Chertow GM, Vart P, Jongs N, et al. Effects of dapagliflozin in stage 4 chronic kidney disease. J Am Soc Nephrol 2021;32:2352–2361.



20. Cherney DZI, Dekkers CCJ, Barbour SJ, et al. Effects of the SGLT2 inhibitor dapagliflozin on proteinuria in non-diabetic patients with chronic kidney disease (DIAMOND): a randomised, double-blind, crossover trial. Lancet Diabetes Endocrinol 2020;8:582–593.


21. Wheeler DC, Toto RD, Stefánsson BV, et al. A pre-specified analysis of the DAPA-CKD trial demonstrates the effects of dapagliflozin on major adverse kidney events in patients with IgA nephropathy. Kidney Int 2021;100:215–224.

22. EMPA-KIDNEY Collaborative Group. Impact of primary kidney disease on the effects of empagliflozin in patients with chronic kidney disease: secondary analyses of the EMPAKIDNEY trial. Lancet Diabetes Endocrinol 2024;12:51–60.

23. Koshino A, Neuen BL, Jongs N, et al. Effects of dapagliflozin and dapagliflozin-saxagliptin on erythropoiesis, iron and inflammation markers in patients with type 2 diabetes and chronic kidney disease: data from the DELIGHT trial. Cardiovasc Diabetol 2023;22:330.



24. Ishikawa N, Oguri T, Isobe T, Fujitaka K, Kohno N. SGLT gene expression in primary lung cancers and their metastatic lesions. Jpn J Cancer Res 2001;92:874–879.



25. Zhou J, Zhu J, Yu SJ, et al. Sodium-glucose co-transporter-2 (SGLT-2) inhibition reduces glucose uptake to induce breast cancer cell growth arrest through AMPK/mTOR pathway. Biomed Pharmacother 2020;132:110821.


26. Yamamoto L, Yamashita S, Nomiyama T, et al. Sodium-glucose cotransporter 2 inhibitor canagliflozin attenuates lung cancer cell proliferation in vitro. Diabetol Int 2021;12:389–398.



27. Kaji K, Nishimura N, Seki K, et al. Sodium glucose cotransporter 2 inhibitor canagliflozin attenuates liver cancer cell growth and angiogenic activity by inhibiting glucose uptake. Int J Cancer 2018;142:1712–1722.

28. Lega IC, Bronskill SE, Campitelli MA, et al. Sodium glucose cotransporter 2 inhibitors and risk of genital mycotic and urinary tract infection: a population-based study of older women and men with diabetes. Diabetes Obes Metab 2019;21:2394–2404.

29. Uitrakul S, Aksonnam K, Srivichai P, Wicheannarat S, Incomenoy S. The incidence and risk factors of urinary tract infection in patients with type 2 diabetes mellitus using SGLT2 inhibitors: a real-world observational study. Medicines (Basel) 2022;9:59.

30. Thong KY, Yadagiri M, Barnes DJ, et al. Clinical risk factors predicting genital fungal infections with sodium-glucose cotransporter 2 inhibitor treatment: the ABCD nationwide dapagliflozin audit. Prim Care Diabetes 2018;12:45–50.


31. Blau JE, Tella SH, Taylor SI, Rother KI. Ketoacidosis associated with SGLT2 inhibitor treatment: analysis of FAERS data. Diabetes Metab Res Rev 2017;33:e2924.



32. Palmer BF, Clegg DJ. Euglycemic ketoacidosis as a complication of SGLT2 inhibitor therapy. Clin J Am Soc Nephrol 2021;16:1284–1291.

33. Daniele G, Xiong J, Solis-Herrera C, et al. Dapagliflozin enhances fat oxidation and ketone production in patients with type 2 diabetes. Diabetes Care 2016;39:2036–2041.

34. Ryan PB, Buse JB, Schuemie MJ, et al. Comparative effectiveness of canagliflozin, SGLT2 inhibitors and non-SGLT2 inhibitors on the risk of hospitalization for heart failure and amputation in patients with type 2 diabetes mellitus: a real-world meta-analysis of 4 observational databases (OBSERVE-4D). Diabetes Obes Metab 2018;20:2585–2597.



The broad-spectrum benefits of sodium-glucose cotransporter- 2 (SGLT2) inhibitors beyond glycemic control.
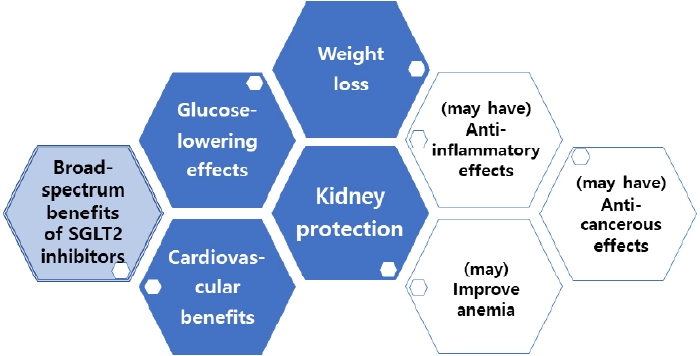
Figure 1.
Table 1.
Trials of sodium-glucose cotransporter-2 (SGLT2) inhibitors demonstrating renal benefits



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




