유전자 검사 시대 골수형성이상증후군의 진단과 치료
Diagnosis and Treatment of Myelodysplastic Syndrome in the Era of Genetic Testing
Article information
Trans Abstract
Myelodysplastic syndrome (MDS) is a heterogeneous disorder with diverse prognoses influenced by cytopenias, genetic variants, and myeloblast proportions in the bone marrow. Accurate prognosis prediction and tailored treatment plans are essential. The International Prognostic Scoring System-Molecular (IPSS-M), which additionally reflects the impact of MDS-related genetic mutations to the clinical and laboratory information, is anticipated to offer superior prognostic accuracy compared to existing systems like the Revised International Prognostic Scoring System (IPSS-R). Despite its statistical complexity, its web-based calculation and ease of discussing results with patients using intuitive data sets provide notable advantages. Progress in MDS treatment, exemplified by effective anemia correction with an erythropoiesis-maturation agent in SF3B1-mutated cases and efforts to refine poor prognoses in TP53-mutated cases, reflects the evolving landscape of genetic-based interventions in MDS. Advancements in genetic diagnostic technology, combined with enhanced knowledge of the bone marrow niche, are anticipated to lead to significant improvement in MDS treatment outcomes in the future.
서 론
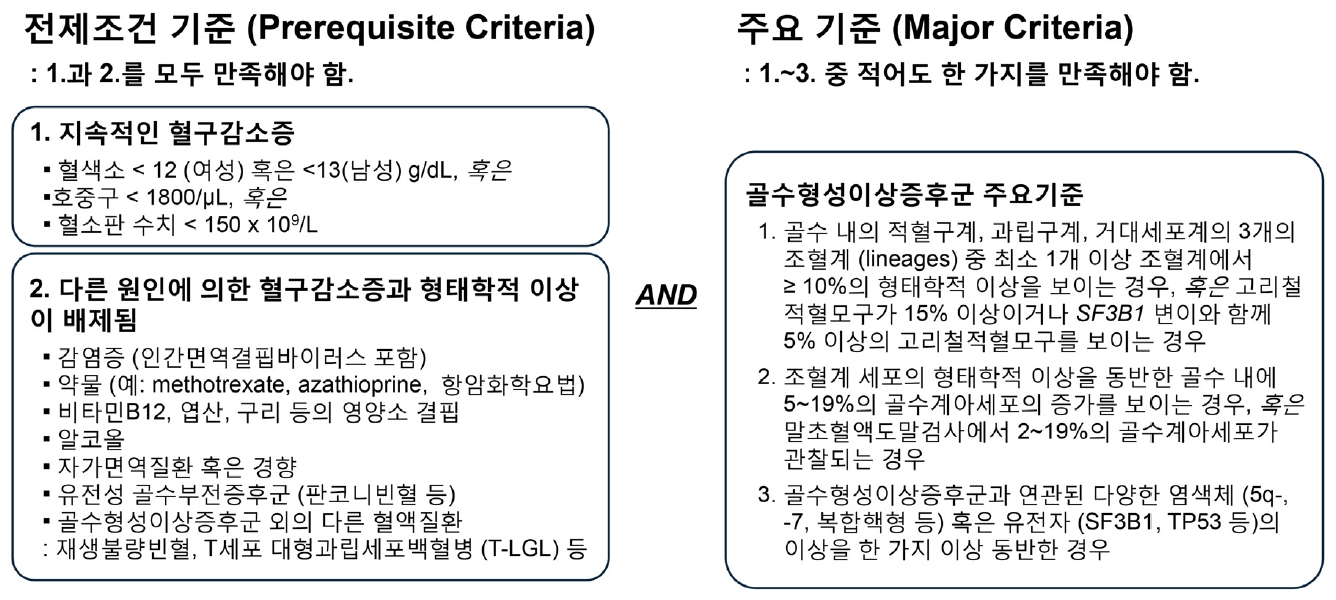
골수형성이상증후군(myelodysplastic syndrome, MDS)은 영양소 결핍, 감염, 알코올, 약제, 자가면역질환 등의 이차적 원인이 없는 혈구 감소(cytopenia)가 지속되면서 골수 내 조혈계 세포의 형태학적 이상, 골수 혹은 말초 혈액 내 골수계 아세포(myeloblasts)의 증가, 또는 특징적인 유전 변이 중 한 가지 이상을 동반한 상태를 일컫는다(Fig. 1) [1]. 혈액세포들을 완성되어 생산된 제품들, 골수를 해당 제품들을 생산하는 공장이라 한다면, MDS는 공장이 손상을 입어(유전 변이 등) 제품 생산량이 대체로 감소하고(혈구 감소), 만들어진 제품의 일부는 모양이 이상하거나 기능이 불량한 상황(형성 이상)이라고 비유할 수 있다.
환자들은 비록 MDS라는 하나의 이름으로 묶여 있지만 혈구 수 감소 정도, 유전 변이 그리고 골수 내 골수계아세포의 비율에 따라 매우 다양한 예후를 보인다. 개정판 국제 예후 지표 체계(Revised International Prognostic Scoring System, IPSS-R)에 따라 환자를 분류할 경우, 치료 없이 경과를 관찰할 경우 예상 총 생존율의 중앙값은 very low (VL) 위험군의 경우 8.8년 이지만 very high (VH) 위험군은 0.8년으로 매우 큰 차이를 보인다[2]. 이를 고려할 때, 환자의 위험도를 정확하게 예측하고 그에 따른 적절한 치료 방침을 정하는 것이 성공적인 MDS 치료의 핵심이다.
오랫동안 국제 예후 지표 체계(International Prognostic Scoring System, IPSS) [3]와 IPSS-R [2]이 예후 분류 기준으로 사용되어 왔지만 유전 변이 측면에서는 염색체 이상 여부만을 반영할 수 있었다. 그러나 차세대 염기서열 분석(next generation sequencing, NGS)을 이용하여 골수 검체에서 다양한 유전자 변이를 한 번에 확인할 수 있게 되면서, 각 유전자의 변이 여부와 예후의 연관성에 대한 연구가 많이 이루어져 왔고[4,5], 2022년에는 분자 국제 예후 지표 체계(IPSS-Molecular, IPSS-M)가 등장하였다[6].
유전자 검사의 확대로 MDS의 치료에도 발전이 이루어졌다. 염색체 검사를 통하여 5q결손증후군 MDS에서 lenalidomide [7]가 효과적인 것으로 알려진 이후로, 고리철적혈모구(ring sideroblast)와 연관된 SF3B1 변이를 가진 저위험군 MDS 환자에게 적혈구조혈성숙제제(erythropoiesis maturation agent, EMA)인 luspatercept이 효과적임이 확인되었다. 뿐만 아니라, 염색체복합핵형(complex karyotype) 및 홑염색체핵형(monosomal karyotype)과 흔히 동반되어 매우 불량한 치료 성적을 보이는 TP53 변이 MDS에 대한 이해도 깊어지고 있다.
본 론
MDS의 새로운 예후 체계 IPSS-M
MDS의 예후 분류를 위한 국제협력그룹(International Working Group for the Prognosis of MDS, IWG-PM)은 IPSS-M의 개발을 위해 유럽을 중심으로 미국, 브라질, 타이완의 다수 기관에서 진단받은 2,957명의 MDS 환자를 발굴 코호트(discovery cohort)로 선정하여 임상 정보와 유전자 정보를 분석하였다[6]. 모든 분석 검체는 치료 전 검체로 골수 내 아세포 20% 미만이며, 말초 혈액 백혈구 수가 13 × 109/L 미만인 경우로 제한하여 acute myeloid leukemia (AML)와 MDS/myeloproliferative neoplasm (MPN) 중첩증후군(MDS/MPN overlap syndrome) 환자들을 배제하려 하였다. 이전의 항암 화학 요법이나 방사선 치료 후 발생한 치료 연관 MDS 환자는 분석에 포함하였다. 또한 754명의 일본 MDS 환자들을 검증 코호트(validation cohort)로 추후 분석하였다. 모든 환자들에게 동일한 152개 유전자에 대한 표적 패널 염기서열 분석(targeted panel sequencing)을 시행하였다. MLL partial tandem duplication의 경우 CNACS in-house coverage analysis로 검출한 후 integrative genomics viewer로 수동 검사하였으며 DDX41 변이는 대립유전자 빈도(variant allele frequency, VAF)와 DDX41 좌의 염색체 결손 여부를 확인한 후 체세포 변이를 생식세포 변이와 구분하였다[6].
분석 결과를 통해 환자들을 위험도에 따라 VL, low (L), moderately low (ML), moderately high (MH), high (H), VH의 6개 위험군으로 분류하였고, 빈도는 각각 14%, 33%, 11%, 11%, 14%, 17%였다. 총 생존 기간의 중앙값은 VL 위험군에서 10.6년이었으며, 가장 높은 비율로 전체의 1/3에 해당하는 L 위험군에서는 6년, VH 위험군에서는 1.0년이었다(Table 1) [6]. IPSS-R에 따른 분류 시, 고위험군보다는 중간 혹은 저위험군 환자에서 위험도의 재분류가 더 빈번하게 일어났으며, IPSS-M의 정확도가 상대적으로 더 높은 것으로 확인되었다. 예를 들어, IPSS-R로 동일하게 intermediate (INT) 위험군으로 분류된 환자들 중에서 IPSS-M을 적용 시 VH 위험군으로 재분류된 환자들에서의 무백혈병 발생 기간 중앙값이 0.87년(95% confidence interval [CI], 0.67-1.30)인데 반하여 IPSS-M에 따라 L 위험군으로 재분류된 경우 무백혈병 발생 기간 중앙값은 6.1년(95% CI, 5.2-10.1)으로 그 차이가 컸다. 그러나 동일한 IPSS-M 그룹 내에서 IPSS-R에 따른 예후의 차이는 유의하게 나타나지 않았다[6]. 이를 통해 기존 IPSS-R에서 INT 이하의 위험군에 해당하는 환자들의 경우 NGS 검사를 통한 IPSS-M의 확인이 더욱 필요할 수 있음을 알 수 있다. 이 같은 결과는 검증 코호트를 통하여 재현되었고[6], 이후 여러 연구들이 IPSS-M의 IPSS-R 대비 유용성을 보고하고 있다[8-11].
IPSS 및 IPSS-R과는 달리 IPSS-M은 보다 많은 임상 정보와 여러 유전자 검사의 결과들을 반영해야 하므로 쉽게 점수화하여 위험도를 분류할 수 없다. 대신 MDS 재단(The MDS Foundation)과 함께 편리한 웹 계산기(IPSS-M Risk Calculator; The MDS Foundation, Yardville, NJ, USA, https://mds-risk-model.com)를 개발하였다. 웹 계산기를 통해 진료 현장에서 짧은 시간 내에 정보들을 입력할 수 있고 즉시 위험도 계산 결과를 얻을 수 있으며 결과지를 PDF 파일로 인쇄까지 할 수 있다. 계산을 통하여 IPSS-M에 따른 예상 무백혈병 생존 기간 및 총 생존 기간의 중앙값과 25-75% 범위, 그리고 1년과 4년 경과 시 예상되는 AML로의 전환율을 알 수 있다. 진료 현장에서 실제 사용하는 유전자 검사 패널에는 IPSS-M에 포함된 152개의 유전자 중 일부가 포함되어 있지 않을 수 있는데 이 경우 not assessed에 표기하여 분석에 반영할 수 있다. 환자의 위험군이 분포상 어느 정도에 위치하는지와 예상되는 예후에 대한 카플란-마이어 생존곡선까지 보여주므로 환자들이 현재 상태를 시각적 자료들을 통하여 보다 직관적으로 잘 이해할 수 있게 해주는 장점이 있다[12].
유전자 이상을 동반한 MDS의 치료
NGS 검사를 통해 한 번에 많은 수의 유전 변이를 검사할 수 있게 되었지만, MDS에서는 치료의 표적으로 작용하거나 독특한 특징을 보여 별도의 아형으로 분류될 수 있는 유전 변이가 AML의 경우와 비교할 때 많지 않다. 2022년 개정된 세계보건기구(World Health Organization, WHO)의 골수계 종양에 대한 제5판 분류 개정안에서는 기존의 5번 염색체 결손 MDS에 더하여 SF3B1 변이(MDS with low blasts and SF3B1 mutation, MDS-SF3B1)와 TP53의 변이를 동반한 MDS (MDS with biallelic TP53 inactivation, MDS-biTP53)만을 별도의 아형으로 분류하고 있다[1]. 같은 해 새롭게 발표된 국제 합의 분류(International Consensus Classification, ICC)의 골수계 종양 분류에서도 용어와 정의의 미묘한 차이는 있으나 두 유전자 변이를 동반한 MDS에 대한 분류가 동일하게 적용되었다[13].
저위험 MDS의 가장 흔한 문제는 빈혈이다. 상당 수의 환자들이 매 8주 이내의 간격으로 반복적인 적혈구 수혈이 필요한 수혈 의존 상태에 빠진다. ESA는 빈혈을 교정하는 데 유용한 치료법이나 혈청 erythropoietin이 500 mU/mL 미만인 경우 사용할 수 있으며 약 40-60%에서 반응을 보인다. ESA의 효과 유지 기간은 평균 18-24개월로, 다수의 환자는 ESA를 사용할 수 없거나 반응을 잃는다[14]. 골수에서 고리철적혈모구라는 특징적인 적혈구계 조혈세포가 관찰되면서 SF3B1 유전자의 변이를 가진 수혈 의존 MDS 환자에서는 EMA인 luspatercept가 빈혈 조절에 효과적이다[15]. 매 3주마다 피하 주사하는 luspatercept는 적혈구 조혈의 후기 성숙 단계에서 transforming growth factor-beta (TGF-β) superfamily ligand trap으로 작용하여 ActRIIB 활성화 억제와 Smad2/3 신호 감소를 통하여 TGF-β에 의한 무효 적혈구 조혈(ineffective erythropoiesis)을 줄여줌으로써 혈색소를 높이는 약제이다[16]. 저위험군 MDS 환자 전반을 대상으로 한 2상 임상시험[17]에서 고리철적혈모구와 SF3B1 변이를 동반한 MDS 환자에게 특히 효과적이라는 분석에 기초하여 고리철적혈모구가 15% 이상이거나 SF3B1 돌연변이가 있는 경우 고리철적혈모구가 5% 이상인 환자군에서 위약 대비 3상 임상시험을 진행하였고[15] 그 결과 첫 24주 동안 38%의 환자에서 8주 이상 지속되는 적혈구 수혈 비의존을 보였고(대조군 13%, p< 0.001) 다수의 환자에서 의미 있는 적혈구 수혈량 감소를 보였다. 이후 SF3B1 단백 기능이 저하될 경우 TGF-β와 P53 신호전달 체계가 활성화되어 G0/G1 세포주기 중지(cell cycle arrest)와 무효 적혈구 조혈이 조장됨이 zebrafish을 이용한 실험에서 증명되었다[18]. Luspatercept은 해당 환자군에서 미국 Food and Drug Agency와 대한민국 식품의약품안전처의 승인을 얻었으며, 현재는 다시 고리철적혈모구나 SF3B1 변이 여부에 관계없이 수혈 의존 저위험 MDS 환자 일반에서의 빈혈 개선 가능성이 ESA를 대조군으로 수행된 3상 임상시험(COMMANDS 연구)을 통하여 연구 중으로 최근 긍정적인 중간 결과가 발표되었다[19]. 국내에서는 아직 부담스러운 약제비 등을 이유로 급여 인정을 받지 못하여 실제 사용이 용이하지는 않으나, 비수혈 요법에 대한 의학적, 사회적 요구가 커져가고 있는 상황에서 타 적응증으로의 확대 등을 통해 글로벌 시장의 관점에서 중요한 약제로 부상할 것으로 예상된다.
TP53 변이를 동반한 골수계 종양의 예후가 좋지 않은 것은 잘 알려져 있으나, 최근 자세한 연구들을 통해 TP53 변이 MDS와 AML에 대한 이해가 깊어지고 있다. 혈액암에서 TP53의 돌연변이 외에도 17번 염색체 내 TP53 좌의 결손(deletion)이나 양쪽 상동염색체의 유전 구성이 동일하게 변화되어 상동염색체 간의 상호 보완적 역할을 소실시키는 카피 수 중립 이형 접합성 상실(copy neutral loss of heterozygosity, CN-LOH)도 TP53의 불활성화(inactivation)에 기여한다. 이런 기전으로 두 상동염색체 모두의 TP53이 억제되는 biallelic 혹은 double-hit으로 표현되는 상황에서 환자의 예후가 특히 좋지 않다는 점이 알려졌고[20] MDS 환자에서도 잘 확인되었다[21]. MDS에서 TP53 변이의 VAF가 22%를 초과할 경우 역시 좋지 않은 예후를 시사한다는 분석이 있는데[21], CN-LOH 검사가 임상 현장에서 일상적으로 이루어지기는 어렵기 때문에 TP53 변이 MDS 환자에서 TP53 변이의 VAF를 참고할 수 있음을 시사한다. 다만 HOVON-SAKK 그룹에서 AML과 excess blasts를 보이는 MDS 환자들을 대상으로 분석한 연구에서는 mono-allelic과 bi-allelic TP53 변이 환자 간의 총 생존율의 차이가 전혀 없었고, VAF에 따른 예후의 차이도 관찰할 수 없었기 때문에[22] AML 및 아세포가 높은 고위험 MDS에서는 mono-allelic, low VAF의 TP53 변이라도 보다 긍정적인 결과를 기대할 수 있다고 단정하기는 어렵다. TP53 변이 골수계 종양의 치료는 골수계 종양에서 가장 도전적인 분야로, 질병의 기전에 대한 이해가 높아지면서 새롭고 효과적인 치료법이 개발될 것으로 기대된다.
유전자 검사 정보를 이용한 고위험 MDS에서의 보다 효과적인 치료 가능성
고위험 MDS 환자가 고강도 치료를 견딜 수 있는 신체 상태를 갖추었다면, 완치를 위하여 동종조혈모세포 이식을 시도할 수 있다. 대체로 골수 내 아세포 비율이 높으면 선행 치료로 아세포 비율을 낮추고 이식을 진행하는 것이 권고되나[23], 선행 치료인 저메틸화제나 집중 관해 유도 항암 화학 요법의 치료 반응을 분명히 예측할 수 있는 유전 변이는 아직까지 알려진 바 없다[5].
IPSS, IPSS-R, IPSS-M은 각각 4개, 5개, 6개의 그룹으로 위험군을 분류하나, 동종 조혈모세포 이식 시행 여부를 판단해야 하는 임상의의 입장에서는 결국 저위험군과 고위험군 간의 분류가 핵심이며, 그런 면에서 5개의 그룹으로 분류하고 가운데 INT 위험군을 둔 IPSS-R보다는 각각 3개씩의 저위험군과 고위험군을 둔 IPSS-M이 편리할 수 있다. IPSS-M이 IPSS-R보다 총 생존 기간과 AML로의 전환 위험을 보다 잘 예측한다는 측면에서, 앞으로 IPSS-M 결과가 환자의 이식 결정에 있어 가장 중요한 요소로 고려될 수 있다. 동종 조혈모세포 이식 결정 과정에서 IPSS-M의 우월한 유용성에 대하여 보고하는 연구도 발표되고 있다[10]. 다만 등장한지 얼마 되지 않은 IPSS-M이 과연 유전자 검사 결과를 반영한 최고의 예후 예측 도구인지에 대해서는 더 많은 검증 연구가 필요하다. 저위험군에서 시간을 두고 고위험군으로 진행한 MDS 환자의 경우 클론 진화(clonal evolution)의 가능성이 높아[24] 이식 전 새롭게 NGS 검사를 해야 할 수 있다. 현재 국내의 조혈모세포 이식 요양 급여 대상자 질병별 기준에서는 IPSS-M이 MDS 환자에서의 고려 사항으로 명시되어 있지 않다.
결 론
MDS는 혈구 감소, 유전 변이 그리고 골수 내 아세포의 비율에 따라 매우 다양한 예후를 보이는 이질적인 질환이므로, 개별 환자의 예후를 정교하게 예측하고 그에 따른 적절한 치료 계획을 수립해야 한다. 기존의 임상 및 실험실 정보와 함께 MDS 관련 유전자 변이들의 영향을 종합적으로 반영한 IPSS-M은 IPSS-R 등 기존의 예후 분류 지표들보다 더 나은 예후 예측이 가능하게 할 것으로 기대되며, 내부 통계적인 복잡성에도 불구하고 웹 계산기를 통해 편리하게 계산하고 환자와 결과를 상의할 수 있는 장점이 있다. SF3B1 변이 동반 MDS에서 특별히 좋은 반응을 보이는 빈혈 교정 제제의 등장과 TP53 변이를 동반한 MDS의 불량한 예후를 세분화하려는 노력 등은 유전자 검사의 발전이 MDS 치료의 진보로 이어지고 있음을 보여주고 있다. NGS가 일상화된 정밀 유전자 검사 시대의 진단 기술 발전이 병태생리 연구의 다른 큰 한 축인 골수 내 미세환경[25]에 대한 지식의 향상과 합쳐져서 앞으로 MDS 치료 성적의 큰 향상을 이룰 것으로 기대된다.
Notes
CONFLICTS OF INTEREST
No potential conflict of interest relevant to this article was reported.
FUNDING
None.
AUTHOR CONTRIBUTIONS
JH conceptualized the theme of the current article, reviewed existing literature, and wrote the manuscript.
Acknowledgements
None.