 |
 |
| Korean J Med > Volume 98(2); 2023 > Article |
|
žöĒžēĹ
žč†žĘÖ žĹĒŽ°úŽāėŽįĒžĚīŽü¨žä§ ŽįĪžč† ž†ĎžĘÖ žĚīŪõĄ ŽįúžÉĚŪēú ICI žóįÍīÄ žĚīžÉĀ ŽįėžĚĎžĚÄ Žß§žöį ŽďúŽ¨ł žā¨Ž°ÄžĚīŽč§. ŽįĪžč† ž†ĎžĘÖžúľŽ°ú žĚłŪēú Ž©īžó≠žõźžĄĪžĚė Ž≥ÄŪôĒÍįÄ ICI žĻėŽ£Ćžóź ŽĮłžĻ† žėĀŪĖ•Ž†•žóź ŽĆÄŪēīžĄúŽäĒ žēĆŽ†§žßĄ ŽįĒÍįÄ ž†ĀŽč§. Ž≥ł ž¶ĚŽ°Ä Ž≥īÍ≥†ŽäĒ žč†žĘÖ žĹĒŽ°úŽāė Íįźžóľ žėąŽį©žĚĄ žúĄŪēú ŽįĪžč† ž†ĎžĘÖ žĚīŪõĄ, ICI žĻėŽ£Ć Í≥ľž†ēžóźžĄú ŽįúžÉĚŪēú ŽĻĄŪäĻžĚīž†ĀžĚł irAEžĚė ÍįÄŽä•žĄĪžĚĄ ž†úžčúŪēúŽč§.
Abstract
COVID-19 vaccination is essential in cancer patients. However, there is limited evidence of the prognosis of these patients, especially for those taking immune checkpoint inhibitors (ICIs). We present a patient on pembrolizumab for advanced endometrioid adenocarcinoma experiencing continuous diarrhea and subsequent episodes of fever with pain in multiple joints following a second dose of the BNT162b2 mRNA COVID-19 vaccine. An ICI-induced immune-related adverse effect (irAE) was the main diagnosis; cytokine release syndrome and rheumatoid arthritis were also considered. Notably, the novel irAE occurred after the 19th pembrolizumab trial, highlighting the potential effect of changes in systemic immunogenicity after BNT162b2 vaccination. Ultimately, the patient was treated with steroid, which alleviated her symptoms. Here, we report a rare adverse effect after COVID-19 vaccination in an endometrioid carcinoma patient on ICI therapy. This report shows that there is a need to consider and investigate vaccine-related adverse events.
2020ŽÖĄ 12žõĒ ŽĮłÍĶ≠ FDAžóźžĄú COVID-19 mRNA ŽįĪžč†žĚė ÍłīÍłČ žā¨žö©žĚĄ žäĻžĚłŪēú žĚīŪõĄ, ž†Ą žĄłÍ≥Ąž†ĀžúľŽ°ú ŽįĪžč† ž†ĎžĘÖžĚī žĚīŽ£®žĖīž°ĆŽč§. žēĒŪôėžěźŽď§žĚÄ ÍĪīÍįēŪēú žā¨ŽěĆŽď§žóź ŽĻĄŪēī COVID-19žóź ÍįźžóľŽźėžóąžĚĄ ŽēĆ ž§ĎŪôėžěźžč§ žěÖžõźžú®Í≥ľ žā¨ŽßĚŽ•†žĚī ŽÜíÍ≥†, Ūē≠žēĒ žĻėŽ£Ć Í≥ľž†ēžóź žĖīŽ†§žõÄžĚī ŽįúžÉĚŪēúŽč§[1]. žĚīŽü¨Ūēú žĚīžú†Ž°ú žĚľŽ∂Ä ÍĶ≠ÍįĞ󟞥úŽäĒ žēĒŪôėžěźŽ•ľ ŪŹ¨Ūē®Ūēú Í≥†žúĄŪóė ŪôėžěźÍĶįŽď§žóźÍ≤Ć žöįžĄ†ž†ĀžúľŽ°ú ŽįĪžč† ž†ĎžĘ̥֞ žčúŪĖČŪēėÍ≥† žěąŽč§[2]. žó¨Žü¨ žěĄžÉĀžčúŪóėžĚĄ ŪÜĶŪēėžó¨ COVID-19 mRNA ŽįĪžč†žĚė ž†ĎžĘÖžĚÄ Í∂ĆÍ≥†ŽźėÍ≥† žěąžßÄŽßĆ, Žč®Íłįž†ĀžĚł žĚīžÉĀ ŽįėžĚϞ̥ ž§Ďž†źž†ĀžúľŽ°ú ŪŹČÍįÄŪĖąŽč§ŽäĒ ŪēúÍ≥ĄÍįÄ žěąŽč§. ŪäĻŪěą Ž©īžó≠ÍīÄŽ¨łžĖĶž†úž†ú(immune checkpoint inhibitor, ICI) žĻėŽ£Ć ŽŹĄž§Ďžóź ž†ĎžĘÖŪēú ŽįĪžč†žĚė žĚīžÉĀ žěĎžö©žóź ŽĆÄŪēīžĄú žóįÍĶ¨Žźú ŽįĒŽäĒ Í∑ĻžÜĆžąėžĚīŽ©į, ŽįĪžč† ž†ĎžĘÖžúľŽ°ú žĚłŪēú Ž©īžó≠žõźžĄĪžĚė Ž≥ÄŪôĒÍįÄ Ūē≠žēĒ žĻėŽ£ĆŽ•ľ ŽįõÍ≥† žěąŽäĒ ŪôėžěźžóźÍ≤Ć žĖīŽĖ†Ūēú žėąŪõĄŽ°ú žĚīžĖīžßąžßÄŽäĒ ŽĮłžßÄžąėŽč§[3].
Ž≥ł ž¶ĚŽ°Ä Ž≥īÍ≥†žĚė ŪôėžěźŽäĒ Í≥†žúĄŪóė žěźÍ∂ĀŽāīŽßČžēĒžĚĄ žßĄŽč®ŽįõžēĄ 2žį®Ž°ÄžĚė žąėžą† ŪõĄ Ž≥īž°įŪē≠žēĒžöĒŽ≤ēÍ≥ľ Žį©žā¨žĄ†žöĒŽ≤ēžúľŽ°ú žĻėŽ£ĆŽ•ľ ŽįõžēėžßÄŽßĆ žěźÍ∂ĀŽāīŽßČžēĒžĚī žě¨ŽįúŪēėžėÄÍ≥†, žĚīŪõĄ Ž©īžó≠ÍīÄŽ¨łžĖĶž†úž†úŽ•ľ Ūą¨žó¨ŪēėŽ©į ŪäĻŽ≥ĄŪēú Ž∂ÄžěĎžö© žóÜžĚī žßąŽ≥ĎžĚė žßĄŪĖČ žĖĎžÉĀžĚĄ ž°įž†ąŪēėÍ≥† žěąžóąŽč§. COVID-19 BNT162b2 ŽįĪžč† 2žį® ž†ĎžĘÖ žĚīŪõĄ 1ž£ľžĚľ ŪõĄŽ∂ÄŪĄį 10žĚľžßł žßÄžÜ掟ėŽäĒ žĄ§žā¨ÍįÄ ŽāėŪÉÄŽā¨Í≥†, 3ÍįúžõĒžĚī žßÄŽāú žĚīŪõĄ ÍįĄŪ󟞆ĀžĚł Žįúžóī ŽįŹ žä¨ÍīÄž†ą, Í≤¨ÍīÄž†ą, žÜźŽ™©ÍīÄž†ą ŽďĪžóźžĄú Žč§ŽįúžĄĪžĚė ÍīÄž†ą ŪÜĶž¶ĚÍ≥ľ žĘÖžįŞ̥ žÉąŽ°≠Í≤Ć ŪėłžÜĆŪēėŽ©į žěÖžõźŪēėžėÄŽč§. Ž≥ł ŽÖľŽ¨łžóźžĄúŽäĒ ŪôėžěźžĚė žĚīžÉĀ ž¶ĚžÉĀÍ≥ľ ŽįĪžč† ž†ĎžĘÖžĚė žóįÍīÄžĄĪ, žĻėŽ£Ć Žį©žĻ®žĚė žĄ§ž†ēÍ≥ľ Í∑łžóź ŽĒįŽ•ł Í≤ĹÍ≥ľ ŽįŹ žėąŪõĄŽ•ľ Ž≥īÍ≥†ŪēėÍ≥†žěź ŪēúŽč§.
Ūôė žěź: 54žĄł žó¨žěź
ž£ľ žÜĆ: Žč§ÍīÄž†ąžĄĪ ŪÜĶž¶Ě ŽįŹ žĘÖžįĹ
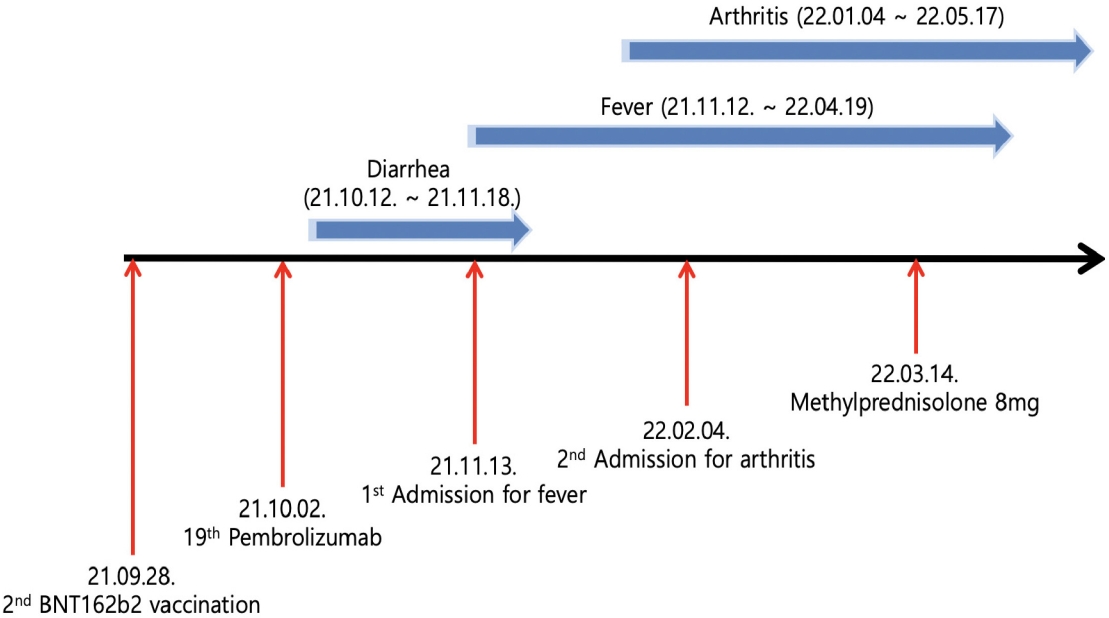
ŪėĄŽ≥ĎŽ†•: žěźÍ∂ĀÍ∑ľžĘÖ žĻėŽ£Ć Ž™©ž†ĀžúľŽ°ú žč§žčúŪēú žěźÍ∂Āž†Āž∂ú ŽįŹ žĖĎžł° Ž∂ÄžÜćÍłįž†ąž†úžą† žĚīŪõĄ žěźÍ∂ĀŽāīŽßČžēĒžĚĄ žßĄŽč®ŽįõÍ≥† žßĄŽč®ž†Ā ÍįúŽ≥Ķžą† ŽįŹ Ž≥īž°įŪē≠žēĒžöĒŽ≤ē(paclitaxel/carboplatin)Í≥ľ Žį©žā¨žĄ†žöĒŽ≤ēžúľŽ°ú žĻėŽ£ĆŽ•ľ ŽįõžēėžúľŽāė, ÍįĄžĚė žĖĎ žóĹžóź Žč§ŽįúžĄĪ ž†ĄžĚī Ž≥ĎžÜĆÍįÄ ŪôēžĚłŽźėžóąŽč§. ž†ĄžĚī Ž≥ĎžÜĆžĚė Ž©īžó≠ž°įžßĀŪôĒŪēôžóľžÉȞ󟞥ú mismatch repair proteinžĚė žĚľžĘ̳֞ MLH-1/PMS2 Žč®ŽįĪ ŽįúŪėĄ žÜƞ觞Ěī ŪôēžĚłŽźėžĖī pembrolizumabžúľŽ°ú žĻėŽ£ĆŽ•ľ žčúžěĎŪēėžėÄžúľŽ©į, 3ž£ľžĚė ÍįĄÍ≤©žúľŽ°ú 1ŽÖĄ ŽŹôžēą žßĄŪĖČŽźú 18žį®Ž°ÄžĚė Ūē≠žēĒžöĒŽ≤ēžóźžĄú žôĄž†ĄÍīÄŪēī(complete remission)žóź ŽŹĄŽč¨ŪēėŽ©į ŪäĻžĚī Ž∂ÄžěĎžö© ŽėźŪēú ÍīÄžįįŽźėžßÄ žēäžēėŽč§. COVID-19 BNT162b2 ŽįĪžč† ž†ĎžĘÖ(1žį®: 21.08.25, 2žį®: 21.09.18) žĚīŪõĄ žßĄŪĖČŪēú 19Ž≤ąžßł Ūē≠žēĒžöĒŽ≤ē(21.10.02) 1ž£ľžĚľ ŪõĄŽ∂ÄŪĄį 10žĚľÍįĄ žßÄžÜ掟ėŽäĒ žĄ§žā¨Ž•ľ ŪėłžÜĆŪēėžó¨ Ūē≠žēĒžöĒŽ≤ē ž§ĎŽč® ŽįŹ Í≥†žö©ŽüČ žä§ŪÖĆŽ°úžĚīŽďú žöĒŽ≤ē(IV methylprednisolone 100 mg, 21.10.27-21.11.09)žúľŽ°ú žĻėŽ£ĆŪēėžėÄŽč§. 2022ŽÖĄ 2žõĒžóźŽäĒ 1Žč¨ ŽŹôžēą žßÄžÜ掟ėŽäĒ 38.5‚ĄÉ žĚīžÉĀžĚė ÍįĄŪóźžóī(intermittent fever) ŽįŹ žä¨ÍīÄž†ą, Í≤¨ÍīÄž†ą, žÜźŽ™©ÍīÄž†ąžĚĄ ŪŹ¨Ūē®Ūēú Žč§ÍīÄž†ąžĄĪ ŪÜĶž¶ĚÍ≥ľ žĘÖžįĹ, C-reactive protein (CRP) žÉĀžäĻžĚī ŪôēžĚłŽźėžĖī ŪŹČÍįÄ ŽįŹ žĻėŽ£Ć žúĄŪēī žěÖžõź(22.02.04)ŪēėžėÄŽč§(Fig. 1).
žč†ž≤ī žßĄžįį žÜĆÍ≤¨: žč†ž≤ī žßĄžįįžóźžĄú Ūėąžēē 117/77 mmHg, Žß•Žįē žąė 122ŪöĆ/Ž∂Ą, ŪėłŪĚ°žąė 18ŪöĆ/Ž∂Ą, ž≤īžė® 37.2‚ĄÉžėÄžúľŽ©į, žč¨ž†ĄŽŹĄžóźžĄúŽäĒ ŽŹôžĄĪŽĻąŽß• žôłžóź ŪäĻžĚī žÜĆÍ≤¨žĚī ÍīÄžįįŽźėžßÄ žēäžēėŽč§. žĖĎžł° žä¨ÍīÄž†ą, žĖĎžł° Í≤¨ÍīÄž†ą, žôľž™Ĺ ž£ľÍīÄž†ą, žė§Ž•łž™Ĺ Í≥†ÍīÄž†ą, žĖĎžł° žÜźŽ™©ÍīÄž†ą ŽďĪžóź žēēŪÜĶžĚī žěąžúľŽāė, Ž™ÖŪôēŪēú ÍīÄž†ą žĘÖžįĹÍ≥ľ Í∑ľŽ†• ž†ÄŪēė žÜĆÍ≤¨žĚÄ ÍīÄžįįŽźėžßÄ žēäžēėŽč§.
Í≤Äžā¨žč§ žÜĆÍ≤¨: ŽßźžīąŪėąžē° Í≤Äžā¨žóźžĄú ŽįĪŪėąÍĶ¨ 7,110/mm3, ŪėąžÉČžÜĆ 8.1 g/dL, Ūó§ŽßąŪ܆ŪĀ¨Ž¶¨Ūäł 25.2%, ŪėąžÜĆŪĆź 288,000/mm3, erythrocyte sedimentation rate (ESR) 120 mm/hržėÄÍ≥†, Ūėąž≤≠žÉĚŪôĒŪēô Í≤Äžā¨žóźžĄú žīĚ Žč®ŽįĪ 6.6 g/dL, žēĆŽ∂ÄŽĮľ 3.2 g/dL, žīĚ ŽĻĆŽ¶¨Ž£®ŽĻą 0.2 mg/dL, alkaline phosphatase 196 IU/L, alanine aminotransferase (ALT)/aspartate aminotransferase (AST) 22/60 IU/L, ferritin 934.6 ng/mL, lactate dehydrogenase (LDH) 247 IU/L, creatine kinase (CK) 21 IU/L, albumin globulin ratio 0.94žėÄÍ≥†, Ž©īžó≠Ūėąž≤≠ Í≤Äžā¨žóźžĄú CRP 175.3 mg/L, ÍįźžóľŪėąž≤≠ Í≤Äžā¨žóźžĄú procalcitonin 0.12 ng/mLžėÄŽč§. žěźÍįÄŽ©īžó≠ žßąŪôė Í≤Äžā¨žóźžĄú antinuclear antibodies 1:80 (negative), anti-DNA, anti-RNP (-), anti-Sm (-), anti SS-A/Ro (-), anti-SS-B/La (-), anti-Scl 70 (-), anti CCP Ab (-), anti-Jo 1 (-), anti-centromere Ab (-), Ž©īžó≠Žč®ŽįĪ Í≤Äžā¨žóźžĄú C3 149.6, C4 33.93, Ž©īžó≠Ūėąž≤≠ Í≤Äžā¨žóźžĄú rheumatoid factor 12.0 IU/mLŽ°ú ŪäĻžĚī žÜĆÍ≤¨žĚÄ ÍīÄžįįŽźėžßÄ žēäžēėŽč§.
Žį©žā¨žĄ† žÜĆÍ≤¨: ž≤úžě•ÍīÄž†ą ŽįŹ Í≥®ŽįėŽ∂Ä Žč®žąú žī¨žėĀžóźžĄúŽäĒ žĖĎžł° Í≥†ÍīÄž†ąžóź ŪáīŪĖČžĄĪ Ž≥ÄŪôĒ(degenerative change of both hip joints) žÜĆÍ≤¨, Í≤Ĺž∂ĒŽ∂Ä Žč®žąú žī¨žėĀžóźžĄúŽäĒ Í≤ĹŪēú ŪáīŪĖČžĄĪ Í≤Ĺž∂Ēž¶Ě(mild degenerative spondylosis) žÜĆÍ≤¨žĚī ŪôēžĚłŽźėžóąŽč§. žĚīžôłžóź žßĄŪĖČŪēú Ž¨īŽ¶é Žč®žąú Žį©žā¨žĄ† žī¨žėĀ, žÜź Žį©žā¨žĄ† žī¨žėĀ(hand AP) ŽįŹ Í≤¨ÍīÄž†ą, ž£ľÍīÄž†ą, ŪēėžßÄžóź ŽĆÄŪēú Žį©žā¨žĄ† žī¨žėĀžóźžĄú ŪäĻžĚī žÜĆÍ≤¨žĚī ÍīÄžįįŽźėžßÄ žēäžēėŽč§. ŪĚČŽ∂Ä XžĄ† Í≤Äžā¨(chest PA)žóźžĄúŽŹĄ ŪäĻžĚī žÜĆÍ≤¨žĚÄ ÍīÄžįįŽźėžßÄ žēäžēėŽč§.
žěźÍłįÍ≥ĶŽ™ÖžėĀžÉĀ žÜĆÍ≤¨: žěÖžõź 1Žč¨ ž†Ą žôłŽ∂Ä Ž≥ĎžõźžóźžĄú žčúŪĖČŪēú žĘĆžł° žä¨ÍīÄž†ą žěźÍłįÍ≥ĶŽ™ÖžėĀžÉĀžóźžĄú ŪôúŽßČžĚė ž¶ĚžčĚÍ≥ľ ÍīÄž†ąÍįē Žāī žāľž∂úžĚī ÍīÄžįįŽźėžóąŽč§.
žěĄžÉĀ Í≤ĹÍ≥ľ ŽįŹ žĻėŽ£Ć: žěÖžõź ÍłįÍįĄ ŽŹôžēą žßÄžÜ枆ĀžĚł ÍīÄž†ą ŪÜĶž¶ĚÍ≥ľ ÍįĄŪ󟞆ĀžĚł ŽįúžóīžĚĄ ŪėłžÜĆŪēėžėÄžúľŽāė, žóľž¶ĚžĄĪ ÍīÄž†ąžóľžĚė ÍįÄŽä•žĄĪžĚī ŽĖ®žĖīž†ł ŽĻĄžä§ŪÖĆŽ°úžĚīŽďúžĄĪ žÜĆžóľžßĄŪÜĶž†úžĚė Ūēú žĘÖŽ•ėžĚł naproxen 1,000 mgžĚĄ ŪēėŽ£® 1ŪöĆ Í≤ĹÍĶ¨ Ūą¨žó¨ŪēėŽ©į ÍīÄžįįŪēėžėÄŽč§. ŽėźŪēú ŽßĆžĄĪ žßąŪôėžóź žĚėŪēú ŽĻąŪėą žÜĆÍ≤¨žóź ŽĆÄŪēīžĄú žąėŪėąžĚĄ ŪŹ¨Ūē®Ūēú ŽāīÍ≥ľž†Ā žĻėŽ£ĆŽ•ľ žßĄŪĖČŪēėžėÄŽč§. žěÖžõź 13žĚľžßł žÉĀŪÉúÍįÄ Ūėłž†ĄŽźėžĖī Ūáīžõź ž°įžĻėŪēėžėÄžúľŽ©į, žßĄŪÜĶž†ú(acetaminophen 325 mg, tapentadol 100 mg)žôÄ Ūē≠žÉĚž†ú(levofloxacin 750 mg)Ž•ľ ž≤ėŽį©ŪēėžėÄŽč§.
žôłŽěė ž∂Ēž†Ā ÍīÄžįįžóźžĄú žßÄžÜ枆ĀžĚł ŽįúžóīÍ≥ľ Ūē®ÍĽė, žĖĎžł° ŽįúŽ™©, žĖĎžł° ž§Ďž°ĪžßÄÍīÄž†ą(metatarsophalangeal joint), žĖĎžł° žÜźŽ™©ÍīÄž†ą, žĖĎžł° ž†ú 2, 4, 5žąėžßÄžĚė Í∑ľžúĄžßÄÍįĄÍīÄž†ą(proximal interphalangeal joint)žĚĄ ŪŹ¨Ūē®Ūēú Žč§ÍīÄž†ąžĄĪ ŪÜĶž¶ĚÍ≥ľ žĘÖžįĹ ŽįŹ ž°įž°įÍįēžßĀžĚĄ ŪėłžÜĆŪēėžėÄžúľŽ©į, CRPŽäĒ 149.4 mg/LŽ°ú žÉĀžäĻŪēėžó¨ žóľž¶ĚžĄĪ ÍīÄž†ąžóľžĚė žĖĎžÉĀžúľŽ°ú žě¨ŪŹČÍįÄŽźėžóąŽč§. ŽĒįŽĚľžĄú methylprednisolone 8 mgžĚĄ Í≤ĹÍĶ¨ Ūą¨žēĹŪēėžėÄÍ≥†, ž¶ĚžÉĀžĚī žôĄŪôĒŽźėŽäĒ Í≤ɞ̥ ŪôēžĚłŪēú žĚīŪõĄ žö©ŽüȞ̥ ž†źžį®ž†ĀžúľŽ°ú ž§ĄžĚīŽ©īžĄú ÍīÄžįį ž§ĎžĚīŽč§.
ICI žöĒŽ≤ēžúľŽ°ú žĚłŪēī Žč§žĖĎŪēú Ž©īžó≠ ÍīÄŽ†® žĚīžÉĀŽįėžĚĎ(immune-related adverse effects, irAEs)žĚī ŽāėŪÉÄŽāėŽ©į, žĚīŽäĒ ŪŹČÍ∑†ž†ĀžúľŽ°ú 5Ž≤ąžßł žĻėŽ£Ć žĚīŪõĄ(ž†Ąž≤ī ICI žĻėŽ£Ć ÍłįÍįĄ ŪŹČÍ∑† 3.5ÍįúžõĒ) ŽāėŪÉÄŽāėŽäĒ Í≤ÉžúľŽ°ú Ž≥īÍ≥†ŽźėžĖī žěąŽč§[4]. PD-1 žĖĶž†ú ÍłįŽįė ICIžĚł pembrolizumabžĚĄ žā¨žö©ŪēėŽäĒ žēĹ 20%žĚė ŪôėžěźžóźžĄú irAEÍįÄ ŽāėŪÉÄŽāėŽ©į, Í∑łž§Ď ž†ĀÍ∑Ļž†Ā žĻėŽ£ĆŽ•ľ žöĒŪēėŽäĒ grade 3 žĚīžÉĀžĚė ž§Ďž¶Ě Ž∂ÄžěĎžö©žĚÄ 10% ž†ēŽŹĄžĚł Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąŽč§. ÍĶ¨ž≤īž†ĀžĚł Ž∂ÄžěĎžö©žĚė žĖĎžÉĀžĚÄ ÍįĎžÉĀžĄ†žóľžúľŽ°ú žĚłŪēú ÍįĎžÉĀžĄ† ÍłįŽä• žĚīžÉĀžĚī 15% ž†ēŽŹĄŽ°ú ÍįÄžě• ŽßéžĚī Ž≥īÍ≥†ŽźėŽ©į, ŽįúžßĄ(9-13%), žě•žóľ(6-7%)žĚī Žč§Ž•ł ŪĚĒŪēú ͳȞĄĪ Ž∂ÄžěĎžö©žúľŽ°ú žĖłÍłČŽźúŽč§. žĚīžôłžóźŽŹĄ ŽďúŽ¨ľžßÄŽßĆ ŪŹźŽ†ī(4-5%), ÍłįŪÉÄ žč†Í≤ĹŪēôž†Ā žĚīžÉĀ(2%), ÍįĄžóľ(0.3-1%)žĚī žě•Íłįž†ĀžĚł žĻėŽ£ĆžóźžĄú ŽāėŪÉÄŽāėŽ©į ž§Ďž¶ĚžĚė Ūē©Ž≥Ďž¶ĚžúľŽ°ú žĚīžĖīžßą ÍįÄŽä•žĄĪžĚī ŽÜíŽč§. ŽßąžßÄŽßČžúľŽ°ú Ž≥ł ž¶ĚŽ°ÄžôÄ ÍįôžĚÄ Í∑ľÍ≥®Í≤©Í≥Ą Ž∂ÄžěĎžö©(1-10%)žĚī žĻėŽ£Ć ŽŹĄž§Ď žó¨Žü¨ žčúÍłįžóź ÍĪłž≥ź ŽįúžÉĚŪē† žąė žěąŽäĒ Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąŽč§[4].
ŪäĻŪěą, ICI žĻėŽ£Ć žĚīŪõĄžĚė žóľž¶ĚžĄĪ ÍīÄž†ąžóľžĚÄ žēĹ 3.3% ž†ēŽŹĄŽ°ú ŽďúŽ¨ľÍ≤Ć ŽįúžÉĚŪēėŽ©į, Í∑ł žĖĎžÉĀžĚÄ Žč§žĖĎŪēėÍ≤Ć Ž≥īÍ≥†ŽźėÍ≥† žěąŽč§[5]. ž£ľÍīÄž†ą, žä¨ÍīÄž†ą ŽďĪžĚė ŽĆÄÍīÄž†ąžóź ÍĶ≠ŪēúŽźėžĖī ŽāėŪÉÄŽāėŽäĒ žÜĆžąėžĄĪ ÍīÄž†ąžóľžĚė ŪėēŪÉúŽŹĄ Ž≥īÍ≥†ŽźėžßÄŽßĆ ž§ĎžąėžßÄÍīÄž†ą, žąėžßÄžĚė Í∑ľžúĄžßÄÍįĄÍīÄž†ą, žÜźŽ™©ÍīÄž†ą ŽďĪ žĖĎžł°žĚė Žč§žąė ÍīÄž†ąžĚĄ ž£ľŽ°ú žĻ®Ž≤ĒŪēėŽäĒ ŪäĻžĄĪžĚī ŽāėŪÉÄŽāė Ž•ėŽßąŪčįžä§ ÍīÄž†ąžóľÍ≥ľžĚė ÍįźŽ≥ĄžĚī žöĒÍĶ¨ŽźėŽäĒ Í≤ĹžöįÍįÄ žě¶Žč§[6]. ŪēėžßÄŽßĆ Ž©īžó≠ ÍīÄŽ†® Ž∂ÄžěĎžö©žúľŽ°ú ŽįúžÉĚŪēú ÍīÄž†ąžóľžĚÄ Ž•ėŽßąŪčįžä§ žßąŪôėÍ≥ľŽäĒ Žč¨Ž¶¨ ŽĻĄžä§ŪÖĆŽ°úžĚīŽďúžĄĪ žÜĆžóľžßĄŪÜĶž†úžôÄ žä§ŪÖĆŽ°úžĚīŽďúžĚė Žč®ŽŹÖ žā¨žö©žúľŽ°úŽŹĄ Ūėłž†ĄžĚĄ Ž≥īžĚīŽäĒ Í≤ĹžöįÍįÄ žĚľŽįėž†ĀžĚīŽč§[5].
Ž≥ł ž¶ĚŽ°ÄžĚė ŪôėžěźŽäĒ 19Ž≤ąžßł pembrolizumabžĚĄ Ūą¨žó¨ŪēėÍ≥† 3ÍįúžõĒ ŪõĄ žĖĎž™Ĺ ŽįúŽ™©, ŽįúÍįÄŽĚĹ, žÜźŽ™©, žÜźÍįÄŽĚĹ ŽďĪžĚė 10Íįú žĚīžÉĀžĚė ŪĀ¨Í≥† žěĎžĚÄ ÍīÄž†ąžóźžĄú ž°įž°įÍįēžßĀžĚī ŽŹôŽįėŽźú ŪÜĶž¶ĚÍ≥ľ žĘÖžįĹžĚī žěąŽäĒ Žč§ŽįúžĄĪ ÍīÄž†ąžóľžĚė žÜĆÍ≤¨žĚī žěąžóąŽč§. ŽėźŪēú, ŪôėžěźžĚė ÍīÄž†ąžóľ ž¶ĚžĄłŽäĒ žä§ŪÖĆŽ°úžĚīŽďúžöĒŽ≤ēŽßĆžúľŽ°ú žôĄŪôĒŽźėŽäĒ Í≤ĹÍ≥ľÍįÄ ŽāėŪÉÄŽā¨žúľŽ©į žĚīŽü¨Ūēú ž†źžĚÄ žĚľŽįėž†ĀžĚł ICI žĻėŽ£Ć žĚīŪõĄ ŽįúžÉĚŪēėŽäĒ ÍīÄž†ąžóľžĚė žěĄžÉĀž†Ā ŪäĻžßēÍ≥ľ Ž∂ÄŪē©ŪēėŽäĒ Ž™®žäĶžĚīŽč§.
Í∑łŽü¨Žāė Ž≥īŪÜĶžĚė Í∑ľÍ≥®Í≤©Í≥Ą irAEžôÄŽäĒ Žč§Ž•īÍ≤Ć Ž≥ł ž¶ĚŽ°ÄžĚė Ž©īžó≠ ÍīÄŽ†® Ž∂ÄžěĎžö©žĚÄ žĻėŽ£ĆŽ•ľ žčúžěĎŪēúžßÄ 1ŽÖĄžßł, ICIŽ•ľ 19žį®Ž°Ä žßĄŪĖČŪēú žĚīŪõĄžóź ŽāėŪÉÄŽā¨Íłį ŽēĆŽ¨łžóź žĚīŽ°Äž†ĀžúľŽ°ú ŪŹČÍįÄŽźúŽč§. Ž≥īÍ≥†Žźú ŽįĒžóź ŽĒįŽ•īŽ©ī, žóľž¶ĚžĄĪ ÍīÄž†ąžóľžĚÄ ŪŹČÍ∑†ž†ĀžúľŽ°ú 4Ž≤ąžßł(žĶúŽĆÄ 8Ž≤ąžßł) ICI žĻėŽ£Ćžóź ŽāėŪÉÄŽāėÍĪįŽāė žĻėŽ£Ć Íįúžčú žĚīŪõĄ ŪŹČÍ∑† 3.5ÍįúžõĒ ŪõĄžóź ŽāėŪÉÄŽāėŽäĒ Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąŽč§[5]. ŽėźŪēú, žóľž¶ĚžĄĪ ÍīÄž†ąžóľžĚė Ž∂ÄžěĎžö©žĚī Ž≥īÍ≥†Žźú ŪôėžěźŽď§žóźÍ≤ĆžĄú Ūē≠ŪēĶŪē≠ž≤ī, HLA-B27, Ž•ėŽßąŪčįžä§ žĚłžěźžôÄ Ūē≠CCPŪē≠ž≤ī žĖĎžĄĪ, žěźÍįÄŽ©īžó≠ žßąŪôė ÍįÄž°ĪŽ†• ŽďĪžĚė žúĄŪóė žĚłžěźÍįÄ Í≥ĶŪÜĶž†ĀžúľŽ°ú Ž≥īÍ≥†ŽźėžóąŽäĒŽćį, Ž≥ł ž¶ĚŽ°ÄžĚė ŪôėžěźŽäĒ ŪēīŽčĻŽźėŽäĒ ŽįĒÍįÄ žóÜžóąŽč§ŽäĒ ž†źžóźžĄú žį®žĚīÍįÄ ŽāėŪÉÄŽāúŽč§[7].
ŪäĻŪěą Ž≥ł ž¶ĚŽ°ÄŽäĒ BNT162b2 ž†ĎžĘÖÍ≥ľžĚė žĚłÍ≥ľžĄĪžĚī žĚėžč¨ŽźúŽč§ŽäĒ ž†źžóźžĄú ŪäĻžßēž†źžĚī ž°īžě¨ŪēúŽč§. žÉĀÍłį ŪôėžěźŽäĒ ž†Ąž≤ī 18žį®Ž°ÄžĚė ICI žĻėŽ£ĆŽ•ľ žßĄŪĖČŪēėŽäĒ ŽŹôžēą(ž†Ąž≤ī žĻėŽ£Ć ÍłįÍįĄ žēĹ 1ŽÖĄ) ž£ľžĚėÍįÄ ŪēĄžöĒŪēú Ž∂ÄžěĎžö©žĚī ŽįúžÉĚŪēėžßÄ žēäžēėŽč§. Í∑łŽü¨Žāė 2žį® BNT162b2 ž†ĎžĘÖ žßĀŪõĄ žčúŪĖČŪēú 19Ž≤ąžßł ICI žĻėŽ£Ć žĚīŪõĄ, žä§ŪÖĆŽ°úžĚīŽďúŽ•ľ žĚīžö©Ūēú Ž©īžó≠ žĖĶž†ú žĻėŽ£ĆžôÄ žěÖžõź žĻėŽ£ĆŽ•ľ žöĒŪēėŽäĒ žĻėŽ™Öž†ĀžĚł irAEŽ°ú žĚīžĖīž†ł žßĄŽč®ž†Ā žĖīŽ†§žõÄžĚī žěąžóąŽč§.
BNT162b2 ŽįĪžč† ž†ĎžĘÖžĚė Ž©īžó≠žõźžĄĪ Ūö®Í≥ľÍįÄ ICI žĻėŽ£Ć Í≥ľž†ēžóź ŽĮłžĻėŽäĒ žėĀŪĖ•žóź ŽĆÄŪēėžó¨ žēĆŽ†§žßĄ ŽįĒŽäĒ Ų̄žÜĆŪēėŽč§. Í∑łŽü¨Žāė PD-1 žĖĶž†úž†ú ÍłįŽįė ICI žĻėŽ£ĆŽ•ľ žßĄŪĖČŪēėŽćė ŽĆÄžě•žēĒ ŪôėžěźžóźžĄú BNT162b2 ž†ĎžĘÖ žĚīŪõĄ ŽįúžÉĚŪēú ŽįúžóīÍ≥ľ žĄ§žā¨, Í∑ľžú°ŪÜĶ ŽďĪžĚĄ ŽŹôŽįėŪēú žā¨žĚīŪ܆žĻīžĚł Žį©ž∂ú ž¶ĚŪõĄÍĶįžĚė ž¶ĚŽ°ÄÍįÄ ž†úžčúŽźú ŽįĒ žěąÍłį ŽēĆŽ¨łžóź, ÍįÄŽä•žĄĪžĚī ž°īžě¨ŪēúŽč§. ŽėźŪēú žē장ú žĄúžą†Ūēú Ž≥īŪÜĶžĚė ICI ÍīÄŽ†® Ž∂ÄžěĎžö©žĚī ŽįúžÉĚŪēėŽäĒ žčúž†źÍ≥ľ žėąžôłž†ĀžĚł Ž™®žäĶžĚī ÍīÄžįįŽźėžĖī Ž≥ł ž¶ĚŽ°ÄžóźžĄúŽäĒ BNT162b2Ž•ľ žēĆŽ†§žßĄ ICI Ž∂ÄžěĎžö©žĚė žú†Žįú žöĒžĚłžúľŽ°ú ž£ľŽ™©ŪēėžėÄŽč§[8].
COVID-19 ŽįĪžč† ž†ĎžĘÖžúľŽ°ú žĚłŪēú ͳȞĄĪ Ž∂ÄžěĎžö©žĚÄ žĚľŽįėž†ĀžĚł ŽįĪžč† ž†ĎžĘÖžúľŽ°ú žĚłŪēú Ž∂ÄžěĎžö©žĚė ŽįúŪėĄ žĖĎžÉĀž≤ėŽüľ ŪĒľŽ°ú(59%), ŽĎźŪÜĶ(52%), žė§Ūēú(35%), Žįúžóī(16%)žĚī ŪĚĒŪěą Ž≥īÍ≥†ŽźúŽč§[9]. ŽėźŪēú žĚľŽ∂Ä COVID-19 ŽįĪžč† ž†ĎžĘÖ žĚłÍĶ¨žóźžĄú Í∑ľÍ≥®Í≤©Í≥Ą Ž∂ÄžěĎžö©(22-37%)žĚī ŽāėŪÉÄŽā† žąė žěąŽäĒ Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąžúľŽ©į žĚľŽ∂Ğ󟞥† ÍīÄž†ąžóľžĚė ž¶ĚŽ°ÄÍįÄ Ž≥īÍ≥†ŽźėžóąŽč§[9]. Í∑łŽü¨Žāė BNT162b2 ž†ĎžĘÖžóź žĚėŪēī žßĀž†Ďž†ĀžúľŽ°ú ÍīÄž†ąžóľžĚī ŽįúžÉĚŪēú žā¨Ž°ÄŽäĒ Žß§žöį ŽďúŽ¨ľŽ©į, ŪôėžěźŽď§žóźÍ≤ĆžĄú Í≥†žó≠ÍįÄžĚė žěźÍįÄŪē≠ž≤ī(rheumatoid factor, anticitrullinated protein antibody) ÍįÄ ÍīÄžįįŽźėÍ≥†, žĻėŽ£ĆŽ•ľ žúĄŪēėžó¨ DMARDs (tocilizumab, etanercept)Ž•ľ žĚīžö©ŪēėŽ©ī Ūėłž†ĄŽźėŽäĒ ž†ĄŪėēž†ĀžĚł Ž•ėŽßąŪčįžä§ žßąŪôėžĚė žĖĎžÉĀžúľŽ°ú ŽāėŪÉÄŽā¨Žč§ŽäĒ ž†źžóźžĄú Ž≥ł ž¶ĚŽ°ÄžôÄŽäĒ žį®žĚīÍįÄ žěąŽč§[10]. ŽėźŪēú, Ž¨łŪóƞ󟞥ú Ž≥īÍ≥†Žźú COVID-19 ŽįĪžč† ž†ĎžĘÖžúľŽ°ú žĚłŪēú Í∑ľÍ≥®Í≤©Í≥Ą Ž∂ÄžěĎžö©žĚÄ ŪÜĶžÉĀž†ĀžúľŽ°ú 7žĚľ žĚīŽāīžĚė ͳȞĄĪž†ĀžĚł Í≤ĹÍ≥ľŽ•ľ Ž≥īžĚīŽäĒ Í≤ÉžĚī žĚľŽįėž†ĀžĚīÍłįžóź žį®Ž≥Ąž†źžĚī Ž∂ÄÍįĀŽźúŽč§[9].
Ž≥ł ž¶ĚŽ°ÄŽäĒ žēĆŽ†§žßĄ žßĄŪĖČžĄĪ žěźÍ∂ĀŽāīŽßČžēĒžĚĄ žúĄŪēú Ūē≠žēĒžöĒŽ≤ēžúľŽ°ú pembrolizumab Žč®ŽŹÖ žöĒŽ≤ēžĚĄ 1ŽÖĄÍįĄ žßĄŪĖČŪēėžėÄŽč§. Í∑łŽü¨Žāė BNT162b2 ž†ĎžĘÖ žĚīŪõĄ 19Ž≤ąžßł pembrolizumab žĻėŽ£ĆŽ°ú ͳȞĄĪž†ĀžĚł ŽįúžóīÍ≥ľ žě•žóľžĚė ž¶ĚžÉĀžĚĄ žčúžěĎžúľŽ°ú ŽĻĄŪäĻžĚīž†ĀžĚł ÍīÄž†ąžóľžúľŽ°ú žĚīžĖīž†ł žěÖžõźž†Ā žĻėŽ£ĆÍįÄ ŪēĄžöĒŪēėžėÄŽč§. žÉĀÍłį ŪôėžěźžĚė irAEŽäĒ 1) žė§Žěú Ž©īžó≠ žĻėŽ£Ć ÍłįÍįĄ žĚīŪõĄ ŽįúžÉĚŪēėžėÄÍ≥†, 2) BNT162b2ŽĚľŽäĒ žú†ŽįúžĚłžěźÍįÄ žĚėžč¨ŽźėŽ©į, 3) ŽāėŪÉÄŽāú Ž•ėŽßąŪčįžä§žĄĪ ÍīÄž†ąžóľžĚī žĚľŽįėž†ĀžĚł pembrolizumabžóź žĚėŪēú Ž©īžó≠ ÍīÄŽ†® Ž∂ÄžěĎžö©žĚė ŪäĻžßēž†źŽď§Í≥ľ žį®žĚīÍįÄ ŽāėŪÉÄŽāúŽč§ŽäĒ ž†źžóźžĄú žÉąŽ°úžöī žā¨Ž°ÄžĚīŽč§.
COVID-19 ŽįĪžč† ž†ĎžĘÖžĚī žēĒŪôėžěźžĚė Ūē≠žēĒ žĻėŽ£Ć Í≥ľž†ēžóź ŽĮłžĻėŽäĒ žėĀŪĖ•žóź ŽĆÄŪēīžĄú žóįÍĶ¨Žźú ŽįĒŽäĒ ž†ĀŽč§. žßÄÍłąÍĻĆžßÄžĚė žóįÍĶ¨ Í≤įÍ≥ľžóź ŽĒįŽ•īŽ©ī ŽįĪžč† ž†ĎžĘÖ žĚīŪõĄ irAEŽäĒ ŪÜĶÍ≥Ąž†ĀžúľŽ°ú žú†žĚėŪēėžßÄ žēäžēĄ COVID-19 ŽįĪžč† ž†ĎžĘÖžĚÄ Í∂ĆÍ≥†ŽźėÍ≥† žěąŽč§. Í∑łŽü¨Žāė Ž≥ł ž¶ĚŽ°ÄžôÄ ŽćĒŽ∂ąžĖī žĚľŽ∂ÄžĚė ŪôėžěźžóźžĄúŽäĒ ŽįĪžč† ž†ĎžĘÖžóź žĚėŪēú Ž©īžó≠ ÍīÄŽ†® Ž∂ÄžěĎžö©žĚī žĻėŽ™Öž†ĀžĚł žėąŪõĄŽ°ú žĚīžĖīžßą ÍįÄŽä•žĄĪžĚĄ ž†úžčúŪēúŽč§. žĚīŽü¨Ūēú ŽįúÍ≤¨žĚÄ žēěžúľŽ°úžĚė ÍīÄŽ†® ŪôėžěźÍĶįžóźžĄú ŪĖ•ŪõĄ žĚīžÉĀ ŽįėžĚĎžóź ŽĆÄŪēú a Ž∂ĄžĄĚžĚĄ žīČÍĶ¨ŪēėŽ©į ŪäĻŪěą COVID-19 ŽįĪžč† ž†ĎžĘÖÍ≥ľ ICI žĻėŽ£ĆžĚė žēĹŽ¨ľž†Ā žÉĀŪėłžěĎžö©žĚė žĚīŪēīŽ•ľ žúĄŪēú žóįÍĶ¨ ŪēĄžöĒžĄĪžĚĄ žó≠žĄ§ŪēúŽč§.
REFERENCES
1. Desai A, Gainor JF, Hegde A, et al. COVID-19 vaccine guidance for patients with cancer participating in oncology clinical trials. Nat Rev Clin Oncol 2021;18:313‚Äď319.


2. Korompoki E, Gavriatopoulou M, Kontoyiannis DP. COVID-19 Vaccines in patients with cancer-a welcome addition, but there is need for optimization. JAMA Oncol 2021;7:1113‚Äď1114.


3. Green AK, Feinberg J, Makker V. A review of immune checkpoint blockade therapy in endometrial cancer. Am Soc Clin Oncol Educ Book 2020;40:1‚Äď7.

4. Martins F, Sofiya L, Sykiotis GP, et al. Adverse effects of immune-checkpoint inhibitors: epidemiology, management and surveillance. Nat Rev Clin Oncol 2019;16:563‚Äď580.


5. Richter MD, Crowson C, Kottschade LA, Finnes HD, Markovic SN, Thanarajasingam U. Rheumatic syndromes associated with immune checkpoint inhibitors: a single-center cohort of sixty-one patients. Arthritis Rheumatol 2019;71:468‚Äď475.

6. Ghosh N, Tiongson MD, Stewart C, et al. Checkpoint inhibitor-associated arthritis: a systematic review of case reports and case series. J Clin Rheumatol 2021;27:e317‚Äďe322.



7. Albandar HJ, Fuqua J, Albandar JM, Safi S, Merrill SA, Ma PC. Immune-related adverse events (irAE) in cancer immune checkpoint inhibitors (ICI) and survival outcomes correlation: to rechallenge or not? Cancers (Basel) 2021;13:989.



8. Au L, Fendler A, Shepherd STC, et al. Cytokine release syndrome in a patient with colorectal cancer after vaccination with BNT162b2. Nat Med 2021;27:1362‚Äď1366.





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




