 |
 |
| Korean J Med > Volume 97(1); 2022 > Article |
|
Abstract
Rhythm control therapy is used in atrial fibrillation (AF) management to improve AF-related symptoms along with rate control. AF catheter ablation is effective in maintaining sinus rhythm and has an acceptable complication rate. Compared with antiarrhythmic drugs, AF catheter ablation is superior with respect to arrhythmia-free survival and improvement in the quality of life. Therefore, AF ablation is recommended for rhythm control after the failure of antiarrhythmic drugs and is sometimes considered a first-line therapy for AF patients. Radiofrequency and cryoballoon ablation show similar efficacy, with slightly different complication profiles. Surgery for AF is also an effective rhythm control therapy and should be considered in patients undergoing cardiac surgery or in those with failed catheter ablation. For patients undergoing AF catheter ablation, performing ablation under uninterrupted warfarin or non-vitamin K oral anticoagulant treatment is recommended for periprocedural stroke risk management. Here, we review existing data and discuss the general principles of AF catheter and surgical ablation in patients with AF.
심방세동의 증상 조절을 위하여 심박수 조절과 함께 율동 조절 치료를 할 수 있다. 심방세동 전극도자절제술은 동율동 조절을 하는 데 효과적이고 수용 가능한 정도의 합병증을 동반한다. 심방세동 전극도자절제술은 항부정맥제와 비교할때 부정맥 재발 또는 증상, 운동 능력 및 삶의 질 개선 측면에서 우월한 것으로 알려졌다. 따라서 만약 항부정맥제 치료에 실패하거나 불내성을 보일 경우 심방세동 전극도자절제술을 고려할 수 있다. 고주파 전극도자절제술과 냉각풍선 절제술의 성적은 비슷하고 합병증 발생 양상이 약간 다른 것으로 보고되었다. 심방세동의 수술적 절제술 역시 효과적으로 심장 수술이 예정되어 있거나 전극도자절제술에 실패하였을 경우 고려할 수 있다. 심방세동 전극도자절제술이 예정되어 있을 경우 항응고치료를 통해 시술 전후 뇌졸중 발생 위험을 관리해야 한다. 대한부정맥학회에서는 심방세동 전극도자 및 수술적 절제술 그리고 시술 전후 뇌졸중 위험 관리에 대해 현재까지 발표된 증거들을 바탕으로 진료 지침을 제시하고자 한다.
심방세동 전극도자절제술은 심방세동 재발을 방지할 수있는 잘 정립된 치료법이다[1]. 숙련된 시술자가 시행할 경우, 심방세동 전극도자절제술은 안전하고 동율동 유지 및 증상 개선 측면에서 항부정맥제보다 우월하다[2-18]. 만약 장기적 치료로 율동 조절을 선택하였다면 심방세동 전극도자 절제술과 항부정맥제의 효과와 부작용에 대해 환자와 논의할 것을 추천한다.
심방세동 전극도자절제술 후 심방세동 재발의 위험요소로 알려진 것들에는 좌심방 크기, 심방세동 지속 기간, 연령, 신기능 저하 그리고 magnetic resonance imaging (MRI)으로 관찰 가능한 기질(substrate) 등이 있다[19-23]. 최근의 체계적 고찰에 따르면 전극도자절제술 후 심방세동 재발 예측모델 들은 잠재적인 효과가 있는 것으로 보고되었으나 좀 더 철저한 평가가 필요한 상태이다[24,25]. 전극도자절제술 전 모델 변수들을 측정함으로써 심방세동 재발 가능성을 시술 전에 예측하고자 하는 것이지만, 현재까지 어떠한 점수체계도 다른 것들과 비교하여 우수하다고 입증되지 않았다[26-31]. 따라서 현재로서는 재발 위험이 있는 지속성 심방세동 환자에서 전극도자절제술의 적합한 적응증은 심방세동 지속 기간과 같은 잘 평가된 위험인자들을 고려하고, 각 환자의 선호도 등 개별 상황을 고려해서 결정되어야 한다. 특히, 심방세동 재발의 위험을 줄이기 위해 조절할 수 있는 위험인자들에 대해 환자들에게 명확하게 설명해 주어야 한다[21,32-41].
심방세동 전극도자절제술의 적응증은 그림 1에 정리되어 있다. 심방세동 전극도자절제술은 발작성 및 지속성 심방세동 환자에서 동율동을 유지하는 데 효과적이다[2-8,11-16,42]. 심방세동 전극도자절제술의 가장 중요한 임상적 효과는 부정맥과 관련된 증상을 감소시키는 것이다[9,10,17,43,44]. 이러한 점은 최근 무작위 대조시험에서 입증되었는데, 약물 치료 그룹과 비교하여 전극도자절제술 그룹에서 삶의 질이 유의하게 높았고, 이는 심방세동 부담(burden) 감소로 인한 것이다[9]. 증상 개선 효과는 최근에 발표된 대규모 CABANA (Catheter ABlation vs. ANtiarrhythmic Drug Therapy for Atrial Fibrillation) 무작위 대조시험에서도 확인되었는데[10], 이 연구에서 심방세동 전극도자절제술 전략은 사망, 중증 뇌졸중, 심각한 출혈 또는 심정지 발생으로 이루어진 일차 목표를 약물 치료와 비교하여 유의하게 감소시키지 못하였다[17]. 반면, 가장 최근에 발표된 EAST-AFNET 4 (Early treatment of Atrial fibrillation for Stroke prevention Trial) 무작위 연구에 따르면 진단받은 지 1년 이내의 초기 심방세동 환자들을 대상 으로 적극적으로 율동 조절을 할 경우 일반적 치료와 비교하여 일차 목표인 심혈관계 사망, 뇌졸중 또는 심부전 악화 또는 급성 관동맥 증후군에 의한 입원이 유의하게 감소되었다[45]. 이 연구에서 조기 율동 조절 그룹은 항부정맥제 투여 또는 전극도자절제술을 통해 율동 조절을 하였고 절제술은 연구 2년 시점에 19.4%에서 시행되었다. 아직까지 ‘일반적인’ 심방세동 환자군에서 전극도자절제술이 총사망률, 뇌졸중 또는 주요 출혈을 유의하게 감소시킨다는 무작위 대조시험은 없는 상태이므로 전극도자절제술의 적응증은 증상 조절 이상으로 확대되기 어렵고, 무증상 환자에서는 일반적으로 추천되지 않는다. 다만, 진단받은 지 1년 이내의 조기 심방세동의 경우 무증상이더라도 좀 더 적극적으로 전극도자절제술을 포함하여 율동 조절을 고려해 볼 수 있겠다.
박출률저하심부전 환자군을 대상으로 시행된 두 개의 무작위 대조시험에서 심방세동 전극도자절제술은 총사망 및 입원을 감소시켰다[13,46]. 다만, 이 두 연구 중 CASTLE-AF (Catheter Ablation vs. Standard conventional Treatment in patients with LEft ventricular dysfunction and Atrial Fibrillation) 연구에서만 사망률 및 심부전 입원을 연구의 일차 종점으로 설정하였다[46]. 이 연구 결과를 일반화 가능한지에 대해 최근 대규모 심부전 환자군을 대상으로 평가가 진행되었는데, CASTLE-AF 연구 선정 기준을 만족한 환자는 소수에 불과하였지만(< 10%) 연구와 비슷한 절제술의 효과가 관찰되었다[47]. 더 진행된 박출률저하심부전 환자를 대상으로 소규모로 진행된 AMICA (Atrial Fibrillation Management in Congestive Heart Failure With Ablation) 무작위 대조시험에서는 1년 시점에서 심방세동 전극도자절제술의 효과를 보여주지 못하였으나, CABANA 하위그룹 분석 결과에서는 박출률저하심부전 환자에서 심방세동 전극도자절제술을 시행할 경우 연구의 일차 종점인 사망, 뇌졸중, 출혈 및 심정지 발생을 줄이고 사망률 또한 감소시킴을 보여주었다[48,49]. 최근에 결과가 발표된 RAFT-AF (Randomized Ablation-based atrial Fibrillation rhythm control versus rate control Trial in patients with heart failure and high burden Atrial Fibrillation) 무작위 대조시험에서는 좌심실 박출률이 저하되거나 보존된 심부전 환자 모두를 대상으로 심방세동 전극도자절제술의 효과를 평가하고자 하였다[50]. 그 결과 심방세동 전극도자절 제술 그룹은 심박수 조절 그룹과 비교할 때 일차 종점인 총사망 및 심부전 사건 발생을 유의하게 감소시키지는 못하였다. 다만, 절제술 그룹에서 일차 목표가 수치적으로 더 적었고(특히 박출률 ≤ 45% 경우), 좌심실 기능이 개선되었으며, 삶의 질도 개선되었다. 전반적으로 박출률저하심부전 환자에서 심방세동 전극도자절제술은 심박수 조절과 비교하여 동율동 유지율이 높고 및 좌심실박출률, 운동능력 그리고 삶의 질을 더 향상시킨다[13,46,51-59]. 따라서 박출률저하 심부전 환자에서 삶의 질 및 좌심실 기능을 개선시키고, 심부전 입원을 감소시키며 잠재적으로 사망률까지 감소시키기 위해[60] 절제술을 고려할 수 있다.
만약 심방세동 관련 빈맥유발심근병증(빠르고 비동기적이며 불규칙적인 심근 수축에 의한 심실 기능장애)이 강하게 의심될 경우 좌심실 기능 회복을 위해 심방세동 전극도자절제술이 추천된다[61-64].
일반적으로 절제술은 Class I 또는 III 항부정맥제 치료에 실패하거나 불내성을 보일 때 이차 치료로 추천된다. 이러한 지침은 약물 치료 실패 후 심방세동 전극도자절제술이 항부 정맥제와 비교할 때 부정맥 재발 또는 증상, 운동 능력 및 삶의 질 개선 측면에서 우월함을 입증한 여러 무작위 대조시험 결과에 바탕을 두고 있다[3-6,9-11,13,15-17,45,65,66].
항부정맥제 사용 전 심방세동 전극도자절제술을 고려하는 임상 시험 결과를 보면 동율동 유지에 있어 더 효과적이고, 경험 많은 센터에서 시행될 경우 합병증 발생도 수용할 수 있는 수준으로 보인다[7,8,16,67]. MANTRA-PAF (Medical ANtiarrhythmic Treatment or Radiofrequency Ablation in Paroxysmal Atrial Fibrillation) 연구의 5년 추적 결과에서 절제술군에서 항부정맥제 사용군과 비교하여 심방세동 부담은 유의하게 줄었으나 삶의 질 향상으로 이어지지는 않았으나[15], CAPTAF (Catheter Ablation compared with Pharmacological Therapy for Atrial Fibrillation) 연구에서는 Class I 및 III 항부 정맥제를 사용한 적 없던 심방세동 환자를 대상으로 절제술 군은 항부정맥제 사용군과 비교하여 심방세동 부담이 감소하였고 이는 삶의 질 향상으로 이어졌다[9]. 이러한 연구 결과들 및 환자의 선호도를 바탕으로 발작성 심방세동 환자들 에서 항부정맥제를 사용하기 전 심방세동 전극도자절제술은 고려될 수 있고(Class IIa), 재발의 위험이 낮은 지속성 심방 세동 환자들에서도 고려될 수 있겠다(Class IIb).
심방세동 전극도자절제술의 기본은 고주파 절제 카테터를 이용하여 폐정맥 주변에 여러 개의 병변을 만들거나 냉각 풍선과 같은 단일 샷 절제 장치를 사용하여 폐정맥을 전기적으로 완전히 고립시키는 것이다[3,5,6,11,14,42,44,66,68-77]. 불행히도 영구적인 폐정맥의 전기적 고립은 달성하기 어렵다. 폐정맥 재연결이 70% 이상에서 발생한다고 알려졌는데[75,78-87], 새로운 세대의 카테터 사용으로 재연결률은 상당히 낮아질 것으로 예상된다[88-90].
특히, 지속성 또는 장기간 지속성 심방세동에서는 광범위한 절제술이 필요하다. 여기에는 심방의 선형 절제술, 좌심방이 또는 상대정맥 고립, 복잡 분할 전기도(complex fractionated electrogram), 로터(rotors), 폐정맥 외 유발병소, 신경절의 절제술, MRI 또는 전압 지도를 통한 섬유화 부위 절제술 그리고 지배적 주파수 지점(high dominant frequency sites) 절제술이 포함된다[90-99]. 그러나 첫 시술에서 폐정맥 고립술 외 추가적인 절제술이 유익할 것인지에 대해서는 아직 정립 되지 않았다[68,69,72,100-118]. 무작위 대조시험 결과에 근거하면 폐정맥외 유발병소(특히 좌심방이)를 목표로 하거나 폐정맥 고립선 주변의 저전압 부위를 선택적으로 절제하는 것은 효과적일 것으로 추정된다[97,113]. 하대정맥-삼첨판 협부 (cavotricuspid isthmus, CTI) 의존 심방조동이 확인된 환자에서 심방세동 절제술을 시행할 때 우측 협부 절제술을 고려할수 있다[119-121]. 비-CTI 의존 심방빈맥의 경우 절제술 기법은 기저 메커니즘과 빈맥 유발병소 또는 회로에 따른다.
몇몇 무작위 대조시험 및 관찰 연구에서는 발작성 심방세동의 초기 시술로 고주파전극도자 절제술과 냉각풍선 절제술을 비교하였다[14,73,122-136]. 그 결과 두 기법 모두 전반적으로 부정맥-무발생 생존 및 합병증 발생 측면에서 비슷한 결과를 보였는데, 냉각풍선 절제술의 경우 시술 시간이 좀 더 짧고 조영 시간은 좀 더 긴 것으로 보고하였다[14,73,122-136]. 반면, 일부 연구에서는 냉각풍선 절제술의 경우 입원 기간이 줄어들고 합병증 발생률은 더 낮다고 보고하였다[130,137]. 어떠한 에너지원을 사용할 것인지는 기관의 가용성, 시술자 선호 및 경험 그리고 환자 선호도에 따르게 될 것이다. 절제술 과정을 단순화하고 결과를 개선시키기 위해 카테터 디자인 및 에너지원을 바꾸는 시도가 이루어지고 있는데, 현재의 지침을 바꾸기 위해서는 추가적인 증거가 필요한 상황이다.
전향적 등록 연구 결과를 보면 심방세동 전극도자절제술을 받은 환자의 대략 4-14%가량에서 합병증을 경험하고, 2-3%는잠재적으로 생명을 위협할 수 있는 것들이다[138,139]. 최근 발표된 CABANA 연구는 대부분 경험 많고 시술 건수가 많은 기관을 중심으로 참여하였는데, 합병증 발생률은 상기 범위의 하한 정도였다[17]. 합병증은 주로 시술 24시간 이내에 발생하는데, 일부는 1-2달 지나서 발생하기도 한다(Table 1) [138]. 시술 중 사망은 매우 드물고(< 0.2%) 보통 심낭 압전과 관련된다[138,140,141].
다수의 무작위 대조시험에서 항부정맥제와 다양한 기술 및 에너지원을 사용한 심방세동 전극도자절제술을 비교하였는데 일차 치료로서 또는 항부정맥제 실패 후 모두 전극도자절제술이 부정맥-무발생 생존 측면에서 우월하였다[2-6,8,11,12,14-16,42,65-67,97]. 그러나 많은 환자들에서 여러 차례 시술을 받아야 했고 뒤늦게 재발한 경우가 드물지 않았다[43,142-144].
전극도자절제술 후 심방세동 재발은 다양한 요소들의 복잡한 상호작용으로 발생한다. 이러한 요인에는 긴 심방세동 지속기간, 고령 그리고 좌심방 크기의 증가가 있고[19-22], 심장 외막 지방 조직과 같은 구조적 요인도 있으며[154,155], 전기적 또는 형태학적 마커로 확인된 심방 기질(substrate)의 존재를 들 수 있다[156]. 다양한 위험 예측 점수가 제시되었는데 이러한 점수 체계는 예측력이 중등도 정도에 그치고 있어 추가적인 개선이 필요할 것으로 보이며, 가장 강력한 예측인자 중 하나는 조기 재발한 심방세동으로 알려져 있다[27]. 심방세 동의 율동 조절 및 전극도자절제술 관련 권고는 표 3 에 정리 되어 있다.
Maze 수술은 심방세동의 수술적 치료 방법이다. 초기에 좌심방을 자르고 다시 꿰맸던 Maze 수술 방법은 여러 기기를 사용한 수술적 절제술로 발전되어 왔다[157-159]. 현재까지 200편 이상의 새로운 수술적 절제술 기법 발전에 관한 연구가 보고된 바 있다[160]. 그중 대부분은 후향적 연구이거나 관찰 연구지만 일부 무작위 대조시험이나 메타분석 연구도 함께 발표되었다[161-164]. 위 연구들에서 수술적 절제술 치료의 율동 조절 효과에 대해서는 뚜렷하게 관찰되었으나 삶의 질 향상, 뇌졸중, 사망률에 관한 긍정적 효과는 뚜렷이 관찰되지 않았다[163,165-167]. 단 1개의 무작위 대조시험에서 심방세동 수술 후 5년간 추적 관찰한 결과, 뇌졸중의 위험을 낮추고 동율동이 잘 유지되는 것을 확인하였지만 뇌졸중 발생에 관해 충분한 검증력을 갖춘 연구는 아니었다[164]. 대규모 레지스트리 연구에서 승모판 수술이나 관상동맥 우회술을 할 당시에 절제술을 함께 진행하였을 때 좀 더 좋은 생존율이 관찰되었다[168]. 환자의 치료 방향을 결정할 때는 심장 전문 흉부외과 의사와 부정맥 전문 내과의사가 서로 협업하여 결정하는 것이 가장 이상적인 방법이다(Table 4).
대부분의 관련 연구들은 승모판막 수술을 받는 환자들을 대상으로 연구가 진행되었다. 수술적인 폐정맥의 전기적 차단술은 동율동을 유지하는 데 효과적이지만[169], 가장 효과적인 치료 방법은 폐정맥과 좌심방 후벽을 함께 차단시키는 방법이다. 이를 위해 선형 절제술(linear ablation)이 필요하지만, 그로 인해 심장의 중요한 구조로의 전기 신호 전달이 방해를 받을 수 있다. 많은 연구 결과들이 Maze 수술에서 양극 고주파 클램프나 냉각절제를 권고하고 있다[170]. 발작성 심방세동이 아닌 환자들에서는 양쪽 심방을 치료하는 것이 좌심방만 치료하는 것보다 동율동 유지에 좀 더 효과적으로 보인다[162].
흉강경을 통한 고주파 절제술은 구조적 심질환이 없는 심방세동 환자에서 폐정맥과 좌심방 후벽의 절연 그리고 좌심방이 폐색을 목적으로 한다. 여러 연구에서 수술 이후에 리듬조절의 효과는 잘 입증되어 있으며, 일부 연구들은 삶의질 향상도 보고하고 있다[180,181,184-186]. 최근 3가지 무작위 대조시험을 메타분석한 연구에서 수술적 치료는 발적성/지속성 심방세동 환자에서 전극도자절제술에 비해 좀 더 좋은 율동 조절 효과를 보이고 재시술의 필요성도 낮은 것으로 보였다[187]. 심방세동 전극도자절제술의 실패할 위험이 높은 환자들을 대상으로 진행한 FAST 연구에서는 평균 7년을 추적 관찰하였을 때 고주파 전극도자절제술에 비해서 낮은 재발률을 보였다(56% vs. 87%) [185]. 하지만 일반적으로 수술적 치료는 입원 기간이 길고 합병증의 발생률이 높다[161]. 흉강경 심방세동 시술의 안정성에 대해 메타분석을 한 연구에 따르면 30일 내 합병증의 빈도가 11.3%로 보고되고 있고, 위 합병증들은 대부분 저절로 호전되었다. 한편, 다기관 레지스트리 분석에서는 합병증 발생률이 3.6%로 낮았다[188]. 무작위 대조시험에서는 흉강경을 이용한 심방세동 시술이 전극도자절제술에 비해 좀 더 좋은 율동 조절 효과를 보였지만 흉강경 시술은 좀 더 침습적이고, 합병증 발생의 위험이 높고, 입원 기간이 길다[165,189]. 전극도자절제술과 비교하여 위험 이득을 따졌을 때 흉강경 시술은 이전 전극도자절제 술이 실패한 경우나, 시술을 실패할 확률이 높은 환자들에게 우선적으로 권유하는 것이 합리적이다. 수술적 치료를 할 때 좌삼방이를 함께 제거하거나, 폐색시키는 것이 뇌졸중의 위험을 낮추는지에 대해서는 아직 뚜렷하지 않으며 그렇기 때문에 뇌졸중 위험에 따라 경구항응고제 치료를 수술 이후에도 유지해야 한다.
하이브리드 심방세동 시술은 심폐우회를 하지 않은 상태에서 최소 침습적으로 흉골절개를 하지 않고 심장의 외막에서 절제하는 수술적 치료와 심장 내막 쪽에서 시행하는 전극 도자절제술을 합친 방법이다. 수술적 치료 이후에 바로 이어서 전극도자절제술을 시행할 수도 있고, 수술 후 6개월 이내 시행할 수도 있다[190]. 아직까지 두 가지 방법을 비교한 연구는 아직 없다.
심방세동 절제술을 받는 환자에서 시술 전후 경구항응고제 관리에 있어 약간의 차이가 있겠으나, 최근들어 시술자들은 international normalized ratio 수치가 치료 범위 내에 있다는 가정하에 비타민K길항제 또는 NOAC 치료를 중단하지 않고 시술을 하는 방식을 취하고 있다. 항응고치료를 하지 않았던 환자들의 경우 절제술 3-4주 전부터 항응고치료를 시작하는 것을 고려할 수 있다(Table 5) [1].
12개의 연구 메타분석 결과 심방세동 전극도자절제술에서 무중단 non-vitamin K antagonist oral anticoagulant (NOAC)와비타민K길항제를 비교하였을 때 뇌졸중/일과성뇌허혈은 더 낮았고(NOAC, 0.08%; 비타민K길항제, 0.16%), 무증상 대뇌 색전 사건 발생은 비슷하였다(8.0% vs 9.6%) [194]. 반면, 주요 출혈은 비타민K길항제군과 비교하여(2%), 무중단 NOAC 군에서(0.9%) 유의하게 감소하였다[194].
시술 전후 NOAC과 와파린을 비교한 대규모 무작위 대조 시험(the RE-CIRCUIT trial [Randomized Evaluation of dabigatran etexilate Compared to warfarIn in pulmonaRy vein ablation: assessment of different peri-proCedUral antIcoagulation sTrategies]) 결과, 절제술 8주 이내 주요 출혈 발생률이 다비 가트란군에서 와파린 대비 유의하게 감소하였다(1.6% vs. 6.9%) [195]. 다른 무작위 대조시험들(리바록사반을 이용한 VENTURE-AF [196], 아픽사반을 사용한 AXAFA-AFNET 5 [197] 그리고 에독사반을 이용한 ELIMINATE-AF [198])에서도 무중단 NOAC과 와파린을 비교하였을 때 비슷한 사건 발생률을 보였다. 전체적으로 심방세동 전극도자절제술을 받는 환자들에서 시술 전후 무중단 NOAC 사용은 뇌졸중/일과 성뇌허혈 발생률은 낮았고, 무중단 비타민K길항제 사용과 비교하여 주요 출혈 발생도 유의하게 줄였다. 반면, 헤파린 브리징은 출혈 위험을 높이므로 피해야 하겠다.
심방세동 수술을 받은 모든 환자에서 절제술에 의한 내막 손상이 발생하기 때문에 수술 후 출혈 위험을 고려하여 가능한 빨리 경구항응고제를 투여할 것을 권장한다. 장기간 경구 항응고제 중단에 관한 무작위 대조시험은 없다. 오래 기간 추적한 비무작위 연구 결과에 따르면 수술 후 지속적으로 동율동인 환자에서 뇌졸중 발생이 적었으나, 좌심방이 절제를 하였더라도 심방세동인 환자들에서는 그렇지 않았다[159]. 따라서, 성공적으로 Maze 수술을 받았고 좌심방이 폐색술을 받았더라도 뇌졸중 위험이 있는 모든 환자에서 장기적인 경구항응고제 투여가 추천된다.
심방세동의 증상 조절을 위하여 율동 조절 치료를 할 수있다. 심방세동 전극도자절제술은 항부정맥제와 비교할 때부정맥 재발 또는 증상, 운동 능력 및 삶의 질 개선 측면에서 우월한 것으로 알려졌다. 따라서 유증상의 심방세동 환자에서 항부정맥제 치료에 실패하거나 불내성을 보일 경우 율동 조절을 위해 심방세동 전극도자절제술을 권고한다. 경우에 따라 심방세동 절제술은 율동 조절의 일차 치료로 고려할 수도 있다. 고주파 전극도자절제술과 냉각풍선 절제술의 성적은 비슷하고 합병증 발생 양상이 약간 다른데, 각 기관별로 이용 가능한 방법을 이용하여 절제술을 진행하면 된다. 심방 세동의 수술적 절제술 역시 효과적으로 심장 수술이 예정되어 있거나 전극도자절제술에 실패하였을 경우 고려할 수 있다. 이와 함께 시술 후 심방세동 재발 위험을 최소화하기 위해 체중 감량 및 운동 그리고 고혈압 및 수면무호흡증 등 기저질환 관리에도 신경 써야 하겠다. 마지막으로 심방세동 전극도자절제술이 예정되어 있을 경우 시술 전후 뇌졸중 발생 위험을 최소화하기 위해 와파린 또는 NOAC을 중단하지 않고 절제술을 시행할 것을 권고한다.
REFERENCES
1. Calkins H, Hindricks G, Cappato R, et al. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation: executive summary. Heart Rhythm 2017;14:e445–e494.


2. Nyong J, Amit G, Adler AJ, et al. Efficacy and safety of ablation for people with non-paroxysmal atrial fibrillation. Cochrane Database Syst Rev 2016;11:CD012088.


3. Jaïs P, Cauchemez B, Macle L, et al. Catheter ablation versus antiarrhythmic drugs for atrial fibrillation: the A4 study. Circulation 2008;118:2498–2505.


4. Oral H, Pappone C, Chugh A, et al. Circumferential pulmonary-vein ablation for chronic atrial fibrillation. N Engl J Med 2006;354:934–941.


5. Mont L, Bisbal F, Hernández-Madrid A, et al. Catheter ablation vs. antiarrhythmic drug treatment of persistent atrial fibrillation: a multicentre, randomized, controlled trial (SARA study). Eur Heart J 2014;35:501–507.


6. Wilber DJ, Pappone C, Neuzil P, et al. Comparison of antiarrhythmic drug therapy and radiofrequency catheter ablation in patients with paroxysmal atrial fibrillation: a randomized controlled trial. JAMA 2010;303:333–340.


7. Morillo CA, Verma A, Connolly SJ, et al. Radiofrequency ablation vs antiarrhythmic drugs as first-line treatment of paroxysmal atrial fibrillation (RAAFT-2): a randomized trial. JAMA 2014;311:692–700.


8. Cosedis Nielsen J, Johannessen A, Raatikainen P, et al. Radiofrequency ablation as initial therapy in paroxysmal atrial fibrillation. N Engl J Med 2012;367:1587–1595.


9. Blomström-Lundqvist C, Gizurarson S, Schwieler J, et al. Effect of catheter ablation vs antiarrhythmic medication on quality of life in patients with atrial fibrillation: the CAPTAF randomized clinical trial. JAMA 2019;321:1059–1068.



10. Mark DB, Anstrom KJ, Sheng S, et al. Effect of catheter ablation vs medical therapy on quality of life among patients with atrial fibrillation: the CABANA randomized clinical trial. JAMA 2019;321:1275–1285.



11. Packer DL, Kowal RC, Wheelan KR, et al. Cryoballoon ablation of pulmonary veins for paroxysmal atrial fibrillation: first results of the North American Arctic Front (STOP AF) pivotal trial. J Am Coll Cardiol 2013;61:1713–1723.


12. Ganesan AN, Shipp NJ, Brooks AG, et al. Long-term outcomes of catheter ablation of atrial fibrillation: a systematic review and meta-analysis. J Am Heart Assoc 2013;2:e004549.



13. Di Biase L, Mohanty P, Mohanty S, et al. Ablation versus amiodarone for treatment of persistent atrial fibrillation in patients with congestive heart failure and an implanted device: results from the AATAC multicenter randomized trial. Circulation 2016;133:1637–1644.

14. Kuck KH, Brugada J, Fürnkranz A, et al. Cryoballoon or radiofrequency ablation for paroxysmal atrial fibrillation. N Engl J Med 2016;374:2235–2245.


15. Nielsen JC, Johannessen A, Raatikainen P, et al. Long-term efficacy of catheter ablation as first-line therapy for paroxysmal atrial fibrillation: 5-year outcome in a randomised clinical trial. Heart 2017;103:368–376.


16. Hakalahti A, Biancari F, Nielsen JC, Raatikainen MJ. Radiofrequency ablation vs. antiarrhythmic drug therapy as first line treatment of symptomatic atrial fibrillation: systematic review and meta-analysis. Europace 2015;17:370–378.


17. Packer DL, Mark DB, Robb RA, et al. Effect of catheter ablation vs antiarrhythmic drug therapy on mortality, stroke, bleeding, and cardiac arrest among patients with atrial fibrillation: the CABANA randomized clinical trial. JAMA 2019;321:1261–1274.


18. Noseworthy PA, Gersh BJ, Kent DM, et al. Atrial fibrillation ablation in practice: assessing CABANA generalizability. Eur Heart J 2019;40:1257–1264.



19. Teh AW, Kistler PM, Lee G, et al. Electroanatomic remodeling of the left atrium in paroxysmal and persistent atrial fibrillation patients without structural heart disease. J Cardiovasc Electrophysiol 2012;23:232–238.


20. D'Ascenzo F, Corleto A, Biondi-Zoccai G, et al. Which are the most reliable predictors of recurrence of atrial fibrillation after transcatheter ablation?: a meta-analysis. Int J Cardiol 2013;167:1984–1989.


21. Berruezo A, Tamborero D, Mont L, et al. Pre-procedural predictors of atrial fibrillation recurrence after circumferential pulmonary vein ablation. Eur Heart J 2007;28:836–841.


22. Njoku A, Kannabhiran M, Arora R, et al. Left atrial volume predicts atrial fibrillation recurrence after radiofrequency ablation: a meta-analysis. Europace 2018;20:33–42.


23. Marrouche NF, Wilber D, Hindricks G, et al. Association of atrial tissue fibrosis identified by delayed enhancement MRI and atrial fibrillation catheter ablation: the DECAAF study. JAMA 2014;311:498–506.


24. Deng H, Bai Y, Shantsila A, Fauchier L, Potpara TS, Lip GYH. Clinical scores for outcomes of rhythm control or arrhythmia progression in patients with atrial fibrillation: a systematic review. Clin Res Cardiol 2017;106:813–823.



25. Kosich F, Schumacher K, Potpara T, Lip GY, Hindricks G, Kornej J. Clinical scores used for the prediction of negative events in patients undergoing catheter ablation for atrial fibrillation. Clin Cardiol 2019;42:320–329.



26. Kornej J, Hindricks G, Shoemaker MB, et al. The APPLE score: a novel and simple score for the prediction of rhythm outcomes after catheter ablation of atrial fibrillation. Clin Res Cardiol 2015;104:871–876.



27. Kornej J, Schumacher K, Dinov B, et al. Prediction of electro-anatomical substrate and arrhythmia recurrences using APPLE, DR-FLASH and MB-LATER scores in patients with atrial fibrillation undergoing catheter ablation. Sci Rep 2018;8:12686.



28. Kosiuk J, Dinov B, Kornej J, et al. Prospective, multicenter validation of a clinical risk score for left atrial arrhythmogenic substrate based on voltage analysis: DR-FLASH score. Heart Rhythm 2015;12:2207–2212.


29. Mujović N, Marinković M, Marković N, Shantsila A, Lip GY, Potpara TS. Prediction of very late arrhythmia recurrence after radiofrequency catheter ablation of atrial fibrillation: the MB-LATER clinical score. Sci Rep 2017;7:40828.



30. Mesquita J, Ferreira AM, Cavaco D, et al. Development and validation of a risk score for predicting atrial fibrillation recurrence after a first catheter ablation procedure - ATLAS score. Europace 2018;20:f428–f435.


31. Winkle RA, Jarman JW, Mead RH, et al. Predicting atrial fibrillation ablation outcome: the CAAP-AF score. Heart Rhythm 2016;13:2119–2125.


32. Pathak RK, Middeldorp ME, Lau DH, et al. Aggressive risk factor reduction study for atrial fibrillation and implications for the outcome of ablation: the ARREST-AF cohort study. J Am Coll Cardiol 2014;64:2222–2231.


33. Trines SA, Stabile G, Arbelo E, et al. Influence of risk factors in the ESC-EHRA EORP atrial fibrillation ablation long-term registry. Pacing Clin Electrophysiol 2019;42:1365–1373.


34. Wong CX, Sullivan T, Sun MT, et al. Obesity and the risk of incident, post-operative, and post-ablation atrial fibrillation: a meta-analysis of 626,603 individuals in 51 studies. JACC Clin Electrophysiol 2015;1:139–152.


35. Santoro F, Di Biase L, Trivedi C, et al. Impact of uncontrolled hypertension on atrial fibrillation ablation outcome. JACC Clin Electrophysiol 2015;1:164–173.


36. Jongnarangsin K, Chugh A, Good E, et al. Body mass index, obstructive sleep apnea, and outcomes of catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol 2008;19:668–672.


37. Patel D, Mohanty P, Di Biase L, et al. Safety and efficacy of pulmonary vein antral isolation in patients with obstructive sleep apnea: the impact of continuous positive airway pressure. Circ Arrhythm Electrophysiol 2010;3:445–451.


38. Matiello M, Nadal M, Tamborero D, et al. Low efficacy of atrial fibrillation ablation in severe obstructive sleep apnoea patients. Europace 2010;12:1084–1089.


39. Chilukuri K, Dalal D, Gadrey S, et al. A prospective study evaluating the role of obesity and obstructive sleep apnea for outcomes after catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol 2010;21:521–525.


40. Naruse Y, Tada H, Satoh M, et al. Concomitant obstructive sleep apnea increases the recurrence of atrial fibrillation following radiofrequency catheter ablation of atrial fibrillation: clinical impact of continuous positive airway pressure therapy. Heart Rhythm 2013;10:331–337.


41. Li L, Wang ZW, Li J, et al. Efficacy of catheter ablation of atrial fibrillation in patients with obstructive sleep apnoea with and without continuous positive airway pressure treatment: a meta-analysis of observational studies. Europace 2014;16:1309–1314.


42. Calkins H, Reynolds MR, Spector P, et al. Treatment of atrial fibrillation with antiarrhythmic drugs or radiofrequency ablation: two systematic literature reviews and meta-analyses. Circ Arrhythm Electrophysiol 2009;2:349–361.


43. Wokhlu A, Monahan KH, Hodge DO, et al. Long-term quality of life after ablation of atrial fibrillation the impact of recurrence, symptom relief, and placebo effect. J Am Coll Cardiol 2010;55:2308–2316.

44. Reddy VY, Dukkipati SR, Neuzil P, et al. Randomized, controlled trial of the safety and effectiveness of a contact force-sensing irrigated catheter for ablation of paroxysmal atrial fibrillation: results of the TactiCath Contact Force Ablation Catheter Study for Atrial Fibrillation (TOCCASTAR) study. Circulation 2015;132:907–915.


45. Kirchhof P, Camm AJ, Goette A, et al. Early rhythm-control therapy in patients with atrial fibrillation. N Engl J Med 2020;383:1305–1316.


46. Marrouche NF, Brachmann J, Andresen D, et al. Catheter ablation for atrial fibrillation with heart failure. N Engl J Med 2018;378:417–427.


47. Noseworthy PA, Van Houten HK, Gersh BJ, et al. Generalizability of the CASTLE-AF trial: catheter ablation for patients with atrial fibrillation and heart failure in routine practice. Heart Rhythm 2020;17:1057–1065.



48. Kuck KH, Merkely B, Zahn R, et al. Catheter ablation versus best medical therapy in patients with persistent atrial fibrillation and congestive heart failure: the randomized AMICA trial. Circ Arrhythm Electrophysiol 2019;12:e007731.

49. Packer DL, Piccini JP, Monahan KH, et al. Ablation versus drug therapy for atrial fibrillation in heart failure: results from the CABANA trial. Circulation 2021;143:1377–1390.


50. Kumbhani DJ. A Randomized Ablation-based atrial Fibrillation rhythm control versus rate control Trial in patients with heart failure and high burden Atrial Fibrillation - RAFT-AF [Internet]. Washington (DC): American College of Cardiology, c2021 [cited 2021 Jul 13]. Available from: https://www.acc.org/latest-in-cardiology/clinical-trials/2021/05/14/23/50/raft-af
51. Khan MN, Jaïs P, Cummings J, et al. Pulmonary-vein isolation for atrial fibrillation in patients with heart failure. N Engl J Med 2008;359:1778–1785.


52. MacDonald MR, Connelly DT, Hawkins NM, et al. Radiofrequency ablation for persistent atrial fibrillation in patients with advanced heart failure and severe left ventricular systolic dysfunction: a randomised controlled trial. Heart 2011;97:740–747.


53. Jones DG, Haldar SK, Hussain W, et al. A randomized trial to assess catheter ablation versus rate control in the management of persistent atrial fibrillation in heart failure. J Am Coll Cardiol 2013;61:1894–1903.


54. Hunter RJ, Berriman TJ, Diab I, et al. A randomized controlled trial of catheter ablation versus medical treatment of atrial fibrillation in heart failure (the CAMTAF trial). Circ Arrhythm Electrophysiol 2014;7:31–38.


55. Al Halabi S, Qintar M, Hussein A, et al. Catheter ablation for atrial fibrillation in heart failure patients: a meta-analysis of randomized controlled trials. JACC Clin Electrophysiol 2015;1:200–209.


56. Prabhu S, Taylor AJ, Costello BT, et al. Catheter ablation versus medical rate control in atrial fibrillation and systolic dysfunction: the CAMERA-MRI study. J Am Coll Cardiol 2017;70:1949–1961.

57. Elgendy AY, Mahmoud AN, Khan MS, et al. Meta-analysis comparing catheter-guided ablation versus conventional medical therapy for patients with atrial fibrillation and heart failure with reduced ejection fraction. Am J Cardiol 2018;122:806–813.


58. Ma Y, Bai F, Qin F, et al. Catheter ablation for treatment of patients with atrial fibrillation and heart failure: a meta-analysis of randomized controlled trials. BMC Cardiovasc Disord 2018;18:165.



59. Khan SU, Rahman H, Talluri S, Kaluski E. The clinical benefits and mortality reduction associated with catheter ablation in subjects with atrial fibrillation: a systematic review and meta-analysis. JACC Clin Electrophysiol 2018;4:626–635.


60. Yang PS, Sung JH, Jang E, et al. Catheter ablation improves mortality and other outcomes in real-world patients with atrial fibrillation. J Am Heart Assoc 2020;9:e015740.



61. Martin CA, Lambiase PD. Pathophysiology, diagnosis and treatment of tachycardiomyopathy. Heart 2017;103:1543–1552.


62. Brembilla-Perrot B, Ferreira JP, Manenti V, et al. Predictors and prognostic significance of tachycardiomyopathy: insights from a cohort of 1269 patients undergoing atrial flutter ablation. Eur J Heart Fail 2016;18:394–401.


63. Dagres N, Varounis C, Gaspar T, et al. Catheter ablation for atrial fibrillation in patients with left ventricular systolic dysfunction. A systematic review and meta-analysis. J Card Fail 2011;17:964–970.


64. Prabhu S, Costello BT, Taylor AJ, et al. Regression of diffuse ventricular fibrosis following restoration of sinus rhythm with catheter ablation in patients with atrial fibrillation and systolic dysfunction: a substudy of the CAMERA MRI trial. JACC Clin Electrophysiol 2018;4:999–1007.


65. Stabile G, Bertaglia E, Senatore G, et al. Catheter ablation treatment in patients with drug-refractory atrial fibrillation: a prospective, multi-centre, randomized, controlled study (Catheter Ablation For The Cure Of Atrial Fibrillation Study). Eur Heart J 2006;27:216–221.


66. Pappone C, Augello G, Sala S, et al. A randomized trial of circumferential pulmonary vein ablation versus antiarrhythmic drug therapy in paroxysmal atrial fibrillation: the APAF Study. J Am Coll Cardiol 2006;48:2340–2347.


67. Wazni OM, Marrouche NF, Martin DO, et al. Radiofrequency ablation vs antiarrhythmic drugs as first-line treatment of symptomatic atrial fibrillation: a randomized trial. JAMA 2005;293:2634–2640.


68. Lee JM, Shim J, Park J, et al. The electrical isolation of the left atrial posterior wall in catheter ablation of persistent atrial fibrillation. JACC Clin Electrophysiol 2019;5:1253–1261.


69. Pak HN, Park J, Park JW, et al. Electrical posterior box isolation in persistent atrial fibrillation changed to paroxysmal atrial fibrillation: a multicenter, prospective, randomized study. Circ Arrhythm Electrophysiol 2020;13:e008531.


70. Natale A, Reddy VY, Monir G, et al. Paroxysmal AF catheter ablation with a contact force sensing catheter: results of the prospective, multicenter SMART-AF trial. J Am Coll Cardiol 2014;64:647–656.

71. McLellan AJ, Ling LH, Azzopardi S, et al. A minimal or maximal ablation strategy to achieve pulmonary vein isolation for paroxysmal atrial fibrillation: a prospective multi-centre randomized controlled trial (the minimax study). Eur Heart J 2015;36:1812–1821.


72. Verma A, Jiang CY, Betts TR, et al. Approaches to catheter ablation for persistent atrial fibrillation. N Engl J Med 2015;372:1812–1822.


73. Luik A, Radzewitz A, Kieser M, et al. Cryoballoon versus open irrigated radiofrequency ablation in patients with paroxysmal atrial fibrillation: the prospective, randomized, controlled, noninferiority freezeAF study. Circulation 2015;132:1311–1319.



74. Dukkipati SR, Cuoco F, Kutinsky I, et al. Pulmonary vein isolation using the visually guided laser balloon: a prospective, multicenter, and randomized comparison to standard radiofrequency ablation. J Am Coll Cardiol 2015;66:1350–1360.

75. Kuck KH, Hoffmann BA, Ernst S, et al. Impact of complete versus incomplete circumferential lines around the pulmonary veins during catheter ablation of paroxysmal atrial fibrillation: results from the gap-atrial fibrillation-German atrial fibrillation competence network 1 trial. Circ Arrhythm Electrophysiol 2016;9:e003337.

76. Nery PB, Belliveau D, Nair GM, et al. Relationship between pulmonary vein reconnection and atrial fibrillation recurrence: a systematic review and meta-analysis. JACC Clin Electrophysiol 2016;2:474–483.


77. Bassiouny M, Saliba W, Hussein A, et al. Randomized study of persistent atrial fibrillation ablation: ablate in sinus rhythm versus ablate complex-fractionated atrial electrograms in atrial fibrillation. Circ Arrhythm Electrophysiol 2016;9:e003596.

78. Nanthakumar K, Plumb VJ, Epstein AE, Veenhuyzen GD, Link D, Kay GN. Resumption of electrical conduction in previously isolated pulmonary veins: rationale for a different strategy? Circulation 2004;109:1226–1229.


79. Verma A, Kilicaslan F, Pisano E, et al. Response of atrial fibrillation to pulmonary vein antrum isolation is directly related to resumption and delay of pulmonary vein conduction. Circulation 2005;112:627–635.


80. Ouyang F, Antz M, Ernst S, et al. Recovered pulmonary vein conduction as a dominant factor for recurrent atrial tachyarrhythmias after complete circular isolation of the pulmonary veins: lessons from double Lasso technique. Circulation 2005;111:127–135.


81. Cheema A, Dong J, Dalal D, et al. Incidence and time course of early recovery of pulmonary vein conduction after catheter ablation of atrial fibrillation. J Cardiovasc Electrophysiol 2007;18:387–391.


82. Pratola C, Baldo E, Notarstefano P, Toselli T, Ferrari R. Radiofrequency ablation of atrial fibrillation: is the persistence of all intraprocedural targets necessary for long-term maintenance of sinus rhythm? Circulation 2008;117:136–143.


83. Rajappan K, Kistler PM, Earley MJ, et al. Acute and chronic pulmonary vein reconnection after atrial fibrillation ablation: a prospective characterization of anatomical sites. Pacing Clin Electrophysiol 2008;31:1598–1605.


84. Bänsch D, Bittkau J, Schneider R, et al. Circumferential pul- monary vein isolation: wait or stop early after initial successful pulmonary vein isolation? Europace 2013;15:183–188.


85. Nakamura K, Naito S, Kaseno K, et al. Optimal observation time after completion of circumferential pulmonary vein isolation for atrial fibrillation to prevent chronic pulmonary vein reconnections. Int J Cardiol 2013;168:5300–5310.


86. Neuzil P, Reddy VY, Kautzner J, et al. Electrical reconnection after pulmonary vein isolation is contingent on contact force during initial treatment: results from the EFFICAS I study. Circ Arrhythm Electrophysiol 2013;6:327–333.


87. Kim TH, Park J, Uhm JS, Joung B, Lee MH, Pak HN. Pulmonary vein reconnection predicts good clinical outcome after second catheter ablation for atrial fibrillation. Europace 2017;19:961–967.


88. Bordignon S, Fürnkranz A, Perrotta L, et al. High rate of durable pulmonary vein isolation after second-generation cryoballoon ablation: analysis of repeat procedures. Europace 2015;17:725–731.


89. Ullah W, McLean A, Tayebjee MH, et al. Randomized trial comparing pulmonary vein isolation using the SmartTouch catheter with or without real-time contact force data. Heart Rhythm 2016;13:1761–1767.


90. Phlips T, Taghji P, El Haddad M, et al. Improving procedural and one-year outcome after contact force-guided pulmonary vein isolation: the role of interlesion distance, ablation index, and contact force variability in the 'CLOSE'-protocol. Europace 2018;20:f419–f427.


91. Shah D, Haissaguerre M, Jais P, Hocini M. Nonpulmonary vein foci: do they exist? Pacing Clin Electrophysiol 2003;26:1631–1635.


92. Nademanee K, McKenzie J, Kosar E, et al. A new approach for catheter ablation of atrial fibrillation: mapping of the electrophysiologic substrate. J Am Coll Cardiol 2004;43:2044–2053.


93. Haïssaguerre M, Hocini M, Sanders P, et al. Catheter ablation of long-lasting persistent atrial fibrillation: clinical outcome and mechanisms of subsequent arrhythmias. J Cardiovasc Electrophysiol 2005;16:1138–1147.


94. Haïssaguerre M, Sanders P, Hocini M, et al. Catheter ablation of long-lasting persistent atrial fibrillation: critical structures for termination. J Cardiovasc Electrophysiol 2005;16:1125–1137.


95. Atienza F, Almendral J, Jalife J, et al. Real-time dominant frequency mapping and ablation of dominant frequency sites in atrial fibrillation with left-to-right frequency gradients predicts long-term maintenance of sinus rhythm. Heart Rhythm 2009;6:33–40.


96. Stavrakis S, Nakagawa H, Po SS, Scherlag BJ, Lazzara R, Jackman WM. The role of the autonomic ganglia in atrial fibrillation. JACC Clin Electrophysiol 2015;1:1–13.



97. Di Biase L, Burkhardt JD, Mohanty P, et al. Left atrial appendage isolation in patients with longstanding persistent AF undergoing catheter ablation: BELIEF trial. J Am Coll Cardiol 2016;68:1929–1940.


98. Gianni C, Mohanty S, Di Biase L, et al. Acute and early outcomes of focal impulse and rotor modulation (FIRM)-guided rotors-only ablation in patients with nonparoxysmal atrial fibrillation. Heart Rhythm 2016;13:830–835.


99. Santangeli P, Zado ES, Hutchinson MD, et al. Prevalence and distribution of focal triggers in persistent and long-standing persistent atrial fibrillation. Heart Rhythm 2016;13:374–382.


100. Katritsis DG, Pokushalov E, Romanov A, et al. Autonomic denervation added to pulmonary vein isolation for paroxysmal atrial fibrillation: a randomized clinical trial. J Am Coll Cardiol 2013;62:2318–2325.


101. Arbelo E, Guiu E, Ramos P, et al. Benefit of left atrial roof linear ablation in paroxysmal atrial fibrillation: a prospective, randomized study. J Am Heart Assoc 2014;3:e000877.



102. Da Costa A, Levallois M, Romeyer-Bouchard C, Bisch L, Gate-Martinet A, Isaaz K. Remote-controlled magnetic pulmonary vein isolation combined with superior vena cava isolation for paroxysmal atrial fibrillation: a prospective randomized study. Arch Cardiovasc Dis 2015;108:163–171.


103. Wong KC, Paisey JR, Sopher M, et al. No benefit of complex fractionated atrial electrogram ablation in addition to circumferential pulmonary vein ablation and linear ablation: benefit of complex ablation study. Circ Arrhythm Electrophysiol 2015;8:1316–1324.


104. Vogler J, Willems S, Sultan A, et al. Pulmonary vein isolation versus defragmentation: the CHASE-AF clinical trial. J Am Coll Cardiol 2015;66:2743–2752.

105. Faustino M, Pizzi C, Agricola T, et al. Stepwise ablation approach versus pulmonary vein isolation in patients with paroxysmal atrial fibrillation: Randomized controlled trial. Heart Rhythm 2015;12:1907–1915.


106. Scott PA, Silberbauer J, Murgatroyd FD. The impact of adjunctive complex fractionated atrial electrogram ablation and linear lesions on outcomes in persistent atrial fibrillation: a meta-analysis. Europace 2016;18:359–367.


107. Driessen AHG, Berger WR, Krul SPJ, et al. Ganglion plexus ablation in advanced atrial fibrillation: the AFACT study. J Am Coll Cardiol 2016;68:1155–1165.

108. Wynn GJ, Panikker S, Morgan M, et al. Biatrial linear ablation in sustained nonpermanent AF: results of the substrate modification with ablation and antiarrhythmic drugs in nonpermanent atrial fibrillation (SMAN-PAF) trial. Heart Rhythm 2016;13:399–406.


109. Zhang Z, Letsas KP, Zhang N, et al. Linear ablation following pulmonary vein isolation in patients with atrial fi- brillation: a meta-analysis. Pacing Clin Electrophysiol 2016;39:623–630.


110. Fink T, Schlüter M, Heeger CH, et al. Stand-alone pulmonary vein isolation versus pulmonary vein isolation with additional substrate modification as index ablation procedures in patients with persistent and long-standing persistent atrial fibrillation: the randomized alster-lost-AF Trial (ablation at St. Georg Hospital for long-standing persistent atrial fibrillation). Circ Arrhythm Electrophysiol 2017;10:e005114.

111. Kim TH, Uhm JS, Kim JY, Joung B, Lee MH, Pak HN. Does additional electrogram-guided ablation after linear ablation reduce recurrence after catheter ablation for longstanding persistent atrial fibrillation? A prospective randomized study. J Am Heart Assoc 2017;6:e004811.



112. Lee KN, Roh SY, Baek YS, et al. Long-term clinical comparison of procedural end points after pulmonary vein isolation in paroxysmal atrial fibrillation: elimination of non-pulmonary vein triggers versus noninducibility. Circ Arrhythm Electrophysiol 2018;11:e005019.

113. Kircher S, Arya A, Altmann D, et al. Individually tailored vs. standardized substrate modification during radio-frequency catheter ablation for atrial fibrillation: a randomized study. Europace 2018;20:1766–1775.


114. Ammar-Busch S, Bourier F, Reents T, et al. Ablation of complex fractionated electrograms with or without ADditional LINEar lesions for persistent atrial fibrillation (The ADLINE Trial). J Cardiovasc Electrophysiol 2017;28:636–641.


115. Blandino A, Bianchi F, Grossi S, et al. Left atrial substrate modification targeting low-voltage areas for catheter ablation of atrial fibrillation: a systematic review and meta-analysis. Pacing Clin Electrophysiol 2017;40:199–212.


116. Yang B, Jiang C, Lin Y, et al. STABLE-SR (electrophysiological substrate ablation in the left atrium during sinus rhythm) for the treatment of nonparoxysmal atrial fibrillation: a prospective, multicenter randomized clinical trial. Circ Arrhythm Electrophysiol 2017;10:e005405.

117. Yu HT, Shim J, Park J, et al. Pulmonary vein isolation alone versus additional linear ablation in patients with persistent atrial fibrillation converted to paroxysmal type with antiarrhythmic drug therapy: a multicenter, prospective, randomized study. Circ Arrhythm Electrophysiol 2017;10:e004915.

118. Wang YL, Liu X, Zhang Y, et al. Optimal endpoint for catheter ablation of longstanding persistent atrial fibrillation: a randomized clinical trial. Pacing Clin Electrophysiol 2018;41:172–178.


119. Pérez FJ, Schubert CM, Parvez B, Pathak V, Ellenbogen KA, Wood MA. Long-term outcomes after catheter ablation of cavo-tricuspid isthmus dependent atrial flutter: a meta-analysis. Circ Arrhythm Electrophysiol 2009;2:393–401.

120. Natale A, Newby KH, Pisanó E, et al. Prospective randomized comparison of antiarrhythmic therapy versus first-line radiofrequency ablation in patients with atrial flutter. J Am Coll Cardiol 2000;35:1898–1904.


121. Wazni O, Marrouche NF, Martin DO, et al. Randomized study comparing combined pulmonary vein-left atrial junction disconnection and cavotricuspid isthmus ablation versus pulmonary vein-left atrial junction disconnection alone in patients presenting with typical atrial flutter and atrial fibrillation. Circulation 2003;108:2479–2483.


122. Neumann T, Kuniss M, Conradi G, et al. MEDAFI-Trial (micro-embolization during ablation of atrial fibrillation): comparison of pulmonary vein isolation using cryoballoon technique vs. radiofrequency energy. Europace 2011;13:37–44.


123. Herrera Siklódy C, Deneke T, Hocini M, et al. Incidence of asymptomatic intracranial embolic events after pulmonary vein isolation: comparison of different atrial fibrillation ablation technologies in a multicenter study. J Am Coll Cardiol 2011;58:681–688.


124. Schmidt M, Dorwarth U, Andresen D, et al. Cryoballoon versus RF ablation in paroxysmal atrial fibrillation: results from the German Ablation Registry. J Cardiovasc Electrophysiol 2014;25:1–7.


125. Pérez-Castellano N, Fernández-Cavazos R, Moreno J, et al. The COR trial: a randomized study with continuous rhythm monitoring to compare the efficacy of cryoenergy and radiofrequency for pulmonary vein isolation. Heart Rhythm 2014;11:8–14.


126. Hunter RJ, Baker V, Finlay MC, et al. Point-by-point radiofrequency ablation versus the cryoballoon or a novel combined approach: a randomized trial comparing 3 methods of pulmonary vein isolation for paroxysmal atrial fibrillation (The Cryo Versus RF Trial). J Cardiovasc Electrophysiol 2015;26:1307–1314.


127. Squara F, Zhao A, Marijon E, et al. Comparison between radiofrequency with contact force-sensing and second-generation cryoballoon for paroxysmal atrial fibrillation catheter ablation: a multicentre European evaluation. Europace 2015;17:718–724.


128. Straube F, Dorwarth U, Ammar-Busch S, et al. First-line catheter ablation of paroxysmal atrial fibrillation: outcome of radiofrequency vs. cryoballoon pulmonary vein isolation. Europace 2016;18:368–375.


129. Schmidt M, Dorwarth U, Andresen D, et al. German ablation registry: cryoballoon vs. radiofrequency ablation in paroxysmal atrial fibrillation--one-year outcome data. Heart Rhythm 2016;13:836–844.


130. Kuck KH, Fürnkranz A, Chun KR, et al. Cryoballoon or radiofrequency ablation for symptomatic paroxysmal atrial fibrillation: reintervention, rehospitalization, and qual- ity-of-life outcomes in the FIRE AND ICE trial. Eur Heart J 2016;37:2858–2865.



131. Buist TJ, Adiyaman A, Smit JJJ, Ramdat Misier AR, Elvan A. Arrhythmia-free survival and pulmonary vein reconnection patterns after second-generation cryoballoon and contact-force radiofrequency pulmonary vein isolation. Clin Res Cardiol 2018;107:498–506.


132. Mörtsell D, Arbelo E, Dagres N, et al. Cryoballoon vs. radiofrequency ablation for atrial fibrillation: a study of outcome and safety based on the ESC-EHRA atrial fibrillation ablation long-term registry and the Swedish catheter ablation registry. Europace 2019;21:581–589.


133. Akkaya E, Berkowitsch A, Zaltsberg S, et al. Ice or fire? Comparison of second-generation cryoballoon ablation and radiofrequency ablation in patients with symptomatic persistent atrial fibrillation and an enlarged left atrium. J Cardiovasc Electrophysiol 2018;29:375–384.


134. Murray MI, Arnold A, Younis M, Varghese S, Zeiher AM. Cryoballoon versus radiofrequency ablation for paroxysmal atrial fibrillation: a meta-analysis of randomized controlled trials. Clin Res Cardiol 2018;107:658–669.


135. Buiatti A, von Olshausen G, Barthel P, et al. Cryoballoon vs. radiofrequency ablation for paroxysmal atrial fibrillation: an updated meta-analysis of randomized and observational studies. Europace 2017;19:378–384.


136. Kabunga P, Phan K, Ha H, Sy RW. Meta-analysis of contemporary atrial fibrillation ablation strategies: irrigated radiofrequency versus duty-cycled phased radiofrequency versus cryoballoon ablation. JACC Clin Electrophysiol 2016;2:377–390.

137. Bollmann A, Ueberham L, Schuler E, et al. Cardiac tamponade in catheter ablation of atrial fibrillation: German-wide analysis of 21 141 procedures in the Helios atrial fibrillation ablation registry (SAFER). Europace 2018;20:1944–1951.


138. Arbelo E, Brugada J, Blomström-Lundqvist C, et al. Contemporary management of patients undergoing atrial fibrillation ablation: in-hospital and 1-year follow-up findings from the ESC-EHRA atrial fibrillation ablation long-term registry. Eur Heart J 2017;38:1303–1316.


139. Steinbeck G, Sinner MF, Lutz M, Müller-Nurasyid M, Kääb S, Reinecke H. Incidence of complications related to catheter ablation of atrial fibrillation and atrial flutter: a nationwide in-hospital analysis of administrative data for Germany in 2014. Eur Heart J 2018;39:4020–4029.



140. Deshmukh A, Patel NJ, Pant S, et al. In-hospital complications associated with catheter ablation of atrial fibrillation in the United States between 2000 and 2010: analysis of 93 801 procedures. Circulation 2013;128:2104–2112.


141. Tripathi B, Arora S, Kumar V, et al. Temporal trends of in-hospital complications associated with catheter ablation of atrial fibrillation in the United States: an update from Nationwide Inpatient Sample database (2011-2014). J Cardiovasc Electrophysiol 2018;29:715–724.


142. Gaita F, Scaglione M, Battaglia A, et al. Very long-term outcome following transcatheter ablation of atrial fibrillation. Are results maintained after 10 years of follow up? Europace 2018;20:443–450.


143. Ouyang F, Tilz R, Chun J, et al. Long-term results of catheter ablation in paroxysmal atrial fibrillation: lessons from a 5-year follow-up. Circulation 2010;122:2368–2377.


144. Weerasooriya R, Khairy P, Litalien J, et al. Catheter ablation for atrial fibrillation: are results maintained at 5 years of follow-up? J Am Coll Cardiol 2011;57:160–166.

145. Siontis KC, Ioannidis JPA, Katritsis GD, et al. Radiofrequency ablation versus antiarrhythmic drug therapy for atrial fibrillation: meta-analysis of quality of life, morbidity, and mortality. JACC Clin Electrophysiol 2016;2:170–180.


146. Kim YG, Shim J, Choi JI, Kim YH. Radiofrequency catheter ablation improves the quality of life measured with a short form-36 questionnaire in atrial fibrillation patients: a systematic review and meta-analysis. PLoS One 2016;11:e0163755.



147. Walfridsson H, Walfridsson U, Nielsen JC, et al. Radiofrequency ablation as initial therapy in paroxysmal atrial fibrillation: results on health-related quality of life and symptom burden. The MANTRA-PAF trial. Europace 2015;17:215–221.


148. Wong CX, Abed HS, Molaee P, et al. Pericardial fat is associated with atrial fibrillation severity and ablation outcome. J Am Coll Cardiol 2011;57:1745–1751.


149. Kang JH, Lee DI, Kim S, et al. Prediction of long-term outcomes of catheter ablation of persistent atrial fibrillation by parameters of preablation DC cardioversion. J Cardiovasc Electrophysiol 2012;23:1165–1170.


150. Mahajan R, Lau DH, Brooks AG, et al. Electrophysiological, electroanatomical, and structural remodeling of the atria as consequences of sustained obesity. J Am Coll Cardiol 2015;66:1–11.


151. Chang SL, Tuan TC, Tai CT, et al. Comparison of outcome in catheter ablation of atrial fibrillation in patients with versus without the metabolic syndrome. Am J Cardiol 2009;103:67–72.


152. Mohanty S, Mohanty P, Di Biase L, et al. Impact of metabolic syndrome on procedural outcomes in patients with atrial fibrillation undergoing catheter ablation. J Am Coll Cardiol 2012;59:1295–1301.


153. Cappato R, Calkins H, Chen SA, et al. Updated worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circ Arrhythm Electrophysiol 2010;3:32–38.


154. Nakahara S, Hori Y, Kobayashi S, et al. Epicardial adipose tissue-based defragmentation approach to persistent atrial fibrillation: its impact on complex fractionated electrograms and ablation outcome. Heart Rhythm 2014;11:1343–1351.


155. Masuda M, Mizuno H, Enchi Y, et al. Abundant epicardial adipose tissue surrounding the left atrium predicts early rather than late recurrence of atrial fibrillation after catheter ablation. J Interv Card Electrophysiol 2015;44:31–37.


156. Blanche C, Tran N, Rigamonti F, Burri H, Zimmermann M. Value of P-wave signal averaging to predict atrial fibrillation recurrences after pulmonary vein isolation. Europace 2013;15:198–204.


157. Cox JL, Schuessler RB, Boineau JP. The development of the Maze procedure for the treatment of atrial fibrillation. Semin Thorac Cardiovasc Surg 2000;12:2–14.


158. Melby SJ, Zierer A, Bailey MS, et al. A new era in the surgical treatment of atrial fibrillation: the impact of ablation technology and lesion set on procedural efficacy. Ann Surg 2006;244:583–592.


159. Badhwar V, Rankin JS, Damiano RJ Jr, et al. The Society of Thoracic Surgeons 2017 clinical practice guidelines for the surgical treatment of atrial fibrillation. Ann Thorac Surg 2017;103:329–341.


160. Belley-Cote EP, Singal RK, McClure G, et al. Perspective and practice of surgical atrial fibrillation ablation: an international survey of cardiac surgeons. Europace 2019;21:445–450.


161. Berger WR, Meulendijks ER, Limpens J, et al. Persistent atrial fibrillation: a systematic review and meta-analysis of invasive strategies. Int J Cardiol 2019;278:137–143.


162. Barnett SD, Ad N. Surgical ablation as treatment for the elimination of atrial fibrillation: a meta-analysis. J Thorac Cardiovasc Surg 2006;131:1029–1035.


163. McClure GR, Belley-Cote EP, Jaffer IH, et al. Surgical ablation of atrial fibrillation: a systematic review and meta-analysis of randomized controlled trials. Europace 2018;20:1442–1450.


164. Osmancik P, Budera P, Talavera D, et al. Five-year outcomes in cardiac surgery patients with atrial fibrillation undergoing concomitant surgical ablation versus no ablation. The long-term follow-up of the PRAGUE-12 Study. Heart Rhythm 2019;16:1334–1340.


165. Gillinov AM, Gelijns AC, Parides MK, et al. Surgical ablation of atrial fibrillation during mitral-valve surgery. N Engl J Med 2015;372:1399–1409.



166. Sharples L, Everett C, Singh J, et al. Amaze: a double-blind, multicentre randomised controlled trial to investigate the clinical effectiveness and cost-effectiveness of adding an ablation device-based maze procedure as an adjunct to routine cardiac surgery for patients with pre-existing atrial fibrillation. Health Technol Assess 2018;22:1–132.

167. Bagge L, Probst J, Jensen SM, et al. Quality of life is not improved after mitral valve surgery combined with epicardial left atrial cryoablation as compared with mitral valve surgery alone: a substudy of the double blind randomized SWEDish Multicentre Atrial Fibrillation study (SWEDMAF). Europace 2018;20:f343–f350.


168. Suwalski P, Kowalewski M, Jasiński M, et al. Surgical ablation for atrial fibrillation during isolated coronary artery bypass surgery. Eur J Cardiothorac Surg 2020;57:691–700.


169. Gillinov AM, Bakaeen F, McCarthy PM, et al. Surgery for paroxysmal atrial fibrillation in the setting of mitral valve disease: a role for pulmonary vein isolation? Ann Thorac Surg 2006;81:19–28.


170. Basu S, Nagendran M, Maruthappu M. How effective is bipolar radiofrequency ablation for atrial fibrillation during concomitant cardiac surgery? Interact Cardiovasc Thorac Surg 2012;15:741–748.



171. Chao TF, Lip GYH, Lin YJ, et al. Age threshold for the use of non-vitamin K antagonist oral anticoagulants for stroke prevention in patients with atrial fibrillation: insights into the optimal assessment of age and incident comorbidities. Eur Heart J 2019;40:1504–1514.


172. Beukema WP, Sie HT, Misier AR, Delnoy PP, Wellens HJ, Elvan A. Predictive factors of sustained sinus rhythm and recurrent atrial fibrillation after a radiofrequency modified Maze procedure. Eur J Cardiothorac Surg 2008;34:771–775.


173. Lee SH, Kim JB, Cho WC, et al. The influence of age on atrial fibrillation recurrence after the maze procedure in patients with giant left atrium. J Thorac Cardiovasc Surg 2011;141:1015–1019.


174. Damiano RJ Jr, Schwartz FH, Bailey MS, et al. The Cox maze IV procedure: predictors of late recurrence. J Thorac Cardiovasc Surg 2011;141:113–121.



175. Sunderland N, Maruthappu M, Nagendran M. What size of left atrium significantly impairs the success of maze surgery for atrial fibrillation? Interact Cardiovasc Thorac Surg 2011;13:332–338.


176. Bakker RC, Akin S, Rizopoulos D, Kik C, Takkenberg JJ, Bogers AJ. Results of clinical application of the modified maze procedure as concomitant surgery. Interact Cardiovasc Thorac Surg 2013;16:151–156.


177. Ad N, Holmes SD. Prediction of sinus rhythm in patients undergoing concomitant Cox maze procedure through a median sternotomy. J Thorac Cardiovasc Surg 2014;148:881–887.


178. Blomström-Lundqvist C, Johansson B, Berglin E, et al. A randomized double-blind study of epicardial left atrial cryoablation for permanent atrial fibrillation in patients undergoing mitral valve surgery: the SWEDish Multicentre Atrial Fibrillation study (SWEDMAF). Eur Heart J 2007;28:2902–2908.


179. Huffman MD, Malaisrie SC, Karmali KN. Concomitant at- rial fibrillation surgery for people undergoing cardiac surgery. JAMA Cardiol 2017;2:334–335.


180. Budera P, Straka Z, Osmančík P, et al. Comparison of cardiac surgery with left atrial surgical ablation vs. cardiac surgery without atrial ablation in patients with coronary and/or valvular heart disease plus atrial fibrillation: final results of the PRAGUE-12 randomized multicentre study. Eur Heart J 2012;33:2644–2652.



181. Wang JG, Xin M, Han J, et al. Ablation in selective patients with long-standing persistent atrial fibrillation: medium-term results of the Dallas lesion set. Eur J Cardiothorac Surg 2014;46:213–220.


182. Badhwar V, Rankin JS, Ad N, et al. Surgical ablation of atrial fibrillation in the United States: trends and propensity matched outcomes. Ann Thorac Surg 2017;104:493–500.


183. Joshibayev S, Bolatbekov B. Early and long-term outcomes and quality of life after concomitant mitral valve surgery, left atrial size reduction, and radiofrequency surgical ablation of atrial fibrillation. Anatol J Cardiol 2016;16:797–803.



184. Driessen AHG, Berger WR, Bierhuizen MFA, et al. Quality of life improves after thoracoscopic surgical ablation of advanced atrial fibrillation: results of the Atrial Fibrillation Ablation and Autonomic Modulation via Thoracoscopic Surgery (AFACT) study. J Thorac Cardiovasc Surg 2018;155:972–980.


185. Castellá M, Kotecha D, van Laar C, et al. Thoracoscopic vs. catheter ablation for atrial fibrillation: long-term follow-up of the FAST randomized trial. Europace 2019;21:746–753.



186. Osmancik P, Budera P, Talavera D, et al. Improvement in the quality of life of patients with persistent or long-standing persistent atrial fibrillation after hybrid ablation. J Interv Card Electrophysiol 2020;57:435–442.


187. Kim HJ, Kim JS, Kim TS. Epicardial thoracoscopic ablation versus endocardial catheter ablation for management of atrial fibrillation: a systematic review and meta-analysis. Interact Cardiovasc Thorac Surg 2016;22:729–737.



188. van Laar C, Verberkmoes NJ, van Es HW, et al. Thoracoscopic left atrial appendage clipping: a multicenter cohort analysis. JACC Clin Electrophysiol 2018;4:893–901.

189. Gammie JS, Haddad M, Milford-Beland S, et al. Atrial fibrillation correction surgery: lessons from the Society of Thoracic Surgeons National Cardiac Database. Ann Thorac Surg 2008;85:909–914.


190. Calkins H, Kuck KH, Cappato R, et al. 2012 HRS/EHRA/ECAS expert consensus statement on catheter and surgical ablation of atrial fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. Europace 2012;14:528–606.


191. van der Heijden CAJ, Vroomen M, Luermans JG, et al. Hybrid versus catheter ablation in patients with persistent and longstanding persistent atrial fibrillation: a systematic review and meta-analysis †. Eur J Cardiothorac Surg 2019;56:433–443.


192. Velagic V, DE Asmundis C, Mugnai G, et al. Repeat procedures after hybrid thoracoscopic ablation in the setting of longstanding persistent atrial fibrillation: electrophysiological findings and 2-year clinical outcome. J Cardiovasc Electrophysiol 2016;27:41–50.


193. Osmancik P, Budera P, Zdarska J, Herman D, Petr R, Straka Z. Electrophysiological findings after surgical thoracoscopic atrial fibrillation ablation. Heart Rhythm 2016;13:1246–1252.


194. Cardoso R, Knijnik L, Bhonsale A, et al. An updated meta-analysis of novel oral anticoagulants versus vitamin K antagonists for uninterrupted anticoagulation in atrial fibrillation catheter ablation. Heart Rhythm 2018;15:107–115.


195. Calkins H, Willems S, Gerstenfeld EP, et al. Uninterrupted dabigatran versus warfarin for ablation in atrial fibrillation. N Engl J Med 2017;376:1627–1636.


196. Cappato R, Marchlinski FE, Hohnloser SH, et al. Uninterrupted rivaroxaban vs. uninterrupted vitamin K antagonists for catheter ablation in non-valvular atrial fibrillation. Eur Heart J 2015;36:1805–1811.



197. Kirchhof P, Haeusler KG, Blank B, et al. Apixaban in patients at risk of stroke undergoing atrial fibrillation ablation. Eur Heart J 2018;39:2942–2955.



198. Hohnloser SH, Camm J, Cappato R, et al. Uninterrupted edoxaban vs. vitamin K antagonists for ablation of atrial fibrillation: the ELIMINATE-AF trial. Eur Heart J 2019;40:3013–3021.



199. Ezekowitz MD, Pollack CV Jr, Halperin JL, et al. Apixaban compared to heparin/vitamin K antagonist in patients with atrial fibrillation scheduled for cardioversion: the EMANATE trial. Eur Heart J 2018;39:2959–2971.



200. Bhargava M, Di Biase L, Mohanty P, et al. Impact of type of atrial fibrillation and repeat catheter ablation on long-term freedom from atrial fibrillation: results from a multicenter study. Heart Rhythm 2009;6:1403–1412.


201. Winkle RA, Mead RH, Engel G, Patrawala RA. Long-term results of atrial fibrillation ablation: the importance of all initial ablation failures undergoing a repeat ablation. Am Heart J 2011;162:193–200.


202. Hocini M, Sanders P, Deisenhofer I, et al. Reverse remodeling of sinus node function after catheter ablation of atrial fibrillation in patients with prolonged sinus pauses. Circulation 2003;108:1172–1175.


203. Wang H, Han J, Wang Z, et al. A prospective randomized trial of the cut-and-sew Maze procedure in patients undergoing surgery for rheumatic mitral valve disease. J Thorac Cardiovasc Surg 2018;155:608–617.


204. Lawrance CP, Henn MC, Miller JR, et al. A minimally invasive Cox maze IV procedure is as effective as sternotomy while decreasing major morbidity and hospital stay. J Thorac Cardiovasc Surg 2014;148:955–962.



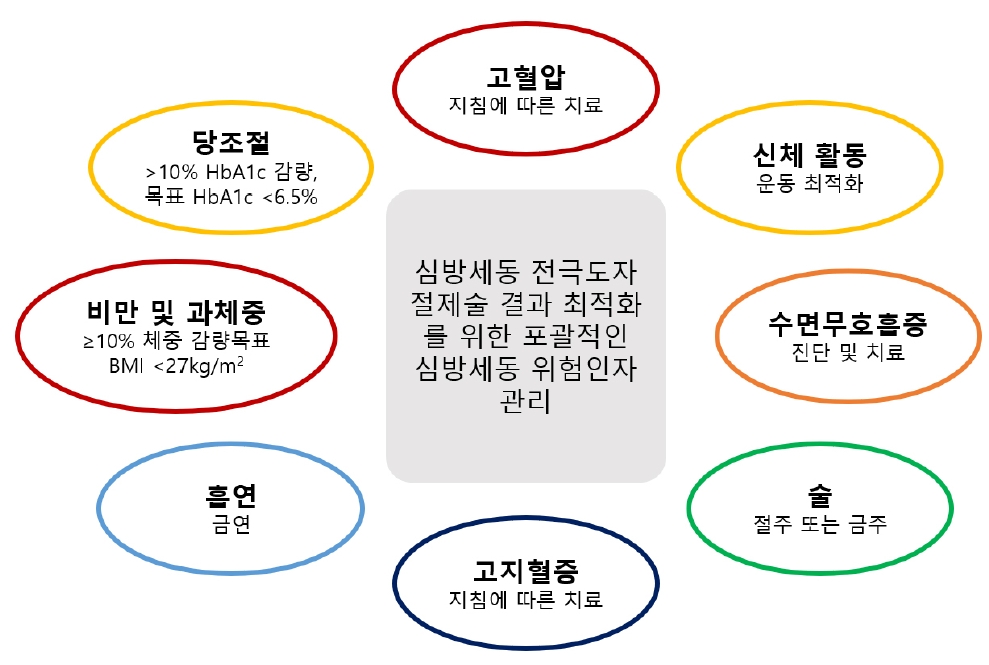
유증상 심방세동에서 전극도자절제술의 적응증. a유의하게 확장된 좌심방, 고령, 긴 심방세동 지속 기간, 신부전 및 기타 심혈관계 위험인자. b드문 개별적 상황에서 전극도자절제술은 일차 요법으로 신중하게 고려될 수 있다. c빈맥심근병증이 강하게 의심될 경우 좌심실 기능장애를 역전시키기 위해 추천됨. d생존률을 높이고 입원을 줄이기 위해.

Figure 1.
Table 1.
심방세동 전극도자절제술 및 흉강경절제술의 시술 관련 합병증
Table 2.
심방세동 전극도자절제술 후 추적 관찰 시 핵심사항
Table 3.
심방세동의 율동 조절 및 전극도자절제술 관련 권고
| 일반적 권고 | ||
| 1. 심방세동 전극도자절제술을 결정할 때 시술의 위험과 시술 후 심방세동 재발의 주요 위험요인들을 고려하여 환자와 상의할 것을 권고한다[3-6,11,14,32,34,44,66,72,74]. (Class I, Level of evidence B) | ||
| 2. 첫 번째 폐정맥고립술 후 환자의 증상이 개선되었다면 심방세동이 재발한 환자에서 폐정맥고립술을 반복해서 받는 것을 고려할 수 있다[200,201]. (Class IIa, Level of evidence B) | ||
| 약물 치료 실패 후 심방세동 전극도자절제술 | ||
| 1. 아래의 환자에서 심방세동 재발에 의한 증상을 개선시키기 위해 Class I 또는 III 항부정맥제 치료에 실패하거나 불내성을 보일 경우 폐정맥고립술인 심방세동 전극도자절제술을 권고한다[3-5,10,11,14,15,17,42,44,65,66,70,72,74,77]. (Class I) | ||
| A. 발작성 심방세동(Level of evidence A) | ||
| B. 심방세동 재발의 주요 위험요인이 없는 지속성 심방세동(Level of evidence A) C. 심방세동 재발의 주요 위험요인이 있는 지속성 심방세동(Level of evidence B) | ||
| 2. 발작성 및 지속성 심방세동 환자에서 심방세동 재발에 의한 증상을 개선시키기 위해 베타-차단제 치료에 실패하거나 불내성을 보일 경우 율동 조절을 위해 폐정맥고립술인 심방세동 전극도자절제술을 권고한다[9]. (Class IIa, Level of evidence B) | ||
| 일차 치료 | ||
| 1. 아래의 유증상 환자 일부에서 증상 개선을 위해 율동 조절 일차 치료로 Class I 또는 III 항부정맥제 투여 대신 환자의 선택, 이익, 그리고 위험을 고려하여 폐정맥고립술인 심방세동 전극도자절제술을 고려할 수 있다. | ||
| A. 발작성 심방세동 에피소드[7,8,15,16,67]. (Class IIa, Level of evidence B) | ||
| B. 심방세동 재발의 주요 위험요인이 없는 지속성 심방세동[11,12,31,32,35,68,111,117,130]. (Class IIb, Level of evidence C) | ||
| 2. 심방세동 전극도자절제술은 | ||
| A. 증상 유무와 관계없이 빈맥유발심근병증 가능성이 높을 경우 심방세동 환자의 좌심실 기능부전을 역전시키기 위해 권고한다[56,63,64]. (Class I, Level of evidence B) | ||
| B. 좌심실 박출률이 저하된 심부전이 동반된 심방세동 환자의 일부에서 생존률을 개선시키고 심부전 입원을 줄이기 위해 고려해야 한다[14,48,52-56,58,59,157-159,162]. (Class IIa, Level of evidence B) | ||
| 3. 폐정맥고립술인 심방세동 전극도자절제술은 임상적 상황을 고려하여 심방세동 관련 서맥 또는 심방세동의 율동전환 후 유증상의 동정지가 있는 환자들에서 박동조율기 삽입을 피하기 위한 전략으로 고려할 수 있다[202]. (Class IIa, Level of evidence C) | ||
| 기법 및 기술 | ||
| 1. 폐정맥의 완전한 전기적 고립술을 모든 심방세동 전극도자절제술에서 권고한다[3-6,11,14,32,34,44,66,72,74]. (Class I, Level of evidence A) | ||
| 2. 만약 환자에게 CTI-의존 심방조동이 발생한 바 있거나 전형적인 심방조동이 심방세동 전극도자절제술 중 유도된다면 CTI 병변 만드는 것을 고려할 수 있다[119-121]. (Class IIb, Level of evidence B) | ||
| 3. 폐정맥고립술 외 추가적인 병변 형성(저전압 부위, 선형 병변, 분할 전기도, 이소성 병변, 로터 등)은 고려될 수 있으나 잘 정립되어 있지는 않다[68,72,97,100-118]. (Class IIb, Level of evidence B) | ||
| 절제술 결과 개선을 위한 생활양식개선 및 기타 전략 | ||
| 1. 체중 감량은 비만한 심방세동 환자, 특히 심방세동 절제술이 예정일 경우 권고된다[32,34,36,39,148-150]. (Class I, Level of evidence B) | ||
| 2. 위험요인을 엄격히 조절하고 유발 요인을 피하는 것은 율동 조절 전략의 일부로서 권고된다[32,33]. (Class I, Level of evidence B) | ||
Table 4.
심방세동 수술적 치료 권고
| 1. 다른 심장 수술을 진행할 때, 함께 심방세동 수술적 치료를 하는 것을 고려해야 한다. 다만 리듬 조절의 이익과 심방 부정맥 재발의 위험성을 따져보아야 한다[165,179,203-205]. (Class II, Level of evidence A) |
| 2. 하이브리드 시술을 포함하여 흉강경을 이용한 심방세동 시술은 이전 경피적 심방세동 시술이 실패하였거나 혹은 실패할 확률이 높고, 항부정맥 약제에 불응하는 유증상 발작성, 지속성 심방세동 환자에게 장기간의 리듬조절을 목적으로 고려되어야 한다. 그리고 시술은 부정맥 전문의와 외과의사로 구성된 경험 있는 협의체를 통해 결정되어야 한다[206]. (Class IIa, Level of evidence B) |
| 3. 하이브리드 시술을 포함하여 흉강경을 이용한 심방세동 수술적 치료는 항부정맥제 약물치료에 불응하는 재발의 위험성의 높은 유증상 지속성 심방세동 환자에서 리듬조절을 선호하는 경우 고려될 수 있다. (Class IIb, Level of evidence C) |
Table 5.
율동 조절 중재술을 받는 환자들의 시술 전후 뇌졸중 위험 관리 관련 권고
| 1. 뇌졸중 위험인자가 있는 심방세동 환자에서 절제술 전 경구항응고제를 복용하지 않는 경우 시술 전 뇌졸중 위험 관리로서 항응고치료 시작 및 다음 사항을 권고한다. (Class I, Level of evidence C) | |
| A. 바람직하게는, 절제술 전 적어도 3주 동안 치료적 경구 항응고제 투여(Class IIa, Level of evidence C) | |
| B. 또는, 절제술 전 좌심방 혈전을 배제하기 위해 경식도심초음파 시행(Class IIa, Level of evidence C) | |
| 2. 심방세동 전극도자절제술을 받는 환자에서 와파린, 다비가트란, 리바록사반, 아픽사반 또는 에독사반으로 항응고치료를 받고 있었을 경우 경구항응고제 중단 없이 절제술을 진행하는 것을 권고한다[195,196,198]. (Class I, Level of evidence A) | |
| 3. 심방세동 전극도자절제술 후 다음 사항을 권고한다. | |
| A. 절제술 후 적어도 2개월 동안 와파린이나 NOAC으로 전신 항응고치료 유지한다. (Class I, Level of evidence C) | |
| B. 절제술 후 2개월이 지난 후 전신 항응고치료의 장기적 유지는 절제술의 확실한 성공 또는 실패가 아니라 환자의 뇌졸중 위험 요소를 기반으로 한다. (Class I, Level of evidence C) | |
| 4. 심방세동 수술 및 좌심방이 폐색술을 받은 환자에서 장기적 경구항응고제 치료는 CHA2DS2-VASc 점수를 바탕으로 평가된 환자의 혈전색전 위험에 근거하여 권고한다. (Class I, Level of evidence C) | |
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 4,195 View
- 260 Download



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



