 |
 |
| Korean J Med > Volume 96(4); 2021 > Article |
|
žöĒžēĹ
Ž™©ž†Ā
žĚėžēĹŪíąžĚė ž†Āž†ąŪēú žā¨žö©žóźŽŹĄ Ž∂ąÍĶ¨ŪēėÍ≥† žēĹŽ¨ľžĚīžÉĀŽįėžĚĎ (ADR)žĚÄ ŽįúžÉĚŪē† žąė žěąžúľŽ©į, žĚīŽäĒ ŪôėžěźžĚė žēąž†ĄÍ≥ľ žßĀž†Ďž†ĀžúľŽ°ú ÍīÄŽ†®Žźú Ž¨łž†úŽ•ľ žēľÍłįŪē† žąė žěąŽč§. žĚī žóįÍĶ¨žĚė Ž™©ž†ĀžĚÄ Žč®žĚľ 3žį® žĚėŽ£ĆÍłįÍīĞ󟞥ú žēĹŽ¨ľžĚīžÉĀŽįėžĚĎÍ≥ľ ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄžĚė ŪäĻžĄĪžĚĄ Ž∂ĄžĄĚŪēėŽäĒ Í≤ÉžĚīŽč§.
Žį©Ž≤ē
žĄúžöłŽĆÄŪēôÍĶźŽ≥Ďžõź žēĹŽ¨ľžēąž†ĄžĄľŪĄįžóź 2010ŽÖĄ 1žõĒ 1žĚľŽ∂ÄŪĄį 2019ŽÖĄ 12žõĒ 31žĚľÍĻĆžßÄ Ž≥īÍ≥†Žźú žēĹŽ¨ľžĚīžÉĀŽįėžĚĎ ŪŹČÍįĞ쟎£ĆŽ•ľ Ž∂ĄžĄĚŪēėžėÄŽč§. žēĹŽ¨ľ žā¨žö©Í≥ľ žĚīžÉĀžā¨Ž°Ä ŽįúžÉĚžĚė žĚłÍ≥ľžĄĪžĚÄ žĄłÍ≥ĄŽ≥īÍĪīÍłįÍĶ¨ žõĀžāīŽĚľ Ž™®ŽčąŪĄįŽßĀžĄľŪĄį(World Health Organization-Uppsala Monitoring Centre, WHO-UMC) žĚłÍ≥ľžĄĪ ŪŹČÍįÄ Íłįž§ÄžĚĄ ÍłįŽįėŪēėžó¨ Ūôēžč§Ūē®(certain), ÍįÄŽä•žĄĪ ŽÜížĚĆ(probable), ÍįÄŽä•žĄĪ žěąžĚĆ(possible)žúľŽ°ú ŪŹČÍįÄŽźú žā¨Ž°ÄŽď§ŽßĆ Ž∂ĄžĄĚžóź ŪŹ¨Ūē®ŪēėžėÄŽč§. žóįŽ†Ļ, žĄĪŽ≥Ą, ž¶ĚžÉĀ ŽįúžÉĚ žčúÍłį, ž§Ďž¶ĚŽŹĄ ŽįŹ žúĄž§ĎŽŹĄ Í∑łŽ¶¨Í≥† žēĹŽ¨ľžĚīžÉĀŽįėžĚĎ, ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄžĚė žč†ž≤īÍłįÍīÄÍ≥Ą Ž∂ĄŽ•ėÍįÄ Ž∂ĄžĄĚŽźėžóąŽč§.
Í≤įÍ≥ľ
žóįÍĶ¨ ÍłįÍįĄ ŽŹôžēą žīĚ 49,955ÍĪīžĚė žēĹŽ¨ľžĚīžÉĀŽįėžĚĎ ŪŹČÍįÄžßÄÍįÄ ÍįÄŽä•žĄĪ žěąžĚĆ, ÍįÄŽä•žĄĪ ŽÜížĚĆ, Ūôēžč§Ūē®žúľŽ°ú ŪŹČÍįÄŽźėžóąŽč§. žúĄžě•ÍīÄÍ≥Ą ž¶ĚžÉĀ(25.9%)žĚÄ ž†Ąž≤ī Ž≥īÍ≥† ÍĪīžąėžóź ŽĻĄŪēī ž§Ďž¶Ě(2.6%)žĚė ŽĻĄžú®žĚī ŽāģžēėŽćė ŽįėŽ©ī, Ūėąžē°Ūēôž†Ā žßąŪôė(6.6%)žĚÄ ž§Ďž¶Ě(39.2%)žĚė ŽĻĄžú®žĚī žÉĀŽĆÄž†ĀžúľŽ°ú ŽÜížēėŽč§. žēĹŽ¨ľžĚīžÉĀŽįėžĚĎ ž§Ď 10.2%ÍįÄ ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄŽ°ú ŪŹČÍįÄŽźėžóąžúľŽ©į, žĖĎ Í∑ĻŽč®žĚė žóįŽ†ĻŽĆĞ󟞥ú ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄžĚė ŽĻĄžú®žĚī ŽÜížēėŽč§. žč†ž≤īÍłįÍīÄÍ≥Ą Ž∂ĄŽ•ėŽ°ú Ž∂ĄŽ•ėŪēėžėĞ̥ ŽēĆŽäĒ ž†Ąžč† žßąŪôėžĚī ÍįÄžě• ŽßéžĚī Ž≥īÍ≥†ŽźėžóąžúľŽ©į Í∑ł Ží§Ž°ú ŪĒľŽ∂ÄžôÄ Ž∂ÄžÜćÍłįÍīÄ žě•žē†ÍįÄ ŽßéžēėŽč§. Ūē≠žēĒž†úžôÄ Ūē≠žÉĚž†úÍįÄ ž§ĎŽĆÄŪēú žú†Ūēīžā¨Ž°ÄžĚė žĚėžč¨žēĹž†úŽ°ú ÍįÄžě• ŽßéžĚī Ž≥īÍ≥†ŽźėžóąŽč§. žēĄŽāėŪēĄŽĚĹžčúžä§ ŽįėžĚĎžĚī ÍįÄžě• ŪĚĒŪēú ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄžėÄŽč§(6.5%).
Í≤įŽ°†
ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄžĚė ŽĻĄžú®žĚÄ žč†ž≤īÍłįÍīÄÍ≥Ą Ž∂ĄŽ•ėžôÄ žēĹž†ú Ž≥ĄŽ°ú Žč§Ž•īÍ≤Ć ŽāėŪÉÄŽā¨Žč§. žĖĎ Í∑ĻŽč®žĚė žóįŽ†ĻŽĆĞ󟞥ú ž§ĎŽĆÄŪēú žú†Ūēīžā¨Ž°ÄžĚė ŽĻĄžú®žĚī ŽÜížēėžúľŽĮÄŽ°ú žĖīŽ¶įžĚīžôÄ ŽÖłžĚłžóźžĄúŽäĒ žě†žě¨ž†ĀžĚł ž§ĎŽĆÄŪēú žú†Ūēīžā¨Ž°ÄÍįÄ ŽįúžÉĚŪē† ÍįÄŽä•žĄĪžĚī žěąžĖī žĄłžč¨Ūēú ž£ľžĚėÍįÄ ŪēĄžöĒŪēėŽč§.
Abstract
Background/Aims
Despite proper use of pharmaceuticals, adverse drug reactions (ADRs) can lead to problems related to patient safety. We analyzed the characteristics of ADRs, particularly serious adverse events (SAEs), in a single tertiary medical institution.
Methods
Spontaneous ADR report data collected from 2010 to 2019 in Seoul National University Hospital were assessed. Causality was evaluated according to the World Health Organization-Uppsala Monitoring Centre criteria. Age, sex, onset, severity, seriousness, and system organ class (SOC) of ADRs and SAEs were analyzed.
Results
During the study period, a total of 49,955 individual case safety reports were assessed as possible, probable, or certain. Although the number of gastrointestinal ADR reports was high (25.9%), severe cases were uncommon (2.6%). By contrast, the number of hematologic disorders was low (6.6%) but 39.2% of them were severe. Among ADRs, 10.2% were assessed as SAEs, the proportion of which was high at extreme ages and in males. Body as a whole-general disorders were the most frequently reported SOC for SAEs, followed by skin and appendage disorders. Antineoplastic agents and antibiotics were the most common causative agents of SAEs and ADRs. Anaphylactic reaction was the most frequent SAE (6.5%).
žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚÄ ž†ēžÉĀž†ĀžĚł žö©ŽüČÍ≥ľ žö©Ž≤ēžúľŽ°ú žēĹŽ¨ľžĚĄ Ūą¨žó¨ ŪõĄ ŽįúžÉĚŪēú žú†ŪēīŪēėÍ≥† žĚėŽŹĄŽźėžßÄ žēäžĚÄ ŽįėžĚĎžúľŽ°úžć® ŪēīŽčĻ žĚėžēĹŪíąÍ≥ľžĚė žĚłÍ≥ľÍīÄÍ≥ĄŽ•ľ Žįįž†úŪē† žąė žóÜŽäĒ Í≤ĹžöįŽ°ú ž†ēžĚėŽźúŽč§[1]. žěĄžÉĀžčúŪóėžĚĄ ÍĪįžĻú žč†žēĹžĚīŽĚľ ŪēėŽćĒŽĚľŽŹĄ ŽįúžÉĚ ŽĻąŽŹĄÍįÄ Žß§žöį ŽďúŽ¨ł žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚė Í≤Ĺžöį žěĄžÉĀžčúŪóėžóźžĄúŽäĒ ŽįúÍ≤¨ŽźėžßÄ Ž™ĽŪē† žąė žěąžúľŽ©į, Ž∂ąŪäĻž†ē Žč§žąėžĚė žā¨ŽěƎ吏Ěī žě•ÍłįÍįĄ žēĹŽ¨ľžĚĄ Ž≥Ķžö©ŪēėŽ©į Žč§žĖĎŪēú žēĹŽ¨ľ ŽįŹ žĚĆžčĚÍ≥ľ žÉĀŪėłžěĎžö©žĚĄ žĚľžúľŪā¨ žąė žěąžĖī žēĹŽ¨ľžĚė žčúŪĆź ŪõĄžóź žěĄžÉĀžčúŪóėžóźžĄúŽäĒ ŽįúÍ≤¨ŽźėžßÄ žēäžēėŽćė ŽďúŽ¨ľžßÄŽßĆ ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄÍįÄ ž∂ĒÍįÄŽ°ú ŽįúÍ≤¨Žź† ÍįÄŽä•žĄĪžĚī žěąŽč§. ŽĒįŽĚľžĄú žčúŪĆź ŪõĄžóźŽŹĄ žßÄžÜ枆ĀžĚł žēĹŽ¨ľÍįźžčú ŪôúŽŹôžĚĄ ŪÜĶŪēī žĚėžēĹŪíąžĚė žēąž†ĄžĄĪžĚĄ ÍīÄŽ¶¨ŪēėŽäĒ Í≤ÉžĚī ž§ĎžöĒŪēėŽč§.
ŪēúÍĶ≠žĚėžēĹŪíąžēąž†ĄÍīÄŽ¶¨žõźžĚė ‚Äė2019 žĚėžēĹŪíą ŽďĪ žēąž†ĄžĄĪ ž†ēŽ≥ī Ž≥īÍ≥†ŽŹôŪĖ•‚Äôžóź ŽĒįŽ•īŽ©ī ÍĶ≠ŽāīžóźžĄú žěźŽįúž†ĀžúľŽ°ú žč†Í≥†ŽźėŽäĒ žēĹŽ¨ľžĚīžÉĀŽįėžĚĎ žā¨Ž°ÄÍįÄ ž¶ĚÍįÄŪēėÍ≥† žěąŽč§[2]. žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚÄ žĚłžĘÖŽ≥ĄŽ°ú Žč§Ž•īÍ≤Ć ŽāėŪÉÄŽā† žąė žěąžúľŽĮÄŽ°ú, ŪēúÍĶ≠žĚłžóźÍ≤ĆžĄú žĖīŽĖ§ žēĹŽ¨ľŽď§žĚī žĖīŽĖ§ žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚī ŽßéžĚī ŽįúžÉĚŽźėŽäĒžßÄ ŪôēžĚłŪēėžó¨ žĚīžóź ŽĆÄŪēú žēąž†ēžĄĪ ž†ēŽ≥īŽ•ľ ÍĶ¨ž∂ēŪēīžēľ ŪēúŽč§[3].
žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚÄ ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄžôÄ ž§ĎŽĆÄŪēėžßÄ žēäžĚÄ žĚīžÉĀžā¨Ž°ÄŽ°ú ŽāėŽąĆ žąė žěąŽäĒŽćį, žĚī ž§Ď ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄŽäĒ žēĹŽ¨ľžĚīžÉĀŽįėžĚĎ ž§Ď žā¨Žß̞̥ žīąŽěėŪēėÍĪįŽāė žÉĚŽ™ÖžĚĄ žúĄŪėĎŪēėŽäĒ Í≤Ĺžöį, žěÖžõź ŽėźŽäĒ žěÖžõź ÍłįÍįĄžĚė žóįžě•žĚī ŪēĄžöĒŪēú Í≤Ĺžöį, žßÄžÜ枆Ā ŽėźŽäĒ ž§ĎŽĆÄŪēú Ž∂ąÍĶ¨Žāė ÍłįŽä•ž†ÄŪēėŽ•ľ žīąŽěėŪēėŽäĒ Í≤Ĺžöį, žĄ†ž≤úžĄĪ ÍłįŪėē ŽėźŽäĒ žĚīžÉĀžĚĄ žīąŽěėŪēėŽäĒ Í≤Ĺžöį, ÍłįŪÉÄ žĚėŪēôž†ĀžúľŽ°ú ž§ĎžöĒŪēú žÉĀŪô© ž§Ď ŪēėŽāėžóź ŪēīŽčĻŪēėŽäĒ Í≤ĹžöįŽ•ľ ŽßźŪēúŽč§[4]. ÍĶ≠ŽāīžóźžĄú Žč®žĚľÍłįÍīĞ󟞥ú žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžóź ŽĆÄŪēī Ž∂ĄžĄĚŪēú žóįÍĶ¨ÍįÄ žěąžóąžúľŽāė, ŪäĻž†ē žĚīžÉĀžā¨Ž°Ä ŪėĻžĚÄ ŪäĻž†ē žēĹŽ¨ľžóź ŽĆÄŪēī Ž∂ĄžĄĚŪēú Í≤Ɏ吏Ěī ŽĆÄŽ∂ÄŽ∂ĄžĚīžóąžúľŽ©į, ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°Ä ž†ĄŽįėžóź ŽĆÄŪēī Ž∂ĄžĄĚŪēú Í≤ÉžĚÄ žóÜžóąŽč§[5-12].
žĚī žóįÍĶ¨žóźžĄúŽäĒ žĄúžöłŽĆÄŪēôÍĶźŽ≥ĎžõźžóźžĄú 10ŽÖĄÍįĄ žěźŽįúž†ĀžúľŽ°ú Ž≥īÍ≥†Žźú žēĹŽ¨ľžĚīžÉĀŽįėžĚĎ ŽįŹ ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°Äžóź ŽĆÄŪēú žĚłÍĶ¨Ūēôž†Ā ŪäĻžĄĪ ŽįŹ žõźžĚł žēĹŽ¨ľ, žěĄžÉĀž†ĀžĚł ŪäĻžĄĪžóź ŽĆÄŪēī Ž∂ĄžĄĚŪēėžėÄŽč§.
žĚī žóįÍĶ¨ŽäĒ žĄúžöłŽĆÄŪēôÍĶźŽ≥Ďžõź žóįÍĶ¨žú§Ž¶¨žúĄžõźŪöĆžĚė ÍłįÍīÄžäĻžĚł(IRB No. 1911-080-1078)žĚĄ ŽįõÍ≥† žĄúžöłŽĆÄŪēôÍĶźŽ≥Ďžõź žēĹŽ¨ľžēąž†ĄžĄľŪĄįžóź 2010ŽÖĄ 1žõĒ 1žĚľŽ∂ÄŪĄį 2019ŽÖĄ 12žõĒ 31žĚľÍĻĆžßÄ Ž≥īÍ≥†Žźú žēĹŽ¨ľžĚīžÉĀŽįėžĚĎ ŪŹČÍįĞ쟎£ĆŽ•ľ Ž∂ĄžĄĚŪēėžėÄŽč§. žēĹŽ¨ľ žā¨žö©Í≥ľ žĚīžÉĀžā¨Ž°Ä ŽįúžÉĚžĚė žĚłÍ≥ľžĄĪžĚÄ žĄłÍ≥ĄŽ≥īÍĪīÍłįÍĶ¨ žõĀžāīŽĚľ Ž™®ŽčąŪĄįŽßĀžĄľŪĄį(World Health Organization-Uppsala Monitoring Centre, WHO-UMC) žĚłÍ≥ľžĄĪŪŹČÍįÄ Íłįž§ÄžĚĄ ÍłįŽįėŪēėžó¨ Ūôēžč§Ūē®(certain), ÍįÄŽä•žĄĪ ŽÜížĚĆ(probable), ÍįÄŽä•žĄĪ žěąžĚĆ(possible)žúľŽ°ú ŪŹČÍįÄŽźú žā¨Ž°ÄŽď§ŽßĆ Ž∂ĄžĄĚžóź ŪŹ¨Ūē®ŪēėžėÄÍ≥†, ÍįÄŽä•žĄĪ ž†ĀžĚĆ(unlikely), Ž∂ĄŽ•ė Ž∂ąÍįÄ(unclassified), ŪŹČÍįÄ Ž∂ąÍįÄ(unassessable)Ž°ú ŪŹČÍįÄŽźú žā¨Ž°Ä ŽįŹ ŽĮłŪŹČÍįÄ žā¨Ž°ÄŽäĒ Ž∂ĄžĄĚžóźžĄú ž†úžôłŪēėžėÄŽč§[13]. žĚī ŽįĖžóź Ž≥īÍ≥†Žźú ÍĪīŽď§ ž§Ď Ž≥Ďžõź žôł ŽįúžÉĚ žā¨Ž°Ä, ž°įžėĀž†ú ŽďĪ Í≤Äžā¨žč§žóźžĄú ŽįúžÉĚŪēú ž°įžėĀž†ú ÍīÄŽ†® žā¨Ž°ÄŽď§ŽŹĄ ž†úžôłŪēėžėÄŽč§.
žóįŽ†Ļ, žĄĪŽ≥Ą, žĚėžč¨ŽźėŽäĒ žõźžĚł žēĹŽ¨ľ, žĚīžÉĀžā¨Ž°Ä, ž§Ďž¶ĚŽŹĄ ŽįŹ žĚłÍ≥ľÍīÄÍ≥Ą, žúĄž§ĎŽŹĄ, Í∑łŽ¶¨Í≥† ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄžĚė žú†ŪėēžĚĄ Ž∂ĄžĄĚŪēėžėÄŽč§. žĚėžč¨ žēĹŽ¨ľžĚÄ Anatomical Therapeutic Chemical Classification System (ATC žĹĒŽďú)žóź ŽĒįŽĚľ Í≥ĄžóīžĚĄ Ž∂ĄŽ•ėŪēėžėÄŽč§. Ž≥īÍ≥†Žźú žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚÄ žĄłÍ≥ĄŽ≥īÍĪīÍłįÍĶ¨ žĚīžÉĀžā¨Ž°Ä žö©žĖīžßĎ(World Health Organization Adverse Reaction Terminology, WHO-ART)žĚė žö©žĖīŽ•ľ Íłįž§ÄžúľŽ°ú žč†ž≤īÍłįÍīÄÍ≥Ą Ž∂ĄŽ•ė(system organ class, SOC) ŽįŹ žöįžĄ† žąúžúĄžö©žĖī(preferred terms) ž†ēŽ≥īŽ•ľ žā¨žö©ŪēėžėÄŽč§. ž§Ďž¶ĚŽŹĄŽäĒ Í≤Ĺž¶Ě(mild), ž§ĎŽďĪž¶Ě(moderate), ž§Ďž¶Ě(severe)žúľŽ°ú ÍĶ¨Ž∂ĄŪēėžó¨ ŪŹČÍįÄŪēėžėÄŽč§. Í≤Ĺž¶ĚžĚÄ ž¶ĚžÉĀ ŽėźŽäĒ ž¶ĚŪõĄŽ•ľ žßÄÍįĀŪē† žąėŽäĒ žěąžúľŽāė, žČĹÍ≤Ć žįłžĚĄ žąė žěąŽäĒ ž†ēŽŹĄ, ž§ĎŽďĪž¶ĚžĚÄ žĚľžÉĀžĚė ŪôúŽŹôžĚĄ Žį©ŪēīŪē† ŽßĆŪĀľ Ž∂ąŪéłŪēú ž†ēŽŹĄ, ž§Ďž¶ĚžĚÄ žĚľžĚīŽāė žĚľžÉĀžĚė ŪôúŽŹôžĚĄ žąėŪĖČŪē† žąė žóÜŽäĒ ž†ēŽŹĄŽ°ú ž†ēžĚėŪēėžėÄžúľŽ©į, žĚėŽ¨īÍłįŽ°ĚÍ≤ĹÍ≥ľŽ•ľ Í∑ľÍĪįŽ°ú ž§Ďž¶ĚŽŹĄŽ•ľ ŪŹČÍįÄŪēėžėÄŽč§[4].
žúĄž§ĎŽŹĄŽäĒ žč¨ÍįĀŪē®(serious) ŽėźŽäĒ žč¨ÍįĀŪēėžßÄ žēäžĚĆ(not serious)žúľŽ°ú ÍĶ¨Ž∂ĄŪēėžėÄÍ≥†, žā¨ŽßĚ, ž¶ČÍįĀž†ĀžúľŽ°ú žÉĚŽ™ÖžĚĄ žúĄŪėĎŪēėŽäĒ Í≤Ĺžöį, žėĀÍĶ¨ž†Ā ŽėźŽäĒ žč§žßąž†Ā Ž∂ąÍĶ¨Žāė ÍłįŽä•ž†ÄŪēėŽ•ľ žīąŽěėŪēėŽäĒ Í≤Ĺžöį, žĄ†ž≤úž†Ā ÍłįŪėēžĚĄ žú†ŽįúŪēú Í≤Ĺžöį ŽďĪžĚĄ žč¨ÍįĀŪē®žúľŽ°ú ž†ēžĚėŪēėžėÄŽč§[13]. ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄŽäĒ žĄúžöłŽĆÄŪēôÍĶźŽ≥Ďžõź žēĹŽ¨ľžēąž†ĄžĄľŪĄįŽ°ú Ž≥īÍ≥†Žźú žēĹŽ¨ľžĚīžÉĀŽįėžĚĎ ŪŹČÍįÄžßĞ󟞥ú žúĄž§ĎŽŹĄÍįÄ žč¨ÍįĀŪē®(serious)žúľŽ°ú Ž∂ĄŽ•ėŽźú žā¨Ž°ÄŽď§ŽßĆ ŪŹ¨Ūē®ŪēėžėÄŽč§.
Í≤įÍ≥ľ ÍįížĚÄ ÍĪīžąėžôÄ ŽįĪŽ∂Ąžú®Ž°ú Íłįžą†ŪēėžėÄžúľŽ©į, žĻīžĚīž†úÍ≥ĪÍ≤Äž†ē(Chi-square test)žĚĄ žĚīžö©Ūēėžó¨ ŽĻĄžú® ÍĶ¨žĄĪžĚė žį®žĚīŽ•ľ ŽĻĄÍĶźŪēėžėÄŽč§. Ž™®Žď† ŪÜĶÍ≥ĄŪēôž†Ā Ž∂ĄžĄĚžĚÄ žú†žĚėžąėž§Ä 95%Ž•ľ ž†Āžö©Ūēėžó¨ p-value 0.05 ŽĮłŽßƞ̥ ŪÜĶÍ≥Ąž†ĀžúľŽ°ú žú†žĚėŪēú Í≤ÉžúľŽ°ú ÍįĄž£ľŪēėžėÄŽč§. Ž™®Žď† ŪÜĶÍ≥ĄŪēôž†Ā Ž∂ĄžĄĚžĚÄ IBM¬ģ SPSS statistics 25.0 (SPSS Inc., Chicago, IL, USA)žĚĄ žā¨žö©ŪēėžėÄŽč§.
žīĚ 49,955ÍĪīžĚė žēĹŽ¨ľžĚīžÉĀŽįėžĚĎ ŪŹČÍįÄžßÄžóź ŽĆÄŪēī žīĚ 54,803ÍįúžĚė žēĹŽ¨ľ, 75,782ÍįÄžßÄ žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚī Ž≥īÍ≥†ŽźėžóąÍ≥†, WHO-UMC žĚłÍ≥ľžĄĪ ŪŹČÍįÄ Íłįž§ÄžĚĄ ž†Āžö©ŪēėžėĞ̥ ŽēĆ ÍįÄŽä•žĄĪ žěąžĚĆ 25,215ÍĪī(50.5%), ÍįÄŽä•žĄĪ ŽÜížĚĆ 22,930ÍĪī(45.9%), Ūôēžč§Ūē®žúľŽ°ú ŪŹČÍįÄŽźú žā¨Ž°ÄŽäĒ 1,810ÍĪī(3.6%)žĚīžóąŽč§. žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚė ž§Ďž¶ĚŽŹĄŽ•ľ žāīŪéīŽ≥īŽ©ī Í≤Ĺž¶Ě 25,600ÍĪī(51.2%), ž§ĎŽďĪž¶Ě 20,735ÍĪī(41.5%), ž§Ďž¶Ě 3,620ÍĪī(7.2%)žĚīžóąŽč§.
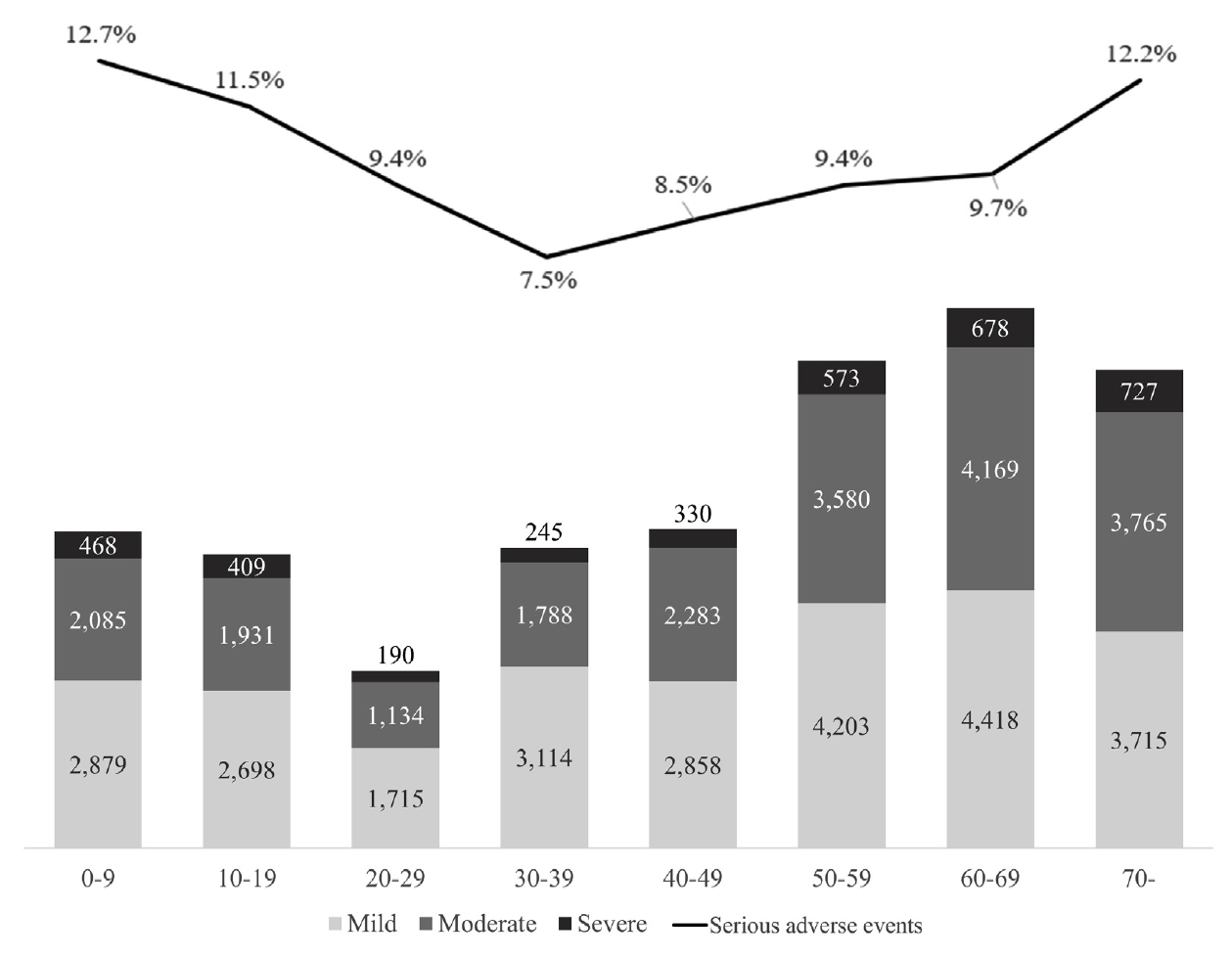
ÍįÄŽä•žĄĪ žěąžĚĆ žĚīžÉĀžúľŽ°ú ŪŹČÍįÄŽźú žā¨Ž°ÄŽď§žĚĄ žĄĪŽ≥Ąžóź ŽĒįŽĚľ Ž∂ĄžĄĚŪēėžėĞ̥ ŽēĆ, žó¨žĄĪ 28,286ÍĪī(56.6%), Žā®žĄĪ 21,669ÍĪī(43.4%)žúľŽ°ú ŽāėŪÉÄŽā¨Žč§. ŪŹČÍ∑† ŽāėžĚīŽäĒ 45.5¬Ī23.7žĄłžėÄžúľŽ©į, žóįŽ†ĻŽĆÄ Ž≥ĄŽ°ú Ž∂ĄžĄĚŪēī Ž≥īžēėžĚĄ ŽēĆŽäĒ 60ŽĆÄÍįÄ ÍįÄžě• ŽÜížĚÄ ŽĻĄžú®(18.5%)žĚĄ žį®žßÄŪēėžėÄŽč§. žÜĆžēĄž≤≠žÜĆŽÖĄ(19žĄł žĚīŪēė)žóźžĄú 10,470ÍĪī(21.0%), žĄĪžĚł(20-69žĄł)žóźžĄú 31,278ÍĪī(62.6%), ŽÖłžĚł(70žĄł žĚīžÉĀ)žóźžĄú 8,207ÍĪī(16.4%)žĚī Ž≥īÍ≥†ŽźėžóąŽč§(Table 1).
žóįÍĶ¨ ÍłįÍįĄ ŽŹôžēą ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄŽ°ú Ž≥īÍ≥†Žźú ŪŹČÍįÄžßÄŽäĒ žīĚ 5,092ÍĪīžúľŽ°ú 10.2%Ž•ľ žį®žßÄŪēėžėÄžúľŽ©į, ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄŽäĒ žīĚ 7,615ÍĪīžĚīžóąŽč§. ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄžĚė ž§Ďž¶ĚŽŹĄŽ•ľ žāīŪéīŽ≥īžēėžĚĄ ŽēĆ Í≤Ĺž¶Ě 12ÍĪī(0.2%), ž§ĎŽďĪž¶Ě 2,264ÍĪī(44.5%), ž§Ďž¶Ě 2,816ÍĪī(55.3%)žĚīžóąŽč§. žĄĪŽ≥Ąžóź ŽĒįŽĚľžĄúŽäĒ Žā®žĄĪ 2,628ÍĪī(12.0%), žó¨žĄĪ 2,464ÍĪī(8.7%)žúľŽ°ú ŪÜĶÍ≥Ąž†ĀžúľŽ°ú Žā®žĄĪžóźžĄú ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄžĚė ŽĻĄžú®žĚī ŽćĒ ŽÜížēėŽč§(p<0.001). žóįŽ†ĻžúľŽ°ú ŽāėŽąĄžĖī Ž≥īžēėžĚĄ ŽēĆ žÜĆžēĄž≤≠žÜĆŽÖĄ(19žĄł žĚīŪēė) 1,271ÍĪī(12.1%), žĄĪžĚł(20žĄł žĚīžÉĀ) 3,821ÍĪī(9.7%)žúľŽ°ú žÜĆžēĄž≤≠žÜĆŽÖĄžóźžĄú žÉĀŽĆÄž†ĀžúľŽ°ú ŽÜížēėŽč§(p<0.001). žĄĪžĚłžĚė Í≤Ĺžöį, 70žĄłŽ•ľ Íłįž†źžúľŽ°ú ŽĻĄÍĶźŪēú Í≤įÍ≥ľ 70žĄł žĚīžÉĀžóźžĄúŽäĒ ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄÍįÄ 999ÍĪī(12.2%)žúľŽ°ú 70žĄł ŽĮłŽßƞ󟞥úžĚė 4,093ÍĪī(9.8%)žóź ŽĻĄŪēī ŽÜížēĄ(p<0.001) žĖĎ Í∑ĻŽč® žóįŽ†ĻŽĆĞ󟞥ú ŽßéžĚī Ž≥īÍ≥†Žź®žĚĄ žēĆ žąė žěąžóąŽč§(Fig. 1).
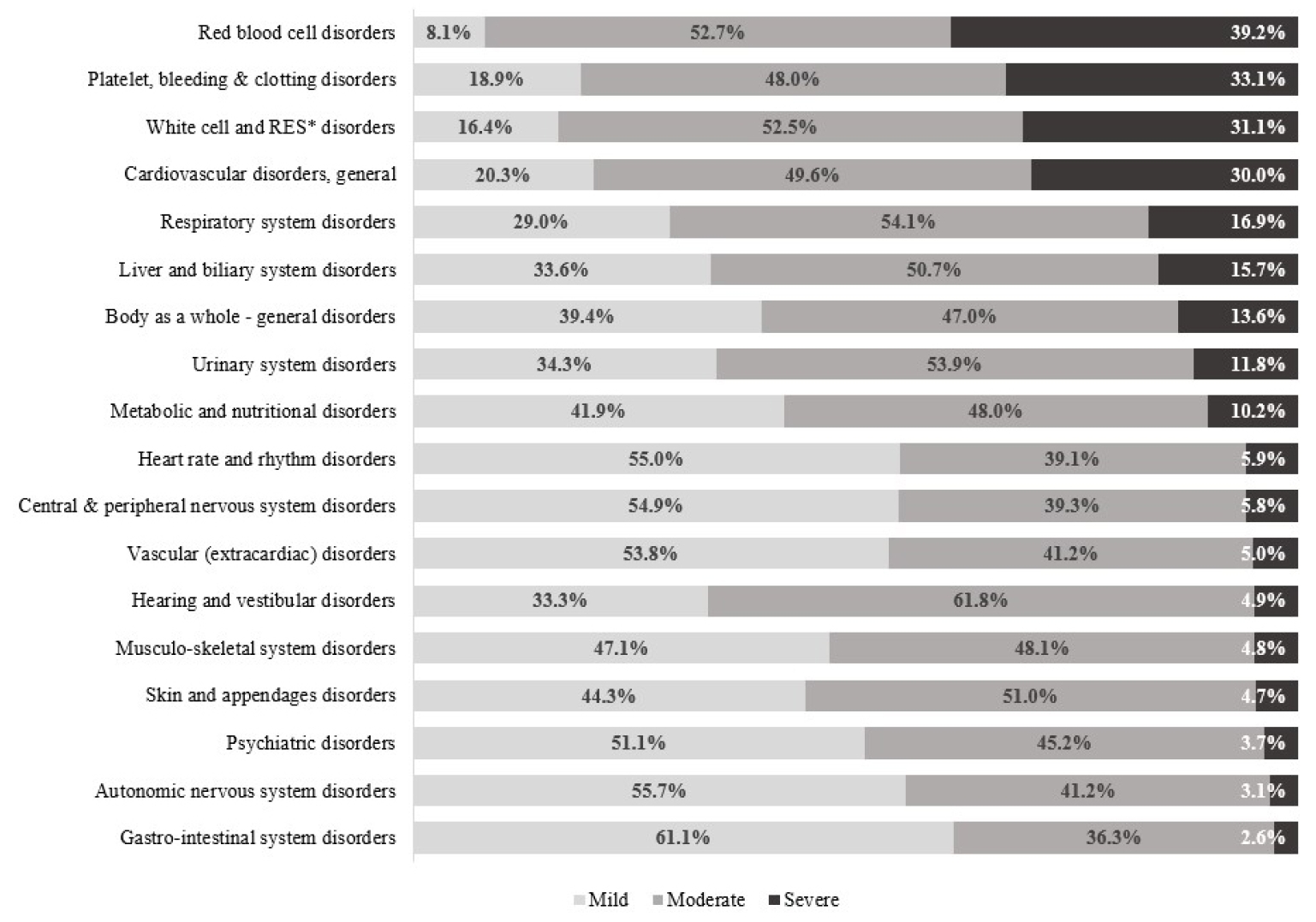
Ž≥īÍ≥†Žźú žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚė SOCŽäĒ žúĄžě•ÍīÄÍ≥Ą ž¶ĚžÉĀ 19,638ÍĪī(25.9%), ŪĒľŽ∂Ä ŽįŹ Ž∂ÄžÜćÍłįÍīÄ 18,851ÍĪī(24.9%), ž†Ąžč† žßąŪôė 9,109ÍĪī(12.0%) žąúžúľŽ°ú Ž≥īÍ≥†ŽźėžóąŽč§(Table 2). žúĄžě•ÍīÄÍ≥Ą ž¶ĚžÉĀ(2.6%)žĚÄ ž†Ąž≤ī Ž≥īÍ≥† ÍĪīžąėžóź ŽĻĄŪēī ž§Ďž¶ĚžĚė ŽĻĄžú®žĚī ŽāģžēėŽćė ŽįėŽ©ī, ŽįĪŪėąÍĶ¨ ŽįŹ Í∑łŽ¨ľŽāīŪĒľÍ≥Ąžóī žě•žē†(39.2%), ŪėąžÜĆŪĆź, ž∂úŪėą, žĚĎÍ≥† žě•žē†(33.1%), žĚľŽįėž†Ā žč¨ŪėąÍīÄ žßąŪôė(30.0%)žĚÄ ž§Ďž¶ĚžĚė ŽĻĄžú®žĚī žÉĀŽĆÄž†ĀžúľŽ°ú ŽÜížēėŽč§(Fig. 2). WHO-ARTžóź ŽĒįŽ•ł Žč®žĚľ žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚÄ žė§žč¨žĚī 5,759ÍĪī(7.6%)žúľŽ°ú ÍįÄžě• ŽßéžēėžúľŽ©į, ÍįÄŽ†§žõÄž¶Ě 3,777ÍĪī(5.0%), ŽįúžßĄ 3,491ÍĪī(4.6%) žąúžúľŽ°ú Ž≥īÍ≥†ŽźėžóąŽč§.
žĚėžč¨ žēĹŽ¨ľžĚĄ ATC-code Ž≥ĄŽ°ú Ž∂ĄŽ•ėŪēėžó¨ žÉĀžúĄ 20žúĄŽ•ľ Ž∂ĄžĄĚŪēú Í≤įÍ≥ľ, Ūē≠žēĒž†úŽ°ú žďįžĚīŽäĒ žēĹŽ¨ľÍĶįžĚī 6žĘÖŽ•ė(Ūē≠žč†žÉĚŽ¨ľž†ú; L01X, žčĚŽ¨ľžĄĪ žēĆžĻľŽ°úžĚīŽďúžôÄ ž≤úžóį Ž¨ľžßą; L01C, Ūē≠ŽĆÄžā¨ž†ú; L01B, žēĆŪā¨ŪôĒž†ú; L01A, Ž©īžó≠žĖĶž†úž†ú; L04A, žĄłŪŹ¨ŽŹÖžĄĪ Ūē≠žēĒž†ú ŽįŹ ÍīÄŽ†® Ž¨ľžßą; L01D)Ž°ú Ūē≠žēĒž†úžóź žĚėŪēú žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚī ÍįÄžě• ŽßéžēėžúľŽ©į, žč†Í≤ĹÍ≥Ą žēĹŽ¨ľÍĶį 3žĘÖŽ•ė(ŽßąžēĹžĄĪ žßĄŪÜĶž†ú; N02A, ž†Ąžč†Žßąž∑®ž†ú; N01A, ÍłįŪÉÄ žßĄŪÜĶž†ú ŽįŹ Ūēīžóīž†ú; N02B), Ūē≠žÉĚž†úÍĶį 4žĘÖŽ•ė(ÍłįŪÉÄ Ž≤†ŪÉÄ-ŽĚĹŪÉź Ūē≠žÉĚž†ú; J01D, ÍłįŪÉÄ Ūē≠žÉĚž†ú; J01X, Ž≤†ŪÉÄ-ŽĚĹŪÉź Ūē≠žÉĚž†ú, ŪéėŽčąžč§Ž¶į; J01C, ŪÄīŽÜÄŽ°†Í≥Ą Ūē≠žÉĚž†ú; J01M)ÍįÄ ŽßéžĚī žč†Í≥†ŽźėžóąŽč§. ATC code 4žěźŽ¶¨Ž°ú žĄłŽ∂Ä Ž∂ĄŽ•ėŪēīŽ≥ł Í≤įÍ≥ľ, Ūē≠žč†žÉĚŽ¨ľž†ú(anti-neoplastic agents, L01X) 12,240ÍĪī(22.3%), Ūē≠Í≤įŪēĶž†ú(drugs for treatment of tuberculosis, J04A) 6,059ÍĪī(11.1%), žčĚŽ¨ľžĄĪ žēĆžĻľŽ°úžĚīŽďúžôÄ ž≤úžóį Ž¨ľžßą(plant alkaloids and other natural products, L01C) 5,634ÍĪī(10.3%), ÍłįŪÉÄ Ž≤†ŪÉÄ-ŽĚĹŪÉź Ūē≠žÉĚž†ú(other beta-lactam antibacterials, J01D) 3,825ÍĪī(7.0%) žąúžĄúŽ°ú žč†Í≥†ŽźėžóąŽč§. Žč®žĚľ žēĹŽ¨ľŽ°úŽäĒ irinotecanžĚī 2,994ÍĪī(5.5%)žúľŽ°ú ÍįÄžě• ŽßéžēėÍ≥†, oxaliplatin 2,789ÍĪī(5.1%), docetaxel 2,659ÍĪī(4.9%), fentanyl 2,163ÍĪī(3.9%), pyrazinamide 1,700ÍĪī(3.1%) žąúžĚīžóąŽč§(Table 3).
Ūē≠žēĒž†úžóź žĚėŪēú žēĹŽ¨ľžĚīžÉĀŽįėžĚϞ̥ žāīŪéīŽ≥īŽ©ī, Í≤Ĺž¶ĚžĚī 11,706ÍĪī(48.4%), ž§ĎŽďĪž¶Ě 9,979ÍĪī(44.8%), ž§Ďž¶ĚžĚī 437ÍĪī(6.8%)žĚīžóąŽč§. žúĄž§ĎŽŹĄŽ°ú Ž∂ĄŽ•ėŪēėžėĞ̥ ŽēĆŽäĒ žč¨ÍįĀŪēėžßÄ žēäžĚĆžĚī 22,118ÍĪī(91.4%), žč¨ÍįĀŪē®žĚī 2,089ÍĪī(8.63%)žĚī Ž≥īÍ≥†ŽźėžóąŽč§. SOCŽ≥ĄŽ°ú Ž∂ĄŽ•ėŪēīŽ≥īžēėžĚĄ ŽēĆ žúĄžě•ÍīÄÍ≥Ą žßąŪôėžĚī 7,548ÍĪī(31.2%)žúľŽ°ú ÍįÄžě• ŽßéžēėžúľŽ©į, ŪĒľŽ∂Ä ŽįŹ Ž∂ÄžÜćÍłįÍīÄžĚī 5,675ÍĪī(23.45%), ž†Ąžč† žßąŪôė 3,831ÍĪī(15.83%) Í∑ľžú°-Í≥®Í≤©Í≥Ą žßąŪôėžĚī 1,364ÍĪī(5.64%), ž§Ďž∂Ē ŽįŹ Žßźžīąžč†Í≤ĹÍ≥Ą žě•žē† 1,347ÍĪī(5.56%) žąúžĚīžóąŽč§. Ūē≠žēĒž†ú ž§ĎžóźžĄú ÍįÄžě• ŽßéžĚī Ž≥īÍ≥†Žźú žēĹž†úŽď§ žąúžúľŽ°ú ŽāėžóīŪēėžėĞ̥ ŽēĆ, irinotecanžĚī 2,994ÍĪī(5.5%)žúľŽ°ú ÍįÄžě• ŽßéžēėžúľŽ©į, oxaliplatin 2,789ÍĪī(5.1%), docetaxel 2,659ÍĪī(4.9%), rituximab 1,508ÍĪī(2.8%), paclitaxel 1,381ÍĪī(2.5%), cisplatin 1,257ÍĪī(2.3%), carboplatin 1,045ÍĪī(1.9%) žąúžúľŽ°ú Ž≥īÍ≥†ŽźėžóąŽč§. ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄŽ°ú Ž≥īÍ≥†Žźú Ūē≠žēĒž†úŽäĒ oxaliplatinžĚī 207ÍĪī, rituximab 138ÍĪī, etoposide 128ÍĪī, carboplatin 125ÍĪī, paclitaxel 123ÍĪī žąúžúľŽ°ú ŽßéžĚī Ž≥īÍ≥†ŽźėžóąŽč§.
Ūē≠Í≤įŪēĶž†ú žā¨Ž°ÄŽď§žĚĄ Ž∂ĄžĄĚŪēīŽ≥īžēėžĚĄ ŽēĆ, Í≤Ĺž¶ĚžĚī 1,901ÍĪī(31.4%), ž§ĎŽďĪž¶ĚžĚī 3,538ÍĪī(58.4%), ž§Ďž¶ĚžĚī 525ÍĪī(8.7%)žĚīžóąŽč§. žúĄž§ĎŽŹĄŽ°ú Ž∂ĄŽ•ėŪēėžėĞ̥ ŽēĆŽäĒ žč¨ÍįĀŪēėžßÄ žēäžĚĆžúľŽ°ú Ž∂ĄŽ•ėŽźú žā¨Ž°ÄÍįÄ 5,689ÍĪī(93.9%), žč¨ÍįĀŪē®žúľŽ°ú Ž∂ĄŽ•ėŽźú žā¨Ž°ÄÍįÄ 370ÍĪīžĚī Ž≥īÍ≥†ŽźėžóąŽč§. Ūē≠Í≤įŪēĶž†úŽď§ ž§Ď pyrazinamideÍįÄ 1,700ÍĪī(2.2%)žúľŽ°ú ÍįÄžě• ŽßéžĚī Ž≥īÍ≥†ŽźėžóąžúľŽ©į, isoniazid 1,654ÍĪī(2.2%), ethambutol 1,628ÍĪī(2.1%) žąúžĚīžóąŽč§. žĚī ž§Ď žúĄž§ĎŽŹĄÍįÄ žč¨ÍįĀŪē®žúľŽ°ú Ž≥īÍ≥†Žźú žā¨Ž°ÄŽď§žĚÄ rifampinžĚī 114ÍĪī(12.7%)žúľŽ°ú ÍįÄžě• ŽßéžēėžúľŽ©į, isoniazid 104ÍĪī(6.3%), ethambutol 82ÍĪī(5.0%), pyrazinamide 64ÍĪī(3.8%) žąúžĚīžóąŽč§. Ūē≠Í≤įŪēĶž†úžóź žĚėŪēú žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚī ÍįÄžě• ŽßéžĚī Ž≥īÍ≥†Žźú SOCŽäĒ ŪĒľŽ∂Ä ŽįŹ Ž∂ÄžÜćÍłįÍīÄžĚī 1,911ÍĪī(31.5%)žúľŽ°ú 1žúĄ(isoniazid: 577ÍĪī, ethambutol: 544ÍĪī, pyrazinamide: 481ÍĪī, rifampin: 309ÍĪī)žėÄžúľŽ©į, žúĄžě•ÍīÄÍ≥Ą ž¶ĚžÉĀžĚī 1,294ÍĪī(21.4%)žúľŽ°ú 2žúĄ(isoniazid: 406ÍĪī, ethambutol: 357ÍĪī, pyrazinamide: 333ÍĪī, rifampin: 198ÍĪī)Ž•ľ žį®žßÄŪēėžėÄžúľŽ©į, ÍįĄ ŽįŹ ŽčīŽŹĄÍ≥Ą žßąŪôėžĚī isoniazidžôÄ rifampinžĚÄ ÍįĀÍįĀ 3žúĄ(isoniazid: 206ÍĪī, rifampin: 115ÍĪī), pyrazinamide, ethambutolžĚÄ ÍįĀÍįĀ 4žúĄ(pyrazinamide: 244ÍĪī, ethambutol: 147ÍĪī)žėÄŽč§.
ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄŽ°ú Ž≥īÍ≥†Žźú ŪŹČÍįÄžßÄ 5,092ÍĪīžĚĄ SOCŽ°ú Ž∂ĄžĄĚŪēú Í≤įÍ≥ľ, 7,615ÍĪīžĚī žěąžóąŽč§. ž†Ąžč† žßąŪôėžĚī 1,549ÍĪī(20.3%)žúľŽ°ú ž†úžĚľ ŽßéžēėžúľŽ©į, ŪĒľŽ∂ÄžôÄ Ž∂ÄžÜćÍłįÍīÄ žě•žē† 1,277ÍĪī(16.8%), ÍįĄ ŽįŹ ŽčīŽŹĄÍ≥Ą žßąŪôė 765ÍĪī(10.0%), žúĄžě•ÍīÄÍ≥Ą žě•žē† 537ÍĪī(7.1%) žąúžúľŽ°ú Ž≥īÍ≥†ŽźėžóąŽč§(Table 2). ž†Ąžč† žßąŪôėžóźžĄúŽäĒ žēĄŽāėŪēĄŽĚĹžčúžä§ŽįėžĚĎ 497ÍĪī(6.5%), žóī 245ÍĪī(3.2%), žēĹŽ¨ľÍ≥ľŽĮľŽįėžĚĎ 189ÍĪī(2.5%), žēĆŽ†ąŽ•īÍłįŽįėžĚĎ 123ÍĪī(1.6%) žąúžúľŽ°ú Ž≥īÍ≥†ÍįÄ ŽźėžóąŽč§. ŪĒľŽ∂ÄžôÄ Ž∂ÄžÜćÍłįÍīÄ žě•žē†žóźžĄúŽäĒ ŽįúžßĄ 472ÍĪī(6.2%), ÍįÄŽ†§žõÄž¶Ě 210ÍĪī(2.8%), ŽĎźŽďúŽü¨Íłį 166ÍĪī(2.2%) žąúžúľŽ°ú Ž≥īÍ≥†ŽźėžóąŽč§. ŪĒľŽ∂ÄžôÄ Ž∂ÄžÜćÍłįÍīÄžě•žē†žóźžĄú Ž≥īÍ≥†ÍĪīžąėŽäĒ ŽßéžßÄ žēäžēėžúľŽāė žä§ŪčįŽłźžä§-ž°īžä®ž¶ĚŪõĄÍĶį, ŪĎúŪĒľÍīīžā¨žö©ŪēīŽŹĄ ÍįĀÍįĀ 91ÍĪī(1.2%), 24ÍĪī(0.3%) Ž≥īÍ≥†ŽźėžóąŽč§. ÍįĄ ŽįŹ ŽčīŽŹĄÍ≥Ą žßąŪôėžóźžĄúŽäĒ ÍįĄŪö®žÜĆž¶ĚÍįÄ 278ÍĪī(3.7%), ÍįĄžĄłŪŹ¨žÜźžÉĀ 102ÍĪī(1.3%), ÍįĄÍłįŽä•žĚīžÉĀ 85ÍĪī(1.1%)žúľŽ°ú ÍįĄ ÍīÄŽ†® ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄÍįÄ 465ÍĪī(6.1%) ŽįúžÉĚŪēėžėÄžúľŽ©į, ŽĻĄŽá®ÍłįÍ≥Ą žßąŪôėžóźžĄúŽäĒ žßąžÜĆŪėąž¶ĚžĚī 190ÍĪī(51.6%)žúľŽ°ú ÍįÄžě• ŽßéžēėžúľŽ©į ͳȞĄĪ žč†Ž∂Äž†ĄžĚī 69ÍĪī(18.8%), ŪēćŽá® 15ÍĪī(4.1%), ŪėąŽá® 14ÍĪī(3.8%) žąúžúľŽ°ú ŽįúžÉĚŪēėžėÄŽč§.
Žč®žĚľ žĚīžÉĀžā¨Ž°ÄŽ°úŽäĒ žēĄŽāėŪēĄŽĚĹžčúžä§ ŽįėžĚĎžĚī 497ÍĪī(9.7%)žúľŽ°ú ÍįÄžě• ŽßéžēėÍ≥†, ŽįúžßĄ 472ÍĪī(9.3%), ž†ÄŪėąžēē 441ÍĪī(8.7%), ŪėłŪĚ° Í≥§ŽěÄ 286ÍĪī(5.6%), ÍįĄŪö®žÜĆž¶ĚÍįÄÍįÄ 278ÍĪī(5.5%) žąúžúľŽ°ú Ž≥īÍ≥†ŽźėžóąŽč§(Table 4).
ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄžĚė žõźžĚł žēĹž†ú ž§Ď žÉĀžúĄ 20ÍįÄžßÄ žēĹŽ¨ľžĚĄ ATC-code 4žěźŽ¶¨Ž°ú žĄłŽ∂Ä Ž∂ĄŽ•ėŪēīŽ≥ł Í≤įÍ≥ľ, žēĹŽ¨ľžĚīžÉĀŽįėžĚĎÍ≥ľ žú†žā¨ŪēėÍ≤Ć Ūē≠žēĒž†úŽ°ú žďįžĚīŽäĒ žēĹŽ¨ľÍĶįžĚī 5žĘÖŽ•ė(Ūē≠žč†žÉĚŽ¨ľž†ú; L01X, žčĚŽ¨ľžĄĪ žēĆžĻľŽ°úžĚīŽďúžôÄ ž≤úžóį Ž¨ľžßą; L01C, Ūē≠ŽĆÄžā¨ž†ú; L01B, žēĆŪā¨ŪôĒž†ú; L01A, Ž©īžó≠žĖĶž†úž†ú; L04A)Ž°ú ÍįÄžě• ŽßéžēėŽč§. Í∑ł Ží§Ž•ľ žĚīžĖī Ūē≠žÉĚž†úÍĶįžĚī 6žĘÖŽ•ė(ÍłįŪÉÄ Ž≤†ŪÉÄ-ŽĚĹŪÉź Ūē≠žÉĚž†ú; J01D, ÍłįŪÉÄ Ūē≠žÉĚž†ú; J01X, Ūē≠Í≤įŪēĶž†ú; J04A, Ž≤†ŪÉÄ-ŽĚĹŪÉź Ūē≠žÉĚž†ú, ŪéėŽčąžč§Ž¶į; J01C, ž†Ąžč† Ūē≠žßĄÍ∑†ž†ú; J02A), žč†Í≤ĹÍ≥Ą žēĹŽ¨ľÍĶįžĚī 5žĘÖŽ•ė(Ūē≠ž†ĄÍįĄž†ú; N03A, ÍłįŪÉÄ žßĄŪÜĶž†ú ŽįŹ Ūēīžóīž†ú; N02B, ž†Ąžč†Žßąž∑®ž†ú; N01A, ŽßąžēĹžĄĪ žßĄŪÜĶž†ú; N02A, žąėŽ©īž†ú ŽįŹ žßĄž†ēž†ú; N05C) žąúžúľŽ°ú ŽßéžĚī žč†Í≥†ŽźėžóąŽč§. Žč®žĚľ žēĹŽ¨ľÍĶįžúľŽ°úŽäĒ Ūē≠žč†žÉĚŽ¨ľž†úÍįÄ 585ÍĪī(10.6%), žčĚŽ¨ľžĄĪ žēĆžĻľŽ°úžĚīŽďúžôÄ ž≤úžóįŽ¨ľžßąžĚī 392ÍĪī(7.1%), ÍłįŪÉÄ Ūē≠žÉĚž†úÍįÄ 353ÍĪī(6.4%) žąúžĄúŽ°ú žč†Í≥†ŽźėžóąŽč§. Žč®žĚľ žõźžĚł žēĹž†úŽ°úŽäĒ vancomycinžĚī 339ÍĪī(4.5%)žúľŽ°ú ÍįÄžě• ŽßéžēėžúľŽ©į, oxaliplatin 207ÍĪī(2.7%), piperacillin/tazobactam 190ÍĪī(2.5%), rituximab 138ÍĪī(1.8%) žąúžĚīžóąŽč§(Table 3).
Vancomycinžóź žĚėŪēú ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°Ä 339ÍĪīžúľŽ°ú ŽĻĄŽá®ÍłįÍ≥Ą žßąŪôė 120ÍĪī(35.4%), ŪĒľŽ∂ÄžôÄ Ž∂ÄžÜćÍłįÍīÄ žě•žē† 83ÍĪī(24.5%), ž†Ąžč†ž†Ā žßąŪôė 49ÍĪī(14.5%), ŽįĪŪėąÍĶ¨ ŽįŹ Í∑łŽ¨ľŽāīŪĒľÍ≥Ąžóī žě•žē† 45ÍĪī(13.3%) žąúžĚīžóąŽč§. ÍįúŽ≥Ą žĚīžÉĀžā¨Ž°ÄŽäĒ Ūėąž§ĎŪĀ¨Ž†ąžēĄŪčįŽčĆ ž¶ĚÍįÄÍįÄ 74ÍĪī(21.8%)žúľŽ°ú ÍįÄžě• ŽßéžēėžúľŽ©į, ŽįúžßĄ 50ÍĪī(14.7%), žóī 21ÍĪī(6.2%), Í≥ľŽ¶ĹŽįĪŪėąÍĶ¨ÍįźžÜĆž¶Ě 20ÍĪī(5.9%), ͳȞĄĪ žč†Ž∂Äž†Ą 19ÍĪī(5.6%) žąúžúľŽ°ú ŽįúžÉĚŪēėžėÄŽč§.
Oxaliplatinžóź žĚėŪēú ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°Ä 207ÍĪī ž§Ď ž†Ąžč†ž†Ā žßąŪôėžĚī 107ÍĪī(51.7%)žúľŽ°ú ÍįÄžě• ŽßéžĚī ŽįúžÉĚŪēėžėÄžúľŽ©į, ŪĒľŽ∂ÄžôÄ Ž∂ÄžÜćÍłįÍīÄ žě•žē†ÍįÄ 23ÍĪī(11.1%), ŽįĪŪėąÍĶ¨ ŽįŹ Í∑łŽ¨ľŽāīŪĒľÍ≥Ąžóī žě•žē†ÍįÄ 22ÍĪī(10.6%), ŪėłŪĚ°ÍłįÍ≥Ą žßąŪôė 17ÍĪī(8.2%) žąúžĚīžóąŽč§. ÍįúŽ≥Ą žĚīžÉĀžā¨Ž°ÄŽ°úŽäĒ žēĄŽāėŪēĄŽĚĹžčúžä§ ŽįėžĚĎžĚī 54ÍĪī(26.1%)žúľŽ°ú ÍįÄžě• ŽßéžēėžúľŽ©į, žēĆŽ†ąŽ•īÍłįŽįėžĚĎ 27ÍĪī(13.0%), Í≥ľŽ¶ĹŽįĪŪėąÍĶ¨ÍįźžÜĆž¶Ě 17ÍĪī(8.2%) žąúžúľŽ°ú ŽįúžÉĚŪēėžėÄŽč§.
Piperacillin/tazobactamžóź žĚėŪēú ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°Ä 190ÍĪī ž§ĎžóźžĄúŽäĒ ŪĒľŽ∂ÄžôÄ Ž∂ÄžÜćÍłįÍīÄ žě•žē†ÍįÄ 40ÍĪī(21.1%)žúľŽ°ú ÍįÄžě• ŽßéžĚī ŽįúžÉĚŪēėžėÄžúľŽ©į, ÍįĄ ŽįŹ ŽčīŽŹĄÍ≥Ą žßąŪôėžĚī 36ÍĪī(18.9%), ž†Ąžč†ž†Ā žßąŪôėžĚī 25ÍĪī(13.2%), ŪėąžÜĆŪĆź, ž∂úŪėą, žĚĎÍ≥† žě•žē†ÍįÄ 22ÍĪī(11.6%) žąúžĚīžóąŽč§. ÍįúŽ≥Ą žĚīžÉĀžā¨Ž°ÄŽ°úŽäĒ ŽįúžßĄžĚī 22ÍĪī(11.6%), ŪėąžÜĆŪĆźÍįźžÜĆž¶ĚžĚī 20ÍĪī(10.5%), Í≥ľŽ¶ĹŽįĪŪėąÍĶ¨ÍįźžÜĆž¶Ě, ÍįĄŪö®žÜĆž¶ĚÍįÄÍįÄ ÍįĀÍįĀ 10ÍĪī(5.3%) žąúžúľŽ°ú ŽįúžÉĚŪēėžėÄŽč§.
ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄŽď§ ž§Ď žēĄŽāėŪēĄŽĚĹžčúžä§ ŽįėžĚϞ̥ žú†ŽįúŪēú žēĹž†úŽď§žĚĄ ATC-code 4žěźŽ¶¨Ž°ú Ž∂ĄŽ•ėŪēėžėĞ̥ ŽēĆ Ūē≠žč†žÉĚŽ¨ľž†ú ŽįŹ Ž©īžó≠žĖĶž†úž†ú Í≥ĄžóīžĚī 164ÍĪī(33.0%)žúľŽ°ú ÍįÄžě• ŽßéžēėŽäĒŽćį, Ūē≠žÉĚž†ú Í≥Ąžóī 114ÍĪī(22.9%), ŽĻĄžä§ŪÖĆŽ°úžĚīŽďúžĄĪ žÜƞ󾞆ú ŽįŹ Ūē≠Ž•ėŽßąŪčįžä§ž†ú Í≥Ąžóī 36ÍĪī(7.2%), žúĄÍ∂§žĖĎ, žúĄžčĚŽŹĄžó≠Ž•ė žßąŪôė žĻėŽ£Ćž†ú Í≥Ąžóī 27ÍĪī(5.4%), Ūē≠Ūėąž†Ąž†ú Í≥Ąžóī 17ÍĪī(3.4%), ÍłįŪÉÄ žßĄŪÜĶž†ú ŽįŹ Ūēīžóīž†ú 11ÍĪī(2.2%), žēĄŪéłžú†žā¨ž†ú Í≥Ąžóī 10ÍĪī(2.0%) žąúžĚīžóąŽč§. Ūē≠žč†žÉĚŽ¨ľž†ú ŽįŹ Ž©īžó≠žĖĶž†úž†ú Í≥ĄžóīžóźžĄúŽäĒ Ūē≠žč†žÉĚŽ¨ľž†úÍįÄ 99ÍĪī(19.9%)žúľŽ°ú ÍįÄžě• ŽßéžēėžúľŽ©į, žčĚŽ¨ľžĄĪ žēĆžĻľŽ°úžĚīŽďúžôÄ ž≤úžóį Ž¨ľžßą 31ÍĪī(6.2%), Ž©īžó≠žĖĶž†úž†ú 27ÍĪī(5.4%) žąúžĚīžóąŽč§. Ūē≠žÉĚž†ú Í≥ĄžóīžóźžĄúŽäĒ ÍłįŪÉÄ Ž≤†ŪÉÄ-ŽĚĹŪÉź Ūē≠žÉĚž†úÍįÄ 60ÍĪī(12.1%), Ž≤†ŪÉÄ-ŽĚĹŪÉź Ūē≠žÉĚž†ú, ŪéėŽčąžč§Ž¶į 28ÍĪī(5.6%), ŪÄīŽÜÄŽ°†(quinolone) 13ÍĪī(2.6%) žąúžĚīžóąŽč§. ŽĻĄžä§ŪÖĆŽ°úžĚīŽďúžĄĪ žÜƞ󾞆ú ŽįŹ Ūē≠Ž•ėŽßąŪčįžä§ž†ú Í≥ĄžóīžóźžĄúŽäĒ ŽĻĄžä§ŪÖĆŽ°úžĚīŽďúžĄĪ žÜƞ󾞆ú 36ÍĪī(7.2%), Í∑ľžĚīžôĄž†ú 26ÍĪī(5.2%) žąúžĚīžóąŽč§. žēĄŽāėŪēĄŽĚĹžčúžä§Ž•ľ žú†ŽįúŪēú žõźžĚł žēĹž†úŽď§ ž§Ď Žč®žĚľ žēĹž†úŽ°úŽäĒ oxaliplatin 54ÍĪī(10.9%), cefaclor 24ÍĪī(4.8%), thymoglobulin 20ÍĪī(4.0%), paclitaxel 19ÍĪī(3.8%), rocuronium 15ÍĪī(3.0%), ranitidine 14ÍĪī(2.8%), rituximabÍ≥ľ aspirin ÍįĀÍįĀ 13ÍĪī(2.6%), cetuximab 11ÍĪī(2.2%), amoxicillin 10ÍĪī(2.0%) žąúžúľŽ°ú žč†Í≥†ŽźėžóąŽč§.
ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄŽď§ ž§Ď žä§ŪčįŽłźžä§-ž°īžä®ž¶ĚŪõĄÍĶįÍ≥ľ ŪĎúŪĒľÍīīžā¨ žö©ŪēīŽ•ľ žú†ŽįúŪēú žēĹž†úŽď§žĚĄ ATC-code 4žěźŽ¶¨Ž°ú Ž∂ĄŽ•ėŪēīŽ≥īžēėžĚĄ ŽēĆ, Ūē≠ÍįĄžßąž†úÍįÄ 31ÍĪī(27.0%)žúľŽ°ú ÍįÄžě• ŽßéžēėžúľŽ©į, ŽĻĄžä§ŪÖĆŽ°úžĚīŽďúžĄĪ žÜĆžóľžßĄŪÜĶž†ú 14ÍĪī(12.2%), ŪÜĶŪíć žĻėŽ£Ćž†úÍįÄ 12ÍĪī(10.4%), Ūē≠žÉĚž†ú Í≥Ąžóī ž§Ď ÍłįŪÉÄ Ž≤†ŪÉÄ-ŽĚĹŪÉź Ūē≠žÉĚž†úÍįÄ 10ÍĪī(8.7%), Ž≤†ŪÉÄ-ŽĚĹŪÉź Ūē≠žÉĚž†úÍįÄ 8ÍĪī(7.0%) žąúžúľŽ°ú ŽāėŪÉÄŽā¨Žč§. Žč®žĚľ žēĹŽ¨ľŽ°úŽäĒ allopurinolžĚī 12ÍĪī(10.4%)žúľŽ°ú ÍįÄžě• ŽßéžēėžúľŽ©į, valproate 7ÍĪī(6.1%), carbamazepineÍ≥ľ lamotrigine ÍįĀÍįĀ 6ÍĪī(5.2%), phenytoin 5ÍĪī(4.3%), vancomycinÍ≥ľ ibuprofen ÍįĀÍįĀ 4ÍĪī(3.5%) žąúžúľŽ°ú žč†Í≥†ŽźėžóąŽč§.
ÍįĄ ŽįŹ ŽčīŽŹĄÍ≥Ą žßąŪôėžĚĄ žú†ŽįúŪēú žēĹž†úŽ•ľ ATC-code 4žěźŽ¶¨Ž°ú Ž∂ĄŽ•ėŪēėžėĞ̥ ŽēĆ Ūē≠žÉĚž†ú Í≥ĄžóīžĚÄ 302ÍĪī(39.5%)žúľŽ°ú ÍįÄžě• ŽßéžēėžúľŽ©į, Ūē≠žč†žÉĚŽ¨ľž†ú ŽįŹ Ž©īžó≠žĖĶž†úž†ú Í≥ĄžóīžĚī 225ÍĪī(29.4%), žč†Í≤ĹÍ≥Ą Í≥ĄžóīžĚī 51ÍĪī(6.7%), Ūėąžē° ŽįŹ Ūėąžē°ŪėēžĄĪÍłįÍīÄ Í≥ĄžóīžĚī 32ÍĪī(4.2%) žāį ÍīÄŽ†® žßąŪôėžóź ŽĆÄŪēú žēĹž†úÍįÄ 21ÍĪī(2.7%) žąúžĚīžóąŽč§. Ūē≠žÉĚž†ú Í≥ĄžóīžóźžĄúŽäĒ Ūē≠Í≤įŪēĶž†úÍįÄ 99ÍĪī(12.9%), ÍłįŪÉÄ Ž≤†ŪÉÄ-ŽĚĹŪÉź Ūē≠žÉĚž†úÍįÄ 66ÍĪī(8.6%), Ž≤†ŪÉÄ-ŽĚĹŪÉź Ūē≠žÉĚž†ú, ŪéėŽčąžč§Ž¶įžĚī 40ÍĪī(5.2%) žąúžĄúŽ°ú ŽßéžĚī žč†Í≥†ŽźėžóąŽč§. Ūē≠žč†žÉĚŽ¨ľž†ú ŽįŹ Ž©īžó≠žĖĶž†úž†ú Í≥ĄžóīžóźžĄúŽäĒ Ūē≠ŽĆÄžā¨Ž¨ľžßą 58ÍĪī(7.6%), ÍłįŪÉÄ Ūē≠žč†žÉĚŽ¨ľž†ú 49ÍĪī(6.4%), žēĆŪā¨ŪôĒž†ú 47ÍĪī(6.1%), žčĚŽ¨ľžĄĪ žēĆžĻľŽ°úžĚīŽďúžôÄ ž≤úžóįŽ¨ľžßą 41ÍĪī(5.4%) žąúžúľŽ°ú žč†Í≥†ŽźėžóąŽč§. Žč®žĚľ žēĹž†úŽ°úŽäĒ methotrexate 37ÍĪī(4.8%), piperacillin/tazobactam 36ÍĪī(4.7%), isoniazid 32ÍĪī(4.2%), rifampicin 30ÍĪī(3.9%), etoposide 28ÍĪī(3.7%) žąúžúľŽ°ú ŽßéžēėŽč§.
ŽĻĄŽá®ÍłįÍ≥Ą žßąŪôėžĚĄ žú†ŽįúŪēú žēĹž†úŽäĒ ATC-code 4žěźŽ¶¨Ž°ú Ž∂ĄŽ•ėŪēėžėĞ̥ ŽēĆ, Ūē≠žÉĚž†ú Í≥ĄžóīžĚī 219ÍĪī(59.5%)žúľŽ°ú ÍįÄžě• ŽßéžēėžúľŽ©į, Í∑ł Ží§Ž•ľ žĚīžĖī Ūē≠žč†žÉĚŽ¨ľž†ú ŽįŹ Ž©īžó≠žĖĶž†úž†ú Í≥ĄžóīžĚī 88ÍĪī(23.9%)žąúžúľŽ°ú žč†Í≥†ŽźėžóąŽč§. Ūē≠žÉĚž†ú Í≥ĄžóīžóźžĄúŽäĒ ÍłįŪÉÄ Ūē≠žÉĚž†ú Í≥Ąžóī 138ÍĪī(37.5%)žúľŽ°ú ÍįÄžě• ŽßéžēėžúľŽ©į, Ūē≠žßĄÍ∑†ž†ú(antimycotics for systemic use, J02A)ÍįÄ 28ÍĪī(7.6%)žúľŽ°ú Ží§Ž•ľ žĚīžóąžúľŽ©į, Ūē≠žč†žÉĚŽ¨ľž†ú ŽįŹ Ž©īžó≠žĖĶž†úž†ú Í≥ĄžóīžóźžĄúŽäĒ žēĆŪā¨ŪôĒž†ú 27ÍĪī(7.4%), ÍłįŪÉÄŪē≠žč†žÉĚŽ¨ľž†úÍįÄ 25ÍĪī(6.8%) žąúžúľŽ°ú ŽßéžēėŽč§. ŽĻĄŽá®ÍłįÍ≥Ą žßąŪôėžĚĄ žú†ŽįúŪēú žēĹž†ú ž§Ď Žč®žĚľžēĹž†úŽ°úŽäĒ vancomycinžĚī 120ÍĪī(32.6%)žúľŽ°ú ÍįÄžě• ŽßéžēėžúľŽ©į, amphotericin B 22ÍĪī(6.0%), acyclovir 16ÍĪī(4.3%), colistin 15ÍĪī(4.1%) žąúžĄúŽ°ú ŽßéžēėŽč§.
Ž≥ł žóįÍĶ¨ŽäĒ ÍĶ≠Žāī 3žį® žĚėŽ£ĆÍłįÍīĞ󟞥ú ŽįúžÉĚŪēėŽäĒ žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚė žĚłÍĶ¨Ūēôž†Ā ŪäĻžĄĪ ŽįŹ žõźžĚł žēĹž†ú, ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°Äžóź ÍīÄŪēú ž†ēŽ≥īŽ•ľ ŪĆĆžēÖŪēėÍłį žúĄŪēī žĄúžöłŽĆÄŪēôÍĶźŽ≥Ďžõźžóź 10ŽÖĄÍįĄ Ž≥īÍ≥†Žźú ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°Ä ž†Ąž≤īžóź ŽĆÄŪēīžĄú Ž∂ĄžĄĚžĚĄ žßĄŪĖČŪēėžėÄŽč§.
žĄĪŽ≥ĄŽ°ú ŽāėŽąĄžĖīŽ≥īŽ©ī žó¨žĄĪžĚī 56.6%, Žā®žĄĪžĚī 43.4%Ž°ú žó¨žĄĪžĚī Žā®žĄĪžóź ŽĻĄŪēī ŽĻĄžú®žĚī ŽÜížēėžúľŽāė ž†Ąž≤ī žēĹž†úžĚė žā¨žö©ŽüČžóź ŽĆÄŪēú ŪÜĶÍ≥ĄŽäĒ žóÜÍłį ŽēĆŽ¨łžóź ŽįúžÉĚŽ•†žĚī ŽćĒ ŽÜížĚÄžßÄŽäĒ ŪôēžĚłŪē† žąė žóÜžóąŽč§. žĄĪŽ≥Ąžóź ŽĒįŽ•ł žį®žĚīŽäĒ žėĀÍĶ≠žóźžĄú žąėŪĖČŽźú žßÄžó≠žā¨ŪöĆ ÍłįŽįė žĹĒŪėłŪäł žóįÍĶ¨ 48ÍįúŽ•ľ Ž∂ĄžĄĚŪēú ŽÖľŽ¨łžóźžĄú žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚī žó¨žĄĪžóźžĄú Žā®žĄĪŽ≥īŽč§ žēĹ 1.5Žįį ŽÜíÍ≤Ć Ž≥īÍ≥†ŽźėžóąžúľŽ©į, žä§ŪéėžĚłžĚė žēĹŽ¨ľÍįźžčú ÍīÄŽ†® Ž≥īÍ≥†žóźžĄú ŽĻĄžä§ŪÖĆŽ°úžĚīŽďúžĄĪ žÜĆžóľžßĄŪÜĶž†úžóź ŽĆÄŪēú žēĹŽ¨ľžĚīžÉĀŽįėžĚĎ ž§Ď 60%ÍįÄ žó¨žĄĪžóźžĄú ŽįúžÉĚŪēėžėÄŽč§Í≥† Ž≥īÍ≥†ŽźėžĖī žú†žā¨Ūēú Í≤įÍ≥ľŽ•ľ Ž≥īžėÄŽč§[14].
žóįŽ†ĻŽ≥ĄŽ°ú Ž≥īžēėžĚĄ ŽēĆŽäĒ žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚÄ 50ŽĆÄžôÄ 60ŽĆĞ󟞥ú ŽßéžĚī Ž≥īÍ≥†ŽźėžóąŽäĒŽćį, žĚīŽäĒ ŪēīŽčĻ žóįŽ†ĻŽĆĞ󟞥ú ž†ĄŽįėž†ĀžĚł žēĹ žā¨žö©ŽüČžĚī ž¶ĚÍįÄŪēėÍłį ŽēĆŽ¨łžóź ŽāėŪÉÄŽāú Í≤įÍ≥ľŽ°ú Ž≥īžĚłŽč§. ÍĪīÍįēŽ≥īŪóėžč¨žā¨ŪŹČÍįÄžõź 2019ŽÖĄ ͳȞó¨žĚėžēĹŪíą ž≤≠ÍĶ¨ ŪėĄŪô©žóź ŽĒįŽ•īŽ©ī 2015ŽÖĄŽ∂ÄŪĄį 2019ŽÖĄÍĻĆžßÄ žóįŽ†ĻŽ≥Ą ž≤≠ÍĶ¨ŪėĄŪô©žóźžĄú 50ŽĆÄÍįÄ 126,454,000ÍĪī(17.8%)žúľŽ°ú ÍįÄžě• ŽßéžĚÄ ž≤≠ÍĶ¨ÍĪīžąėŽ•ľ žį®žßÄŪēėžėÄÍ≥†, 60ŽĆÄÍįÄ 120,878,000ÍĪī(17.0%)žúľŽ°ú Í∑ł Žč§žĚĆžúľŽ°ú ŽßéžĚƞ̥ ŪôēžĚłŪē† žąė žěąžóąžúľŽ©į, ŪäĻŪěą 2018ŽÖĄŽ∂ÄŪĄįŽäĒ 60ŽĆÄžĚė žĚėžēĹŪíą ž≤≠ÍĶ¨ÍĪīžąėÍįÄ 50ŽĆÄŽ•ľ ŽĄėžĖīžĄįŽč§[15].
ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°Ä ÍĪīžąėŽ•ľ žāīŪéīŽ≥īžēėžĚĄ ŽēĆ Žā®žĄĪžĚī žó¨žĄĪŽ≥īŽč§ ŽćĒ ŽßéžēėÍ≥†, ž†Ąž≤ī žēĹŽ¨ľžĚīžÉĀŽįėžĚĎ ž§Ď ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄžĚė ŽĻĄžú®žĚĄ žóįŽ†ĻŽĆÄŽ≥ĄŽ°ú žāīŪéīŽ≥ł Í≤įÍ≥ľ, žÜĆžēĄž≤≠žÜĆŽÖĄÍ≥ľ ŽÖłžĚłžóźžĄú ŽįúžÉĚŽ•†žĚī ŽÜížēĄ žĖĎ Í∑ĻŽč® žóįŽ†ĻžóźžĄú Ž≥īŽč§ ŽćĒ žĄłžč¨Ūēú ž£ľžĚėÍįÄ ŪēĄžöĒŪē®žĚĄ žēĆ žąė žěąžóąŽč§.
Ž≥ł žóįÍĶ¨žóźžĄúŽäĒ žĚėžč¨ žēĹŽ¨ľžĚĄ ATC žĹĒŽďúŽ°ú Ž∂ĄŽ•ėŪēú žěźŽ£ĆŽ•ľ ŪÜĶŪēīžĄú Ūē≠žēĒž†úžôÄ Ūē≠žÉĚž†úžóź žĚėŪēú žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚī Žč§žąė Ž≥īÍ≥†ŽźėžóąžúľŽ©į, ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄŽŹĄ Ūē≠žēĒž†ú ŽįŹ Ūē≠žÉĚž†úžóźžĄú ŽßéžĚī Ž≥īÍ≥†ŽźėžóąžĚƞ̥ ŪôēžĚłŪē† žąė žěąžóąŽč§. ÍĶ≠Žāī 3žį® žĚėŽ£ĆÍłįÍīĞ󟞥ú ŽįúžÉĚŪēú žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžóź ŽĆÄŪēú Ūēú žóįÍĶ¨žóźžĄúŽäĒ žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚė žõźžĚł žēĹŽ¨ľŽ°ú Ūē≠žÉĚž†ú, ž°įžėĀž†ú, ŽßąžēĹžĄĪ žßĄŪÜĶž†úžĚė žąúžĄúŽ°ú Ž≥īÍ≥†ŪēėžėÄžúľŽ©į[9], Žč§Ž•ł ŽĆÄŪēôŽ≥ĎžõźžóźžĄú žąėŪĖČŽźú žóįÍĶ¨žóźžĄúŽŹĄ Ūē≠žÉĚž†úÍįÄ žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚė žõźžĚł žēĹŽ¨ľŽ°ú ŽßéžĚī Ž≥īÍ≥†ŽźėžóąŽč§[10]. Ž≥ł žóįÍĶ¨žóźžĄúŽäĒ žÉĀžúĄ 20žĘÖ žĚīŽāīžóź Ūē≠žēĒž†úÍįÄ 14žĘÖžúľŽ°ú ÍįÄžě• ŽßéžĚī ŪŹ¨Ūē®ŽźėžóąŽäĒŽćį, žĚīŽäĒ Ž≥ł žóįÍĶ¨ÍįÄ žąėŪĖČŽźú ÍłįÍīÄžĚė Ūôėžěź ÍĶ¨žĄĪ ž§Ď Ūē≠žēĒžĻėŽ£ĆŽ•ľ ŽįõŽäĒ ŪôėžěźÍįÄ žÉĀŽĆÄž†ĀžúľŽ°ú ŽßéžēėÍłį ŽēĆŽ¨łžúľŽ°ú ž∂Ēž†ēŽźúŽč§. Ūē≠žēĒž†úŽ•ľ žĚīžĖī Í≤įŪēĶ žĻėŽ£Ćž†úÍįÄ ž†Ąž≤ī 2žúĄŽ°ú Ž≥īÍ≥†ŽźėžóąŽäĒŽćį, žöįŽ¶¨ŽāėŽĚľÍįÄ OECD ÍĶ≠ÍįÄ ž§Ď Í≤įŪēĶ ŽįúžÉĚŽ•†žĚī ŽÜíÍłį ŽēĆŽ¨łžóź[16] žēĹž†ú žā¨žö©ŽüČžĚī Žč§Ž•ł ÍĶ≠ÍįÄžóź ŽĻĄŪēī žā¨žö©ŽüČžĚī ŽßéžēĄ ÍīÄŽ†® žēĹŽ¨ľžĚīžÉĀŽįėžĚĎŽŹĄ žÉĀŽĆÄž†ĀžúľŽ°ú ŽßéžēėžĚĄ Í≤ÉžúľŽ°ú ž∂Ēž†ēŽźúŽč§. 9ŽÖĄÍįĄ ŽĮłÍĶ≠ žčĚŪíąžĚėžēĹÍĶ≠žúľŽ°ú Ž≥īÍ≥†Žźú ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°Äžóź ÍīÄŪēėžó¨ Ž∂ĄžĄĚŪēú žóįÍĶ¨žóźžĄúŽäĒ ÍįÄžě• ŽßéžĚī Ž≥īÍ≥†Žźú žēĹŽ¨ľÍĶįžĚÄ Ūē≠žēĒž†úžėÄžúľŽāė, 2žúĄŽäĒ Ūē≠žöįžöłž†úÍįÄ ŽßéžĚī Ž≥īÍ≥†ŽźėžĖī žį®žĚīÍįÄ žěąžóąŽč§[17].
žēĹŽ¨ľžĚīžÉĀŽįėžĚϞ̥ SOC Ž≥ĄŽ°ú Ž∂ĄŽ•ėŪēú Í≤įÍ≥ľ, žúĄžě•ÍīÄÍ≥Ą žßąŪôėžĚÄ Ž≥īÍ≥†ÍĪīžąėŽäĒ ÍįÄžě• ŽßéžēėžúľŽāė ž§Ďž¶ĚžĚė ŽĻĄžú®žĚī 2.6%žóź Í∑łž≥§Žćė ŽįėŽ©ī, ž†ĀŪėąÍĶ¨ žě•žē†(39.2%), ŪėąžÜĆŪĆź, ž∂úŪėą, žĚĎÍ≥† žě•žē†(33.1%) ŽįĪŪėąÍĶ¨ ŽįŹ Í∑łŽ¨ľŽāīŪĒľÍ≥Ąžóī žě•žē†(31.1%)žôÄ ÍįôžĚÄ Ūėąžē°Ūēôž†Ā žßąŪôėžĚÄ Ž≥īÍ≥†ŽäĒ žÉĀŽĆÄž†ĀžúľŽ°ú ž†ĀžóąžúľŽāė ž§Ďž¶ĚžĚė ŽĻĄžú®žĚī ŽÜížēėŽč§. ÍĶ≠ŽāīžóźžĄú žąėŪĖČŽźú Žč®žĚľ 3žį® žĚėŽ£ĆÍłįÍīĞ󟞥ú ŽįúžÉĚŪēú ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°Äžóź ÍīÄŪēú žóįÍĶ¨žóźžĄúŽŹĄ SOC Ž≥ĄŽ°ú Ž∂ĄŽ•ėŪēėžėĞ̥ ŽēĆ ŽįĪŪėąÍĶ¨ ŽįŹ Í∑łŽ¨ľŽāīŪĒľÍ≥Ąžóī žě•žē†ÍįÄ 15.1%Ž°ú ÍįÄžě• ŽßéžēėžúľŽ©į, žĚľŽįė žč¨ŪėąÍīÄžßąŪôė, ž†Ąžč†ž†Ā žßąŪôė žąúžúľŽ°ú Ž≥īÍ≥†Žźú Í≤ÉÍ≥ľ žú†žā¨Ūēú Í≤įÍ≥ľŽ•ľ Ž≥īžėÄŽč§[9]. ŽĒįŽĚľžĄú Ūėąžē°Í≥ĄŪÜĶžĚė žēĹŽ¨ľžĚīžÉĀŽįėžĚĎžĚī ŽįúžÉĚŪēėžėĞ̥ Í≤Ĺžöį, ž†ĀÍ∑Ļž†ĀžĚł Ž™®ŽčąŪĄįŽßĀžĚī žöĒÍĶ¨ŽźúŽč§.
ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°Ä ž§Ď ÍįÄžě• ŽßéžĚī Ž≥īÍ≥†Žźú žĚīžÉĀžā¨Ž°ÄŽäĒ žēĄŽāėŪēĄŽĚĹžčúžä§ ŽįėžĚĎžĚīžóąžúľŽ©į, Í∑ł Žč§žĚĆžúľŽ°úŽäĒ ŽįúžßĄ, ž†ÄŪėąžēē, ŪėłŪĚ°Í≥§ŽěÄ žąúžúľŽ°ú ŽāėŪÉÄŽā¨Žč§. Í∑łŽü¨Žāė ŽįúžßĄ, ž†ÄŪėąžēē, ŪėłŪĚ°Í≥§ŽěÄžĚÄ žēĄŽāėŪēĄŽĚĹžčúžä§žóź ŽŹôŽįėŽźėžĖī ŽāėŪÉÄŽāėŽäĒ ž¶ĚžÉĀžĚľ žąė žěąžúľŽĮÄŽ°ú, žēĄŽāėŪēĄŽĚĹžčúžä§ ŽįúžÉĚ žā¨Ž°ÄÍįÄ žč§ž†úŽ≥īŽč§ Í≥ľžÜĆŪŹČÍįÄŽźėžóąžĚĄ Í≤ÉžúľŽ°ú ž∂Ēž†ēŽźúŽč§. žĚīŽü¨Ūēú Í≤ĹŪĖ•žĚÄ ŪēúÍĶ≠žĚėžēĹŪíąžēąž†ĄÍīÄŽ¶¨žõźžóź žĚīžÉĀžā¨Ž°Ä Ž≥īÍ≥† žčú ÍįĀ ž¶ĚžÉĀŽ≥ĄŽ°ú ÍįúŽ≥Ą žěÖŽ†•žĚĄ Í∂ĆÍ≥†Ūē®žóź ŽĒįŽ•ł Í≤ÉžúľŽ°ú žēĄŽāėŪēĄŽĚĹžčúžä§žôÄ ÍįôžĚī Ž≥ĶŪē© ž¶ĚžÉĀžúľŽ°ú ŽāėŪÉÄŽāėŽäĒ Í≤Ĺžöįžóź ŽĆÄŪēīžĄúŽäĒ Ž™®Žď† ž¶ĚžÉĀžĚĄ žēĄžöįŽ•īŽäĒ WHO-ART žö©žĖīŽ°ú žěÖŽ†•ŪēėŽäĒ Í≤ÉžĚī ž†ēŪôēŪēú žßĎÍ≥Ąžóź ŽŹĄžõÄžĚī Žź† Í≤ÉžúľŽ°ú žÉĚÍįĀŪēúŽč§.
žä§ŪčįŽłźžä§-ž°īžä®ž¶ĚŪõĄÍĶįÍ≥ľ ŪĎúŪĒľÍīīžā¨žö©ŪēīŽäĒ ŽďúŽ¨ľžßÄŽßĆ ŽįúžÉĚŪēėŽ©ī Žß§žöį žĻėŽ™Öž†ĀžĚł žĚīžÉĀžā¨Ž°ÄŽ°ú žĚėžč¨ žēĹž†úŽď§žĚĄ Ūą¨žó¨Ūē† ŽēĆ ž£ľžĚėÍįÄ ŪēĄžöĒŪēėŽč§. Ž≥ł žóįÍĶ¨žóźžĄú ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄŽď§ ž§Ď žä§ŪčįŽłźžä§-ž°īžä®ž¶ĚŪõĄÍĶįžĚė žõźžĚłžēĹž†úŽď§Ž°úŽäĒ Ūē≠ÍįĄžßąž†ú, ŽĻĄžä§ŪÖĆŽ°úžĚīŽďúžĄĪ žÜĆžóľžßĄŪÜĶž†ú, ŪÜĶŪíć žĻėŽ£Ćž†ú ŽďĪžĚī Žč§žąėŽ•ľ žį®žßÄŪēėžó¨ ÍĶ≠Žāīžôł Žč§Ž•ł žóįÍĶ¨Žď§Í≥ľ ŽĻĄžä∑Ūēú Í≤įÍ≥ľŽ•ľ Ž≥īžėÄŽč§[18-24].
Ž≥ł žóįÍĶ¨ŽäĒ žěźŽįúž†Ā žēĹŽ¨ľžĚīžÉĀŽįėžĚĎ Ž≥īÍ≥†Ž•ľ ŪÜĶŪēī žąėžßĎŽźú žěźŽ£ĆŽ•ľ Ž∂ĄžĄĚŪēú Í≤ÉžúľŽ°ú, žěźŽįúž†Ā Ž≥īÍ≥†žĚė ŪäĻžĄĪžÉĀ ž†ēŽ≥īžĚė ŽĻĄŽö§Ž¶ľ, Í≥ľžÜĆŽ≥īÍ≥† ŽďĪžĚė ŪēúÍ≥Ąž†źžĚī žěąŽč§. ŽėźŪēú ž†Ąž≤ī žēĹŽ¨ľ žā¨žö©ŽüȞ̥ žēĆ žąė žóÜÍłį ŽēĆŽ¨łžóź ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄžĚė ŽįúžÉĚŽ•†žĚĄ Í≥†Ž†§Ūē† žąė žó܎觎äĒ ŪēúÍ≥Ąž†źžĚĄ ÍįĖŽäĒŽč§.
Í∑łŽü¨Žāė Ž≥ł žóįÍĶ¨ŽäĒ Žč®žĚľÍłįÍīĞ󟞥ú žě•ÍłįÍįĄ Ž≥īÍ≥†Žźú ŽąĄž†ĀžěźŽ£ĆŽ•ľ Ūôúžö©Ūēú žóįÍĶ¨Ž°ú, žēĹŽ¨ľžĚīžÉĀŽįėžĚĎÍ≥ľ ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄžĚė žĚłÍĶ¨Ūēôž†Ā ŪäĻžĄĪ ŽįŹ žĚėžč¨žēĹŽ¨ľ, WHO-ARTŽ≥Ą Ž∂ĄŽ•ė ŽďĪžóź ŽĆÄŪēú ž†ēŽ≥īŽ•ľ žēĆ žąė žěąžóąžúľŽ©į, ž§ĎŽĆÄŪēú žĚīžÉĀžā¨Ž°ÄŽ•ľ žú†ŽįúŪēú Í≤ÉžúľŽ°ú žĚėžč¨ŽźėŽäĒ žēĹž†úŽď§žóź ŽĆÄŪēú ž∂ĒÍįÄž†ĀžĚł žóįÍĶ¨Ž•ľ ŪÜĶŪēī ŪēīŽčĻ žēĹž†úžóź ŽĆÄŪēú žēąž†ĄžĄĪžóź Íłįžó¨Ūē† žąė žěąžĚĄ Í≤ÉžúľŽ°ú žÉĚÍįĀŽźúŽč§.
Acknowledgements
Ž≥ł žóįÍĶ¨ŽäĒ 2020ŽÖĄŽŹĄ žčĚŪíąžĚėžēĹŪíąžēąž†Ąž≤ėžĚė žßÄžó≠žĚėžēĹŪíąžēąž†ĄžĄľŪĄį žöīžėĀžėąžāįžúľŽ°ú žąėŪĖČŽźėžóąžúľŽ©į žĚīžóź Íįźžā¨ŽďúŽ¶ĹŽčąŽč§.
REFERENCES
2. Korea Institute of Drug Safety & Risk Management. Trend of reporting on medication safety information in 2019 [Internet]. Anyang: Korea Institute of Drug Safety & Risk Management, c2020. [cited 2020 Jun 5]. Available from: https://nedrug.mfds.go.kr/bbs/2/52/#
3. Baehr A, Pe√Īa JC, Hu DJ. Racial and ethnic disparities in adverse drug events: a systematic review of the literature. J Racial Ethn Health Disparities 2015;2:527‚Äď536.


4. Goldman JL, Sullins A, Sandritter T, Leeder JS, Lowry J. Pediatric pharmacovigilance: enhancing adverse drug reaction reporting in a tertiary care children's hospital. Ther Innov Regul Sci 2013;47:566‚Äď571.


5. Park JY. Analysis of data on capecitabine-related adverse drug reactions from the Korean adverse event reporting system database. Eur J Oncol Nurs 2018;34:55‚Äď60.


6. Kim H, Kim N, Lee DH, Kim HS. Analysis of national pharmacovigilance data associated with statin use in Korea. Basic Clin Pharmacol Toxicol 2017;121:409‚Äď413.


7. Kim S, Park K, Kim MS, Yang BR, Choi HJ, Park BJ. Data-mining for detecting signals of adverse drug reactions of fluoxetine using the Korea Adverse Event Reporting System (KAERS) database. Psychiatry Res 2017;256:237‚Äď242.


8. Lee YK, Shin JS, Kim Y, et al. Antidepressants-related cardiovascular adverse events using the adverse event reporting system. Psychiatry Res 2018;268:441‚Äď446.


9. Seo Y, Han Y, Kim SH, et al. Clinical features of serious adverse drug reactions in a tertiary care hospital in Korea. Korean J Med 2017;92:392‚Äď400.

10. Rew SY, Koh YI, Shin HY, et al. Reporting and clinical features of adverse drug reactions from a single university hospital. Korean J Asthma Allergy Clin Immunol 2011;31:184‚Äď191.
11. An J, Jung H, Kwon OY, et al. Differences in adverse reactions among iodinated contrast media: analysis of the KAERS database. J Allergy Clin Immunol Pract 2019;7:2205‚Äď2211.


12. Prajapati K, Desai M, Shah S, Panchal J, Kapadia J, Dikshit R. An analysis of serious adverse drug reactions at a tertiary care teaching hospital. Perspect Clin Res 2016;7:181‚Äď186.



13. WHO-UMC. The use of the WHO-UMC system for standardised case causality assessment [Internet]. Geneva: WHO, c2013. [cited 2020 Jul 7]. Available from: https://www.who.int/publications/m/item/WHO-causality-assessment
15. Health Insurance Review and Assessment Service. Status of claims for medicines in 2019 [Internet]. Wonuju: Health Insurance Review and Assessment Service, c2018. [cited 2020 Jul 16]. Available from: https://www.hira.or.kr/bbsDummy.do?pgmid=HIRAA020045010000&brdScnBltNo=4&brdBltNo=2331&pageIndex=1#none
17. Sonawane KB, Cheng N, Hansen RA. Serious adverse drug events reported to the FDA: analysis of the FDA adverse event reporting system 2006-2014 database. J Manag Care Spec Pharm 2018;24:682‚Äď690.


18. Abdulah R, Suwandiman TF, Handayani N, et al. Incidence, causative drugs, and economic consequences of drug-induced SJS, TEN, and SJS-TEN overlap and potential drug-drug interactions during treatment: a retrospective analysis at an Indonesian referral hospital. Ther Clin Risk Manag 2017;13:919‚Äď925.
19. Liotti L, Caimmi S, Bottau P, et al. Clinical features, outcomes and treatment in children with drug induced Stevens-Johnson syndrome and toxic epidermal necrolysis. Acta Biomed 2019;90:52‚Äď60.
20. Borrelli EP, Lee EY, Descoteaux AM, Kogut SJ, Caffrey AR. Stevens-Johnson syndrome and toxic epidermal necrolysis with antiepileptic drugs: an analysis of the US Food and Drug Administration adverse event reporting system. Epilepsia 2018;59:2318‚Äď2324.



21. Kang MG, Sohn KH, Kang DY, et al. Analysis of individual case safety reports of severe cutaneous adverse reactions in Korea. Yonsei Med J 2019;60:208‚Äď215.



22. Yang MS, Lee JY, Kim J, et al. Searching for the culprit drugs for Stevens-Johnson syndrome and toxic epidermal necrolysis from a nationwide claim database in Korea. J Allergy Clin Immunol Pract 2020;8:690‚Äď695.e2.


Table 1.
Demographic characteristics of patients with ADRs (n = 49,955)
Table 2.
System organ class of reported adverse drug reactions and serious adverse events
Table 3.
Frequently reported drugs for adverse reactions and serious adverse events by ATC class
J04A: drugs for treatment of tuberculosis, J01C: ő≤-lactam antibacterials, penicillins, J01D: other ő≤-lactam anti-bacterials, J01X: other anti-bacterials, L01A: alkylating agents, L01B: anti-metabolites, L01C: plant alkaloids and other natural products, L01X: anti-neoplastic agents, M01A: anti-inflammatory and anti-rheumatic products, non-steroids, N01A: anesthetics, general, N02A: opioids, N03A: anti-epileptics.
ATC, anatomical therapeutic chemical classification system code.
Table 4.
Top 20 frequently reported serious adverse events
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 3,034 View
- 194 Download



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



