내시경적 역행성 췌담도 조영술 연관 천공의 진단과 치료
Diagnosis and Management of Iatrogenic Endoscopic Retrograde Cholangiopancreatography Perforations Based on the European Society of Gastrointestinal Endoscopy Position Statement
Article information
Trans Abstract
Endoscopic retrograde cholangiopancreatography (ERCP)-related iatrogenic perforations are identified when gas or luminal contents exit the gastrointestinal tract during ERCP. Although perforations are rare, mortality is high; prompt diagnosis and appropriate management are essential. A multidisciplinary approach is required. The vast majority of such patients can be safely managed medically and endoscopically but must be carefully selected. Endoscopic closure can be considered, depending on the type of perforation. In patients who are deteriorating or whose iatrogenic perforations are not securely closed endoscopically, surgery is mandatory.
서 론
내시경적 역행성 췌담도 조영술(endoscopic retrograde cholangiopancreatography, ERCP) 시행 중에 발생하는 의인성 천공은 드물지만 심각한 부작용으로 신속한 진단과 적절한 관리가 매우 중요하다. 최근 유럽 소화기내시경협회(European Society of Gastrointestinal Endoscopy, ESGE)에서 ERCP 연관 천공의 처치와 관련된 2014년 권고안을 개정하여 발표하였다[1]. 의인성 천공은 발생 빈도가 낮기 때문에 대규모의 전향 연구가 어렵고, 따라서 최신 ESGE의 권고안도 가이드라인이 아닌 입장 표명으로 제한되는 단점이 있다.
본 론
정의 및 진단
ERCP 연관 천공은 시술 후 가스 또는 장관 내용물이 위장관 외부에서 관찰되거나, 또는 내시경 검사 중 육안으로 천공이 확인된 경우로 정의한다[2].
천공의 진단 시기는 치료 및 환자 예후에 결정적인 영향을 미친다[3,4]. 환자가 복부 팽만을 동반한 비 전형적 복통, 흉통, 피하 기종, 호흡곤란을 호소하면 의인성 천공을 의심해야 하며, 진단이 지연되면 systemic inflammatory response syndrome, 저혈압, 정신착란 등의 심각한 증상이 발생하게 된다. 천공의 조기 진단은 장 내용물의 다량 누출로 인한 오염을 방지하여 수술 및 내시경 치료를 가능하게 하므로 예후에 중요한 영향을 미치게 된다[5-8]. 천공의 영상 진단을 위해 복부 단순촬영, 복부 전산화단층촬영(computed tomography, CT) 등이 가장 많이 사용된다[9]. 복부 CT는 소량의 장관 외 가스, 장관 내용물 등의 감지가 가능하며, 천공에 대한 내시경 치료 후 완벽한 폐쇄 여부도 확인이 가능하다[6,10]. 수용성 조영제 섭취 후 복부 CT 검사를 시행하면 누출 부위가 효과적으로 표시되어 천공의 진단 및 내시경 치료 후 평가에 도움이 된다. 내시경 시술 후 의인성 천공이 없이 작은 기포가 관찰될 수 있으므로, 영상 검사에서 확인되는 이상들은 반드시 내시경 검사 및 임상 증상과 함께 평가되어야 한다[3,11].
천공의 위치에 다른 분류
ERCP 연관 천공은 천공의 위치에 따라 팽대부를 포함한 췌담관 천공과 십이지장의 비 팽대부 천공으로 분류되고, 치료 방식과 예후에 차이가 있다.
ERCP와 관련된 천공의 위치는 Stapfer의 분류법에 의거하여 위험도 순서에 따라 4가지로 구분한다(Table 1) [12]. 1형 천공은 내시경 자체에 의한 십이지장의 외측 벽의 손상으로 ERCP 연관 천공의 15-20%를 차지한다. 2형 및 3형 천공은 ERCP 연관 천공의 80-85%를 차지하며 유두 팽대부 주위에 주로 발생한다. 4형 천공은 후 복강 내의 공기만 관찰되는 경우이다. 21개의 전향 연구(16,855명)에 대한 체계적인 문헌고찰에서 0.60%의 환자(95% confidence interval [CI] 0.48%-0.72%)에서 ERCP와 관련된 십이지장 또는 췌담관 천공이 보고되었으며, 천공 관련 사망률은 9.90% (95% CI 3.96%-15.84%)였다[13]. 가장 최근 발표된 체계적인 문헌고찰에서도 0.60%의 동일한 천공률이 보고되었다(12개 후향 연구, 42,374명) [14]. 한 후향 연구에서 Stapfer 분류의 2형-4형 천공에서 다음과 같은 위험 요소가 확인되었다[15]: 내시경 유두 절개술(odds ratio [OR] 9.0; 95% CI 3.2-28.1), 담관 협착 및 확장(OR 7.2; 95% CI 1.84-28.11), 총담관 확장(OR 4.07; 95% CI 1.63-10.18), 오디 괄약근 기능 이상(OR 3.8; 95% CI 1.4-11.0), 시술 시간의 연장(OR 1.021; 95% CI 1.006-1.036). 내시경 유두 절제술이 필요한 유두상 병변의 존재(OR 18.0; p<0.01)와 예비 절개술의 시행(OR 3.0; p=0.04)은 다른 연구에서 독립적인 위험인자로 확인되었다[16].
일반적인 치료 고려사항
ERCP 연관 천공은 진단 시점, 내강 내 이물질, 천공의 유형(크기, 위치) 환자의 전반적인 상태 및 병원 내 천공의 치료가 가능한 전문가의 존재, 사용 가능한 봉합 장비의 유무에 따라 보존 치료, 내시경을 통한 봉합, 담즙 배액술, 수술 등을 고려한다. 대부분의 ERCP 연관 천공은 비 수술적인 치료가 권고되지만 여기에는 신중한 선택이 필요하여, Stapfer의 분류에 따른 치료 알고리즘이 제안되었다(Fig. 1). 내시경 검사 종료 후 천공이 확인되는 경우, 1형 천공은 수술 치료가 일차 치료이다. 2형 및 3형 천공의 경우 1형 천공에 비해 크기가 작고 복강 내로 흘러 나간 체액량도 상대적으로 적어 환자의 상태가 안정적이면 보존적인 치료가 우선 권장된다. 내시경 검사 중에 천공이 확인되는 경우 내시경 술기를 이용한 봉합 혹은 스텐트 삽입 등이 권고되며, 가능하면 즉시 시도하여 복막염을 예방하고 수술 필요성을 줄인다[12,17,18]. ERCP 연관 천공이 주로 발생하는 부위인 십이지장은 소장 다른 부위(공장 및 회장)에서 발생하는 천공에 비하여 높은 사망률을 보인다. 이러한 사망률의 차이는 십이지장 내용물의 누출에 대한 전신 반응 및 외과 수술 방식의 차이 때문으로 추정된다. 15건의 십이지장 천공 사례에 대한 후향 분석에서 수술이 지연되면(> 24시간) 사망률이 급격히 증가한다는 사실이 확인되었다[19]. 전체 사망률은 20%였으며, 다른 여러 코호트에서도 유사한 사망률이 보고되었다. 천공에 대하여 내시경 치료를 시행하였을 경우, 입원 기간이 짧아지는 경향이 확인되었다[20-22].
1, 2형 천공은 크기에 따라 다양한 내시경 클립이 적용된다.
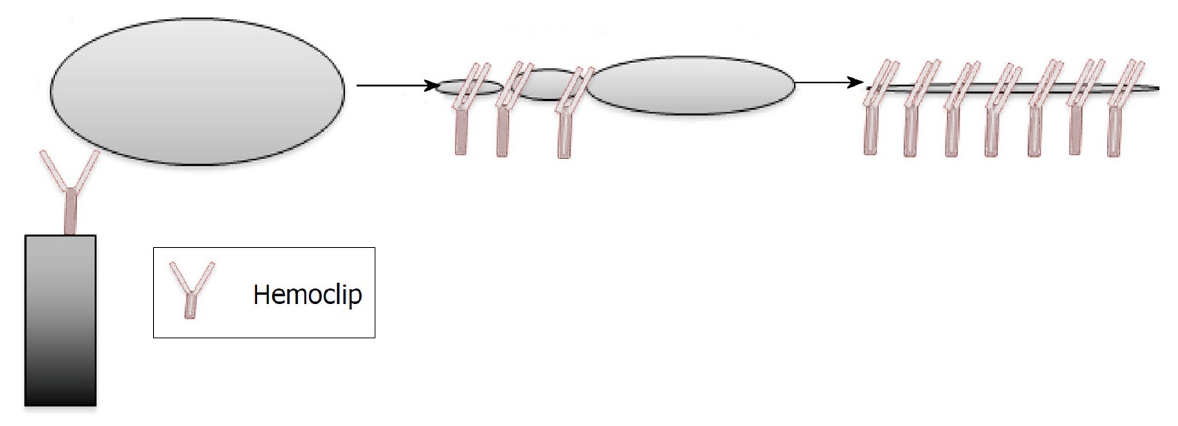
Through-the-scope (TTS) 클립은 천공의 가장자리를 둘러싼 조직이 부드럽고 비섬유성인 경우 유용하다(Fig. 2). 하지만 익폭의 제한 때문에 일반적으로 작은 결함(< 10 mm)에만 적용할 수 있다[23-25]. 좀 더 큰 천공(10-25 mm)은 over-the-scope (OTS) 클립으로 치료할 수 있다(Fig. 3) [23]. 30 mm보다 큰 천공은 내시경 치료가 다소 어렵지만, OTS 클립이나 내시경 봉합 장비(endoscopic suturing device)를 광범위하게 사용하여 치료의 효과를 높일 수 있다[26-30]. 최근 메타분석에서 십이지장 천공의 내시경 치료의 성공률은 88%에 이르는 것으로 보고 되었다[31]. Artifon 등[32]에 따르면 12시간 내에 내시경 치료를 시행한 경우 천공의 종류 및 크기와 무관하게 치료 성공률은 100%로 보고되었다. 1, 2형 천공에서 24시간 내에 수술적 치료를 시행한 경우 사망률은 6.12%였지만 24시간이 경과한 경우 사망률은 17.64%에 달하였다[14]. 천공에 대한 내시경 기술의 발전 및 다양한 클립의 개발로 내시경 치료와 수술적 치료를 결정하는 데 병변 크기의 중요성은 점차 줄어들고 있다. 천공의 발견 시점이 치료 방법을 결정하는 중요한 요인이 되었으며, 수술적 처치 역시 치료 시간이 지연되면 불량한 예후를 보이게 된다. ERCP 시술 중 혹은 시술 후 12시간 내에 발견된 천공은 가능한 내시경적 치료를 우선 시도한다. 비위관 또는 비십이지장관 삽입은 감압 및 소화액의 제거에 도움이 될 수 있다. 긴장성 기복증이 발생하면 가스로 인한 혈역학 불안정 혹은 호흡기 부전이 발생할 수 있으며 구획 증후군으로 진행할 수 있다. 경피적으로 대구경정맥 카테터를 복강 내 삽입 후 복부를 압박하여 응급으로 감압을 수행해야 한다[33]. 공기에 비하여 CO2는 쉽게 장 점막에 흡수되어 호흡기를 통해 제거되므로 시술과 관련된 장 팽창 및 복통을 줄일 수 있다[34,35]. 소화기 내시경 검사에서 CO2의 사용은 표준 관행이 되었으며, 의인성 천공의 위험이 높은 시술 혹은 의인성 천공이 의심되거나 확인된 경우 더욱 중요하다. 의인성 천공의 내시경 봉합 후 예상되는 시술의 성공률과 환자의 전반적인 임상 상태를 고려하여 추가적인 치료가 권장된다. 의인성 천공에 대한 내시경 치료가 실패하였거나 시술을 시행하지 못하는 경우, 그리고 임상 상태가 악화되는 환자는 외과 치료가 권장된다. 의인성 천공은 관리가 복잡하기 때문에 내시경 전문의, 영상의학과 전문의 및 외과 전문의를 포함하는 다학제 접근이 필요하다. 의인성 천공의 후속 조치는 천공의 유형과 부위 및 환자의 임상 상태에 따라 달라진다. 보존 치료는 경정맥 항생제, 금식, 혈역학 모니터링 및 긴밀한 다학제 추적 검사로 구성된다. 비경구영양은 7일 이상 금식이 필요하거나 영양 결핍 환자에게 권장된다. 보존 치료가 실패하고 환자의 상태가 악화되면(패혈증 또는 복막염 징후) 수술을 강력히 고려한다[33,36-38]. 천공의 크기가 크거나, 복막염으로 인한 전신 증상, 패혈증의 진행 등 임상 상태의 악화, 활성 누출의 존재, 경피 배액이 실패하거나 경피 배액이 불가능한 많은 양의 장관 내용물이 복부 CT 검사에서 관찰될 때 조기 수술이 권장된다. 2, 3형의 ERCP 연관 천공은 비수술적 치료에서 대부분 효과적인 반응을 보이지만, 비수술적 치료가 실패하여 지연된 수술적 치료는 불량한 예후를 보인다[39,40]. 비수술적 치료 실패로 24시간이 지연되어 시행된 수술적 처치는 천공의 종류와는 무관하게 이환율, 사망률 및 재원 기간이 증가하는 경과를 보인다[19,41]. 의인성 천공의 외과 수술 방식(laparoscopy vs. open procedure)은 주로 천공의 위치와 외과 의사의 선택에 의해 결정된다.
천공의 위치에 따른 치료
공통적인 조치
천공이 발생하면 입원 및 광범위 항생제 투여를 시행한다. 문헌에 보고된 대부분의 환자는 천공 부위에 체액의 누출을 최소화하기 위해 금식, 비위관(또는 십이지장관) 삽입, 양성자펌프억제제를 투여하였다. 내시경이나 수술을 통해 천공이 성공적으로 봉합된 경우 경구 섭취를 시작할 수 있다. 경정맥영양은 장기간 장내 섭취가 없을 것으로 예상되거나 심각한 영양실조에 걸린 환자에게 권장된다. 의인성 천공의 성공적인 내시경 치료가 예상되면 본래 목적이었던 시술을 완료하는 것이 중요할 수 있다[42]. 시술을 완료하지 않은 환자는 주로 조절되지 않는 담관염으로 임상 경과가 악화되어 사망할 수 있다[43]. 1차 내시경 봉합이 성공하면 천공의 유형과 관계없이 약 90%의 환자가 수술 없이 회복된다. 수술이 필요한 일반적인 징후에는 다량의 조영제 누출, 내시경으로 해결할 수 없는 문제(예: 유두부 종양의 내시경 치료 중 발생한 천공), 심한 복막염, 비수술 치료에도 불구하고 심각한 패혈증, 경피 배액 또는 내시경 초음파 유도 배액이 불가능한 후복막강내 체액 저류 등이 포함된다[44,45]. 발열, 빈맥, 복벽 경직, 백혈구 증가증과 같은 임상 징후는 보존 치료가 실패하였으며 응급 수술이 필요함을 시사한다[33,37,38]. 환자의 임상 상태는 본격적인 복막염이 발생한 경우에만 악화될 수 있다. 따라서 임상 상태에 의존하면 수술이 지연되고, 이환율 및 사망률이 증가하게 된다[19,46].
수술 방식에는 천공의 일차 봉합술, 복부 세척, 배액관 거치 및 십이지장 전환 등이 고려된다[14]. 수술 방식 사이의 전향 비교 연구는 불가능하며 가장 적합한 수술 방식은 천공의 크기와 위치, 발생 시점에서 수술까지의 시간, 환자의 기저 상태 및 현재 임상 상태를 고려하여 결정한다.
유두부 주위 및 췌담관 천공의 치료
유두부 주위 및 췌담관 천공의 국소 치료는 천공의 봉합 또는 천공에서 담즙을 전환하여 자발적인 치유를 유도한다. 2형 천공의 치료는 담즙배액술을 단독으로 시행하거나 내시경 봉합을 함께 시행한다. 2형 및 3형 천공에서 천공 부위로부터 담즙의 전환에는 플라스틱 스텐트, 완전 피막형 자가팽창성 금속스텐트(fully covered self-expandable metal stent, FCSEMS) 및 경비담도배액법 등이 이용된다. 저류된 체액은 경피 배액 혹은 내시경 초음파 유도 하에 내부 배액을 시도 할 수 있다[47].
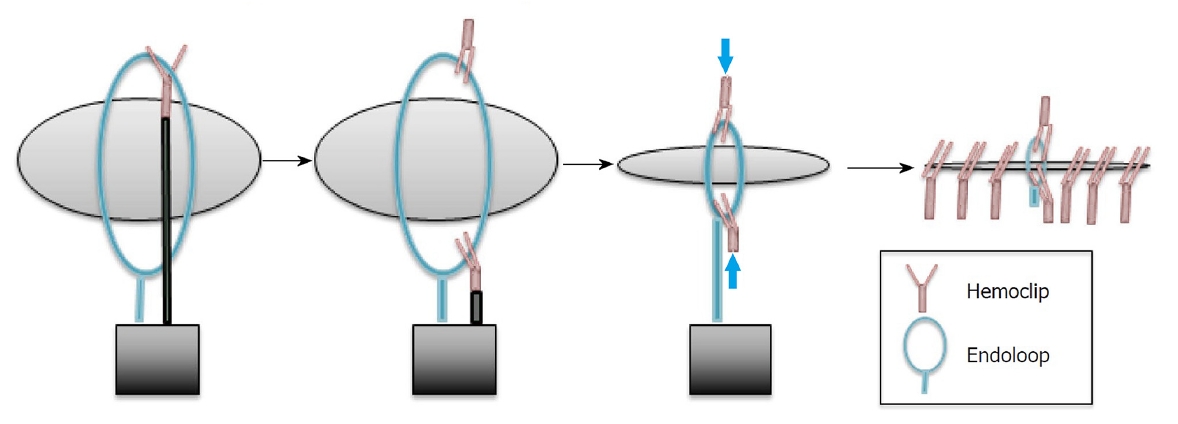
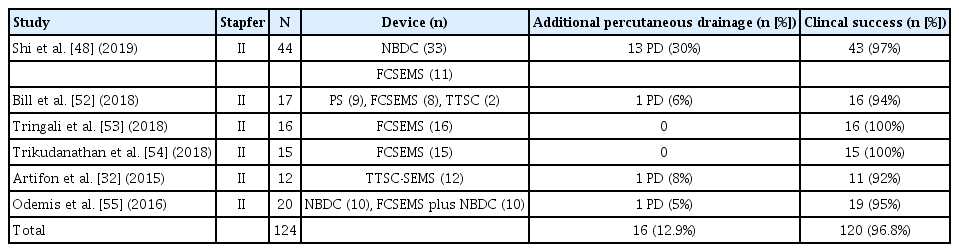
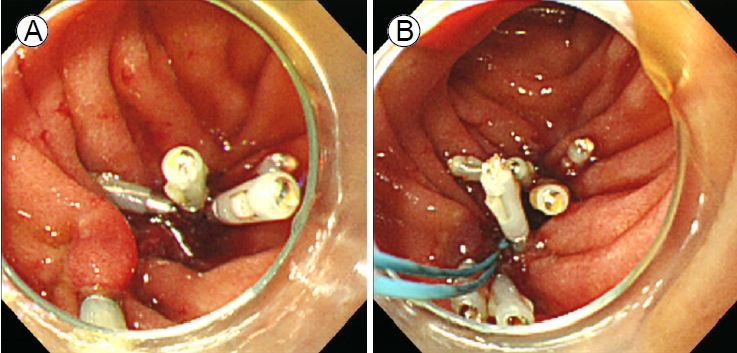
Stapfer의 분류법에 따른 제2형 십이지장 천공은 후복막강과 연결된다. ERCP 시술 중에 2형 천공이 확인되면 시술자는 천공 부위를 막고 내시경 담즙 배액술을 시도하여 담즙 흐름을 천공 부위에서 멀리 떨어뜨려야 한다[48]. 천공의 봉합에 사용되는 TTS 클립은 천공의 크기, 위치, 십이지장경 elevator에 의한 클립 적용의 제한 등 한계가 존재한다. 이러한 문제를 해결하기 위해 여러 개의 TTS 클립을 사용하거나, 좀 더 수월한 클립 적용을 위하여 캡 장착 직시경(cap-fitted endoscope with an axial view)을 사용해 볼 수 있다[20] (Fig. 4). 십이지장경 전용 TTS 클립(duodenoscope-friendly TTS clip)은 시술자에게 더 넓은 시야를 제공하며 elevator와 관련된 클립 적용의 불리함을 극복하는 데 도움이 된다[49]. 큰 천공의 내시경 치료에는 OTS 클립이나 내시경 봉합 장비(endoscopic suturing device)외에 다른 치료 대안으로 단일 또는 이중 채널 내시경을 사용하여 TTS 클립과 endoloop를 같이 적용해 볼 수 있다[50,51] (Fig. 5). 경비 담도 배액과 FCSEMS 삽입을 비교한 두 개의 대규모 연구에서 통증(p=0.005), 재원 기간(p=0.053) 및 후복막강의 농양 발생(p=0.018)에서 FCSEMS 삽입술이 더 나은 결과를 보여주었다(Table 2) [32,48,52-55]. 다량의 조영제 누출이 발생하여 비수술 치료 혹은 자연적으로 해결되지 않는 경우에는 응급수술을 고려한다. 임상적으로 안정된 환자에서 2형 천공이 지연되어 발견된 경우에는 다시 ERCP를 시행하여 담도 스텐트를 삽입한다[56]. 이러한 환자에서 발생할 수 있는 지속되는 후복막강의 저류된 체액은 경피 배액으로 치료할 수 있다[8,57]. 담즙종(biloma)이 발생하였을 경우 내시경 초음파를 이용한 내부배액(internal drainage)은 효과적인 치료 수단이 될 수 있다. 처음에 비수술 치료를 시도한 환자의 1%에서 수술이 필요하였으며, 이러한 경우 사망률이 38%로 더 나쁜 예후를 보여주었다[39]. Stapfer 분류법에 따른 제3형 십이지장 천공은 95%의 환자에서 성공적인 비수술 치료가 가능하므로 우선 보존 치료를 시도한다. ERCP 시술 중에 췌담관에서 상당량의 조영제 유출이 감지되면 FCSEMS 또는 플라스틱 스텐트를 사용하여 천공된 부위의 감압을 고려한다[12,58]. 일반적으로 3형 천공은 좋은 예후를 보인다[39].
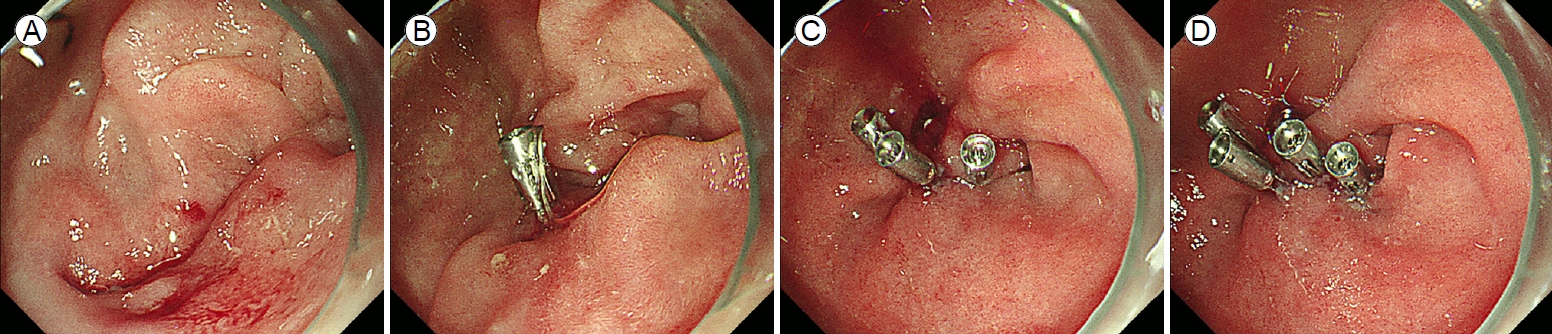
(A) A large perforation in the third duodenal region. (B) Application of the first through-the-scope clip. (C) Application of the second and third through-the-scope clips. (D) Successful primary endoscopic closure via cap-assisted endoscopy using multiple endoclips.
비팽대부위 천공의 치료
Stapfer 분류법에 따른 제1형 십이지장 천공은 ERCP 시술 중 내시경 스콥의 압력과 마찰로 유발되며 비팽대부위에서 발생한다[12]. 최근 체계적인 문헌고찰에 따르면 1형 천공은 ERCP 연관 천공 중에서 두 번째 높은 빈도로 발생하였다[14]. Billroth II 위절제술의 과거력과 기술적으로 어려운 시술은 1형 천공의 주요 위험 요소로 알려져 있다[16,56,59,60]. 최근 후향 연구에 따르면 Billroth II 위절제술을 받은 환자에서 내시경의 루프 모양 삽입(loop-shaped insertion)이 천공의 위험 요소임이 밝혀졌다[61].
의인성 천공이 십이지장 비팽대 부위에 시술 직후 또는 조기에(< 12 시간) 발견되는 경우 우선 내시경 치료가 권장된다. 최근 성공적인 내시경 치료 사례가 증가하고 있으며 응급 수술의 필요성은 감소하고 있다. 하지만 천공을 내시경으로 봉합할 수 없거나, 환자가 상태가 악화되어 내시경 시술을 견딜 수 없는 경우에는 응급 수술이 필요하다. 내시경 시술 후 상당한 시간이 경과하여(> 12시간) 의인성 천공이 진단되고 CT에서 다량의 조영제 누출이 있거나 환자가 범복막염 또는 패혈증을 보이는 경우 수술이 필요하다[14]. 내시경 봉합이 불가능하고 수술도 적합하지 않은 환자에서 다량의 조영제 누출이나 고형물이 없는 액체 저류가 있을 때는 경피 배액이 합리적이다[8,62]. 외과 치료는 이환율과 사망률이 높으므로 적응증이 된다면 가능한 즉각적인 내시경 치료를 우선적으로 선택한다. 1형 천공의 봉합에 가장 흔히 사용되는 기구는 클립이다. 비교적 크기가 큰 천공의 경우, TTS 클립만으로도 충분할 때도 있지만[21,63], endoloop와 TTS 클립을 함께 사용하면 좀 더 성공적으로 봉합할 수 있다[22,51] (Fig. 6). 최근에는 OTS 클립을 적용하여 최대 직경 20 mm의 천공을 봉합할 수 있으며, 경우에 따라 클립 2개를 사용하기도 한다[64,65]. 한 후향 연구에서 OTS 클립을 도입한 후 위장관의 의인성 천공을 위한 수술이 62.5%에서 12.5%로 감소함을 보고하였다[66]. Covered 및 semi-covered SEMS의 사용은 현재 상부위장관 천공의 새로운 치료 대안으로 연구되고 있으며, 향후 의인성 천공 치료에 가능한 도구로 기대되고 있다[67]. 1형 천공의 성공적인 내시경 치료가 증가함에 따라 ERCP 연관 천공에서 치료 알고리즘의 수정이 요구되고 있다[40].
결 론
ERCP 연관 천공은 발생 빈도는 낮지만 사망률이 10%까지 보고되는 위중한 합병증이다. 대규모의 전향 연구가 불가능하여 구체적인 치료 방침을 제공하는 가이드라인이 존재하지 않는다. 최근 개정된 ESGE 권고안은 내시경 전문의가 의인성 천공 환자를 치료하는 데 도움을 줄 수 있는 정보를 제공하기 위한 목적으로 작성되었으나, 가이드라인이 아니기 때문에 법적인 치료 기준을 설정하는 데 이용할 수 없다. 본 권고안은 근거에 기반한 최선의 해결 방안을 제시하고 있으나 모든 상황에 일괄 적용할 수는 없으며 특정 임상 상황 및 이용 가능한 장비, 인력 등을 종합적으로 고려해서 판단해야 한다. 본 권고안이 향후 ERCP 연관 천공의 신속한 진단과 적절한 치료에 도움이 되길 기대한다.