 |
 |
| Korean J Med > Volume 95(3); 2020 > Article |
|
Abstract
Systemic lupus erythematosus (SLE) is a prototypic autoimmune disease with highly variable clinical and immunological manifestations. Classification and diagnosis of SLE are complicated by the multi-organ nature of the disease and by our incomplete understanding of its pathophysiology. The 1997 update of the 1982 American College of Rheumatology (ACR) criteria for SLE has been widely used for classification of SLE. In order to improve clinical relevance and early diagnosis, the Systemic Lupus Erythematosus International Collaborating Clinics (SLICC) group suggested the 2012 SLICC criteria. These sets of classification criteria have unweighted lists of various serological and clinical findings typical of SLE, can be fulfilled by reaching a sum score of points. The only exception is biopsy-proven lupus nephritis with autoantibodies in the 2012 SLICC criteria. In an attempt to overcome limitations of the previous sets of SLE classification criteria, the new 2019 SLE European League Against Rheumatism/American College of Rheumatology (EULAR/ACR) classification criteria for SLE have been recently published. The 2019 EULAR/ACR criteria include positive ANA at least once as obligatory entry criterion; followed by additive hierarchically clustered and weighted criteria. The structure and weighting of criteria constitute a paradigm shift in the classification of SLE. In the validation cohort, the new criteria had a sensitivity of 96.1% and specificity of 93.4%. This review attempts to delineate the history, performance and limitations of the current sets of SLE criteria.
ņĀäņŗĀĒÖŹļ░śļŻ©ĒæĖņŖż(systemic lupus erythematosus, SLE)ļŖö ņŚ¼ļ¤¼ ĻĖ░Ļ┤ĆņØä ņ╣©ļ▓öĒĢśļŖö ņĀäņŗĀņĀü ņ×ÉĻ░Ćļ®┤ņŚŁ ņ¦łĒÖśņ£╝ļĪ£ ļŗżņ¢æĒĢ£ ņ×ÉĻ░ĆĒĢŁņ▓┤ņÖĆ ļ®┤ņŚŁļ│ĄĒĢ®ņ▓┤ ĒśĢņä▒ņŚÉ ņØśĒĢ┤ ņĪ░ņ¦ü ņåÉņāüņØ┤ ļéśĒāĆļé£ļŗż[1]. ĒĢśļéśņØś ņןĻĖ░ Ļ│äĒåĄ(organ system)ņØä ņ╣©ļ▓öĒĢśļŖö ņןĻĖ░ ĒŖ╣ņØ┤ ņ×ÉĻ░Ćļ®┤ņŚŁ ņ¦łĒÖśĻ│╝ ļŗ¼ļ”¼ ĒÖśņ×Éļ¦łļŗż Ļ░üĻĖ░ ļŗżņ¢æĒĢ£ ņ×äņāü ņ”Øņāüņ£╝ļĪ£ ļ░£ļ│æĒĢĀ ņłś ņ׳ņ£╝ļ®░, ņ¦łļ│æ Ļ▓ĮĻ│╝ņŚÉ ļö░ļØ╝ ļéśĒāĆļéśļŖö ņ×äņāü ņ”ØņāüĻ│╝ ņåīĻ▓¼ļÅä ļ¦żņÜ░ ļŗżņ¢æĒĢśļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ņĀäņŗĀ ņ”Øņāü, Ēö╝ļČĆņĀÉļ¦ē ņ”Øņāü, ĻĘ╝Ļ│©Ļ▓®Ļ│ä ņ”ØņāüņØ┤ ĒØöĒĢśļéś, ņŗĀņןĻ│╝ Ļ░ÖņØĆ ņŗĀņ▓┤ ņŻ╝ņÜö ņןĻĖ░ļÅä ļŗżņ¢æĒĢśĻ▓ī ņ╣©ļ▓öĒĢĀ ņłś ņ׳ļŗż. ļÅÖņØ╝ĒĢ£ ņןĻĖ░ Ļ│äĒåĄ ļé┤ņŚÉņä£ļÅä ņä£ļĪ£ ļŗżļźĖ ņ”ØņāüņØ┤ ļéśĒāĆļéĀ ņłś ņ׳ņ£╝ļ®░, ņØ┤ļōż ņ”ØņāüņØĆ ĒŖ╣ņĀĢ ņ×ÉĻ░ĆĒĢŁņ▓┤ņÖĆ Ļ┤ĆļĀ©ļÉśĻĖ░ļÅä ĒĢ£ļŗż. ĒÖśņ×ÉņØś Ēśłņ▓ŁņŚÉņä£ ļ░£Ļ▓¼ļÉśļŖö ļŗżņ¢æĒĢ£ ņ×ÉĻ░ĆĒĢŁņ▓┤ļŖö ņ¦äļŗ©ņĀü Ļ░Ćņ╣śļź╝ Ļ░¢ņ¦Ćļ¦ī ĒĢŁĒĢĄĒĢŁņ▓┤ņØś Ļ▓ĮņÜ░, ņŚ¼ļ¤¼ ņ×ÉĻ░Ćļ®┤ņŚŁ ņ¦łĒÖśņŚÉņä£ļÅä ļéśĒāĆļéś ĒŖ╣ņØ┤ļÅäĻ░Ć ļ¢©ņ¢┤ņ¦Ćļ®░ ņ¦łĒÖś ĒŖ╣ņØ┤ ĒĢŁņ▓┤ļĪ£ ņĢīļĀżņ¦ä ĒĢŁdsDNAĒĢŁņ▓┤, ĒĢŁSmĒĢŁņ▓┤ ļō▒ņØĆ ņØ╝ļČĆ ĒÖśņ×ÉņŚÉņä£ļ¦ī ņ¢æņä▒ņØä ļ│┤ņŚ¼ ļ»╝Ļ░ÉļÅäĻ░Ć ļ¢©ņ¢┤ņ¦ĆļŖö ļŗ©ņĀÉņØ┤ ņ׳ļŗż[2,3].
SLE ņ¦äļŗ© ĻĖ░ņżĆņ£╝ļĪ£ Ļ░Ćņן ļäÉļ”¼ ņØ┤ņÜ®ļÉśņ¢┤ ņś© Ļ▓āņØĆ 1982ļģä ļ»ĖĻĄŁļźśļ¦łĒŗ░ņŖżĒĢÖĒÜī(American College of Rheumatology, ACR)ņØś ļČäļźś ĻĖ░ņżĆ[4]ņØä ņØ╝ļČĆ Ļ░£ņĀĢĒĢ£ 1997ļģä ACR ļČäļźś ĻĖ░ņżĆņØ┤ļŗż[5]. ņØ┤Ēøä ņäĖĻ│ä ļŻ©ĒæĖņŖż ņĀäļ¼ĖĻ░Ć ļ¬©ņ×ä(Systemic Lupus International Collaborating Centers, SLICC)ņŚÉņä£ ņØ┤ņĀäņØś ļČäļźś ĻĖ░ņżĆņØä ļ│┤ņÖäĒĢśņŚ¼ 2012ļģä SLICC ļČäļźś ĻĖ░ņżĆņØä ļ░£Ēæ£ĒĢśņśĆņ£╝ļ®░[6], ņĄ£ĻĘ╝ ACR Ļ│╝ ņ£Āļ¤Įļźśļ¦łĒŗ░ņŖżĒĢÖĒÜī(European League Against Rheumatism, EULAR)ņŚÉņä£ļŖö ĻĘ╝Ļ▒░ņŚÉ ĻĖ░ļ░śĒĢśĻ│Ā ņĀäļ¼ĖĻ░Ć ņØśĻ▓¼ņØä ņĀłņČ®ĒĢśņŚ¼ ĒĢŁļ¬®ņŚÉ ļö░ļØ╝ Ļ░Ćņżæņ╣śļź╝ ļČĆņŚ¼ĒĢ£ ņāłļĪ£ņÜ┤ 2019ļģä EULAR/ACR ļČäļźś ĻĖ░ņżĆņØä ļ░£Ēæ£ĒĢśņśĆļŗż[7]. SLE ļČäļźś ĻĖ░ņżĆļōżņØĆ ņ×äņāü ņŚ░ĻĄ¼ ņłśĒ¢ēņØä ņ£äĒĢ┤ Ļ│ĀņĢłļÉśņŚłņ¦Ćļ¦ī, ņ¦äļŻī ĒśäņןņŚÉņä£ SLE ĒÖśņ×Éļź╝ Ļ░Éļ│ä ņ¦äļŗ©ĒĢśļŖöļŹ░ ņé¼ņÜ®ĒĢśĻ│Ā ņ׳ņ£╝ļ®░, ņ¦äļŗ©ņØś ļ»╝Ļ░ÉļÅäņÖĆ ĒŖ╣ņØ┤ļÅäļź╝ ļåÆņØ┤Ļ│Ā ņĪ░ĻĖ░ ņ¦äļŗ©ņ£©ņØä Ē¢źņāüņŗ£ĒéżĻĖ░ ņ£äĒĢ┤ Ļ░£ņĀĢļÉśņ¢┤ ņÖöļŗż. ņØ┤ļōżņØĆ ļŗżņ¢æĒĢ£ Ēśłņ▓ŁĒĢÖņĀü ņåīĻ▓¼ ļ░Å ņĀäĒśĢņĀü ņ”ØņāüņØś ļ¬®ļĪØņ£╝ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ņ£╝ļ®░, ĒĢ┤ļŗ╣ ĒĢŁļ¬®ļōżņØś ņĀÉņłś ņ┤ØĒĢ®ņØ┤ ņĀĢĒĢ┤ņ¦ä ņĀÉņłśļź╝ ļäśņ£╝ļ®┤ SLEļĪ£ ļČäļźśĒĢ£ļŗż. ņ£ĀņØ╝ĒĢ£ ņśłņÖĖļŖö ņĪ░ņ¦üĒĢÖņĀüņ£╝ļĪ£ ĒÖĢņ¦äļÉ£ ļŻ©ĒæĖņŖżņŗĀņŚ╝ņØ┤ ņ×ÉĻ░ĆĒĢŁņ▓┤ļź╝ ļÅÖļ░śĒĢśĻ│Ā ņ׳ļŖö Ļ▓ĮņÜ░ļĪ£ 2012ļģä SLICC ļČäļźś ĻĖ░ņżĆņŚÉņä£ ņĀ£ņŗ£ĒĢśĻ│Ā ņ׳ļŗż. Ļ░£ņĀĢļÉ£ 2019ļģä EULAR/ACR ļČäļźś ĻĖ░ņżĆņØĆ ņØ┤ņĀäņØś ļČäļźś ĻĖ░ņżĆĻ│╝ ļŗ¼ļ”¼ ANAļź╝ ņ¦äņ×ģ ĻĖ░ņżĆ(entry criterion)ņ£╝ļĪ£ ņĀ£ņĀĢĒĢśņśĆĻ│Ā Ļ░ü ĒĢŁļ¬®ņŚÉ Ļ░Ćņżæņ╣śļź╝ ļČĆņŚ¼ĒĢśņśĆņ£╝ļ®░, ļČäļźś ĻĖ░ņżĆņØś ļÅÖņØ╝ ņśüņŚŁ ļé┤ ĒĢŁļ¬®ļōż ņżæ Ļ░Ćņן ļåÆņØĆ ņĀÉņłśļ¦īņØä ĒĢ®ņé░ĒĢśļŖö Ļ▓āņØ┤ ĒŖ╣ņ¦ĢņØ┤ļŗż[7]. ļ│ĖĻ│ĀņŚÉņä£ļŖö ņØ┤ņĀäņØś SLE ļČäļźś ĻĖ░ņżĆļōżņØä ļ╣äĻĄÉ┬ĘļČäņäØĒĢśĻ│Ā ņāłļĪ£ņÜ┤ 2019ļģä EULAR/ACR ļČäļźś ĻĖ░ņżĆņØä ņåīĻ░£ĒĢśĻ│Āņ×É ĒĢ£ļŗż. ņØ┤ņÖĆ ĒĢ©Ļ╗ś ņāłļĪ£ņÜ┤ ļČäļźś ĻĖ░ņżĆņØä ļæśļ¤¼ņŗ╝ ļģ╝ļ×ĆĻ│╝ ņ£ĀņÜ®ņä▒ņŚÉ ļīĆĒĢ┤ņä£ļÅä ņé┤ĒÄ┤ļ│┤Ļ│Āņ×É ĒĢ£ļŗż.
1982ļģä ACRņŚÉņä£ ļ░£Ēæ£ĒĢ£ SLE ļČäļźś ĻĖ░ņżĆņØĆ ņ┤Ø 11Ļ░£ ĻĖ░ņżĆņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņĀĖ ņ׳ņ£╝ļ®░, 4Ļ░£ņØś Ēö╝ļČĆņĀÉļ¦ē Ļ┤ĆļĀ© ĻĖ░ņżĆ ļ░Å ņŗ¼ņן Ēś╣ņØĆ ĒÅÉ, ņŗĀņן, ņżæņČöņŗĀĻ▓ĮĻ│ä, Ļ┤ĆņĀł ņ╣©ļ▓öņŚÉ ļīĆĒĢ£ 4Ļ░£ ĻĖ░ņżĆ, ĒśłņĢĪ ļ░Å ļ®┤ņŚŁ Ļ▓Ćņé¼ ņåīĻ▓¼, ANA ņ¢æņä▒ņØä ĒżĒĢ©ĒĢśļŖö ļéśļ©Ėņ¦Ć 3Ļ░£ ĻĖ░ņżĆņ£╝ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ļŗż[4]. 11Ļ░£ņØś ĻĖ░ņżĆ ņżæ 4Ļ░£ ņØ┤ņāüņØä ļ¦īņĪ▒ĒĢśļŖö Ļ▓ĮņÜ░ SLEļĪ£ ļČäļźśĒĢśņśĆļŖöļŹ░, ņØ┤ļōżņØ┤ ļ¬©ļæÉ ļÅÖņŗ£ņŚÉ ņĪ┤ņ×¼ĒĢĀ ĒĢäņÜöļŖö ņŚåņ£╝ļ®░, Ļ│╝Ļ▒░ņŚÉ ņĪ┤ņ×¼Ē¢łļŹś ņ”ØņāüļÅä ĒĢ©Ļ╗ś Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢ£ļŗż. ņØ┤ ļČäļźś ĻĖ░ņżĆņØĆ 10ļģä ņØ┤ņāü Ēæ£ņżĆņ£╝ļĪ£ ņé¼ņÜ®ļÉśņŚłņ£╝ļéś ņØ┤Ēøä Ļ░£ļ░£ļÉ£ ņāłļĪ£ņÜ┤ ņ×ÉĻ░ĆĒĢŁņ▓┤ Ļ▓Ćņé¼ļ▓ĢņØä ļ░śņśüĒĢśņŚ¼ 1997ļģä Ļ░£ņĀĢļÉśņŚłļŗż(Table 1). 1997ļģä Ļ░£ņĀĢļÉ£ ACR ļČäļźś ĻĖ░ņżĆņŚÉņä£ļŖö ļ¦Éņ┤łĒśłņĢĪ ļÅäļ¦ÉņŚÉņä£ Ļ┤Ćņ░░ĒĢśļŹś LE ņäĖĒż Ļ▓Ćņé¼Ļ░Ć ņéŁņĀ£ļÉśĻ│Ā, ļīĆņŗĀ ĒĢŁņØĖņ¦Ćņ¦łĒĢŁņ▓┤ Ļ▓Ćņé¼Ļ░Ć ņČöĻ░ĆļÉśņŚłļŗż. ĒĢŁņØĖņ¦Ćņ¦łĒĢŁņ▓┤ Ļ▓Ćņé¼ ļ░®ļ▓Ģņ£╝ļĪ£ņä£ ĒĢŁcardiolipin ĒĢŁņ▓┤, lupus anticoagulant Ļ▓Ćņé¼ ņ¢æņä▒ņØ┤ ņČöĻ░ĆļÉśņŚłņ£╝ļ®░, ņØ┤ņĀäņØś ļ¦żļÅģļ░śņØæ ņ£äņ¢æņä▒ņØĆ ĒĢŁņØĖņ¦Ćņ¦łĒĢŁņ▓┤ Ļ▓Ćņé¼ ļ░®ļ▓Ģ ņżæ ĒĢśļéśļĪ£ ņ£Āņ¦ĆļÉśņŚłļŗż[8]. ĒĢŁņØĖņ¦Ćņ¦łĒĢŁņ▓┤ Ļ▓Ćņé¼ņØś ņČöĻ░ĆļŖö SLEņØś ļ░£ļ│æļźĀĻ│╝ ņ£Āļ│æļźĀ ļ│ĆĒÖöņŚÉļÅä ņśüĒ¢źņØä ļ»Ėņ│żņ£╝ļ®░[9], ņŗ¼ĒśłĻ┤ĆĻ│ä ņ¦łĒÖśņ£╝ļĪ£ ņØĖĒĢ£ ņé¼ļ¦ØļźĀņØ┤ ņ”ØĻ░ĆĒĢśļ®┤ņä£ ĒĢŁņØĖņ¦Ćņ¦łĒĢŁņ▓┤ļź╝ Ļ░¢ļŖö SLE ĒÖśņ×ÉņØś ĒĢŁĒśłņĀä ņ╣śļŻīņŚÉļÅä Ļ┤Ćņŗ¼ņØä Ļ░¢Ļ▓ī ļÉśņŚłļŗż[10]. 1997ļģä ACR ļČäļźś ĻĖ░ņżĆņØä ļäÉļ”¼ ņé¼ņÜ®ĒĢśĻ▓ī ļÉśļ®┤ņä£ ļ¬ć Ļ░Ćņ¦Ć ļ¼ĖņĀ£ņĀÉļōżņØ┤ ņĀ£ĻĖ░ļÉśņŚłļŗż. ņ┤Ø 11Ļ░Ćņ¦Ć ĻĖ░ņżĆ ņżæ Ēö╝ļČĆņĀÉļ¦ē Ļ┤ĆļĀ© ĻĖ░ņżĆņØ┤ 4Ļ░£ļź╝ ņ░©ņ¦ĆĒĢśņŚ¼ Ēö╝ļČĆ ņ”ØņāüņŚÉ Ļ│╝ļŗżĒĢ£ ņĀÉņłśļź╝ ļČĆņŚ¼ĒĢśļŖö ņĀÉ, ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ┤ ĒÖĢņØĖļÉśņŚłņ£╝ļéś 3Ļ░£ ņØ┤ĒĢśņØś ĻĖ░ņżĆļ¦īņØä ļ¦īņĪ▒ĒĢśļŖö ĒÖśņ×É Ēś╣ņØĆ ņ¦łļ│æ ņ┤łĻĖ░ ĒÖśņ×Éļź╝ ņ¦äļŗ©ĒĢśĻĖ░ ņ¢┤ļĀżņÜ┤ ņĀÉ, ņŗĀĻ▓ĮņĀĢņŗĀĒĢÖņĀü ĻĖ░ņżĆņŚÉ ļ░£ņ×æĻ│╝ ņĀĢņŗĀļ│æ ļæÉ Ļ░Ćņ¦Ćļ¦īņØ┤ ĒżĒĢ©ļÉ£ ņĀÉ ĻĘĖļ”¼Ļ│Ā ņ¦łļ│æĒÖ£ņä▒ļÅäļź╝ ļ░śņśüĒĢśļŖö ļ│┤ņ▓┤ Ļ▓Ćņé¼Ļ░Ć ĒżĒĢ©ļÉśņ¦Ć ņĢŖņĢśļŗżļŖö ņĀÉ ļō▒ņØ┤ļŗż[11]. ņØ┤ļź╝ ļ│┤ņÖäĒĢśĻĖ░ ņ£äĒĢ┤ 2012ļģä SLICCņŚÉņä£ Ļ░£ņĀĢļÉ£ SLE ļČäļźś ĻĖ░ņżĆņØä ļ░£Ēæ£ĒĢśņśĆļŗż[6].
2012 SLICC ļČäļźś ĻĖ░ņżĆņØĆ 11Ļ░£ņØś ņ×äņāü ĻĖ░ņżĆĻ│╝ 6Ļ░£ņØś ļ®┤ņŚŁ ĻĖ░ņżĆņ£╝ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ņ£╝ļ®░, Ļ░üĻ░ü 1Ļ░£ ņØ┤ņāüņØś ņ×äņāüĻ│╝ ļ®┤ņŚŁ ĻĖ░ņżĆņØä ļ¦īņĪ▒ĒĢśĻ│Ā, ņ┤Ø 4Ļ░£ ņØ┤ņāüņØś ĻĖ░ņżĆņØä ņČ®ņĪ▒ĒĢĀ ļĢī SLEļĪ£ ļČäļźśĒĢ£ļŗż. ņØ┤ ņÖĖņŚÉ ANA Ēś╣ņØĆ ĒĢŁdsDNAĒĢŁņ▓┤Ļ░Ć ņ¢æņä▒ņØ┤ļ®┤ņä£ ņĪ░ņ¦üĒĢÖņĀüņ£╝ļĪ£ ļŻ©ĒæĖņŖżņŗĀņŚ╝ņØ┤ ĒÖĢņ¦äļÉ£ Ļ▓ĮņÜ░ņŚÉļŖö ņ£äņØś 4Ļ░Ćņ¦Ć ĻĖ░ņżĆņØä ņČ®ņĪ▒ņŗ£Ēéżņ¦Ć ļ¬╗ĒĢ┤ļÅä SLEļĪ£ ņ¦äļŗ© Ļ░ĆļŖźĒĢśņŚ¼ ļŻ©ĒæĖņŖżņŗĀņŚ╝ņŚÉ ņ¦äļŗ©ņĀüņØĖ Ļ░Ćņżæņ╣śļź╝ ņŻ╝ņŚłļŗż(Table 2). SLE ņ”ØņāüņØä ļŹö ņל ņØ┤ĒĢ┤ĒĢśĻ▓ī ļÉśĻ│Ā, ļŗżņ¢æĒĢ£ ļ®┤ņŚŁĒĢÖņĀü Ļ▓Ćņé¼Ļ░Ć ļ░£ņĀäĒĢ©ņŚÉ ļö░ļØ╝ ņØ┤ļź╝ ļČäļźś ĻĖ░ņżĆņŚÉ ļ░śņśüĒĢśĻ▓ī ļÉśņŚłļŗż. 1997 ACR ļČäļźś ĻĖ░ņżĆĻ│╝ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ 4Ļ░£ņØś Ēö╝ļČĆ Ļ┤ĆļĀ© ĻĖ░ņżĆņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ£╝ļéś, ĻĖēņä▒Ļ│╝ ņĢäĻĖēņä▒ ļŻ©ĒæĖņŖż Ēö╝ļČĆļ│æļ│ĆņØä ĒĢśļéśņØś ĻĖ░ņżĆņ£╝ļĪ£ ņĘ©ĻĖēĒĢśņśĆĻ│Ā, ļ░śĒØöņØ┤ ņŚåļŖö Ēāłļ¬©ļź╝ ļ│äļÅäņØś ĒĢŁļ¬®ņ£╝ļĪ£ ņČöĻ░ĆĒĢśņśĆļŗż. ļ░▒ĒśłĻĄ¼ Ļ░Éņåī, ļ”╝ĒöäĻĄ¼ Ļ░Éņåī, ĒśłņåīĒīÉ Ļ░Éņåīļź╝ ĒĢśļéśņØś ĒśłņĢĪĒĢÖņĀü ĻĖ░ņżĆņ£╝ļĪ£ ļ¼ČņŚłļŹś 1997 ACR ļČäļźś ĻĖ░ņżĆĻ│╝ ļŗ¼ļ”¼ ņØ┤ļōż ĒĢŁļ¬®ņØä ļČäļ”¼ĒĢśņŚ¼ ļÅģļ”ĮņĀü ĻĖ░ņżĆņ£╝ļĪ£ ņĘ©ĻĖēĒĢśņśĆņ£╝ļ®░, ņŗĀĻ▓ĮņĀĢņŗĀĒĢÖņĀü ĻĖ░ņżĆņŚÉņä£ļŖö ĻĖ░ņĪ┤ņØś Ļ▓ĮļĀ©ņØ┤ļéś ņĀĢņŗĀļ│æ ņÖĖņŚÉ ļŗżļ░£ņä▒ ļŗ©ņŗĀĻ▓ĮņŚ╝(mononeuritis multiplex), ņ▓ÖņłśņŚ╝(myelitis), ļ¦Éņ┤ł Ēś╣ņØĆ ļæÉĻ░£ ņŗĀĻ▓Įļ│æņ”Ø(peripheral or cranial neuropathy) ĒĢŁļ¬®ņØä ņČöĻ░ĆĒĢśņŚ¼ ņŗĀĻ▓ĮĻ│ä ņ”ØņāüņØä ņóĆ ļŹö ļŗżņ¢æĒĢśĻ▓ī ļ░śņśüĒĢśĻ│Āņ×É ĒĢśņśĆļŗż[12]. ļśÉĒĢ£ ļ®┤ņŚŁ ĻĖ░ņżĆņŚÉņä£ Ļ░üĻ░üņØś ņ×ÉĻ░ĆĒĢŁņ▓┤ļź╝ Ļ░£ļ│ä ĒĢŁļ¬®ņ£╝ļĪ£ ļČäļ”¼ĒĢśņśĆĻ│Ā ĒĢŁņØĖņ¦Ćņ¦łĒĢŁņ▓┤ Ļ▓Ćņé¼ ļ░®ļ▓Ģņ£╝ļĪ£ ĒĢŁbeta2GP1 ĒĢŁņ▓┤Ļ░Ć ņČöĻ░ĆļÉśņŚłņ£╝ļ®░, ļ│┤ņ▓┤ņÖĆ ņ¦üņĀæ ņ┐░ņŖż Ļ▓Ćņé¼ļź╝ ĒżĒĢ©ĒĢśņśĆļŗż. SLICC ļČäļźś ĻĖ░ņżĆņØś ņ¦äļŗ© ņä▒ļŖźņØĆ 1997 ACR ĻĖ░ņżĆņŚÉ ļ╣äĒĢ┤ ĒŖ╣ņØ┤ļÅäļŖö ļé«ņ¦Ćļ¦ī(83% vs. 96%), ļ»╝Ļ░ÉļÅäĻ░Ć ļŹö ļåÆĻ▓ī ļ│┤Ļ│ĀļÉśņŚłļŗż(97% vs. 84%) [6].
1997ļģä ACR ļČäļźś ĻĖ░ņżĆņØĆ ĒŖ╣ņØ┤ļÅäļŖö ļåÆņ¦Ćļ¦ī(96%) ļ»╝Ļ░ÉļÅäĻ░Ć ļŗżņåī ļ¢©ņ¢┤ņ¦Ćļ®░(83%), 11Ļ░£ ĻĖ░ņżĆņŚÉ ņ¦äļŗ©ņĀüņØĖ Ļ░Ćņżæņ╣śļź╝ ņĀäĒśĆ ļ░śņśüĒĢśņ¦Ć ņĢŖļŖö ļ¼ĖņĀ£ņĀÉņØ┤ ņ׳ļŗż. ņśłļź╝ ļōżļ®┤ ņĪ░ņ¦üĒĢÖņĀüņ£╝ļĪ£ ĒÖĢņØĖļÉ£ ļŻ©ĒæĖņŖżņŗĀņŚ╝ņØ┤ļéś ĒśłĻĄ¼Ļ░Éņåīņ”Ø ļō▒ņØĆ SLEņŚÉ ņóĆ ļŹö ņ¦äļŗ©ņĀüņØĖ ņØśļ»Ėļź╝ Ļ░Ćņ¦ĆļŖö ņåīĻ▓¼ņ£╝ļĪ£ ļ│╝ ņłś ņ׳ļŖöļŹ░, ņØ┤ņŚÉ ļīĆĒĢ£ Ļ│ĀļĀż ņŚåņØ┤ Ļ░ü ĻĖ░ņżĆņØś ņĀÉņłśļź╝ ļÅÖņØ╝ĒĢśĻ▓ī ņé░ņĀĢĒĢśļŖö ļ¼ĖņĀ£ņĀÉņØ┤ ņ׳ņŚłļŗż. 2012 SLICC ĻĖ░ņżĆņØĆ 1997 ACR ĻĖ░ņżĆņŚÉ ļ╣äĒĢ┤ ļ»╝Ļ░ÉļÅäļź╝ Ēü¼Ļ▓ī Ļ░£ņäĀĒĢśņśĆņ¦Ćļ¦ī(97%), ļ░śļīĆļĪ£ ĒŖ╣ņØ┤ļÅäĻ░Ć ļé«ņĢäņ¦ĆļŖö(84%) ĒĢ£Ļ│äļź╝ ļ│┤ņśĆļŗż[6]. ņØ┤ļōżņØä ņ”Øņāü ļ░£Ēśä 5ļģä ņØ┤ļé┤ņØĖ ĒÖśņ×ÉļōżņŚÉĻ▓ī ņĀüņÜ®ĒĢśņśĆņØä ļĢī SLE ņ¦äļŗ©ņŚÉ ļīĆĒĢ£ ļ»╝Ļ░ÉļÅäļŖö 1997 ACR ĻĖ░ņżĆņØĆ 76%, 2012 SLICC ĻĖ░ņżĆņØĆ 89.3%ļĪ£ ļæÉ ļČäļźś ĻĖ░ņżĆ ļ¬©ļæÉ ņ¦łļ│æ ņ┤łĻĖ░ ĒÖśņ×ÉņŚÉ ļīĆĒĢ£ ņ¦äļŗ©ņØ┤ ņĀ£ĒĢ£ņĀüņØ┤ļØ╝Ļ│Ā ĒĢĀ ņłś ņ׳ļŗż[13]. ļśÉĒĢ£ ņØ┤ ļČäļźś ĻĖ░ņżĆļōżņØĆ Ļ░ü ĒĢŁļ¬®ļōżņØ┤ ņä£ļĪ£ ļÅģļ”ĮņĀüņØ┤ļØ╝ļŖö Ļ░ĆņĀĢņØä ļ░öĒāĢņ£╝ļĪ£ ĒĢśĻ│Ā ņ׳ļŖöļŹ░, ļ│äĻ░£ļĪ£ ņĘ©ĻĖēĒĢśĻ│Ā ņ׳ļŖö ĒĢŁļ¬®ļōżņØ┤ ņŗżņĀ£ļĪ£ļŖö ļÅÖņØ╝ĒĢ£ ĒśäņāüĻ│╝ ņŚ░Ļ┤ĆļÉśņ¢┤ ļéśĒāĆļéśļŖö Ļ▓āņØ┤ļØ╝ļ®┤ Ļ░ü ĒĢŁļ¬®ņŚÉ Ļ│╝ļŗżĒĢ£ ņĀÉņłśļź╝ ļČĆņŚ¼ĒĢśļŖö Ļ▓░Ļ│╝ļź╝ ņ┤łļלĒĢĀ Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż. ņŚ¼ļ¤¼ ņĀäļ¼ĖĻ░ĆļōżņØĆ Ļ┤æĻ│╝ļ»╝ņä▒Ļ│╝ ļŻ©ĒæĖņŖżĒÖŹļ░śņ▓śļ¤╝ ņØ╝ļČĆ ņ”ØņāüļōżņØĆ Ļ░ÖņØĆ ĒśäņāüņØś Ļ▓░Ļ│╝ļĪ£ ļÅÖļ░śļÉśļŖö Ļ▓āņØ┤ļØ╝Ļ│Ā ņ¦ĆņĀüĒĢ┤ņÖöļŗż[14,15]. Touma ļō▒[16]ņØĆ SLE ļČäļźś ĻĖ░ņżĆņØś ĒĢŁļ¬® Ļ░äņŚÉ ņŗżņĀ£ļĪ£ ĻĄ░ņ¦æ(cluster) ĒśäņāüņØ┤ ņ׳ļŖöņ¦Ć ņĢīņĢäļ│┤Ļ│Āņ×É ĻĄŁņĀ£ ņĪ░ĻĖ░ ļŻ©ĒæĖņŖż ņĮöĒśĖĒŖĖņŚÉņä£ ņØ┤ļ¤¼ĒĢ£ Ēøäļ│┤ ĻĖ░ņżĆļōżņØś ņŚ░Ļ┤Ćņä▒ņØä ņĪ░ņé¼ĒĢśņśĆĻ│Ā, Euro-Lupus ņĮöĒśĖĒŖĖ ļŹ░ņØ┤Ēä░ļź╝ Ļ▓Ćņ”Ø ņĮöĒśĖĒŖĖļĪ£ ņĀüņÜ®ĒĢśņŚ¼ ĒÅēĻ░ĆĒĢśņśĆļŗż. ĻĘĖ Ļ▓░Ļ│╝ ļ░£ņ¦äņØĆ Ļ┤æĻ│╝ļ»╝ņä▒, Ēāłļ¬©, ĻĄ¼Ļ░ĢĻČżņ¢æĻ│╝ ļÅÖļ░śļÉśļ®░, Ēśłņ▓ŁĒĢÖņĀü ņåīĻ▓¼ ņżæ anti-SmņØĆ anti-dsDNAņÖĆ, anti-RNPņÖĆ anti-RoļŖö anti-LaņÖĆ ļÅÖļ░śĒĢśņŚ¼ ļéśĒāĆļéśĻ│Ā, ĒĢŁņØĖņ¦Ćņ¦łĒĢŁņ▓┤ļōżļÅä ņØ┤ļ¤¼ĒĢ£ ĻĄ░ņ¦æņØ┤ ņ׳ņØīņØä ņĢī ņłś ņ׳ņŚłļŗż[16]. ļö░ļØ╝ņä£ Ēö╝ļČĆņĀÉļ¦ē ĻĖ░ņżĆĻ│╝ ĒśłņĢĪĒĢÖņĀü ĻĖ░ņżĆ, ĒŖ╣ņĀĢ ņ×ÉĻ░ĆĒĢŁņ▓┤ĻĄ░ņŚÉņä£ļŖö ņ¦Ćļéśņ╣£ ņĀÉņłś ļČĆņŚ¼ļź╝ Ēö╝ĒĢśĻĖ░ ņ£äĒĢ┤ Ļ░ÖņØĆ ņśüņŚŁ ļé┤ņØś ĒĢŁļ¬®ļōż ņżæ Ļ░Ćņן ļåÆņØĆ ņĀÉņłśļ¦īņØä ĒĢ®ņé░ĒĢśļŖö Ļ▓āņØ┤ ĒĢ®ļ”¼ņĀüņØ┤ļØ╝Ļ│Ā Ļ▓░ļĪĀņ¦ĆņŚłņ£╝ļ®░, ņØ┤ļŖö 2019 EULAR/ACR ļČäļźś ĻĖ░ņżĆņŚÉņä£ ņĀÉņłś ļČĆĻ│╝ ļ░®ņŗØņØś ĻĘ╝Ļ▒░Ļ░Ć ļÉśņŚłļŗż.
ĻĖ░ņĪ┤ņØś SLE ļČäļźś ĻĖ░ņżĆļōżņØĆ ņ┤łĻĖ░ļ│┤ļŗżļŖö ņ£Āļ│æ ĻĖ░Ļ░äņØ┤ ĻĖ┤ ĒÖśņ×ÉļōżņŚÉ ļŹö ņĀüĒĢ®ĒĢśļŗżļŖö ņĀÉņŚÉņä£ ļ░£ļ│æ ņ┤łĻĖ░ ĒÖśņ×ÉļÅä ņ¦äļŗ©ĒĢĀ ņłś ņ׳ļŖö ņāłļĪ£ņÜ┤ ļČäļźś ĻĖ░ņżĆņØś ĒĢäņÜöņä▒ņØ┤ ņĀ£ĻĖ░ļÉśņŚłļŗż. ļśÉĒĢ£ ļ░£ņĀäļÉ£ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ ļ░Å ņĀäļ¼ĖĻ░Ć ņØśĻ▓¼ ļō▒ņØä ļ░śņśüĒĢśĻĖ░ ņ£äĒĢ┤ ļ»ĖĻĄŁĻ│╝ ņ£Āļ¤Įļźśļ¦łĒŗ░ņŖżĒĢÖĒÜī Ļ│ĄļÅÖņ£╝ļĪ£ ļīĆĻĘ£ļ¬©ņØś ĻĄŁņĀ£ ļŗżĒĢÖņĀ£ ņ£äņøÉĒÜīļź╝ ĻĄ¼ņä▒ĒĢśņśĆņ£╝ļ®░, ņŚ¼ļ¤¼ ĒĢ®ņØś ļŗ©Ļ│äļź╝ Ļ▒░ņ│É ņāłļĪ£ņÜ┤ ļČäļźś ĻĖ░ņżĆņØä ļÅäņČ£ĒĢśņśĆļŗż[7]. 2019 EULAR/ACR ļČäļźś ĻĖ░ņżĆņØĆ ļŗżņØīņØś ļæÉ Ļ░Ćņ¦Ć ĻĖ░ļ│Ė Ļ░£ļģÉņŚÉņä£ ņČ£ļ░£ĒĢśņśĆļŗż. ņ▓½ņ¦Ė, ANAļź╝ ļČäļźś ĻĖ░ņżĆņØś ĒĢśļéśļĪ£ ņ£Āņ¦ĆĒĢśĻĖ░ļ│┤ļŗżļŖö ņ¦äņ×ģ ĻĖ░ņżĆ(entry criterion)ņ£╝ļĪ£ ņ▒äĒāØĒĢśļŖö Ļ▓āņØ┤ ļŹö ļéśņØĆ ņ¦äļŗ© ņä▒ļŖźņØä ļ│┤ņØĖļŗż. ņØ┤ļŖö Ļ░äņĀæļ®┤ņŚŁĒśĢĻ┤æļ▓Ģ(indirect immunofluorescence assay, IFA)ņŚÉņä£ 1:80 ņØ┤ņāüņØś ANA ņ¢æņä▒ņØä ņ¦äņ×ģ ĻĖ░ņżĆņ£╝ļĪ£ ĒĢśļ®┤ ņ¦äļŗ©ņŚÉ ļ¦żņÜ░ ļåÆņØĆ ļ»╝Ļ░ÉļÅäļź╝ ļ│┤ņØĖļŗżļŖö ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ ĻĘ╝Ļ▒░ļĪ£ ĒĢ£ļŗż[17]. ļö░ļØ╝ņä£ ņāłļĪ£ņÜ┤ ļČäļźś ĻĖ░ņżĆņŚÉņä£ļŖö ANAĻ░Ć ĒĢ£ļ▓łņØ┤ļØ╝ļÅä ņ¢æņä▒ņØ┤ņ¢┤ņĢ╝ ļČäļźś ĻĖ░ņżĆņØś ļŗżņØī ļŗ©Ļ│äļĪ£ ņ¦äĒ¢ēĒĢĀ ņłś ņ׳ļŗż(Fig. 1, Table 3). ļæśņ¦Ė, ņØ┤ņĀäņŚÉ ļÅģļ”ĮņĀüņ£╝ļĪ£ ņ£Āņ¦ĆļÉśņ¢┤ ņś© Ļ░ü ĻĖ░ņżĆņØś ņ¦äļŗ©ņĀü Ļ░Ćņ╣śļŖö ļÅÖņØ╝ĒĢśņ¦Ć ņĢŖļŗż. ņśłļź╝ ļōżņ¢┤ ĻĄ¼Ļ░ĢĻČżņ¢æņØä ļŻ©ĒæĖņŖżņŗĀņŚ╝Ļ│╝ ļÅÖļō▒ĒĢśĻ▓ī ņāØĻ░üĒĢĀ ņłś ņŚåļŗżļŖö Ļ▓āņØ┤ļŗż. ņāłļĪ£ņÜ┤ ļČäļźś ĻĖ░ņżĆņØĆ ĒĢŁļ¬®ņŚÉ ļö░ļØ╝ 2-10ņĀÉņØś Ļ░Ćņżæņ╣śļź╝ ļČĆņŚ¼ĒĢśļ®░, 7Ļ░£ņØś ņ×äņāü ĻĖ░ņżĆ(ņĀäņŗĀ ņ”Øņāü, ĒśłņĢĪĒĢÖņĀü ņ¦łĒÖś, ņŗĀĻ▓ĮņĀĢņŗĀ ņ¦łĒÖś, Ēö╝ļČĆņĀÉļ¦ē ņ¦łĒÖś, ņןļ¦ēņŚ╝, ĻĘ╝Ļ│©Ļ▓®Ļ│ä ņ¦łĒÖś, ņŗĀņן ņ¦łĒÖś)Ļ│╝ 3Ļ░£ņØś ļ®┤ņŚŁ ĻĖ░ņżĆ(ĒĢŁņØĖņ¦Ćņ¦łĒĢŁņ▓┤, ļ│┤ņ▓┤, ļŻ©ĒæĖņŖż ĒŖ╣ņØ┤ĒĢŁņ▓┤)ņ£╝ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ļŗż. ļÅÖņØ╝ ņśüņŚŁ ļé┤ ĒĢŁļ¬®ļōż ņżæ Ļ░Ćņן ļåÆņØĆ ņĀÉņłśļ¦īņØä ĒĢ®ņé░ĒĢśņŚ¼ ĒÖśņ×É ņĀÉņłśņØś ņ┤ØĒĢ®ņØ┤ 10ņĀÉ ņØ┤ņāüņØ╝ ļĢī SLEļĪ£ ļČäļźśĒĢ£ļŗż(Fig. 1). ņāłļĪ£ņÜ┤ EULAR/ACR ļČäļźś ĻĖ░ņżĆņØä Ļ▓Ćņ”Ø ņĮöĒśĖĒŖĖņŚÉ ņĀüņÜ®ĒĢśņśĆņØä ļĢī ļ»╝Ļ░ÉļÅäļŖö 96%, ĒŖ╣ņØ┤ļÅäļŖö 93%ļź╝ ļ│┤ņśĆņ£╝ļ®░, 1997 ACR ļČäļźś ĻĖ░ņżĆņØĆ Ļ░üĻ░ü 83%, 93%, 2012 SLICC ļČäļźś ĻĖ░ņżĆņØĆ Ļ░üĻ░ü 97%, 84%ņØĖ Ļ▓āĻ│╝ ļ╣äĻĄÉĒĢśļ®┤ Ļ│╝Ļ▒░ ĻĖ░ņżĆļōżņŚÉ ļ╣äĒĢ┤ ņ¦äļŗ© ļŖźļĀźņØ┤ ļŹö ņÜ░ņłśĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż(Table 4).
2019 ACR/EULAR ļČäļźś ĻĖ░ņżĆņŚÉņä£ļŖö ANA ņżæņÜöņä▒ņØä ņ×¼ņĀĢļ”ĮĒĢśņśĆļŗż[7]. ANA ņ¢æņä▒ņØĆ ĒÅēĻ░ĆņØś ņ▓½ ļŗ©Ļ│äļĪ£ņä£ ļ░śļō£ņŗ£ ĒĢ£ ļ▓łņØ┤ļØ╝ļÅä 1:80 ņØ┤ņāüņØś ņŚŁĻ░Ćļź╝ ļ│┤ņŚ¼ņĢ╝ ĒĢ£ļŗż. ANA ņĖĪņĀĢņØĆ HEp2ņäĖĒżļź╝ ņØ┤ņÜ®ĒĢ£ Ļ░äņĀæļ®┤ņŚŁĒśĢĻ┤æļ▓Ģ(HEp2-IFA)ņØ┤ ņśżļ×£ ĻĖ░Ļ░ä Ēæ£ņżĆ Ļ▓Ćņé¼ļ▓Ģņ£╝ļĪ£ ļäÉļ”¼ ņé¼ņÜ®ļÉśņ¢┤ ņÖöļŗż. ĻĘĖļ¤¼ļéś ļ¬©ļōĀ Ļ▓Ćņé¼ņŗżņŚÉņä£ ņØ┤ Ļ▓Ćņé¼Ļ░Ć Ļ░ĆļŖźĒĢśņ¦ĆļŖö ņĢŖĻĖ░ ļĢīļ¼ĖņŚÉ ņØ┤ņÖĆ ņ£Āņé¼ĒĢ£ ņä▒ļŖźņØä ļ│┤ņØ┤ļŖö Ļ│Āņ▓┤ņāü(solid phase) Ļ▓Ćņé¼ļ▓Ģņ£╝ļĪ£ņä£ ĒÜ©ņåīĻ▓░ĒĢ®ļ®┤ņŚŁĒØĪņ░®ļ▓Ģ(enzyme-linked immunosorbent assay, ELISA), ĒśĢĻ┤æĒÜ©ņåīļ®┤ņŚŁņĖĪņĀĢļ▓Ģ(fluoroenzyme immunoassays, FEIA), ĒÖöĒĢÖļ░£Ļ┤æļ®┤ņŚŁļČäņäØļ▓Ģ(chemiluminescence assays, CLIA) ļō▒ņØä ņØ┤ņÜ®ĒĢ£ ANA Ļ▓ĆņČ£ļÅä ņØ┤ļŻ©ņ¢┤ņ¦ĆĻ│Ā ņ׳ļŗż[18]. ANAļź╝ ņ¦äņ×ģ ĻĖ░ņżĆņ£╝ļĪ£ ņé¼ņÜ®ĒĢ£ļŗżļŖö Ļ▓āņØĆ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ANA ņØīņä▒ņØĖ ĒÖśņ×ÉļŖö ņāł ļČäļźś ĻĖ░ņżĆņŚÉņä£ļŖö SLEļĪ£ ņ¦äļŗ©ĒĢĀ ņłś ņŚåļŗżļŖö Ļ▓āņØä ņØśļ»ĖĒĢ£ļŗż. ĻĘĖļ¤¼ļéś ANA ņØīņä▒ņØĖ SLE ĒÖśņ×ÉĻĄ░ņØ┤ ņØ╝ļČĆ ņĪ┤ņ×¼ĒĢśļŖö Ļ▓āņØĆ ņé¼ņŗżņØ┤ļ®░, ņØ┤ļōżņØä ņ£äĒĢ£ ļīĆņ▓┤ ĻĖ░ņżĆņŚÉ ļīĆĒĢ£ ņČöĻ░ĆņĀü ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż. ļśÉĒĢ£, ANA ņØīņä▒ ņåīĻ▓¼ņØ┤ ņØ┤ļ»Ė SLEļź╝ ņĪ░ņ¦üĒĢÖņĀüņ£╝ļĪ£ ņ¦äļŗ©ļ░øņĢśĻ▒░ļéś Ļ░ĢļĀźĒ׳ ņØśņŗ¼ļÉśļŖö ĒÖśņ×ÉņŚÉĻ▓ī ĒĢäņÜöĒĢ£ ņ╣śļŻī ņĀ£Ļ│ĄņØä ņ¦ĆņŚ░ņŗ£ĒéżļŖö ĻĘ╝Ļ▒░Ļ░Ć ļÉśņ¢┤ņä£ļŖö ņĢł ļÉ£ļŗż. ļŗżļ¦ī ļČäļźś ĻĖ░ņżĆņØĆ ĒÜ©ņ£©ņĀüņØĖ ņ×äņāü ņŚ░ĻĄ¼ņÖĆ ņ×äņāüņŗ£ĒŚśņØä ļ¬®ņĀüņ£╝ļĪ£ ļ¦īļōżņ¢┤ņĪīļŗżļŖö ņĘ©ņ¦ĆņŚÉ ļ╣äņČöņ¢┤ļ│╝ ļĢī ANA ņØīņä▒ņØĖ ĒÖśņ×ÉļŖö ņ×äņāüņŗ£ĒŚśņŚÉņä£ ņĀ£ņÖĖĒĢ┤ļÅä ļ¼┤ļ░®ĒĢśļŗżļŖö Ļ▓āņØ┤ ņĀĆņ×ÉļōżņØś ņāØĻ░üņØ┤ļŗż[7].
ņĪ░ĻĖ░ ļŻ©ĒæĖņŖż ņĮöĒśĖĒŖĖņŚÉņä£ ļŗżļźĖ ņ×ÉĻ░Ćļ®┤ņŚŁ ņ¦łĒÖśņŚÉ ļ╣äĒĢ┤ ļ░£ņŚ┤ņØ┤ ņ┤łĻĖ░ ņ”Øņāüņ£╝ļĪ£ ņ×ÉņŻ╝ ļéśĒāĆļé¼ĻĖ░ ļĢīļ¼ĖņŚÉ ņ×äņāü ĻĖ░ņżĆņŚÉ ļ░£ņŚ┤ņØä ĒżĒĢ©ĒĢśņŚ¼ ņĪ░ĻĖ░ ņ¦äļŗ©ņŚÉ ļÅäņøĆņØä ņŻ╝Ļ│Āņ×É ĒĢśņśĆļŗż. ļśÉĒĢ£ Ļ░ü ĻĖ░ņżĆļōżņØä ļÅÖņØ╝ ņśüņŚŁļ│äļĪ£ ĻĄ¼ņĪ░ĒÖöĒĢśņśĆņ£╝ļ®░, ņ¦äļŗ©ņĀü Ļ░Ćņ╣śņŚÉ ļö░ļØ╝ Ļ░Ćņżæņ╣śļź╝ ļČĆņŚ¼ĒĢśņśĆļŗż. ĻĖēņä▒ ņŗ¼ļ¦ēņŚ╝ņØä ĒØēļ¦ē Ēś╣ņØĆ ņŗ¼ļ¦ēņé╝ņČ£Ļ│╝ ĻĄ¼ļČäĒĢśņśĆĻ│Ā 2012 SLICC ĻĖ░ņżĆņØś ņŗĀĻ▓ĮņĀĢņŗĀ ņ¦łĒÖś ĻĖ░ņżĆņŚÉ ĒżĒĢ©ļÉśņŚłļŹś ļŗżļ░£ņä▒ ļŗ©ņŗĀĻ▓ĮņŚ╝, ņ▓ÖņłśņŚ╝, ļ¦Éņ┤ł Ēś╣ņØĆ ļæÉĻ░£ ņŗĀĻ▓Įļ│æņ”Ø ĒĢŁļ¬®ņØĆ ļŗżņŗ£ ņĀ£ņÖĖļÉśņŚłļŗż. ņŗĀņן ņ¦łĒÖśņŚÉņä£ļÅä ļŻ©ĒæĖņŖżņŗĀņŚ╝ņØś ņĪ░ņ¦üĒĢÖņĀü ļČäļźśņŚÉ ļö░ļØ╝ Ļ░Ćņżæņ╣śļź╝ ļŗżļź┤Ļ▓ī ļČĆņŚ¼ĒĢśņśĆļŖöļŹ░, International Society of Nephrology/Renal Pathology Society ļČäļźś 3ĒśĢ Ēś╣ņØĆ 4ĒśĢņØ┤ 2ĒśĢ Ēś╣ņØĆ 5ĒśĢļ│┤ļŗż ļåÆņØĆ ņĀÉņłśļź╝ ļ░øļŖöļŗż. Ļ▓Ćņé¼ļÅä C3ņÖĆ C4 ļ¬©ļæÉ Ļ░ÉņåīĒĢ£ Ļ▓ĮņÜ░Ļ░Ć ĒĢśļéśļ¦ī Ļ░ÉņåīĒĢ£ Ļ▓ĮņÜ░ļ│┤ļŗż ļåÆņØĆ ņĀÉņłśļź╝ ļ░øļÅäļĪØ ĒĢśņśĆļŗż. Ļ░ü ĒĢŁļ¬®ņØĆ SLE ņÖĖņŚÉ ņØ┤ļź╝ ņäżļ¬ģĒĢĀ ņłś ņ׳ļŖö ņøÉņØĖņØ┤ ņĪ┤ņ×¼ĒĢśņ¦Ć ņĢŖņØä ļĢīļ¦ī ņĀÉņłśļź╝ ļČĆņŚ¼ĒĢ┤ņĢ╝ ĒĢśļ®░, ļÅÖņØ╝ ņśüņŚŁ ļé┤ņŚÉņä£ Ļ░Ćņן ļåÆņØĆ ņĀÉņłśļź╝ ĒĢ®ņé░ĒĢ£ļŗż.
ANAļź╝ ņ¦äņ×ģ ĻĖ░ņżĆņ£╝ļĪ£ ļæÉļŖö Ļ▓āņØĆ ļŗżņØī ņäĖ Ļ░Ćņ¦Ć Ļ░ĆņĀĢņØ┤ ļ¦īņĪ▒ļÉśņ¢┤ņĢ╝ ĒĢ£ļŗż. ņ▓½ņ¦Ė, SLEņŚÉņä£ ANA ņ¢æņä▒ņØĆ ņśłņÖĖ ņŚåņØ┤ ĒĢäņłśņĀüņØ┤ļ®░, ANA ņØīņä▒ ļŻ©ĒæĖņŖżļŖö ļ¦żņÜ░ ļō£ļ¼╝ļŗż[19]. ļæśņ¦Ė, SLEņŚÉņä£ ANA ņ¢æņä▒ņØĆ ņŗ£Ļ░äņØ┤ Ļ▓ĮĻ│╝ĒĢ┤ļÅä ņ¦ĆņåŹļÉ£ļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ ņ¦łļ│æ Ļ▓ĮĻ│╝ ņżæ ņ¢┤ļŖÉ ņŗ£ņĀÉņŚÉ Ļ▓Ćņé¼ĒĢśļŹöļØ╝ļÅä ANA ņ¢æņä▒ņØä ļČäļźś ĻĖ░ņżĆņØś ņČ£ļ░£ņĀÉņ£╝ļĪ£ ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŗż. ņģŗņ¦Ė, ANAļź╝ Ļ▓ĆņČ£ĒĢśļŖö Ēæ£ņżĆ Ļ▓Ćņé¼ļŖö HEp2-IFA Ēś╣ņØĆ Ļ│Āņ▓┤ņāü(solid phase) Ļ▓Ćņé¼ļ▓ĢņØ┤ļŗż. SLEņŚÉņä£ ANA ņ¢æņä▒ņ£©ņØĆ 95-99%ļĪ£ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░, 100%ļĪ£ ļ│┤Ļ│ĀĒĢ£ Ļ▓ĮņÜ░ļŖö ņåīņłśņŚÉ ļČłĻ│╝ĒĢśļŗż[19,20]. ļŗ©ļ®┤ņĀü ņŚ░ĻĄ¼ļōżņŚÉņä£ļŖö ļŹö ļé«Ļ▓ī ļ│┤Ļ│ĀļÉśļŖö Ļ▓ĮņÜ░ļÅä ļ╣łļ▓łĒĢśļ®░, SLEņŚÉņä£ ANAņØś ņŗżņĀ£ ņ¢æņä▒ņ£©ņØĆ ņĢīļĀżņĀĖ ņ׳ņ¦Ć ņĢŖļŗż. ĻĘĖ ņØ┤ņ£ĀļŖö ļīĆņāü ĒÖśņ×É, ņ£Āļ│æ ĻĖ░Ļ░ä, ņØ┤ņĀäņØś ņ╣śļŻī, ņé¼ņÜ®ļÉ£ ANA Ļ▓Ćņé¼ļ▓ĢļōżņØ┤ ļ¬©ļæÉ ļÅÖņØ╝ĒĢśņ¦Ć ņĢŖĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ĒĢŁ IL-6ļź╝ ņØ┤ņÜ®ĒĢ£ 2ņāü ņ×äņāü ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļō▒ļĪØļÉ£ SLE ĒÖśņ×ÉņØś ņäĀļ│ä Ļ▓Ćņé¼ Ļ▓░Ļ│╝ 23.8%Ļ░Ć ANA ņØīņä▒ņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļ®░, ļ▓©ļ”¼ļ¼┤ļ▒ü 2ņāü ņ×äņāü ņŚ░ĻĄ¼ļÅä ANA ņØīņä▒ņ£©ņØä 30%Ļ╣īņ¦Ć ļåÆĻ▓ī ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ļŗż[21]. SLE ĒÖśņ×ÉļŖö ņ¢┤ļŖÉ ņŗ£ĻĖ░ņŚÉ ANAļź╝ Ļ▓Ćņé¼ĒĢ┤ļÅä 100% ņ¢æņä▒ņØ┤ļØ╝ļŖö Ļ▓¼ĒĢ┤ļŖö ņāüļŗ╣ ļČĆļČä Ļ░ĆņĀĢņŚÉ ņØśņĪ┤ĒĢśĻ│Ā ņ׳ļŖö Ļ▓āņØ┤ļŗż. ņØ┤ņŚÉ ANA ņ¢æņä▒ņØä ĒĢäņłś ņ¦äņ×ģņĪ░Ļ▒┤ņ£╝ļĪ£ ņ▒äĒāØĒĢ£ Ļ▓āņŚÉ ļīĆĒĢ┤ ļģ╝ļ×ĆņØ┤ ļÉśĻ│Ā ņ׳ļŗż. ņØ┤ļ»Ė ņ¦äļŗ©ņØ┤ ĒÖĢņĀĢļÉ£ SLE ĒÖśņ×ÉņŚÉņä£ ANA ņØīņä▒ņØ┤ ņ×ÉņŻ╝ ļéśĒāĆļéśļŖö ņØ┤ņ£ĀļŖö ļŗżņØīņØś ļæÉ Ļ░Ćņ¦Ć ņØ┤ņ£ĀĻ░Ć Ļ░ĆļŖźĒĢśļŗż. ĒĢśļéśļŖö ņŗ£Ļ░ä Ļ▓ĮĻ│╝ņŚÉ ļö░ļØ╝ Ēś╣ņØĆ ņ╣śļŻīņŚÉ ļö░ļØ╝ Ēśłņ▓ŁĒĢÖņĀü ņåīĻ▓¼ņØ┤ ļŗ¼ļØ╝ņ¦ł ņłś ņ׳ļŗżļŖö Ļ▓āņØ┤Ļ│Ā, ļŗżļźĖ ĒĢśļéśļŖö Ēśäņ×¼ ņé¼ņÜ®ĒĢśĻ│Ā ņ׳ļŖö Ļ▓Ćņé¼ ļ░®ļ▓ĢņØś ņä▒ļŖźĻ│╝ Ļ┤ĆļĀ©ļÉ£ ĻĖ░ņłĀņĀüņØĖ ļ¼ĖņĀ£ņØ┤ļŗż[22]. 2019 EULAR/ACR ļČäļźś ĻĖ░ņżĆņŚÉņä£ ANA ņ¢æņä▒ņØ┤ ĒĢäņłś ĻĖ░ņżĆņ£╝ļĪ£ ļō▒ņןĒĢ©ņŚÉ ļö░ļØ╝ ļŹö ļéśņØĆ ANA Ļ▓Ćņé¼ļ▓ĢņŚÉ ļīĆĒĢ£ Ļ┤Ćņŗ¼ņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŗż. ANA ņ¢æņä▒ņ£©ņØĆ ņé¼ņÜ®ĒĢ£ Ļ▓Ćņé¼ļ▓ĢĻ│╝ Ļ▓Ćņé¼ ĒéżĒŖĖņŚÉ ļö░ļØ╝ ļŗ¼ļØ╝ņ¦ł ņłś ņ׳ļŗż. ĒĢ£ ņŚ░ĻĄ¼[22]ņŚÉņä£ ņŗĀņן ņ╣©ļ▓öņØ┤ ņŚåĻ│Ā ņ£Āļ│æ ĻĖ░Ļ░äņØ┤ ļŗżņ¢æĒĢ£ 103ļ¬ģņØś SLE ĒÖśņ×É Ēśłņ▓ŁņØä ņäĖ Ļ░Ćņ¦Ć ļŗżļźĖ HEp2-IFA kitļĪ£ Ļ▓Ćņé¼ĒĢśņśĆņØä ļĢī ANA ņØīņä▒ņ£©ņØĆ 4.9-22.3%ļĪ£ ļŗżņ¢æĒĢśĻ▓ī ļéśĒāĆļé¼ļŗż. ELISA Ļ▓Ćņé¼ļ▓ĢņØś ņØīņä▒ņ£©ņØĆ 13.6%ņśĆņ£╝ļ®░, ļŗżņżæļČäņäØļ▓Ģ(multiplex)ņØś ņØīņä▒ņ£©ļÅä 13.6%ņśĆļŗż. ļö░ļØ╝ņä£ ņ¢┤ļ¢ĀĒĢ£ Ļ▓Ćņé¼ļÅä 100%ņØś ņ¢æņä▒ņ£©ņŚÉ ļÅäļŗ¼ĒĢśņ¦Ć ļ¬╗ĒĢśņśĆņ£╝ļ®░, ņØ┤ļōż Ļ▓Ćņé¼ļ▓ĢņØä ņĪ░ĒĢ®ĒĢśņŚ¼ ņé¼ņÜ®ĒĢśņśĆņØä ļĢī ņ¢æņä▒ņ£©ņØ┤ 100%ņŚÉ ĻĘ╝ņĀæĒĢśĻ▓ī ļÉśņŚłļŗż. HEp2-IFA ņŚŁĻ░ĆĻ░Ć 1:80ņØ╝ ļĢī SLE ĒÖĢņ¦äņŚÉ ļīĆĒĢ£ ņÜ░ļÅäļ╣ä(likelihood ratio)ļŖö 1.1ņØ┤ļ®░, ņŚŁĻ░Ćļź╝ 1:160, 1:320, 1:640ņ£╝ļĪ£ ņ”ØĻ░Ćņŗ£Ēéżļ®┤ ņÜ░ļÅäļ╣äļŖö Ļ░üĻ░ü 4.1ļ░░, 7.0ļ░░, 14.7ļ░░ļĪ£ ņ”ØĻ░ĆĒĢśņśĆļŗż[23]. ņĄ£ĻĘ╝ņØś ļ®öĒāĆ ļČäņäØ ņŚ░ĻĄ¼ņŚÉņä£ļŖö HEp2-IFAņÖĆ Ļ│Āņ▓┤ņāü ļČäņäØļ▓Ģ(solid phase assay)ņØĖ FEIA Ļ▓Ćņé¼ļź╝ ļ│æĒ¢ēĒĢśņśĆņØä ļĢī ļŗ©ļÅģ Ļ▓Ćņé¼ļ│┤ļŗż ņ¦äļŗ© ņĀĢĒÖĢļÅäļź╝ ļåÆņØ╝ ņłś ņ׳ļŗżļŖö ņé¼ņŗżņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż[24]. ļŗżņ¢æĒĢ£ ANA Ļ▓Ćņé¼ļ▓ĢņØś ņ¢æņä▒ņ£©ņØ┤ ņØ╝ņĀĢĒĢśņ¦Ć ņĢŖļŗżļŖö ņĀÉĻ│╝ ļŻ©ĒæĖņŖż ĒÖśņ×ÉņØś ņŗżņĀ£ ANA ņ¢æņä▒ņ£©ņØä ņĀĢĒÖĢĒ׳ ļ¬©ļźĖļŗżļŖö ņĀÉņØĆ ņāłļĪ£ņÜ┤ ļČäļźś ĻĖ░ņżĆņØś ļģ╝ļ×ĆņØ┤ ļÉśĻ│Ā ņ׳ļŗż. ņĢ×ņ£╝ļĪ£ ņØ┤ ļ¼ĖņĀ£ņĀÉņØä ĒĢ┤Ļ▓░ĒĢśĻĖ░ ņ£äĒĢ£ ņŚ░ĻĄ¼Ļ░Ć ļŹö ļ¦ÄņØ┤ ņŗ£Ē¢ēļÉśņ¢┤ņĢ╝ ĒĢśļéś Ēśäņ×¼ļĪ£ņä£ļŖö IFAņÖĆ Ļ│Āņ▓┤ņāü ļČäņäØļ▓ĢņØä ļ│æņÜ®ĒĢśļŖö Ļ▓āņØ┤ ņĄ£ņäĀņØś ļ░®ļ▓ĢņØ╝ Ļ▓āņØ┤ļŗż.
2019 EULAR/ACR ĻĖ░ņżĆņØ┤ ļ░£Ēæ£ļÉ£ ņØ┤Ēøä ņØ┤ļź╝ ņŗżņĀ£ ņ¦äļŻī ņżæņØĖ Ēś╣ņØĆ Ļ│╝Ļ▒░ņØś ĒÖśņ×ÉļōżņŚÉĻ▓ī ņĀüņÜ®ĒĢśņŚ¼ ĻĘĖ ņ£ĀņÜ®ņä▒ņØä ņĢīņĢäļ│┤Ļ│Āņ×ÉĒĢśļŖö ņŚ░ĻĄ¼Ļ░Ć ĒÖ£ļ░£Ē׳ ņ¦äĒ¢ēļÉśĻ│Ā ņ׳ļŗż. Sacre ļō▒[25]ņØĆ ņŗ¼ļ¦ēņé╝ņČ£ļĪ£ ņ×ģņøÉĒ¢łļŹś 129ļ¬ģņØś ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņØ┤ ĻĖ░ņżĆņØä ņĀüņÜ®ĒĢśņśĆņØäļĢī 17ļ¬ģņØ┤ SLEļĪ£ ņ¦äļŗ©ļÉśņŚłņ£╝ļ®░, ļ»╝Ļ░ÉļÅäļŖö 100%ņśĆņ£╝ļéś ĒŖ╣ņØ┤ļÅäļŖö 84%ļĪ£ ļŗżņåī ļé«ņĢśļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ņØ┤ņŚÉ Aringer ļō▒[26]ņØĆ Sacre ņŚ░ĻĄ¼ņØś ļ»╝Ļ░ÉļÅäĻ░Ć ļé«ņØĆ Ļ▓āņØĆ ļČäļźś ĻĖ░ņżĆņØä ļČĆņĀüņĀłĒĢśĻ▓ī ņĀüņÜ®ĒĢśņśĆĻĖ░ ļĢīļ¼ĖņØ┤ļØ╝ļŖö ļ░śļĪĀņØä ņĀ£ĻĖ░ĒĢ£ ļ░ö ņ׳ļŗż. ņ”ē, ĒĢ┤ļŗ╣ ņ”ØņāüņØ┤ļéś ņåīĻ▓¼ņØä ņäżļ¬ģĒĢĀ ņłś ņ׳ļŖö ņøÉņØĖņØ┤ SLEņØ╝ ļĢīļ¦ī ņĀÉņłśļź╝ ņé░ņĀĢĒĢ┤ņĢ╝ ĒĢśļŖöļŹ░ ĻĘĖļĀćņ¦Ć ņĢŖņĢśļŗżļŖö Ļ▓āņØ┤ļŗż. Adamichou ļō▒[27]ņØ┤ 1997 ACR, 2012 SLICC, 2019 EULAR/ACR ĻĖ░ņżĆņØä ņĪ░ĻĖ░ ļŻ©ĒæĖņŖż ņĮöĒśĖĒŖĖņŚÉ ņĀüņÜ®ĒĢśņśĆņØä ļĢī ļ»╝Ļ░ÉļÅäļŖö Ļ░üĻ░ü 82.7%, 91.3%, 88.6%ļĪ£ ļéśĒāĆļéś 2012 SLICCĻ│╝ 2019 EULAR/ACR ĻĖ░ņżĆņØ┤ ņĪ░ĻĖ░ ņ¦äļŗ©ņŚÉļŖö ņóĆ ļŹö ņĀüĒĢ®ĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│┤ņśĆļŗż. ņäĖ Ļ░Ćņ¦Ć ĻĖ░ņżĆ ļ¬©ļæÉļź╝ ļ¦īņĪ▒ĒĢśļŖö ĒÖśņ×ÉļŖö 76.7%ņŚÉ ļČłĻ│╝ĒĢśņśĆņ£╝ļ®░, Ļ░ü ĻĖ░ņżĆļ¦łļŗż 25.6-30%ņØś ĒÖśņ×Éļź╝ ņ¦äļŗ©ĒĢśņ¦Ć ļ¬╗ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ļŗż. ņŻ╝ļ¬®ĒĢĀ ņĀÉņØĆ ņ¦äļŗ©ļÉśņ¦Ć ļ¬╗ĒĢ£ ĒÖśņ×ÉņØś ņāüļŗ╣ņłśļŖö ņżæļō▒ļÅä ņØ┤ņāüņØś ņ”ØņāüņØ┤ļéś ņןĻĖ░ ņåÉņāüņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņŚłļŗżļŖö ņĀÉņØ┤ļŗż. ļö░ļØ╝ņä£ SLE ņ¦äļŗ©ņ£©ņØä ĻĘ╣ļīĆĒÖöĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņäĖ Ļ░Ćņ¦Ć ĻĖ░ņżĆ ļ¬©ļæÉļź╝ ņāüĒśĖļ│┤ņÖäņĀüņ£╝ļĪ£ ņé¼ņÜ®ĒĢ┤ņĢ╝ ĒĢ£ļŗżĻ│Ā ņĀ£ņĢłĒĢśņśĆļŗż. ņØ┤ņÖĖ ņ×äņāüņĀü ņ£Āņé¼ņä▒ņØä Ļ│Ąņ£ĀĒĢśļŖö ņć╝ĻĘĖļĀī ņ”ØĒøäĻĄ░Ļ│╝ SLE, ļæÉ ņ¦łĒÖśņØ┤ ĒĢ©Ļ╗ś ļéśĒāĆļéśļŖö ņżæļ│Ą ņ”ØĒøäĻĄ░ņØä Ļ░Éļ│äĒĢśļŖö ļŹ░ņŚÉļÅä ņāłļĪ£ņÜ┤ ļČäļźś ĻĖ░ņżĆņØ┤ ņ£ĀņÜ®ĒĢśņśĆļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ņŚłļŗż[28]. ņĄ£ĻĘ╝ 100ļ¬ģņØś SLE ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢ£ ņØ╝ļ│ĖņØś ĒĢ£ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ņŚÉņä£ļŖö 2019 EULAR/ACR ĻĖ░ņżĆņØś ļ»╝Ļ░ÉļÅäļŖö 92%ļĪ£ 1997 ACR ĻĖ░ņżĆ(97%)ņØ┤ļéś 2012 SLICC ĻĖ░ņżĆ(99%)ņŚÉ ļ╣äĒĢ┤ ļŗżņåī ļé«Ļ▓ī ļéśĒāĆļé¼ļŗż[29]. ļśÉĒĢ£ SLEļĪ£ ņ¦äļŗ©ļÉśņ¦Ć ļ¬╗ĒĢ£ ĒÖśņ×ÉņØś ļīĆļČĆļČäņØĆ ANA ņŚŁĻ░ĆĻ░Ć 1:80 ņØ┤ĒĢśņśĆļŹś ĒÖśņ×ÉļōżļĪ£ ņØ┤ļōżņØś ņ¦äļŗ©ņØä ļåōņ╣śņ¦Ć ņĢŖĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņ¦äņ×ģ ĻĖ░ņżĆņØś ļ│┤ņÖäņØ┤ ĒĢäņÜöĒĢ┤ ļ│┤ņØĖļŗż.
SLEņØś ļ░£ļ│æ ņ¢æņāüņØĆ ĒÖśņ×Éļ¦łļŗż Ēü░ ņ░©ņØ┤ļź╝ ļ│┤ņØ╝ ļ┐Éļ¦ī ņĢäļŗłļØ╝ ļŗżļźĖ ņĀäņŗĀņĀü ņ×ÉĻ░Ćļ®┤ņŚŁ ņ¦łĒÖśĻ│╝ ņżæļ│ĄļÉśļŖö ņåīĻ▓¼ļōżļĪ£ ņØĖĒĢ┤ ņ¦äļŗ©ņŚÉ ņ¢┤ļĀżņøĆņØ┤ ļ¦Äļŗż. SLE ļČäļźś ĻĖ░ņżĆņØĆ ņ×äņāü ņ”Øņāü ļ░Å ņ¦ĢĒøä, Ļ▓Ćņé¼ņŗż ņåīĻ▓¼ņØä ņóģĒĢ®ĒĢśņŚ¼ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ņ£╝ļ®░, ņ¦äļŗ©ņØś ļ»╝Ļ░ÉļÅäņÖĆ ĒŖ╣ņØ┤ļÅäļź╝ ļåÆņØ┤Ļ│Ā, ņĪ░ĻĖ░ ņ¦äļŗ©ņØä Ē¢źņāüņŗ£ĒéżĻĖ░ ņ£äĒĢ┤ ļ░£ņĀäļÉśņ¢┤ ņÖöļŗż. ņ¦ĆĻĖłĻ╣īņ¦Ć 1997ļģä Ļ░£ņĀĢļÉ£ ACR ĻĖ░ņżĆĻ│╝ 2012ļģä SLICC ĻĖ░ņżĆņØä ņ×äņāü ņŚ░ĻĄ¼ ļ░Å ņ¦äļŻī ĒśäņןņŚÉņä£ ļäÉļ”¼ ņé¼ņÜ®ĒĢ┤ ņÖöņ£╝ļéś ņØ┤ņĀä ļČäļźś ĻĖ░ņżĆļōżņØś ļ¼ĖņĀ£ņĀÉņØä ļ│┤Ļ░ĢĒĢśĻ│Ā ņČĢņĀüļÉ£ ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ņÖĆ ņĀäļ¼ĖĻ░Ć ņØśĻ▓¼ņØä ļ░śņśüĒĢśņŚ¼ 2019ļģä ļ»ĖĻĄŁĻ│╝ ņ£Āļ¤Įļźśļ¦łĒŗ░ņŖżĒĢÖĒÜī Ļ│ĄļÅÖņ£╝ļĪ£ ņāłļĪ£ņÜ┤ ļČäļźś ĻĖ░ņżĆņØä ļ░£Ēæ£ĒĢśņśĆļŗż. 2019ļģä EULAR/ACR ļČäļźś ĻĖ░ņżĆņØĆ ANAļź╝ ņ¦äņ×ģ ĻĖ░ņżĆņ£╝ļĪ£ ņé¼ņÜ®ĒĢśĻ│Ā, Ļ░ü ĒĢŁļ¬®ņŚÉ Ļ░Ćņżæņ╣śļź╝ ļČĆņŚ¼ĒĢśļ®░, Ļ│äņĖĄ ĻĄ¼ņĪ░ņĀüņ£╝ļĪ£ ņśüņŚŁņØä ļéśļłäņŚłļŗżļŖö ĒŖ╣ņ¦ĢņØ┤ ņ׳ļŗż. ņāłļĪ£ņÜ┤ ļČäļźś ĻĖ░ņżĆņØĆ ņØ┤ņĀä ĻĖ░ņżĆņŚÉ ļ╣äĒĢ┤ ļ»╝Ļ░ÉļÅäņÖĆ ĒŖ╣ņØ┤ļÅä ļ¬©ļæÉ ņÜ░ņłśĒĢ£ ņ¦äļŗ© ņä▒ļŖźņØä ļéśĒāĆļéĖļŗż. ļśÉĒĢ£ ņ×äņāü ĻĖ░ņżĆņŚÉ ļ░£ņŚ┤ņØä ĒżĒĢ©ĒĢśņŚ¼ ņ┤łĻĖ░ ĒÖśņ×ÉņØś ņ¦äļŗ©ņŚÉ ļÅäņøĆņØä ņŻ╝Ļ│Āņ×É ĒĢśņśĆņ£╝ļ®░, ņŗĀņן ņĪ░ņ¦ü Ļ▓Ćņé¼ ņåīĻ▓¼ņØä ļČäļ”¼ĒĢśņŚ¼ Ļ░ü ņåīĻ▓¼ļ¦łļŗż ņ¦äļŗ©ņŚÉ ļ»Ėņ╣śļŖö ņśüĒ¢źņØ┤ ļŗżļ”äņØä ļ░śņśüĒĢśĻ│Āņ×É ĒĢśņśĆļŗż. ĻĘĖļ¤¼ļéś ņ£Āļ│æ ĻĖ░Ļ░äņØ┤ļéś Ļ▓Ćņé¼ ņŗ£ņĀÉņŚÉ ļö░ļØ╝ ņŚäņŚ░Ē׳ ANA ņØīņä▒ņØĖ SLE ĒÖśņ×ÉļōżņØ┤ ņĪ┤ņ×¼ĒĢśļ®░ ņĀĢĒÖĢĒĢ£ ANA ņ¢æņä▒ņ£©ņØä ļ¬©ļźĖļŗżļŖö ņĀÉņØ┤ ļģ╝ļ×ĆņØ┤ ļÉśĻ│Ā ņ׳Ļ│Ā, Ļ░Ćņżæņ╣ś ļČĆņŚ¼ ņ▓┤Ļ│äļź╝ ļÅäņ×ģĒĢśņŚ¼ ņŗżņĀ£ ņ¦äļŻī ĒśäņןņŚÉņä£ ņēĮĻ▓ī ņĀüņÜ®ĒĢśĻĖ░ ņ¢┤ļĀĄļŗżļŖö ļ¼ĖņĀ£ņĀÉņØ┤ ņ׳ļŗż. ņŚ¼ļ¤¼ ņØĖņóģ ļ░Å ņ¦ĆņŚŁņŚÉņä£ ņŚŁĒĢÖņĪ░ņé¼ņÖĆ ņ×äņāü ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢ┤ ļČäļźś ĻĖ░ņżĆņØś ņ£ĀņÜ®ņä▒ ļ░Å ĒāĆļŗ╣ņä▒ņŚÉ ļīĆĒĢ£ Ļ▓Ćņ”ØņØ┤ ņ¦ĆņåŹļÉśņ¢┤ņĢ╝ ĒĢĀ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż.
REFERENCES
2. Olsen NJ, Karp DR. Autoantibodies and SLE: the threshold for disease. Nat Rev Rheumatol 2014;10:181ŌĆō186.


3. Pisetsky DS. Anti-DNA antibodies--quintessential biomarkers of SLE. Nat Rev Rheumatol 2016;12:102ŌĆō110.


4. Tan EM, Cohen AS, Fries JF, Masi AT, Mcshane DJ, Rothfield NF, et al. The 1982 revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1982;25:1271ŌĆō1277.


5. Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum 1997;40:1725.

6. Petri M, Orbai AM, Alarc├│n GS, Gordon C, Merrill JT, Fortin PR, et al. Derivation and validation of the systemic lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheum 2012;64:2677ŌĆō2686.



7. Aringer M, Costenbader K, Daikh D, Brinks R, Mosca M, Ramsey-Goldman R, et al. 2019 European league against Rheumatism/American College of Rheumatology classification criteria for systemic lupus erythematosus. Ann Rheum Dis 2019;78:1151ŌĆō1159.

8. Piette JC, Wechsler B, Francis C, Godeau P. Systemic lupus erythematosus and the antiphospholipid syndrome: reflections about the relevance of ARA criteria. J Rheumatol 1992;19:1835ŌĆō1837.

9. Li S, Gong T, Peng Y, Nieman KM, Gilbertson DT. Prevalence and incidence of systemic lupus erythematosus and associated outcomes in the 2009-2016 US medicare population. Lupus 2020;29:15ŌĆō26.


10. Eilertsen G├ś, Becker-Merok A, Nossent JC. The influence of the 1997 updated classification criteria for systemic lupus erythematosus: epidemiology, disease presentation, and patient management. J Rheumatol 2009;36:552ŌĆō559.


11. Yu C, Gershwin ME, Chang C. Diagnostic criteria for systemic lupus erythematosus: a critical review. J Autoimmun 2014;48:10ŌĆō13.


12. Liang MH, Corzillius M, Bae SC, Lew RA, Fortin PR, Gordon C, et al. The American College of Rheumatology nomenclature and case definitions for neuropsychiatric lupus syndromes. Arthritis Rheum 1999;42:599ŌĆō608.


13. In├¬s L, Silva C, Galindo M, L├│pez-Longo FJ, Terroso G, Rom├Żo VC, et al. Classification of systemic lupus erythematosus: systemic lupus International Collaborating Clinics versus American College of Rheumatology criteria. A comparative study of 2,055 patients from a real-life, international systemic lupus erythematosus cohort. Arthritis Care Res (Hoboken) 2015;67:1180ŌĆō1185.


14. Albrecht J, Berlin JA, Braverman IM, Callen JP, Connolly MK, Costner MI, et al. Dermatology position paper on the revision of the 1982 ACR criteria for systemic lupus erythematosus. Lupus 2004;13:839ŌĆō849.


15. Johnson SR, Khanna D, Daikh D, Cervera R, Costedoat-Chalumeau N, Gladman DD, et al. Use of consensus methodology to determine candidate items for systemic lupus erythematosus classification criteria. J Rheumatol 2019;46:721ŌĆō726.


16. Touma Z, Cervera R, Brinks R, Lorenzoni V, Tani C, Hoyer BF, et al. Associations among classification criteria items within systemic lupus erythematosus. Arthritis Care Res (Hoboken) 2019 Sep 27 [Epub]. http://dx.doi.org/10.1002/acr.24078

17. Leuchten N, Hoyer A, Brinks R, Schoels M, Schneider M, Smolen J, et al. Performance of antinuclear antibodies for classifying systemic lupus erythematosus: a systematic literature review and meta-regression of diagnostic data. Arthritis Care Res (Hoboken) 2018;70:428ŌĆō438.


18. Claessens J, Belmondo T, De Langhe E, Westhovens R, Poesen K, H├╝e S, et al. Solid phase assays versus automated indirect immunofluorescence for detection of antinuclear antibodies. Autoimmun Rev 2018;17:533ŌĆō540.


19. Choi MY, Clarke AE, St Pierre Y, Hanly JG, Urowitz MB, Romero-Diaz J, et al. Antinuclear antibody-negative systemic lupus erythematosus in an international inception cohort. Arthritis Care Res (Hoboken) 2019;71:893ŌĆō902.


20. Sj├Čwall C, Sturm M, Dahle C, Bengtsson AA, J├Čnsen A, Sturfelt G, et al. Abnormal antinuclear antibody titers are less common than generally assumed in established cases of systemic lupus erythematosus. J Rheumatol 2008;35:1994ŌĆō2000.

21. Pisetsky DS, Rovin BH, Lipsky PE. New perspectives in rheumatology: biomarkers as entry criteria for clinical trials of new therapies for systemic lupus erythematosus: the example of antinuclear antibodies and anti-DNA. Arthritis Rheumatol 2017;69:487ŌĆō493.


22. Pisetsky DS, Spencer DM, Lipsky PE, Rovin BH. Assay variation in the detection of antinuclear antibodies in the sera of patients with established SLE. Ann Rheum Dis 2018;77:911ŌĆō913.

23. Bizzaro N, Brusca I, Previtali G, Alessio MG, Daves M, Platzgummer S, et al. The association of solid-phase assays to immunofluorescence increases the diagnostic accuracy for ANA screening in patients with autoimmune rheumatic diseases. Autoimmun Rev 2018;17:541ŌĆō547.


24. Orme ME, Andalucia C, Sj├Člander S, Bossuyt X. A comparison of a fluorescence enzyme immunoassay versus indirect immunofluorescence for initial screening of connective tissue diseases: systematic literature review and meta-analysis of diagnostic test accuracy studies. Best Pract Res Clin Rheumatol 2018;32:521ŌĆō534.


25. Sacre K, Delaval L, Dossier A, Alexandra JF, Berleur M, Chauveheid MP, et al. New 2019 SLE EULAR/ACR classification criteria are valid for identifying patients with SLE among patients admitted for pericardial effusion. Ann Rheum Dis 2019 Dec 6 [Epub]. http://dx.doi.org/10.1136/annrheumdis-2019-216712

26. Aringer M, Costenbader K, D├Črner T, Johnson SR. Response to: 'new 2019 SLE EULAR/ACR classification criteria are valid for identifying patients with SLE among patients admitted for pericardial effusion' by Sacre et al. Ann Rheum Dis 2019 Dec 20 [Epub]. http://dx.doi.org/10.1136/annrheumdis-2019-216803

27. Adamichou C, Nikolopoulos D, Genitsaridi I, Bortoluzzi A, Fanouriakis A, Papastefanakis E, et al. In an early SLE cohort the ACR-1997, SLICC-2012 and EULAR/ACR-2019 criteria classify non-overlapping groups of patients: use of all three criteria ensures optimal capture for clinical studies while their modification earlier classification and treatment. Ann Rheum Dis 2020;79:232ŌĆō241.


28. Assan F, Seror R, Mariette X, Nocturne G. New 2019 SLE EULAR/ACR classification criteria are valuable for distinguishing patients with SLE from patients with pSS. Ann Rheum Dis 2019 Sep 9 [Epub]. http://dx.doi.org/10.1136/annrheumdis-2019-216222

Classification criteria for systemic lupus erythematosus [7]. SLE, systemic lupus erythematosus. aAdditional criteria items within the same domain will not be counted. bIn an assay with at least 90% specificity against relevant disease controls.
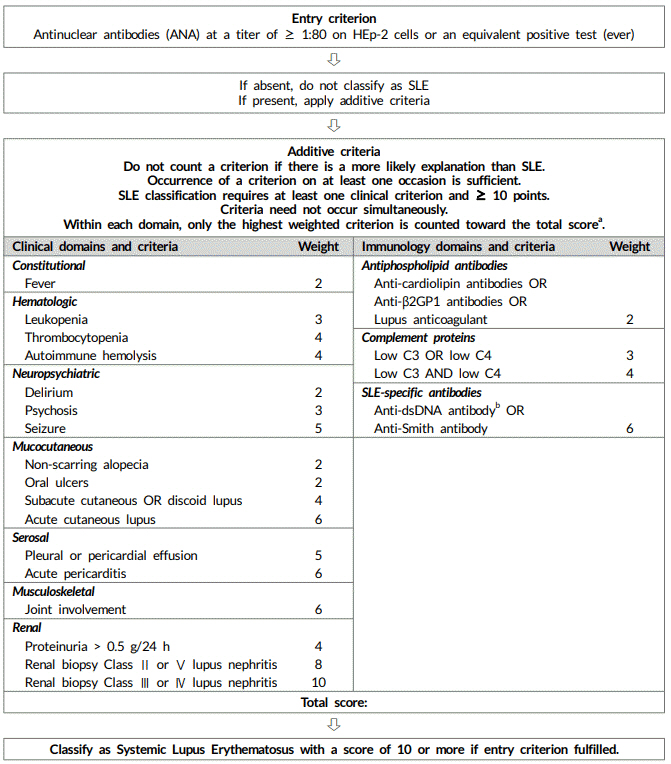
Figure┬Ā1.
Table┬Ā1.
1997 American College of Rheumatology revised classification criteria for systemic lupus erythematosus [5]
Table┬Ā2.
2012 SLICC classification criteria for SLE [6]
Table┬Ā3.
Definitions of 2019 EULAR/ACR SLE classification criteria [7]
| Criteria | Definition |
|---|---|
| ANA | ANA at a titre of Ōēź 1:80 on HEp-2 cells or an equivalent positive test at least once. Testing by immunofluorescence on HEp-2 cells or a solid phase ANA screening immunoassay with at least equivalent performance is highly recommended |
| Fever | Temperature > 38.3┬░C |
| Leucopenia | White blood cell count < 4.0├Ś109/L |
| Thrombocytopenia | Platelet count < 100├Ś109/L |
| Autoimmune haemolysis | Evidence of haemolysis, such as reticulocytosis, low haptoglobin, elevated indirect bilirubin, elevated LDH AND positive CoombŌĆÖs (direct antiglobulin) test. |
| Delirium | Characterised by 1) change in consciousness or level of arousal with reduced ability to focus, 2) symptom development over hours to < 2 days, 3) symptom fluctuation throughout the day, 4) either (4a) acute/subacute change in cognition (e.g., memory deficit or disorientation), or (4b) change in behaviour, mood, or affect (e.g., restlessness, reversal of sleep/wake cycle) |
| Psychosis | Characterised by 1) delusions and/or hallucinations without insight and 2) absence of delirium |
| Seizure | Primary generalised seizure or partial/focal seizure |
| Non-scarring alopecia | Non-scarring alopecia observed by a cliniciana |
| Oral ulcers | Oral ulcers observed by a cliniciana |
| Subacute cutaneous or discoid lupus | Subacute cutaneous lupus erythematosus observed by a cliniciana: Annular or papulosquamous (psoriasiform) cutaneous eruption, usually photodistributed |
| Discoid lupus erythematosus observed by a cliniciana: Erythematous-violaceous cutaneous lesions with secondary changes of atrophic scarring, dyspigmentation, often follicular hyperkeratosis/haematological (scalp), leading to scarring alopecia on the scalp | |
| If skin biopsy is performed, typical changes must be present. Subacute cutaneous lupus: interface vacuolar dermatitis consisting of a perivascular lymphohistiocytic infiltrate, often with dermal mucin noted. Discoid lupus: interface vacuolar dermatitis consisting of a perivascular and/or periappendageal lymphohistiocytic infiltrate. In the scalp, follicular keratin plugs may be seen. In longstanding lesions, mucin deposition and basement membrane thickening may be noted | |
| Pleural or pericardial effusion | Imaging evidence (such as ultrasound, X-ray, CT scan, MRI) of pleural or pericardial effusion, or both |
| Acute pericarditis | Ōēź 2 of 1) pericardial chest pain (typically sharp, worse with inspiration, improved by leaning forward), 2) pericardial rub, 3) EKG with new widespread ST-elevation or PR depression, 4) new or worsened pericardial effusion on imaging (such as ultrasound, X-ray, CT scan, MRI) |
| Joint involvement | EITHER 1) synovitis involving two or more joints characterised by swelling or effusion OR 2) tenderness in two or more joints and at least 30 min of morning stiffness |
| Proteinuria >0.5 g/24 hours | Proteinuria > 0.5 g/24 hours by 24 hours urine or equivalent spot urine protein-to-creatinine ratio |
| Class II or V lupus nephritis on renal biopsy according to ISN/RPS 2003 classification | Class II: mesangial proliferative lupus nephritis: purely mesangial hypercellularity of any degree or mesangial matrix expansion by light microscopy, with mesangial immune deposit. A few isolated subepithelial or subendothelial deposits may be visible by immune-fluorescence or electron microscopy, but not by light microscopy |
| Class V: membranous lupus nephritis: global or segmental subepithelial immune deposits or their morphological sequelae by light microscopy and by immunofluorescence or electron microscopy, with or without mesangial alterations | |
| Class III or IV lupus nephritis on renal biopsy according to International Society of Nephrology/Renal Pathology Society (ISN/RPS) 2003 | Class III: focal lupus nephritis: active or inactive focal, segmental or global endocapillary or extracapillary glomerulonephritis involving < 50% of all glomeruli, typically with focal subendothelial immune deposits, with or without mesangial alterations |
| Class IV: diffuse lupus nephritis: active or inactive diffuse, segmental or global endocapillary or extracapillary glomerulonephritis involving Ōēź 50% of all glomeruli, typically with diffuse subendothelial immune deposits, with or without mesangial alterations. This class includes cases with diffuse wire loop deposits but with little or no glomerular proliferation | |
| Positive antiphospholipid antibodies | Anticardiolipin antibodies (IgA, IgG, or IgM) at medium or high titre (> 40 A phospholipids (APL), GPL or MPL units, or > the 99th percentile) or positive anti-╬▓2GP1 antibodies (IgA, IgG, or IgM) or positive lupus anticoagulant |
| Low C3 OR low C4 | C3 OR C4 below the lower limit of normal |
| Low C3 AND low C4 | Both C3 AND C4 below their lower limits of normal |
| Anti-dsDNA antibodies OR anti- Smith (Sm) antibodies. | Anti-dsDNA antibodies in an immunoassay with demonstrated Ōēź 90% specificity for SLE against relevant disease controls OR anti-Sm antibodies |
Table┬Ā4.
Operating characteristics of the new classification criteria compared with the ACR 1997 and SLICC 2012 classification criteria in the derivation and the validation cohorts. Adapted and modified from reference [7].
| ACR 1997 Criteria | SLICC 2012 Criteria | EULAR/ACR 2019 Criteria | |
|---|---|---|---|
| Derivation | |||
| ŌĆāSensitivity | 85 | 97 | 98 |
| ŌĆāSpecificity | 95 | 90 | 96 |
| Validation | |||
| ŌĆāSensitivity | 83 | 97 | 96.1 |
| ŌĆāSpecificity | 93 | 84 | 93.4 |



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




