 |
 |
| Korean J Med > Volume 95(2); 2020 > Article |
|
žöĒžēĹ
Ž™©ž†Ā
žēĒ ŪôėžěźžĚė Í≤Ĺžöį Žč§žĖĎŪēú žēĹŽ¨ľžóź ŽÖłž∂úŽźėŽ©į, žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė žúĄŪóėŽŹĄÍįÄ ŽÜížĚÄ ŽÖłžĚłžóźžĄú ŽįúŽ≥ĎžĚī ŽßéžĚÄ ž†źžĚĄ Í≥†Ž†§ŪēúŽč§Ž©ī žēĒ ŪôėžěźžóźžĄú žēĹŽ¨ľžú†ŪēīŽįėžĚĎ ŽįúžÉĚ žúĄŪóėŽŹĄÍįÄ Žß§žöį ŽÜížĚĄ Í≤ÉžúľŽ°ú ž∂Ēž†ēŽźúŽč§. Ūē≠žēĒž†úžôÄ žóįÍīÄŽźú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžóź ŽĆÄŪēú Ž∂ĄžĄĚžĚī žĚľŽ∂Ä žěąžĚĄ ŽŅź, ÍĶ≠ŽāīžóźžĄú žēĒ ŪôėžěźžóźžĄú ŽįúžÉĚŪēėŽäĒ žēĹŽ¨ľžú†ŪēīŽįėžĚĎžóź ŽĆÄŪēú ž†ĄŽįėž†ĀžĚł Ž∂ĄžĄĚ žěźŽ£ĆŽäĒ žóÜŽč§. žąėŽÖĄÍįĄ žěźŽįúŽ≥īÍ≥† žčúžä§ŪÖúžĚĄ ŪÜĶŪēī Ž≥īÍ≥†Žźú žēĹŽ¨ľžú†ŪēīŽįėžĚĎ ž§Ď žēĒ ŪôėžěźžóźžĄú ŽįúžÉĚŽźú žēĹŽ¨ľžú†ŪēīŽįėžĚĎ ŪäĻžĄĪžĚĄ ŪôēžĚłŪēėÍ≥†žěź ŪēėžėÄŽč§.
Žį©Ž≤ē
2010ŽÖĄ 7žõĒŽ∂ÄŪĄį 2015ŽÖĄ 6žõĒÍĻĆžßÄ Í≥†žč†ŽĆÄŪēôÍĶź Ž≥ĶžĚĆŽ≥ĎžõźžĚė žěźŽįúž†ĀžĚł Ž≥īÍ≥† žčúžä§ŪÖúžĚĄ ŪÜĶŪēī žąėžßĎŽźú žēĹŽ¨ľžú†Ūēī žā¨Ž°Ä Ž≥īÍ≥† ÍĪīžóź ŽĆÄŪēī Íłįž†Ä žßąŪôė, žõźžĚłžúľŽ°ú žĚėžč¨ŽźėŽäĒ žēĹŽ¨ľ, žěĄžÉĀ žĖĎžÉĀ ŽďĪžĚĄ ŪõĄŪĖ•ž†ĀžúľŽ°ú Ž∂ĄžĄĚŪēėžėÄŽč§. WHO-UMC žĚłÍ≥ľžĄĪ ŪŹČÍįÄÍłįž§Äžóź Í∑ľÍĪįŪēėžó¨ ÍįÄŽä•žĄĪ ž†ĀžĚĆ ŽėźŽäĒ ŪŹČÍįÄ ŽįŹ Ž∂ĄŽ•ė Ž∂ąÍįÄŽ°ú ŪŹČÍįÄŽźú žā¨Ž°ÄŽäĒ Ž∂ĄžĄĚžóźžĄú ž†úžôłŪēėžėÄŽč§.
Í≤įÍ≥ľ
žīĚ 1,455ÍĪīžĚī Ž≥īÍ≥†ŽźėžóąžúľŽ©į, Í∑łž§Ď žēĒ ŪôėžěźžóźžĄú Ž≥īÍ≥†Žźú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚī 822ÍĪī(52.1%)žĚīžóąŽč§. žú†Ūēī žā¨Ž°ÄÍįÄ Ž≥īÍ≥†Žźú žēĒ ŪôėžěźžĚė ŪŹČÍ∑† žóįŽ†ĻžĚÄ 60.86 ¬Ī 12.08žĄł(17-90žĄł)žėÄžúľŽ©į, Žā®žěźÍįÄ 45.9%žėÄŽč§. ŪĚĒŪēú žõźžĚł žēĹŽ¨ľžĚÄ ž£ľžā¨žėĀžĖĎž†úÍįÄ žį®žßÄŪēėŽäĒ ŽĻĄžú®žĚī 40.4% (332ÍĪī)Ž°ú ÍįÄžě• ŽÜížēėžúľŽ©į, Í∑ł Žč§žĚĆžúľŽ°úŽäĒ Ūē≠žÉĚž†ú(17.4%), žßĄŪÜĶž†ú(16.7%), žöĒžė§ŽďúŪôĒ ž°įžėĀž†ú(10.6%), ŽĻĄŪÉÄŽĮľž†ú(3.9%), Ūē≠ÍĶ¨Ū܆ž†ú(3.0%), Ūē≠žēĒž†ú(2.4%)žėÄŽč§. ŽāėŪÉÄŽāú ž¶ĚžÉĀžúľŽ°ú ÍĶ¨žó≠, ÍĶ¨Ū܆žôÄ ÍįôžĚÄ žúĄžě•ÍīÄ ž¶ĚžÉĀžĚī 32.6%, ŪĒľŽ∂Ä ž¶ĚžÉĀžĚī 28.5%, žč†Í≤ĹÍ≥Ą ž¶ĚžÉĀžĚī 26%Ž°ú ŪĚĒŪēėžėÄŽč§. Ž≥īÍ≥†Žźú žā¨Ž°ÄŽď§žĚė ž§Ďž¶ĚŽŹĄŽ•ľ Ž∂ĄŽ•ėŪēėžėĞ̥ ŽēĆ Í≤Ĺž¶ĚžĚī 475ÍĪī(57.8%), ž§ĎŽďĪž¶ĚžĚī 296ÍĪī(36%), ž§Ďž¶ĚžĚī 51ÍĪī(6.2%)žĚīžóąŽč§. ž§Ďž¶ĚžĚė žú†ŪēīŽįėžĚĎ Ž≥īÍ≥†ŽäĒ 54.9%ÍįÄ Žā®žěźžėÄžúľŽ©į, Í≥†Ž†ĻžĚė ŽāėžĚīžóź ŽßéžĚī ŽįúžÉĚŪēėžėÄÍ≥†, ŪôėžěźžĚė Íłįž†ÄžēĒ žßąŪôėžĚĄ Ž∂ĄžĄĚŪēėžėĞ̥ ŽēĆ žúĄžēĒ(41.2%), ŽĆÄžě•žēĒ(15.7%), ŽāúžÜĆ/žěźÍ∂ĀžēĒ(11.8%), ŽčīŽŹĄžēĒ(7.8%)žĚė ŽĻĄžú®žĚī ŽßéžēėŽč§. ž§Ďž¶ĚžĚĄ žĚľžúľŪā® žõźžĚłžēĹŽ¨ľŽ°úŽäĒ ž£ľžā¨žėĀžĖĎž†úžôÄ žßĄŪÜĶž†ú(ÍįĀÍįĀ 19.6%)ÍįÄ ÍįÄžě• ŽßéžēėžúľŽ©į, Žč§žĚĆžúľŽ°ú Ūē≠žÉĚž†ú(17.6%), Ūē≠žēĒž†ú(13.7%), žöĒžė§ŽďúŪôĒž°įžėĀž†ú(11.8%)žėÄÍ≥† ŽĻĄŪÉÄŽĮľž†úÍįÄ 3.9%žėÄŽč§.
Í≤įŽ°†
Ūē≠žÉĚž†ú, žöĒžė§ŽďúŪôĒ ž°įžėĀž†ú, žßĄŪÜĶž†ú ŽďĪžĚī žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė ŪĚĒŪēú žõźžĚł žēĹŽ¨ľŽ°ú žěė žēĆŽ†§ž†ł žěąžßÄŽßĆ, žēĒ ŪôėžěźžóźžĄúŽäĒ Ūē≠žēĒž†úŽŅźŽßĆ žēĄŽčąŽĚľ, žĚīŽď§ žēĹž†úžôÄ Ūē®ÍĽė ž£ľžā¨žėĀžĖĎž†ú ŽįŹ ŽĻĄŪÉÄŽĮľž†úŽŹĄ žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė ŪĚĒŪēú žõźžĚłžĚī Žź† žąė žěąžĚƞ̥ žĚłžßÄŪē† ŪēĄžöĒÍįÄ žěąžúľŽ©į, ŪĖ•ŪõĄ ž£ľžā¨žėĀžĖĎž†ú ŽįŹ ŽĻĄŪÉÄŽĮľž†úžóź ŽĆÄŪēú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžóź ŽĆÄŪēīžĄúŽäĒ Žč§ÍłįÍīÄ žóįÍĶ¨ÍįÄ ŪēĄžöĒŪēėÍ≤†Žč§.
Abstract
Background/Aims
Although the number of domestic adverse drug reactions (ADRs) reported in Korea is rapidly increasing, the analysis of ADRs in cancer patients remains limited. We sought to investigate the clinical features of ADRs in cancer patients.
Methods
ADR data were collected from a spontaneous reporting system at single university hospital, between July 2010 and June 2015. ADR cases assessed to be ‚Äúunlikely‚ÄĚ or ‚Äúunclassifiable‚ÄĚ as per the criteria of the World Health Organization-Uppsala Monitoring Center were excluded. Additional medical information was retrospectively collected from chart reviews, and clinical features of ADRs were analyzed.
Results
In total, 1,455 cases were reported. Of these, 822 ADRs (52.1%) were observed in cancer patients. The mean age of cancer patients was 60.8 years (range, 17‚Äď90 years), and 45.9% were male. The most prevalent clinical features were gastrointestinal abnormalities (32.6%), such as nausea and vomiting, followed by skin (28.5%) and neurologic manifestations (26.0%). Fifty-one (6.2%) and 296 cases (36.0%) were classified as severe and moderate, respectively. The most common causative agents were parenteral nutrition (PN) supplements (40.4%), followed by antibiotics (17.8%), analgesics (16.7%), iodinated contrast media (ICM, 10.6%), and vitamins (3.9%). Antineoplastic agents were responsible for 2.9% of cases. PN supplements were commonly associated with severe reactions.
Conclusion
Although it is well known that antibiotics, ICM, and analgesics induce ADRs, PN supplements, vitamins, and antineoplastic agents should also be considered as common causes of ADRs in cancer patients. Further investigation and monitoring to determine the causality associated with these agents is required.
žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚÄ žĚėžēĹŪíą ŽďĪžĚĄ ž†ēžÉĀž†ĀžúľŽ°ú Ūą¨žó¨ŪēėÍĪįŽāė žā¨žö©Ūē®žúľŽ°ú ŽįúžÉĚŪēú žú†ŪēīŪēėÍ≥†ŽŹĄ žĚėŽŹĄŽźėžßÄ žēäžĚÄ ŽįėžĚϞ̥ ŽßźŪēúŽč§[1]. žēĹŽ¨ľžĚÄ žßĄŽč®Í≥ľ žĻėŽ£Ćžóź žěąžĖī ŪēĶžč¨ž†ĀžĚł žó≠Ūē†žĚĄ ŪēėŽäĒ Í≤ÉžúľŽ°ú, žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚÄ žēĹž†úžĚė Ūö®Í≥ľŽßĆŪĀľžĚīŽāė Ūôėžěź žßĄŽ£Ćžóź žč¨ÍįĀŪēú žėĀŪĖ•žĚĄ ŽĮłžĻúŽč§. ž¶Č, Ūôėžěź ÍįúÍįúžĚłžĚė žč†ž≤ī ŽįŹ ž†ēžč†ž†Ā žÜźžÉĀžĚĄ žīąŽěėŪē†ŽŅźŽßĆ žēĄŽčąŽĚľ žú†ŪēīŽįėžĚĎžóź ŽĆÄŪēú ž∂ĒÍįÄ žĻėŽ£ĆžôÄ žěÖžõź ÍłįÍįĄžĚĄ žóįžě•žčúŪāīžúľŽ°ú žĚłŪēī žĚėŽ£Ć ŽĻĄžö©žĚĄ ž¶ĚÍįÄžčúŪā®Žč§[2-5]. Í∑ł Í≤įÍ≥ľ žēĹŽ¨ľžú†ŪēīŽįėžĚϞ̥ ž°įÍłį ŽįúÍ≤¨ŪēėÍ≥† Ūö®Í≥ľž†ĀžúľŽ°ú žėąŽį©ŪēėÍ≥†žěź ŪēėŽäĒ žõÄžßĀžěĄžĚī žěąžĖī žôĒžúľŽ©į, ÍĶ≠ŽāīžóźžĄúŽŹĄ 1985ŽÖĄ ‚ÄėžĚėžēĹŪíą ŽďĪ žēąž†ĄžĄĪ ž†ēŽ≥īž≤ėŽ¶¨ Í∑úž†ē‚ÄôžĚĄ ž†úž†ēŪēėžėÄÍ≥†, žĚīŪõĄ ŪôúŽįúŪēėÍ≤Ć žēĹŽ¨ľÍįźžčúž†úŽŹĄÍįÄ žčúŪĖČŽźėÍ≥† žěąŽč§[1]. žĚīŽ•ľ ŽįĒŪÉēžúľŽ°ú ŽćįžĚīŪĄįŽ≤†žĚīžä§ÍįÄ ÍĶ¨ž∂ēŽźėžóąžúľŽ©į, žēĹŽ¨ľžú†ŪēīŽįėžĚĎÍ≥ľ ÍīÄŽ†®Ūēėžó¨ ŪŹČÍįÄ žßÄŪĎúŽ•ľ žě¨Ž∂ĄžĄĚŪēėÍĪįŽāė, Žč®žĚľ žĚėŽ£ĆÍłįÍīĞ󟞥ú Ž≥īÍ≥†Žźú žěźŽ£ĆŽ•ľ Ž∂ĄžĄĚŪēėÍĪįŽāė, ŪäĻž†ēžēĹŽ¨ľžĚīŽāė žóįŽ†Ļžóź ŽĒįŽĚľ žēĹŽ¨ľžú†ŪēīŽįėžĚĎ žĖĎžÉĀžĚĄ Ž∂ĄžĄĚŪēėŽäĒ ŽďĪ Žč§žĖĎŪēú ž†ĎÍ∑ľ Žį©Ž≤ēžúľŽ°ú žēĹŽ¨ľžú†ŪēīŽįėžĚĎ žóįÍĶ¨ÍįÄ žßĄŪĖČŽźėÍ≥† žěąŽč§.
žĶúÍ∑ľ ŪŹČÍ∑† žąėŽ™ÖžĚė žóįžě•žúľŽ°ú žĚłŪēú ŽÖłŽ†Ļ žĚłÍĶ¨žĚė ž¶ĚÍįÄ, žčĚžäĶÍīĞ̥ ŽĻĄŽ°ĮŪēú žÉĚŪôú žĖĎžčĚ, ŪôėÍ≤Ĺ ŽďĪžĚė Ž≥ÄŪôĒŽ°ú žēĒ ŪôėžěźÍįÄ ÍłČÍ≤©Ūěą ž¶ĚÍįÄŪēėÍ≥† žěąŽč§. ÍĶ≠ÍįÄžēĒž†ēŽ≥īžĄľŪĄįžóź ŽĒįŽ•īŽ©ī, žēĒ ŽįúžÉĚŽ•†žĚÄ 2016ŽÖĄ žöįŽ¶¨ŽāėŽĚľ ÍĶ≠ŽĮľ 223Ž™ÖŽčĻ 1Ž™Ö, 65žĄł žĚīžÉĀžĚė ŽÖłžĚłžóźžĄúŽäĒ 64Ž™ÖŽčĻ 1Ž™ÖžĚł Í≤ÉžúľŽ°ú ŽāėŪÉÄŽā¨Žč§[6]. žēĒ ŪôėžěźžĚė Í≤Ĺžöį Ūē≠žēĒž†úŽ•ľ ŽĻĄŽ°ĮŪēėžó¨ ŪÜĶž¶Ě ÍįźžÜĆ ŽįŹ žā∂žĚė žßą ÍįúžĄ†žĚĄ žúĄŪēī Žč§žĖĎŪēú žēĹŽ¨ľ žĻėŽ£ĆÍįÄ žĚīŽ£®žĖīžßÄÍ≥† žěąŽč§. ŽėźŪēú žēĒ žßĄŪĖČ žÉĀŪÉúŽ•ľ ŪŹČÍįÄŪēėÍłį žúĄŪēī ž°įžėĀž†úŽ•ľ žā¨žö©Ūēú Í≤Äžā¨žóź ŽįėŽ≥Ķž†ĀžúľŽ°ú ŽÖłž∂úŽźėÍ≥† žěąžĖī žĚīŽď§Í≥ľ ÍīÄŽ†®Žźú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚī ŽįúžÉĚŪē† žúĄŪóėžĄĪžĚī ŽÜíŽč§. Í≤ĆŽč§ÍįÄ žēĒ ŪôėžěźžĚė Í≤Ĺžöį ŽÖłžĚłžĚė ŽĻąŽŹĄÍįÄ ŽÜížĚÄ Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąŽč§. ŽÖłžĚłžĚÄ žēĹŽ¨ľžĚė Ž∂ĄŪŹ¨žôÄ žēĹŽŹôŪēôž†Ā ŽįėžĚĎžĚī žěĄžÉĀž†ĀžúľŽ°ú Žč¨ŽĚľ žēĹŽ¨ľÍ≥ľ ÍīÄŽ†®Ūēú žó¨Žü¨ Ž¨łž†úž†źžĚī žēľÍłįŽź† žúĄŪóėžĄĪžĚī ŽÜížúľŽ©į žč§ž†ú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚī ŽÖłžĚłžóźÍ≤ĆžĄú ŽćĒ ŽßéžĚī Ž≥īÍ≥†ŽźėÍ≥† žěąŽč§[7-9]. ŽĒįŽĚľžĄú žēĒ ŪôėžěźžóźžĄú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė žúĄŪóėŽŹĄÍįÄ Žß§žöį ŽÜížĚĄ Í≤ÉžúľŽ°ú ž∂Ēžł°ŽźėŽāė, Ūē≠žēĒž†úžôÄ žóįÍīÄŽźú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžóź ŽĆÄŪēú žóįÍĶ¨ÍįÄ žĚľŽ∂Ä žěąžĚĄ ŽŅź[10], žēĒ ŪôėžěźžóźžĄú ŽįúžÉĚŪēėŽäĒ žēĹŽ¨ľžú†ŪēīŽįėžĚĎžóź ŽĆÄŪēú ž†ĄŽįėž†ĀžĚł Ž∂ĄžĄĚ žěźŽ£ĆŽäĒ Ž≥īÍ≥†Žźú ŽįĒÍįÄ ÍĪįžĚė žóÜŽč§.
Ž≥ł žóįÍĶ¨žěźŽäĒ žßÄžó≠ ÍłįŽįėžĚė žĚľÍįú ŽĆÄŪēôŽ≥ĎžõźžóźžĄú žąėŽÖĄÍįĄ žěźŽįúž†Ā Ž≥īÍ≥† žčúžä§ŪÖúžĚĄ ŪÜĶŪēī Ž≥īÍ≥†Žźú žēĹŽ¨ľžú†ŪēīŽįėžĚĎ ž§Ď žēĒ ŪôėžěźžóźžĄú ŽįúžÉĚŽźú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė žĖĎžÉĀžĚĄ Ž∂ĄžĄĚŪēėžó¨ ŪĖ•ŪõĄ žēĒ ŪôėžěźžóźžĄú ŽįúžÉĚŪēėŽäĒ žēĹŽ¨ľžú†ŪēīŽįėžĚĎžóź ŽĆÄŪēú ÍłįŽ≥ł žěźŽ£ĆŽ°ú Ūôúžö©ŪēėÍ≥†žěź Ž≥ł žóįÍĶ¨Ž•ľ žčúŪĖČŪēėžėÄŽč§.
žĚī žóįÍĶ¨ŽäĒ Í≥†žč†ŽĆÄŪēôÍĶź Ž≥ĶžĚĆŽ≥ĎžõźžĚė ÍłįÍīÄžú§Ž¶¨žč¨žĚėžúĄžõźŪöĆžĚė žäĻžĚłžĚĄ ŽįõžĚÄ žóįÍĶ¨Í≥ĄŪö枥úžóź ŽĒįŽĚľ žßĄŪĖČŽźėžóąžúľŽ©į, ŪõĄŪĖ•ž†Ā žěźŽ£ĆŽ∂ĄžĄĚžúľŽ°ú žĄúŽ©ī ŽŹôžĚėŽäĒ ŽįõžßÄ žēäžēėŽč§(IRB No. 2016-01-013).
Ž≥ł žóįÍĶ¨ŽäĒ 2010ŽÖĄ 7žõĒŽ∂ÄŪĄį 2015ŽÖĄ 6žõĒÍĻĆžßÄ Í≥†žč†ŽĆÄŪēôÍĶź Ž≥ĶžĚĆŽ≥ĎžõźžóźžĄú žõźŽāī ž†ĄžěźžĚėŽ¨īÍłįŽ°ĚžĚė žěźŽįúž†Ā žēĹŽ¨ľžú†ŪēīŽįėžĚĎ Ž≥īÍ≥† žčúžä§ŪÖúžĚĄ ŪÜĶŪēī Ž≥īÍ≥†Žźú žā¨Ž°Ä ž§Ď žßĄŽč®Ž™ÖžĚĄ Íłįž§ÄžúľŽ°ú žēĒ ŪôėžěźžôÄ žēĒ ŪôėžěźÍįÄ žēĄŽčĆ ŪôėžěźŽď§(ŽĻĄ-žēĒ Ūôėžěź)Ž°ú Ž∂ĄŽ•ėŪēėžó¨ Ž∂ĄžĄĚžĚĄ žßĄŪĖČŪēėžėÄŽč§. ŽŹôžĚľŪēú ŪôėžěźžóźžĄú žĄúŽ°ú Žč§Ž•ł žčúÍłįžóź ŽĎź ÍĪī žĚīžÉĀžĚė žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚī ŽįúžÉĚŪēú Í≤ĹžöįŽäĒ Ž≥ĄŽŹĄžĚė žēĹŽ¨ľžú†ŪēīŽįėžĚĎžúľŽ°ú Ž∂ĄžĄĚŪēėžėÄŽč§.
žēĹŽ¨ľžú†ŪēīŽįėžĚĎ Ž≥īÍ≥† ÍĪīžóź ŽĆÄŪēī Íłįž†Ä žßąŪôė, žõźžĚłžúľŽ°ú žĚėžč¨ŽźėŽäĒ žēĹŽ¨ľ, žěĄžÉĀ žĖĎžÉĀ ŽďĪžĚĄ ŪõĄŪĖ•ž†ĀžúľŽ°ú Ž∂ĄžĄĚŪēėžėÄŽč§. žēĹŽ¨ľÍ≥ľ žú†ŪēīŽįėžĚĎ ÍįĄžĚė žĚłÍ≥ľžĄĪžĚÄ ž†ĄŽ¨łÍįÄžóź žĚėŪēī ŪŹČÍįÄŽźėžóąÍ≥†, World Health Organization-Uppsala Monitoring Center (WHO-UMC) žĚłÍ≥ľžĄĪŪŹČÍįÄ žßÄŪĎúŽ•ľ žā¨žö©Ūēėžó¨ Ūôēžč§Ūē®(certain), ÍįÄŽä•žĄĪ ŽÜížĚĆ(probable or likely), ÍįÄŽä•žĄĪ žěąžĚĆ(possible), ÍįÄŽä•žĄĪ ž†ĀžĚĆ(unlikely), ŪŹČÍįÄ ŽėźŽäĒ Ž∂ĄŽ•ė Ž∂ąÍįÄ(unassessable or unclassifiable)Ž°ú Ž∂ĄŽ•ėŪēėžėÄŽč§[11]. žóįÍĶ¨žěźŽď§žĚÄ WHO-UMC žßÄŪĎúŽ•ľ ž†Āžö©Ūēėžó¨ ‚ÄėÍįÄŽä•žĄĪ ž†ĀžĚĆ‚ÄôÍ≥ľ ‚ÄėŪŹČÍįÄ/Ž∂ĄŽ•ė Ž∂ąÍįÄ‚ÄôŽ°ú ŪĆźž†ēŽźú žā¨Ž°ÄŽäĒ Ž∂ĄžĄĚžóźžĄú ž†úžôłŪēėžėÄŽč§.
žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė ž¶ĚžÉĀžĚÄ Í≥ĄŪÜĶŽ≥ĄŽ°ú ž†Ąžč† ž¶ĚžÉĀ(Žįúžóī, žčĚžöēÍįźŪáī, ž†Ąžč†Ž∂ÄžĘÖ, ž†Ąžč† žá†žēĹÍįź ŽďĪ), ŽĎźÍ≤ĹŽ∂Ä ž¶ĚžÉĀ(žčúŽ†•žě•žē†, žēąžēēžÉĀžäĻ, ž≤≠Ž†•žě•žē†, ŽĮłÍįĀžě•žē†, ÍĶ¨Íįą ŽďĪ), ŪėłŪĚ°Íłį ž¶ĚžÉĀ(ÍłįžĻ®, ŪėłŪĚ°Í≥§ŽěÄ, ŪŹźŽ∂ÄžĘÖ), žč¨ŪėąÍīÄ ž¶ĚžÉĀ(ŽĻąŽß•, žĄúŽß•, ž†ÄŪėąžēē, ŪĚČŽ∂ÄŪÜĶž¶Ě ŽďĪ), žúĄžě•ÍīÄ ž¶ĚžÉĀ(žė§žč¨, ÍĶ¨Ū܆, Ž≥ĶŪÜĶ, žĄ§žā¨, Ž≥ÄŽĻĄ, žÜĆŪôĒŽ∂ąŽüČ, žÜćžďįŽ¶ľ ŽďĪ), ÍįĄ ŽįŹ ŽčīŽŹĄÍ≥Ą ž¶ĚžÉĀ(ÍįĄžóľ, ŽĻĆŽ¶¨Ž£®ŽĻą ž¶ĚÍįÄ ŽďĪ), ŪĒľŽ∂ÄŽįėžĚĎ(ÍįÄŽ†§žõÄž¶Ě, ŽĎźŽďúŽü¨Íłį, ŽįúžßĄ, žąėŪŹ¨, ŪÉąŽ™® ŽďĪ), Í∑ľÍ≥®Í≤©Í≥Ą ž¶ĚžÉĀ(ÍīÄž†ąŪÜĶ, Í∑ľžú°ŪÜĶ, Í≥®Žč§Í≥Ķž¶Ě ŽďĪ), žč†žě•Í≥Ą žĚīžÉĀ(Žč®ŽįĪŽá®, ŪėąŽá®, žÜĆŽ≥ÄŽüČ ÍįźžÜĆ, ŪĀ¨Ž†ąžēĄŪčįŽčĆ ž¶ĚÍįÄ ŽďĪ), žč†Í≤ĹŪēôž†Ā žĚīžÉĀ(ŽĎźŪÜĶ, žĖīžßÄŽüľž¶Ě, ÍłįžĖĶŽ†• žě•žē†, žÜźŽįú ž†ÄŽ¶ľ/ŽĖ®Ž¶ľ, žĚīžÉĀ žöīŽŹô ŽďĪ), ž†ēžč†Í≥ľž†ĀžĚīžÉĀ(Ž∂ąžēą, žĄ¨ŽßĚ, ŪĖČŽŹôÍ≥ľŽč§ ŽďĪ), Ūėąžē°Í≥Ą žĚīžÉĀ(ŽįĪŪėąÍĶ¨ ÍįźžÜĆ, ŽĻąŪėą, ŪėąžÜĆŪĆź ÍįźžÜĆ ŽďĪ), ÍłįŪÉÄ(ŽįįŽá®žě•žē†, žÉĚŽ¶¨Ž∂ąžąú, žĄĪÍłįŽä• žě•žē† ŽďĪ)Ž°ú ÍĶ¨Ž∂ĄŪēėžėÄŽč§.
Ž≥īÍ≥†Žźú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė ž§Ďž¶ĚŽŹĄŽäĒ Ž≥īŪéłž†ĀžúľŽ°ú žā¨žö©ŽźėŽäĒ Hartwig ŽďĪ[12]žĚī ž†úžēąŪēú Ž∂ĄŽ•ėŽ≤ēžóź ŽĒįŽĚľ Í≤Ĺž¶Ě, ž§ĎŽďĪž¶Ě, ž§Ďž¶Ě 3ÍįÄžßÄŽ°ú Ž∂ĄŽ•ėŪēėžėÄŽč§. Í≤Ĺž¶ĚžĚÄ Žč§Ž•ł žĻėŽ£Ćž†úŽāė žěÖžõź žóįžě• ŽďĪžĚė ž†ąžį®ÍįÄ ŪēĄžöĒ žóÜŽäĒ Í≤Ĺžöį, ž§ĎŽďĪž¶ĚžĚÄ žēĹŽ¨ľ žĻėŽ£Ć Ž≥ÄÍ≤ĹžĚīŽāė ŪäĻž†ēžĻėŽ£ĆŽ•ľ žöĒŪēėŽäĒ Í≤Ĺžöį ŽėźŽäĒ žěÖžõź ÍłįÍįĄžĚī žĶúžÜĆ 1žĚľ žĚīžÉĀ žóįžě•Žźú Í≤ĹžöįÍįÄ ŪēīŽčĻŽźėŽ©į, ž§Ďž¶ĚžĚÄ žėĀÍĶ¨ž†ĀžĚł žÜźžÉĀžúľŽ°ú žĚłŪēī žÉĚŽ™ÖžĚĄ žúĄŪėĎŪē† ÍįÄŽä•žĄĪžĚī žěąÍĪįŽāė ž§ĎŪôėžěźžč§ ŽďĪžĚė žßĎž§Ď žĻėŽ£ĆÍįÄ ŪēĄžöĒŪēú Í≤ĹžöįŽ°ú ž†ēžĚėŽźúŽč§. žĚīŽü¨Ūēú žēĹŽ¨ľžú†ŪēīŽįėžĚĎ ž§ĎŽďĪŽŹĄ Ž∂ĄŽ•ėŽäĒ žč§ž†ú žēĹŽ¨ľžú†ŪēīŽįėžĚĎ žā¨Ž°ÄŽ•ľ Ž≥īÍ≥†Ūēú žĚėŽ£ĆžĚłžĚė žĚėÍ≤¨Í≥ľ ŪôėžěźŽ≥ĎŽ†•žĚĄ Ū܆ŽĆÄŽ°ú ŪēėžėÄŽč§. žēĹŽ¨ľžú†ŪēīŽįėžĚĎžúľŽ°ú Ž≥īÍ≥†Žźú žā¨Ž°ÄžĚė žõźžĚł žēĹŽ¨ľžĚÄ žėĀŽ¨ł žĄĪŽ∂ĄŽ™ÖžĚĄ Íłįž§ÄžúľŽ°ú Ž∂ĄžĄĚŪēėžėÄžúľŽ©į, Ž≥ĶžßÄŽ∂ÄžĚė žēĹž†úŽ∂ĄŽ•ėžĹĒŽďúŽ•ľ Íłįž§ÄžúľŽ°ú Ž∂ĄŽ•ėŪēėžėÄÍ≥†, žēĹŽ¨ľ Ūą¨žēĹ Í≤ĹŽ°úÍįÄ Ūē®ÍĽė ž°įžā¨ŽźėžóąŽč§.
Íłįžą†ŪÜĶÍ≥ĄŽ•ľ žā¨žö©Ūēėžó¨ Ūôėžěźžąė ŽėźŽäĒ ÍĪīžąė ŽįŹ ŽįĪŽ∂Ąžú®Ž°ú ŪĎúžčúŪēėžėÄžúľŽ©į, ŪēĄžöĒŪēú Í≤Ĺžöį ŪŹČÍ∑† ¬Ī ŪĎúž§ÄŪéłžį®Ž°ú ŽāėŪÉÄŽāīžóąŽč§. Í∑łŽ£ĻÍįĄžĚė ŽĻĄÍĶźŽ•ľ žúĄŪēī Student t-test ŽįŹ žĻīžĚī ž†úÍ≥ĪÍ≤Äž†ēžĚĄ žĚīžö©ŪēėžėÄŽč§. ŪÜĶÍ≥Ą Ž∂ĄžĄĚžĚÄ SPSS 20.0 ŪĒĄŽ°úÍ∑łŽě®(IBM Co., Armonk, NY, USA)žĚĄ žā¨žö©ŪēėžėÄŽč§.
ž†ĄŽ¨łÍįÄžóź žĚėŪēú žĚłÍ≥ľÍīÄÍ≥Ą ŪŹČÍįĞ󟞥ú ‚ÄėÍįÄŽä•žĄĪ Ų̄Žįē‚ÄôÍ≥ľ ‚ÄėŪŹČÍįÄ/Ž∂ĄŽ•ė Ž∂ąÍįÄ‚ÄôŽ•ľ ž†úžôłŪēėÍ≥† žóįÍĶ¨ ÍłįÍįĄ ž§Ď 1,370Ž™ÖžĚė ŪôėžěźžóźžĄú žīĚ 1,455ÍĪīžĚī Ž≥īÍ≥†ŽźėžóąŽč§. žĚī ž§Ď 822ÍĪī(52.1%)žĚī 762Ž™ÖžĚė žēĒ ŪôėžěźžóźžĄú Ž≥īÍ≥†Žźú žā¨Ž°ÄžėÄžúľŽ©į, 633ÍĪī(47.9%)žĚÄ 608Ž™ÖžĚė ŽĻĄ-žēĒŪôėžěźžóźžĄú Ž≥īÍ≥†Žźú žā¨Ž°ÄžėÄŽč§. ŪôėžěźŽčĻ žēĹŽ¨ľžú†ŪēīŽįėžĚĎ Ž≥īÍ≥†ÍĪīžąėŽäĒ žēĒ ŪôėžěźÍįÄ 1.08ÍĪī, ŽĻĄ-žēĒ ŪôėžěźÍįÄ 1.04ÍĪīžĚīžóąŽč§. žēĒ ŪôėžěźžóźžĄú Ž≥īÍ≥†Žźú žú†ŪēīŽįėžĚĎžĚė žĚłÍ≥ľÍīÄÍ≥ĄŽ•ľ WHO-UMCžĚė ŪŹČÍįÄ Íłįž§Äžóź ŽĒįŽĚľžĄú Ž∂ĄŽ•ėŪēú Í≤įÍ≥ľ, Ūôēžč§Ūē®žĚÄ 13ÍĪī(1.6%), ÍįÄŽä•žĄĪ ŽÜížĚĆžĚī 213ÍĪī(25.9%), ÍįÄŽä•žĄĪ žěąžĚĆžĚī 596ÍĪī(72.5%)žĚīžóąŽč§. žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚī Ž≥īÍ≥†Žźú žēĒ ŪôėžěźžĚė ŪŹČÍ∑† žóįŽ†ĻžĚÄ 60.86 ¬Ī 12.08žĄłŽ°ú ŽĻĄ-žēĒ ŪôėžěźžĚė 51.73 ¬Ī 16.85žĄłžóź ŽĻĄŪēī ŽÜížēėžúľŽ©į(p< 0.001), žēĹ 80%ÍįÄ 50žĄł žĚīžÉĀžóźžĄú ŽįúžÉĚŪēėžėÄÍ≥† 70žĄł žĚīžÉĀžĚī 24%Ž•ľ žį®žßÄŪēėžėÄŽč§. žú†ŪēīŽįėžĚĎ Ž≥īÍ≥†žĚė 45.9% (377ÍĪī)ÍįÄ Žā®žĄĪžóźžĄú Ž≥īÍ≥†ŽźėžóąžúľŽ©į, žēĒ ŪôėžěźžôÄ ŽĻĄ-žēĒ Ūôėžěź ÍįĄ Ž≥īÍ≥† žā¨Ž°Ä ž§Ď žĄĪŽ≥Ąžóź ŽĒįŽ•ł žú†žĚėŪēú žį®žĚīŽäĒ žóÜžóąŽč§(Table 1). žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚī Ž≥īÍ≥†Žźú žēĒŪôėžěźžĚė Íłįž†Ä žēĒ žßąŪôėžĚĄ Ž∂ĄžĄĚŪēėžėĞ̥ ŽēĆ, žúĄžēĒžĚī 35.9%, ŽĆÄžě•žēĒžĚī 20.4%Ž°ú žúĄžě•ÍīÄÍ≥Ą žēĒžĚī ÍįÄžě• ŽßéžēėžúľŽ©į, ŪŹźžēĒ 9.4%, ÍįĎžÉĀžĄ†žēĒ 6.1%, ŽāúžÜĆ/žěźÍ∂ĀžēĒ 5.7%, žú†Žį©žēĒ 5.2%, ÍįĄžēĒ 4.6%, ŽčīŽŹĄÍ≥ĄžēĒ 2.9%, žčĚŽŹĄžēĒ 2.8%, ž∑Ćžě•žēĒ 1.6%, Ūėąžē°žēĒ 1.5% žąúžĚīžóąžúľŽ©į ÍłįŪÉÄ žēĒžĚī 3.9%žėÄŽč§.
Ž≥īÍ≥†Žźú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė žõźžĚł žēĹž†úžóź ŽĆÄŪēī žēĒ ŪôėžěźžôÄ ŽĻĄ-žēĒŪôėžěź ÍįĄžĚė žį®žĚīŽ•ľ Ž∂ĄžĄĚŪēėžėÄŽč§(Table 1). ŽĻĄ-žēĒ ŪôėžěźžóźžĄúŽäĒ Ūē≠žÉĚž†úžôÄ žßĄŪÜĶž†ú(tramadol, nonsteroidal anti-inflammatory drugs[NSAIDs], and opioids)ÍįÄ ÍįĀÍįĀ 36.5%, 24.7%Ž°ú ÍįÄžě• ŪĚĒŪēú žõźžĚłžĚīžóąÍ≥† žöĒžė§ŽďúŪôĒ ž°įžėĀž†úÍįÄ 13.4%Ž°ú Žč§žĚƞ̥ žį®žßÄŪēėžėÄŽč§. ŽįėŽ©ī, žēĒ ŪôėžěźžóźžĄúŽäĒ ž£ľžā¨žėĀžĖĎž†úÍįÄ žį®žßÄŪēėŽäĒ ŽĻĄžú®žĚī 40.4% (332ÍĪī)Ž°ú ÍįÄžě• ŽÜížēėžúľŽ©į, Í∑ł Žč§žĚĆžúľŽ°úŽäĒ Ūē≠žÉĚž†ú(17.4%), žßĄŪÜĶž†ú(16.7%), žöĒžė§ŽďúŪôĒž°įžėĀž†ú(10.6%), ŽĻĄŪÉÄŽĮľž†ú(3.9%), Ūē≠ÍĶ¨Ū܆ž†ú(3.0%), Ūē≠žēĒž†ú(2.4%)Ž°ú ŽĻĄ-žēĒ ŪôėžěźžôÄ žú†žĚėŪēú žį®žĚīŽ•ľ Ž≥īžėÄŽč§(p< 0.001). ŪäĻŪěą, žßĄŪÜĶž†ú ž§ĎžóźžĄúŽäĒ žēĒ ŪôėžěźžôÄ ŽĻĄ-žēĒ Ūôėžěź ŽĎźÍĶį Žč§ tramadolžĚė ŽĻĄžú®žĚī Žß§žöį ŽÜížēėŽč§.
žõźžĚł žēĹŽ¨ľžĚė Ūą¨žēĹ Í≤ĹŽ°úŽ•ľ Ž∂ĄžĄĚŪēėžėĞ̥ ŽēĆ, žēĒ ŪôėžěźŽď§žóźžĄúŽäĒ ž†ēŽß•Ūą¨žó¨ÍįÄ 93.3%Ž°ú ÍįÄžě• ŽßéžēėžúľŽ©į, Í≤ĹÍĶ¨Ūą¨žó¨ÍįÄ 3.5%, Í∑ľžú°ž£ľžā¨ÍįÄ 2.7%, ŪĒľŽ∂Ä ž†Ďžį©žĚĄ ŪÜĶŪēú Ūą¨žó¨ÍįÄ 0.4%, ŪĒľŪēėž£ľžā¨ÍįÄ 0.1%Ž•ľ žį®žßÄŪēėžėÄŽč§(Table 1). ŽĻĄ-žēĒ ŪôėžěźžĚė Í≤Ĺžöį ž†ēŽß•Ūą¨žó¨ÍįÄ 87.5%, Í≤ĹÍĶ¨Ūą¨žó¨ÍįÄ 8.1%Ž°ú žēĒ ŪôėžěźŽď§žóź ŽĻĄŪēī žÉĀŽĆÄž†ĀžúľŽ°ú ž†ēŽß•Ūą¨žó¨ ŽĻĄžú®žĚī ŽāģÍ≥† Í≤ĹÍĶ¨Ūą¨žó¨ ŽĻĄžú®žĚī ŽÜížēėŽč§(p< 0.05).
žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė žěĄžÉĀ ž¶ĚžÉĀžóź ŽĆÄŪēī Í≥ĄŪÜĶŽ≥Ą Ž∂ĄŪŹ¨Ž•ľ ž°įžā¨ŪēėžėĞ̥ ŽēĆ, žÜĆŪôĒÍłį ž¶ĚžÉĀžĚī 26ÍĪī(32.6%), ŪĒľŽ∂Ä ž¶ĚžÉĀžĚī 234ÍĪī(28.5%), žč†Í≤ĹÍ≥Ą ž¶ĚžÉĀžĚī 214ÍĪī(26.0%)žúľŽ°ú ŪĚĒŪěą Ž≥īÍ≥†ŽźėžóąŽč§. Žč§žĚĆžúľŽ°ú ž†Ąžč† ž¶ĚžÉĀžĚī 170ÍĪī(20.7%)žúľŽ°ú ŽĻĄÍĶźž†Ā ŽÜížĚÄ ŽĻąŽŹĄŽ•ľ žį®žßÄŪēėžėÄŽč§(Fig. 1). ž¶ĚžÉĀŽ≥ĄŽ°ú Ž∂ĄŽ•ėŪēėžėĞ̥ ŽēĆžóźŽäĒ ÍĶ¨žó≠(22.5%), ÍĶ¨Ū܆(16.8%), ŪĒľŽ∂Ä ÍįÄŽ†§žõÄž¶Ě(19.3%), ŪĒľŽ∂ÄŽįúžßĄ/ŽĎźŽďúŽü¨Íłį(20%)ÍįÄ ŪĚĒŪēėÍ≤Ć ŽāėŪÉÄŽāú žěĄžÉĀ žĖĎžÉĀžĚīžóąžúľŽ©į, Í∑ł Žč§žĚĆžúľŽ°ú ŽĎźŪÜĶ(14.4%), Žįúžóī(14.2%), žĖīžßÄŽüľž¶Ě(9.4%) ŽďĪžĚė ž¶ĚžÉĀžĚī ŪĚĒŪēėžėÄŽč§(Fig. 1).
žēĒ ŪôėžěźžóźžĄú Ž≥īÍ≥†Žźú žēĹŽ¨ľžú†ŪēīŽįėžĚώ吏Ěė ž§Ďž¶ĚŽŹĄŽ•ľ Ž∂ĄŽ•ėŪēī Ž≥īžēėžĚĄ ŽēĆ Í≤Ĺž¶ĚžĚÄ 475ÍĪī(57.8%), ž§ĎŽďĪž¶ĚžĚÄ 296ÍĪī(36%), ž§Ďž¶ĚžĚÄ 51ÍĪī(6.2%)žĚīžóąŽč§. ž§Ďž¶ĚžĚė žú†ŪēīŽįėžĚĎ Ž≥īÍ≥†ŽäĒ 54.9%ÍįÄ Žā®žěźŽ°ú, Í≤Ĺž¶Ě ŽįŹ ž§ĎŽďĪž¶Ěžóź ŽĻĄŪēī Žā®žĄĪžĚė ŽĻĄžú®žĚī žÉĀŽĆÄž†ĀžúľŽ°ú ŽÜížĚÄ Í≤ĹŪĖ•žĚĄ Ž≥īžėÄžúľŽ©į, 61-70žĄłÍįÄ 33.3%, 71-80žĄłÍįÄ 29.4%, 81žĄł žĚīžÉĀžĚī 9.6%Ž°ú Í≥†Ž†ĻžĚė ŽāėžĚīžóź ž§Ďž¶ĚžĚė ŽįėžĚĎžĚī ŽßéžĚī ŽįúžÉĚŪēėžėÄŽč§(Table 1). ŪôėžěźžĚė Íłįž†Ä žēĒ žßąŪôėžĚĄ Ž∂ĄžĄĚŪēėžėĞ̥ ŽēĆ, žúĄžēĒžĚī 41.2%Ž°ú ÍįÄžě• ŽßéžēėžúľŽ©į, Žč§žĚĆžúľŽ°ú ŽĆÄžě•žēĒ(15.7%)Í≥ľ ŽāúžÜĆ/žěźÍ∂ĀžēĒ(11.8%), ŽčīŽŹĄžēĒ(7.8%)žĚė ŽĻĄžú®žĚī ŽßéžēėŽč§.
ž§Ďž¶ĚžĚė žēĹŽ¨ľžú†ŪēīŽįėžĚϞ̥ žĚľžúľŪā® Í≤ÉžúľŽ°ú Ž≥īÍ≥†Žźú žõźžĚł žēĹŽ¨ľžĚÄ ž£ľžā¨žėĀžĖĎž†úžôÄ žßĄŪÜĶž†ú(ÍįĀÍįĀ 19.6%)ÍįÄ ÍįÄžě• ŽßéžēėžúľŽ©į, Žč§žĚĆžúľŽ°ú Ūē≠žÉĚž†ú(17.6%), Ūē≠žēĒž†ú(13.7%), žöĒžė§ŽďúŪôĒ ž°įžėĀž†ú(11.8%)žėÄÍ≥†, žúĄžě•ÍīÄÍ≥Ą žēĹžĚī 7.8%, ŽĻĄŪÉÄŽĮľž†úÍįÄ 3.9%žėÄŽč§. ž£ľžā¨žėĀžĖĎž†úžĚė Í≤Ĺžöį žßÄžßą žĄĪŽ∂ĄžóźžĄú ŽĆÄŽ∂ÄŽ∂Ą ŽįúžÉĚŪēėžėÄŽč§. ž§Ďž¶ĚžĚė žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚÄ žõźžĚł žēĹŽ¨ľ ž£ľžěÖ ŪõĄ Í≤Ĺž¶Ě ŽįŹ ž§ĎŽďĪž¶ĚžĚė ŽįėžĚĎžóź ŽĻĄŪēī žÉĀŽĆÄž†ĀžúľŽ°ú ŽĻ®Ž¶¨ žú†ŪēīŽįėžĚĎžĚī ŽįúžÉĚŪēú Í≤ĹŪĖ•žĚĄ Ž≥īžėÄŽč§(61.6 ¬Ī 94.8Ž∂Ą vs. 77.4 ¬Ī 132.9Ž∂Ą vs. 41.7 ¬Ī 67.8Ž∂Ą, p= 0.51).
žēĒ ŪôėžěźžóźžĄú ž§Ďž¶ĚžĚė žú†ŪēīŽįėžĚϞ̥ žĚľžúľŪā® Í≤ÉžúľŽ°ú Ž≥īÍ≥†Žźú žõźžĚł žēĹŽ¨ľŽ°ú ž£ľžā¨žėĀžĖĎž†úžĚė ŽĻąŽŹĄÍįÄ ŽÜížēėÍłįžóź, žēĒ ŪôėžěźžóźžĄú ž£ľžā¨ žėĀžĖĎž†úžóź žĚėŪēī ŽāėŪÉÄŽāėŽäĒ žěĄžÉĀ žĖĎžÉĀžĚĄ Ž∂ĄžĄĚŪēėžėÄŽč§. ŽĎźŪÜĶžĚīŽāėžóīÍįź, ÍĶ¨žó≠ ŽďĪžĚė ž¶ĚžÉĀžĚī ŪĚĒŪěą Ž≥īÍ≥†ŽźėžóąŽč§. ŪĒľŽ∂Ä ŽįúžßĄ, ŪĚČŪÜĶ, ŪėłŪĚ°Í≥§ŽěÄ, ÍīÄž†ąŪÜĶ ŽįŹ Í∑ľžú°ŪÜĶ, žč¨Í≥Ą Ūē≠žßĄ ŽďĪžĚė ŽįėžĚĎŽŹĄ Ž≥īÍ≥†ŽźėžóąÍ≥†(Fig. 2), žĚīŽüį ž¶ĚžÉĀžĚÄ ž£ľŽ°ú ž§Ďž¶ĚžĚė žú†ŪēīŽįėžĚĎŽ≥īÍ≥†žóźžĄú ŽāėŪÉÄŽā¨Žč§.
Ūē≠žēĒž†úžôÄ ÍīÄŽ†®Ūēėžó¨ žēĹŽ¨ľžú†ŪēīŽįėžĚĎžóź ŽĆÄŪēú žó¨Žü¨ Ž≥īÍ≥†ÍįÄ žěąžßÄŽßĆ, žēĒ ŪôėžěźžóźžĄú ŽįúžÉĚŪēú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžā¨Ž°Äžóź ŽĆÄŪēú žóįÍĶ¨ŽäĒ ÍĶ≠žôłžóźžĄúŽŹĄ Žß§žöį ŽďúŽ¨ľŽč§. Ž≥ł žóįÍĶ¨žóźžĄúŽäĒ Žč®žĚľÍłįÍīÄ žõźŽāī žēĹŽ¨ľžú†ŪēīŽįėžĚĎ ÍįźžčúžĄľŪĄįŽ•ľ ŪÜĶŪēī žēĒ ŪôėžěźŽď§žóźÍ≤ĆžĄú Ž≥īÍ≥†Žźú žēĹŽ¨ľžú†ŪēīŽįėžĚϞ̥ Ž∂ĄžĄĚŪēėÍ≥† Í∑ł ŪäĻžßēžĚĄ žāīŪéīŽ≥īžēėŽč§. 1,455ÍĪīžĚė žú†ŪēīŽįėžĚϞ̥ Ž∂ĄžĄĚŪēėžėÄÍ≥†, Í∑łž§Ď 822ÍĪī(52.1%)žĚī žēĒ ŪôėžěźžóźžĄú ŽįúžÉĚŪēú žā¨Ž°ÄžėÄŽč§. Ūėłž£ľžĚė žóįÍĶ¨žóźžĄú žěÖžõźŪēú žēĒ ŪôėžěźžĚė 74.3%ÍįÄ žēĹŽ¨ľžú†ŪēīŽįėžĚϞ̥ Í≤ĹŪóėŪēėžėÄŽč§Í≥† Ž≥īÍ≥†Ūēú ŽįĒ žěąžßÄŽßĆ[13], Ž≥ł žóįÍĶ¨žóźžĄúŽäĒ žěźŽįúž†Ā Ž≥īÍ≥†žěźŽ£ĆžĚė ŪēúÍ≥ĄŽ°ú žēĒ ŪôėžěźžóźžĄú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė ž†ēŪôēŪēú ŽįúžÉĚ ŽĻąŽŹĄŽ•ľ Ž∂ĄžĄĚŪē† žąėŽäĒ žóÜžóąžúľŽ©į, Ž≥īÍ≥†Žźú žõźžĚł žēĹŽ¨ľ ŪėĄŪô©Í≥ľ žěĄžÉĀ žĖĎžÉĀžĚĄ Ž∂ĄžĄĚŪē† žąė žěąžóąŽč§. žēĒ ŪôėžěźžóźžĄú žú†ŪēīŽįėžĚĎžĚī Ž≥īÍ≥†Žźú ŪôėžěźÍĶįžĚė ŪäĻžĄĪžĚĄ Ž≥īŽ©ī žó¨žĄĪžóźžĄú Žč§žÜĆ ŽßéžĚÄ Í≤ĹŪĖ•žĚī žěąžóąŽäĒŽćį, žĚīŽäĒ žó¨žĄĪžĚī žēĹŽ¨ľžú†ŪēīŽįėžĚĎžóź ž∑®žēĹŪēú Í≤ÉžúľŽ°ú žēĆŽ†§žßĄ Í≤ÉÍ≥ľ ŽĻĄžä∑ŪēėžėÄŽč§[14-16]. ŪēėžßÄŽßĆ ž§Ďž¶ĚžĚė žú†ŪēīŽįėžĚĎŽßƞ̥ Ž∂ĄžĄĚŪēú Í≤ĹžöįžóźŽäĒ žė§Ū칎†§ žó¨žĄĪŽ≥īŽč§ Žā®žĄĪžĚė ŽĻĄžú®žĚī Žč§žÜĆ ŽÜížĚÄ Í≤ĹŪĖ•žĚĄ Ž≥īžėÄŽč§. ÍĶ≠Žāī ŽÖłžĚłžĚĄ ŽĆÄžÉĀžúľŽ°ú Ūēú žēĹŽ¨ľžú†ŪēīŽįėžĚĎ Ž∂ĄžĄĚ žóįÍĶ¨žóźžĄú ž§Ďž¶Ě žú†ŪēīŽįėžĚĎžĚī Žā®žĄĪžóźžĄú ŽĻĄÍĶźž†Ā ŽÜížēėŽćė ž†źžĚĄ Í≥†Ž†§Ūē† ŽēĆ[8], žč§ž†ú žó¨žĄĪŽ≥īŽč§ Žā®žĄĪžóźžĄú ž§Ďž¶ĚžĚė žú†ŪēīŽįėžĚĎ ŽįúžÉĚŽ•†žĚī ŽÜížĚĄ ÍįÄŽä•žĄĪŽŹĄ Í≥†Ž†§Ūēī Ž≥ľ žąė žěąÍ≤†žúľŽāė, žĚīŽ≥īŽč§ŽäĒ Žā®žĄĪ ŪôėžěźžĚė ŽįúžÉĚ ŽĻąŽŹĄÍįÄ ŽÜížĚÄ žúĄžēĒ ŽįŹ ŽĆÄžě•žēĒ ŪôėžěźžóźžĄú ž§Ďž¶ĚžĚė žēĹŽ¨ľžú†ŪēīŽįėžĚĎ žā¨Ž°ÄÍįÄ ŽßéžĚī ŽįúžÉĚŽźú Í≤ÉÍ≥ľ ÍīÄŽ†®ŽźėžóąžĚĄ Í≤ÉžúľŽ°ú ž∂Ēž†ēŽźúŽč§. žóįŽ†ĻŽĆÄŽ≥ĄŽ°ú Ž∂ĄžĄĚŪēėžėĞ̥ ŽēĆ 51-60žĄł ŪôėžěźžĚė ŽĻĄžú®žĚī 31%Ž°ú ÍįÄžě• ŽßéžēėžúľŽ©į, Žč§žĚĆžúľŽ°ú 60-70ŽĆĞ󟞥ú ŽßéžĚī ŽįúžÉĚŪēėžėÄŽč§. ŪäĻŪěą, ž§ĎŽĆÄŪēú žú†Ūēī žā¨Ž°ÄžĚė Í≤Ĺžöį 60ŽĆÄ žĚīžÉĀžĚė ŽÖłžĚł ŪôėžěźžóźžĄú Ž≥īÍ≥† ŽĻĄžú®žĚī ŽÜížĚƞ̥ ŪôēžĚłŪē† žąė žěąžóąŽč§. 80žĄł žĚīŪõĄžóź žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė ŽįúžÉĚžĚī ÍįźžÜĆŪēėžó¨ žóįŽ†ĻžĚī žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė ŽŹÖŽ¶Ĺž†ĀžĚł žúĄŪóėžĚłžěźÍįÄ Žź† žąė žóÜžĚƞ̥ Ž≥īÍ≥†Ūēú žóįÍĶ¨ÍįÄ žěąžßÄŽßĆ[17], ŽßéžĚÄ žóįÍĶ¨Žď§žĚÄ ŽÖłŽ†ĻžĚė ŪôėžěźžóźžĄú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė ŽĻąŽŹĄÍįÄ ŽÜíÍ≥†, ŪäĻŪěą ž§Ďž¶ĚžĚė ŽįėžĚĎÍ≥ľ ÍīÄŽ†® žěąŽč§Í≥† Ž≥īÍ≥†ŪēėÍ≥† žěąŽč§[15,18,19]. žĚīŽäĒ Ž≥ł žóįÍĶ¨ Í≤įÍ≥ľžôÄŽŹĄ žĚľžĻėŪēúŽč§.
Ūē≠žÉĚž†úžôÄ žßĄŪÜĶž†ú, žöĒžė§ŽďúŪôĒ ž°įžėĀž†úŽäĒ ÍĶ≠ŽāīžóźžĄú ŪĚĒŪěą Ž≥īÍ≥†ŽźėŽäĒ žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė žõźžĚł žēĹŽ¨ľžĚīŽč§[20-23]. Ž≥ł žóįÍĶ¨žóźžĄú ŽĻĄ-žēĒ ŪôėžěźžóźžĄúŽäĒ žĚīž†Ą žóįÍĶ¨Žď§Í≥ľ žú†žā¨ŪēėÍ≤Ć Ūē≠žÉĚž†úžôÄ žßĄŪÜĶž†ú(tramadol, NSAIDs, and narcotics), žöĒžė§ŽďúŪôĒ ž°įžėĀž†úÍįÄ žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė ŪĚĒŪēú žõźžĚłžúľŽ°ú Ž≥īÍ≥†ŽźėžóąŽč§. ŪēėžßÄŽßĆ žēĒ ŪôėžěźžóźžĄúŽäĒ Ūē≠žÉĚž†ú(17.4%), žßĄŪÜĶž†ú(16.7%), žöĒžė§ŽďúŪôĒ ž°įžėĀž†ú(10.6%)Ž≥īŽč§ ž£ľžā¨žėĀžĖĎž†úÍįÄ žõźžĚł žēĹŽ¨ľžĚė 40.4%Ž•ľ žį®žßÄŪēėŽ©į ŪĚĒŪēú žõźžĚł žēĹŽ¨ľŽ°ú ŪôēžĚłŽźėžóąŽč§. žĚľŽįėž†ĀžúľŽ°ú ž£ľžā¨žėĀžĖĎž†úŽäĒ ŪėąÍīÄ žĻīŪÖĆŪĄį ÍīÄŽ†® Íįźžóľ, žßÄŽį©ÍįĄ ŽįŹ ÍįĄžóľ, ŽčīŽā≠žóľ, ž†ĄŪēīžßą žĚīžÉĀ, žě• žúĄž∂ē, žÉČž†Ąž¶Ě, ž≤īžė® žÉĀžäĻ, Í≥ľŽĮľŽįėžĚĎ ŽďĪ Žč§žĖĎŪēú žú†ŪēīŽįėžĚϞ̥ žĚľžúľŪā¨ žąė žěąŽč§Í≥† žēĆŽ†§ž†ł žěąžúľŽāė[24], žč§ž†úŽ°ú ž£ľžā¨žėĀžĖĎž†úžóź žĚėŪēú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžóź ŽĆÄŪēú Ž≥īÍ≥†ŽäĒ ŽďúŽ¨ľŽč§. ž£ľžā¨žėĀžĖĎž†úžóź žĚėŪēú Í≥ľŽĮľŽįėžĚĎžĚÄ 1965ŽÖĄ ž≤ėžĚĆ 4ÍįúžĚė ž¶ĚŽ°ÄÍįÄ Ž≥īÍ≥†Žźú žĚīŪõĄ ÍįĄŪ󟞆ĀžúľŽ°ú ž¶ĚŽ°ÄŽ≥īÍ≥†ÍįÄ žĚīŽ£®žĖīžßÄÍ≥† žěąžúľŽ©į[25-27], 150ŽßĆ Ž™ÖŽčĻ 1Ž™Ö ž†ēŽŹĄžóźžĄú ŽįúžÉĚŪēėŽäĒ Í≤ÉžúľŽ°ú ž∂Ēžł°ŽźėÍ≥† žěąŽč§[28,29]. 2018ŽÖĄ Christian ŽďĪ[30]žĚī Ž¨łŪóĆÍ≥†žįįŪēú ŽįĒžóź ŽĒįŽ•īŽ©ī ž£ľžā¨ žėĀžĖĎž†úžóź ŽĆÄŪēú Í≥ľŽĮľŽįėžĚĎžĚÄ ŪôėžěźžĚė 60%ÍįÄ ž≤ę ž£ľžā¨ ŽčĻžčú ŽįúžÉĚŪēėžėÄžúľŽ©į, ž≤ęŽā† ŽįúžÉĚŪēú ŪôėžěźžĚė 70%ÍįÄ ž£ľžěÖ žčúžěĎ 30Ž∂Ą žēąžóź ŽįúžÉĚŪēėŽ©į, ŪĒľŽ∂Ä ž¶ĚžÉĀžĚī ÍįÄžě• ŪĚĒŪēėžßÄŽßĆ žēĄŽāėŪēĄŽĚĹžčúžä§Žāė ŪėłŪĚ°Íłį ž¶ĚžÉĀ, Ūėąžē°Ūēôž†Ā Ž∂ąžēąž†ē ŽďĪžĚī ŽāėŪÉÄŽā† žąė žěąŽč§Í≥† Ž≥īÍ≥†Ūēú ŽįĒ žěąŽč§. ŽėźŪēú, žĚīŽüį Í≥ľŽĮľŽįėžĚĎžĚė žõźžĚłžúľŽ°úŽäĒ ž£ľžā¨žėĀžĖĎž†úžĚė žßÄžßą žĄĪŽ∂Ą(48.4%)žĚī ÍįÄžě• ŪĚĒŪēėžėÄžúľŽ©į, ŽĻĄŪÉÄŽĮľ(33.3%)žĚīŽāė žēĄŽĮłŽÖłžāį žĄĪŽ∂Ą(9%)ŽŹĄ žõźžĚłžĚī Žź† žąė žěąžĚƞ̥ Ž≥īÍ≥†ŪēėžėÄŽč§[30]. Ž≥ł žóįÍĶ¨žóźžĄúŽŹĄ ž£ľžā¨žėĀžĖĎž†úžĚė žßÄžßą žĄĪŽ∂ĄžóźžĄú ÍįÄžě• ŪĚĒŪěą ŽįúžÉĚŪēėžėÄžúľŽ©į, 12.2%ŽäĒ žēĄŽĮłŽÖłžāį žĄĪŽ∂Ąžóź žĚėŪēīžĄú ŽįúžÉĚŽźėžóąŽč§. ŽėźŪēú, ŽĻĄŪÉÄŽĮľ Ž≥ĶŪē©ž†úŽāė ŽĻĄŪÉÄŽĮľ B, C ž†úž†úžóź žĚėŪēú žú†ŪēīŽįėžĚĎŽŹĄ žēĒ ŪôėžěźžĚė 3.4%žóźžĄú ÍīÄžįįŽźėžóąŽč§. žĚīŽ≤ą žóįÍĶ¨žóźžĄú žēĒ ŪôėžěźžóźžĄú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė žõźžĚł žēĹŽ¨ľŽ°ú ž£ľžā¨žėĀžĖĎž†úÍįÄ ŽßéžēėŽćė Í≤ÉžĚÄ žā¨žö©ŽüČžĚī ŽßéžĚÄ Í≤ÉÍ≥ľ ÍīÄŽ†® žěąžĚĄ Í≤ÉžúľŽ°ú ž∂Ēž†ēŽźúŽč§. žēĒ ŪôėžěźŽď§žĚÄ žßĄŽč® žčúŽ∂ÄŪĄį ŪôėžěźžĚė 10-40%ÍįÄ ž≤īž§Ď ÍįźžÜĆŽ•ľ Í≤ĹŪóėŪēėŽ©į, žč¨žßÄžĖī žėĀžĖĎÍ≤įŪēćžĚĄ ŽāėŪÉÄŽāīŽäĒ Í≤ĹžöįÍįÄ ŽßéŽč§[31]. žĚīŽ°ú žĚłŪēī žā∂žĚė žßąŽŅźŽßĆ žēĄŽčąŽĚľ Íįźžóľ ÍłįŪöĆÍįÄ ŽÜížúľŽ©į Ž≥Ďžõź žěÖžõź ÍłįÍįĄžĚī žóįžě•ŽźėŽäĒ ŽďĪ žā¨ŽßĚžĚė žúĄŪóėŽŹĄÍįÄ ŽÜížĚÄ Í≤ÉžúľŽ°ú žēĆŽ†§ž†ł žěąžĖī[32,33], žĻėŽ£Ćžóź ŽĆÄŪēú ŽįėžĚϞ̥ ŪĖ•žÉĀžčúŪā§Í≥†žěź Í≤ĹÍĶ¨žėĀžĖĎ Ūą¨žó¨Ž•ľ ŽĻĄŽ°ĮŪēėžó¨ ž£ľžā¨žėĀžĖĎž†ú Ūą¨žó¨ÍįÄ žěĄžÉĀžóźžĄú ŽĻąŽ≤ąŪēėÍ≤Ć žĚīŽ£®žĖīžßÄÍ≥† žěąŽč§[34]. žč§ž†ú Ž≥ł žóįÍĶ¨žóźžĄú ž≤ėŽį©Ž•†žĚī žÉĀŽĆÄž†ĀžúľŽ°ú ŽāģžĚÄ ŽĻĄ-žēĒ ŪôėžěźžĚė žēĹŽ¨ľžú†ŪēīŽįėžĚϞ󟞥úŽäĒ ž£ľžā¨žėĀžĖĎž†úÍįÄ žį®žßÄŪēėŽäĒ ŽĻĄžú®žĚī ŽÜížßÄ žēäžēėŽč§(40.4% vs. 6.2%). Í≤ĆŽč§ÍįÄ ž£ľžā¨žėĀžĖĎž†úŽ°ú žĚłŪēú žú†ŪēīŽįėžĚĎ Ž≥īÍ≥†žĚė ŽßéžĚÄ Ž∂ÄŽ∂ĄžĚī Žč§Ž•ł žēĹŽ¨ľÍ≥ľ Ž≥Ďžö©Ūēú Í≤ÉžúľŽ°ú ŽāėŪÉÄŽāú ž†źžĚĄ Í≥†Ž†§Ūē† ŽēĆ, žč§ž†ú ž£ľžā¨žėĀžĖĎž†ú Žč®ŽŹÖžóź žĚėŪēú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚÄ Ž≥ł žóįÍĶ¨žóźžĄú Ž≥īÍ≥†Žźú Í≤ÉŽ≥īŽč§ŽäĒ ŽāģžĚĄ Í≤ÉžúľŽ°ú ž∂Ēž†ēŽźúŽč§.
žĚīŽ≤ą žóįÍĶ¨žóźžĄúŽäĒ ž∂ĒÍįÄŽ°ú ž§Ďž¶ĚžĚė žēĹŽ¨ľžú†ŪēīŽįėžĚϞ̥ žĚľžúľŪā® žõźžĚł žēĹŽ¨ľžĚĄ Ž∂ĄžĄĚŪēėžėÄžúľŽ©į, ž£ľžā¨žėĀžĖĎž†ú(19.6%)ÍįÄ žßĄŪÜĶž†ú(19.6%), Ūē≠žÉĚž†ú(15.7%), Ūē≠žēĒž†ú(11.8%), žöĒžė§ŽďúŪôĒ ž°įžėĀž†ú(11.8%)žôÄ Ūē®ÍĽė ŪĚĒŪēú žõźžĚłžěĄžĚĄ ŪôēžĚłŪēėžėÄŽč§. žēĒ ŪôėžěźžóźžĄú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė žõźžĚłžóź žěąžĖī ž£ľžā¨žėĀžĖĎž†úžĚė ŽĻąŽŹĄÍįÄ ŽÜížĚÄ Í≤ÉžĚī ž§Ďž¶ĚžĚė žú†ŪēīŽįėžĚĎžĚė žõźžĚł Ž∂ĄžĄĚžóźžĄú ŽÜížĚÄ ŽĻĄžú®žĚĄ ŽāėŪÉÄŽÉąžĚĄ ÍįÄŽä•žĄĪŽŹĄ žěąŽč§. ŪēėžßÄŽßĆ Ž≥ł žóįÍĶ¨žóźžĄú ž£ľžā¨žėĀžĖĎž†úžóź žĚėŪēú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė žěĄžÉĀ žĖĎžÉĀžĚĄ Ž∂ĄžĄĚŪēėžėĞ̥ ŽēĆ ŪĚČŪÜĶ, ŪėłŪĚ°Í≥§ŽěÄ, žč¨Í≥ĄŪē≠žßĄ ŽďĪžĚė ŽįėžĚϞ̥ ŪôēžĚłŪēú ŽįĒ žěąžúľŽ©į, žĚīŽäĒ Christian ŽďĪ[30]žĚė Ž≥īÍ≥†žóźžĄú ŽāėŪÉÄŽāú žēĄŽāėŪēĄŽĚĹžčúžä§ ŽįėžĚĎžĚīŽāė ŪėłŪĚ°Íłį ž¶ĚžÉĀ ŽďĪ ž§Ďž¶ĚžĚė ŽįėžĚĎ žĖĎžÉĀÍ≥ľ žĚľžĻėŪēėžėÄŽč§. Í≤ĆŽč§ÍįÄ ÍĶ≠Žāī Žč®žĚľ Ž≥ĎžõźžóźžĄú ž§Ďž¶ĚžĚė žēĹŽ¨ľžú†ŪēīŽįėžĚϞ̥ Ž∂ĄžĄĚŪēú žóįÍĶ¨žóźžĄú ŪėľŪē© ŽĻĄŪÉÄŽĮľž†úÍįÄ žēĄŽāėŪēĄŽĚĹžčúžä§žĚė 3Ž≤ąžßł ŪĚĒŪēú žõźžĚł žēĹŽ¨ľŽ°ú Ž≥īÍ≥†Ūēú ŽįĒ žěąžúľŽ©į[35], Ž≥ł žóįÍĶ¨žóźžĄú ŽĻĄŪÉÄŽĮľž†úŽŹĄ ž§Ďž¶ĚžĚė žēĹŽ¨ľžú†ŪēīŽįėžĚϞ̥ žĚľžúľŪā§ŽäĒ žõźžĚł ž§ĎžĚė ŪēėŽāėžėÄŽćė ž†źžĚĄ Í≥†Ž†§ŪēúŽč§Ž©ī žēĒ ŪôėžěźžóźžĄú ž£ľžā¨žėĀžĖĎž†ú ŽįŹ ŽĻĄŪÉÄŽĮľž†ú Ūą¨žó¨ žčúžóź žēĹŽ¨ľžú†ŪēīŽįėžĚĎ ŽįúžÉĚ ÍįÄŽä•žĄĪ ŽŅźŽßĆ žēĄŽčąŽĚľ, ŪäĻŪěą ž§Ďž¶ĚžĚė žú†ŪēīŽįėžĚĎžĚī ŽįúžÉĚŪē† žąė žěąžĚƞ̥ žĚłžßÄŪē† ŪēĄžöĒÍįÄ žěąÍ≤†žúľŽ©į, ŪäĻŪěą ž£ľžā¨ žėĀžĖĎž†úžĚė Í≤Ĺžöį žßÄžßą žĄĪŽ∂ĄžĚė žėĀžĖĎž†ú Ūą¨žó¨ žčúžóź ŽćĒ ž£ľžĚėÍįÄ ŪēĄžöĒŪēėÍ≤†Žč§.
Ž≥ł žóįÍĶ¨žóźžĄú žēĒ ŪôėžěźžóźžĄú Ūē≠žēĒž†úžóź žĚėŪēú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚÄ ŪĎúž†ĀžĻėŽ£Ćž†úŽ•ľ ŪŹ¨Ūē®Ūē† Í≤Ĺžöį 2.9%Ž°ú Žč§Ž•ł žóįÍĶ¨žóź ŽĻĄŪēī ŽĻąŽŹĄÍįÄ ŽāģžēėžúľŽ©į, žĚī ž§Ď ž§Ďž¶ĚžĚė žú†ŪēīŽįėžĚĎžĚī 8ÍĪīžúľŽ°ú Ūē≠žēĒž†ú žú†Ūēī žā¨Ž°ÄžĚė 33.3%Ž•ľ žį®žßÄŪēėžėÄŽč§. žĚīŽäĒ ÍĶ≠ŽāīžóźžĄú Ž≥īÍ≥†Žźú Ūē≠žēĒž†ú žú†Ūēī žā¨Ž°Ä Ž∂ĄžĄĚ žóįÍĶ¨žóźžĄú 7.8%ÍįÄ ž§Ďž¶ĚžĚė žú†ŪēīŽįėžĚĎžĚīžóąŽćė Í≤Éžóź ŽĻĄŪēī ŽÜížĚÄ ŽĻąŽŹĄžėÄŽč§[10]. žĚīŽäĒ Í≤Ĺž¶ĚžĚė žú†ŪēīŽįėžĚĎžóź ŽĆÄŪēú Ž≥īÍ≥†ÍįÄ ŽąĄŽĚĹŽźėžĖī žÉĀŽĆÄž†ĀžúľŽ°ú ž§Ďž¶Ě ŽįėžĚĎžĚė ŽĻąŽŹĄÍįÄ ŽÜížĚÄ Í≤ÉžúľŽ°ú Ž≥īžĚīŽ©į, žč§ž†ú Ūē≠žēĒž†úžóź žĚėŪēú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚÄ Ž≥ł žóįÍĶ¨ Í≤įÍ≥ľŽ≥īŽč§ŽäĒ ŽßéžĚĄ Í≤ÉžúľŽ°ú ž∂Ēž†ēŽźúŽč§.
žēĒ ŪôėžěźžóźžĄú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚÄ žúĄžě•ÍīÄÍ≥Ą, ŪĒľŽ∂Ä, žč†Í≤ĹÍ≥Ą Í∑łŽ¶¨Í≥† ž†Ąžč†Í≥Ą ž¶ĚžÉĀžĚė žąúžĄúŽ°ú ŽįúŪėĄŽźėžóąŽč§. ž¶ĚžÉĀŽ≥ĄŽ°ú Ž∂ĄŽ•ėŪēėžėĞ̥ ŽēĆžóźŽäĒ ÍĶ¨žó≠(22.5%), ÍĶ¨Ū܆(16.8%), ŪĒľŽ∂ÄÍįÄŽ†§žõÄž¶Ě(19.3%), ŪĒľŽ∂ÄŽįúžßĄ/ŽĎźŽďúŽü¨Íłį(20%)ÍįÄ ŪĚĒŪēėÍ≤Ć ŽāėŪÉÄŽāú žěĄžÉĀ žĖĎžÉĀžĚīžóąŽč§. Ūėłž£ľžóźžĄú Ž≥īÍ≥†Žźú žěÖžõźŪēú žēĒ ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú Ūēú žēĹŽ¨ľžú†ŪēīŽįėžĚĎ Ž∂ĄžĄĚžóźžĄúŽäĒ Ž≥ÄŽĻĄ, ÍĶ¨žó≠, ÍĶ¨Ū܆, ŪĒľŽ°úÍįź, ŪÉąŽ™®, Í≥®žąė žĖĶž†ú, ŪĒľŽ∂Ä ŽįėžĚĎ, ÍĶ¨Žāīžóľ, žĄ§žā¨ ŽďĪžĚī ŪĚĒŪēú ž¶ĚžÉĀžúľŽ°ú Ž≥īÍ≥†Žźú ŽįĒ žěąŽč§[13]. Ž≥ł žóįÍĶ¨žóźžĄúŽäĒ Í≥®žąėžĖĶž†úžôÄ ÍīÄŽ†®Žźú žú†ŪēīŽįėžĚĎžĚė Ž≥īÍ≥†ŽäĒ Žß§žöį ž†ĀžóąŽäĒŽćį, žĚīŽäĒ žěĄžÉĀž†Ā ž¶ĚžÉĀ žúĄž£ľŽ°ú žěźŽįúž†Ā Ž≥īÍ≥†ÍįÄ žĚīŽ£®žĖīž°ĆÍłį ŽēĆŽ¨łžúľŽ°ú ž∂Ēž†ēŽźúŽč§. ÍĶ¨žó≠, ÍĶ¨Ū܆ ŽďĪžĚė ž¶ĚžÉĀžĚÄ tramadol žā¨žö©Í≥ľ ÍīÄŽ†®ŽźėžĖī ž£ľŽ°ú Ž≥īÍ≥†Žźú ž¶ĚžÉĀžĚīžßÄŽßĆ, žēĒ ŪôėžěźžóźžĄú Ūą¨žó¨ŽźėŽäĒ Ūē≠žēĒž†úžĚė ž£ľžöĒ Ž∂ÄžěĎžö©žúľŽ°ú žēĆŽ†§ž†ł žěąžĖī žĚīžôÄ ÍīÄŽ†®ŽźėžóąžĚĄ ÍįÄŽä•žĄĪŽŹĄ Žįįž†úŪē† žąė žóÜŽč§.
Ž≥ł žóįÍĶ¨ŽäĒ žēĒ ŪôėžěźžóźžĄú ŽįúžÉĚŪēú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė žĖĎžÉĀžĚĄ Ž∂ĄžĄĚŪēú žóįÍĶ¨žĚīŽāė Ž™á ÍįÄžßÄ ž†úŪēúž†źžĚī žěąŽč§. ž≤ęžßł, žĚī žóįÍĶ¨ŽäĒ žěźŽįúž†Ā Ž≥īÍ≥†žěźŽ£ĆŽ•ľ ÍłįŽįėžúľŽ°ú Ūēú ŪõĄŪĖ•ž†Ā Ž∂ĄžĄĚ žóįÍĶ¨žĚīŽč§. Í∑ł Í≤įÍ≥ľ žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė ž†ēŪôēŪēú ŽįúžÉĚŽ•†žĚĄ ÍĶ¨Ūē† žąė žóܞ̥ ŽŅź žēĄŽčąŽĚľ, žĚīŽĮł žěė žēĆŽ†§žßĄ žú†ŪēīŽįėžĚĎžĚīŽāė Í≤Ĺž¶ĚžĚė žú†ŪēīŽįėžĚĎžĚī ž†ĀÍ≤Ć Ž≥īÍ≥†ŽźėžóąžĚĄ žąė žěąžúľŽ©į, Ž≥īÍ≥†žěźžĚł žĚėŽ£ĆžĚłžĚė Ž≥īÍ≥†žú®žóź ŽĒįŽĚľ Í∑ł Í≤įÍ≥ľÍįÄ Žč¨ŽĚľžßą žąė žěąŽč§. Í∑łŽü¨Žāė žēĒ ŪôėžěźŽ•ľ ŽĆÄžÉĀžúľŽ°ú Ūēú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžóź ŽĆÄŪēú ž†ĄŪĖ•ž†ĀžĚł žó≠Ūēôž°įžā¨ÍįÄ ŪėĄžč§ž†ĀžúľŽ°ú žĖīŽ†§žöī ž†źžĚĄ ÍįźžēąŪē† ŽēĆ Ž≥ł žóįÍĶ¨žôÄ ÍįôžĚÄ žěźŽįúž†Ā žēĹŽ¨ľžú†ŪēīŽįėžĚĎ ŽćįžĚīŪĄį Ž∂ĄžĄĚžĚÄ žú†žö©ŪēėŽč§. ŽĎėžßł, ŪôēžßĄŽźú žõźžĚł žēĹŽ¨ľŽŅźŽßĆ žēĄŽčąŽĚľ žĚėžč¨ŽźėŽäĒ žēĹŽ¨ľžóź ŽĆÄŪēīžĄúŽŹĄ Ž≥īÍ≥†ÍįÄ žĚīŽ£®žĖīžßÄÍłį ŽēĆŽ¨łžóź žõźžĚł žēĹŽ¨ľžĚī žēĄŽčĆ žēĹž†úŽď§ŽŹĄ Ž∂ĄžĄĚžóź ŪŹ¨Ūē®ŽźėžĖī žõźžĚł žēĹŽ¨ľžĚė ŽĻąŽŹĄÍįÄ Í≥ľžÜĆ ŽėźŽäĒ Í≥ľŽĆÄ ŪŹČÍįÄŽźėžóąžĚĄ žąė žěąŽč§ŽäĒ ž†úŪēúž†źžĚī žěąŽč§. ŽßąžßÄŽßČžúľŽ°ú Ž≥ł žóįÍĶ¨ŽäĒ Žč®žĚľ Ž≥ĎžõźžóźžĄú Ž≥īÍ≥†Žźú žěźŽ£ĆŽ•ľ Ž∂ĄžĄĚŪēú Í≤ÉžúľŽ°ú ž†Ąž≤ī žēĒ ŪôėžěźžĚė žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė ŪäĻžĄĪžĚĄ ŽāėŪÉÄŽāīÍłįžóźŽäĒ žĖīŽ†§žõÄžĚīžěąŽč§. žēĒ ŪôėžěźŽď§žĚė Í≤Ĺžöį, 2-3žĘÖžĚė Ūē≠žēĒž†úŽ•ľ ŽĻĄŽ°ĮŪēėžó¨ Žč§žĖĎŪēú žēĹž†úŽ•ľ Ž≥Ķžö©ŪēėÍ≥† žěąŽäĒ Í≤ĹžöįÍįÄ ŽßéžēĄ žč§ž†ú Ž≥īÍ≥†Žźú žú†ŪēīŽįėžĚĎžĚī ŪäĻž†ē žēĹž†úžôÄ žĚłÍ≥ľžĄĪžĚĄ ŪôēžĚłŪēėŽäĒ Í≤ÉžĚī žĖīŽ†§žöł žąė žěąžßÄŽßĆ, ŽćĒ ŽßéžĚÄ ÍīÄžč¨Í≥ľ ž£ľžĚėŽ•ľ ÍįÄžßÄÍ≥† žēĒ ŪôėžěźžóźžĄú žēĹŽ¨ľžú†ŪēīŽįėžĚϞ̥ žėąŽį©ŪēėÍ≥† ŽĆÄž≤ėŪēėŽ†§ŽäĒ ŽÖłŽ†•žĚī ŪēĄžöĒŪē† Í≤ÉžúľŽ°ú Ž≥īžĚīŽ©į, žĚīžóź ŽĆÄŪēú žßÄžÜ枆ĀžĚł Žč§ÍłįÍīÄ žóįÍĶ¨ÍįÄ žąėŽįėŽźėžĖīžēľ Ūē† Í≤ÉžĚīŽč§.
Í≤įŽ°†ž†ĀžúľŽ°ú Ž≥ł žóįÍĶ¨ŽäĒ Žč®žĚľ Ž≥ĎžõźžóźžĄú žěźŽįúž†ĀžúľŽ°ú Ž≥īÍ≥†Žźú žēĹŽ¨ľžú†ŪēīŽįėžĚĎ ž§Ď žēĒ ŪôėžěźŽď§žĚĄ ŽĆÄžÉĀžúľŽ°ú Ž∂ĄžĄĚžĚĄ žßĄŪĖČŪēėžėÄžúľŽ©į, žēĹŽ¨ľžú†ŪēīŽįėžĚĎžĚė žõźžĚłžúľŽ°ú ž£ľžā¨žėĀžĖĎž†ú, Ūē≠žÉĚž†ú, žßĄŪÜĶž†ú, žöĒžė§ŽďúŪôĒ ž°įžėĀž†úžĚė ŽĻąŽŹĄÍįÄ ŽÜížēėžúľŽ©į, ŪäĻŪěą ž£ľžā¨žėĀžĖĎž†úžôÄ ŽĻĄŪÉÄŽĮľž†úÍįÄ žßĄŪÜĶž†úžôÄ Ūē≠žēĒž†úžôÄ Ūē®ÍĽė žēĒ ŪôėžěźžóźžĄú ž§Ďž¶ĚžĚė žēĹŽ¨ľžú†ŪēīŽįėžĚϞ̥ žĚľžúľŪā§ŽäĒ žõźžĚłžěĄžĚĄ ŪôēžĚłŪē† žąė žěąžóąŽč§. ŽĒįŽĚľžĄú žēĒ ŪôėžěźžóźÍ≤Ć ž£ľžā¨žėĀžĖĎž†úžôÄ ŽĻĄŪÉÄŽĮľž†úŽ•ľ Ūą¨žó¨Ūē† ŽēĆŽäĒ žēĹŽ¨ľžú†ŪēīŽįėžĚĎ ŽįúžÉĚ ÍįÄŽä•žĄĪžĚĄ žóľŽĎźŪēīžēľ Ūē† Í≤ÉžúľŽ°ú žÉĚÍįĀŽźėŽ©į, ŪĖ•ŪõĄ ž£ľžā¨ žėĀžĖĎž†ú ŽįŹ ŽĻĄŪÉÄŽĮľž†úžóź ŽĆÄŪēú žēĹŽ¨ľžú†ŪēīŽįėžĚĎžóź ŽĆÄŪēīžĄúŽäĒ Žč§ÍłįÍīÄ žóįÍĶ¨ÍįÄ ŪēĄžöĒŪēėÍ≤†Žč§.
REFERENCES
1. Choi NK, Park BJ. Adverse drug reaction surveillance system in Korea. J Prev Med Public Health 2007;40:278‚Äď284.


2. Pirmohamed M, James S, Meakin S, et al. Adverse drug reactions as cause of admission to hospital: prospective analysis of 18 820 patients. BMJ 2004;329:15‚Äď19.



3. Gautier S, Bachelet H, Bordet R, Caron J. The cost of adverse drug reactions. Expert Opin Pharmacother 2003;4:319‚Äď326.

4. Bouvy JC, De Bruin ML, Koopmanschap MA. Epidemiology of adverse drug reactions in Europe: a review of recent observational studies. Drug Saf 2015;38:437‚Äď453.



5. Lundkvist J, J√∂nsson B. Pharmacoeconomics of adverse drug reactions. Fundam Clin Pharmacol 2004;18:275‚Äď280.


6. National Cancer Information Center. Cancer incidence [Internet]. Goyang (KR): National Cancer Information Center, c2018. [cited 2018 Dec 31]. Available from: https://www.cancer.go.kr/lay1/S1T639C640/contents.do
7. Lim KH, Kang MK, Kim BK, et al. Analysis of adverse drug reactions in elderly patients based on a spontaneous reporting system in a single tertiary hospital. Korean J Med 2017;92:277‚Äď285.

8. Beyth RJ, Shorr RI. Epidemiology of adverse drug reactions in the elderly by drug class. Drugs Aging 1999;14:231‚Äď239.


9. Scripcaru G, Mateus C, Nunes C. Adverse drug events-analysis of a decade. A Portuguese case-study, from 2004 to 2013 using hospital database. PLoS One 2017;12:e0178626.



10. Lee JY, Jung JW, Kang HR, Lee SH, Kim HS, Cho SH. Data analysis for anti-neoplastic chemotherapy-related adverse events reported to the Korean pharmacovigilance regional network. Korean J Med 2013;85:385‚Äď395.

11. Son MK, Lee YW, Jung HY, et al. Comparison of the Naranjo and WHO-Uppsala Monitoring Centre criteria for causality assessment of adverse drug reactions. Korean J Med 2008;74:181‚Äď187.
12. Hartwig SC, Siegel J, Schneider PJ. Preventability and severity assessment in reporting adverse drug reactions. Am J Hosp Pharm 1992;49:2229‚Äď2232.


13. Lau PM, Stewart K, Dooley M. The ten most common adverse drug reactions (ADRs) in oncology patients: do they matter to you? Support Care Cancer 2004;12:626‚Äď633.


14. de Vries ST, Denig P, Ekhart C, et al. Sex differences in adverse drug reactions reported to the national pharmacovigilance centre in the Netherlands: an explorative observational study. Br J Clin Pharmacol 2019;85:1507‚Äď1515.



15. Ca√Īas PE, Luna Del Castillo JD. Adverse drug reactions in patients visiting a general hospital: a meta-analysis of results. An Med Interna 2007;24:574‚Äď578.

16. Giardina C, Cutroneo PM, Mocciaro E, et al. Adverse drug reactions in hospitalized patients: results of the FORWARD (facilitation of reporting in hospital ward) study. Front Pharmacol 2018;9:350.



17. Carbonin P, Pahor M, Bernabei R, Sgadari A. Is age an independent risk factor of adverse drug reactions in hospitalized medical patients? J Am Geriatr Soc 1991;39:1093‚Äď1099.


18. Patel TK, Patel PB. Incidence of adverse drug reactions in indian hospitals: a systematic review of prospective studies. Curr Drug Saf 2016;11:128‚Äď136.


19. Corsonello A, Pedone C, Incalzi RA. Age-related pharmacokinetic and pharmacodynamic changes and related risk of adverse drug reactions. Curr Med Chem 2010;17:571‚Äď584.


20. Rew SY, Koh YL, Shin HY, et al. Reporting and clinical features of adverse drug reactions from a single university hospital. Korean J Asthma Allergy Clin Immunol 2011;31:184‚Äď191.
21. Kim MK, Kang HR, Kim JH, et al. Analysis of adverse drug reactions collected by an electronic reporting system in a single hospital. Korean J Med 2009;77:601‚Äď609.
22. Kim MH, Jung HY, Sohn MK, et al. Clinical features of adverse drug reactions in a tertiary care hospital in Korea. Korean J Asthma Allergy Clin Immunol 2008;28:35‚Äď39.
23. Rhey KY, Lee SH. Analysis of the Korea Food and Drug Administration adverse drug reaction reports. Kor J Clin Pharm 2011;21:138‚Äď144.
24. Mundi MS, Salonen BR, Bonnes S. Home parenteral nutrition: fat emulsions and potential complications. Nutr Clin Pract 2016;31:629‚Äď641.


25. Guimbretiere J, Nicolas F, Nicolas G, Guimbretiere L. 4 cases of intolerance to lipid perfusions observed with an emulsion of cotton seed oil in the presence of soya lecithin and dl-alpha-tocopherol. Cah Anesthesiol 1965;13:355‚Äď370.
26. Scolapio JS, Ferrone M, Gillham RA. Urticaria associated with parenteral nutrition. JPEN J Parenter Enteral Nutr 2005;29:451‚Äď453.


27. Bullock L, Etchason E, Fitzgerald JF, McGuire WA. Case report of an allergic reaction to parenteral nutrition in a pediatric patient. JPEN J Parenter Enteral Nutr 1990;14:98‚Äď100.


28. Nagata MJ. Hypersensitivity reactions associated with parenteral nutrition: case report and review of the literature. Ann Pharmacother 1993;27:174‚Äď177.

29. Monjo MC, Perez JS, Peris MC, et al. Probable hypersensitivity reaction to parenteral nutrition: report of a case. Nutr Hosp 2005;20:228‚Äď231.

30. Christian VJ, Tallar M, Walia CLS, Sieracki R, Goday PS. Systematic review of hypersensitivity to parenteral nutrition. JPEN J Parenter Enteral Nutr 2018;42:1222‚Äď1229.


31. Virizuela JA, Camblor-√Ālvarez M, Luengo-P√©rez LM, et al. Nutritional support and parenteral nutrition in cancer patients: an expert consensus report. Clin Transl Oncol 2018;20:619‚Äď629.


32. S√°nchez RE, Garc√≠a-Galbis MR. Enteral nutrition on the nutritional status of cancer. Nutr Hosp 2015;32:1408‚Äď1416.

33. Chow R, Bruera E, Chiu L, et al. Enteral and parenteral nutrition in cancer patients: a systematic review and meta-analysis. Ann Palliat Med 2016;5:30‚Äď41.

Clinical manifestations of adverse events in cancer patients, classified by (A) system organ classes and by (B) symptoms.
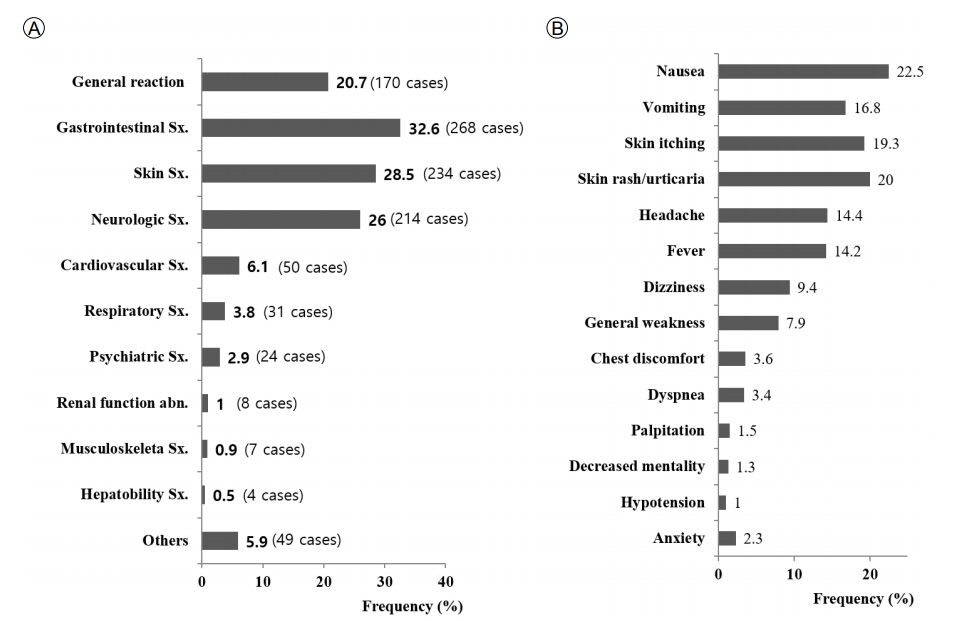
Figure 1.
Clinical presentation of cancer patients with adverse drug reaction from parenteral nutritional supplements.
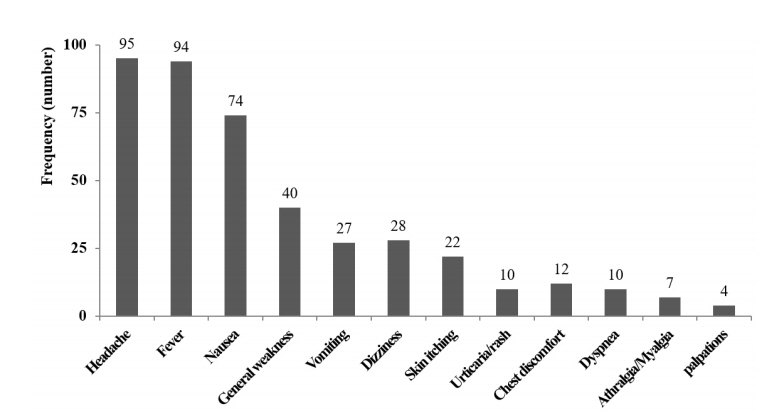
Figure 2.
Table 1.
Baseline characteristics of cases included in this analysis
|
Patients with cancer |
Patients without cancer (total n = 633) | ||||||
|---|---|---|---|---|---|---|---|
| Total (n = 822) | Mild and moderate cases (n = 771) | Severe cases (n = 51) | |||||
| Age (years)a | |||||||
| ‚ÄÉ | 11‚Äď20 | 1 (0.1) | 1 (0.1) | 0 | 31 (4.9) | ||
| 21‚Äď30 | 11 (1.3) | 11 (1.4) | 0 | 58 (9.2) | |||
| 31‚Äď40 | 34 (4.1) | 31 (4.0) | 3 (5.9) | 65 (10.3) | |||
| 41‚Äď50 | 104 (12.7) | 98 (12.7) | 5 (9.8) | 116 (18.3) | |||
| 51‚Äď60 | 255 (31.0) | 243 (31.5) | 12 (23.5) | 157 (24.8) | |||
| 61‚Äď70 | 220 (26.8) | 205 (26.6) | 15 (29.4) | 116 (18.3) | |||
| 71‚Äď80 | 165 (20.1) | 152 (19.7) | 14 (27.5) | 80 (12.6) | |||
| ‚Č•81 | 32 (3.9) | 30 (3.9) | 2 (3.9) | 10 (1.61) | |||
| Gender (M/F) | 377 (45.9)/445 | 354 (45.9)/417 | 28 (54.9)/23 | 273 (43.1)/360 | |||
| BMI (kg/m2) | 22.50 ¬Ī 4.32 | 22.48 ¬Ī 4.34 | 22.61 ¬Ī 3.83 | 21.94 ¬Ī 6.67 | |||
| Causative drugsa,b | |||||||
| Parenteral nutrition supplements | 332 (40.4) | 322 (41.8) | 10 (19.6) | 39 (6.2) | |||
| ‚ÄÉ | Amino-acid | 100 (12.2) | 99 (12.8) | 1 (2.0) | 15 (2.4) | ||
| Lipid | 230 (28.0) | 221 (28.7) | 9 (17.6) | 23 (3.6) | |||
| TPN | 2 (0.2) | 2 (0.3) | 0 | 1 (0.2) | |||
| Vitamins | 32 (3.9) | 30 (3.9) | 2 (3.9) | 39 (6.2) | |||
| Multi-vitamins | 22 (2.7) | 22 (2.9) | 1 (2.0) | 26 (4.1) | |||
| Vitamin B or C | 6 (0.7) | 6 (0.9) | 0 | 3 (0.5) | |||
| Vitamin K | 4 (0.5) | 4 (0.5) | 1(2.0) | 10 (1.6) | |||
| Antibiotics | 143 (17.4) | 134 (17.4) | 9 (17.6) | 231 (36.5) | |||
| Penicillins | 7 (0.9) | 7 (0.9) | 1 (2.0) | 17 (2.7) | |||
| ‚ÄÉ | Natural penicillin | 0 | 0 | 0 | 1 | ||
| Aminopenicillins | 3 | 3 | 0 | 5 | |||
| Extended spectrum penicillins | 4 | 3 | 1 | 11 | |||
| Cephalosporins | 104 (12.7) | 96 (12.5) | 8 (15.6) | 119 (18.8) | |||
| Quinolones | 27 (3.3) | 27 (3.5) | 0 | 75 (11.8) | |||
| Ciprofloxacin | 20 | 20 | 0 | 59 | |||
| Levofloxacin | 6 | 6 | 0 | 14 | |||
| Moxifloxacin | 1 | 1 | 0 | 2 | |||
| Aminoglycosides | 1 (0.1) | 1 (0.1) | 0 | 4 (0.6) | |||
| Aztreonam | 1 (0.1) | 1 (0.1) | 0 | 4 (0.6) | |||
| Vancomycin | 0 | 0 | 0 | 3 (0.5) | |||
| Metronidazole | 3 (0.4) | 3 (0.4) | 0 | 7 (1.1) | |||
| Clindamycin | 0 | 0 | 0 | 2 (0.3) | |||
| Anti-fungal agents | 1 (0.1) | 1 (0.1) | 0 | 0 | |||
| Anti-tuberculosis agents | 0 | 0 | 0 | 8 (1.3) | |||
| Analgesics | 137 (16.7) | 127 (16.7) | 10 (19.6) | 156 (24.7) | |||
| NSAIDs | 13 (1.6) | 11 (1.4) | 2 (3.9) | 31 (4.9) | |||
| Paracetamol | 4 (0.5) | 4 (0.5) | 0 | 1 (0.2) | |||
| Tramadol | 100 (12.2) | 95 (12.3) | 5 (9.8) | 102 (16.1) | |||
| Acetaminophen | 2 (0.2) | 2 (0.3) | 0 | 0 | |||
| Tramadol + acetaminophen | 5 (0.6) | 5 (0.6) | 0 | 1 (0.2) | |||
| Opioids | 13 (1.6) | 10 (1.3) | 3 (5.9) | 15 (2.4) | |||
| Anti-neoplastic agents | 20 (2.4) | 13 (1.7) | 7 (13.7) | 0 | |||
| Paclitaxel | 2 (0.2) | 1 (0.1) | 1 (2.0) | 0 | |||
| Oxaliplatin | 11 (1.3) | 8 (1.1) | 3 (5.9) | 0 | |||
| Cisplatin | 3 (0.3) | 1 (0.1) | 2 (3.9) | 0 | |||
| Carboplatin | 1 (0.1) | 1 (0.1) | 0 | 0 | |||
| Irinotecan | 1 (0.1) | 1 (0.1) | 0 | 0 | |||
| Cyclophosphamide | 1 (0.1) | 0 | 1 (2.0) | 0 | |||
| Thalidomide | 1 (0.1) | 1 (0.1) | 0 | 0 | |||
| Biologics | 4 (0.5) | 3 (0.4) | 1 (2.0) | 4 (0.6) | |||
| Iodinated contrast media | 87 (10.6) | 80 (10.4) | 7 (11.8) | 85 (13.4) | |||
| Gadolinium contrast media | 3 (0.4) | 2 (0.3) | 1 (2.0) | 7 (1.1) | |||
| Corticosteroids | 2 (0.2) | 2 (0.3) | 0 | 2 (0.3) | |||
| GI medication | 37 (4.5) | 33 (4.3) | 4 (7.8) | 30 (4.7) | |||
| Anti-emetics | 25 (3.0) | 23 (3.0) | 2 (3.9) | 16 (2.5) | |||
| H2 blocker | 2 (0.2) | 2 (0.3) | 0 | 1 (0.2) | |||
| PPI | 2 (0.2) | 1 (0.1) | 1 (2.0) | 4 (0.6) | |||
| Laxatives | 1 (0.1) | 1 (0.1) | 0 | 2 (0.3) | |||
| Anti-spasmodic | 1 (0.1) | 1 (0.1) | 0 | 0 | |||
| Digestant | 2 (0.2) | 2 (0.3) | 0 | 1 (0.2) | |||
| Other: gabexatemesilate | 4 (0.5) | 3 (0.4) | 1(2.0) | 6 (0.9) | |||
| Anti-hypertensive agents | 1 (0.1) | 1(0.1) | 0 | 6 (0.9) | |||
| CNS drug | 8 (1.0) | 8 (1.0) | 0 | 3 (0.5) | |||
| Clotiazepam | 1 (0.1) | 1 (0.1) | 0 | 0 | |||
| Zolpidem | 2 (0.2) | 2 (0.3) | 0 | 3 (0.5) | |||
| Lorazepam | 2 (0.2) | 2 (0.3) | 0 | 0 | |||
| Midazolam | 3 (0.4) | 3 (0.4) | 0 | 0 | |||
| Anesthetics | 1 (0.1) | 1 (0.1) | 0 | 4 (0.6) | |||
| Anti-histamine | 1 (0.1) | 1 (0.1) | 0 | 3 (0.5) | |||
| Others | 13 (1.6) | 13 (1.7) | 0 | 23 (3.6) | |||
| Admission routec | |||||||
| Intravenous | 767 (93.3) | 719 (93.3) | 48 (94.1) | 554 (87.5) | |||
| Intramuscular | 22 (2.7) | 21 (2.7) | 1 (2.0) | 18 (2.8) | |||
| Subcutaneous | 1 (0.1) | 1 (0.1) | 0 | 4 (0.6) | |||
| Oral | 29 (3.5) | 28 (3.6) | 1 (2.0) | 51 (8.1) | |||
| Patch | 3 (0.4) | 2 (0.3) | 1 (2.0) | 4 (0.6) | |||
| Inhalation | 0 | 0 | 0 | 1 (0.2) | |||
| Eye drop | 0 | 0 | 0 | 1 (0.2) | |||
Values are presented as mean ¬Ī standard deviation or frequencies (%).
Statistical significance was evaluated by t-test or chi-squared test.
M, male; F, female; BMI, body mass index; TPN, total parenteral nutrition; NSAIDs, nonsteroidal anti-inflammatory drugs; PPI, proton-pump inhibitor; CNS, central nervous system.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




