 |
 |
| Korean J Med > Volume 94(2); 2019 > Article |
|
Abstract
CD19 chimeric antigen receptor T-cell (CAR-T) therapy, a genetically engineered cell therapy, showed unprecedented efficacy in the treatment of relapsed or refractory diffuse large B-cell lymphoma. Two agents, axicabtagene ciloleucel and tisagenlecleucel, were approved by the Food and Drug Administration in 2017. However, CAR-T therapy is a treatment with complex logistics and high costs, as well as inherent adverse events, including cytokine-release syndrome and neurotoxicity. In addition, predictive biomarkers for efficacy and toxicity are lacking. Industry-academy cooperation is urgently required to develop CAR-T therapy that is effective, safe, and affordable for patients in Korea.
림ي”„ى¢…ى€ يکˆى•،ى•” ى¤‘ ë°œىƒë¹ˆëڈ„ê°€ ê°€ى¥ 높ى€ ى§ˆي™کىœ¼ë،œ 2018ë…„ 기ى¤€ êµë‚´ى—گى„œ ى•½ 5ى²œ ىکˆىک ى‹ ي™کى´ ë°œىƒي•œ 것ىœ¼ë،œ ى¶”ى •ëگœë‹¤[1]. ى´ ى¤‘ ê´‘ë²”ىœ„يپ°Bى„¸يڈ¬ë¦¼ي”„ى¢…ى€ ى „ى²´ 비يک¸ى§€ي‚¨ 림ي”„ى¢…ىک ى•½ 40%를 ى°¨ى§€ي•کëٹ” ê°€ى¥ ي”ي•œ ى•„يک•ى´ë‹¤[2]. 1ى°¨ ي‘œى¤€ ى¹ک료ى¸ Rituximab 병ىڑ© ي•ى•”ي™”ي•™ىڑ”법(R-CHOP)ى„ ي†µي•کى—¬ 80-90%ىک ي™کىگê°€ 부분 ê´€ي•´ ى´ىƒپىک ë°کى‘ى„ يڑچë“ي•کى§€ë§Œ, ë‚ک머ى§€ 10-15%ىک ي™کىگëٹ” 1ى°¨ ى¹ک료ى—گ 불ى‘ى„±ى´ë©° 20-35% ى •ëڈ„ëٹ” ê´€ي•´ ي›„ ى¬ë°œى„ ê²½ي—کي•œë‹¤[3]. ى¬ë°œ ëکگëٹ” 불ى‘ى„± ي™کىگىک ى ˆë°ک ى •ëڈ„ê°€ 구ى œي•ى•”ي™”ي•™ىڑ”법ى—گ ë°کى‘ي•کë©°, ى´ ى¤‘ ى ٹê³ ى „ى‹ ىƒپيƒœê°€ ى–‘يک¸ي•œ ي™کىگëٹ” ê³ ىڑ©ëں‰ ي•ى•”ي™”ي•™ىڑ”법 ë°ڈ ىگê°€ى،°يکˆëھ¨ى„¸يڈ¬ى´ى‹ى„ ي†µي•کى—¬ ى™„ى¹ک를 기대ي• ىˆک ىˆë‹¤. ê·¸ëں¬ë‚ک ى´ë“¤ ى¤‘ ى•½ 30-40% ى •ëڈ„만 ى¥ê¸° ىƒى،´ي•ک게 ëگœë‹¤[4]. ىگê°€ى،°يکˆëھ¨ى„¸يڈ¬ى´ى‹ى„ ى‹œي–‰ي• ىˆک ى—†ê±°ë‚ک ىگê°€ى،°يکˆëھ¨ى„¸يڈ¬ى´ى‹ىˆ ى‹œي–‰ ي›„ ى¬ë°œ ëکگëٹ” ى§„ي–‰ي•œ ê²½ىڑ° ىکˆي›„ëٹ” 매ىڑ° 불ëں‰ي•œëچ°, ىµœê·¼ ى‹œي–‰ëگœ 다기관 ي›„ي–¥ ى—°êµ¬(SCHOLAR-1)ى—گ 따르면 구ى œي•ى•”ي™”ي•™ىڑ”법ى—گ 대ي•œ ë°کى‘ë¥ ى€ 26%, ى¤‘ê°„ ىƒى،´ 기간ى€ 6.3ê°œى›”ى´ى—ˆë‹¤[5]. ë°کى‘ى„ ë³´ى¸ ي™کىگ ى¤‘ ى¼ë¶€ى—گى„œ ëڈ™ى¢…ى،°يکˆëھ¨ى„¸يڈ¬ى´ى‹ ى¹ک료를 ê³ ë ¤ي• ىˆک ىˆىœ¼ë‚ک ê³µى—¬ىگ ى—¬ë¶€, ى „ى‹ ىƒپيƒœ, ى´ى‹يژ¸ëŒ€ىˆ™ى£¼ë°کى‘ ê´€ë ¨ ى´ي™کىœ¨ ë°ڈ ى¹ک료 ê´€ë ¨ ى‚¬ë§ë¥ 등ى„ ى¢…ي•©ى پىœ¼ë،œ ê³ ë ¤ي•کى—¬ى•¼ ي•œë‹¤.
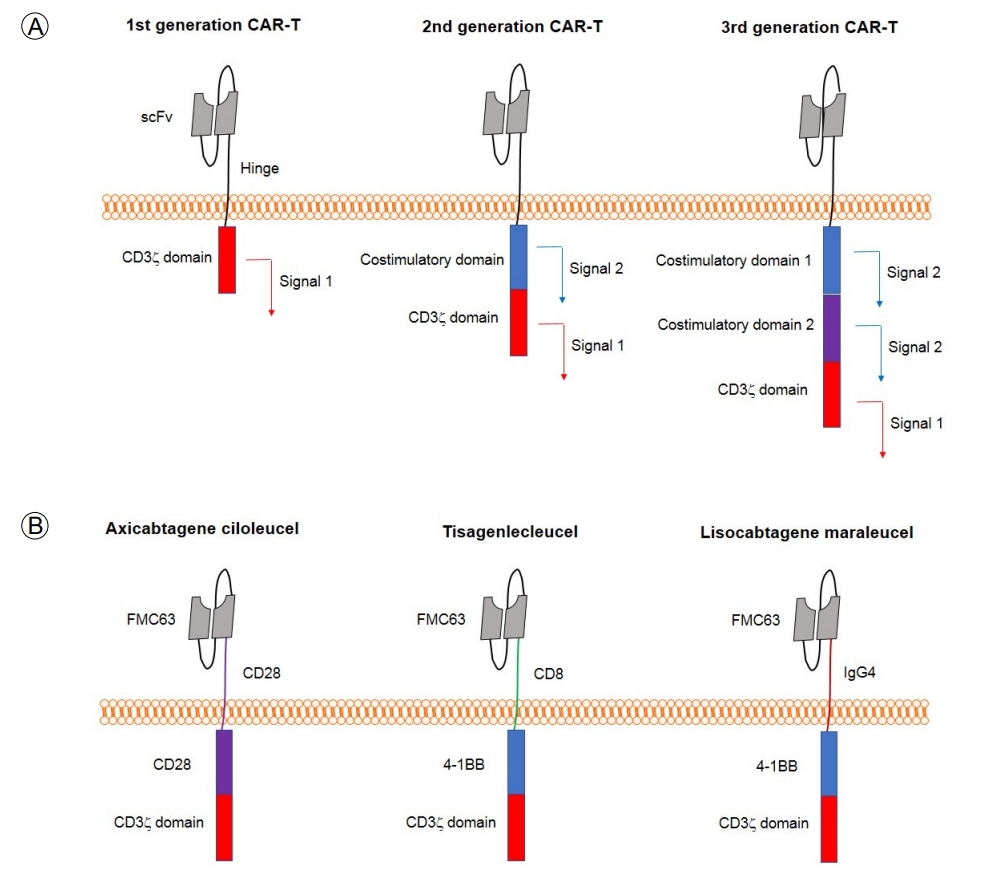
ي‚¤ë©”ë¦ي•ى›گىˆکىڑ©ى²´Tى„¸يڈ¬(chimeric antigen receptor T-cells, CAR-T)ëٹ” ىœ ى „ê³µي•™ى„ ى´ىڑ©ي•œ ى¼ى¢…ىک ى°¨ىڑ©ى„¸يڈ¬ ë©´ى— ى¹ک료(adoptive cellular immunotherapy)법ى´ë‹¤. ي‚¤ë©”ë¦ي•ى›گىˆکىڑ©ى²´ëٹ” 1) ي•ى›گى„ ى¸ى§€ي•کëٹ” single chain variable fragment (scFv), 2) ى—°ê²° 부ىœ„(hinge), 3) 막ىکپى—(transmembrane domain), 4) ى´ى°¨ى‹ يک¸ى „달 부ىœ„(costimulatory domain), 5) Tى„¸يڈ¬ ىˆکىڑ©ى²´ىک CD3 zeta ى‚¬ىٹ¬ë،œ 구ى„±ëگœë‹¤. ى¼ë°کى پىœ¼ë،œ ë ˆيٹ¸ë،œë°”ى´ëں¬ىٹ¤ ëکگëٹ” ë Œي‹°ë°”ى´ëں¬ىٹ¤ë¥¼ ى´ىڑ©ي•کى—¬ ي™کىگ Tى„¸يڈ¬ى—گ يک•ى§ˆى„ ëڈ„ى…ي•œ ë’¤(Fig. 1) ë°°ى–‘ي•کى—¬ ي™کىگى—گ게 يˆ¬ى—¬ي•œë‹¤. CAR-Tىک scFv 부ىœ„ى™€ ي‘œى پ ي•ى›گى´ ê²°ي•©ي•ک게 ëگکë©´ ى„¸يڈ¬ë‚´ CD3 zeta ى‚¬ىٹ¬(1ى°¨ ى‹ يک¸) ë°ڈ 2ى°¨ ى‹ يک¸ى „달 부ىœ„ê°€ ي™œى„±ي™”ëگکى–´ Tى„¸يڈ¬ ىگê·¹, ي™œى„±ي™”, ى¦ى‹ى„ ىœ ëڈ„ي•¨ىœ¼ë،œىچ¨ ي‘œى پ ى„¸يڈ¬ë¥¼ ى‚¬ë©¸ى‹œي‚¨ë‹¤. CAR-T ى¹ک료ëٹ” 기ى،´ Tى„¸يڈ¬ ىˆکىڑ©ى²´ى™€ 달리 ي‚¤ë©”ë¦ىˆکىڑ©ى²´ىک ë©´ى—글ë،œë¶ˆë¦°ىک ي•ى›گى¸ى§€ 부ىœ„를 ي†µي•کى—¬ ي‘œى پ ي•ى›گى„ ى¸ى§€ي•ک므ë،œ human leukocyte antigen (HLA) ى œي•œى„ ë°›ى§€ ى•ٹ게 ëگœë‹¤.
Bى„¸يڈ¬ى—گى„œ ë°œيک„ëگکëٹ” CD19를 ي‘œى پىœ¼ë،œ ي•کëٹ” ë‘گ ê°€ى§€ CAR-T ى¹ک료ى œ(axicabtagene ciloleucel ë°ڈ tisagenlecleucel)ê°€ 2017ë…„ ë¯¸êµ ى‹ي’ˆىکى•½êµ(Food and Drug Administration, FDA)ى—گى„œ ي—ˆê°€ë°›ى•ک다. CAR-T ى¹ک료ëٹ” 1989ë…„ ى´ىٹ¤ë¼ى—ک Eshahar ë°•ى‚¬ê°€ ىµœى´ˆë،œ ê³ ى•ˆي•کى—¬ ى œى•ˆي•کىک€ىœ¼ë©° 당ى‹œ T-bodyë،œ ëھ…ëھ…ي•کىک€ë‹¤[6]. 다만 당ى‹œى—گëٹ” يک„ى¬ى™€ ê°™ى´ 단ى¼ى‚¬ىٹ¬êµ¬ى،°ê°€ ى•„ë‹Œ ë©´ى—글ë،œë¶ˆë¦° ى¤‘ى‡„(VH) ë°ڈ ê²½ى‡„(VL)ىک ي•ى›گê²°ي•© 부ىœ„를 ê°پê°پ Tى„¸يڈ¬ ىˆکىڑ©ى²´ىک alpha ى‚¬ىٹ¬(Cخ±) ë°ڈ beta ى‚¬ىٹ¬(Cخ²)ىک 불변 부ىœ„(constant domain)ى™€ ê²°ي•©ي•œ يک•يƒœë،œ ê³ ى•ˆي•کىک€ىœ¼ë©° ë”°ë¼ى„œ 네 ê°€ى§€ ë²،ي„°(2 أ— 2)를 ى œى‘ي•کى—¬ VHCخ± ë°ڈ VLCخ² ëکگëٹ” VHCخ² ë°ڈ VLCخ± ى،°ي•©ىœ¼ë،œ ë‘گ ê°œىک ë²،ي„°ë¥¼ ëڈ™ى‹œى—گ يک•ى§ˆى „ي™کي•کى—¬ ë°œيک„ى‹œى¼°ë‹¤. ى´ي›„ VHى™€ VLى„ ë§پى»¤ë،œ ى—°ê²°ي•کى—¬ يک„ى¬ى™€ ê°™ى€ 단ى¼ى‚¬ىٹ¬ ي‚¤ë©”ë¦ىˆکىڑ©ى²´ê°€ 개발ëگکى–´ 구ى،°ê°€ 단ىˆœي™”ëگکê³ يڑ¨ىœ¨ى„ ى¦ëŒ€ي• ىˆک ىˆê²Œ ëگکى—ˆë‹¤[7]. ëکگي•œ Tى„¸يڈ¬ë¥¼ ىگê·¹ي•کëٹ”ëچ° ىˆى–´ Tى„¸يڈ¬ ىˆکىڑ©ى²´ë¥¼ ي†µي•œ 1ى°¨ ىگê·¹ë؟گ만ى´ ى•„ë‹ˆë¼ 2ى°¨ ى‹ يک¸(co-stimulation) ى—ى‹œ ى¤‘ىڑ”ي•¨ى´ ë°يک€ى،Œë‹¤. CD28 ëکگëٹ” 4-1BBى™€ ê°™ى€ 2ى°¨ ى‹ يک¸ 부ىœ„를 CAR-Tى—گ ëڈ„ى…ي•کë ¤ëٹ” ى‹œëڈ„ê°€ ى„±ê³µي•کë©´ى„œ يک„ى¬ ى‚¬ىڑ©ëگکëٹ” CAR-Tىک يک•يƒœë¥¼ ê°–ى¶”게 ëگکى—ˆë‹¤[8-10]. 2ى°¨ ى‹ يک¸ 부ىœ„ê°€ يڈ¬ي•¨ëگکى§€ ى•ٹى€ CAR-T를 1ى„¸ëŒ€, ي•کë‚کىک 2ى°¨ ى‹ يک¸ 부ىœ„ê°€ يڈ¬ي•¨ëگœ CAR-T를 2ى„¸ëŒ€, ë‘گ ê°€ى§€ 2ى°¨ ى‹ يک¸ 부ىœ„를 يڈ¬ي•¨ي•کëٹ” CAR-T를 3ى„¸ëŒ€ë،œ 분ë¥کي•کê³ ىˆë‹¤(Fig. 1). CAIX, folate receptor ëکگëٹ” Her2/neu를 ي‘œى پىœ¼ë،œ ي•کëٹ” CAR-T ى¹ک료ى œى—گ 대ي•œ ى„ىƒپى—°êµ¬ê°€ ى‹ ى¥ى•”, ë‚œى†Œى•”, 대ى¥ى•” 등ى„ 대ىƒپىœ¼ë،œ 먼ى € ى‹œي–‰ëگکى—ˆىœ¼ë‚ک يڑ¨ê³¼ê°€ 미미ي•کê±°ë‚ک on-target ىگê°€ ëڈ…ى„±ى´ 문ى œê°€ ëگکى—ˆë‹¤[11]. ë°کë©´ CD19ëٹ” Bى„¸يڈ¬ى—گ يٹ¹ى´ى پىœ¼ë،œ ي‘œيک„ëگکë©° 다ى–‘ي•œ Bى„¸يڈ¬ ى•…ى„± ى§ˆي™کى—گ ë°œيک„ëگکى–´ CAR-T ى¹ک료ى œê°€ ى پê·¹ى پىœ¼ë،œ 개발ëگکى—ˆë‹¤. 2010ë…„ëڈ„ى—گ ë¯¸êµ National Cancer Institute (NCI)ىک Dr. Kochenderfer 그룹ى—گى„œ axicabtagene ciloleucelىک ëھ¨ى²´ê°€ ëگکëٹ” CD28ى„ 2ى°¨ ى‹ يک¸ى „달 부ىœ„ë،œ ي•کëٹ” CD19 CAR-T를 ى†Œيڈ¬ë¦¼ي”„ى¢… ي™کىگى—گ게 يˆ¬ى—¬ي•کى—¬ ê´€ي•´ë¥¼ ى„±ê³µى پىœ¼ë،œ ىœ ëڈ„ي•œ ى‚¬ë،€ë¥¼ ىµœى´ˆë،œ ë³´ê³ ي•کىک€ë‹¤[12]. ى´ي›„ 2011ë…„ يژœى‹¤ë² 니ى•„대ي•™ 그룹ى—گى„œ tisagenlecleucelىک ëھ¨ى²´ê°€ ëگکëٹ” 4-1BB를 2ى°¨ ى‹ يک¸ ى „달 부ىœ„ë،œ ê°–ëٹ” CD19 CAR-T를 개발ي•کى—¬ ى¹ک료 불ى‘ى„± 만ى„± 림ي”„구ى„± ë°±يکˆë³‘ ي™کىگ를 ى„±ê³µى پىœ¼ë،œ ى¹ک료ي•œ ى‚¬ë،€ë¥¼ ë³´ê³ ي•کىک€ë‹¤[13]. ى´ي›„ CD19 ى–‘ى„±ى¸ 급ى„± 림ي”„구백يکˆë³‘, 만ى„± 림ي”„구 ë°±يکˆë³‘, ëکگëٹ” Bى„¸يڈ¬ 비يک¸ى§€ي‚¨ 림ي”„ى¢…ى„ 대ىƒپ ى§ˆي™کىœ¼ë،œ ي•œ 다ىˆکىک ى—°êµ¬ىگ ى£¼ëڈ„ ى„ىƒپى—°êµ¬ê°€ ى„±ê³µى پىœ¼ë،œ ى‹œي–‰ëگکى—ˆë‹¤[14-16].
ىڑ°ى„ ي™کىگىک ë§گى´ˆيکˆى•،단ي•µêµ¬(peripheral blood mononuclear cells, PBMC)를 ë°±يکˆêµ¬ى„±ë¶„ى±„ى§‘ىˆ ى„ ى‹œي–‰ي•کى—¬ 분리ي•œë‹¤. PBMCëٹ” 냉ى¥ ëکگëٹ” 냉ëڈ™ëگکى–´ ىکى•½ي’ˆى œى،°ê´€ë¦¬ê¸°ى¤€(Good Manufacturing Practice [GMP])ى„ 만ى،±ي•کëٹ” CAR-T ىƒى‚°ى‹œى„¤ë،œ ى´ى†،ëگœë‹¤. PBMCë،œë¶€ي„° Tى„¸يڈ¬ë¥¼ 분리ي•کê³ , يک•ى§ˆëڈ„ى… يڑ¨ىœ¨ى„ ى¦ëŒ€ى‹œي‚¤ê¸° ىœ„ي•کى—¬ 먼ى € Tى„¸يڈ¬ë¥¼ ي™œى„±ي™”ي•œ ë’¤ ي‚¤ë©”ë¦ي•ى›گىˆکىڑ©ى²´(CAR) ë²،ي„°ë¥¼ يک•ى§ˆëڈ„ى…ي•œë‹¤. ى´ë¥¼ ىœ„ي•کى—¬ ى¼ë°کى پىœ¼ë،œ ë ˆيٹ¸ë،œë°”ى´ëں¬ىٹ¤ ëکگëٹ” ë Œي‹°ë°”ى´ëں¬ىٹ¤ ë²،ي„°ê°€ ى‚¬ىڑ©ëگکى§€ë§Œ ى „ىœ„ىœ ى „단ىœ„(transposon)를 ى´ىڑ©ي•کëٹ” 방법ëڈ„ 개발 ى¤‘ى´ë‹¤. ë ˆيٹ¸ë،œë°”ى´ëں¬ىٹ¤ ëکگëٹ” ë Œي‹°ë°”ى´ëں¬ىٹ¤ë¥¼ ى´ىڑ©ي• ê²½ىڑ° يک•ى§ˆ ى „ي™کëگœ Tى„¸يڈ¬ ë‚´ ىœ ى „ى²´ى—گ CAR ىœ ى „ىگê°€ ى‚½ى…ëگکى–´ CAR 단백ى§ˆى„ ë°œيک„ي•ک게 ëگœë‹¤. ى´ي›„ CAR-T를 ë°°ى–‘ي•کê³ ى •ëڈ„관리 ê³¼ى •ى„ ê±°ى³گ 냉ëڈ™ي•کى—¬ ى¹ک료기관ىœ¼ë،œ ë°°ى†،ëگœë‹¤. ىƒى‚° 기간ى€ ى•½ 10-21ى¼ ى •ëڈ„ê°€ ى†Œىڑ”ëگœë‹¤. 대개ىک ê²½ىڑ° ي™کىگëٹ” CAR-T 기ëٹ¥ ë°ڈ ى‚¬ى´ي† ى¹´ى¸ 분비를 ى–µى œي•کëٹ” ى،°ى ˆ Tى„¸يڈ¬(regulatory T-cells) 등ى„ ى œê±°ي•ک기 ىœ„ي•œ ëھ©ى پىœ¼ë،œ fludarabine ë°ڈ cyclophosphamide 근간ىک ي•ى•”ى „ى²کى¹ک(lymphodepleting chemotherapy)를 먼ى € ى‹œي–‰ë°›ëٹ”다. CAR-T يˆ¬ى—¬ëٹ” ى¢…ë¥کى—گ ë”°ë¼ ى…ى›گ ëکگëٹ” ى™¸ëکى—گى„œ ى´ë£¨ى–´ى§„다.
يک„ى¬ tisagenlecleucel (CTL019)ى€ ىµœى†Œ ë‘گ ê°€ى§€ ى´ىƒپىک ى´ى „ ى¹ک료ى—گ ى‹¤يŒ¨ي•œ ى†Œى•„ 급ى„± 림ي”„구백يکˆë³‘ ë°ڈ ى¬ë°œى„± ëکگëٹ” 불ى‘ى„± ê´‘ë²”ىœ„يپ°Bى„¸يڈ¬ë¦¼ي”„ى¢…ى—گ 대ي•کى—¬, axicabtagene ciloleucel (KTE-C19)ى€ ى¬ë°œى„± ëکگëٹ” 불ى‘ى„± ê´‘ë²”ىœ„يپ°Bى„¸يڈ¬ë¦¼ي”„ى¢…ى—گ 대ي•کى—¬ FDAى—گى„œ ي—ˆê°€ëگکى—ˆë‹¤. Lisocabtagene maraleucelى€ يک„ى¬ ىٹ¹ى¸ى„ ىœ„ي•œ ى—°êµ¬ê°€ ى§„ي–‰ ى¤‘ى´ë‹¤. ê°پ ى¹ک료ى œى—گ 대ي•œ ي—ˆê°€ ى„ىƒپى—°êµ¬ëٹ” 단ى¼êµ° ى—°êµ¬ë،œ ى§„ي–‰ëگکى—ˆىœ¼ë©° ê·¸ 결과를 ى•„ëکى—گ ىڑ”ى•½ي•کê³ ىگ ي•œë‹¤. 다만 ê°پ ى—°êµ¬ë³„ ى¹ک료군 يٹ¹ى„±ى—گ ى°¨ى´ê°€ ىˆى–´ ى—°êµ¬ 결과를 비êµگ 분ى„ي•کëٹ” ëچ°ى—گëٹ” ى£¼ىکê°€ ي•„ىڑ”ي•ک다(Table 1, Fig. 1B).
Bى„¸يڈ¬ë¦¼ي”„ى¢… ى¹ک료ى œë،œى„œ ىµœى´ˆë،œ ë¯¸êµ FDA ىٹ¹ى¸ى„ ë°›ى€ CAR-T ى¹ک료ى œى¸ axicabtagene ciloleucelى€ ë¯¸êµ NCIى—گى„œ 개발ي•œ CAR-T를 근간ىœ¼ë،œ 개발ëگکى—ˆê³ CD28ى„ 2ى°¨ ى‹ يک¸ 부ىœ„ë،œ ى‚¬ىڑ©ي•œë‹¤. Pivotal trialى¸ ZUMA-1ى€ 미êµê³¼ ى´ىٹ¤ë¼ى—کىک 22ê°œ ى—°êµ¬ê¸°ê´€ى´ ى°¸ى—¬ي•œ 단ى¼êµ°, 다기관 2ىƒپ ى„ىƒپى—°êµ¬ى´ë‹¤[17,18]. ى¬ë°œى„± ê´‘ë²”ىœ„يپ°Bى„¸يڈ¬ë¦¼ي”„ى¢…, ى¼ى°¨ى¢…격ëڈ™Bى„¸يڈ¬ë¦¼ي”„ى¢…, ى „ي™کëگœ ى†Œيڈ¬ë¦¼ي”„ى¢… ي™کىگ를 대ىƒپىœ¼ë،œ ى´ 119ëھ…ى´ 등ë،ëگکى—ˆê³ ى´ ى¤‘ 108ëھ…ى´ axicabtagene ciloleucelى„ يˆ¬ى—¬ë°›ى•ک다. ë°کى‘ يڈ‰ê°€ê°€ ى´ë£¨ى–´ى§„ 101ëھ…ى—گى„œ ى „ى²´ ë°کى‘ë¥ 83%, ى™„ى „ ë°کى‘ë¥ 58%를 ë³´ىک€ë‹¤. ى¤‘ى•™ ى¶”ى پ ê´€ى°° 기간 27.1ê°œى›” ى¤‘, ى¤‘ى•™ ë°کى‘ ىœ ى§€ 기간 11.1ê°œى›”, ى¤‘ى•™ 무ى§„ي–‰ ىƒى،´ 기간ى€ 5.9ê°œى›”ى´ى—ˆىœ¼ë©° ى¤‘ى•™ ىƒى،´ 기간ى€ ëڈ„달ëگکى§€ ى•ٹى•ک다.
Tisagenlecleucelى€ يژœى‹¤ë² 니ى•„대ي•™ى—گى„œ 개발ëگœ CAR-T를 ëھ¨ى²´ë،œ 개발ëگکى—ˆê³ , axicabtagene ciloleucelê³¼ 달리 4-1BB를 ى´ى°¨ى‹ يک¸ 부ىœ„ë،œ ى‚¬ىڑ©ي•œë‹¤. Pivotal trialى¸ JULIET ى—°êµ¬ëٹ” 미êµ, يک¸ى£¼, ى؛گë‚ک다, ىœ ëں½, ى¼ë³¸ 등 10ê°œêµ 27ê°œ 기관ى´ ى°¸ى—¬ي•œ êµى œى„ىƒپى—°êµ¬ë،œ ىک미가 ىˆë‹¤[19,20]. ى´ 165ëھ…ى´ 등ë،ëگکى—ˆىœ¼ë©° ى´ ى¤‘ 111ëھ…ى—گ게 tisagenlecleucelى´ يˆ¬ى—¬ëگکى—ˆê³ ى´ ى¤‘ 93ëھ…ى—گى„œ ë°کى‘ يڈ‰ê°€ê°€ ى´ë£¨ى–´ى،Œë‹¤. 등ë، ى‹œى گ부ي„° ى²« يˆ¬ى•½ى¼ê¹Œى§€ىک ى¤‘ى•™ 기간ى€ 54ى¼ى´ى—ˆë‹¤. ZUMA-1ê³¼ 달리 ى¼ى°¨ى¢…격ëڈ™Bى„¸يڈ¬ë¦¼ي”„ى¢…ى€ 등ë،ى—گى„œ ى œى™¸ëگکى—ˆë‹¤. ى „ى²´ ë°کى‘ë¥ ى€ 52%, ى™„ى „ ë°کى‘ë¥ ى€ 40%ىک€ë‹¤. ى¤‘ى•™ ë°کى‘ ىœ ى§€ 기간ى€ ëڈ„달ëگکى§€ ى•ٹى•کىœ¼ë‚ک 12ê°œى›” ë°کى‘ ىœ ى§€ىœ¨ى´ 65%ىک€ىœ¼ë©° ى™„ى „ ë°کى‘ى„ ى–»ى€ ي™کىگëٹ” ى „ى²´ىک 79%ىک€ë‹¤. ى´ ى¤‘ 3ê°œى›”ê°„ ë°کى‘ى´ ىœ ى§€ëگکëٹ” ê²½ىڑ° 1ë…„ 무ى§„ي–‰ ىƒى،´ىœ¨ى´ 83%ىک€ë‹¤. Tisagenleucleucelى„ يˆ¬ى—¬ë°›ى€ ي™کىگىک ى¤‘ى•™ ىƒى،´ 기간ى€ 12ê°œى›”ى´ى—ˆىœ¼ë©° ى—°êµ¬ى—گ 등ë،ëگœ ى „ى²´ 165ëھ…ى„ 대ىƒپىœ¼ë،œ 분ى„ي•کë©´ 8.3ê°œى›”ى´ى—ˆë‹¤.
Lisocabtagene maraleucelى€ Fred-Hitchinson ى•”ى„¼ي„°ى—گى„œ 개발ي•œ CAR-T를 ëھ¨ى²´ë،œ 개발ëگکى—ˆê³ , 4-1BB를 2ى°¨ ى‹ يک¸ 부ىœ„ë،œ ى‚¬ىڑ©ي•œë‹¤. 다른 CAR-Tى™€ 달리 CD4 Tى„¸يڈ¬ى™€ CD8 Tى„¸يڈ¬ىک 비ىœ¨ى„ 1:1ë،œ ë§ى¶ک ى گى´ يٹ¹ى§•ى´ë‹¤. TRANSCEND-NHL-001 ى—°êµ¬ى—گ ى „ى²´ 134ëھ…ىک ي™کىگê°€ 등ë،ëگکى—ˆê³ , ى´ ى¤‘ ê´‘ë²”ىœ„يپ°Bى„¸يڈ¬ë¦¼ي”„ى¢…, ê³ ë“±ê¸‰Bى„¸يڈ¬ë¦¼ي”„ى¢…, ى „ي™کëگœ ى†Œيڈ¬ë¦¼ي”„ى¢…만ى„ يڈ¬ي•¨ي•کëٹ” ي•µى‹¬ى½”يک¸يٹ¸ 73ëھ…ى„ 대ىƒپىœ¼ë،œ 분ى„ي•کىک€ى„ ë•Œ ى „ى²´ ë°کى‘ë¥ 80%, ى™„ى „ ë°کى‘ë¥ 59%ىک€ë‹¤. 6ê°œى›” ى¶”ى پ ê´€ى°° 기간 ى¤‘ 41%ىک ي™کىگê°€ 무ى§„ي–‰ ىƒى،´ي•کىک€ë‹¤[21].
ى„¸ ê°€ى§€ CAR-T ëھ¨ë‘گ ى†Œى§‘단분ى„ى‹œ ىکˆي›„ê°€ 불ëں‰ي•œ 것ىœ¼ë،œ ى•Œë ¤ى§„ double hit lymphoma ë°ڈ double expressor lymphoma 등ى—گى„œëڈ„ ى¢‹ى€ ى¹ک료 يڑ¨ê³¼ë¥¼ ë³´ىک€ë‹¤. ى´ë¥¼ ى¢…ي•©ي•کë©´ يڑ¨ê³¼ى پى¸ ى¹ک료 ىکµى…کى´ ى—†ëٹ” 불ëں‰ي•œ ىکˆي›„ىک ي™کىگêµ°ى—گى„œ CD19 CAR-Tëٹ” ى•½ 50-80% ى •ëڈ„ىک ë°کى‘ë¥ ى„ ë³´ى´ë©° ى¼ë¶€ ي™کىگى—گى„œ ى™„ى¹ک를 기대ي• ىˆک ىˆى„ 것ىœ¼ë،œ ë³´ى¸ë‹¤.
ê·¸ëں¬ë‚ک CAR-T ى¹ک료ëٹ” ىœ ى „ىگى،°ى‘ى„ ي†µي•کى—¬ Tى„¸يڈ¬ ي™œى„±ى„ ىœ ëڈ„ي•کëٹ” ى¹ک료ë،œ ê³ ىœ ي•œ ëڈ…ى„±ى„ ëڈ™ë°کي• ىˆک ىˆë‹¤. ى´ ى¤‘ ى‚¬ى´ي† ى¹´ى¸ë¶„비ى¦ي›„êµ°(cytokine release syndrome, CRS)ê³¼ ى‹ ê²½ëڈ…ى„±ى´ ى„ىƒپى پىœ¼ë،œ 매ىڑ° ى¤‘ىڑ”ي•ک다. CRSëٹ” CAR-Tىک ي™œى„±ي™” ë°ڈ ى¦ى‹ê³¼ ي•¨ê»ک ى—¼ى¦ى„± ى‚¬ى´ي† ى¹´ى¸ىک 분비가 ى¦ê°€ي•کë©´ى„œ ë°œى—´, ي”¼ë،œê°گ, ى‡¼يپ¬ ë°ڈ ëھ¨ى„¸يکˆê´€ ىœ ى¶œى¦ي›„êµ°(capillary leak syndrome), يک¸ي،곤ë€, ë§گى´ˆê¸°ê´€ى†گىƒپ 등ى´ ى´ˆëکëگکëٹ” 것ىœ¼ë،œ ى پى ˆي•ک게 ى،°ى¹کëگکى§€ ى•ٹى„ ê²½ىڑ° ى¹کëھ…ى پى¼ ىˆک ىˆëٹ” ى¤‘대ي•œ 부ى‘ىڑ©ى´ë‹¤. ZUMA-1 ى—°êµ¬ى—گى„œëٹ” ى „ى²´ ي™کىگ ى¤‘ 93%ى—گى„œ CRS를 ê²½ي—کي•کىک€ëٹ”ëچ°, 13%ëٹ” 3ëڈ„ ى´ىƒپىœ¼ë،œ ë³´ê³ ëگکى—ˆê³ , 2ëھ…ىک ي™کىگëٹ” ê°پê°پ CRS ê´€ë ¨ ى پيکˆêµ¬يڈ¬ى‹ى„± 림ي”„ى،°ى§پ구ى¦ى‹ى¦(hemophagocytic lymphohistiocytosis) ë°ڈ ى‹¬ى •ى§€ë،œ ى‚¬ë§ي•کىک€ë‹¤[17,18]. ê·¸ëں¬ë‚ک 대부분ىک ê²½ىڑ° IL-6 ىˆکىڑ©ى²´ ى–µى œى œى¸ tocilizumabê³¼ ىٹ¤ي…Œë،œى´ë“œë¥¼ ى´ىڑ©ي•کى—¬ ى پى ˆي•œ ى¹ک료가 ى´ë£¨ى–´ى،Œë‹¤. Axicabtagene ciloleucelىک ê²½ىڑ° يˆ¬ى—¬ ى•½ 2ى¼ ي›„ى—گ CRSê°€ ë°œىƒي•کى—¬ 8ى¼ ى •ëڈ„ ى§€ى†چëگکى—ˆë‹¤. ë°کë©´ tisagenlecleucel ë°ڈ lisocabtagene maraleucelىک ê²½ىڑ° ى•½ 3ى¼, 5ى¼ى§¸ى—گ ë°œىƒي•کىک€ë‹¤. Tisagenlecleucelىک ê²½ىڑ° 22-23%ى—گى„œ 3ëڈ„ ى´ىƒپىک CRSê°€ ë°œىƒي•کىک€ëٹ”ëچ°, 부ى‘ىڑ© يڈ‰ê°€ى—گ ىˆى–´ يژœى‹¤ë² 니ى•„대ي•™ ىگى²´ 기ى¤€ى„ ى‚¬ىڑ©ي•کىک€ê¸° 때문ى—گ 단ىˆœë¹„êµگى—گëٹ” ي•œê³„ê°€ ىˆë‹¤. ê·¸ëں¬ë‚ک tocilizumabىک ى‚¬ىڑ©ى€ 15%ë،œ ZUMA-1ىک 43% ى‚¬ىڑ©ى—گ 비ي•کى—¬ ى پى—ˆë‹¤. Lisocabtagene maraleucelىک ê²½ىڑ° 3ëڈ„ ى´ىƒپىک CRS ë°œىƒى´ 3% ى •ëڈ„ë°–ى—گ ëگکى§€ ى•ٹى•کê³ tocilizumab ى‚¬ىڑ©ىکˆëڈ„ 7%ى—گ ê·¸ى³گ ىƒپ대ى پىœ¼ë،œ CRSىک ë°œىƒë¥ ى´ ë‚®ى€ 것ىœ¼ë،œ ë³´ى¸ë‹¤. 등ë، ي™کىگêµ°ى—گ ى°¨ى´ê°€ ىˆëٹ” ى—°êµ¬ê°„ىک 비êµگëٹ” ي•´ى„ى—گ ى£¼ىک를 ىڑ”ي•کë‚ک, CD28 2ى°¨ ى‹ يک¸ 부ىœ„를 يڈ¬ي•¨ي•œ CAR-Tىک ê²½ىڑ° ى´ˆê¸° ى¦ى‹ى´ ëچ”ىڑ± ي™œë°œي•کى—¬ CRSىک ë°œىƒë¥ ى´ ëچ” 높ى€ 것ىœ¼ë،œ ë³´ى¸ë‹¤.
ى‹ ê²½ëڈ…ى„±ىک ê²½ىڑ° 병يƒœىƒë¦¬ê°€ ى•„ى§پ ى •ي™•يˆ ى•Œë ¤ى ¸ ىˆى§€ ى•ٹ다. 다만 يکˆى•،뇌ى¥ë²½ى„ ي†µê³¼ي•œ Tى„¸يڈ¬, 단ي•µêµ¬ 등ى—گ ىکي•کى—¬ 분비ëگœ ى—¼ى¦ى„± ى‚¬ى´ي† ى¹´ى¸ى´ ê´€ى—¬ي•کëٹ” 것ىœ¼ë،œ ى¶”ى •ëگکê³ ىˆë‹¤. ي™کىگëٹ” يک¼ëڈˆ, 떨림 등 가벼ىڑ´ ى¦ىƒپ부ي„° ى‹¤ى–´ى¦, ê°„ى§ˆ ë°œى‘, ىکى‹ى†Œى‹¤ ë°ڈ يک¼ىˆک 등 다ى–‘ي•œ ى¦ىƒپى„ ë³´ى¼ ىˆک ىˆê³ CRSى™€ 달리 tocilizumabىک يڑ¨ê³¼ëٹ” ى œي•œى پى´ë©° ىٹ¤ي…Œë،œى´ë“œê°€ ى£¼ëگœ ى¹ک료 ىڑ”법ى´ë‹¤. CRSëٹ” 비êµگى پ ى¹ک료 ى´ˆê¸°ى—گ ë°œىƒي•کëٹ” ë°کë©´, ى‹ ê²½ëڈ…ى„±ى€ CAR-T ى¹ک료 ي›„ ىƒپ당 기간ى´ ى§€ë‚œ ي›„ى—گëڈ„ ë°œىƒى´ ê°€ëٹ¥ي•œ 것ىœ¼ë،œ ى•Œë ¤ى ¸ ىˆë‹¤. ZUMA-1 ى—°êµ¬ى—گى„œëٹ” 3ëڈ„ ى´ىƒپىک ى‹ ê²½ëڈ…ى„±ى´ 28%ى—گى„œ ë°œىƒي•کىک€ê³ ى•½ 5ى¼ ي›„ى—گ ë°œىƒي•کى—¬ 17ى¼ê°„ ى§€ى†چëگکى—ˆë‹¤. JULIET ى—°êµ¬ى—گى„œëٹ” 3ëڈ„ ى´ىƒپىک ى‹ ê²½ëڈ…ى„±ى´ 12%, TRANSCEND-NHL-001 ى—°êµ¬ 대ىƒپىگ ى¤‘ ê´‘ë²”ىœ„يپ°Bى„¸يڈ¬ë¦¼ي”„ى¢… ë°ڈ ى „ي™کëگœ ى†Œيڈ¬ë¦¼ي”„ى¢…만ى„ 대ىƒپىœ¼ë،œ ي•œ ي•µى‹¬ى½”يک¸يٹ¸ى—گى„œ 15%ى—گى„œ ë°œىƒي•کىک€ë‹¤.
ى´ى™¸ى—گëڈ„ ى •ىƒپ Bى„¸يڈ¬ى—گëڈ„ CD19 ë°œيک„ى´ ىˆى–´ CAR-Tى—گ ىکي•کى—¬ ى œê±°ëگک므ë،œ Bى„¸يڈ¬ 무يک•ى„± 기간ى´ ë°œىƒي•œë‹¤. ë”°ë¼ى„œ ى„ىƒپى پىœ¼ë،œ ي•„ىڑ”ى‹œ ë©´ى—글ë،œë¶ˆë¦°ىک ë³´ى¶©ى´ ي•„ىڑ”ي• ىˆک ىˆë‹¤. ى•„ىڑ¸ëں¬ ى €يک¸ى¤‘구ى¦ ë°ڈ يکˆى†ŒيŒگê°گى†Œى¦ëڈ„ ىˆکê°œى›”까ى§€ ى§€ى†چëگ ىˆک ىˆى–´ ى¹ک료 ي›„ ë©´ë°€ي•œ ى¶”ى پ ê´€ى°°ى´ ي•„ىڑ”ي•ک다.
ZUMA-1 ى—°êµ¬ىک ê²½ىڑ° 111ëھ…ىک 등ë، ي™کىگ ى¤‘ 9%ى¸ 10ëھ…ىک ي™کىگê°€ CAR-T ى¹ک료를 ë°›ى§€ ëھ»ي•کىک€ë‹¤. ى´ ى¤‘ 1%ëٹ” CAR-T ىƒى‚° ى‹¤يŒ¨, 6%ëٹ” ىœ ي•´ى‚¬ë،€(adverse events) 때문ى´ى—ˆë‹¤. JULIET ى—°êµ¬ىک ê²½ىڑ° 등ë،ëگœ ي™کىگ ى¤‘ 31%ىک ي™کىگê°€ CAR-T ى¹ک료를 ë°›ى§€ ëھ»ي•کىک€ê³ 7%ëٹ” ىƒى‚° ى‹¤يŒ¨, 24%ëٹ” يˆ¬ى—¬ ى „ ى‚¬ë§ 16ëھ…ى„ يڈ¬ي•¨ي•œ ي™کىگ ىƒپيƒœى™€ ى—°ê´€ëگœ 문ى œىک€ë‹¤. TRASCNED-NHL-001 ى—°êµ¬ىک ê²½ىڑ°ى—گëڈ„ 15%ê°€ يˆ¬ى—¬ë°›ى§€ ëھ»ي•کىک€ëٹ”ëچ° 1%ىک ىƒى‚° ى‹¤يŒ¨, 10%ىک ىœ ي•´ى‚¬ë،€ 등ىک ى‚¬ىœ ىک€ë‹¤. Axicabtagene ciloleucelى€ ZUMA-1 ى—°êµ¬ى—گى„œ ë°±يکˆêµ¬ى„±ë¶„ى±„ى§‘ىˆ ى—گى„œ ىƒى‚°ê¹Œى§€ ى•½ 17ى¼ى´ ى†Œىڑ”ëگکى—ˆىœ¼ë©° tisagenlecleucelى€ JULIET ى—°êµ¬ى—گى„œ ىƒى‚° 기간ى´ ëھ…ى‹œëگکى§€ëٹ” ى•ٹى•کىœ¼ë‚ک ى—°êµ¬ 등ë،ى¼ë،œë¶€ي„° ى£¼ى…까ى§€ ى•½ 54ى¼(30-92ى¼)ى´ ى†Œىڑ”ëگکى—ˆë‹¤. ى´ëں° ى¸،ë©´ى„ ê³ ë ¤ي•کى—¬ JULIET ى—°êµ¬ ë°ڈ TRANSCEND-NHL-001 ى—°êµ¬ى—گى„œëٹ” CAR-T يˆ¬ى—¬ ى „ ê°€êµگ ى¹ک료를 ي—ˆىڑ©ي•کىک€ê³ JULIET ى—°êµ¬ىک ê²½ىڑ° 92%ى—گى„œ 다ى–‘ي•œ ê°€êµگ ى¹ک료가 ى‹œي–‰ëگکى—ˆë‹¤[19]. Axicabtagene ciloleucelىک ى„ىƒپى—°êµ¬ ى™¸ ى‹¤ى‚¬ىڑ©ىکˆë¥¼ 분ى„ي•œ ي›„ي–¥ ى—°êµ¬ى—گى„œëڈ„ 7%ىک ي™کىگê°€ ë°±يکˆêµ¬ى„±ë¶„ى±„ى§‘ىˆ ي›„ يˆ¬ى—¬ ى „ ى§ˆë³‘ ى§„ي–‰ ëکگëٹ” ê°گى—¼ى¦ 등ىœ¼ë،œ ى‚¬ë§ي•کىک€ë‹¤[22]. ى¦‰, ىƒى‚° ë°ڈ ى „ى²کى¹ک 기간 ى¤‘ ى پى§€ ى•ٹى€ ي™کىگê°€ ى‚¬ë§ي•کى—¬ CAR-T ى¹ک료ى—گ ى پى ˆي•œ ي™کىگêµ° ى„ ى • ë°ڈ ىƒى‚° 기간 ى¤‘ ي™کىگ ىƒپيƒœ ىœ ى§€ê°€ ى¤‘ىڑ”ي•œ ê³¼ى œê°€ ëگ 것ىœ¼ë،œ ë³´ى¸ë‹¤.
ëکگي•œ ى•ى„œ ى–¸ê¸‰ي•œ ë°”ى™€ ê°™ى´ CRS ë°ڈ ى‹ ê²½ëڈ…ى„±ى—گ 대ي•œ ى پى ˆي•œ 대ى²کê°€ 매ىڑ° ى¤‘ىڑ”ي•ک다. ىƒپ당ىˆکىک ي™کىگى—گى„œ ىٹ¹ى••ى œ ë°ڈ ى¸ê³µيک¸ي،기ىک ى‚¬ىڑ©ى´ ي•„ىڑ”ي•ک므ë،œ يکˆى•،ى¢…ى–‘ ىکى‚¬ë؟گ ى•„ë‹ˆë¼ ى¤‘ي™کىگى‹¤ê³¼ىک يک‘ë ¥, ى‹ ê²½ëڈ…ى„±ىک يڈ‰ê°€ ë°ڈ ى،°ى¹ک를 ىœ„ي•کى—¬ ى‹ 경과 ى „문ىکى™€ىک 긴밀ي•œ يک‘ë ¥ى´ ي•„ىڑ”ي•ک다. ى¦‰, CAR-T ى¹ک료를 ى‹œي–‰ي•کëٹ” ê²½ىڑ° 기민ي•کê³ ى پى ˆي•œ 대ى²ک를 ىœ„ي•کى—¬ 다ي•™ى œيŒ€ىک 구ى„±ى´ ي•„ىڑ”ي• 것ىœ¼ë،œ ë³´ى¸ë‹¤.
ى¹ک료ى—گ 대ي•œ ى ‘ê·¼ى„±ى„ ى œê³ ي•ک기 ىœ„ي•œ ى¹ک료ىک ê²½ى œى„± يڈ‰ê°€ëڈ„ ي•„ىڑ”ي•ک다. يک„ى¬ 미êµىک ى‚¬ë،€ë¥¼ ë³´ë©´ ê°پ ى¹ک료ى œ ىگى²´ىک ê³ ë¹„ىڑ©ى—گ ëچ”불ى–´ ى•½ë¬¼ يˆ¬ى—¬ ë°ڈ 부ى‘ىڑ© ë°œىƒى‹œ ي›„ى†چ ى،°ى¹کى—گ ي•„ىڑ”ي•œ ىک료비를 يڈ¬ي•¨ي•کë©´ ى²œë¬¸ي•™ى پ 비ىڑ©ى´ ى†Œىڑ”ëگکى–´ ىک료기관과 ىک료보ي—کى‚¬ ëھ¨ë‘گى—گ게 ى´ىٹˆê°€ ëگکê³ ىˆë‹¤.
ى•ىک ى—°êµ¬ë“¤ى—گى„œ ى•½ 30-40% ى •ëڈ„ىک ي™کىگê°€ ى¥ê¸°ى پ ى¹ک료 يڑ¨ê³¼ë¥¼ ë³´ى´ëٹ” 것ى€ 매ىڑ° ê³ ë¬´ى پى¸ ى„±ê³¼ى´ê¸°ëٹ” ي•کë‚ک, ى—¬ى „يˆ 60-70%ىک ي™کىگ들ى€ ë°کى‘ى´ ى—†ê±°ë‚ک ى¬ë°œى„ ê²½ي—کي•ک게 ëگœë‹¤. ى´ى—گ 대ي•œ ى›گى¸ىœ¼ë،œ CD19 ي•ى›گ ى†گى‹¤, PD-L1/PD-1 ى¶• 등 ë©´ى—미ى„¸ي™کê²½ ىڑ”ى¸, CAR-Tىک 림ي”„ى¢… ى¹¨يˆ¬(trafficking) 부ى¬ 등ى´ ê±°ë، ëگکê³ ىˆë‹¤[23]. ى´ë¥¼ 극복ي•ک기 ىœ„ي•کى—¬ PD-1 ى–µى œى œ ëکگëٹ” ibrutinib 등과 병ىڑ©ي•کëٹ” ى‹œëڈ„ ë°ڈ CD19 ى´ى™¸ىک ي‘œى پ ى¦‰, CD20, CD22, CD79Bى—گ 대ي•œ CAR-T 개발 등ى´ ى´ë£¨ى–´ى§€ê³ ىˆë‹¤[24-26].
CD19를 ي‘œى پىœ¼ë،œ ي•کëٹ” CAR-T ى¹ک료ëٹ” 2010ë…„ ىµœى´ˆ ى‚¬ë،€ë³´ê³ ى´ي›„ 다ىˆکىک 단ى¼ê¸°ê´€ 2ىƒپ ى„ىƒپى—°êµ¬ë¥¼ ê±°ى³گ 다기관 ي—ˆê°€ ى„ىƒپى—°êµ¬ë¥¼ ى‹œي–‰ي•کى—¬ 2017ë…„ 2ê°œىک ى¹ک료가 FDA ي—ˆê°€ë¥¼ ë°›ى•ک다. 미êµى—گى„œëٹ” ى„ىƒپى—°êµ¬ىک 단계를 ë²—ى–´ë‚ک ي‘œى¤€ ى¹ک료ىک ىکپى—ىœ¼ë،œ ىگ리ى،기 ى‹œى‘ي•کىک€ë‹¤. ىµœê·¼ ى‹¤ى‚¬ىڑ©ىکˆë¥¼ ى •ë¦¬ي•œ 다기관 ي›„ي–¥ ى—°êµ¬ىک 결과를 ë³´ë©´ ي—ˆê°€ ى„ىƒپى—°êµ¬ى™€ ىœ ى‚¬ي•œ ى¹ک료 결과를 ë³´ى´ê³ ىˆë‹¤. ىگê°€ى،°يکˆëھ¨ى„¸يڈ¬ى´ى‹ ي›„ ى¬ë°œ ëکگëٹ” ى§„ي–‰ي•œ ي™کىگى™€ ىگê°€ى،°يکˆëھ¨ى„¸يڈ¬ى´ى‹ىک 대ىƒپى´ ëگکى§€ ى•ٹëٹ” ي™کىگىک 3ى°¨ ى´ىƒپىک ى¹ک료 ىƒپي™©, ى¦‰ 기ى،´ ىڑ”법ىœ¼ë،œëٹ” ى¹ک료가 매ىڑ° ى–´ë ¤ىڑ´ ي™کىگêµ°ى—گى„œ يک„ى¬ë،œى„œëٹ” ىœ ى¼ي•ک게 ى™„ى¹ک를 기대ي•´ ë³¼ ىˆک ىˆëٹ” ى¹ک료법ى´ë‹¤. يک„ى¬ ىœ„ى—گ ى–¸ê¸‰ëگœ 3ê°œ ى¹ک료ى œى—گ 대ي•کى—¬ CAR-Tى™€ ي‘œى¤€ 2ى°¨ ى¹ک료 ë°ڈ ىگê°€ى،°يکˆëھ¨ى„¸يڈ¬ى´ى‹ىک يڑ¨ê³¼ë¥¼ 비êµگي•کëٹ” 3ىƒپ ى—°êµ¬ê°€ 계يڑچ ëکگëٹ” ى§„ي–‰ ى¤‘ى—گ ىˆë‹¤(NCT03391466, NCT03483103, NCT03570892). CAR-Tëٹ” 매ىڑ° يڑچ기ى پى¸ ى¹ک료법ى´ى§€ë§Œ ى¹ک료 يڑ¨ê³¼ىک ê°œى„ ë°ڈ يڑ¨ê³¼, 부ى‘ىڑ©ى„ ىکˆى¸،ي• ىˆک ىˆëٹ” ë°”ى´ىک¤ë§ˆى»¤ىک 발굴ى´ ي•„ىڑ”ي•ک다. êµë‚´ ى—ى‹œ CAR-T ى¹ک료ىک ëڈ„ى…ى´ 매ىڑ° ى‹œê¸‰ي•کë©° ë³µى،ي•œ ى¹ک료 ى ˆى°¨ى™€ 비ىڑ© ë°ڈ ى ‘ê·¼ى„± ى œê³ 를 ىœ„ي•œ êµë‚´ى™¸ ى‚°ي•™يک‘ë ¥ى´ 매ىڑ° ى ˆى‹¤ي•ک다.
REFERENCES
1. Jung KW, Won YJ, Kong HJ, Lee ES. Prediction of cancer incidence and mortality in Korea, 2018. Cancer Res Treat 2018;50:317–323.



2. Kim JM, Ko YH, Lee SS, et al. WHO classification of malignant lymphomas in Korea: report of the third nationwide study. Korean J Pathol 2011;45:254–260.

3. Sehn LH, Gascoyne RD. Diffuse large B-cell lymphoma: optimizing outcome in the context of clinical and biologic heterogeneity. Blood 2015;125:22–32.


4. Gisselbrecht C, Glass B, Mounier N, et al. Salvage regimens with autologous transplantation for relapsed large B-cell lymphoma in the rituximab era. J Clin Oncol 2010;28:4184–4190.



5. Crump M, Neelapu SS, Farooq U, et al. Outcomes in refractory diffuse large B-cell lymphoma: results from the international SCHOLAR-1 study. Blood 2017;130:1800–1808.



6. Gross G, Waks T, Eshhar Z. Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity. Proc Natl Acad Sci U S A 1989;86:10024–10028.



7. Eshhar Z, Waks T, Gross G, Schindler DG. Specific activation and targeting of cytotoxic lymphocytes through chimeric single chains consisting of antibody-binding domains and the gamma or zeta subunits of the immunoglobulin and T-cell receptors. Proc Natl Acad Sci U S A 1993;90:720–724.



8. Finney HM, Lawson AD, Bebbington CR, Weir AN. Chimeric receptors providing both primary and costimulatory signaling in T cells from a single gene product. J Immunol 1998;161:2791–2797.


9. Brentjens RJ, Latouche JB, Santos E, et al. Eradication of systemic B-cell tumors by genetically targeted human T lymphocytes co-stimulated by CD80 and interleukin-15. Nat Med 2003;9:279–286.


10. Maher J, Brentjens RJ, Gunset G, Riviأ¨re I, Sadelain M. Human T-lymphocyte cytotoxicity and proliferation directed by a single chimeric TCRzeta /CD28 receptor. Nat Biotechnol 2002;20:70–75.


12. Kochenderfer JN, Wilson WH, Janik JE, et al. Eradication of B-lineage cells and regression of lymphoma in a patient treated with autologous T cells genetically engineered to recognize CD19. Blood 2010;116:4099–4102.



13. Porter DL, Levine BL, Kalos M, Bagg A, June CH. Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia. N Engl J Med 2011;365:725–733.



14. Davila ML, Riviere I, Wang X, et al. Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia. Sci Transl Med 2014;6:224ra225.

15. Turtle CJ, Hanafi LA, Berger C, et al. CD19 CAR-T cells of defined CD4+:CD8+ composition in adult B cell ALL patients. J Clin Invest 2016;126:2123–2138.



16. Turtle CJ, Hanafi LA, Berger C, et al. Immunotherapy of non-Hodgkin's lymphoma with a defined ratio of CD8+ and CD4+ CD19-specific chimeric antigen receptor-modified T cells. Sci Transl Med 2016;8:355ra116.



17. Neelapu SS, Locke FL, Bartlett NL, et al. Axicabtagene ciloleucel CAR T-cell therapy in refractory large B-cell lymphoma. N Engl J Med 2017;377:2531–2544.



18. Locke FL, Ghobadi A, Jacobson CA, et al. Long-term safety and activity of axicabtagene ciloleucel in refractory large B-cell lymphoma (ZUMA-1): a single-arm, multicentre, phase 1-2 trial. Lancet Oncol 2019;20:31–42.


19. Schuster SJ, Bishop MR, Tam CS, et al. Tisagenlecleucel in adult relapsed or refractory diffuse large B-cell lymphoma. N Engl J Med 2019;380:45–56.


20. Schuster SJ, Svoboda J, Chong EA, et al. Chimeric antigen receptor T cells in refractory B-cell lymphomas. N Engl J Med 2017;377:2545–2554.



21. Abramson JS, Gordon LI, Palomba ML, et al. Updated safety and long term clinical outcomes in TRANSCEND NHL 001, pivotal trial of lisocabtagene maraleucel (JCAR017) in R/R aggressive NHL. J Clin Oncol 2018;36:7505.

22. Nastoupil LJ, Jain MD, Spiegel JY, et al. Axicabtagene ciloleucel (Axi-cel) CD19 chimeric antigen receptor (CAR) T-cell therapy for relapsed/refractory large B-cell lymphoma: real world experience. Blood 2018;132:91.

23. Jacobson CA, Hunter B, Armand P, et al. Axicabtagene ciloleucel in the real world: outcomes and predictors of response, resistance and toxicity. Blood 2018;132:92.

24. Yoon DH, Osborn MJ, Tolar J, Kim CJ. Incorporation of immune checkpoint blockade into chimeric antigen receptor T cells (CAR-Ts): combination or built-in CAR-T. Int J Mol Sci 2018;19:E340.


(A) Basic structure of three generations of chimeric antigen receptor T-cells. (B) Structure of axicabtagene ciloleucel, tisagenlecleucel, and lisocabtagene maraleucel. CAR-T, chimeric antigen receptor T-cell; scFv, single-chain variable fragment.
Figureآ 1.
Tableآ 1.
Summary of the data from pivotal trials of CD19 CAR-T
| Study | ZUMA-1 | JULIET | TRANSCEND-NHL-001 |
|---|---|---|---|
| Sponsor | Kite pharma | Novartis | Juno therapeutics |
| CAR-T | Axicabtagene ciloleucel | Tisagenlecleucel | Lisocabtagene maraleucel |
| Structure | FMC63/CD28/CD3zeta | FMC63/4-1BB/CD3zeta | FMC63/4-1BB /CD3zeta |
| Vector | Retrovirus | Lentivirus | Lentivirus |
| CD4:CD8 | Not specified | Not specified | 1:1 |
| No. of enrolled patients | 119 | 165 | 134 |
| No. of treated patients | 108 | 111 | 114 |
| No. of assessable patients | 101 | 93 | 73a |
| Time to infusion, median | Not reported | 54 days (30-92 days) | Not reported |
| Bridging chemotherapy | 0% | 92% | Not reported |
| Lymphodepletion | Flu 30 mg/m2 + Cy 500 mg/m2 for 3 days | Flu 25 mg/m2 + Cy 250 mg/m2 for 3 days or Bendamustine 90 mg/m2 for 2 days | Flu 30 mg/m2 + Cy 300 mg/m2 for 3 days |
| Dose of cells | 2.0 أ— 106 cells/kg | Median 3.0 أ— 108 cells | 5.0 أ— 107 cells (DL1) or 1.0 أ— 108 cells (DL2) |
| Disease subtypes | DLBCL, PMBL, tFL | DLBCL, tFL | DLBCL, tFL, FLG3B |
| OR rates | 83% | 52% | 80% |
| CR rates | 58% | 40% | 59%a |
| PFS, median | 5.9 months | Around 3 months (ITT)b | Not reported |
| Duration of response | 11.1 months | Not reached | Not reached |
| OS, median | Not reached | 8.3 months (ITT) | 12 months |
| 12.0 months (PP) | |||
| CRS ≥ grade 3 | 13% | 22% | 3%a |
| Neurotoxicity ≥ grade 3 | 28% | 12% | 15%a |
| Tocilizumab use | 43% | 15% | 7% |
| Steroid use | 27% | Not reported | 10% |
CAR-T, chimeric antigen receptor T-cell; DLBCL, diffuse large B-cell lymphoma; PMBL, primary mediastinal B-cell lymphoma; tFL, transformed follicular lymphoma; FLG3B, follicular lymphoma grade 3B; OR, overall response; CR, complete response; PFS, progression-free survival; ITT, intention-to-treat; OS, overall survival; PP, per protocol; CRS, cytokine-release syndrome.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




