 |
 |
| Korean J Med > Volume 93(6); 2018 > Article |
|
요약
목적
방법
Abstract
Background/Aims
Methods
Results
REFERENCES
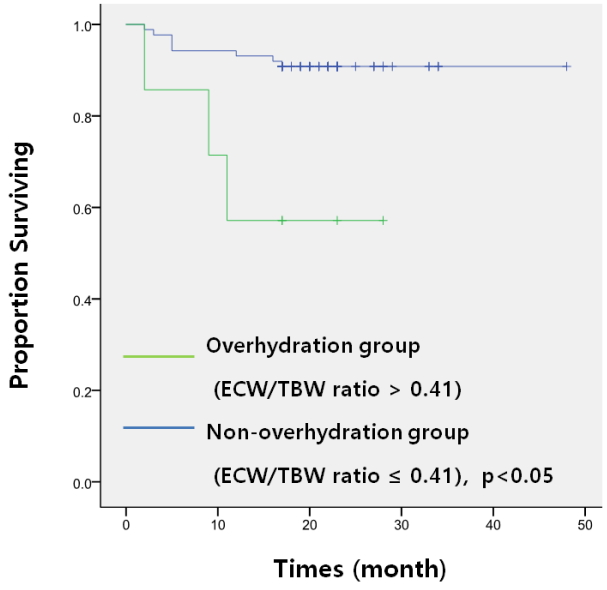
Figure 1.
Table 1.
| Variable | Total (n = 93) | Surviving (n = 82) | Expired (n = 11) | p-value |
|---|---|---|---|---|
| Age (years) | 57.7 ± 12.8 | 56.5 ± 12.7 | 67.0 ± 9.2 | < 0.01a |
| Gender (female : male) | 47 : 46 | 44 : 38 | 3 : 8 | 0.1 |
| Diabetes | 41 (44.0) | 39 (47.6) | 2 (18.2) | 0.065 |
| Dialysis duration (months) | 92.4 ± 66.0 | 95.2 ± 67.6 | 72.9 ± 51.1 | 0.297 |
| CAD | 20 (21.5) | 15 (18.3) | 5 (45.5) | 0.04a |
| Heart failure | 16 (17.2) | 10 (12.2) | 6 (54.5) | < 0.01a |
| CVA | 15 (16.1) | 14 (17.1) | 1 (9.1) | 0.057 |
| Dry weight | 59.5 ± 11.3 | 59.1 ± 11.1 | 61.9 ± 12.8 | 0.44 |
| URR (%) | 74.50 ± 5.86 | 74.80 ± 6.03 | 72.18 ± 3.97 | 0.16 |
| WBC (103/uL) | 6.19 ± 2.96 | 6.12 ± 3.03 | 6.72 ± 2.33 | 0.53 |
| Hemoglobin (g/dL) | 10.30 ± 1.06 | 10.34 ± 1.07 | 9.95 ± 0.95 | 0.25 |
| CRP (mg/dL) | 0.35 ± 0.91 | 0.25 ± 0.74 | 1.10 ± 1.57 | 0.03a |
| Platelet (103/uL) | 169.28 ± 49.71 | 169.15 ± 47.61 | 170.18 ± 66.12 | 0.94 |
| Na (mEq/L) | 139.22 ± 2.73 | 139.39 ± 2.63 | 138.09 ± 3.26 | 0.14 |
| K (mEq/L) | 4.83 ± 0.72 | 4.86 ± 0.72 | 4.58 ± 0.63 | 0.21 |
| Cl (mEq/L) | 99.24 ± 10.37 | 99.10 ± 10.87 | 100.18 ± 5.60 | 0.74 |
| tCO2 (mEq/L) | 20.61 ± 2.99 | 20.50 ± 3.05 | 21.40 ± 2.47 | 0.35 |
| Protein (g/dL) | 6.41 ± 0.49 | 6.41 ± 0.49 | 6.40 ± 0.47 | 0.93 |
| Albumin (g/dL) | 3.92 ± 0.34 | 3.96 ± 0.28 | 3.55 ± 0.47 | 0.00a |
| Calcium (mg/dL) | 8.63 ± 0.77 | 8.66 ± 0.78 | 8.39 ± 0.60 | 0.27 |
| Phosphorus (mg/dL) | 4.80 ± 1.27 | 4.92 ± 1.19 | 3.90 ± 1.50 | 0.01a |
| Total chol. (mg/dL) | 136.85 ± 30.3 | 136.76 ± 31.1 | 137.45 ± 24.5 | 0.94 |
| Triglyceride (mg/dL) | 107.14 ± 80.92 | 110.96 ± 84.12 | 78.63 ± 43.65 | 0.21 |
| HDL chol. (mg/dL) | 42.08 ± 13.02 | 42.68 ± 12.59 | 37.60 ± 15.73 | 0.22 |
| LDL chol. (mg/dL) | 66.38 ± 23.11 | 66.35 ± 23.03 | 66.52 ± 24.83 | 0.98 |
| PTH (pg/mL) | 212.03 ± 251.92 | 232.47 ± 261.63 | 61.48 ± 39.85 | 0.03a |
Values are presented as mean ± standard deviation or number (%) unless otherwise indicated.
CAD, coronary artery disease; CVA, cerebrovascular accident; URR, urea reduction rate; WBC, white blood cell; CRP, C-reactive protein; chol., cholesterol; HDL, high density lipoprotein; LDL, low density lipoprotein; PTH, parathyroid hormone.
Table 2.
| Variable | Total (n = 93) | Surviving (n = 82) | Expired (n = 11) | p-value |
|---|---|---|---|---|
| ICW (L) | 20.16 ± 4.37 | 20.07 ± 4.47 | 20.80 ± 3.60 | 0.60 |
| ECW (L) | 12.93 ± 2.62 | 12.78 ± 2.63 | 14.06 ± 2.38 | 0.12 |
| TBW (L) | 33.09 ± 6.91 | 32.85 ± 7.03 | 34.87 ± 5.89 | 0.37 |
| Fat (kg) | 14.65 ± 7.74 | 14.61 ± 7.78 | 14.90 ± 7.78 | 0.90 |
| BMI (kg/m2) | 22.43 ± 3.45 | 22.47 ± 3.46 | 22.16 ± 3.54 | 0.78 |
| WHR | 0.87 ± 0.09 | 0.86 ± 0.09 | 0.90 ± 0.1 | 0.18 |
| ECW/TBW ratio | 0.39 ± 0.02 | 0.39 ± 0.01 | 0.40 ± 0.01 | < 0.008a |
| SLM (kg) | 42.35 ± 8.90 | 42.07 ± 9.07 | 44.42 ± 7.53 | 0.41 |
| FFM (kg) | 44.86 ± 9.39 | 44.56 ± 9.56 | 47.06 ± 7.96 | 0.41 |
| SMM (kg) | 24.29 ± 5.70 | 24.18 ± 5.84 | 25.13 ± 4.69 | 0.60 |
| BCM (kg) | 28.87 ± 6.26 | 28.75 ± 6.41 | 29.78 ± 5.15 | 0.61 |
| BMC (kg) | 2.51 ± 0.52 | 2.49 ± 0.52 | 2.63 ± 0.49 | 0.40 |
| AC (kg) | 28.57 ± 3.16 | 28.52 ± 3.19 | 28.85 ± 3.08 | 0.74 |
| AMC (kg) | 24.27 ± 2.76 | 24.15 ± 2.75 | 25.10 ± 2.81 | 0.28 |
| VFA (kg) | 81.04 ± 43.32 | 79.24 ± 43.58 | 94.37 ± 40.68 | 0.27 |
| BMR (kg) | 1,339.11 ± 202.80 | 1,332.73 ± 206.64 | 1,386.63 ± 172.27 | 0.41 |
| TBW/FFM ratio | 73.78 ± 0.50 | 73.74 ± 0.49 | 74.10 ± 0.48 | 0.02a |
Values are presented as mean ± standard deviation.
BIA, bioelectrical impedance analysis; ICW, intracellular water; ECW, extracellular water; TBW, total body water; BMI, body mass index; WHR, waist hip ratio; SLM, soft lean mass; FFM, fat free mass; SMM, skeletal muscle mass; BCM, body cell mass; BMC, bone mineral content; AC, arm circumference; AMC, arm muscle circumference; VFA, visceral fat area; BMR, basal metabolic rate.
Table 3.
| Correlation coefficient | p-value | |
|---|---|---|
| Skeletal muscle mass | 0.194 | 0.009a |
| Soft lean mass | 0.165 | 0.023a |
| Fat free mass | 0.168 | 0.023a |
| Fat | 0.051 | 0.490 |
| Visceral fat area | -0.021 | 0.771 |
| Total body water | 0.163 | 0.027a |
| Intracellular water | 0.196 | 0.008a |
| Extracellular water | 0.113 | 0.129 |
| ECF/TBW ratio | -0.262 | 0.000a |
| TBW/FFM ratio | -0.227 | 0.003a |
Table 4.
| Variable | Total (n = 93) | Non-overhydration (n = 73) | Overhydration (n = 20) | p-value |
|---|---|---|---|---|
| Age (years) | 57.7 ± 12.8 | 56.35 ± 12.87 | 62.90 ± 11.47 | 0.04a |
| Gender (male : female) | 46 : 47 | 37 : 36 | 9 : 11 | 0.65 |
| Diabetes | 41 (44.0) | 31 (42.5) | 10 (50.0) | 0.54 |
| Dialysis duration (months) | 92.4 ± 66.0 | 90.82 ± 65.47 | 98.60 ± 69.35 | 0.64 |
| CAD | 20 (21.5) | 16 (21.9) | 4 (20.0) | 0.85 |
| Heart failure | 16 (17.2) | 11 (15.1) | 5 (25.0) | 0.29 |
| CVA | 15 (16.1) | 12 (16.4) | 3 (15.0) | 0.87 |
| Dry weight | 59.5 ± 11.3 | 59.56 ± 11.22 | 59.33 ± 11.81 | 0.93 |
| URR (%) | 74.50 ± 5.86 | 74.29 ± 6.21 | 75.23 ± 4.38 | 0.52 |
| WBC (103/uL) | 6.19 ± 2.96 | 6.29 ± 3.23 | 5.86 ± 1.62 | 0.56 |
| Hemoglobin (g/dL) | 10.30 ± 1.06 | 10.34 ± 1.07 | 10.12 ± 1.04 | 0.39 |
| CRP (mg/dL) | 0.35 ± 0.91 | 0.32 ± 0.93 | 0.44 ± 0.86 | 0.61 |
| Platelet (103/uL) | 169.28 ± 49.71 | 171.10 ± 48.73 | 162.60 ± 53.90 | 0.50 |
| Na (mEq/L) | 139.22 ± 2.73 | 139.30 ± 2.50 | 138.90 ± 3.49 | 0.56 |
| K (mEq/L) | 4.83 ± 0.72 | 4.94 ± 0.70 | 4.44 ± 0.65 | 0.006 |
| Cl (mEq/L) | 99.24 ± 10.37 | 98.84 ± 11.43 | 100.65 ± 4.77 | 0.296 |
| tCO2 (mEq/L) | 20.61 ± 2.99 | 20.33 ± 3.12 | 21.63 ± 2.29 | 0.08 |
| Protein (g/dL) | 6.41 ± 0.49 | 6.43 ± 0.43 | 6.32 ± 0.65 | 0.37 |
| Albumin (g/dL) | 3.92 ± 0.34 | 3.99 ± 0.25 | 3.65 ± 0.47 | 0.006 |
| Calcium (mg/dL) | 8.63 ± 0.77 | 8.70 ± 0.73 | 8.63 ± 0.84 | 0.076 |
| Phosphorus (mg/dL) | 4.80 ± 1.27 | 5.06 ± 1.14 | 3.87 ± 1.30 | < 0.01a |
| Total chol. (mg/dL) | 136.85 ± 30.3 | 139.06 ± 29.03 | 128.75 ± 34.04 | 0.17 |
| Triglyceride (mg/dL) | 107.14 ± 80.92 | 111.58 ± 85.24 | 90.90 ± 61.81 | 0.31 |
| HDL chol. (mg/dL) | 42.08 ± 13.02 | 42.82 ± 11.98 | 39.39 ± 16.27 | 0.29 |
| LDL chol. (mg/dL) | 66.38 ± 23.11 | 67.73 ± 22.96 | 61.49 ± 23.55 | 0.28 |
| PTH (pg/mL) | 212.03 ± 251.92 | 215.24 ± 259.14 | 200.47 ± 229.84 | 0.81 |
Values are presented as mean ± standard deviation or number (%) unless otherwise indicated.
CAD, coronary artery disease; CVA, cerebrovascular accident; URR, urea reduction rate; WBC, white blood cell; CRP, C-reactive protein; chol., cholesterol; HDL, high density lipoprotein; LDL, low density lipoprotein; PTH, parathyroid hormone.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




