 |
 |
| Korean J Med > Volume 91(1); 2016 > Article |
|
요약
저자는 갑상선암 환자에서 방사성요오드 치료 후 진단된 만성 골수성 백혈병에서, 2세대 타이로신 키나제 억제제로 치료가 되는 증례를 경험하였기에 문헌고찰과 함께 보고하는 바이다.
Abstract
The incidence of thyroid cancer has increased rapidly worldwide, although most patients can survive for a long time without developing symptoms. While most thyroid cancers are treated with thyroidectomy alone, some patients are given additional radioactive iodine (RAI) in the form of 131I to treat thyroid cancer metastasis. RAI is associated with acute and chronic complications. Secondary malignancies are the most important in long-term cancer survivors. While many studies have reported the occurrence of acute myeloid leukemia after high-dose RAI, there are few reports on chronic myeloid leukemia (CML) after low-dose RAI treatment. Moreover, previous cases of CML following thyroid cancer were reported before the tyrosine kinase inhibitor (TKI) era. Here, we describe two cases of CML following thyroid cancer that were successfully treated with second-generation TKIs.
갑상선암의 발생률은 급격하게 증가하고 있으며, 대부분의 환자에서는 5년 생존율이 100%에 육박할 정도로 장기 생존이 가능하다고 보고되고 있다[1]. 갑상선암 환자에서 생존율을 높이고 삶의 질을 향상시키기 위해 잔여 암을 제거하는 것은 매우 중요한 치료 전략으로, 131I 형태의 방사성요오드는 잔여 갑상선의 절제, 보조 요법 또는 전이암의 조절에 널리 사용되고 있다[2]. 하지만, 방사선요오드는 침샘염, 구내염, 골수형성 부전증을 일으키고 이차성 암을 유발하는 등의 다양한 급성, 만성 합병증을 일으킬 수 있어 주의가 요구된다[2]. 방사성요오드로 치료받은 갑상선암 환자들에서 백혈병이 발생할 확률은 방사성요오드 치료를 받지 않은 환자들보다 2.5배 높은 것으로 알려져 있다[3,4]. 갑상선암 환자에서 방사선요오드 치료와 관련된 급성 골수성 백혈병 발병의 위험성은 많은 연구에서 보고되었지만, 만성 골수성 백혈병은 보고된 사례가 많지 않다[5]. 치료와 관련된 만성 골수성 백혈병은 타이로신 키나제 억제제가 나오기 이전에는 고식적인 약물들로 치료하였다. 본 연구에서는 유두상 갑상선암 환자에서 방사성요오드 치료 후 발생한 만성 골수성 백혈병을 2세대 타이로신 키나제 억제제를 사용하여 성공적으로 치료한 증례 2예를 보고하고자 한다.
환 자: 35세 남자
주 소: 건강 검진상 우연히 발견된 백혈구증가증, 혈소판 증가증
현병력: 건강 검진상 우연히 발견된 백혈구증가증, 혈소판증가증을 주소로 방문하였다.
과거력: 50개월 전 림프절 전이가 있는 유두상 갑상선암에 대해서 양측 갑상선 전절제술 및 중심경부림프절 절제술을 시행받았고 방사성요오드(200 mCi) 치료를 받았다. 갑상선스캔 검사상 갑상선 바탕에 요오드의 지속적인 축적이 관찰되어 30 mCi의 방사성요오드 치료를 추가적으로 받았다. 이후 환자는 갑상선호르몬 치료를 하면서 재발 없이 지냈다.
신체 검사 소견: 혈압은 140/80 mmHg, 체온은 36.5℃, 맥박은 분당 78회, 호흡수는 분당 20회였다. 의식은 명료하였고, 결막은 창백하지 않았으며, 촉지되는 림프절은 없었다. 비장은 늑골하 1 cm 정도 촉지되었다. 복부의 압통은 없었으며 장음은 정상이었다. 사지의 발진이나 점상 출혈은 없었다.
검사실 소견: 혈액 검사상 백혈구 52.28 × 109 /L (중성구 77.5%, 림프구 6.5%, 단핵구 1.7%, 호염기구 7.6%, 호산구 2.4%), 혈색소 12.6 g/dL, 혈소판 1,563 × 109 /L 이었다. 생화학 검사는 혈액요소질소 13.5 mg/dL, 크레아티닌 1.09 mg/dL, as partate transaminase (AST) 26 IU/L, alanine transaminase (ALT) 26 IU/L, 총 빌리루빈 0.4 mg/dL, 알부민 5.0 g/dL였다. Lactate dehydrogenase 1230 IU/L (참고치 225-455)로 상승되어 있었다.
방사선학적 소견: 단순 흉부 방사선 검사상 심비대 소견은 없었다. 복부 초음파상 경도의 지방간과 11.6 cm의 비장 비대 소견이 보였다.
병리학적 소견: 말초 혈액 검사상 백혈구 수는 52.28 × 109/L였고 중성구가 77.5%, 골수흡인 조직검사상 세포과다, 과립구계/적혈구계 비율의 증가, 좌측 이동을 동반한 적혈구계, 과립구계 세포의 성숙, 많은 소형 거대핵세포가 관찰되었다(Fig. 1A). 골수세포 염색체 분석에서는 46, XY, t(9;22)(q34;q11.2)[13]가 관찰되었다(Fig. 1B).
치료 및 경과: Sokal score 1.38 (Hasford score 1441) 로 고위험군 만성 골수성 백혈병 진단 하에 dasatinib 100 mg으로 치료를 시작하였고, 1개월에 완전혈액학적 반응에 도달하였으며 3개월째 break point cluster region-Abelson (BCR-ABL)1 transcripts real-time quantitative polymerase chain reaction (RQ-PCR)은 진단시 relative ratio 1.98 × 10-1에서 3.17 × 10-4, 6개월째 음성 소견을 보였으며, 핵형분석에서는 46, XY[25]로 완전세포유전학적 반응 및 주요 분자유전학적 반응에 도달하였고, 18개월째 외래 추적 관찰 중이다.
환 자: 60세 남자
주 소: 전신쇠약감
현병력: 전신쇠약감으로 방문하였다.
과거력: 33개월 전 림프절 전이가 있는 좌측 갑상선의 유두암에 대해서 양측 갑상선 전절제술 및 중심경부림프절 절제술을 시행받았다. 추가적으로 130 mCi의 방사성요오드 치료를 받았으며, 이후 갑상선호르몬 치료를 하면서 재발 없이 지냈다.
신체 검사 소견: 혈압은 110/60 mmHg, 체온은 36.5℃, 맥박은 분당 72회, 호흡수는 분당 16회였다. 의식은 명료하였고, 결막은 창백하지 않았으며, 촉지되는 림프절은 없었다. 간과 비장은 촉지되지 않았으며 복부의 압통은 없었고 장음은 정상이었다. 사지의 발진이나 점상 출혈은 없었다.
검사실 소견: 혈액 검사상 백혈구 27.60 × 109 /L (중성구 74.0%, 림프구 15.9%, 단핵구 5.8%, 호염기구 1.8%, 호산구 1.5%), 혈색소 12.1g/dL, 혈소판 324 × 109 /L 소견을 보였다. 생화학 검사는 혈액요소질소 11.6 mg/dL, 크레아티닌 0.73 mg/dL, AST 28 IU/L, ALT 24 IU/L, 총 빌리루빈 0.3 mg/dL, 알부민 3.8 g/dL였다. Lactate dehydrogenase 778 IU/L (참고치 225-455)로 증가되어 있었다.
방사선학적 소견: 단순 흉부 방사선 검사상 심비대 소견은 없었다. 복부 전산화단층촬영상 간의 혈관종과 신낭종 소견 외에 특이 소견은 없었다.
병리학적 소견: 골수흡인 조직검사상 세포 충실도가 증가되어 있었으며, 과립구계/적혈구계 비율의 증가 소견이 관찰되었다(Fig. 2A). 골수세포 염색체 분석에서는 46, XY, t(9;22)(q34;q11.2)[15]가 관찰되었다(Fig. 2B).
치료 및 경과: Sokal score 0.73 (Hasford score 729) 으로 저위험군 만성 골수성 백혈병 진단 하에 nilotinib 300 mg 1일 2회 요법으로 치료를 시작하였고, 1개월에 완전혈액학적 반응, 3개월째 BCR-ABL1 transcripts RQ-PCR은 진단시 relative ratio 2.66 × 10-2에서 relative ratio 2.40 × 10-4, 6개월째 음성 소견을 보였으며 핵형분석에서는 46, XY[20] 완전세포유전학적 반응 및 주요 분자유전학적 반응에 도달하였고, 18개월 째 외래 추적 관찰 중이다.
131I 형태의 방사성요오드는 갑상선암 치료에 널리 사용되고 있고 갑상선암의 생존율을 높이는데 기여하고 있다[2]. 방사성요오드가 널리 사용되고 있는 만큼 이것의 장기 합병증에 대한 관심이 많아지고 있으며, 최근 국내에서는 갑상선암 치료 후 발생한 만성 골수성 백혈병 증례 16예가 보고되었으나 방사성요오드 치료와의 관계나 치료 결과에 대한 언급은 없었다[6]. 지금까지 갑상선암 환자에서 방사성요오드 치료 후 발생한 만성 골수성 백혈병은 전 세계적으로 약 10건이 보고되었다(Table 1). 본 증례를 포함해서 12명의 만성 골수성 백혈병 환자들에게 투여된 방사성요오드 용량의 중앙값은 230 mCi (범위 30-850 mCi)였고, 나이의 중앙값은 47세(범위 27-76세) 그리고 방사성요오드 투여일로부터 만성 골수성 백혈병이 진단되기까지의 기간의 중앙값은 72개월(범위 10-168개월)이었다. 일반적인 만성 골수성 백혈병 환자들 나이의 중앙값은 서양에서는 65세인 반면, 동양인에서는 36-50세로 보다 젋은 나이에 발병하는 것으로 보고되었으며, 이차적으로 만성 골수성 백혈병이 발생한 환자들은 상대적으로 연령이 낮았다[7,8]. 잠복기의 범위는 알려져 있지 않지만, 대부분 갑상선암에서 이차적으로 발생한 백혈병은 180개월 이내에 발생하였다[6]. 기존에 보고된 10예의 증례들은 타이로신 키나제 억제제가 나오기 전에 진단되었기 때문에 고식적인 약물로 치료받았다. 만성 골수성 백혈병의 치료는 빠르게 발전하고 있고 타이로신 키나제 억제제를 사용한 뒤로 치료 결과가 향상되었으며, 2세대 타이로신 키나제 억제제의 사용으로 더 빠르고 깊은 반응을 얻을 수 있었다[9]. 본 연구에서는 2세대 타이로신 키나제 억제제로 치료받은 2명의 환자 모두 6개월째에 주요 분자유전학적 반응, 완전세포유전학적 반응을 보였다. 이차적으로 발생한 급성 골수성 백혈병과는 달리 이차적으로 발생한 만성 골수성 백혈병의 치료 효과는 일차성으로 발생한 만성 골수성 백혈병과 다르지 않았다.
방사성요오드 치료와 만성 골수성 백혈병 발생의 연관성에 대한 정확한 병태 생리는 아직 밝혀지지 않았으나 방사성 요오드를 포함한 이온화 방사선은 염색체의 전좌를 유발하는데 영향을 준다고 알려져 있고 이로 인해 백혈병이 발생하였을 가능성이 있다[5]. 이차적으로 발생하는 고형암과 비교하여 방사성요오드 치료 후 이차적으로 발생한 백혈병은 보다 저용량의 치료에서 발생할 수 있다[2]. 본 연구에서 2명의 환자들은 림프절 전이 때문에 방사성요오드 치료가 필수적이었으며, 용량이 230 mCi, 130 mCi로 상대적으로 저용량이었기 때문에 이것이 직접적으로 만성 골수성 백혈병을 유발하였을 가능성이 높지는 않다. 그러나 이러한 경우라 하더라도 항상 이차적으로 종양이 발생할 수 있다는 위험성을 인지하고 환자들에게 그 위험성을 알리는 것은 중요하다.
결론적으로 갑상선암을 치료한 환자들에서는 항암 치료의 장기 효과를 고려해야 하며 만성 골수성 백혈병을 포함한 이차적 종양 발생 가능성에 대한 주의 깊은 관찰이 필요하다. 또한 갑상선암 치료 후 이차적으로 발생한 만성 골수성 백혈병에 있어서 타이로신 키나제 억제제는 좋은 치료 옵션이 될 것이다.
REFERENCES
1. Jung KW, Won YJ, Kong HJ, Oh CM, Lee DH, Lee JS. Cancer statistics in Korea: incidence, mortality, survival, and prevalence in 2011. Cancer Res Treat 2014;46:109–123.



2. Lee SL. Complications of radioactive iodine treatment of thyroid carcinoma. J Natl Compr Canc Netw 2010;8:1277–1287.


3. Rubino C, de Vathaire F, Dottorini ME, et al. Second primary malignancies in thyroid cancer patients. Br J Cancer 2003;89:1638–1644.



4. Sawka AM, Thabane L, Parlea L, et al. Second primary malignancy risk after radioactive iodine treatment for thyroid cancer: a systematic review and meta-analysis. Thyroid 2009;19:451–457.


5. Wang KL, Lin LY, Chen PM, Lin HD. Chronic myeloid leukemia after treatment with 131 for thyroid carcinoma. J Chin Med Assoc 2005;68:230–233.


6. Cho YY, Lim J, Oh CM, et al. Elevated risks of subsequent primary malignancies in patients with thyroid cancer: A nationwide, population-based study in Korea. Cancer 2015;121:259–268.


Morphologic and cytogenetic study. (A) Bone marrow biopsy showing hypercellularity and increased myeloid proliferation and eosinophils (×400). (B) Karyotype revealing 46 chromosomes, XY, t(9;22)(q34;q11.2)[13].
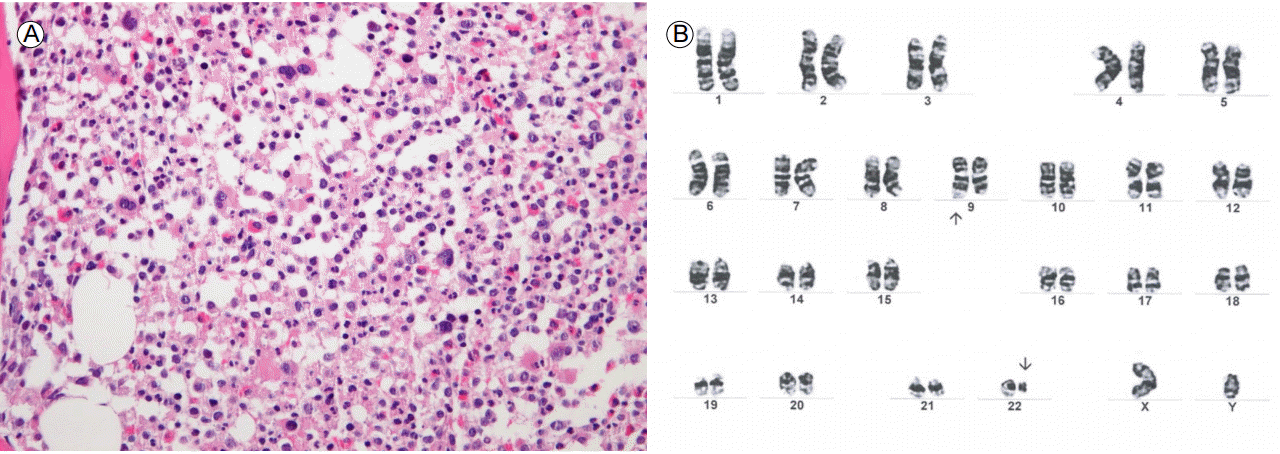
Figure 1.
Morphologic and cytogenetic study. (A) Bone marrow biopsy showing increased cellularity and myeloid proliferation (×100). (B) Karyotype revealing 46, XY, t(9;22)(q34;q11.2)[15].
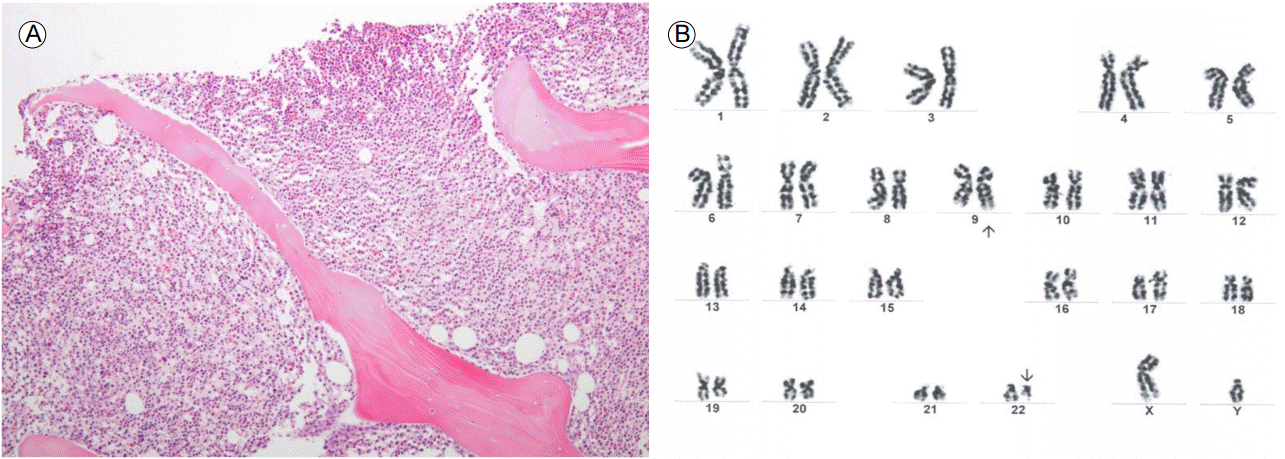
Figure 2.
Table 1.
Reports of chronic myeloid leukemia following radioactive iodine treatment in thyroid cancer patients
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 8,267 View
- 152 Download



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



