ņä£ ļĪĀ
Human immunodeficiency virus (HIV) Ļ░ÉņŚ╝ņŚÉņä£ ŌĆśļ╣äņŚÉņØ┤ņ”ł ĒĢ®ļ│æņ”Ø(non-AIDS morbidity)ŌĆÖņØĆ ņ╣śļŻīņØś ņ¦äļ│┤ļĪ£ ņØĖĒĢ£ ĒÖśņ×ÉļōżņØś Ļ│ĀļĀ╣ĒÖöļĪ£ ņØĖĒĢ┤ ĻĘĖ ņżæņÜöņä▒ņØ┤ ņ”ØĻ░ĆļÉśĻ│Ā ņ׳ļŗż[1-3]. HIV Ļ░ÉņŚ╝Ļ│╝ ņ¦üņĀæņĀüņØĖ Ļ┤ĆĻ│äĻ░Ć ņ׳ļŖö ņ¦łĒÖś(ĻĖ░ĒÜī Ļ░ÉņŚ╝, ņŚÉņØ┤ņ”ł ņ¦Ćņ╣Ł ņóģņ¢æ, HIVņØś ņżæņČöņŗĀĻ▓ĮĻ│ä Ļ░ÉņŚ╝ ļ░Å HIV ņćĀņĢĮņ”ØĒøäĻĄ░, CĒśĢ ļ░Å BĒśĢ Ļ░äņŚ╝ņØś ļÅÖņŗ£ Ļ░ÉņŚ╝ ļō▒) ņÖĖņŚÉ HIV ĒÖśņ×ÉļōżņŚÉĻ▓īņä£ ņ”ØĻ░ĆĒĢśļŖö ņ¦łĒÖśņ£╝ļĪ£ ņ×äņāüņŚÉņä£ ņ╣śļŻīņŗ£ Ļ┤Ćņŗ¼ņØä ļæÉĻ│Ā Ļ░ÖņØ┤ ņ╣śļŻīĒĢ┤ņĢ╝ ĒĢśļŖö ņ¦łĒÖśļōżņØä ŌĆśļ╣äņŚÉņØ┤ņ”ł ĒĢ®ļ│æņ”ØŌĆÖņ£╝ļĪ£ ļ¦ÉĒĢĀ ņłś ņ׳ņ£╝ļ®░ ņØ┤ņŚÉ ļīĆĒĢ£ ņ×äņāüņŚÉņä£ņØś ņżæņÜöĒĢ£ ļČĆļČäņØä ĻĖ░ņłĀĒĢśĻ│Āņ×É ĒĢ£ļŗż. ņØ┤ ņ¦łĒÖśļōżņØś ļīĆĒæ£ņĀüņØĖ ņśłļĪ£ ņŗ¼ĒśłĻ┤ĆĻ│ä ņ¦łĒÖś, ņ¦Ćļ░®ņØ┤ņśüņ¢æņ”Ø(lipodystrophy), ļŗ╣ļć©, Ļ│©(ļ╝ł) ņ¦łĒÖś, ņŗĀ ņ¦łĒÖś, Ļ░ä ņ¦łĒÖś, ņĀĢņŗĀ ņ¦łĒÖś ļ░Å ņŚÉņØ┤ņ”ł ņ¦Ćņ╣Ł ņ¦łĒÖś ņÖĖņØś ņĢģņä▒ ņóģņ¢æ, ņä▒ĻĖ░ļŖź ņןņĢĀ ļō▒ņØ┤ ņ׳ļŗż(Table 1) [1,4,5]. HIV Ļ░ÉņŚ╝ņ×ÉņØś ļ╣äĻ░ÉņŚ╝ņä▒ ņ¦łĒÖśņØ┤ 2010ļģäņŚÉļŖö 29%ņŚÉņä£ 2030ļģäņŚÉļŖö 84%ļĪ£ ņśłņĖĪļÉĀ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[6]. ļśÉĒĢ£ HIV ĒÖśņ×ÉņØś ņé¼ļ¦ØņŚÉ ņŚÉņØ┤ņ”ł ņŚ░Ļ┤Ć ņé¼ļ¦ØņØĆ Ļ░ÉņåīĒĢśĻ│Ā ņ׳Ļ│Ā ļ╣äņŚÉņØ┤ņ”ł ņ¦łĒÖśņŚÉ ņØśĒĢ£ ņé¼ļ¦ØņØĆ ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŗż[7]. ņØ┤ļŖö HIV Ļ░ÉņŚ╝ ņÖĖņŚÉ ļ╣äņŚÉņØ┤ņ”ł ĒĢ®ļ│æņ”Ø ļ░Å ļÅÖļ░ś ņ¦łĒÖśņØś ņ╣śļŻī ņżæņÜöņä▒ņØä ņל ļ¦ÉĒĢ┤ ņżĆļŗż. ņØ┤ļ¤░ ļÅÖļ░ś ņ¦łĒÖśņØś ņ”ØĻ░ĆļĪ£ HIV ĒÖśņ×É ņ¦äļŻīņŗ£ Ļ░ÉņŚ╝ ņ╣śļŻīļ┐Éļ¦īņØ┤ ņĢäļŗłļØ╝ ņóģĒĢ®ņĀüņØĖ ļé┤Ļ│╝ņ¦äļŻīļź╝ ĒĢ┤ņĢ╝ ĒĢśļŖö ņāüĒÖ®ņØ┤ ļÉśņ¢┤Ļ░ĆĻ│Ā ņ׳ļŗż. ļśÉĒĢ£ ļŗżļźĖ ņĀäļ¼ĖĻ░ĆņÖĆņØś ĒśæņØś ņ¦äļŻīĻ░Ć ļŹö ĒĢäņÜöĒĢ┤ņ¦ĆĻ│Ā ņ׳ļŗż.
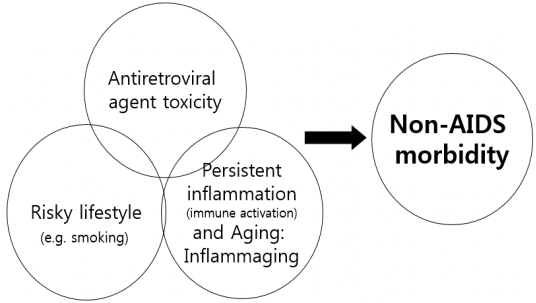
ņ×ÉņŚ░ņĀüņØĖ Ļ│ĀļĀ╣ĒÖöņŚÉ ļŹöĒĢśņŚ¼ ņĢĮņĀ£ņØś ļÅģņä▒, ĻĖ░ņĪ┤ņØś Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŖö ņ£äĒŚś ņØĖņ×É ļ░Å ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņĪ┤ņ×¼ĒĢśļŖö ņŚ╝ņ”Ø(inflammation) ļō▒ņØ┤ ļ╣äņŚÉņØ┤ņ”ł ĒĢ®ļ│æņ”ØņØś ļ░£ņāØņŚÉ ņśüĒ¢źņØä ņżĆļŗż(Fig. 1) [3,8]. Ļ│ĀļĀ╣ĒÖöņÖĆ ļŹöļČłņ¢┤ ņŚ╝ņ”ØņØ┤ ņ¦ĆņåŹĒĢśļŖö ņāüĒā£ļź╝ ŌĆśinflammagingŌĆÖņØ┤ļ×Ć ņÜ®ņ¢┤ļĪ£ ņé¼ņÜ®ĒĢśĻĖ░ļÅä ĒĢ£ļŗż(Fig. 1) [9]. HIV Ļ░ÉņŚ╝ņŗ£ ņ╣śļŻīļź╝ ĒĢśņ¦Ć ņĢŖĻ│Ā ņ׳ļŖö ņāüĒā£ļŖö ļ╣äņŚÉņØ┤ņ”ł ĒĢ®ļ│æņ”ØņØś ņ£äĒŚś ņÜöņåīĻ░Ć ļÉśĻ│Ā ņ׳ļŗż[10]. ņĄ£ĻĘ╝ ņ╣śļŻīņØś Ļ▓ĮĒ¢źņØĆ ļ®┤ņŚŁņØ┤ ļéśļ╣Āņ¦ĆĻĖ░ ņĀäņŚÉ ļ╣ĀļźĖ ĒĢŁļĀłĒŖĖļĪ£ļ░öņØ┤ļ¤¼ņŖż ņ╣śļŻīļź╝ ĒĢśļŖö Ļ▓āņØĖļŹ░ ņØ┤ļŖö ņŚÉņØ┤ņ”ł ņŚ░Ļ┤Ć ņé¼ļ¦ØļźĀņØś Ļ░ÉņåīņÖĆ ņŻ╝ļ│ĆņØĖņŚÉ ļīĆĒĢ£ Ļ░ÉņŚ╝ ņ£äĒŚśņØś Ļ░Éņåī ņÖĖņŚÉļÅä ļ╣äņŚÉņØ┤ņ”ł ĒĢ®ļ│æņ”ØņØś Ļ░ÉņåīņŚÉļÅä ĻĖ░ņŚ¼ĒĢ£ļŗżĻ│Ā ĒīÉļŗ©ļÉ£ļŗż[3]. ņĄ£ĻĘ╝ START ņŚ░ĻĄ¼ņŚÉņä£ļŖö CD4+ 500/╬╝L ņ┤łĻ│╝ņŚÉņä£ņØś ļ╣ĀļźĖ ņ╣śļŻīĻ░Ć 350/╬╝LĻ╣īņ¦Ć ĻĖ░ļŗżļ”░ Ēøä ņ╣śļŻīĒĢśļŖö Ļ▓āņŚÉ ļ╣äĒĢ┤ ņŚÉņØ┤ņ”ł ņŚ░Ļ┤Ć ņé¼Ļ▒┤(event)ņØĆ 0.28ļ░░ ņŚÉņØ┤ņ”ł ļ╣äņŚ░Ļ┤Ć ņé¼Ļ▒┤ņØĆ 0.61ļ░░ Ļ░Éņåīņŗ£Ēé© Ļ▓āņØä ļ│┤ņśĆļŗż[11].
ņŗ¼ĒśłĻ┤ĆĻ│ä ņ¦łĒÖś ļ░Å ņ¦Ćņ¦łņØ┤ņāü
HIV ĒÖśņ×ÉļŖö ņŗ¼ĻĘ╝Ļ▓Įņāēņ”Ø, Ļ│ĀĒśłņĢĢņØä ĒżĒĢ©ĒĢ£ ņŗ¼ĒśłĻ┤ĆĻ│ä ņ¦łĒÖśņØś ļ╣łļÅäĻ░Ć ļ╣äĻ░ÉņŚ╝ņØĖņŚÉ ļ╣äĒĢ┤ ļåÆļŗż[1,12]. ļśÉĒĢ£ ĻĖēņä▒ ņŗ¼ĻĘ╝Ļ▓ĮņāēņØ┤ļéś ļćīņĪĖņżæ Ēøä ņé¼ļ¦ØļźĀņØ┤ HIV Ļ░ÉņŚ╝ņ×ÉņŚÉņä£ ļŹö ļåÆļŗżĻ│Ā ļ│┤Ļ│ĀļÉ£ļŗż[13]. ļé«ņØĆ CD4+ ņłśļŖö ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØś ņ£äĒŚśņØ┤ļŗż[12,14]. HIV Ļ░ÉņŚ╝ņ×ÉņØś ņŗ¼ĒśłĻ┤ĆĻ│ä ņ¦łĒÖśņŚÉ ļīĆĒĢ£ ņ£äĒŚś ņ”ØĻ░ĆņŚÉļŖö ņ¦ĆņåŹĒĢśļŖö ņŚ╝ņ”Ø ļ░śņØæņØ┤ ĒśłĻ┤ĆņØś ļÅÖļ¦źĻ▓ĮĒÖöņØś ņ”ØĻ░Ć ļ░Å plagueņØś ĒīīņŚ┤ņŚÉ ņśüĒ¢źņØä ņŻ╝ļŖö Ļ▓āņ£╝ļĪ£ ņŚ¼Ļ▓©ņ¦äļŗż[15]. ĻĘĖļ¤¼ļ»ĆļĪ£ ņØ┤ ņŚ╝ņ”Ø ļ░śņØæņØä ņżäņØ╝ ņłś ņ׳ļŖö HIV ņ╣śļŻīļŖö ņŗ¼ĒśłĻ┤ĆĻ│ä ņ¦łĒÖśņØś Ļ░Éņåīļź╝ Ļ░ĆņĀĖņś©ļŗż. Abacavir ņ╣śļŻīļŖö D:A:D (Data Collection on Adverse Events of Anti-HIV Drugs) ņŚ░ĻĄ¼ ļō▒ņŚÉņä£ ĻĖēņä▒ ņŗ¼ĻĘ╝Ļ▓ĮņāēņØś ņ£äĒŚśņØä ļåÆņØ┤ļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłĻ│Ā[7], ļŗ©ļ░▒ļČäĒĢ┤ĒÜ©ņåīņ¢ĄņĀ£ņĀ£(protease inhibitor, PI)ļÅä ņØ┤ņÖĆ ņŚ░Ļ┤ĆļÉśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ļŗż[7]. HIV ĒÖśņ×ÉņŚÉņä£ļÅä ņØ╝ļ░śņØĖĻ│╝ Ļ░ÖņØ┤ ņŗ¼ĒśłĻ┤ĆĻ│ä ņ£äĒŚśņØä ņśłņĖĪĒĢśļŖö ļÅäĻĄ¼ļź╝ ņé¼ņÜ®ĒĢ┤ņä£ ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØś ļ░£ņāØ ņ£äĒŚśņØä ņśłņĖĪĒĢĀ ņłś ņ׳ļŗż. ĒØöĒ׳ Framingham ņĀÉņłś ņ▓┤Ļ│äļź╝ ļ¦ÄņØ┤ ņé¼ņÜ®ĒĢśļ®░[16], ĻĘĖ ņÖĖ HIV ĒÖśņ×ÉņŚÉ ļīĆĒĢ£ ņĀäņÜ® ņśłņĖĪ ņĀÉņłśņ▓┤Ļ│äļÅä ņ׳ļŗż[17]. ņŗ¼ĒśłĻ┤ĆĻ│ä ņ¦łĒÖśņØś ņ£äĒŚś ņÜöņåīņŚÉ ļö░ļźĖ ļ╣äņĢĮļ¼╝ņĀü ļ░®ļ▓ĢņØś ļÅÖņøÉ ļ░Å ņ£äĒŚś ņĢĮņĀ£ņØś ĒÜīĒö╝ ļ░Å ĻĄÉņ▓┤ļź╝ ĒÖśņ×É ņ¦äļŻīņŗ£ Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢ£ļŗż[16]. ĻĘĖļ¤¼ļéś HIV Ļ░ÉņŚ╝ņ×ÉņŚÉ ļīĆĒĢ£ aspirin ļō▒ņØ┤ ņĢĮļ¼╝ ņ▓śļ░®ņØĆ Ļ░ÖņØĆ ņ£äĒŚśņŚÉ ņ׳ļŖö ņØ╝ļ░śņØĖņŚÉ ļ╣äĒĢ┤ ņĀüĻ▓ī ņ▓śļ░®ļÉśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā[18] ĻĄŁļé┤ļÅä ņØ┤ņÖĆ ņ£Āņé¼ĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖśņØś ņ£äĒŚśņØä ņżäņØ┤ļŖö ļģĖļĀź ņżæ Ļ░Ćņן ĒÜ©Ļ│╝ņĀüņØ┤Ļ│Ā ņżæņÜöĒĢ£ Ļ▓āņØĆ HIV ĒÖśņ×ÉņŚÉņä£ļÅä ĻĖłņŚ░ņØ┤ļŗż[19].
Ļ│Āņ¦Ćņ¦łĒśłņ”ØņØś ļÅÖļ░śņŗ£ HIV ĒÖśņ×ÉņŚÉņä£ļÅä ļ╣äĻ░ÉņŚ╝ņ×ÉņŚÉņä£ņÖĆ Ļ░ÖņØ┤ ņĪ░ņĀłĒĢśļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢśļŗż(Table 2) [20,21]. ņé¼ņÜ®ļÉśļŖö ņĢĮņĀ£ļĪ£ļŖö statin Ļ│äņŚ┤ņØ┤ ņÜ░ņäĀ ņäĀĒāØļÉ£ļŗż[21]. ņĀĆļ░ĆļÅä ņ¦Ćņ¦łļŗ©ļ░▒ņ¦ł(low-density lipoprotein)ņØä ĻĖ░ņżĆņ£╝ļĪ£ ņ╣śļŻīļź╝ ņŗ£ņ×æĒĢśļŖö Ļ▓ĮņÜ░ pravastatin (20-40 mg ĒĢśļŻ© ĒĢ£ ļ▓ł, ņŗ£ņ×æ ņÜ®ļ¤ē) ļśÉļŖö atorvastatin (10 mg ĒĢśļŻ© ĒĢ£ ļ▓ł, ņŗ£ņ×æ ņÜ®ļ¤ē) ļō▒ņØ┤ ņÜ░ņäĀ ņé¼ņÜ®ļÉśļ®░ simvastatinĻ│╝ lovastatinņØĆ ĻĖłĻĖ░ņØ┤ļŗż[21]. ņ¦Ćņ¦łĻ░ĢĒĢśņĀ£ņØś ņäĀĒāØņŗ£ ņĢĮļ¼╝ ņāüĒśĖņ×æņÜ®ņØä ļ░śļō£ņŗ£ Ļ▓ĆĒåĀĒĢśņŚ¼ņĢ╝ ĒĢśļ®░ PIĻ░Ć ĒŖ╣Ē׳ statin Ļ│äņŚ┤Ļ│╝ ņĢĮļ¼╝ņāüĒśĖņ×æņÜ®ņØ┤ Ēü¼ļŗż[21]. ņżæņä▒ņ¦Ćļ░®ņØ┤ 500 mg/dL ņØ┤ņāüņØ╝ Ļ▓ĮņÜ░ ņ¦Ćņ¦łĻ░ĢĒĢśņĀ£ļŖö fibrate Ļ│äņŚ┤ņØ┤ ņÜ░ņäĀ ņäĀĒāØļÉ£ļŗż[21]. Ļ│Āņ¦Ćņ¦łĒśłņ”ØņØä ņ£ĀļÅäĒĢśļŖö ĒĢŁļĀłĒŖĖļĪ£ļ░öņØ┤ļ¤¼ņŖżņĀ£ļŖö PIĻ░Ć Ļ░Ćņן ņżæņÜöĒĢśļ®░(lopinavir/ritonavir > darunavir/ritonavir ļ░Å atazanavir/ritonavir), non-nucleoside reverse transcriptase inhibitor ņżæņŚÉņä£ļŖö efavirenzĻ░Ć ņŻ╝ņÜö ņ£äĒŚś ņØĖņ×ÉņØ┤ļŗż. Nucleotide reverse-transcriptase inhibitor (NRTI) (stavudine > zidovudine > abacavir)ļōżļÅä Ļ│Āņ¦ĆĒśłņ”ØņØś ņ£äĒŚś ņØĖņ×ÉņØ┤ļŗż[22]. Ēśłņ▓Łņ¦Ćņ¦ł Ļ▓Ćņé¼ļŖö ĒĢŁļĀłĒŖĖļĪ£ļ░öņØ┤ļ¤¼ņŖż ņ╣śļŻī ņĀä ļ░śļō£ņŗ£ ĒĢäņÜöĒĢśļ®░ 6-12Ļ░£ņøö Ļ░äĻ▓®ņ£╝ļĪ£ ņĖĪņĀĢņØ┤ ĻČīņ£ĀļÉ£ļŗż[21]. ņ¦Ćņ¦łĻ░ĢĒĢśņĀ£ ņé¼ņÜ®ņŚÉ ņ¢┤ļĀżņøĆņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ņĢĮļ¼╝ļ│ĆĻ▓ĮņØä Ļ│ĀļĀżĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż[21]. ņ¦Ćņ¦łĻ░ĢĒĢśņĀ£ņØś ņČöĻ░Ć ņé¼ņÜ®Ļ│╝ ņĢĮņĀ£ņØś ļ│ĆĻ▓Į(switch) ņżæ ņ¢┤ļ¢ż ņäĀĒāØņØ┤ ļŹö ņóŗņØĆņ¦ĆļŖö ņל ņĢīļĀżņĀĖ ņ׳ņ¦Ć ņĢŖļŗż.
ņ¦Ćļ░®ņØ┤ņśüņ¢æņ”Ø(lipodystrophy)
ņ¦Ćļ░®ņØ┤ņśüņ¢æņ”ØņØĆ NRTIņÖĆ PIĻ░Ć ļ¦ÄņØ┤ ņŚ░Ļ┤ĆļÉ£ļŗż[23]. ņ¦Ćļ░®ņØ┤ņśüņ¢æņ”ØņØĆ ņŗ¼ĒśłĻ┤ĆĻ│ä ņ¦łĒÖś, Ļ│Āņ¦łĒśłņ”ØĻ│╝ ņŚ░Ļ┤ĆļÉśļ®░ ĒĢŁļĀłļź┤ĒåĀļ░öņØ┤ļ¤¼ņŖżņĀ£ ņé¼ņÜ®ņØś ĻĖ░Ļ░äņØ┤ ĻĖĖņłśļĪØ ņל ļ░£ņāØĒĢ£ļŗż[23,24]. ņ¦Ćļ░®ņØ┤ņśüņ¢æņ”ØņØĆ ņŻ╝ļĪ£ ņ¢╝ĻĄ┤Ļ│╝ ņé¼ņ¦ĆņØś ņ¦Ćļ░®ņ£äņČĢ(lipoatrophy)ņØ┤ ņŻ╝ļÉ£ ļ¼ĖņĀ£ļĪ£ ļéśĒāĆļéśĻ│Ā ņØ╝ļČĆņŚÉņä£ļŖö ļ¬ĖĒåĄĻ│╝ ļ¬®ļŹ£ļ»Ė ļČĆļČäņŚÉ ņ¦Ćļ░®ļ╣äļīĆ(lipohypertrophy)ļĪ£ ļéśĒāĆļéśĻĖ░ļÅä ĒĢ£ļŗż[24]. ņØ┤ļŖö ņéČņØś ņ¦ł(quality of life)ņØś ņĀĆĒĢś ļ░Å ņĢĮņĀ£ ņł£ņØæļÅäņØś ņĀĆĒĢśļź╝ ņØ╝ņ£╝Ēé¼ ņłś ņ׳Ļ│Ā ĒÖśņ×ÉņØś ņÜ░ņÜĖ ļō▒ ņĀĢņŗĀņĀü ļ¼ĖņĀ£ļź╝ ņĢ╝ĻĖ░ĒĢĀ ņłś ņ׳ļŗż[24]. ĒÖśņ×ÉĻ░Ć ņŖżņŖżļĪ£ ņØśĒĢÖņĀü ņ¦ĆņŗØņØ┤ ņŚåņ¢┤ ņØĖņŗØĒĢśņ¦Ć ļ¬╗ĒĢĀ ņłś ņ׳Ļ│Ā ĒåĄņ”ØņØä ļŖÉļü╝ņ¦Ć ņĢŖņ£╝ļ»ĆļĪ£ ņ¦äļŻīĒĢśļŖö ņØśņé¼Ļ░Ć ņØ┤ļź╝ ņØ┤ņĢ╝ĻĖ░ĒĢśņ¦Ć ņĢŖņ£╝ļ®┤ ņ┤łĻĖ░ņŚÉļŖö ņל ļ¬©ļź╝ ņłś ņ׳ļŗż. ņ¦Ćļ░®ņØ┤ņśüņ¢æņ”ØņØĆ ņĀĢļÅäļź╝ 1-4ĻĖ░(grade)ļĪ£ ļéśļłłļŗż[25]. ļé┤Ļ│╝ņĀüņØĖ ņ╣śļŻīļŖö ĒÜ©Ļ│╝ņĀüņØ┤ņ¦Ć ņĢŖĻ│Ā ņČ®ņĀäņĀ£(filler)ņØś ņé¼ņÜ®ņØ┤ ļ»ĖņÜ®ņĀü ļ¬®ņĀüĻ│╝ ņŗ¼ļ”¼ņĀü ņןņĢĀļź╝ ņżäņØ┤ĻĖ░ ņ£äĒĢ┤ ņé¼ņÜ®ļÉĀ ņłś ņ׳ļŗż. ļ│ĖņØĖņØś Ēö╝ĒĢśņ¦Ćļ░®ņØ┤ļéś poly-L-lactic acid ļō▒ņØ┤ ņČ®ņĀäņĀ£ļĪ£ ņé¼ņÜ®ļÉśļéś ņ¢┤ļ¢ż ņČ®ņĀäņĀ£Ļ░Ć ĒÜ©Ļ│╝ņĀüņØĖņ¦Ć ņל ņłśĒ¢ēļÉ£ ņŚ░ĻĄ¼ļŖö ļ¦żņÜ░ ļČĆņĪ▒ĒĢśļŗż[4,26]. ņ¦Ćļ░®ņØ┤ņśüņ¢æņ”ØņØ┤ ļ¦ÄņØ┤ ņ¦äĒ¢ēĒĢ£ ņāüĒā£ņŚÉņä£ ĒĢŁļĀłĒŖĖļĪ£ļ░öņØ┤ļ¤¼ņŖżņĀ£ņØś ļ│ĆĻ▓ĮņØĆ ĒÜ©Ļ│╝Ļ░Ć ņĀüļŗżĻ│Ā ņāØĻ░üļÉ£ļŗż. 1-2ĻĖ░ņŚÉņä£ ņøÉņØĖļÉśļŖö ņĢĮņĀ£ņØś ļ│ĆĻ▓ĮņØ┤ ņØ┤ļŻ©ņ¢┤ņ¦ĆļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢśļŗż. ņ¦Ćļ░®ņØ┤ņśüņ¢æņ”ØņØś ņøÉņØĖņØ┤ ļÉśļŖö ĒĢŁļĀłĒŖĖļĪ£ļ░öņØ┤ļ¤¼ņŖżņĀ£ļŖö zidivudineĻ│╝ stavudineņØ┤ ņżæņÜöĒĢśņśĆņ£╝ļéś[4] ņÜöņ”łņØīņØĆ ĻĘĖ ņé¼ņÜ®ņØ┤ ļ¦żņÜ░ ņżäņŚłļŗż. AbacavirļÅä ņŚ░Ļ┤ĆļÉśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņØ┤ļ®░ PIļÅä ņ£äĒŚś ņĢĮņĀ£ņØ┤ļŗż[4]. ņĢĮņĀ£ļōżņØĆ ņ¦Ćļ░®ņäĖĒżņŚÉ ļīĆĒĢ£ ļ»ĖĒåĀņĮśļō£ļ”¼ņĢä ļÅģņä▒Ļ│╝ ņŚ░Ļ┤ĆļÉśļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż. ĻĘĖļ¤¼ļéś ņ¦Ćļ░®ņØ┤ņśüņ¢æņ”ØņØś ļ░£ņāØĻĖ░ņĀäņØĆ ļ│Ąņ×ĪĒĢśļ®┤ņä£ ļŗżņ¢æĒĢ£ ņØĖņ×ÉĻ░Ć Ļ┤ĆņŚ¼ļÉśļŖö ļō»ĒĢśļŗż[26,27]. ņĄ£ĻĘ╝ņØś ņĢĮņĀ£ļōżņØĆ ņ¦Ćļ░®ņØ┤ņśüņ¢æņ”ØņØś ņ£äĒŚśņØ┤ ļ¦ÄņØ┤ ļé«ņØĆ Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż. NRTIņŚÉ ņØśĒĢ£ ņ¦Ćļ░®ņØ┤ņśüņ¢æņ”ØņØ┤ ņ¦ĆņåŹĒĢśļŖö Ļ▓ĮņÜ░ NRTI ņĀ£ņÖĖ ņĪ░ĒĢ®(NRTI sparing regimen)ņØś ļ│ĄĒĢ® ņ╣śļŻīļź╝ Ļ│ĀļĀżĒĢ┤ ļ│╝ ņłś ņ׳Ļ▓Āļŗż.
ļŗ╣ļć© ļ░Å ņØĖņŖÉļ”░ ņĀĆĒĢŁņä▒
ļŗ╣ļć©Ļ░Ć ņ׳ļŖö HIV ĒÖśņ×ÉļŖö ļŗ╣ļć©ļź╝ ņĢģĒÖöņŗ£Ēé¼ ņłś ņ׳ļŖö HIV ņĢĮļ¼╝ņØś ĒÜīĒö╝Ļ░Ć ĒĢäņÜöĒĢśļ®░ PIņØś ĒÜīĒö╝Ļ░Ć ĒĢäņÜöĒĢśļŗż[28]. ņØ┤ļŖö PIĻ░Ć ņØĖņŖÉļ”░ ņĀĆĒĢŁņä▒ņØä ņ£ĀļÅäĒĢśĻ│Ā ņØĖņŖÉļ”░ ļČäļ╣äļź╝ Ļ░Éņåīņŗ£ĒéżĻĖ░ ļĢīļ¼ĖņØ┤ļŗż[28]. ļŗ╣ļć© ĒÖśņ×ÉņŚÉņä£ ĒØöĒ׳ ļÅÖļ░śļÉśļŖö ņŗĀĻĖ░ļŖź ņןņĢĀĻ░Ć ļÅÖļ░śļÉśņ¢┤ ņ׳ļŖö Ļ▓ĮņÜ░ tenofovir ņé¼ņÜ® ĒÖśņ×ÉņŚÉņä£ ņŗĀĻĖ░ļŖźņØś ņןņĢĀĻ░Ć ļŹö ņל ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż. Tenofovir ļśÉļŖö ņØ┤ ņä▒ļČäņØ┤ ĒżĒĢ©ļÉ£ ļ│ĄĒĢ®ņĀ£ļź╝ ļŗżļźĖ ņĢĮņĀ£ļĪ£ ĻĄÉņ▓┤ĒĢ┤ņĢ╝ ĒĢśļŖöņ¦Ćļź╝ ņČöņĀü ņ¦äļŻīņŗ£ ņŗĀņé¼ĻĄ¼ņ▓┤ ņŚ¼Ļ│╝ņ£©ņØś ļ│ĆĒÖöļź╝ ļ│┤ļ®┤ņä£ ĒīÉļŗ©ĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż. ļŗ╣ļć© ĻĄÉņ£Ī ļ░Å Ēśłļŗ╣ ņĖĪņĀĢ, ņÜ┤ļÅÖ ņÜöļ▓Ģ ļō▒ņŚÉ ļīĆĒĢ£ ĻĄÉņ£ĪņØ┤ ĒĢäņÜöĒĢśļŗż.
Ļ│© ņ¦łĒÖś
HIV ĒÖśņ×ÉņØś Ļ│©ļ░ĆļÅäļŖö ļ╣äĻ░ÉņŚ╝ņ×ÉņŚÉ ļ╣äĒĢ┤ 6.4ļ░░ Ļ░ÉņåīļÉśņ¢┤ ņ׳Ļ│Ā Ļ│©ļŗżĻ│Ąņ”ØņØĆ 3.7ļ░░ ĒØöĒĢśļŗżļŖö ļ®öĒāĆļČäņäØņØ┤ ņ׳ļŗż[29]. Ļ│©ņĀłļÅä 60% ļŹö ĒØöĒĢśļŗżĻ│Ā ļ│┤Ļ│ĀļÉ£ļŗż[30]. ļ╣äĻ░ÉņŚ╝ņ×ÉņŚÉņä£ Ļ│ĀļĀżļÉśļŖö Ļ│©Ļ░Éņåī ļ░Å Ļ│©ļŗżĻ│Ąņ”ØņØś ņ£äĒŚś ņÜöņåīļōż ņÖĖņŚÉ HIV ņ╣śļŻīņĀ£ņÖĆ ņŚ░Ļ┤ĆļÉ£ Ļ│©Ļ░ÉņåīņØś ņ£äĒŚśļÅä ņāØĻ░üĒĢ┤ņĢ╝ ĒĢśļ®░, ĻĘĖ ņĀ£ņĀ£ļĪ£ļŖö PIņÖĆ tenofovirĻ░Ć Ļ┤ĆĻ│äļÉ£ļŗż[29,31]. 50ņäĖ ņØ┤ņāü, ĒÅÉĻ▓Į ļ░Å Ļ│╝Ļ▒░ Ļ│©ņĀł(fragility fracture)ņØś ļ│æļĀźņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ dual-energy X-ray absorptiometry (DXA) Ļ│©ļ░ĆļÅä Ļ▓Ćņé¼ņØś ņŗ£Ē¢ēņØ┤ ĻČīņ£ĀļÉ£ļŗż[32]. T ņĀÉņłśĻ░Ć 2.5 ņØ┤ĒĢśņØ┤Ļ▒░ļéś Ļ│©ņĀłņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ bisphosphateĻ│ä ļ░Å ļŗżļźĖ Ļ│©ļŗżĻ│Ąņ”Ø ņĢĮļ¼╝ņØś ņ▓śļ░®ņØ┤ ĒĢäņÜöĒĢśļŗż. ĻĘĖ ņÖĖ ļ¬©ļōĀ HIV Ļ░ÉņŚ╝ņ×ÉņŚÉņä£ Ļ│©ļŗżĻ│Ąņ”ØņØś ņ£äĒŚś ņÜöņåīļź╝ ņżäņØ┤ļŖö ĻĖłņŚ░, ņÜ┤ļÅÖ ļō▒ņØś ņÜöļ▓ĢļÅä ĻĄÉņ£ĪņØ┤ ĻČīņןļÉ£ļŗż[32]. Ļ│©ņĀłņØś ņ£äĒŚśņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ tenofovirņÖĆ PIļź╝ Ēö╝ĒĢśļŖö Ļ▓āņØ┤ ĻČīņ£ĀļÉ£ļŗż[32]. Ļ│©ļ░ĆļÅä Ļ▓Ćņé¼ļź╝ ĒĢśĻĖ░Ļ░Ć ņ¢┤ļĀżņÜ┤ Ļ▓ĮņÜ░ FRAX ņĀÉņłś(https://www.shef.ac.uk/FRAX/tool.jsp)ļź╝ ņé¼ņÜ®ĒĢśņŚ¼ 10ļģäļé┤ Ļ│©ņĀł ņ£äĒŚśļÅäļź╝ ņĖĪņĀĢĒĢ┤ļ│╝ ņłś ņ׳ļŗż. ĒĢ£ĻĄŁņØĖņŚÉ ļīĆĒĢ£ ĒĢŁļ¬®ļÅä ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņØ┤ ņĀÉņłśņ▓┤Ļ│äļŖö ņĀ£ĒĢ£ļÉ£ ņ£ĀņÜ®ņä▒ņØä Ļ░Ćņ¦äļŗżĻ│Ā ņāØĻ░üļÉśļ®░[33] ĻĄŁļé┤ņØś Ļ▓ĮņÜ░ DXA Ļ│©ļ░ĆļÅä Ļ▓Ćņé¼ļź╝ ņ¦üņĀæ ĒĢśļŖö Ļ▓āņØ┤ ņóŗĻ▓Āļŗż. Ļ│©ņĀł ņ£äĒŚśņØ┤ ņ׳ļŖö ĒÖśņ×É(ĒŖ╣Ē׳ Ļ│ĀļĀ╣ņ×É)ņŚÉĻ▓īļŖö ļéÖņāüņśłļ░®ņŚÉ ļīĆĒĢ£ ĻĄÉņ£ĪņØ┤ ĒĢäņÜöĒĢśļŗż[32].
ņŗĀ ņ¦łĒÖś
ņŗĀ ņ¦łĒÖśņØĆ HIV Ļ░ÉņŚ╝ ņ×Éņ▓┤ņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢĀ ņłś ņ׳Ļ│Ā(ņśł, HIV nephropathy) ļśÉĒĢ£ ļ░öņØ┤ļ¤¼ņŖż Ļ░äņŚ╝Ļ│╝ļÅä ņŚ░Ļ┤ĆļÉĀ ņłś ņ׳ņ¦Ćļ¦ī ņØ┤ļŖö ļō£ļ¼╝ļŗż. ņŗĀĻĖ░ļŖź ņןņĢĀņÖĆ ņŚ░Ļ┤ĆļÉ£ ĒĢŁļĀłĒŖĖļĪ£ļ░öņØ┤ļ¤¼ņŖżņĀ£ļŖö tenofovir disoproxil fumarate (TDF), atazanavir/ritonavir, indinavir ļō▒ņØ┤ļŗż[22,34]. ņ×äņāüņŚÉņä£ Ļ░Ćņן ĒØöĒ׳ ņĀæĒĢśļŖö ņŗĀĻĖ░ļŖźņØś ņןņĢĀļŖö TDFņØś ņé¼ņÜ®Ļ│╝ ļŹöļČłņ¢┤ ļ░£ņāØĒĢśļŖö ņŗĀĻĖ░ļŖźņØś ņØ┤ņāüņØ┤ļŗż[35,36]. ņØ┤ļŖö TDF/emtricitabine ļ│ĄĒĢ®ņĀ£Ļ░Ć Ļ░Ćņן ņÜ░ņäĀ ņČöņ▓£ļÉśļŖö backbone ņĢĮņĀ£ļĪ£ ņĄ£ĻĘ╝ ņłśļģä ņØ┤ņāü ņé¼ņÜ®ļÉśņ¢┤ ņÖöĻ│Ā ņĢäņ¦ü ņČöņ▓£ ņĢĮņĀ£ņØ┤ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. 2015ļģä ļ»ĖĻĄŁņŚÉņä£ ĒŚłĻ░ĆļÉ£ tenofovir alafenamide (TAF)ļŖö TDFņØś ņŗĀĻĖ░ļŖź ļ░Å Ļ│© Ļ░Éņåīļź╝ ļ¦ÄņØ┤ ņżäņØ┤ļŖö Ļ▓āņØ┤ ļ¬ģĒÖĢĒ׳ ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ļŗż[37]. ĻĄŁļé┤ņŚÉņä£ļÅä ņĪ░ļ¦īĻ░ä ņé¼ņÜ®ļÉĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ĻĖ░ļīĆļÉśļ®░ TDFņØś ļīĆļČĆļČäņØ┤ TAFļĪ£ ņ╣śĒÖśļÉĀ Ļ▓āņ£╝ļĪ£ ĻĖ░ļīĆĒĢ£ļŗż[38]. ņĄ£ĻĘ╝ ĒĢŁļĀłĒŖĖļĪ£ļ░öņØ┤ļ¤¼ņŖżņĀ£ņØś boosterļĪ£ ņé¼ņÜ®ļÉśļŖö cobicistatļŖö Ēśłņ▓Ł Ēü¼ļĀłņĢäĒŗ░ļŗīņØś ņ”ØĻ░ĆĻ░Ć Ļ┤Ćņ░░ļÉśņ¦Ćļ¦ī ņŗĀļÅģņä▒ņØĆ ņĢäļŗłļ®░ ņŗĀņןņŚÉņä£ Ēü¼ļĀłņĢäĒŗ░ļŗī ļ░░ņäżņŚÉ ĒĢäņÜöĒĢ£ MATE1 ĒÜ©ņåīņØś ņ¢ĄņĀ£ļĪ£ ņØĖĒĢ£ Ļ▓Ćņé¼ņŗżņĀü ņØ┤ņāüņØ┤ļŗż[22]. ņĢĮņĀ£ ņÖĖņŚÉ ņØ╝ļ░śņØĖļ│┤ļŗż ĒØöĒĢ£ ļ╣łļÅäņØś ļŗ╣ļć©, Ļ│ĀĒśłņĢĢ ļō▒ļÅä ņŗĀĻĖ░ļŖźņØś ņĀĆĒĢśņŚÉ ļ¦żņÜ░ ņżæņÜöĒĢśļ»ĆļĪ£ ņØ┤ņŚÉ ļīĆĒĢ£ ņØ┤ĒĢ┤ņÖĆ ņ╣śļŻīĻ░Ć Ļ░ÖņØ┤ ņØ┤ļŻ©ņ¢┤ņĀĖņĢ╝ ĒĢ£ļŗż. ņ╣śļŻī ņĀä ņÜö Ļ▓Ćņé¼ ļ░Å Ēśłņ▓Ł Ēü¼ļĀłņĢäĒŗ░ļŗī Ļ▓Ćņé¼ Ēøä ņĄ£ņåī 1ļģäņŚÉ 2ĒÜī ņČöņĀü Ļ▓Ćņé¼Ļ░Ć ĒĢäņÜöĒĢśļŗż[34]. ļŗ©ļ░▒ļć©Ļ░Ć 1+ ļéśņśżĻ▒░ļéś ņé¼ĻĄ¼ņ▓┤ņŚ¼Ļ│╝ņ£©ņØ┤ 60 mL/min ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ ņČöĻ░ĆņĀüņØĖ ņĪ░ņé¼Ļ░Ć ĻČīņןļÉ£ļŗż[34].
Ļ░ä ņ¦łĒÖś
HIV ĒÖśņ×ÉļŖö Ļ░ä ĻĖ░ļŖź ņØ┤ņāüņØś ļÅÖļ░śņØ┤ ĒØöĒĢśĻ│Ā ņØ┤ļĪ£ ņØĖĒĢ£ ņé¼ļ¦ØļÅä ļ╣äĻ░ÉņŚ╝ņØĖņŚÉ ļ╣äĒĢ┤ ĒØöĒĢśļŗż[12,39]. ņØ┤ļŖö ļé«ņØĆ CD4+ ņłśņØ╝ņłśļĪØ ĒØöĒĢśļ®░ HIV ņ╣śļŻīņØś ĻĖ░Ļ░äĻ│╝ļŖö Ļ┤ĆĻ│äļÉśņ¦Ć ņĢŖļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉ£ļŗż[39]. ļ░öņØ┤ļ¤¼ņŖż Ļ░äņŚ╝, ņĢīņĮöņś¼ņØśņĪ┤ ļō▒ņØ┤ ņ╣śļŻīļÉśĻ▒░ļéś ņĪ░ņĀłļÉśļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢśļ®░ Ļ░äņŚ╝ņØś ļ░£ņāØņØä ņÜ░ļĀżĒĢ┤ņä£ ņĢĮņĀ£ņØś ņé¼ņÜ®ņØä ļŖ”ņČöļ®┤ ņĢł ļÉ£ļŗż. ļÅäļ”¼ņ¢┤ ļ╣ĀļźĖ ņ╣śļŻīĻ░Ć ļÅäņøĆņØ┤ ļÉ£ļŗżĻ│Ā ņāØĻ░üļÉ£ļŗż[39]. HCV Ļ░ÉņŚ╝ņØś ļÅÖļ░śņØĆ ņé¼ļ¦ØļźĀņØä ņ”ØĻ░Ćņŗ£Ēé©ļŗż[40]. ĒŖ╣Ē׳ HIV Ļ░ÉņŚ╝ņØ┤ ņל ņ╣śļŻīļÉśņ¢┤ ļ░öņØ┤ļ¤¼ņŖżĒśłņ”ØņØ┤ ņĪ░ņĀłļÉśļŖö ņāüĒÖ®ņŚÉņä£ļŖö HCV ļÅÖļ░ś Ļ░ÉņŚ╝ņØ┤ ļ╣äņŚÉņØ┤ņ”ł ĒĢ®ļ│æņ”ØņŚÉ Ļ░Ćņן Ēü¼Ļ▓ī ĻĖ░ņŚ¼ĒĢ£ļŗżĻ│Ā ļ│┤Ļ│ĀļÉ£ļŗż[41]. ņĄ£ĻĘ╝ HCVņŚÉ ļīĆĒĢ£ direct acting antiviral drugņØś ņ×äņāüņŚÉņä£ņØś ņé¼ņÜ®ņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŗż. HCVļź╝ Ļ░Ćņ¦ä HIV ĒÖśņ×ÉņŚÉņä£ņØś ņ╣śļŻī ļ░śņØæņØĆ HIV ļ╣äĻ░ÉņŚ╝ņ×ÉņŚÉ ļ╣äĒĢ┤ ļ¬╗ĒĢśņ¦Ć ņĢŖļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ ņØ┤ņŚÉ ļīĆĒĢ£ ņĀüĻĘ╣ņĀü ņ╣śļŻīļź╝ ĒÖśņ×ÉņÖĆ ņāüņØśĒĢśļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢśļŗż[40].
ņĀĢņŗĀ ņ¦łĒÖś
HIV ĒÖśņ×ÉļōżņØĆ ĒØöĒ׳ ņŗ¼ļ”¼ņĀüņØĖ ŌĆśstigma(ņśżļ¬ģ)ŌĆÖļź╝ Ļ░Ćņ¦Ćļ®░ ĒĢ£ĻĄŁņØĆ ĻĘĖ ņĀĢļÅäĻ░Ć ņäĀņ¦äĻĄŁņŚÉ ļ╣äĒĢ┤ ņŗ¼ĒĢśļŗż. ļé«ņØĆ ņé¼ĒÜīĻ▓ĮņĀ£ņĀü ņāüĒÖ®(low socioeconomic state)ņØ┤ ĒØöĒĢśļ®░ ņĢīņĮöņś¼ņżæļÅģņØ┤ ĒØöĒĢśļŗż. ņĢīņĮöņś¼ņżæļÅģ ļ░Å ņĀĢņŗĀ ņ¦łĒÖśņØĆ ļé«ņØĆ ņł£ņØæļÅäņØś ņ£äĒŚśņØ┤ ļÉ£ļŗż. ņÜ░ņÜĖ(depression)Ļ│╝ ļČłņĢł ņןņĢĀ(anxiety)Ļ░Ć ļśÉĒĢ£ ĒØöĒĢśļŗż. ņÜ░ņÜĖņŚÉ ļīĆĒĢ£ Ļ░äņØ┤ ņäĀļ│ä Ļ▓Ćņé¼Ļ░Ć ļ¬©ļōĀ ĒÖśņ×ÉņŚÉĻ▓ī ĒĢäņÜöĒĢśĻ│Ā[42], ņÜ░ņÜĖņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢśļ®░ ņØ┤ļŖö ņł£ņØæļÅä Ē¢źņāüņŚÉ ņżæņÜöĒĢśļŗż[43]. ņĢĮļ¼╝ņØś ļČĆņ×æņÜ®Ļ│╝ Ļ┤ĆļĀ©ĒĢśņŚ¼ efavirenz ņé¼ņÜ®ņŗ£ ņłśļ®┤ ņןņĢĀļź╝ ļ╣äļĪ»ĒĢ£ ņĀĢņŗĀņĀüņØĖ ļ¼ĖņĀ£ļź╝ ĒØöĒ׳ ņØ╝ņ£╝Ēé©ļŗż[4,22]. HIV ņŚ░Ļ┤Ć ņŗĀĻ▓ĮņØĖņ¦Ć ņןņĢĀ(HIV-associated neurocognitive disorders)ņŚÉ ļīĆĒĢ£ ņŖżĒü¼ļ”¼ļŗØĻ│╝ ĻĄÉņĀĢ Ļ░ĆļŖźĒĢ£ ņÜöņåīņØś ļ░£Ļ▓¼ņØ┤ ĒÖśņ×ÉņØś ņł£ņØæļÅä Ē¢źņāüņØä ņ£äĒĢ┤ ņÜöĻĄ¼ļÉ£ļŗż[44,45].
ņĢģņä▒ ņóģņ¢æ(ņŚÉņØ┤ņ”ł ņ¦Ćņ╣Ł ņ¦łĒÖś ņÖĖ)
HIV ĒÖśņ×ÉņØś ļ╣äņŚÉņØ┤ņ”ł ņŚ░Ļ┤Ć ņĢģņä▒ ņóģņ¢æņØś ņ£äĒŚśņ£╝ļĪ£ ņżæņÜöĒĢ£ Ļ▓āņØĆ ĒØĪņŚ░Ļ│╝ ņĢöņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŖö ļ░öņØ┤ļ¤¼ņŖż(HCV, BĒśĢ Ļ░äņŚ╝ ļ░öņØ┤ļ¤¼ņŖż, ņØĖņ£ĀļæÉņóģļ░öņØ┤ļ¤¼ņŖż) Ļ░ÉņŚ╝ņØ┤ļŗż[46]. HIV ņ╣śļŻīļŖö Ēü░ ņĮöĒśĖĒŖĖ Ļ┤Ćņ░░ ņŚ░ĻĄ¼ņŚÉņä£ HIV ņŚ░Ļ┤Ć ņĢöĻ│╝ ļ╣äņŚÉņØ┤ņ”ł ņŚ░Ļ┤Ć ņĢģņä▒ ņóģņ¢æņØś ļ╣łļÅäļź╝ ņżäņśĆļŗżĻ│Ā ļ│┤Ļ│ĀļÉ£ļŗż[47]. ĒĢŁļĀłĒŖĖļĪ£ļ░öņØ┤ļ¤¼ņŖżņØś ļģĖņČ£Ļ│╝ ĻĘĖ ĻĖ░Ļ░äņØĆ ņĢöņØś ļ░£ņāØĻ│╝ ņŚ░Ļ┤ĆļÉśņ¦Ć ņĢŖļŖö Ļ▓āņ£╝ļĪ£ ļ│┤ņØĖļŗż[48]. ļ░öņØ┤ļ¤¼ņŖżņØś ņ¦ĆņåŹņĀü ņ¢ĄņĀ£ņÖĆ ļ®┤ņŚŁņØś ĒÜīļ│ĄņØ┤ ņĢöņØś ļ░£ņāØņØä ņżäņØ┤ļŖöļŹ░ ņżæņÜöĒĢśļ®░ ĻĖłņŚ░ ļō▒ ņĀäĒåĄņĀüņØĖ ņĢö ņśłļ░® ņłśņ╣ÖņØś ņżĆņłś ļ░Å ņŻ╝ĻĖ░ņĀü Ļ▓Ćņ¦ä ļśÉĒĢ£ ņżæņÜöĒĢśļŗż.
ņä▒ ĻĖ░ļŖź ņןņĢĀ
HIV ĒÖśņ×ÉļŖö ņä▒ĒśĖļź┤ļ¬¼ ņןņĢĀĻ░Ć ĒØöĒĢśļŗż[49]. ļ░£ĻĖ░ļČĆņĀäņØĆ ļé©ņä▒ņŚÉņä£ ļé«ņØĆ CD4+ ņłśņŚÉņä£ ĒØöĒ׳ ļÅÖļ░śļÉśļ®░ ĒĢŁļĀłĒŖĖļĪ£ļ░öņØ┤ļ¤¼ņŖżņĀ£Ļ░Ć ņØ┤ņŚÉ ļīĆĒĢ£ ņ£äĒŚś ņÜöņØĖņØ┤ ļÉśļŖö ņĢĮņĀ£ļŖö PIņØ┤ļŗż[50,51]. ĒØöĒ׳ Ļ░äĻ│╝ļÉśļŖö ņä▒ ĻĖ░ļŖź ņןņĢĀļŖö ĒÖśņ×ÉņŚÉĻ▓ī ņĀüĻĘ╣ņĀü ņ¦łļ¼ĖņØä ĒåĄĒĢ£ ĒīīņĢģĻ│╝ ļé©ņä▒ņØśĒĢÖņŚÉņØś ĒśæņØś ņ¦äļŻīĻ░Ć ĒĢäņÜöĒĢśļŗż.
Ļ▓░ ļĪĀ
ņŗ¼ĒśłĻ┤ĆĻ│ä ņ¦łĒÖś, ņ¦Ćļ░®ņØ┤ņśüņ¢æņ”Ø, ļŗ╣ļć©, Ļ│© ņ¦łĒÖś, ņŗĀ ņ¦łĒÖś, Ļ░ä ņ¦łĒÖś, ņĀĢņŗĀ ņ¦łĒÖś ļ░Å ņŚÉņØ┤ņ”ł ņ¦Ćņ╣Ł ņ¦łĒÖś ņÖĖņØś ņĢģņä▒ ņóģņ¢æ, ņä▒ ĻĖ░ļŖź ņןņĢĀ ļō▒ņØś ļ╣äņŚÉņØ┤ņ”ł ĒĢ®ļ│æņ”ØņØĆ HIV ĒÖśņ×ÉņØś ņé¼ļ¦ØņŚÉ ņŚÉņØ┤ņ”ł ņŚ░Ļ┤Ć ņé¼ļ¦Øļ│┤ļŗż ņĢĮ 4ļ░░ ņĀĢļÅä ĒØöĒĢśļŗż. ņĄ£ĻĘ╝ņØś ļ╣ĀļźĖ ņ╣śļŻīļŖö HIV Ļ░ÉņŚ╝ ņ×Éņ▓┤ņÖĆ ņŻ╝ļ│ĆņØĖņŚÉ ļīĆĒĢ£ ņśłļ░® ĒÜ©Ļ│╝ ņÖĖņŚÉļÅä ļ╣äņŚÉņØ┤ņ”ł ĒĢ®ļ│æņ”ØļÅä ņżäņŚ¼ņżĆļŗż. ļ╣äņŚÉņØ┤ņ”ł ĒĢ®ļ│æņ”ØņØĆ ĻĖłņŚ░, ņÜ┤ļÅÖ ļō▒Ļ│╝ Ļ░ÖņØĆ ņāØĒÖ£ņŖĄĻ┤ĆņØś ļ│ĆĒÖöĻ░Ć ĒĢäņÜöĒĢśļŗż. ņé¼ņÜ®ĒĢśļŖö ĒĢŁļĀłĒŖĖļĪ£ļ░öņØ┤ļ¤¼ņŖż ņĢĮņĀ£Ļ░Ć ņ£äĒŚś ņÜöņåīĻ░Ć ļÉĀ ņłś ņ׳ļŗż. Ļ░ü ļ╣äņŚÉņØ┤ņ”ł ĒĢ®ļ│æņ”ØņŚÉ ļīĆĒĢ£ ņ£äĒŚśņÜöņåīĻ░Ć ļÉśļŖö ĒĢŁļĀłĒŖĖļĪ£ļ░öņØ┤ļ¤¼ņŖżļź╝ ņĢīĻ│Ā ĒĢäņÜöņŗ£ ņĢĮņĀ£ņØś ļ│ĆĻ▓ĮņØä ĻŠĆĒĢśļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢśļŗż. ņĄ£ĻĘ╝ Ļ░£ļ░£ļÉśņ¢┤ ņé¼ņÜ®ļÉśļŖö ņĢĮņĀ£ļōżņØĆ ļ╣äņŚÉņØ┤ņ”ł ĒĢ®ļ│æņ”ØņØś ļ╣łļÅäļŖö ņżäņ¢┤ļōĀ Ļ▓āņØ┤ ļ¦Äņ£╝ļéś ĻĘĖ Ļ┤Ćņ░░ ĻĖ░Ļ░äņØ┤ ņ¦¦ņĢä ņןĻĖ░ ņ×ÉļŻīļź╝ ņ¦Ćņ╝£ļ│╝ ĒĢäņÜöĻ░Ć ņ׳ļŗż. HIV ĒÖśņ×ÉņØś ļ╣äņŚÉņØ┤ņ”ł ĒĢ®ļ│æņ”ØņØĆ ņ╣śļŻīņØś ļ░£ņĀäĻ│╝ Ļ│ĀļĀ╣ĒÖöņÖĆ ļŹöļČłņ¢┤ ļŹöņÜ▒ ņżæņÜöĒĢśĻ▓ī ļÉĀ Ļ▓āņØ┤ļŗż.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






