ņä£ ļĪĀ
Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØĆ Ēøäļ│Ąļ¦ēĻ░Ģ ļé┤ņØś ĻĄ¼ņĪ░ļ¼╝ ļ░Å ņŚ░ļČĆņĪ░ņ¦üņŚÉņä£ ļ╣äņĀĢņāüņĀüņØĖ ņŚ╝ņ”Øņä▒ ņä¼ņ£ĀĒÖöĻ░Ć ņ¦äĒ¢ēļÉśļŖö ņ¦łĒÖśņ£╝ļĪ£, 1905ļģäņŚÉ ņ▓śņØīņ£╝ļĪ£ Ēöäļ×æņŖż ļ╣äļć©ĻĖ░Ļ│╝ņØśņé¼ņØĖ AlbaranņØ┤ ĻĖ░ņłĀĒĢśņśĆĻ│Ā, 1948ļģäņŚÉ OrmondņŚÉ ņØśĒĢ┤ ļæÉ ņ”ØļĪĆĻ░Ć ņśüļ¼Ėņ£╝ļĪ£ ņ▓śņØīņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśļ®┤ņä£ ļÅģļ”ĮļÉ£ ņ¦łĒÖśņ£╝ļĪ£ ļČäļźśļÉśņŚłļŗż[1]. Ēøäļ│Ąļ¦ēĻ░ĢņØś ņŚ░ļČĆņĪ░ņ¦üņŚÉņä£ ļ╣äĒŖ╣ņØ┤ņĀüņØĖ ņŚ╝ņ”Øņä▒ ņä¼ņ£ĀĒÖöĻ░Ć ņ¦äĒ¢ēļÉśļŖö ņ¦łĒÖśņ£╝ļĪ£ ņŻ╝ļĪ£ ņŗĀņןļ│┤ļŗż ņĢäļל ņ£äņ╣śĒĢśļŖö ļ│ĄļČĆļīĆļÅÖļ¦źņØ┤ļéś ņןĻ│©ļÅÖļ¦ź ĻĘ╝ņ▓śņŚÉņä£ ļ░£ĒśäļÉśļ®░, ņØĖņĀæ ĻĖ░Ļ┤ĆņØĖ ņÜöĻ┤Ć, ĒĢśļīĆņĀĢļ¦ź ļō▒ņØä ņ╣©ļ▓öĒĢśņŚ¼ ņóģņ¢æ ĒÜ©Ļ│╝ļĪ£ ņØĖĒĢ£ ņĢĢļ░Ģņ”ØĒøäĻĄ░ņØś ņ”ØņāüņØä ļéśĒāĆļéĖļŗż[2].
ņĢĮ 2/3ņØś ĒÖśņ×ÉņŚÉņä£ļŖö ĻĖ░ņĀĆņØś ņøÉņØĖ ņŚåņØ┤ ĒŖ╣ļ░£ņä▒ņ£╝ļĪ£ ļ░£ņāØĒĢśņ¦Ćļ¦ī, ļéśļ©Ėņ¦Ć 1/3ņØś ĒÖśņ×ÉņŚÉņä£ļŖö ņóģņ¢æ, Ļ░ÉņŚ╝, ņÖĖņāü, ļ░®ņé¼ņäĀ ņ╣śļŻī, ņłśņłĀ, ņĢĮļ¼╝ņäŁņĘ©, ņäØļ®┤ ļō▒ņŚÉ ļīĆĒĢ£ ļģĖņČ£ ļō▒ņŚÉ ņØśĒĢ┤ ņØ┤ņ░©ņĀüņ£╝ļĪ£ ļéśĒāĆļéśĻ▓ī ļÉ£ļŗż[1]. Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņŚÉ ļīĆĒĢ┤ ņĢäņ¦üĻ╣īņ¦Ć ĒÖĢļ”ĮļÉ£ ļČäļźś ĻĖ░ņżĆņØĆ ņŚåņ£╝ļéś, ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņØ┤ļéś ņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāüĻ│╝ Ļ░ÖņØĆ ņśüņāüĒĢÖņĀü Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ┤ ļ│ĄļČĆ ļīĆļÅÖļ¦ź ņŻ╝ņ£äņŚÉņä£ ĻĘĀņØ╝ĒĢśĻ▓ī ņ”ØĻ░ĢļÉśļŖö ņŚ░ļČĆņĪ░ņ¦üņØś ņØīņśüņØä Ļ░Ćņ¦ĆļŖö ņóģĻ┤┤Ļ░Ć ĒÖĢņØĖļÉśļ®┤ ņ¦äļŗ©ņØä ļé┤ļ”┤ ņłś ņ׳ļŗż. ļŗżļ¦ī, ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØä ņ¦äļŗ©ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö ņĢ×ņä£ ņ¢ĖĻĖēļÉ£ ņØ┤ņ░©ņĀüņØĖ ņøÉņØĖļōżņØä Ļ░Éļ│äĒĢśĻĖ░ ņ£äĒĢ£ ņäĀļ│ä Ļ▓Ćņé¼Ļ░Ć ļ░śļō£ņŗ£ ņäĀĒ¢ēļÉśņ¢┤ņĢ╝ ĒĢśļ®░, ĒŖ╣Ē׳ ņøÉļ░£ņĢöņØ┤ļéś ņĀäņØ┤ņĢöĻ│╝ Ļ░ÖņØĆ ņĢģņä▒ņóģņ¢æņØä ļ░░ņĀ£ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö Ēøäļ│Ąļ¦ēĻ░ĢņŚÉ ļīĆĒĢ£ ņĪ░ņ¦üĻ▓Ćņé¼Ļ░Ć ĒĢäņÜöĒĢśĻĖ░ļÅä ĒĢśļŗż[3].
ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØĆ ļō£ļ¼╝Ļ▓ī ņ×ÉĻ░Ćļ®┤ņŚŁ Ļ░æņāüņāśņŚ╝, ņ×ÉĻ░Ćļ®┤ņŚŁ ņĘīņןņŚ╝, ļźśļ¦łĒŗ░ņŖżĻ┤ĆņĀłņŚ╝, Ļ░Ģņ¦üņä▒ ņ▓ÖņČöņŚ╝, ĒśłĻ┤ĆņŚ╝, ņĀäņŗĀĒÖŹļ░śļŻ©ĒæĖņŖż, ņć╝ĻĘĖļĀīņ”ØĒøäĻĄ░, ņøÉļ░£ņä▒ ļŗ┤ņ”Öņä▒ Ļ░äĻ▓Įļ│ĆĻ│╝ Ļ░ÖņØĆ ņ×ÉĻ░Ćļ®┤ņŚŁņ¦łĒÖśĻ│╝ ļÅÖļ░śļÉśņ¢┤ ļéśĒāĆļéśĻĖ░ļÅä ĒĢ£ļŗż[4,5]. ĒĢ┤ņÖĖņŚÉņä£ļŖö ņĀäņŗĀĒÖŹļ░śļŻ©ĒæĖņŖżņÖĆ ļÅÖļ░śļÉ£ ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņŚÉ ļīĆĒĢ£ ļ│┤Ļ│ĀĻ░Ć ņ׳ņŚłņ£╝ļéś[6], ņĢäņ¦üĻ╣īņ¦Ć ĻĄŁļé┤ņŚÉļŖö ļ│┤Ļ│ĀĻ░Ć ņŚåļŗż. ņĀĆņ×ÉļōżņØĆ ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”Øņ£╝ļĪ£ ļ░£ĒśäĒĢ£ ņĀäņŗĀĒÖŹļ░śļŻ©ĒæĖņŖżļź╝ ņä▒Ļ│ĄņĀüņ£╝ļĪ£ ņ╣śļŻīĒĢ£ ņśłļź╝ Ļ▓ĮĒŚśĒĢśņśĆĻĖ░ņŚÉ ļ¼ĖĒŚīĻ│Āņ░░Ļ│╝ ĒĢ©Ļ╗ś ļ│┤Ļ│ĀĒĢśļŖö ļ░öņØ┤ļŗż.
ņ”Ø ļĪĆ
ĒÖś ņ×É: ļé©ņ×É, 44ņäĖ
ņŻ╝ ņåī: ņ¢æņĖĪ ņśåĻĄ¼ļ”¼ ĒåĄņ”Ø
Ēśäļ│æļĀź: 2ņŻ╝ ņĀäļČĆĒä░ ņ¢æņĖĪ ņśåĻĄ¼ļ”¼ ĒåĄņ”ØĻ│╝ ļ│ĄĒåĄ ļ░Å ļ░£ņŚ┤, ļ░░ļć©ņ¦ĆņŚ░, ņ×öļć©Ļ░É ļō▒ņØś ņ”ØņāüņØ┤ ļ░£ņāØĒĢśņśĆĻ│Ā, ļé┤ņøÉ ļŗ╣ņØ╝ ņ”ØņāüņØ┤ ņĢģĒÖöļÉśņ¢┤ ļ│ĖņøÉ ņØæĻĖēņŗżņŚÉ ļ░®ļ¼ĖĒĢśņśĆļŗż. ļ░£ņŚ┤ņØś ĒÅēĻ░Ć ļ░Å ĒåĄņ”ØņĪ░ņĀłņØä ņ£äĒĢ┤ņä£ Ļ░ÉņŚ╝ļé┤Ļ│╝ņŚÉ ņ×ģņøÉĒĢśņśĆļŗż. ņ×ģņøÉ ņżæ ņŗ£Ē¢ēĒĢ£ ļ│ĄļČĆ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ņŗĀņןĒĢśļČĆ ļ│ĄļČĆļīĆļÅÖļ¦źņØä ļæśļ¤¼ņŗ╝ ļČłĻĘ£ņ╣ÖĒĢ£ ņŚ░ņĪ░ņ¦ü ņóģņ¢æņØś ņåīĻ▓¼ņØ┤ ļ│┤ņŚ¼ ņ┤łĻĖ░ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”Øņ£╝ļĪ£ ņøÉņØĖĻ░Éļ│äņØä ņ£äĒĢ┤ņä£ ļźśļ¦łĒŗ░ņŖżļé┤Ļ│╝ņŚÉ ņØśļó░ļÉśņŚłļŗż. ĒÖśņ×ÉļŖö ĻĄ¼Ļ░Ģ ļ░Å ņä▒ĻĖ░ļČĆ ĻČżņ¢æ, Ēö╝ļČĆ ļ░£ņ¦ä, ļĀłņØ┤ļģĖĒśäņāü, Ļ┤æĻ│╝ļ»╝ņ”Ø, ņŚ╝ņ”Øņä▒ ņÜöĒåĄ ļ░Å ļČĆņ░®ļČĆņŚ╝, ĻĄ¼Ļ░Ģ ļ░Å ņĢłĻĄ¼Ļ▒┤ņĪ░ņ”Ø ļō▒ņØś ņ”ØņāüņØä Ļ▓ĮĒŚśĒĢ£ ļ░ö ņŚåņŚłļŗż. ĒśłņĢĪņØæĻ│Ā Ļ▓Ćņé¼ņŚÉņä£ ĒÖ£ņä▒ĒÖö ļČĆļČä ĒŖĖļĪ¼ļ│┤ĒöīļØ╝ņŖżĒŗ┤ ņŗ£Ļ░ä(activated partial thromboplastin time)ņØ┤ 63.1ņ┤łļĪ£ ņŚ░ņןļÉśņ¢┤ ņ׳ņ¢┤ mixing testļź╝ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļéś ĻĄÉņĀĢļÉśņ¦Ć ņĢŖņĢśļŗż. Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØś ņøÉņØĖņ£╝ļĪ£ ņ×ÉĻ░Ćļ®┤ņŚŁņ¦łĒÖśņŚÉ ļīĆĒĢ£ ņøÉņØĖĻ░Éļ│äņØä ņ£äĒĢ┤ņä£ ĒĢŁĒĢĄĒĢŁņ▓┤ņÖĆ ļźśļ¦łĒŗ░ņŖżņØĖņ×É ļ░Å ĒĢŁņØĖņ¦Ćņ¦łĒĢŁņ▓┤ ļō▒ņØś ĒśłņĢĪ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗż. ņØ╝ņŻ╝ņØ╝Ļ░äņØś Ļ▓ĮĒŚśņĀü ĒĢŁņāØņĀ£ Ēł¼ņŚ¼ņÖĆ ļ│┤ņĪ┤ņĀüņØĖ ņłśņĢĪ ņ╣śļŻīļź╝ ĒĢśļ®┤ņä£ ļ░£ņŚ┤Ļ│╝ ņśåĻĄ¼ļ”¼ ĒåĄņ”Ø ļō▒ņØś ņ”ØņāüņØĆ ņä£ņä£Ē׳ ĒśĖņĀäļÉśļŖö Ļ▓ĮĻ│╝ļź╝ ļ│┤ņśĆņ£╝ļéś ņ”ØņāüņØĆ ļé©ņĢäņ׳ļŖö ņāüĒā£ļĪ£, ĒÖśņ×ÉņØś Ļ░£ņØĖņé¼ņĀĢņ£╝ļĪ£ ņĪ░ĻĖ░ Ēć┤ņøÉņØä ņøÉĒĢśņŚ¼ ņČöĻ░Ć Ļ▓Ćņé¼ Ļ▓░Ļ│╝ ĒÖĢņØĖ ļ░Å ņ╣śļŻīļŖö Ēć┤ņøÉ Ēøä ņÖĖļלņŚÉņä£ ņ¦äĒ¢ēĒĢśĻĖ░ļĪ£ ĒĢśņśĆļŗż.
Ļ│╝Ļ▒░ļĀź: ņłśņłĀņØ┤ļéś ņÖĖņāüņØä ĒżĒĢ©ĒĢ£ ĒŖ╣ņØ┤ļ│æļĀźņØĆ ņŚåņŚłĻ│Ā ĒÅēņåīņŚÉ ļ│ĄņÜ®ĒĢśĻ│Ā ņ׳ļŖö ņĢĮļ¼╝ļÅä ņŚåņŚłļŗż.
Ļ░ĆņĪ▒ļĀź: ĒŖ╣ņØ┤ ņé¼ĒĢŁ ņŚåņØī
ņé¼ĒÜīļĀź: ĒØĪņŚ░ņØä ĒĢśņ¦Ć ņĢŖņĢśĻ│Ā ņäØļ®┤ņŚÉ ļīĆĒĢ£ ļģĖņČ£ļĀźļÅä ņŚåņŚłļŗż.
ņŗĀņ▓┤Ļ▓Ćņé¼ ņåīĻ▓¼: ļé┤ņøÉ ļŗ╣ņŗ£ ĒśłņĢĢņØĆ 120/90 mmHg, ļ¦źļ░ĢņØĆ 90ĒÜī/ļČä, ĒśĖĒØĪņłś 20ĒÜī/ļČä, ņ▓┤ņś© 38.4ŌäāņśĆļŗż. ņ▓┤ņżæņØĆ 67.6 kgņØ┤ņŚłņ£╝ļ®░ ņŗĀņןņØĆ 172.4 cmņśĆļŗż. Ļ▓ĮļČĆ, ĒØēļČĆ ļ░Å Ēö╝ļČĆ ņ¦äņ░░ņŚÉņä£ ĒŖ╣ņØ┤ĒĢ£ ņØ┤ņāüņåīĻ▓¼ņØĆ ņŚåņŚłļŗż. ĒĢśļ│ĄļČĆņŚÉ ļ»ĖņĢĮĒĢ£ ņĢĢĒåĄņØ┤ ņ׳ņŚłņ£╝ļéś ļ░śļ░£ņĢĢĒåĄĻ│╝ ļŖæĻ│©ņ▓ÖņČöĻ░üņĢĢĒåĄņØĆ ņŚåņŚłļŗż.
Ļ▓Ćņé¼ņŗż ņåīĻ▓¼: ļ¦Éņ┤łĒśłņĢĪ Ļ▓Ćņé¼ņŚÉņä£ ļ░▒ĒśłĻĄ¼ 9,160/mm3(ĒśĖņżæĻĄ¼ 81.3%, ļ”╝ĒöäĻĄ¼ 9.1%, ļŗ©ĒĢĄĻĄ¼ 6.4%, ĒśĖņé░ĻĄ¼ 0.6%), Ēśłņāēņåī 13.4 g/dL, ĒŚżļ¦łĒåĀĒü¼ļ”¼ĒŖĖ 37.2%, ĒśłņåīĒīÉ 365,000/mm3 ņśĆļŗż. Ēśłņ▓ŁņāØĒÖöĒĢÖ Ļ▓Ćņé¼ņŚÉņä£ ņŗĀņן ļ░Å Ļ░äĻĖ░ļŖź Ļ▓Ćņé¼ļŖö ņĀĢņāüņØ┤ņŚłĻ│Ā, ņÜö Ļ▓Ćņé¼ņŚÉņä£ ĒŖ╣ņØ┤ņåīĻ▓¼ņØĆ ņŚåņŚłļŗż. ņĀüĒśłĻĄ¼ ņ╣©Ļ░Ģ ņåŹļÅäļŖö 27 mm/hr (ņĀĢņāü ļ▓öņ£ä 0-20 mm/hr), C-ļ░śņØæņä▒ļŗ©ļ░▒ņØĆ 181.6 mg/L (ņĀĢņāü ļ▓öņ£ä 0-5.0 mg/L)ļĪ£ ņ”ØĻ░Ć ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż. ļ®┤ņŚŁĒśłņ▓Ł Ļ▓Ćņé¼ņŚÉņä£ ĒĢŁĒĢĄĒĢŁņ▓┤ņØś ņŚŁĻ░ĆļŖö >1:1280 (speckled pattern)ņ£╝ļĪ£ Ļ░Ģņ¢æņä▒ņØ┤ņŚłĻ│Ā, ĒĢŁdsDNA IgG ĒĢŁņ▓┤ 39.8 IU/mL (ņĀĢņāü ļ▓öņ£ä 0-9 IU/mL), ĒĢŁSm ĒĢŁņ▓┤ 55.9 U/mL (ņĀĢņāü ļ▓öņ£ä 0-6 U/mL), ĒĢŁņ╣┤ļööņśżļ”¼ĒĢĆ IgG ĒĢŁņ▓┤ 40.4 GPL/mL (ņĀĢņāü ļ▓öņ£ä 0-9 GPL/mL), ĒĢŁ├¤2GPI IgG ĒĢŁņ▓┤ 28.0 U/mL (ņĀĢņāü ļ▓öņ£ä 0-6 U/mL), ĒĢŁRo ĒĢŁņ▓┤ 32.9 U/mL (ņĀĢņāü ļ▓öņ£ä 0-6 U/mL)ļĪ£ ļ¬©ļæÉ ņ¢æņä▒ ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż. ļźśļ¦łĒŗ░ņŖżņØĖņ×ÉļŖö ņØīņä▒ņØ┤ņŚłĻ│Ā C3 102.0 mg/dL (ņĀĢņāü ļ▓öņ£ä 79-152 mg/dL), C4 36.9 mg/dL (ņĀĢņāü ļ▓öņ£ä 16-38 mg/dL)ļĪ£ ņĀĢņāüņØ┤ņŚłļŗż. Direct CoombŌĆÖs testļŖö ņ¢æņä▒ņØ┤ņŚłņ£╝ļ®░ Ēśłņ▓Ł IgG4ļŖö 40.6 mg/dL (ņĀĢņāü ļ▓öņ£ä 3.9-86.4 mg/dL)ļĪ£ ņĀĢņāü ļ▓öņ£äņśĆļŗż.
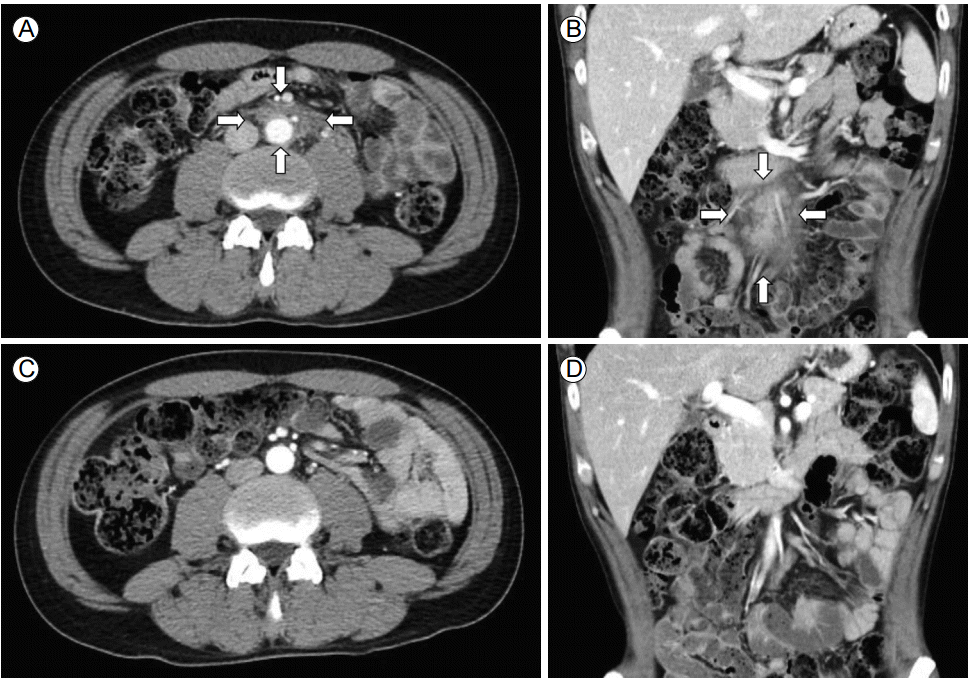
ĒØēļČĆ ļ░Å ļ│ĄļČĆ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü ņåīĻ▓¼: ļ│ĄļČĆ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ņŗĀņןĒĢśļČĆ ļ│ĄļČĆļīĆļÅÖļ¦źņØä ļæśļ¤¼ņŗ╝ ņŚ░ļČĆņĪ░ņ¦üņØś ļČłĻĘ£ņ╣ÖĒĢ£ ņØīņśü ņ”ØĻ░Ć ņåīĻ▓¼ņØ┤ horizontal view (Fig. 1A)ņÖĆ coronal view (Fig. 1B)ņŚÉņä£ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļéś ņÜöĒÅÉņāēņØś ņåīĻ▓¼ņØĆ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. ĒØēļČĆņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ Ļ░ÉņŚ╝ņØ┤ļéś ņĢģņä▒ņóģņ¢æ ļō▒ņØä ĒżĒĢ©ĒĢ£ ĒŖ╣ņØ┤ņåīĻ▓¼ņØĆ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż.
ļ░░ņ¢æ Ļ▓Ćņé¼: ļ░£ņŚ┤ņŗ£ ņŗ£Ē¢ēĒĢ£ ĒśłņĢĪĻ│╝ Ļ░Øļŗ┤ ļ░Å ņåīļ│Ć Ļ▓Ćņé¼ņŚÉņä£ ļÅÖņĀĢļÉ£ ĻĘĀņØĆ ņŚåņŚłņ£╝ļ®░ Ļ░Øļŗ┤ņØś ĒĢŁņé░ĻĘĀ ņŚ╝ņāē ļ░Å Ļ▓░ĒĢĄĻĘĀņŚÉ ļīĆĒĢ£ ĒŖ╣ņØ┤ ņżæĒĢ®ĒÜ©ņåīņŚ░ņćäļ░śņØæ Ļ▓Ćņé¼ ļ¬©ļæÉ ņØīņä▒ņØ┤ņŚłļŗż.
ņ╣śļŻī ļ░Å Ļ▓ĮĻ│╝: Ēć┤ņøÉ 2ņŻ╝ ļÆż Ļ░æņ×ÉĻĖ░ ļ░£ņāØĒĢ£ ņĀäņŗĀņØś ņŗ¼ĒĢ£ ņĀĆļ”╝ ņ”Øņāüņ£╝ļĪ£ ņØĖĻĘ╝ļīĆĒĢÖļ│æņøÉ ņØæĻĖēņŗżņŚÉņä£ ņĢĮļ¼╝ ņ╣śļŻīļź╝ ļ░øņĢśņ£╝ļéś ņ”ØņāüņØś ĒśĖņĀä ņŚåņØ┤ ļŗżņØīļéĀ ļ│ĖņøÉ ļźśļ¦łĒŗ░ņŖżļé┤Ļ│╝ ņÖĖļלņŚÉ ļ░®ļ¼ĖĒĢśņśĆļŗż. ĒåĄņ”ØņĪ░ņĀł ļ░Å ņøÉņØĖĻ░Éļ│äņØä ņ£äĒĢśņŚ¼ ņ×ģņøÉĒĢśņśĆĻ│Ā ļŗ╣ņŗ£ ĒśłņĢĢņØĆ 110/80 mmHg, ļ¦źļ░ĢņØĆ 76ĒÜī/ļČä, ĒśĖĒØĪņłś 20ĒÜī/ļČä, ņ▓┤ņś© 38.2ŌäāņśĆĻ│Ā ņØśņŗØņØĆ ļ¬ģļŻīĒĢśņśĆņ£╝ļ®░ ņŗĀĻ▓ĮĒĢÖņĀü ņ¦äņ░░ņŚÉņä£ Ļ░ÉĻ░ü ĻĖ░ļŖźņØ┤ļéś ņÜ┤ļÅÖ ĻĖ░ļŖź ļ¬©ļæÉ ņĀĢņāüņØ┤ņŚłļŗż. ĒśłņĢĪ Ļ▓Ćņé¼ņŚÉņä£ ļ░▒ĒśłĻĄ¼ 2,420/mm3(ĒśĖņżæĻĄ¼ 68.5%, ļ”╝ĒöäĻĄ¼ 24.5%, ļŗ©ĒĢĄĻĄ¼ 2.7%, ĒśĖņé░ĻĄ¼ 0.6%), Ēśłņāēņåī 9.9 g/dL, ĒŚżļ¦łĒåĀĒü¼ļ”¼ĒŖĖ 28.5%, ĒśłņåīĒīÉ 403,000/mm3ņ£╝ļĪ£ ļ░▒ĒśłĻĄ¼ņÖĆ ĒśłņāēņåīņØś Ļ░Éņåī ņåīĻ▓¼ņØ┤ ņ׳ņŚłņ£╝ļéś haptoglobinĻ│╝ Ēśłņן ĒŚżļ¬©ĻĖĆļĪ£ļ╣ł ļ░Å Ļ░äĻĖ░ļŖź Ļ▓Ćņé¼ ļō▒ņØĆ ņĀĢņāüņØ┤ņŚłĻ│Ā ļ¦Éņ┤łĒśłņĢĪļÅäļ¦É Ļ▓Ćņé¼ņŚÉņä£ļÅä ņÜ®Ēśłņä▒ ļ╣łĒśłņØś ņåīĻ▓¼ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. C3 58.2 mg/dL (ņĀĢņāü ļ▓öņ£ä 79-152 mg/dL), C4 11.6 mg/dL (ņĀĢņāü ļ▓öņ£ä 16-38 mg/dL)ļĪ£ 3ņŻ╝ ņĀäņŚÉ ņĀĢņāüņØ┤ņŚłļŹś ļ│┤ņ▓┤ņØś Ļ░ÉņåīļÅä Ļ┤Ćņ░░ļÉśņŚłļŗż. ņØ┤ņāüņØś Ļ▓Ćņé¼ņŚÉņä£ ļ░▒ĒśłĻĄ¼Ļ░Éņåīņ”Ø, ĒĢŁĒĢĄĒĢŁņ▓┤ ņ¢æņä▒, ĒĢŁdsDNA ĒĢŁņ▓┤ ņ¢æņä▒, ĒĢŁSm ĒĢŁņ▓┤ ņ¢æņä▒, ļ│┤ņ▓┤(C3, C4)ņØś Ļ░Éņåī, ĒĢŁņØĖņ¦ł ĒĢŁņ▓┤ ņ¢æņä▒, direct CoombŌĆÖs test ņ¢æņä▒ ļō▒ņØś ņåīĻ▓¼ņ£╝ļĪ£ ļŻ©ĒæĖņŖż ņĀäļ¼ĖĻ░Ć ĻĘĖļŻ╣ņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦ä Systemic Lupus International Collaborating ClinicņŚÉņä£ 2012ļģä ņāłļĪŁĻ▓ī ņĀ£ņŗ£ĒĢ£ ļČäļźśĻĖ░ņżĆņŚÉ ņØśĒĢ┤ ņĀäņŗĀĒÖŹļ░śļŻ©ĒæĖņŖżļĪ£ ņ¦äļŗ©ņØ┤ Ļ░ĆļŖźĒĢśņśĆļŗż. ļ╣äņĀäĒśĢņĀüņØĖ ņĀäņŗĀņØś ņĀĆļ”╝ ņ”ØņāüņŚÉ ļīĆĒĢ£ ĒÅēĻ░Ćļź╝ ņ£äĒĢśņŚ¼ ņŗĀĻ▓ĮĻ│╝ņŚÉ ņØśļó░ĒĢśņśĆĻ│Ā ņŗĀĻ▓ĮĒĢÖņĀü ņ¦äņ░░Ļ│╝ ņŗĀĻ▓ĮņĀäļÅä Ļ▓Ćņé¼ ļ░Å ĻĘ╝ņĀäļÅä Ļ▓Ćņé¼ņŚÉņä£ļŖö ļ│äļŗżļźĖ ņØ┤ņāüņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ļćīņ▓ÖņłśņĢĪ Ļ▓Ćņé¼ņŚÉņä£ ņĢĢļĀź 120 mmH2OļĪ£ ņĀĢņāüņØ┤ņŚłĻ│Ā, ļ░▒ĒśłĻĄ¼ 9/mm3, ļŗ©ļ░▒ņ¦ł 96.0 mg/dLļĪ£ ņ”ØĻ░ĆļÉ£ ņåīĻ▓¼ņØä ļ│┤ņśĆņ£╝ļ®░, ĒżļÅäļŗ╣ 58 mg/dLņśĆļŗż. ļćīņ▓ÖņłśņĢĪņØś ĒĢŁņé░ĻĘĀ ņŚ╝ņāē ļ░Å Ļ▓░ĒĢĄĻĘĀņŚÉ ļīĆĒĢ£ ĒŖ╣ņØ┤ ņżæĒĢ®ĒÜ©ņåīņŚ░ņćäļ░śņØæ ļ¬©ļæÉ ņØīņä▒ņØ┤ņŚłņ£╝ļ®░ ļ░░ņ¢æ ļÅÖņĀĢļÉ£ ĻĘĀļÅä ņŚåņŚłļŗż. ļćī ņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāüņŚÉņä£ļŖö ĒŖ╣ņØ┤ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśņ£╝ļéś ņ▓ÖņČö ņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāüņŚÉņä£ļŖö ņÜöņČöļČĆņØś ņŗĀĻ▓Į ļ┐īļ”¼Ļ░Ć ļŁēņ│ÉņĀĖņä£ ļæÉĻ║╝ņøīņĀĖ ļ│┤ņśĆņ£╝ļ®░ ņÖĖņĖĪņ£╝ļĪ£ļŖö ņä£ļĪ£ ņ£Āņ░®ņØ┤ ļÉśņ¢┤ņ׳ļŖö Ļ▒░ļ»Ėļ¦ēņŚ╝(arachnoiditis) ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż. ĒÖśņ×ÉļŖö ĒŖ╣Ē׳ ņ¢æņĖĪ ĒĢśņ¦ĆņØś ņŗ¼ĒĢ£ ņĀĆļ”╝ ņ”Øņāüņ£╝ļĪ£ ņä£ņ׳Ļ▒░ļéś ņĢēņĢäņ׳ļŖö Ļ▓āļÅä ņ¢┤ļĀżņÜ┤ ņāüĒā£ņśĆļŖöļŹ░, ĒåĄņ”ØņØś ņøÉņØĖņ£╝ļĪ£ ņĀäņŗĀĒÖŹļ░śļŻ©ĒæĖņŖżņØś ņŗĀĻ▓ĮĻ│ä ņ╣©ļ▓öņŚÉ ņØśĒĢ£ ļ¦Éņ┤łņØś Ļ░ĆļŖöņä¼ņ£ĀņŗĀĻ▓Įļ│æņ”Ø(small fiber neuropathy)Ļ│╝ ļ¼┤ĻĘĀņä▒ ļćīļ¦ēņŚ╝ ļ░Å Ļ▒░ļ»Ėļ¦ēņŚ╝ ļō▒ņØ┤ ļ│ĄĒĢ®ņĀüņ£╝ļĪ£ ņ×æņÜ®ĒĢĀ Ļ░ĆļŖźņä▒ņØä Ļ│ĀļĀżĒĢśņśĆĻ│Ā methylprednisolone 125 mg/dayļĪ£ 1ņŻ╝Ļ░ä ņĀĢļ¦ź ņŻ╝ņé¼ļĪ£ Ēł¼ņŚ¼ĒĢśļ®┤ņä£ ņĀĆļ”╝ ņ”ØņāüņØĆ ņ¢┤ļŖÉ ņĀĢļÅä ĒśĖņĀäļÉśņ¢┤ prednisolone 60 mg/dayļĪ£ Ļ░Éļ¤ēĒĢśņŚ¼ 3ņŻ╝Ļ░ä ņ£Āņ¦ĆĒĢśņśĆĻ│Ā ņĢĮĻ░ä ļé©ņĢäņ׳ļŹś ņ¢æņĖĪ ņśåĻĄ¼ļ”¼ĒåĄņ”ØĻ│╝ ļ│ĄĒåĄ ļ░Å ļ░£ņŚ┤ņØĆ ņÖäņĀäĒ׳ ņåīņŗżļÉśņŚłņ£╝ļ®░ ņĀäņŗĀņØś ņĀĆļ”╝ ņ”ØņāüņØĆ ņä£ņä£Ē׳ ĒśĖņĀäļÉśļŖö Ļ▓ĮĻ│╝ļź╝ ļ│┤ņśĆļŗż. ņŖżĒģīļĪ£ņØ┤ļō£ Ēł¼ņŚ¼ ņŗ£ņ×æ 4ņŻ╝ ļÆż ņČöņĀü Ļ▓Ćņé¼ĒĢ£ ļ│ĄļČĆ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü Ļ▓Ćņé¼ņŚÉņä£ ņØ┤ņĀäņŚÉ ļ│┤ņØ┤ļŹś Ēøäļ│Ąļ¦ēĻ░ĢņØś ņä¼ņ£Āņä▒ ņóģĻ┤┤ļŖö Ļ▒░ņØś ņé¼ļØ╝ņ¦ä Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż(Fig. 1C and 1D). Hydroxychloroquin 200 mg/dayņÖĆ azathioprine 125 mg/day ļ│æņÜ® Ēł¼ņŚ¼ĒĢśļ®┤ņä£ ņŖżĒģīļĪ£ņØ┤ļō£ļŖö Ēł¼ņŚ¼ ņŗ£ņ×æ Ēøä 6Ļ░£ņøöņŚÉ Ļ▒Ėņ│É ņä£ņä£Ē׳ Ļ░Éļ¤ēĒĢśņŚ¼ prednisolone 12.5 mg/dayņ£╝ļĪ£ ņ£Āņ¦ĆĒĢśļ®┤ņä£ ņ”ØņāüņØś ņ×¼ļ░£ ņŚåņØ┤ ņÖĖļלņŚÉņä£ ņČöņĀüĻ┤Ćņ░░ ņżæņØ┤ļŗż.
Ļ│Ā ņ░░
Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØĆ 1948ļģä OrmondņŚÉ ņØśĒĢ┤ ņśüļ¼Ėņ£╝ļĪ£ ņ▓śņØī ļ│┤Ļ│ĀļÉ£ ņØ┤Ēøä 1984ļģäĻ╣īņ¦Ć 481Ļ░£ ņØ┤ņāüņØś ņ”ØļĪĆļ│┤Ļ│ĀĻ░Ć ņ׳ņŚłĻ│Ā ņĄ£ĻĘ╝ ņłśļģäĻ░äņØĆ ļ╣äļć©ĻĖ░Ļ│╝, ļźśļ¦łĒŗ░ņŖżļé┤Ļ│╝, ņŗĀņןļé┤Ļ│╝, ņåīĒÖöĻĖ░ļé┤Ļ│╝ ļō▒ ļŗżņ¢æĒĢ£ ņØśĒĢÖļČäņĢ╝ņŚÉņä£ ļŗżņłśņØś ņ”ØļĪĆĻ░Ć ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż. Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØś ļ░£ņāØ ļ╣łļÅäļŖö 0.1/100,000-1.3/100,000ļĪ£ ļŗżņ¢æĒĢśĻ▓ī ļ│┤Ļ│ĀļÉśņŚłļŖöļŹ░ ņ¦łĒÖśņŚÉ ļīĆĒĢ£ ņØśĒĢÖņĀü ņ¦ĆņŗØņØś ņ”ØĻ░ĆņÖĆ ņ¦äļŗ©ĻĖ░ņłĀņØś ļ░£ņĀäņ£╝ļĪ£ ņØĖĒĢ┤ ņĀÉņ░© ļ░£ņāØ ļ╣łļÅäņØś ļ│┤Ļ│ĀĻ░Ć ļŖśņ¢┤ļé£ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż[5]. ņŻ╝ļĪ£ 50-60ļīĆņŚÉņä£ ļ░£ļ│æĒĢśļ®░ ļé©ņä▒ņØ┤ ņŚ¼ņä▒ļ│┤ļŗż 2-3ļ░░ ļ░£ņāØļźĀņØ┤ ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[1]. ņĢäņ¦üĻ╣īņ¦Ć ņ¦łĒÖśņØś ļ░£ļ│æ ĻĖ░ņĀäņŚÉ ļīĆĒĢ┤ņä£ļŖö ņ×ÉņäĖĒĢśĻ▓ī ĻĘ£ļ¬ģļÉśņ¢┤ ņ׳ņ¦Ć ņĢŖņ£╝ļéś, ļ│æļ”¼ĒĢÖņĀü ņåīĻ▓¼ņØś ņ£Āņé¼ņä▒ņŚÉ ĻĘ╝Ļ▒░ĒĢśņŚ¼ ļ¦īņä▒ ļīĆļÅÖļ¦źņŻ╝ņ£äņŚ╝ Ēś╣ņØĆ ņŚ╝ņ”Øņä▒ ļ│ĄļČĆļīĆļÅÖļ¦źļźśņØś ĒĢ£ Ļ░łļלļĪ£ ņØ┤ĒĢ┤ļÉśĻ│Ā ņ׳ļŗż. ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØ┤ ņĀäņ▓┤ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØś ņĢĮ 70%ļź╝ ņ░©ņ¦ĆĒĢśļŖöļŹ░, ņĄ£ĻĘ╝ņŚÉļŖö ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØä ļ®┤ņŚŁĻĖĆļĪ£ļĖöļ”░ G4 ņŚ░Ļ┤Ćņ¦łĒÖś(IgG4 related disease)ņØś ļ▓öņŻ╝ļĪ£ ņŻ╝ņןĒĢśļŖö ņŚ░ĻĄ¼ņ×ÉļōżļÅä ņ׳ļŗż[7]. IgG4 ņŚ░Ļ┤Ćņ¦łĒÖśņØĆ ņĘīņן, ļŗ┤ļéŁ, ņ╣©ņāś, ļłłļ¼╝ņāś, ĒÅÉ, Ļ░ä, ņŗĀņן, ņżæņČö ņŗĀĻ▓ĮĻ│ä, ņĀäļ”ĮņäĀ ļō▒ ņŚ¼ļ¤¼ ņןĻĖ░ļź╝ ņ╣©ļ▓öĒĢĀ ņłś ņ׳ļŖö ņ¦łĒÖśņ£╝ļĪ£ ņĪ░ņ¦üĒĢÖņĀüņ£╝ļĪ£ ļ”╝ĒöäĻĄ¼ņÖĆ ĒśĢņ¦ł ņäĖĒżņØś ņ╣©ņ£żĻ│╝ ņä¼ņ£ĀĒÖöļź╝ ņØ╝ņ£╝ņ╝£ņä£ ņóģĻ┤┤ļź╝ ĒśĢņä▒ĒĢśļŖö ļ®┤ņŚŁņ¦łĒÖśņØ┤ļŗż. Ēśłņ▓Ł IgG4ņØś ņ”ØĻ░ĆņÖĆ ļ│æļ”¼ņĪ░ņ¦üņŚÉņä£ņØś IgG4 ņ¢æņä▒ņØś ĒśĢņ¦łņäĖĒżņØś ņ”ØĻ░Ćļź╝ ĻĘĖ ĒŖ╣ņ¦Ģņ£╝ļĪ£ ĒĢ£ļŗż. ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”Ø ĒÖśņ×É ņżæ IgG4 ņŚ░Ļ┤Ćņ¦łĒÖśņØś ļ│æļ”¼ņåīĻ▓¼Ļ│╝ ņ×äņāüņĀü ĒŖ╣ņ¦ĢņØä ļ│┤ņØ┤ļŖö ĒÖśņ×ÉļōżņØ┤ ņ׳ļŗż. Koo ļō▒[8]ņØ┤ ņĄ£ĻĘ╝ņŚÉ ļ░£Ēæ£ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”Ø ĒÖśņ×É 19ļ¬ģņØś ļ│æļ”¼ņåīĻ▓¼ ņżæ 9ļ¬ģļ¦īņØ┤ IgG4 ņŚ░Ļ┤Ćņ¦łĒÖśņØś ļ│æļ”¼ņåīĻ▓¼ņØä ļ│┤ņśĆĻ│Ā ņØ┤ļōżņØĆ ļéśļ©Ėņ¦Ć 10ļ¬ģņØś ĒŖ╣ļ░£ņä▒ ĒÖśņ×ÉņŚÉ ļ╣äĒĢ┤ņä£ ņ¦łĒÖśņØś ņ×¼ļ░£ļźĀņØ┤ ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ļéśĒāĆļé¼ņ£╝ļéś ņŗżņĀ£ ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”Ø ĒÖśņ×É ņżæ ņ¢┤ļŖÉ ņĀĢļÅäĻ░Ć IgG4 ņŚ░Ļ┤Ćņ¦łĒÖśņØ╝ņ¦ĆļŖö ņĢäņ¦üĻ╣īņ¦Ć ļ¬ģĒÖĢĒĢśņ¦ĆĻ░Ć ņĢŖļŗż. IgG4 ņŚ░Ļ┤Ćņä▒ ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØĻ│╝ IgG4 ļ╣äņŚ░Ļ┤Ćņä▒ ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØĆ ļ╣äņŖĘĒĢ£ ļ│æļ”¼ņåīĻ▓¼ņØä ļ│┤ņØ┤ļéś, IgG4 ņŚ░Ļ┤Ćņä▒ ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņŚÉņä£ ĒÅÉņāēņä▒ ĒśłĻ┤ĆņŚ╝Ļ│╝ ĒśĖņé░ĻĄ¼ ņ╣©ņ£ż ņ”ØĻ░Ć ļ░Å ļéśņäĀĒśĢ ļ¬©ņ¢æņØś ņä¼ņ£ĀĒÖö ņåīĻ▓¼ņØ┤ ņĪ░ĻĖł ļŹö ļ╣łļ▓łĒ׳ ļéśĒāĆļéśĻ│Ā, ĒŖ╣Ē׳ IgG4 ņ¢æņä▒ ĒśĢņ¦łņäĖĒżņÖĆ IgG ņ¢æņä▒ Ēśłņ¦łņäĖĒżņØś ļ╣äņ£©ņØ┤ 30-50%ļĪ£ ļåÆļŗżļŖö ĒŖ╣ņ¦ĢņØ┤ ņ׳ļŗż[7].
ņ×äņāüņĀüņØĖ ļ░£Ēśä ņ¢æņāüņØĆ ļ│ĄļČĆļéś ņśåĻĄ¼ļ”¼ Ēś╣ņØĆ ĒŚłļ”¼ņØś ļ╣äĒŖ╣ņØ┤ņĀüņØĖ ĒåĄņ”ØņØ┤ Ļ░Ćņן ĒØöĒĢśĻ│Ā, ĒśłĻ┤Ć, ļ”╝ĒöäĻ┤ĆņØś ņĢĢļ░ĢĻ│╝ ĒÅÉņāēņ£╝ļĪ£ ņØĖĒĢ£ ĒśłĻ┤Ćņä▒ ĒīīĒ¢ē, ļ¦Éņ┤ł ĒśłĻ┤ĆņŚ╝, ņłśņŗĀņ”Ø, ĻĖēņä▒ ņŗĀļČĆņĀä, ņĀĢļ¦źļźś, ņØīļéŁņłśņóģĻ╣īņ¦Ć ļŗżņ¢æĒĢśĻ▓ī ļéśĒāĆļé£ļŗż. ņ¦łĒÖśņØś ņ┤łĻĖ░ņŚÉļŖö ņĀäņŗĀ ņćĀņĢĮ, ņŗØņÜĢ ļČĆņ¦ä, ņ▓┤ņżæ Ļ░ÉņåīņÖĆ Ļ░ÖņØĆ ļ╣äĒŖ╣ņØ┤ņĀüņØĖ ņ”Øņāüļ¦ī ļéśĒāĆļéĀ ņłś ņ׳ļŗż.
ļ│ĄļČĆ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüĻ│╝ ņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāüņØĆ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØä ņ¦äļŗ©ĒĢśļŖö ļŹ░ Ļ░Ćņן ļ»╝Ļ░ÉļÅäĻ░Ć ļåÆņØĆ Ļ▓Ćņé¼ļĪ£ņä£, ļ│ĄļČĆļīĆļÅÖļ¦źĻ│╝ ļ│ĄļČĆļīĆļÅÖļ¦źņØś ļČäņ¦ĆņØĖ ņŗĀļÅÖļ¦ź, ņןĻ│©ļÅÖļ¦źņØś ņĀäļ░®ņØ┤ļéś ņÖĖņĖĪņŚÉ ņä¼ņ£Āņä▒ ņóģĻ┤┤Ļ░Ć Ļ┤Ćņ░░ļÉśĻ▒░ļéś ņØ┤ ņóģĻ┤┤ņØś ņĢĢļ░Ģņ£╝ļĪ£ ņØĖĒĢ£ ņśüĒ¢źņØ┤ ņØĖņĀæ ĻĖ░Ļ┤ĆņØĖ ļīĆĒśłĻ┤Ć, ņÜöĻ┤Ć, ņŗĀņן ļō▒ņŚÉ Ļ░ĆĒĢ┤ņ¦ĆļŖö Ļ▓āņØ┤ ĒÖĢņØĖļÉśļ®┤ ņ¦äļŗ©ĒĢĀ ņłś ņ׳ļŗż. ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØĆ ļīĆĻ░£ ĒīÉ(plague)Ļ│╝ ņ£Āņé¼ĒĢ£ ņØīņśüņ£╝ļĪ£ ņŻ╝ļ│Ćņ£╝ļĪ£ ņ╣©ņ£żļÉśļŖö ĒŖ╣ņ¦ĢņØä ļ│┤ņØ┤ļéś, ņØ┤ņ░©ņä▒ņØś Ļ▓ĮņÜ░ ņØīņśüņØĆ ļīĆĻ░£ Ļ▓░ņĀłĒśĢ(nodular) ļé┤ņ¦ĆļŖö ņåīņŚĮņāü(lobulated)ņ£╝ļĪ£ Ļ┤Ćņ░░ļÉ£ļŗż[9]. ņāüĻĖ░ ņśüņāüĒĢÖņĀü Ļ▓Ćņé¼ņŚÉņä£ļÅä ņ¦äļŗ©ņØ┤ ļ¬ģĒÖĢĒĢśņ¦Ć ņĢŖĻ▒░ļéś ņŖżĒģīļĪ£ņØ┤ļō£ ļō▒ņØś ņĢĮļ¼╝ ņ╣śļŻīņŚÉ ļīĆĒĢ£ ļ░śņØæņØ┤ ņóŗņ¦Ć ņĢŖņØä Ļ▓ĮņÜ░ņŚÉļŖö Ēøäļ│Ąļ¦ēĻ░ĢņØś ņĪ░ņ¦ü ņāØĻ▓ĆņØä Ļ│ĀļĀżĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż.
ĒĢ£ĒÄĖ, Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņŚÉņä£ ļ│┤ņØ┤ļŖö Ēøäļ│Ąļ¦ēĻ░ĢņØś ņóģĻ┤┤ļŖö Ļ▓░ĒĢĄ ļ░Å Ē׳ņŖżĒåĀĒöīļØ╝ņ”łļ¦łņ”Ø(histoplasmosis)Ļ│╝ Ļ░ÖņØĆ Ļ░ÉņŚ╝ņä▒ ņ¦łĒÖś, ļ”╝ĒöäņóģĻ│╝ Ļ░ÖņØĆ ņĢģņä▒ņóģņ¢æ, ņ£Āņ£Īņóģņ”Ø(sarcoidosis), ņŚÉļō£ĒŚżņ×ä-ņ▓┤ņŖżĒä░ ļ│æ(Erdheim-Chester disease) ļō▒ņØś ņ¦łĒÖśĻ│╝ļÅä Ļ░Éļ│äņØ┤ ĒĢäņÜöĒĢśļŗż[5].
ļ│Ė ņ”ØļĪĆņØś ĒÖśņ×ÉņŚÉņä£ Ēøäļ│Ąļ¦ēĻ░ĢņØś ņóģĻ┤┤ņŚÉ ļīĆĒĢ£ ņĪ░ņ¦üĻ▓Ćņé¼ļŖö ņŗ£Ē¢ēĒĢśņ¦Ć ļ¬╗Ē¢łļŖöļŹ░ ņĪ░ņ¦üĻ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņśĆļŗżļ®┤ IgG4ņÖĆņØś Ļ┤ĆļĀ©ņä▒ņØä ĒżĒĢ©ĒĢ£ ņ¦łĒÖśņØś ļ│æĒā£ņāØļ”¼ļź╝ ņØ┤ĒĢ┤ĒĢśļŖöļŹ░ ļÅäņøĆņØ┤ ļÉśĻ│Ā ņ¦äļŗ©ņØä ļŹöņÜ▒ ļ¬ģĒÖĢĒĢśĻ▓ī ĒĢĀ ņłś ņ׳ņŚłņØä Ļ▓āņØ┤ļŗż. ĒĢśņ¦Ćļ¦ī ļ│ĄļČĆ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņŚÉņä£ ņĀäĒśĢņĀüņ£╝ļĪ£ Ļ┤Ćņ░░ļÉśļŖö ņŗĀņןĒĢśļČĆ ļ│ĄļČĆļīĆļÅÖļ¦źņØä ļæśļ¤¼ņŗ╝ ņŚ░ļČĆņĪ░ņ¦üņØś ļČłĻĘ£ņ╣ÖĒĢ£ ņØīņśü ņ”ØĻ░Ć ņåīĻ▓¼ņØä ļ│┤ņśĆĻ│Ā, Ļ░ÉņŚ╝ ļ░Å ņóģņ¢æņØś ņ”ØĻ▒░ļŖö ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśņ£╝ļ®░ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØś ņ£äĒŚśņØĖņ×ÉļĪ£ ņĢīļĀżņĀĖ ņ׳ļŖö ņłśņłĀņØ┤ļéś ļ░®ņé¼ņäĀņ╣śļŻī, ņĢĮļ¼╝(beta blocker, methyldopa, hydralazine, methysergide ļō▒)ļ│ĄņÜ®, ņäØļ®┤ļģĖņČ£ ļō▒ņØś ļ│æļĀźņØ┤ ņŚåņŚłļŗż. ļśÉĒĢ£, ņĀäņŗĀĒÖŹļ░śļŻ©ĒæĖņŖżļź╝ ņ¦äļŗ©ĒĢśĻ│Ā ņé¼ņÜ®ĒĢ£ Ļ│ĀņÜ®ļ¤ē ņŖżĒģīļĪ£ņØ┤ļō£ Ēł¼ņŚ¼ 4ņŻ╝ Ēøä Ēøäļ│Ąļ¦ēĻ░Ģ ņóģĻ┤┤ņØś ļ╣ĀļźĖ ņåīņŗżņØä ļ│┤ņŚ¼ ņĀäņŗĀĒÖŹļ░śļŻ©ĒæĖņŖżņŚÉ ļÅÖļ░śļÉ£ ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØä ņ×äņāüņĀüņ£╝ļĪ£ ņ¦äļŗ©ĒĢĀ ņłś ņ׳ņŚłļŗż.
ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØś ņ╣śļŻīļŖö ņŚ╝ņ”Øņä▒ ņä¼ņ£ĀĒÖö ļ░śņØæņØä ļ¦ēĻ│Ā, ņØ┤ņ░©ņĀüņ£╝ļĪ£ ļ░£ņāØĒĢśļŖö ņØĖņĀæ ĻĖ░Ļ┤ĆņØś ņĢĢļ░ĢĻ│╝ ĒÅÉņāēņ£╝ļĪ£ ņØĖĒĢ£ ņ”ØņāüņØä Ļ▓ĮĻ░Éņŗ£ĒéżļŖö ļŹ░ ņ׳ļŗż. ņ¦łĒÖśņØś ĒÖ£ņä▒ļÅäļź╝ ļé«ņČöĻ│Ā ņ×¼ļ░£ņØś ņ£äĒŚśņØä Ļ░Éņåīņŗ£ĒéżļŖö ņØ╝ņ░© ņ╣śļŻīņĀ£ļĪ£ Ļ│ĀņÜ®ļ¤ē ņŖżĒģīļĪ£ņØ┤ļō£Ļ░Ć Ļ░Ćņן ļ¦ÄņØ┤ ņé¼ņÜ®ļÉ£ļŗż. ņ┤łĻĖ░ ņÜ®ļ¤ē prednisolone 1 mg/kg/dayļĪ£ ņŗ£ņ×æĒĢśņŚ¼ ĒĢ£ļŗ¼Ļ░ä ņ£Āņ¦ĆĒĢ£ ļÆż ĒÖśņ×ÉņØś ņ”ØņāüĻ│╝ ņĀüĒśłĻĄ¼ ņ╣©Ļ░Ģ ņåŹļÅä, C-ļ░śņØæņä▒ ļŗ©ļ░▒ņ¦ł, ņśüņāü Ļ▓Ćņé¼ ļō▒ņ£╝ļĪ£ ņ╣śļŻīĒÅēĻ░Ćļź╝ ĒĢśļŖö Ļ▓āņØ┤ ĻČīĻ│ĀļÉ£ļŗż[5]. ņŖżĒģīļĪ£ņØ┤ļō£ ņé¼ņÜ®ņØ┤ ĻĖłĻĖ░ņØĖ ĒÖśņ×ÉņŚÉņä£ļŖö tamoxifenņØ┤ ņé¼ņÜ®ļÉĀ ņłś ņ׳ļŗż. ņŖżĒģīļĪ£ņØ┤ļō£ņŚÉ ņ╣śļŻīļ░śņØæņØä ļ│┤ņØ┤ņ¦Ć ņĢŖĻ▒░ļéś ņ×¼ļ░£ĒĢśļŖö ĒÖśņ×ÉņŚÉņä£ļŖö methotrexate, mycophenolate mofetil, azathioprine, cyclosporine ļō▒Ļ│╝ Ļ░ÖņØĆ ļ®┤ņŚŁņ¢ĄņĀ£ņĀ£ņØś ņČöĻ░Ć ņé¼ņÜ®ņØä Ļ│ĀļĀżĒĢĀ ņłś ņ׳ņ¦Ćļ¦ī ņĢäņ¦üĻ╣īņ¦Ć Ēæ£ņżĆĒÖöļÉ£ ņ╣śļŻī ņ¦Ćņ╣©ņØĆ ņŚåļŗż. ņÜöĻ┤Ć ĒÅÉņāēņ£╝ļĪ£ ņØĖĒĢ£ ņŗĀļČĆņĀä ļō▒ņØ┤ ļÅÖļ░śļÉśņ¢┤ ņ׳ņØä ļĢīļŖö ņÜöĻ┤Ć ļé┤ double J stent ņéĮņ×ģĻ│╝ Ļ▓ĮĒö╝ņĀü ņ╣┤ĒģīĒä░ ņéĮņ×ģņłĀ Ēś╣ņØĆ ņłśņłĀņĀü ņ╣śļŻīĻ░Ć ĒĢäņÜöĒĢĀ ņłś ņ׳ļŗż.
ņĀäņŗĀĒÖŹļ░śļŻ©ĒæĖņŖżņŚÉ ļ│æļ░£ĒĢ£ ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØĆ 1966ļģä Lipman ļō▒[6]ņØ┤ ņ▓śņØī ļ│┤Ļ│ĀĒĢ£ ņØ┤Ēøä ĒĢ┤ņÖĖņŚÉņä£ļŖö ņŚ¼ņä▒ņŚÉņä£ ļ░£ņāØĒĢ£ ņ┤Ø 6Ļ░£ņØś ņ”ØļĪĆļ│┤Ļ│ĀĻ░Ć ņ׳ņŚłņ£╝ļéś, ņĢäņ¦üĻ╣īņ¦Ć ĻĄŁļé┤ņŚÉļŖö ļ│┤Ļ│ĀĻ░Ć ņŚåļŗż. ĒŖ╣Ē׳, ļ│Ė ņ”ØļĪĆļŖö ļé©ņä▒ņŚÉņä£ ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”Ø ņ¦äļŗ© Ēøä ņŚ░ņØ┤ņ¢┤ ļ░£ņāØĒĢ£, ņŗĀĻ▓ĮĻ│äļź╝ ņ╣©ļ▓öĒĢ£ ņĀäņŗĀĒÖŹļ░śļŻ©ĒæĖņŖżļĪ£ ņ¦äļŗ©ļÉ£ Ļ▓ĮņÜ░ļĪ£ ļ¦żņÜ░ ĒؼĻĘĆĒĢ£ ņ”ØļĪĆļØ╝ ĒĢĀ ņłś ņ׳ļŗż.
ĻĄŁļé┤ņŚÉņä£ļŖö ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØ┤ ņ×ÉĻ░Ćļ®┤ņŚŁ Ļ░æņāüņāśņŚ╝, ņ×ÉĻ░Ćļ®┤ņŚŁ ņĘīņןņŚ╝ ļō▒Ļ│╝ ņŚ░Ļ┤ĆļÉśņ¢┤ ļ░£ņāØĒĢ£ ļ│┤Ļ│ĀĻ░Ć ņ׳Ļ│Ā ļźśļ¦łĒŗ░ņŖżņ¦łĒÖśņ£╝ļĪ£ļŖö ļźśļ¦łĒŗ░ņŖżĻ┤ĆņĀłņŚ╝Ļ│╝ ļÅÖļ░śļÉ£ ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØĻ│╝ ĒĢŁņØĖņ¦ĆĒĢŁņ▓┤ ņ”ØĒøäĻĄ░Ļ│╝ ļÅÖļ░śļÉ£ 1ņśłņØś ļ│┤Ļ│ĀĻ░Ć ņ׳ņŚłļŗż[10].
ņøÉņØĖņØ┤ ļČłļ¬ģĒÖĢĒĢ£ ļ│ĄĒåĄ, ĒŚłļ”¼ĒåĄņ”Ø, ņÜöĒÅÉņāēņØä ņØśņŗ¼ĒĢĀ ļ¦īĒĢ£ ņ”Øņāü ļō▒ņØä ĒśĖņåīĒĢśļŖö ĒÖśņ×ÉņŚÉņä£ ļō£ļ¼Ė ņøÉņØĖņØ┤ņ¦Ćļ¦ī Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņŚÉ ļīĆĒĢ£ Ļ│ĀļĀżĻ░Ć ĒĢäņÜöĒĢśĻ▓Āļŗż. ĒŖ╣Ē׳, ļ│Ė ņ”ØļĪĆņ▓śļ¤╝ ĒŖ╣ļ░£ņä▒ Ēøäļ│Ąļ¦ēĻ░Ģ ņä¼ņ£ĀĒÖöņ”ØņØ┤ ļ░£Ļ▓¼ļÉ£ Ļ▓ĮņÜ░ņŚÉļŖö ņĀäņŗĀĒÖŹļ░śļŻ©ĒæĖņŖżļź╝ ĒżĒĢ©ĒĢ£ ņ×ÉĻ░Ćļ®┤ņŚŁņ¦łĒÖśņØ┤ ĻĖ░ņĀĆņŚÉ ņ׳ņØä Ļ░ĆļŖźņä▒ļÅä ņŚ╝ļæÉņŚÉ ļæÉĻ│Ā ņŻ╝ņØś Ļ╣ŖņØĆ ņŗĀņ▓┤ņ¦äņ░░ ļ░Å Ļ▓Ćņé¼Ļ░Ć ņØ┤ļŻ©ņ¢┤ņĀĖņĢ╝ ĒĢĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






