 |
 |
| Korean J Med > Volume 84(1); 2013 > Article |
|
ņÜöņĢĮ
ļ¬®ņĀü:
ĒśłņĀäņÜ®ĒĢ┤ ņ╣śļŻīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā Ļ┤æļ▓öņ£ä ļ░Å ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņØś ņé¼ļ¦ØļźĀņØĆ ņŚ¼ņĀäĒ׳ ļåÆļŗż. ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻīļŖö Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ ņāØļ¬ģņØä ĻĄ¼ĒĢĀ ņ╣śļŻīļĪ£ ņŚ¼Ļ▓©ņ¦Ćņ¦Ćļ¦ī ņ¦äļŗ© ļŗ╣ņŗ£ ņĀĆĒśłņĢĢņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ ņĀĆĒśłņĢĢņ£╝ļĪ£ ņ¦äĒ¢ēļÉĀ ņłś ņ׳ļŖö Ļ│Āņ£äĒŚś ĒÖśņ×ÉņŚÉņä£ļ¦ī ņäĀĒāØņĀüņ£╝ļĪ£ ņĀüņÜ®ļÉśĻ│Ā ņ׳ļŗż. ĻĄŁļé┤ņŚÉņä£ļŖö ņØ┤ņÖĆ Ļ┤ĆļĀ©ļÉ£ ņåīņłśņØś ļ¼ĖĒŚīļ¦īņØ┤ ņ׳ļŖö ņāüĒā£ļĪ£ ņØ┤ņŚÉ ĒśłņĀäņÜ®ĒĢ┤ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢ£ Ļ┤æļ▓öņ£ä ļ░Å ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×ÉļōżņØś ļŗ©ĻĖ░ ņé¼ļ¦ØļźĀņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
ļ░®ļ▓Ģ:
2004ļģä 1ņøö 1ņØ╝ļČĆĒä░ 2011ļģä 7ņøö 30ņØ╝Ļ╣īņ¦Ć 91Ļ░£ņøö ļÅÖņĢł ņł£ņ▓£Ē¢źļīĆĒĢÖĻĄÉ ņä£ņÜĖļ│æņøÉņŚÉņä£ ĒØēļČĆ ņ╗┤Ēō©Ēä░ņ┤¼ņśüņØä ĒåĄĒĢ┤ ņ¦äļŗ© Ēøä ĒśłņĀäņÜ®ĒĢ┤ņĀ£Ļ░Ć Ēł¼ņŚ¼ļÉ£ Ļ┤æļ▓öņ£ä ļ░Å ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ĒøäĒ¢źņĀü ņØśļ¼┤ĻĖ░ļĪØ ņĪ░ņé¼ļź╝ ĒĢśņśĆļŗż. ņØ╝ņ░© Ļ▓░Ļ│╝ļŖö ņ╣śļŻī 30ņØ╝ ņØ┤ļé┤ņØś ņé¼ļ¦Øņ£╝ļĪ£ ĒĢśņśĆņ£╝ļ®░ ņØ┤ņ░© Ļ▓░Ļ│╝ļŖö 30ņØ╝ ņØ┤ļé┤ņØś ņŻ╝ņÜöņČ£Ēśł, 90ņØ╝ ņØ┤ļé┤ņØś ņé¼ļ¦Ø, 90ņØ╝ ņØ┤ļé┤ņØś ņĀĢļ¦źĒśłņĀäņ”ØņØś ņ×¼ļ░£ļĪ£ ĒĢśņśĆļŗż.
Ļ▓░Ļ│╝:
ĒÅÉņāēņĀäņ”Ø ĒÖśņ×É ņżæ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ļź╝ Ēł¼ņŚ¼ ļ░øņØĆ ĒÖśņ×ÉļŖö 21ļ¬ģņ£╝ļĪ£ Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø 9ļ¬ģ, ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø 12ļ¬ģņØ┤ņŚłļŗż. 30ņØ╝ ņØ┤ļé┤ ņé¼ļ¦ØņØĆ 5ļ¬ģ(24%)ņ£╝ļĪ£ Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×É 9ļ¬ģ ņżæ 4ļ¬ģ(44%), ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×É 12ļ¬ģ ņżæ 1ļ¬ģ(8%)ņ£╝ļĪ£ Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ 30ņØ╝ ņé¼ļ¦ØļźĀņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż (p= 0.010). ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ Ēøä 30ņØ╝ ņé¼ļ¦ØļźĀĻ│╝ 90ņØ╝ ņé¼ļ¦ØļźĀņØĆ ļÅÖņØ╝ĒĢśņśĆļŗż. ņČöņĀĢ ņé¼ļ¦ØņøÉņØĖņØĆ 5ļ¬ģ ņżæ 4ļ¬ģ(80%)ņŚÉņä£ ņÜ░ņŗ¼ņŗż ļČĆņĀäņ£╝ļĪ£ ņØĖĒĢ£ ņł£ĒÖśĻĖ░ ĒŚłĒāłņØ┤ņŚłĻ│Ā 1ļ¬ģ(20%)ņØĆ ņ╣śļ¬ģņĀü ņČ£ĒśłļĪ£ ņØĖĒĢ£ ņé¼ļ¦ØņØ┤ņŚłļŗż. ĒśłņĀäņÜ®ĒĢ┤ņĀ£ ņ╣śļŻīļČĆĒä░ ņé¼ļ¦ØĻ╣īņ¦ĆņØś ņŗ£Ļ░äņØĆ 1ņØ╝(ņżæĻ░äĻ░Æ, 0-13ņØ╝)ņØ┤ņŚłļŗż. ņŻ╝ņÜöņČ£ĒśłņØĆ ņ┤Ø 21ļ¬ģ ņżæ 3ļ¬ģ (14%)ņŚÉņä£ ļ░£ņāØĒĢśņśĆĻ│Ā ņØ┤ ņżæ 1ļ¬ģ (5%)ņØĆ ņČ£ĒśłļĪ£ ņØĖĒĢ£ ņé¼ļ¦Øņ£╝ļĪ£ ņČöņĀĢļÉśņŚłļŗż. 90ņØ╝ ņØ┤ļé┤ ņĀĢļ¦źĒśłņĀäņ”ØņØś ņ×¼ļ░£ņØĆ ņŚåņŚłļŗż.
Abstract
Background/Aims:
The mortality rate following massive and submassive pulmonary embolism (PE) remains high despitethrombolytic therapy. Although thrombolytic therapy is considered a life-saving intervention in massive PE, it is only selectivelyindicated in patients without hypotension who are at high risk of developing hypotension. Little is known about its clinical outcomein Korea.
Methods:
We retrospectively reviewed the records of patients given thrombolytics for massive and submassive PE objectivelyconfirmed with chest computed tomography at Soon Chun Hyang University Hospital, Seoul, Korea, from 1 January 2004 to 1August 2011. The primary outcome of this study was 30-day mortality. Secondary outcomes were the incidence of major bleedingat 30 days, mortality at 90 days, and recurrent venous thromboembolism (VTE) at 90 days.
Results:
Thrombolytic therapy was performed in 21 patients: nine with massive and 12 with submassive PE. The overall 30-daymortality rate was 24% (5/21). The mortality rate in patients with massive PE was higher than that in patients with submassive PE(44% vs. 8%, respectively; p= 0.010). Mortality rates at 90 and 30 days were identical. The estimated causes of death were rightventricular failure in four patients and fatal bleeding in one patient. The median time to death from thrombolysis was 1 day (0-13days). Major bleeding episodes occurred in three patients (14%), including fatal bleeding in one patient. There was no recurrentVTE at 90 days.
ĒÅÉņāēņĀäņ”ØņØś 3Ļ░£ņøö ļŗ©ĻĖ░ņé¼ļ¦ØļźĀņØĆ 15.3%ļĪ£ ņé¼ļ¦Øņ£äĒŚśņØĆ ņ×äņāüņ¢æņāüņŚÉ ļö░ļØ╝ ļŗżņ¢æĒĢśņŚ¼ ņŗ¼ĒÅÉņĀĢņ¦ĆĻ░Ć ļéśĒāĆļé£ Ļ▓ĮņÜ░ 70%, ņŖ╣ņĢĢņĀ£ ļ│┤ņĪ░Ļ░Ć ĒĢäņÜöĒĢ£ ņćĮņØĖ Ļ▓ĮņÜ░ 30%, ņĀĆĒśłņĢĢņØ┤ ļéśĒāĆļéśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░ 2% ņØ┤ĒĢśļĪ£ ņČöņĀĢĒĢśĻ│Ā ņ׳ļŗż[1-3].
2006ļģä Kucher ļō▒[4]ņØĆ ICOPER (International Cooperative Pulmonary Embolism Registry) ņŚ░ĻĄ¼ņŚÉņä£ ĒÅÉņāēņĀäņ”Ø ņ¦äļŗ© ļŗ╣ņŗ£ ņłśņČĢĻĖ░ ĒśłņĢĢņØ┤ 90 mmHg ņØ┤ņāüņØĖ Ļ▓ĮņÜ░ 90ņØ╝ ņé¼ļ¦ØļźĀņØ┤ 14.7%, 90 mmHg ļ»Ėļ¦ī(Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø)ņØĖ Ļ▓ĮņÜ░ 52.4%ļĪ£ ĒśłļźśņŚŁĒĢÖņĀüņ£╝ļĪ£ ļČłņĢłņĀĢĒĢ£ Ļ▓ĮņÜ░ ņé¼ļ¦ØļźĀņØ┤ ņ”ØĻ░ĆĒĢśņśĆļŗżĻ│Ā ĒĢśņśĆļŗż. ņłśņČĢĻĖ░ ĒśłņĢĢņØĆ 90 mmHg ņØ┤ņāüņØ┤ņ¦Ćļ¦ī ņŗ¼ņ┤łņØīĒīīņŚÉņä£ ņÜ░ņŗ¼ņŗż ņÜ┤ļÅÖĻ░Éņåīņ”Ø(hypokinesis)ņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ 30ņØ╝ ņé¼ļ¦ØļźĀņØĆ 16.0%, ņŚåļŖö Ļ▓ĮņÜ░ 9.4%ļĪ£ ņÜ░ņŗ¼ņŗż ņÜ┤ļÅÖĻ░Éņåīņ”ØņØĆ 30ņØ╝ ņé¼ļ¦ØļźĀņØś ļÅģļ”ĮņĀü ņśłņĖĪņØĖņ×ÉļĪ£ ļ│┤Ļ│ĀļÉśņŚłņ£╝ļ®░(ņ£äĒŚśļÅä 1.94, 95% ņŗĀļó░ĻĄ¼Ļ░ä 1.23-3.06)[5], 2008ļģä Sanchez ļō▒[6]ņØĆ ļ®öĒāĆļČäņäØņØä ĒåĄĒĢ┤ ņĀĢņāü ĒśłņĢĢņØä ļ│┤ņØ┤ļŖö ĒÅÉņāēņĀäņ”Ø ĒÖśņ×É ņżæ ņŗ¼ņ┤łņØīĒīīņŚÉņä£ ņÜ░ņŗ¼ļČĆņĀäņØś ņ¦ĢĒøäĻ░Ć ņ׳ļŖö ĒÖśņ×ÉņŚÉņä£ ļ│æņøÉļé┤ Ēś╣ņØĆ 90ņØ╝ ņé¼ļ¦Øņ£äĒŚśļ╣äĻ░Ć 2.4ļ░░(95% ņŗĀļó░ĻĄ¼Ļ░ä 1.3-4.4) ņāüņŖ╣ĒĢśņśĆļŗżĻ│Ā ĒĢśņśĆļŗż[6].
Ļ┤æļ▓öņ£ä ļ░Å ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņØś ņŻ╝ļÉ£ ņ╣śļŻīņĀäļץņØĆ ņĪ░ĻĖ░ņŚÉ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ļź╝ Ēł¼ņŚ¼ĒĢśņŚ¼ ĒśłļźśņŚŁĒĢÖņØä ĒÜīļ│Ąņŗ£ĒéżļŖö Ļ▓āņØ┤ņ¦Ćļ¦ī, Ēśäņ×¼ ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻīņØś ņāØņĪ┤ņØ┤ļōØņŚÉ ļīĆĒĢ┤ņä£ļŖö ļģ╝ļ×ĆņØ┤ ņ׳Ļ│Ā[7,8], ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ļĪ£ ņØĖĒĢ£ ņČ£ĒśłĒĢ®ļ│æņ”ØņØś ņ”ØĻ░ĆļĪ£ ņāØņĪ┤ņØ┤ļōØņØ┤ ņāüņćäļÉĀ ņłś ņ׳ņ£╝ļ»ĆļĪ£ ņČ£Ēśł Ļ│Āņ£äĒŚśĻĄ░ ņäĀļ│äņØä ĒåĄĒĢ┤ ņŗĀņżæĒĢśĻ▓ī Ēł¼ņŚ¼ļÉśņ¢┤ņĢ╝ ĒĢ£ļŗż[1]. ĻĄŁļé┤ņŚÉņä£ļŖö Ļ┤æļ▓öņ£ä ļ░Å ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×ÉļōżņØś ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻīņŚÉ ļö░ļźĖ ņé¼ļ¦ØļźĀ ļ░Å ņ×äņāüĻ▓░Ļ│╝ņŚÉ ļīĆĒĢ£ ņåīņłśņØś ļ¼ĖĒŚīļ¦īņØ┤ ņ׳ļŖö ņāüĒā£ņØ┤ļŗż[9,10]. ņØ┤ņŚÉ ņĀĆņ×ÉļōżņØĆ ĒśłņĀäņÜ®ĒĢ┤ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢ£ Ļ┤æļ▓öņ£ä ļ░Å ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×ÉļōżņØś ļŗ©ĻĖ░ ņé¼ļ¦ØļźĀņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢśņśĆļŗż.
2004ļģä 1ņøö 1ņØ╝ļČĆĒä░ 2011ļģä 7ņøö 30ņØ╝Ļ╣īņ¦Ć 91Ļ░£ņøö ļÅÖņĢł ņł£ņ▓£Ē¢źļīĆĒĢÖĻĄÉ ņä£ņÜĖ ļ│æņøÉņŚÉņä£ ņĀĢļ¦źĒśłņĀäņ”ØņØä ņ¦äļŗ©ļ░øņØĆ ĒÖśņ×É ņżæ Ļ┤æļ▓öņ£ä ļ░Å ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Øņ£╝ļĪ£ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ļź╝ ļ░øņØĆ 18ņäĖ ņØ┤ņāü ņä▒ņØĖņØä ļīĆņāüņ£╝ļĪ£ ĒĢśņśĆļŗż.
Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņØĆ ļŗżļźĖ ņøÉņØĖ ņŚåņØ┤ ņłśņČĢĻĖ░ ĒśłņĢĢ 90 mmHg ļ»Ėļ¦īņØś ņĀĆĒśłņĢĢņØ┤ 15ļČä ņØ┤ņāü ņ¦ĆņåŹļÉ£ Ļ▓ĮņÜ░ņÖĆ ņŖ╣ņĢĢņĀ£ Ēś╣ņØĆ ņŗ¼ĒÅÉņåīņāØņłĀņØä ĒĢäņÜöļĪ£ ĒĢśļŖö ņł£ĒÖśļČĆņĀäņØ┤ ņ׳ņŚłļŹś Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆĻ│Ā, ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņØĆ ņłśņČĢĻĖ░ ĒśłņĢĢņØ┤ 90 mmHg ņØ┤ņāüņØ┤ļ®┤ņä£ ņŗ¼ņ┤łņØīĒīīņŚÉņä£ ņóīņŗ¼ņŗż ļśÉļŖö ņŖ╣ļ¬©ĒīÉ ņ¦łĒÖś ņŚåņØ┤ ņÜ░ņŗ¼ņŗżņŚÉ ņĢĢļĀź Ļ│╝ļČĆĒĢśĻ░Ć ņ׳ļŖö Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż[11].
ņ£Āļ░£ņØĖņ×ÉņŚÉ ļö░ļØ╝ 1Ļ░£ņøö ņØ┤ļé┤ņØś ņłśņłĀ, ņ×ģņøÉ, Ļ╣üņŖżļĪ£ ņØĖĒĢ£ ļČĆļÅÖņØĆ ņŻ╝(major) ņ£Āļ░£ņØĖņ×ÉĻ░Ć ņ׳ļŖö ĒÅÉņāēņĀäņ”Øņ£╝ļĪ£ ĒĢśņśĆĻ│Ā, ņŚÉņŖżĒŖĖļĪ£Ļ▓Éņ╣śļŻī, ņ×äņŗĀ, 8ņŗ£Ļ░ä ņØ┤ņāüņØś ņןĻ▒░ļ”¼ņŚ¼Ē¢ē, 1-3Ļ░£ņøöņØś ņŻ╝ ņ£Āļ░£ņØĖņ×ÉĻ░Ć ņ׳ņŚłļŹś Ļ▓ĮņÜ░ ļČĆ(minor) ņ£Āļ░£ņØĖņ×ÉĻ░Ć ņ׳ļŖö ĒÅÉņāēņĀäņ”Øņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆņ£╝ļ®░ ĻĖ░ĒāĆ ņ£Āļ░£ņØĖņ×ÉĻ░Ć ņŚåļŖö Ļ▓ĮņÜ░ļŖö ņ£Āļ░£ņØĖņ×ÉĻ░Ć ņŚåļŖö ĒÅÉņāēņĀäņ”Øņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż. ņĄ£ĻĘ╝ 6Ļ░£ņøö ņØ┤ļé┤ņŚÉ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢśĻ│Ā ņ׳ļŹś ņĢģņä▒ ņóģņ¢æņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ļŖö ņĢö Ļ┤ĆļĀ© ĒÅÉņāēņĀäņ”Øņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż[1]. ļ│Ė ņŚ░ĻĄ¼ņØś ņŚ░ĻĄ¼Ļ│äĒÜŹņä£ļŖö ņ×äņāüņŚ░ĻĄ¼ ņŗ¼ņØśņ£äņøÉĒÜīņØś ņŖ╣ņØĖņØä ļ░øņĢśļŗż.
ĒÅÉņāēņĀäņ”ØņØĆ ĒØēļČĆ ņ╗┤Ēō©Ēä░ ļŗ©ņĖĄņ┤¼ņśüņłĀ Ēś╣ņØĆ ĒÅÉĒśłĻ┤ĆņĪ░ņśü ņ╗┤Ēō©Ēä░ ļŗ©ņĖĄņ┤¼ņśüņłĀņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ļ░ØĻ┤ĆņĀüņ£╝ļĪ£ ņ¦äļŗ©ļÉ£ Ļ▓ĮņÜ░ļĪ£ ĒĢśņśĆĻ│Ā ņ¦äļŗ© ļŗ╣ņŗ£ņØś ņāØņ¦ĢĒøä, ņŗ¼ņ┤łņØīĒīī Ļ▓░Ļ│╝, ļÅÖļ░ś ņ¦łĒÖś, ņŗżĒŚśņŗż ņåīĻ▓¼ ļō▒ņØä ĒøäĒ¢źņĀüņ£╝ļĪ£ ņĪ░ņé¼ĒĢśņśĆļŗż. ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ĻĄ░ņØś ņäĀņĀĢņØĆ Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ļ░Å ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Øņ£╝ļĪ£ ņ¦äļŗ© Ēøä ņČ£Ēśł Ļ│Āņ£äĒŚśĻĄ░ņØä ņĀ£ņÖĖĒĢ£ ĒÖśņ×ÉĻĄ░ņŚÉņä£ Ēł¼ņŚ¼ļÉśņŚłļŗż. ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ņØś ņĀłļīĆņĀü ĻĖłĻĖ░ņ”ØņØĆ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ņŚÉ Ļ│╝ļ»╝ļ░śņØæņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ņÖĆ ņČ£Ēśłņ£äĒŚś Ļ░Éņåīļź╝ ņ£äĒĢ┤ ļæÉĻ░£Ļ░Ģļé┤ ĻĄ¼ņĪ░ņĀü ņ¦łĒÖśņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░(ļćīņóģņ¢æ ļō▒), Ļ│╝Ļ▒░ ļćīņČ£ĒśłņØś ļ│æļĀźņØ┤ ņ׳ļŹś Ļ▓ĮņÜ░, ņĄ£ĻĘ╝ 3Ļ░£ņøö ņØ┤ļé┤ ļćīĻ▓ĮņāēņØś ļ│æļĀźņØ┤ ņ׳ļŹś Ļ▓ĮņÜ░, ņĄ£ĻĘ╝ 3Ļ░£ņøö ņØ┤ļé┤ ļæÉĻ░£Ļ░Ģ ļé┤ ņłśņłĀņØä ļ░øņĢśļŹś Ļ▓ĮņÜ░, Ēśäņä▒ ņČ£Ēśł(active bleeding)ņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░, ĒśłņåīĒīÉ Ļ░Éņåīņ”Ø(ļ¦Éņ┤łĒśłņĢĪ Ļ▓Ćņé¼ņŚÉņä£ ĒśłņåīĒīÉ ņłśĻ░Ć 100,000 mm/m3 ņØ┤ĒĢś) Ēś╣ņØĆ ņČ£Ēśłņä▒ Ļ▓ĮĒ¢źņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ļĪ£ ĒĢśņśĆļŗż. ņāüļīĆņĀü ĻĖłĻĖ░ņ”Øņ£╝ļĪ£ ņĄ£ĻĘ╝ 10ņØ╝ ņØ┤ļé┤ņŚÉ ņŻ╝ņÜöņÖĖņāüņØ┤ļéś ņŻ╝ņÜöņłśņłĀņØä ļ░øņØĆ ĻĖ░ņÖĢļĀź, ņŗĀĻĖ░ļŖź ņןņĢĀ, Ļ░äĻĖ░ļŖź ņןņĢĀ, ņĪ░ņĀłļÉśņ¦Ć ņĢŖņØĆ Ļ│ĀĒśłņĢĢ(ņłśņČĢĻĖ░ ĒśłņĢĢ 180 mmHg Ēś╣ņØĆ ņØ┤ņÖäĻĖ░ ĒśłņĢĢ 110 mmHg ņ┤łĻ│╝), 75ņäĖ ņØ┤ņāüņØś Ļ│ĀļĀ╣ņØś Ļ▓ĮņÜ░ņśĆņ£╝ļ®░ ņāüļīĆņĀü ĻĖłĻĖ░ņ”ØņŚÉ ĒĢ┤ļŗ╣ļÉśļŖö Ļ▓ĮņÜ░ ņ×äņāüņØśņØś ĒīÉļŗ©ņ£╝ļĪ£ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ļź╝ Ļ▓░ņĀĢĒĢśņśĆļŗż. ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ņØś ĻĖ░ņżĆņØĆ ņŗ¼ņ┤łņØīĒīīņŚÉņä£ ņÜ░ņŗ¼ņŗż ņÜ┤ļÅÖĻ░Éņåīņ”ØņØä ĒÖĢņØĖĒĢ£ Ļ▓ĮņÜ░ļĪ£ļ¦ī ĻĄŁĒĢ£ĒĢśņśĆĻ│Ā troponin, pro-BNP, ĒØēļČĆ ņ╗┤Ēō©Ēä░ ļŗ©ņĖĄ ņ┤¼ņśüņŚÉņä£ņØś ņÜ░ņŗ¼ņŗż ĒÖĢņןņØĆ Ēł¼ņŚ¼ņØś ĻĖ░ņżĆņØ┤ ļÉśņ¦Ć ņĢŖņĢśņ£╝ļ®░ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ņŚÉ ļÅÖņØśĒĢśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ ĒĢŁņØæĻ│ĀņĀ£ļź╝ ļŗ©ļÅģņ£╝ļĪ£ Ēł¼ņŚ¼ĒĢśņśĆļŗż.
ņŻ╝ņÜöņČ£Ēśł(major bleeding)ņØĆ ņé¼ļ¦ØņØś ņøÉņØĖņØ┤ ļÉśļŖö ņČ£Ēśł, ņ£äĒŚś ņןĻĖ░(ļæÉĻ░£ļé┤, ņĢłļé┤, ņ▓Öņłśļé┤, Ēøäļ│Ąļ¦ēļé┤ ļ░Å ņŗ¼ļ¦ēļé┤)ļź╝ ņ╣©ļ▓öĒĢśļŖö ņČ£Ēśł, ĒśłņāēņåīĻ░Ć 2 g/dL ņØ┤ņāü Ļ░ÉņåīĒĢśĻ▒░ļéś, ļåŹņČĢņĀüĒśłĻĄ¼ ņłśĒśłņØ┤ 2ļŗ©ņ£ä ņØ┤ņāü ĒĢäņÜöĒĢ£ Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż[12,13]. ņŚ░ĻĄ¼ņØś ņØ╝ņ░© Ļ▓░Ļ│╝ļŖö ņ╣śļŻī 30ņØ╝ ņØ┤ļé┤ņØś ņé¼ļ¦Øņ£╝ļĪ£ ĒĢśņśĆņ£╝ļ®░ ņØ┤ņ░© Ļ▓░Ļ│╝ļŖö 30ņØ╝ ņØ┤ļé┤ņØś ņŻ╝ņÜöņČ£Ēśł, 90ņØ╝ ņØ┤ļé┤ņØś ņé¼ļ¦Ø, 90ņØ╝ ņØ┤ļé┤ņØś ņĀĢļ¦źĒśłņĀäņ”ØņØś ņ×¼ļ░£ļĪ£ ĒĢśņśĆļŗż.
ĒśłņĀäņÜ®ĒĢ┤ņĀ£ļź╝ Ēł¼ņŚ¼ ļ░øņØĆ ĒÖśņ×ÉļōżņØś ĒŖ╣ņä▒ņØĆ ņåīņ¦æļŗ© ļČäņäØņ£╝ļĪ£ ņŚ░ņåŹļ│ĆņłśņŚÉ ļīĆĒĢ┤ņä£ļŖö Mann-Whitney U ļČäņäØņØä ĒĢśņśĆĻ│Ā ļ╣äņŚ░ņåŹļ│ĆņłśņŚÉ ļīĆĒĢ┤ņä£ļŖö FisherņØś ņĀĢĒÖĢ Ļ▓ĆņĀĢņØä ņé¼ņÜ®ĒĢśņśĆļŗż. ņāØņĪ┤ņ£© ļČäņäØņØĆ Kaplan-Meierļ▓ĢņØä ņĀüņÜ®ĒĢśņśĆņ£╝ļ®░ ņØ┤ļōżņØś ņ£ĀņØśņä▒ņØĆ Log-rank testļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż. ĒåĄĻ│äņĀü ņ£ĀņØśņä▒ņØĆ p Ļ░ÆņØ┤ 0.05 ļ»Ėļ¦īņØĖ Ļ▓ĮņÜ░ļĪ£ ĒīÉņĀĢĒĢśņśĆļŗż. ļ¬©ļōĀ ņ×ÉļŻīņØś ļČäņäØņŚÉļŖö SPSS ņåīĒöäĒŖĖņø©ņ¢┤(SPSS 14.0 KO for windows; SPSS inc.; Chicago, IL, USA)ļź╝ ņØ┤ņÜ®ĒĢśņśĆļŗż.
ņŚ░ĻĄ¼ĻĖ░Ļ░ä ļÅÖņĢł ņĀĢļ¦źĒśłņĀäņ”Øņ£╝ļĪ£ ņ¦äļŗ©ļ░øņØĆ ĒÖśņ×ÉļŖö ņ┤Ø 627ļ¬ģņ£╝ļĪ£ ņŗ¼ļČĆņĀĢļ¦źĒśłņĀäņ”Ø ļÅÖļ░ś ņ£Āļ¼┤ņÖĆ Ļ┤ĆĻ│äņŚåņØ┤ ĒÅÉņāēņĀäņ”ØņØä ņ¦äļŗ©ļ░øņĢśļŹś ĒÖśņ×ÉļŖö 468ļ¬ģ(74.6%)ņØ┤ņŚłĻ│Ā ĒÅÉņāēņĀäņ”Ø ĒÖśņ×É ņżæ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ļź╝ Ēł¼ņŚ¼ ļ░øņØĆ ĒÖśņ×ÉļŖö 21ļ¬ģ(4.5%)ņØ┤ņŚłļŗż(Fig. 1). Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø 9ļ¬ģ(43%), ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø 12ļ¬ģ(57%)ņ£╝ļĪ£ ļæÉ ĻĄ░ ļ¬©ļæÉņŚÉņä£ ņŚ░ļĀ╣ ņżæĻ░ä Ļ░ÆņØĆ 75ņäĖ(Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø25-90ņäĖ, ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø 59-88ņäĖ)ņśĆļŗż. Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņØĆ ņŻ╝ ņ£Āļ░£ņØĖņ×ÉĻ░Ć ņ׳ņŚłļŹś Ļ▓ĮņÜ░Ļ░Ć 4ļ¬ģ(44%)ņ£╝ļĪ£ Ļ░Ćņן ļ¦ÄņĢśĻ│Ā ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņØĆ ņ£Āļ░£ņØĖņ×ÉĻ░Ć ņŚåņŚłļŹś Ļ▓ĮņÜ░Ļ░Ć 6ļ¬ģ(50%), ņĢö Ļ┤ĆļĀ©ņØ┤ 4ļ¬ģ(33%)ņØ┤ņŚłļŗż. ņ”ØņāüņØĆ ĒśĖĒØĪĻ│żļ×ĆņØ┤ ļ¬©ļōĀ ĒÖśņ×ÉņŚÉņä£ ņ׳ņŚłĻ│Ā Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ļŖö ņŗżņŗĀ(56%), ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ļŖö ĒØēĒåĄ(42%) ĒśĖņåīĻ░Ć ļ¦ÄņĢśļŗż. ņ”ØņäĖ ļ░£ĒśäļČĆĒä░ ļé┤ņøÉĻ╣īņ¦Ć ĻĖ░Ļ░äņØś ņżæĻ░äĻ░ÆņØĆ Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ 1ņØ╝(1-7ņØ╝), ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ 2ņØ╝(1-14ņØ╝)ļĪ£ ļæÉ ĻĄ░ ļ¬©ļæÉņŚÉņä£ ĻĖēņä▒ Ļ▓ĮĻ│╝ļź╝ ļ│┤ņśĆļŗż. ļÅÖļ░ś ņ¦łĒÖśņØĆ Ļ┤æļ▓öņ£ä ļ░Å ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ļ¬©ļæÉ 6Ļ░£ņøö ņØ┤ļé┤ ņ╣śļŻīļ│æļĀźņØ┤ ņ׳ļŖö ĒÖ£ļÅÖņä▒ ņĢöņØ┤ Ļ░Ćņן ļ¦ÄņĢśĻ│Ā(22% ļ░Å 33%) Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņØĆ ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖś ļ░Å ĒÅÉņ¦łĒÖśņØ┤ ļÅÖļ░śļÉ£ Ļ▓ĮņÜ░Ļ░Ć ņ׳ņŚłņ¦Ćļ¦ī ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦ĆļŖö ņĢŖņĢśļŗż(Table 1).
ĻĖēņä▒ ĒÅÉņāēņĀäņ”ØņØś ļČłļ¤ēĒĢ£ ņśłĒøäņÖĆ Ļ┤ĆļĀ©ņ׳ļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņ¦ä Troponin T (ļ│ĖņøÉ ņĀĢņāü ņ░ĖĻ│Āņ╣ś 0.01 ng/mL ņØ┤ĒĢś)ļŖö ĒÅÉņāēņĀäņ”ØņŚÉņä£ Ļ░üĻ░ü 0.21 ng/mL (8ļ¬ģ, 0.01-0.62 ng/mL), ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ 0.10 ng/mL (11ļ¬ģ, 0.01-0.47 ng/mL) (p= 0.177)ņØ┤ņŚłĻ│Ā pro-BNP (ļ│ĖņøÉ ņĀĢņāü ņ░ĖĻ│Āņ╣ś 233 pg/mL ņØ┤ĒĢś)ļŖö Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ 5,396 pg/mL (7ļ¬ģ, 1,509-13,023 pg/mL), ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ 11,577 pg/mL (11ļ¬ģ, 824-32,787 pg/mL) (p= 0.126)ņØ┤ņŚłļŗż. ĒÖśņ×É ĒŖ╣ņä▒ņŚÉņä£ ņä▒ļ│ä, ņŚ░ļĀ╣, ņĀĢļ¦źĒśłņĀäņ”ØņØś ļ│æļĀź, ņ£Āļ░£ņØĖņ×É, ļÅÖļ░śņ¦łĒÖś, ņŻ╝ ņ”ØņäĖ, ņ”ØņäĖ ļ░£ĒśäļČĆĒä░ ļé┤ņøÉĻ╣īņ¦ĆņØś ĻĖ░Ļ░äņŚÉņä£ Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØĻ│╝ ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ļæÉ ĻĄ░ Ļ░äņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż. ļÅÖļ¦źĒśł ņé░ņåīļČäņĢĢ, D-dimerņŚÉņä£ ļæÉ ĻĄ░ Ļ░äņŚÉ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļŖö ņŚåņŚłļŗż. ņ¦äļŗ©ņŗ£Ļ░ä(ĒØēļČĆ ņ╗┤Ēō©Ēä░ ļŗ©ņĖĄ ņ┤¼ņśü ņŗ£Ļ░ä)ļ│┤ļŗż ņ×äņāüņØśņØś ĒīÉļŗ©ņ£╝ļĪ£ ĒĢŁņØæĻ│ĀņĀ£Ļ░Ć ļ©╝ņĀĆ Ēł¼ņŚ¼ļÉ£ Ļ▓ĮņÜ░ļŖö Ļ┤æļ▓öņ£ä ļ░Å ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ Ļ░üĻ░ü 3ļ¬ģ(33%)Ļ│╝ 3ļ¬ģ(25%)ņØ┤ņŚłĻ│Ā, ņ¦äļŗ©ņŚÉņä£ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼Ļ╣īņ¦ĆņØś ņŗ£Ļ░ä(ņżæĻ░äĻ░Æ)ņØĆ Ļ░üĻ░ü 111ļČä(40-215ļČä)Ļ│╝ 162ļČä(28-2,684ļČä)ņØ┤ņŚłļŗż(Table 1).
ņØ╝ņ░© Ļ▓░Ļ│╝ņØĖ 30ņØ╝ ņØ┤ļé┤ ņé¼ļ¦ØņØĆ 5ļ¬ģ(24%)ņ£╝ļĪ£ Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×É 9ļ¬ģ ņżæ 4ļ¬ģ(44%), ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×É 12ļ¬ģ ņżæ 1ļ¬ģ(8%)ņ£╝ļĪ£ Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ 30ņØ╝ ņé¼ļ¦ØļźĀņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśņ£╝ļ®░(p= 0.010, Table 2, Fig. 2) ĒśłņĀä ņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ Ēøä 30ņØ╝ ņé¼ļ¦ØļźĀĻ│╝ 90ņØ╝ ņé¼ļ¦ØļźĀņØĆ ļÅÖņØ╝ĒĢśņśĆļŗż. ĒśłņĀäņÜ®ĒĢ┤ņĀ£ ņ╣śļŻīļČĆĒä░ ņé¼ļ¦ØĻ╣īņ¦ĆņØś ņŗ£Ļ░äņØĆ 1ņØ╝(ņżæĻ░äĻ░Æ, 0-13ņØ╝)ņØ┤ņŚłļŗż. ņČöņĀĢ ņé¼ļ¦ØņøÉņØĖņØĆ 5ļ¬ģ ņżæ 4ļ¬ģ(80%)ņŚÉņä£ ņÜ░ņŗ¼ņŗż ļČĆņĀäņ£╝ļĪ£ ņØĖĒĢ£ ņł£ĒÖśĻĖ░ ĒŚłĒāłņØ┤ņŚłĻ│Ā 1ļ¬ģ(20%)ņØĆ ņ╣śļ¬ģņĀü ņČ£ĒśłļĪ£ ņØĖĒĢ£ ņé¼ļ¦ØņØ┤ņŚłļŗż(Table 3). ņÜ░ņŗ¼ņŗż ļČĆņĀäņ£╝ļĪ£ ņØĖĒĢ£ ņé¼ļ¦Ø ņżæ 1ņśł(Case 4)ļŖö ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ Ēøä ņØ╝ņŗ£ņĀüņØĖ ĒśĖņĀäņØä ļ│┤ņśĆņ¦Ćļ¦ī ņÜ░ņŗ¼ļČĆņĀäņØś ĒÜīļ│ĄņØ┤ ļÉśņ¦Ć ņĢŖņĢśĻ│Ā, 1ņśł(Case 5)ļŖö ņŗ¼ņĀĢņ¦ĆļĪ£ ņŗ¼ĒÅÉņåīņāØņłĀ ļ░Å ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ļĪ£ ņØ╝ņŗ£ņĀü ĒśĖņĀäņØä ļ│┤ņśĆņ£╝ļéś ņÜ░ņŗ¼ļČĆņĀäņØś ĒÜīļ│ĄņØ┤ ļÉśņ¦Ć ņĢŖņĢä ņłśņłĀņĀü ĒśłņĀäņĀ£Ļ▒░ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆņ£╝ļéś ņé¼ļ¦ØĒĢśņśĆļŗż. ņ╣śļ¬ģņĀü ņČ£ĒśłļĪ£ ņČöņĀĢļÉśļŖö ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø 1ņśłļŖö ĒśłņĀäņÜ®ĒĢ┤ņĀ£ ņ╣śļŻīļĪ£ ņ×äņāüņĀü ĒśĖņĀäņØä ļ│┤ņŚ¼ ĒĢŁņØæĻ│ĀņĀ£ļź╝ ņ£Āņ¦ĆĒĢśĻ│Ā Ēć┤ņøÉĒĢśņśĆņ£╝ļéś ļåÆņØĆ INR Ļ▓░Ļ│╝(12.25)ļĪ£ ļ│┤Ļ│ĀļÉ£ 3ņØ╝ Ēøä ņé¼ļ¦ØĒĢ£ ņ▒äļĪ£ ņØæĻĖēņŗżņØä ļ░®ļ¼ĖĒĢśņŚ¼ ņ╣śļ¬ģņĀü ņČ£ĒśłļĪ£ ņØĖĒĢ£ ņé¼ļ¦Øņ£╝ļĪ£ ņČöņĀĢļÉśņŚłļŗż.
ņŻ╝ņÜöņČ£ĒśłņØĆ ņ┤Ø 21ļ¬ģ ņżæ 3ļ¬ģ(14%)ņŚÉņä£ ļ░£ņāØĒĢśņśĆĻ│Ā ņØ┤ ņżæ 2ļ¬ģņØĆ ņ£äņןĻ┤Ć ņČ£ĒśłļĪ£ ņłśĒśł Ēøä ĒÜīļ│ĄĒĢśņśĆĻ│Ā 1ļ¬ģ(5%)ņØĆ ņČ£ĒśłļĪ£ ņØĖĒĢ£ ņé¼ļ¦Øņ£╝ļĪ£ ņČöņĀĢļÉśņŚłļŗż. 90ņØ╝ ņØ┤ļé┤ ņĀĢļ¦źĒśłņĀäņ”ØņØś ņ×¼ļ░£ņØĆ ņŚåņŚłļŗż(Table 2).
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņŚ░ĻĄ¼ĻĖ░Ļ░ä ļÅÖņĢł ĒÅÉņāēņĀäņ”Øņ£╝ļĪ£ ņ¦äļŗ©ļ░øņØĆ ĒÖśņ×É 468ļ¬ģ ņżæ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ļź╝ Ēł¼ņŚ¼ ļ░øņØĆ ĒÖśņ×ÉļŖö 21ļ¬ģ(4.5%)ņ£╝ļĪ£ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ ņ╣śļŻīļź╝ ļ░øņØĆ Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØĻ│╝ ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×ÉņØś 30ņØ╝ ņé¼ļ¦ØļźĀņØĆ 44%, 8%ņśĆĻ│Ā ĒśłņĀäņÜ®ĒĢ┤ņĀ£ ņ╣śļŻīļČĆĒä░ ņé¼ļ¦ØĻ╣īņ¦ĆņØś ņŗ£Ļ░äņØĆ 1ņØ╝(ņżæĻ░äĻ░Æ, 0-13ņØ╝)ņØ┤ņŚłļŗż. ņČöņĀĢ ņé¼ļ¦ØņøÉņØĖņØĆ ņé¼ļ¦ØĒÖśņ×ÉņØś 80%Ļ░Ć ņÜ░ņŗ¼ņŗżļČĆņĀäņ£╝ļĪ£ ņØĖĒĢ£ ņł£ĒÖśĻĖ░ ĒŚłĒāłņØ┤ņŚłĻ│Ā 20%ļŖö ņ╣śļ¬ģņĀü ņČ£ĒśłņØ┤ņŚłļŗż. ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ Ēøä ņżæļīĆņČ£ĒśłņØĆ 3ļ¬ģ(14%)ņŚÉņä£ ļ░£ņāØĒĢśņśĆĻ│Ā ņØ┤ ņżæ 1ļ¬ģ(5%)ņŚÉņä£ ņé¼ļ¦ØņØś ņ¦üņĀæņĀüņØĖ ņøÉņØĖņØ┤ ļÉśņŚłļŗż.
ĒÅÉņāēņĀäņ”Ø ĒÖśņ×ÉņØś 25%ņŚÉņä£ļŖö ņ▓½ ņ×äņāüņ¢æņāüņØ┤ ĻĖēņé¼ļĪ£ ļéśĒāĆļéśĻ│Ā[14], 90ņØ╝ ņé¼ļ¦ØļźĀņØĆ 17.4%ļĪ£ ņØ┤ ņżæ 66%Ļ░Ć ņ▓½ 2ņŻ╝ņŚÉ ņé¼ļ¦ØĒĢ£ļŗż[3]. Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņØś ņ╣śļŻī ņĀäļץņØĆ ņĪ░ĻĖ░ņŚÉ ĒśłļźśņŚŁĒĢÖņĀü ĒÜīļ│ĄņØä ņŗ£ĒéżļŖö Ļ▓āņ£╝ļĪ£ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ļŖö ņŗĀņåŹĒ׳ ĒśłņĀäņØä ņÜ®ĒĢ┤ņŗ£ņ╝£ ņÜ░ņŗ¼ņŗż Ļ│╝ļČĆĒĢśļź╝ Ļ░Éņåīņŗ£ĒéżĻ│Ā ĒśłļźśņŚŁĒĢÖņĀü ņÜöņåīņÖĆ Ļ░ĆņŖżĻĄÉĒÖś ļČĆņĀäņØä ĒÜīļ│Ąņŗ£Ēé¼ ņłś ņ׳ļŗż[4].
Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ņÖĆ ĒĢŁņØæĻ│ĀņĀ£(ĒŚżĒīīļ”░) Ēł¼ņŚ¼ļź╝ ļ╣äĻĄÉĒĢ£ 5Ļ░£ņØś ļ¼┤ņ×æņ£ä ļīĆņĪ░ņŗ£ĒŚś ļ®öĒāĆļČäņäØņŚÉņä£ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ļŖö ĒśłņĀäņØś ņ×¼ļ░£ Ēś╣ņØĆ ņé¼ļ¦ØņØś ņ£äĒŚśņØä ņ£ĀņØśĒĢśĻ▓ī Ļ░Éņåīņŗ£ņ╝░ņØīņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż(9.4% vs. 19%, ņÜ░ļÅäļ╣ä 0.45, 95% ņŗĀļó░ĻĄ¼Ļ░ä 0.22-0.92) [15]. Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×ÉņŚÉņä£ ĒśłņĀäņÜ®ĒĢ┤ņĀ£(Streptokinase)ņÖĆ ĒĢŁņØæĻ│ĀņĀ£(ĒŚżĒīīļ”░) ļŗ©ļÅģņ╣śļŻīļź╝ ļ╣äĻĄÉĒĢ£ ļ¼┤ņ×æņ£ä ļīĆņĪ░ņŗ£ĒŚśņØĆ Ļ│äĒÜŹļÉ£ 40ļ¬ģņØś ĒÖśņ×É ņżæ 8ļ¬ģĻ╣īņ¦Ć ņ¦äĒ¢ēļÉ£ Ēøä ĒśłņĀäņÜ®ĒĢ┤ņĀ£ ņ╣śļŻīĻĄ░ 4ļ¬ģņŚÉņä£ ļ¬©ļæÉ ņāØņĪ┤ĒĢ£ Ļ▓āĻ│╝ ļīĆņĪ░ņĀüņ£╝ļĪ£ ĒŚżĒīīļ”░ ļŗ©ļÅģņ╣śļŻīĻĄ░ 4ļ¬ģ ļ¬©ļæÉ ņé¼ļ¦ØņØä ĒĢśņŚ¼ ņ£żļ”¼ņĀü ļ¼ĖņĀ£ļĪ£ ņżæļŗ©ļÉśņŚłļŗż[16]. ņØ┤ņÖĆ Ļ░ÖņØĆ ņŚ░ĻĄ¼Ļ▓░Ļ│╝ļĪ£ 2012ļģä ACCP (American College of Chest Physicians) Ļ░ĆņØ┤ļō£ļØ╝ņØĖņŚÉņä£ļŖö ņČ£ĒśłĻ│╝ Ļ┤ĆļĀ©ĒĢ£ ņŻ╝ņÜö ĻĖłĻĖ░ņ”ØņØ┤ ņŚåļŖö Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×ÉņŚÉņä£ ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻīļź╝ ĻČīĻ│ĀĒĢśĻ│Ā ņ׳ļŗż[1]. ĒĢśņ¦Ćļ¦ī ICOPER ņŚ░ĻĄ¼ņŚÉņä£ 90 mmHg ļ»Ėļ¦īņØś ĒÖśņ×É ņżæ 36%ļ¦īņØ┤ ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻīļź╝ ļ░øņØä ņłś ņ׳ņŚłĻ│Ā ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ļź╝ ĒĢ£ Ļ▓ĮņÜ░ņŚÉļÅä Ēł¼ņŚ¼ļź╝ ĒĢśņ¦Ć ņĢŖņĢśļŹś ĻĄ░Ļ│╝ ļ╣äĻĄÉĒĢśļ®┤ 90ņØ╝ ņé¼ļ¦ØļźĀņØä Ļ░Éņåīņŗ£Ēéżņ¦Ć ļ¬╗ĒĢśņŚ¼(46.3% vs. 55.1%, ņ£äĒŚśļ╣ä 0.79, 95% ņŗĀļó░ĻĄ¼Ļ░ä 0.44-1.43) ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻīĻ░Ć ļŗ©ĻĖ░ņé¼ļ¦ØļźĀņØä Ļ░Éņåīņŗ£ĒéżļŖöņ¦ĆļŖö ļČłļČäļ¬ģĒĢśļŗżĻ│Ā ļ│┤Ļ│ĀļÉśĻĖ░ļÅä ĒĢśņśĆļŗż[4].
ņ×äņāüĻ▓ĮĻ│╝ņŚÉņä£ Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņØĆ ņ¦äļŗ© Ēøä ņé¼ļ¦ØĻ╣īņ¦Ć ĻĖēņä▒ Ļ▓ĮĻ│╝ļź╝ ļ│┤ņØ┤Ļ│Ā ņŗ¼ĒÅÉņĀĢņ¦ĆĻ░Ć ļéśĒāĆļé£ Ļ▓ĮņÜ░ 70%ņØś ņé¼ļ¦ØļźĀņØä ļ│┤ņØ┤Ļ│Ā ņ׳ņ¢┤ ņŗĀņåŹĒĢ£ ņ¦äļŗ© ļ░Å ņāØņ▓┤ņ¦ĢĒøäņÖĆ ņÜ░ņŗ¼ļČĆņĀä ņĀĢļÅäņŚÉ ļö░ļźĖ ņŗĀņåŹĒĢ£ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ņØś Ļ▓░ņĀĢņØ┤ ĒĢäņÜöĒĢśļŗż[1]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ņ¦äļŗ© ņŗ£Ļ░äļČĆĒä░ ņŗżņĀ£ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼Ļ╣īņ¦ĆņØś ņŗ£Ļ░äņØĆ 111ļČä(40-215ļČä)ņ£╝ļĪ£ ļ╣äĻĄÉņĀü ņŗĀņåŹĒĢ£ ņ╣śļŻīĻ▓░ņĀĢņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā 44%ņØś ļåÆņØĆ ņé¼ļ¦ØļźĀņØä ļ│┤ņśĆļŗż. ņé¼ļ¦ØļźĀ Ļ░Éņåīļź╝ ņ£äĒĢ£ ņ¦äļŗ© ļ░Å ņ╣śļŻī ņĀäļץņŚÉņä£ Ē¢źĒøä Ļ│ĀļĀżĒĢĀ ņĀÉņØĆ ļŗżņØīĻ│╝ Ļ░Öļŗż. ņ▓½ņ¦Ė, ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ ņ×äņāüņØśņØś ĒīÉļŗ©ņŚÉ ļö░ļźĖ ņ¦äļŗ© ņĀä ĒĢŁņØæĻ│ĀņĀ£ņØś ņÜ░ņäĀņĀü Ēł¼ņŚ¼ļŖö 33%ņŚÉņä£ļ¦ī ņŗ£Ē¢ēļÉśņ¢┤ ņ¦äļŗ©Ļ▓Ćņé¼ ņĀä ņ¦äņ░░ ļ░Å ņ×äņāüņĀü ĒÅēĻ░ĆņŚÉ ļö░ļźĖ ĒĢŁņØæĻ│ĀņĀ£ņØś ļ│┤ļŗż ņĀüĻĘ╣ņĀü Ēł¼ņŚ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż. ļæśņ¦Ė, 44%ņŚÉņä£ļŖö ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ņŚÉļÅä ļ╣äĻ░ĆņŚŁņĀüņØĖ ņŗ¼ĒÅÉĒŚłĒāłļĪ£ņØś ņ¦äĒ¢ēņØä ņŚŁņĀäņŗ£Ēéżņ¦Ć ļ¬╗ĒĢśņśĆĻ│Ā ņŗ¼ņĀĢņ¦ĆĻ░Ć ļ░£ņāØĒĢ£ ĒÖśņ×ÉņØś 80%Ļ░Ć ņé¼ļ¦ØĒĢśņŚ¼ ņżæņ”Øņ£╝ļĪ£ņØś ņ¦äĒ¢ē ņĀä ņČöĻ░ĆņĀüņØĖ ņ¦äļŗ©ņĀü ļģĖļĀźņØ┤ ĒĢäņÜöĒĢśļŗż.
ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×ÉņŚÉĻ▓ī ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ņØś ĒÜ©Ļ│╝ļź╝ ĒÖĢņØĖĒĢ£ ļ¼┤ņ×æņ£ä ļīĆņĪ░ņŗ£ĒŚśņØĖ MAPPET-3 (Management Strategies and Prognosis of Pulmonary Embolism Trial-3) ņŚ░ĻĄ¼ļŖö ĒśłņĀäņÜ®ĒĢ┤ņĀ£(alteplase)Ļ│╝ ĒĢŁņØæĻ│ĀņĀ£ņØś ļ│æņÜ®Ēł¼ņĢĮņØ┤ ĒĢŁņØæĻ│ĀņĀ£ ļŗ©ļÅģĒł¼ņĢĮņŚÉ ļ╣äĒĢ┤ ņØ╝ņ░©Ļ▓░Ļ│╝ņØĖ ļ│æņøÉļé┤ ņé¼ļ¦ØĻ│╝ ņ╣śļŻī Ļ░ĢĒÖö(escalation)ļź╝ ĒĢäņÜöļĪ£ ĒĢśļŖö ņ×äņāüņĀü ņĢģĒÖö(ņŖ╣ņĢĢņĀ£ Ēł¼ņŚ¼, ĻĄ¼ņĪ░ņłśļŗ©ņ£╝ļĪ£ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ ņé¼ņÜ®[rescue fibrinolysis], ņØĖĻ│Ą ĒśĖĒØĪĻĖ░ ņé¼ņÜ®, ņŗ¼ĒÅÉ ņåīņāØņłĀ ļ░Å ņØæĻĖē ĒśłņĀäņĀ£Ļ▒░ņłĀ)Ļ░Ć Ļ░ÉņåīļÉśņŚłļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż[17]. ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻī ņĀäĒøä ņŗ¼ņ┤łņØīĒīī Ļ▓Ćņé¼ļĪ£ 6Ļ░£ņøöĻ░ä ņČöņĀüĒĢ£ ļæÉ ņŚ░ĻĄ¼ņŚÉņä£ ĒŚżĒīīļ”░ ļŗ©ļÅģņ╣śļŻīĻĄ░ņŚÉ ļ╣äĒĢ┤ ĒÅÉļÅÖļ¦źĻ│ĀĒśłņĢĢņØś ĒśĖņĀä[18] ļ░Å ņÜ░ņŗ¼ņŗżļ╣äļīĆņØś ĒśĖņĀä[19]ņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļéśĒāĆļé¼ņ¦Ćļ¦ī ņé¼ļ¦ØļźĀņØś Ļ░Éņåīļź╝ Ļ░ĆņĀĖņśżņ¦ĆļŖö ļ¬╗ĒĢśņśĆļŗż[19]. Ēśäņ×¼ ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻīņØś Ļ▓ĮņÜ░ ņāØņĪ┤ņØ┤ļōØņŚÉ ļīĆĒĢ┤ņä£ļŖö ļģ╝ļ×ĆņØ┤ ņ׳ļŖö ņāüĒā£ļĪ£[7,8] ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņØä ļīĆņāüņ£╝ļĪ£ ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻī(tenecteplase) ļ░Å ĒŚżĒīīļ”░ ņ╣śļŻīņÖĆ ĒŚżĒīīļ”░ ļŗ©ļÅģņ╣śļŻīņØś ņāØņĪ┤ņØ┤ļōØņŚÉ ļīĆĒĢ£ PEITHO (Pulmonary Embolism International Thrombolysis Trial) ņŚ░ĻĄ¼Ļ░Ć ņ¦äĒ¢ē ņżæņØ┤ļŗż[20]. ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻīļŖö ņ╣śļ¬ģņĀü ņČ£Ēśłņ£äĒŚśņä▒Ļ│╝ ĒÖśņ×ÉņāüĒā£ ļ░Å ņāØņĪ┤ņØ┤ļōØņØä Ļ│ĀļĀżĒĢ£ Ļ░£ļ│äĒÖöļÉ£ ņ╣śļŻī ņĀæĻĘ╝ņØ┤ ĒĢäņÜöĒĢ£ ņāüĒā£ļĪ£ 2011ļģä AHA (American Heart Association) Ļ░ĆņØ┤ļō£ļØ╝ņØĖņŚÉņä£ļŖö ņČ£ĒśłņØś ņ£äĒŚśņä▒ņØ┤ ļé«ņ£╝ļ®┤ņä£ ļéśņü£ ņśłĒøäļź╝ ņŗ£ņé¼ĒĢśļŖö ņ×äņāüņĀü ņ¦ĢĒøäĻ░Ć ņ׳ņØä ļĢī(ņāłļĪ£ ļ░£ņāØĒĢ£ ĒśłļźśņŚŁĒĢÖņĀü ļČłņĢłņĀĢ, ĒśĖĒØĪļČĆņĀäņØś ņ¦äĒ¢ē, ņżæņ”Ø ņÜ░ņŗ¼ļČĆņĀä, ņŻ╝ņÜö ņŗ¼ĻĘ╝Ļ┤┤ņé¼) ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻīļź╝ ņĀ£ņĢłĒĢśĻ│Ā ņ׳ļŗż[11]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņØś ņ¦äļŗ©ļČĆĒä░ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼Ļ╣īņ¦Ć 162ļČä(28-2,684ļČä)ņ£╝ļĪ£ Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØĻ│╝ ļ╣äĻĄÉ ņŗ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśĻ│Ā(p= 0.13) ņ¦äļŗ© ņĀä ĒĢŁņØæĻ│ĀņĀ£ Ēł¼ņŚ¼ļŖö 25%ņŚÉņä£ļ¦ī ņŗ£Ē¢ēļÉśņŚłņ¦Ćļ¦ī ņé¼ļ¦ØļźĀņØĆ Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ļé«ņĢśĻ│Ā(8% vs. 44%, p= 0.01) ĒśłņĀäņØś ņ×¼ļ░£ņØ┤ļéś ņÜ░ņŗ¼ļČĆņĀäņØś ļ░£ņāØņ£╝ļĪ£ ņØĖĒĢ£ ņé¼ļ¦ØņØĆ ņŚåņŚłļŗż.
ņČ£ĒśłņØĆ ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻīņŚÉņä£ Ļ░Ćņן ņÜ░ļĀżĒĢśļŖö ĒĢ®ļ│æņ”Øņ£╝ļĪ£ ļ░£ņāØļ╣łļÅäļŖö ļ│┤Ļ│Āļ¦łļŗż ņ░©ņØ┤Ļ░Ć ņ׳ļŗż. ĻĖēņä▒ ĒÅÉņāēņĀäņ”ØņŚÉņä£ ņŻ╝ņÜöņČ£ĒśłņØĆ ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░ 9.1-25%, ĒĢŁņØæĻ│Āņ╣śļŻīļ¦īņØä ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░ 6.1-9.7%ļĪ£ ļ│┤Ļ│ĀļÉśņŚłĻ│Ā[2-4,7,15,21,22] ļæÉĻ░£ļé┤ ņČ£ĒśłņØĆ 0.3-3.0%ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż[2,3,23]. ļ¼┤ņ×æņ£ä ļīĆņĪ░ņŚ░ĻĄ¼ņØś ļČäņäØņŚÉņä£ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ ņ╣śļŻīņØś ņŻ╝ņÜöņČ£Ēśł ņ£äĒŚśņØĆ ĒĢŁņØæĻ│ĀņĀ£ ļŗ©ļÅģ ņ╣śļŻīņŚÉ ļ╣äĒĢ┤ 1.6ļ░░ ņ”ØĻ░Ćņŗ£ņ╝░ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż(ļ╣äĻĄÉņ£äĒŚśļÅä 1.63, 95% ņŗĀļó░ĻĄ¼Ļ░ä 1.0-2.68) [1,7,15]. ņØ┤ņÖĆ Ļ░ÖņØĆ Ļ▓░Ļ│╝ļōżņØä ĒåĀļīĆļĪ£ Ļ░ĆņØ┤ļō£ļØ╝ņØĖņŚÉņä£ļŖö ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ļĪ£ ņØĖĒĢ£ ĒśłļźśņŚŁĒĢÖņĀü ņØ┤ļōØĻ│╝ ņČ£ĒśłļĪ£ ņØĖĒĢ£ ņåÉņŗżņØä Ļ│ĀļĀżĒĢśņŚ¼ ņŗĀņżæĒĢ£ Ēł¼ņŚ¼ļź╝ ĻČīĻ│ĀĒĢśĻ│Ā ņ׳ļŗż[1,11]. Fiumara ļō▒[21]ņØĆ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ ņ╣śļŻīļź╝ ņŗ£Ē¢ēĒĢ£ 104ļ¬ģņØś ĻĖēņä▒ ĒÅÉņāēņĀäņ”Ø ĒÖśņ×ÉņŚÉņä£ ņłśņČĢĻĖ░ ĒśłņĢĢ 90 mmHg ļ»Ėļ¦īņ£╝ļĪ£ ņŖ╣ņĢĢņĀ£ ņé¼ņÜ®(ņÜ░ļÅäļ╣ä 115, 95% ņŗĀļó░ĻĄ¼Ļ░ä 9.4-1410.9), ņĢö(ņÜ░ļÅäļ╣ä 16.0, 95% ņŗĀļó░ĻĄ¼Ļ░ä 3.2-80), ļŗ╣ļć©(ņÜ░ļÅäļ╣ä 9.6, 95% ņŗĀļó░ĻĄ¼Ļ░ä 1.7-54), ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ ņĀä ņāüņŖ╣ļÉ£ INR (international normalized ratio) (ņÜ░ļÅäļ╣ä 5.8, 95% ņŗĀļó░ĻĄ¼Ļ░ä 1.5-22)ņØĆ ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻīņŚÉ ļö░ļźĖ ņŻ╝ņÜöņČ£ĒśłņØś ļÅģļ”ĮņĀü ņØĖņ×ÉļĪ£ ļ│┤Ļ│ĀĒĢśņśĆņ¦Ćļ¦ī Ēśäņ×¼Ļ╣īņ¦Ć ņČ£ĒśłĒĢ®ļ│æņ”ØņØä Ļ░Éņåīņŗ£ĒéżĻĖ░ ņ£äĒĢ£ Ļ▓Ćņ”ØļÉ£ ņśłņĖĪļÅäĻĄ¼ļŖö ņŚåļŖö ņŗżņĀĢņØ┤ļŗż.
ĻĄŁļé┤ņŚÉņä£ ĒśłņĀäņÜ®ĒĢ┤ņ¦ĆļŻīļź╝ ņŗ£Ē¢ēĒĢ£ 40ļ¬ģņØś ĒÅÉņāēņĀäņ”Ø ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ņŚÉņä£ ņŻ╝ņÜöņČ£ĒśłņØ┤ 2ļ¬ģ(5%)ņŚÉņä£ ļ░£ņāØĒĢśĻ│Ā ņØ┤ ņżæ 1ļ¬ģ(2.5%)ņØ┤ ļæÉĻ░£ļé┤ ņČ£ĒśłļĪ£ ņé¼ļ¦ØĒĢśņśĆļŗż[10]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŻ╝ņÜöņČ£Ēśł ļ░£ņāØļźĀņØĆ 14%ņśĆĻ│Ā ņČ£ĒśłņŚÉ ņØśĒĢ£ ņé¼ļ¦ØņØ┤ 5%ņŚÉņä£ ļ░£ņāØĒĢśņśĆļŗż. ņ╣śļ¬ģņĀü ņČ£ĒśłļĪ£ ņČöņĀĢļÉśļŖö ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø 1ņśłļŖö ĒĢŁņØæĻ│Āņ╣śļŻīņŚÉ ļö░ļźĖ ļåÆņØĆ INR Ļ▓░Ļ│╝Ļ░Ć ņé¼ļ¦ØņøÉņØĖņ£╝ļĪ£ ņČöņĀĢļÉśņŚłļŗż.
ņÜ░ņŗ¼ņŗż ĻĖ░ļŖźļČĆņĀä(dysfunction)ņØĆ ņĀĢņāüĒśłņĢĢ ĒÅÉņāēņĀäņ”ØņŚÉņä£ ļŗ©ĻĖ░ņé¼ļ¦ØņØś ņśłņĖĪņØĖņ×É[24]ļĪ£ Sanchez ļō▒[6]ņØĆ ļ®öĒāĆļČäņäØņØä ĒåĄĒĢ┤ ņŗ¼ņ┤łņØīĒīī(ļ╣äĻĄÉņ£äĒŚśļ╣ä 2.53, 95% ņŗĀļó░ĻĄ¼Ļ░ä 1.17-5.50) ļ░Å ņĀäņé░ĒÖö ļŗ©ņĖĄņ┤¼ņśüņØś ņÜ░ņŗ¼ņŗż ĒÖĢņן(ļ╣äĻĄÉņ£äĒŚśļ╣ä 2.3; 95% ņŗĀļó░ĻĄ¼Ļ░ä, 0.9-5.98)ņØ┤ ņé¼ļ¦Øņ£äĒŚśņŚÉ ļīĆĒĢ£ ņśłņĖĪņØĖņ×ÉļĪ£ ļ│┤Ļ│ĀĒĢśņśĆļŗż. Schoepf ļō▒[25]ņØĆ ņĀäņé░ĒÖö ļŗ©ņĖĄņ┤¼ņśüņØä ņŗ£Ē¢ēĒĢ£ ĻĖēņä▒ ĒÅÉņāēņĀäņ”Ø ĒÖśņ×É 431ļ¬ģņØä ļīĆņāüņ£╝ļĪ£ ņ¦äļŗ© ļŗ╣ņŗ£ ņÜ░ņŗ¼ņŗż ĒÖĢņןņØ┤ 30ņØ╝ ņé¼ļ¦ØļźĀņØä ņ”ØĻ░Ćņŗ£Ēé┤ņØä ļ│┤Ļ│ĀĒĢśņśĆļŗż(ņ£äĒŚśļ╣ä 5.17; 95% ņŗĀļó░ĻĄ¼Ļ░ä 1.63-16.35). ņāØĒÖöĒĢÖņĀü ņ¦ĆĒæ£ļĪ£ļŖö ņÜ░ņŗ¼ņŗżņØś ņåīĻ▓Įņāē(microinfarction)ņØä ļéśĒāĆļé┤ļŖö troponin ņāüņŖ╣(ņÜ░ļÅäļ╣ä 5.90, 95% CI 2.68-12.95) [26], ņŗ¼ĻĘ╝ņäĖĒżņØś ņĀäļŗ© ļ│ĆĒśĢļĀź(shear stress)ņØä ļéśĒāĆļé┤ļŖö BNP ņāüņŖ╣(ņÜ░ļÅäļ╣ä 9.51, 95% CI 3.16-28.64), N-terminal pro-BNP ņāüņŖ╣(ņÜ░ļÅäļ╣ä 5.74, 95% CI 2.18-15.13) [27]ņØ┤ ņĀĢņāüĒśłņĢĢņØä ļ│┤ņØ┤ļŖö ĒÅÉņāēņĀäņ”Ø ĒÖśņ×ÉņŚÉņä£ ņé¼ļ¦Øņ£äĒŚś ņśłņĖĪņØĖņ×ÉļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż. TroponinņØ┤ ņāüņŖ╣ĒĢśļŖö ĻĖ░ņĀäņØĆ ņé░ņåīĻ│ĄĻĖēņØś ļ│ĆĒÖö ļ░Å ņÜ░ņŗ¼ĻĖ░ļŖź ņ£Āņ¦Ćļź╝ ņ£äĒĢ£ ņé░ņåīņÜöĻĄ¼ļ¤ēņØś ņ”ØĻ░ĆļĪ£ ņØĖĒĢ┤ ņŗ¼ĻĘ╝ĒŚłĒśł ļ░Å ņÜ░ņŗ¼ņŗż ņåīĻ▓ĮņāēņØ┤ Ļ┤ĆņŚ¼ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉśĻ│Ā ņ׳ļŗż[28]. ĻĘĖļ¤¼ļéś ņŗĀĻ▓ĮĒśĖļź┤ļ¬¼ņØś ņ×ÉĻĘ╣, ņŚ╝ņ”Ø, ĒŚłĒśł ļō▒ņØś ņāüĒÖ®ņŚÉņä£ļÅä ņāüņŖ╣ĒĢĀ ņłś ņ׳ņ¢┤[6] ĒÖśņ×ÉņØś ņĀäņŗĀ ņāüĒā£ļź╝ Ļ│ĀļĀżĒĢ£ ĒĢ┤ņäØņØ┤ ĒĢäņÜöĒĢśĻ▓ĀĻ│Ā, ņāüņŖ╣ĒĢśļŖö ĒÅŁĻ│╝ ņśłĒøäņÖĆņØś ņāüĻ┤Ćņä▒ņŚÉ ļīĆĒĢ┤ņä£ļŖö ņ×ÉļŻīĻ░Ć ļČĆņĪ▒ĒĢ£ ņāüĒā£ņØ┤ļŗż. ņŚ░ļĀ╣, ņä▒ļ│ä, ļÅÖļ░ś ņ¦łĒÖś ļ░Å ĒśłņĢĢ, ļ¦źļ░Ģ, ĒśĖĒØĪņłś, ņ▓┤ņś©, ņØśņŗØņāüĒā£ ĻĘĖļ”¼Ļ│Ā ļÅÖļ¦źĒśł ņé░ņåī ĒżĒÖöļÅäļź╝ ņ░©ļō▒ĒĢśņŚ¼ ņĀÉņłśĒÖöĒĢ£ ĒÅÉņāēņĀäņżæņ”ØļÅäņ¦Ćņłś(PESI score)ļŖö ĒÅÉņāēņĀäņ”ØņØś 30ņØ╝ ņé¼ļ¦ØļźĀņØä ņśłņĖĪĒĢśļŖöļŹ░ ņ£ĀņÜ®ĒĢśļŗż[29].
ļ│Ė ņŚ░ĻĄ¼ļŖö Ļ┤æļ▓öņ£ä ļ░Å ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×Éļ¦īņØä ļīĆņāüņ£╝ļĪ£ ĒĢśņŚ¼ ļīĆļČĆļČäņØś ĒÖśņ×ÉņŚÉņä£ ņŗ¼ņ┤łņØīĒīīņŚÉņä£ ņÜ░ņŗ¼ņŗż ĻĖ░ļŖźņĀĆĒĢś ļ░Å ņāØĒÖöĒĢÖņĀü ņ¦ĆĒæ£ņØś ņāüņŖ╣ņØ┤ ņ׳ņŚłĻ│Ā, ļæÉ ĻĄ░ Ļ░äņŚÉļŖö ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. ņĀ£ĒĢ£ļÉ£ ĒÖśņ×ÉĻĄ░ņ£╝ļĪ£ ņØĖĒĢ┤ ņśłĒøäņØĖņ×ÉļĪ£ņä£ņØś ņŚŁĒĢĀņØä ĒĢśņ¦ĆļŖö ļ¬╗ĒĢśņśĆļŗż.
ļ│Ė ņŚ░ĻĄ¼ņØś ņĀ£ĒĢ£ņĀÉņØĆ ņ▓½ņ¦Ė, ĒśłņĀäņÜ®ĒĢ┤ņĀ£ļź╝ Ēł¼ņŚ¼ĒĢ£ ĒÖśņ×Éļ¦īņØä ļīĆņāüņ£╝ļĪ£ ĒĢśņśĆĻĖ░ ļĢīļ¼ĖņŚÉ 30ņØ╝ ņé¼ļ¦ØļźĀņØ┤ Ļ│╝ņåīĒÅēĻ░ĆļÉĀ ņłś ņ׳ļŗżļŖö ņĀÉņØ┤ļŗż. ņČ£ĒśłĒĢ®ļ│æņ”Ø ļ░£ņāØņØś ņ£äĒŚśņØ┤ ļåÆņĢä ĒśłņĀäņÜ®ĒĢ┤ņĀ£ļź╝ Ēł¼ņŚ¼ĒĢĀ ņłś ņŚåņŚłļŹś ĒÖśņ×ÉļōżĻ│╝ ņ×äņāüņĀüņ£╝ļĪ£ ĒÅÉņāēņĀäņ”ØņØ┤ ņØśņŗ¼ļÉśņŚłļŗżĻ│Ā ĒĢśļŹöļØ╝ļÅä ņāØņ▓┤ņ¦ĢĒøäņØś ļČłņĢłņĀĢņ£╝ļĪ£ ņśüņāüņØśĒĢÖņĀü ņ¦äļŗ©ņØ┤ ļČłĻ░ĆļŖźĒĢśņśĆļŹś ĒÖśņ×ÉļōżņØĆ ļīĆņāüĻĄ░ņŚÉ ĒżĒĢ©ļÉśņ¦Ć ņĢŖņĢśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. ĒÅÉņāēņĀäņ”Ø ĒÖśņ×É ļĀłņ¦ĆņŖżĒŖĖļ”¼ņØĖ ICOPER ņŚ░ĻĄ¼ņØś Ļ▓ĮņÜ░ Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×É ņżæ 1/3 ļ¦īņØ┤ ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻīļź╝ ļ░øņĢśļŗż[3]. ļæśņ¦Ė, ļŗ©ņØ╝ĻĖ░Ļ┤Ć ņŚ░ĻĄ¼ņØ┤Ļ│Ā ņ×ÉļŻīņłśņ¦æņØä ĒåĄĒĢ£ ĒøäĒ¢źņĀü ņŚ░ĻĄ¼ļĪ£ ņåīņłśņØś ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ ĒÖśņ×Éļ¦īņØä ļīĆņāüņ£╝ļĪ£ ĒĢśņŚ¼ ņĀäņ▓┤ ĒÅÉņāēņĀäņ”Ø ĒÖśņ×ÉņŚÉņä£ Ļ┤æļ▓öņ£ä ļ░Å ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×É ĻĄ░ļ│ä ĒśłņĀäņÜ®ĒĢ┤ņĀ£ Ēł¼ņŚ¼ļ╣łļÅäņŚÉ ļö░ļźĖ ņĀäņ▓┤ ņé¼ļ¦ØļźĀņØä ļ│┤Ļ│ĀĒĢśņ¦Ć ļ¬╗ĒĢśņśĆļŗż.
ļ│Ė ņŚ░ĻĄ¼ļŖö Ļ┤æļ▓öņ£ä ļ░Å ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”Ø ĒÖśņ×ÉņŚÉņä£ņØś ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻīņØś ņ×äņāüņ¢æņāüĻ│╝ Ļ▓░Ļ│╝ņŚÉ ļīĆĒĢ£ ņ×ÉļŻīļĪ£ņä£ ĒśłļźśņŚŁĒĢÖņĀü ļČłņĢłņĀĢņØ┤ ļÅÖļ░śļÉ£ Ļ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņŚÉņä£ ņé¼ļ¦ØļźĀņØ┤ ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśĻ│Ā ļæÉĻ░£ļé┤ ņČ£ĒśłņØä ĒżĒĢ©ĒĢ£ ņŻ╝ņÜöņČ£ĒśłņØĆ ņØ┤ņĀ£Ļ╣īņ¦Ć ļ│┤Ļ│ĀļÉ£ Ļ▓░Ļ│╝ņÖĆ ņ£Āņé¼ĒĢ£ ļ░£ņāØļźĀņØä ļ│┤ņśĆļŗż. 30ņØ╝Ļ│╝ 90ņØ╝ ņāØņĪ┤ņ£©ņØ┤ ļÅÖņØ╝ĒĢśņŚ¼ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ ņ╣śļŻī Ēøä ņé¼ļ¦ØņØś ļīĆļČĆļČäņØĆ ĒśłņĀäņÜ®ĒĢ┤ņĀ£ ņ╣śļŻī ņ┤łĻĖ░ 30ņØ╝ņŚÉ ņ¦æņżæļÉśņ¢┤ ņ׳ņØīņØä ņŗ£ņé¼ĒĢ£ļŗż. Ļ┤æļ▓öņ£ä ļ░Å ņĢäĻ┤æļ▓öņ£ä ĒÅÉņāēņĀäņ”ØņØś ĒśłņĀäņÜ®ĒĢ┤ņ╣śļŻīņŚÉ ļīĆĒĢ£ ņāØņĪ┤ņØ┤ļōØ ļģ╝ļ×ĆņŚÉ ļīĆĒĢ┤ņä£ļŖö Ē¢źĒøä ļīĆĻĘ£ļ¬©ņØś ņĀäĒ¢źņĀü ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
REFERENCES
1. Kearon C, Akl EA, Comerota AJ, et al. Antithrombotic therapy for VTE disease: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012;141(2 Suppl):e419SŌĆōe494S.

2. Kasper W, Konstantinides S, Geibel A, et al. Management strategies and determinants of outcome in acute major pulmonary embolism: results of a multicenter registry. J Am Coll Cardiol 1997;30:1165ŌĆō1171.


3. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999;353:1386ŌĆō1389.


4. Kucher N, Rossi E, De Rosa M, Goldhaber SZ. Massive pulmonary embolism. Circulation 2006;113:577ŌĆō582.


5. Kucher N, Rossi E, De Rosa M, Goldhaber SZ. Prognostic role of echocardiography among patients with acute pulmonary embolism and a systolic arterial pressure of 90 mm Hg or higher. Arch Intern Med 2005;165:1777ŌĆō1781.


6. Sanchez O, Trinquart L, Colombet I, et al. Prognostic value of right ventricular dysfunction in patients with haemodynamically stable pulmonary embolism: a systematic review. Eur Heart J 2008;29:1569ŌĆō1577.


7. Thabut G, Thabut D, Myers RP, et al. Thrombolytic therapy of pulmonary embolism: a meta-analysis. J Am Coll Cardiol 2002;40:1660ŌĆō1667.


8. Agnelli G, Becattini C, Kirschstein T. Thrombolysis vs heparin in the treatment of pulmonary embolism: a clinical outcome-based meta-analysis. Arch Intern Med 2002;162:2537ŌĆō2541.


9. Han SY, Song JK, Lee SD, et al. Comparison of effect between thrombolysis and anticoagulation in major pulmonary thromboembolism. Tuberc Respir Dis 2005;59:487ŌĆō496.

10. Yoo JW, Kim W, Choi CM, et al. The therapeutic efficacy and the bleeding complications of urokinase and alteplase in patients with massive pulmonary thromboembolism. Tuberc Respir Dis 2009;66:6ŌĆō12.

11. Jaff MR, McMurtry MS, Archer SL, et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association. Circulation 2011;123:1788ŌĆō1830.


12. B├╝ller HR, Davidson BL, Decousus H, et al. Subcutaneous fondaparinux versus intravenous unfractionated heparin in the initial treatment of pulmonary embolism. N Engl J Med 2003;349:1695ŌĆō1702.


13. B├╝ller HR, Davidson BL, Decousus H, et al. Fondaparinux or enoxaparin for the initial treatment of symptomatic deep venous thrombosis: a randomized trial. Ann Intern Med 2004;140:867ŌĆō873.



14. Heit JA. The epidemiology of venous thromboembolism in the community: implications for prevention and management. J Thromb Thrombolysis 2006;21:23ŌĆō29.


15. Wan S, Quinlan DJ, Agnelli G, Eikelboom JW. Thrombolysis compared with heparin for the initial treatment of pulmonary embolism: a meta-analysis of the randomized controlled trials. Circulation 2004;110:744ŌĆō749.


16. Jerjes-Sanchez C, Ram├Łrez-Rivera A, de Lourdes Garc├Ła M, et al. Streptokinase and heparin versus heparin alone in massive pulmonary embolism: a randomized controlled trial. J Thromb Thrombolysis 1995;2:227ŌĆō229.


17. Konstantinides S, Geibel A, Heusel G, Heinrich F, Kasper W; Management Strategies and Prognosis of Pulmonary Embolism-3 Trial Investigators. Heparin plus alteplase compared with heparin alone in patients with submassive pulmonary embolism. N Engl J Med 2002;347:1143ŌĆō1150.


18. Kline JA, Steuerwald MT, Marchick MR, Hernandez-Nino J, Rose GA. Prospective evaluation of right ventricular function and functional status 6 months after acute submassive pulmonary embolism: frequency of persistent or subsequent elevation in estimated pulmonary artery pressure. Chest 2009;136:1202ŌĆō1210.



19. Fasullo S, Scalzo S, Maringhini G, et al. Six-month echocardiographic study in patients with submassive pulmonary embolism and right ventricle dysfunction: comparison of thrombolysis with heparin. Am J Med Sci 2011;341:33ŌĆō39.


20. Steering Committee. Single-bolus tenecteplase plus heparin compared with heparin alone for normotensive patients with acute pulmonary embolism who have evidence of right ventricular dysfunction and myocardial injury: rationale and design of the Pulmonary Embolism Thrombolysis (PEITHO) trial. Am Heart J 2012;163:33ŌĆō38.

21. Fiumara K, Kucher N, Fanikos J, Goldhaber SZ. Predictors of major hemorrhage following fibrinolysis for acute pulmonary embolism. Am J Cardiol 2006;97:127ŌĆō129.


22. Meyer G, Gisselbrecht M, Diehl JL, Journois D, Sors H. Incidence and predictors of major hemorrhagic complications from thrombolytic therapy in patients with massive pulmonary embolism. Am J Med 1998;105:472ŌĆō477.


23. Kanter DS, Mikkola KM, Patel SR, Parker JA, Goldhaber SZ. Thrombolytic therapy for pulmonary embolism: frequency of intracranial hemorrhage and associated risk factors. Chest 1997;111:1241ŌĆō1245.


24. Kreit JW. The impact of right ventricular dysfunction on the prognosis and therapy of normotensive patients with pulmonary embolism. Chest 2004;125:1539ŌĆō1545.


25. Schoepf UJ, Kucher N, Kipfmueller F, Quiroz R, Costello P, Goldhaber SZ. Right ventricular enlargement on chest computed tomography: a predictor of early death in acute pulmonary embolism. Circulation 2004;110:3276ŌĆō3280.


26. Becattini C, Vedovati MC, Agnelli G. Prognostic value of troponins in acute pulmonary embolism: a meta-analysis. Circulation 2007;116:427ŌĆō433.


27. Cavallazzi R, Nair A, Vasu T, Marik PE. Natriuretic peptides in acute pulmonary embolism: a systematic review. Intensive Care Med 2008;34:2147ŌĆō2156.


Annual number of patients diagnosed with venous thromboembolism and injected with thrombolytics in one institute. The frequency of thrombolytic therapy in patients with PE was 4.5% in the determined period regardless of disease severity. PE, pulmonary embolism; DVT, deep vein thrombosis.
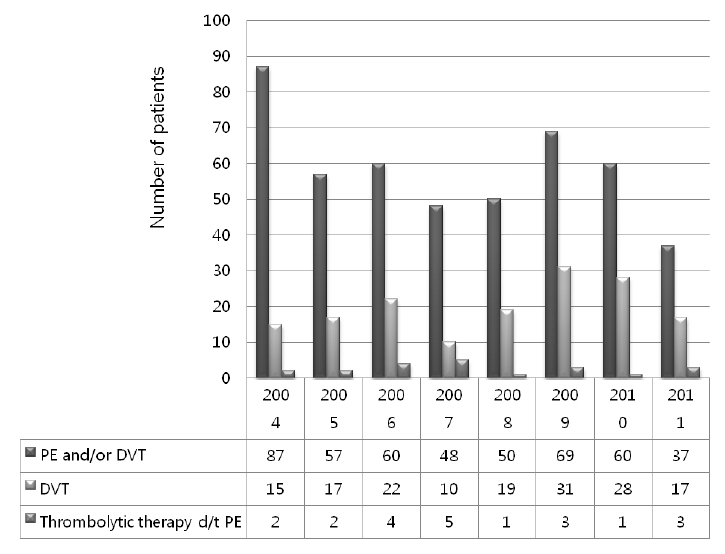
Figure┬Ā1.
Kaplan-Meier curves for overall mortality in patients receiving thrombolytic therapy according to type of PE. Overall mortality of massive the PE group was significantly higher than that of the submassive PE group (log rank, p = 0.010). PE, pulmonary embolism.
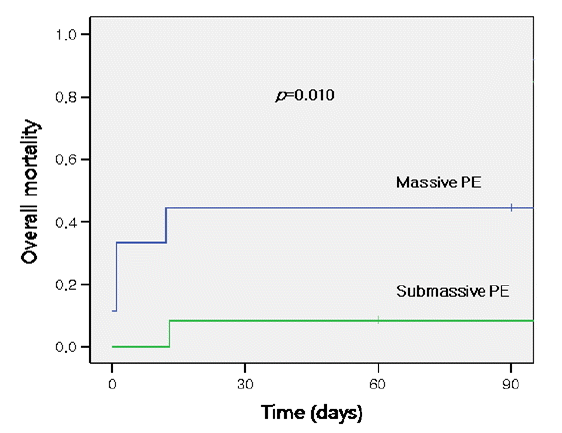
Figure┬Ā2.
Table┬Ā1.
Characteristics of patients receiving thrombolytic therapy
Table┬Ā2.
Clinical outcomes in patients with pulmonary embolism receiving thrombolytic therapy (90-day)
| Outcomes | Massive PE (n = 9) | Submassive PE (n = 12) | p value |
|---|---|---|---|
| Mortality, n (%) | |||
| ŌĆā30 day | 4 (44) | 1 (8) | 0.010 |
| ŌĆā90 day | 4 (44) | 1 (8) | 0.010 |
| Major bleeding, n (%) | 2 (22) | 1 (8) | 0.553 |
| Recurrent PE, n (%)a | 0 | 0 | - |
Table┬Ā3.
Predictive risk factors of early mortality in non-survivors
| Case | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|
| Gender | F | F | F | F | M |
| Age (yr) | 70 | 64 | 88 | 90 | 25 |
| Active malignancy | (-) | (+) | (-) | (-) | (-) |
| Troponin-T, ng/mL | 0.03 | < 0.01 | 0.17 | 0.14 | 0.058 |
| Pro-BNP, pg/mL | - | 8,913 | 32,787 | 5,830 | 1,957 |
| D-dimers, ng/mL | - | 984 | 2,658 | - | 2,808 |
| RV hypokinesis | (+) | (+) | (+) | (+) | (+) |
| Hemodynamic instability | (+) | (+) | (-) | (+) | (+) |
| Anticoagulation prior to diagnosis | (-) | (+) | (+) | (-) | (-) |
| Time to thrombolysis from diagnosis, min | 142 | 40 | 2,684 | 76 | 111 |
| Surgical embolectomy | (-) | (-) | (-) | (-) | (+) |
| Time to death from thrombolysis, dd-hh-mm | 00-05-24 | 12-14 | 13-06-13 | 11-17-39 | 01-00-44 |
| Estimated cause of death | RV failure | RV failure | Suspicious fatal bleedinga | RV failure | RV failure |
a Case 3 arrived dead at the emergency department 3 days after a high INR (12.25) was shown in the outpatient department. The cause of death was not objectively confirmed. Because the symptoms related to PE were much improved after the patient received anticoagulant therapy following thrombolytic therapy, the cause of death was suggested to be fatal bleeding rather than a fatal thromboembolic complication.
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 8,823 View
- 120 Download



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



