 |
 |
| Korean J Med > Volume 81(6); 2011 > Article |
|
요약
목적:
현재 혈액투석에 사용 중인 투석액 칼슘 농도는 1.25 mmol/L, 1.5 mmol/L, 1.75 mmol/L로 구분된다. 고칼슘 투석액은 부갑상선호르몬의 분비를 억제시키는 효과가 있으나 고칼슘혈증 위험을 증가시키고, 저칼슘 투석액은 adynamic bone disease을 개선시키는 효과가 있으나 칼슘 평형을 악화시킬 우려가 있으므로 투석액 칼슘 농도의 적절한 선택은 쉽지 않다. 저자들은 표준칼슘 농도인 1.5 mmol/L 투석액을 사용하였을 때 칼시트리올 용량 변화와 아울러 요독성 골질환에 미치는 효과를 평가하고자 하였다.
방법:
투석액 칼슘 농도 1.75 mmol/L로 1년 이상 혈액투석 중인 환자 36명에서 투석액 칼슘 농도를 1.5 mmol/L로 전환 후 1년간 경과를 추적하였다. 투석액 칼슘 농도를 낮추기 3개월 전에 측정한 혈청 iPTH 농도에 따라 환자를 1군(iPTH < 150 pg/mL, n = 21), 2군(iPTH 150-300 pg/mL, n = 7), 3군 (iPTH > 300 pg/mL, n = 8)으로 구분하여 혈청 칼슘, 인, 알칼리포스파타제, iPTH 농도를 3개월 간격으로 측정하였고, 인결합제 및 칼시트리올 용량 변화를 조사하였다.
결과:
투석액 칼슘 농도 1.75 mmol/L 사용 중 1군, 2군 및 3군의 iPTH 농도는 각각 57 ± 48 pg/mL, 191 ± 46 pg/mL, 589 ± 200 pg/mL로 유의한 차이가 있었다(p< 0.001). 투석액 칼슘 농도를 1.5 mmol/L로 전환 후 1군에서 혈청 iPTH가 12개월에 걸쳐 유의하게 증가하였다(p= 0.01). 3개월째부터 증가가 현저하여(57 ± 48 vs. 287 ± 266 pg/mL, p< 0.01) 이후 증가세를 유지하였다. 그러나 2군에서는 유의한 변화가 없었고, 3군의 혈청 iPTH는 12개월에 걸쳐 유의하게 감소하였는데(p= 0.02) 특히 9개월째 감소가 기저치에 비해 낮았다(589 ± 200 vs. 242 ± 246 pg/mL, p < 0.01). 혈청 알칼리포스파타제도 혈청 iPTH와 유사한 변화 양상을 보였다. 투석액 칼슘 농도를 1.5 mmol/L로 전환한 후 1군과 2군에서 인결합제와 칼시트리올 투여 용량의 유의한 변화는 없었으나, 3군에서 칼시트리올 용량이 6개월째부터 유의하게 증가하였고(4.4 ± 5.1 vs. 9.6 ± 2.9 μg/month, p < 0.05) 나머지 기간 동안 증가 추세를 유지하였다.
Abstract
Background/Aims:
Whereas higher dialysate calcium (Ca) levels may pose a risk of hypercalcemia, lower levels may induce a negative Ca balance. We evaluated the effect of lowering dialysate Ca levels from 1.75 to 1.5 mmol/L and explored the appropriate use of calcitriol to regulate bone metabolism in hemodialysis patients.
Methods:
The dialysate Ca levels of 36 patients were reduced from 1.75 to 1.5 mmol/L. They were divided into three groups according to basal intact parathyroid hormone (iPTH) level (group 1, iPTH < 150 pg/mL, n = 21; group 2, iPTH 150-300 pg/mL, n = 7; group 3, iPTH > 300 pg/mL, n = 8). Data were collected at 3-month intervals for 1 year.
Results:
Throughout the study period, no significant difference in phosphate binders, serum Ca, phosphorus (P), or Ca × P products was observed among groups. However, iPTH, alkaline phosphatase (AP), and calcitriol dosage patterns differed among groups. In group 1, iPTH and AP increased significantly over 12 months (p = 0.01). In group 2, iPTH and AP showed no significant changes. In group 3, iPTH and AP declined significantly over 12 months (p = 0.02). Calcitriol dosage did not change in groups 1 and 2, but increased significantly in group 3 (p = 0.001).
Conclusions:
After converting hemodialysate Ca levels from 1.75 to 1.5 mmol/L, the initially different iPTH concentrations converged to a modestly elevated level. The use of 1.5 mmol/L hemodialysate Ca may thus be appropriate for both high- and low-turnover bone disease if phosphate binders and calcitriol are combined appropriately. (Korean J Med 2011;81:751-758)
만성콩팥병이 진행하면 고인산혈증이 발생하고 비타민 D 활성화가 감소하여 골대사의 변화를 초래한다. 투석 환자에서 주로 이차성 부갑상선기능항진증이 문제되었으나, 최근에는 칼슘이 포함된 인결합제와 비타민 D 제제 사용이 증가하면서 부갑상선호르몬 분비가 오히려 억제되는 adynamic bone disease의 빈도가 점차 증가하고 있다. 이와 관련하여, 투석액의 칼슘 농도는 칼슘 평형 및 골대사에 영향 미치는 주요 요소이다.
현재 혈액투석에 사용하는 투석액 칼슘 농도는 1.25 mmol/L, 1.5 mmol/L, 1.75 mmol/L로 구분된다[1]. 고칼슘(1.75 mmol/L) 투석액은 부갑상선호르몬 분비를 억제시키고 혈역학을 안정시켜 투석 중 저혈압을 예방하는 효과가 있으나[2], 고칼슘혈증에 의한 전이성 석회화 우려가 있다[3]. 한편, 저칼슘(1.25 mmol/L) 투석액은 고칼슘혈증의 위험을 감소시켜 칼슘제제나 비타민 D를 좀 더 자유롭게 사용할 수 있으므로 adynamic bone disease의 개선 효과가 있다[4,5]. 그러나 칼슘 평형을 악화시켜 부갑상선호르몬 분비를 자극하고 투석 중 저혈압을 일으킬 우려가 있으므로 적절한 투석액 칼슘 농도를 선택하는 것이 쉽지 않다[6].
혈액투석이 도입된 초기에는 생리학적 수준에 맞추어 투석액 칼슘 농도 1.25 mmol/L가 사용되었으나, 이차성 부갑상선기능항진증이 중요한 문제로 대두되어 최근까지 고칼슘 투석액이 주로 사용되었다. 그러나 칼슘이 포함된 인결합제와 비타민 D 사용이 증가하면서 고칼슘혈증과 adynamic bone disease이 합병되어 다시 투석액 칼슘 농도를 낮추어야 하는 상황이 흔히 있다. 국내에서도 adynamic bone disease가 있는 혈액투석 환자에서 투석액 칼슘 농도를 표준칼슘(1.5 mmol/L)에서 저칼슘(1.25 mmol/L)으로 낮추었을 때 일부 환자에서 억제된 부갑상선 기능이 회복되었다고 보고된 바 있다[7]. 그러나 부갑상선호르몬 분비가 정상이거나 높은 수준의 환자에서도 투석액 칼슘 농도를 낮추어 유리한 효과를 기대할 수 있는지 아직 분명하지 않다. 저자들은 부갑상선호르몬 수준이 다양한 혈액투석 환자에서 고칼슘(1.75 mmol/L) 투석액을 표준칼슘(1.5 mmol/L) 농도로 낮추어 사용하였을 때 calcitriol 용량 변화와 아울러 골대사에 미치는 효과를 평가하고자 하였다.
한양대학교병원에서 1년 이상 고칼슘 투석액(투석액 칼슘농도 1.75 mmol/L)을 사용하면서 안정적으로 혈액투석을 받는 환자 36명을 대상으로 하여, 표준칼슘 투석액(투석액 칼슘 농도 1.5 mmol/L)으로 전환한 후 1년간 경과를 추적하였다. 혈청 칼슘 농도에 영향을 미칠 수 있는 전신 감염증, 악성 신생물, 간경변증, 담즙정체성 질환, 결핵을 포함한 육아종증, 부갑상선절제술의 경우 및 신이식 혹은 투석방법을 변경한 환자는 제외하였다.
표준칼슘 투석액 사용 전 3개월과 사용 후 1년에 걸쳐 3개월 간격으로 측정한 혈청 총 칼슘, 인, 알칼리포스파타제(alkaline phosphatase), 부갑상선호르몬(intact parathyroid hormone, iPTH) 및 요소감소율(urea reduction rate, URR)을 후향적으로 수집하여 분석하였다. 혈청 알부민 농도가 총 칼슘 농도에 미치는 영향을 배제하기 위하여, 다음 공식에 따라 혈청 총 칼슘 농도를 혈청 알부민 농도로 교정하였다[8].
교정 칼슘 농도(corrected Calcium, c-Ca) (mg/dL) = 총 칼슘 농도(mg/dL) + [4 - 알부민 농도 (g/L)] × 0.8
생화학적 지표들은 표준 자동분석기를 이용하여 측정하였고, 혈청 iPTH는 면역방사계수측정법(immunoradiometric assay, 정상치 8-76 pg/mL)을 이용하여 측정하였다. 환자들이 사용한 고칼슘 투석액(헤모트레이트 비1호, 중외제약, 서울, 한국)과 표준칼슘 투석액(헤모비덱스 0.1% 1호, 중외제약, 서울, 한국)의 조성이 표 1에 제시되어 있다.
또한, 표준칼슘 투석액으로 전환하기 3개월 전에 측정한 기저 혈청 iPTH 농도에 따라, 환자를 1군(iPTH < 150 pg/mL, n = 21), 2군(iPTH 150-300 pg/mL, n = 7) 및 3군(iPTH > 300 pg/mL, n = 8)으로 구분하여 12개월에 걸친 혈청 총 칼슘, 인, iPTH, 알칼리포스파타제 농도 및 요소감소율 변화를 비교하였다. 투석환자 진료지침에 따라 혈청 인 농도 4.5-5.5 mg/dL를 목표로 칼슘이 포함된 인결합제(탄산칼슘 500 mg/T 및 아세트산칼슘 710 mg/T)와 sevelamer (800 mg/T)가 사용되었고, iPTH 150-300 pg/mL를 유지하고자 iPTH 300 pg/mL 이상인 경우에 경구(0.25 μg/T) 혹은 정주(1 μg/A) 칼시트리올을 투여하였다[9]. 인결합제와 칼시트리올 투여 용량도 3개월 간격으로 후향적으로 수집하여 분석하였다.
측정값은 평균 ± 표준편차로 표시하였고, 통계처리를 위해 PASW 통계 프로그램 윈도우용 18.0 (PASW, Inc., Chicago, IL, USA)을 사용하였다. 표준칼슘 투석액으로 전환하고 1년에 걸쳐 3개월 간격으로 반복 측정한 연속변수들의 변화 여부를 검증하기 위하여 repeated measures ANOVA를 이용하였고, 기저치와 전환 후 3, 6, 9, 12개월 사이의 두 측정치를 비교하고자 Wilcoxon Matched-Pairs Signed-Ranks test을 이용하였다. 세 군 또는 두군 사이의 기저치를 비교할 때는 연속변수의 경우 Kruskal-Wallis test 또는 Mann-Whitney U test를 각각 이용하였고, 카테고리변수의 경우 Chi-squared test를 이용하였다. p 값 0.05 미만을 통계적으로 유의하다고 판단하였다.
대상 환자 36명 중 남자 18명, 여자 18명이었고, 연령이 55.6 ± 11.4세였으며, 평균 혈액투석 기간은 179 ± 79개월(85-371개월)이었다. 만성콩팥병의 원인은 고혈압 12예, 당뇨병 6예, 만성사구체신염 5예 및 원인불명 5예였다.
전체 환자에서 표준칼슘 투석액으로 전환 후 3개월 간격으로 측정한 요소감소율, 교정 칼슘 농도, 혈청 인, 교정 칼슘 × 인 값, 알칼리포스파타제 및 iPTH 자료가 표 2에 제시되어 있다. 표준칼슘 투석액으로 전환 후 12개월 동안 요소감소율, 교정 칼슘 농도, 혈청 인, 교정 칼슘 × 인 및 알칼리포스파타제의 유의한 변화는 없었다. 그러나 혈청 iPTH는 표준칼슘 투석액으로 전환 후 12개월에 걸쳐 점차 증가하였고(p = 0.037), 특히 6개월째 값이 높았다가(202 ± 238 vs. 391 ± 371 pg/mL, p < 0.05) 약간 감소하여 안정되었다(Table 2).
같은 기간 동안 투여된 인결합제인 칼슘이 포함된 제제와 sevelamer 모두 표준칼슘 투석액으로 전환 후 그 용량에 유의한 변화가 없었다. 그러나 경구 혹은 정주 칼시트리올 용량은 표준칼슘 투석액으로 전환 후 유의하게 증가하였다(p = 0.002, Table 3).
표준칼슘 투석액으로 전환하기 3개월 전에 측정한 기저 혈청 iPTH 농도에 따라 환자를 세 군으로 구분하였을 때 1군, 2군 및 3군의 iPTH 농도는 각각 57 ± 48 pg/mL, 191 ± 46pg/mL, 589 ± 200 pg/mL로 유의한 차이가 있었다(p < 0.001). 한편, 세 군 사이에 연령, 성별, 혈액투석 기간, 요소감소율, 원인질환, 교정 칼슘 농도, 혈청 인 농도, 교정 칼슘 × 인 값 및 알칼리포스파타제는 세 군 사이에 유의한 차이가 없었다. 인결합제의 용량 차이는 없었으나, 칼시트리올 투여 용량이 3군에서 많은 경향이었다(p = 0.053, Table 4).
세 군에서 표준 칼슘 투석액으로 전환 후 12개월 동안 인결합제와 칼시트리올 투여 용량의 변화를 비교하였다. 칼슘이 포함된 인결합제(1군, p = 0.689; 2군, p = 0.858; 3군, p = 0.142)와 sevelamer (1군, p = 0.089; 2군, p = 0.227; 3군, p = 0.401) 모두 12개월에 걸쳐 용량의 유의한 변화는 없었다. 경구 혹은 정주 칼시트리올의 경우 1군과 2군에서 유의한 변화가 없었으나, 3군에서는 6개월째부터 유의하게 증가하였고(4.4 ± 5.1 vs. 9.6 ± 2.9 μg/month, p = 0.023) 나머지 기간 동안에도 증가 추세를 유지하였다(p = 0.001). 세 군 사이에 칼시트리올 투여 용량을 비교했을 때에도 표준 칼슘 투석액으로 전환 후 12개월에 걸쳐 모두 3군에서 유의하게 많았다(Table 5).
표준칼슘 투석액으로 전환하고 12개월에 걸쳐 3개월 간격으로 측정한 교정 칼슘 농도(1군, p = 0.381; 2군, p = 0.981; 3군, p = 0.064), 혈청 인 농도(1군, p = 0.099; 2군, p = 0.706; 3군, p = 0.411) 및 교정 칼슘 × 인 값(1군, p = 0.115; 2군, p = 0.719; 3군, p = 0.436)은 세 군 모두 유의한 변화가 없었다. 그러나 혈청 iPTH의 경우, 1군에서 12개월에 걸쳐 유의하게 증가하였고(p = 0.013), 특히 3개월째 현저하게 증가하였다가(57 ± 48 vs. 287 ± 266 pg/mL, p < 0.01) 나머지 기간 동안 증가 추세를 유지하였다(Fig. 1A). 대부분의 환자에서 혈청 iPTH 값이 150-300 pg/mL였으나, 3예에서는 1,000 pg/mL 이상으로 증가하였고 4예에서는 반대로 150 pg/mL 미만으로 유지되었다. 한편, 2군의 혈청 iPTH는 표준칼슘 투석액으로 전환 후 유의한 변화가 없었다(p = 0.455, Fig. 1B). 이에 비해 3군에서는 혈청 iPTH가 표준칼슘 투석액으로 전환 후 12개월에 걸쳐 유의하게 감소하였고(p = 0.02), 특히 9개월째 현저한 감소를 나타내었다(589 ± 200 vs. 242 ± 246 pg/mL, p < 0.01, Fig. 1C). iPTH 100 pg/mL 이하로 감소한 경우가 3예에서 관찰되었다.
위와 같은 iPTH 변화 양상에 부합하여, 혈청 알칼리포스파타제가 각 군 사이에 서로 다른 변화 양상을 보였다(Fig. 2). 1군의 경우 표준칼슘 투석액으로 전환 후 6개월째 유의하게 증가하였고(78 ± 31 vs. 90 ± 31 IU/L, p < 0.05), 3군에서는 표준칼슘 투석액으로 전환 후 12개월째 유의하게 감소하였다(103 ± 32 vs. 88 ± 25 IU/L, p < 0.05).
근래 들어 혈액투석 환자에서 사용하는 투석액 칼슘 농도는 과거에 비해 낮아지는 경향이다. 국제적인 전향적 연구였던 Dialysis Outcomes and Practice Patterns Study I (DOPPS I)에서 혈액투석액 칼슘 농도 1 mmol/L 증가할 때마다 사망률이 13% 정도 증가하는 소견이 보고되었다[10]. 다른 연구결과에서도 투석액 칼슘 농도를 낮출 때 혈관의 탄성도가 증가하였고[11], 칼슘이 포함된 인결합제를 장기간 사용하면서 유발된 고칼슘혈증 환자에서 근신경계 기능이상, 연부조직의 석회화 및 심전도 이상 등이 보고되었다[12]. 따라서 2009년에 발표된 KDIGO Clinical Practice Guideline에서는 만성콩팥병 환자의 혈청 칼슘 농도를 정상 범위(8.4-9.5 mg/dL)로 유지하고, 투석액 칼슘 농도 1.25-1.5 mmol/L를 사용하도록 권고하였다[13]. 그러나 칼슘 농도 1.25 mmol/L인 투석액을 사용하면 이차성 부갑상선기능항진증이 악화될 수 있고[14], 골흡수 증가에 따른 골밀도 감소가 초래될 수 있다는 보고가 있다[15]. 본 연구는 혈청 iPTH가 다양한 말기콩팥병 환자에서 혈액투석액 칼슘 농도를 1.5 mmol/L으로 선택하였을 때 요독성 골질환에 미치는 긍정적인 효과를 보여주었다.
투석액의 칼슘 농도를 1.75 mmol/L에서 1.5 mmol/L로 낮춘 후 전체 환자의 혈청 iPTH는 12개월에 걸쳐 유의하게 증가하였으나(Table 2), 기저 iPTH에 따라 전체 환자를 세 군으로 구분하였을 때 그 변화 양상은 서로 달랐다(Fig. 1). 즉, 기저 iPTH가 높지 않았던 1군에서는 투석액의 칼슘 농도를 1.75 mmol/L에서 1.5 mmol/L로 낮춘 후 혈청 iPTH가 12개월에 걸쳐 유의하게 증가하였고, 기저 iPTH가 중등도로 높았던 2군에서는 12개월 동안 혈청 iPTH의 유의한 변화가 없었으며, 기저 iPTH가 매우 높았던 3군에서는 혈청 iPTH가 12개월에 걸쳐 유의하게 감소하였다. 따라서 최초 혈청 iPTH가 다양했던 혈액투석 환자들이 혈액투석액 칼슘 농도를 1.75 mmol/L에서 1.5 mmol/L으로 전환하면서 혈청 iPTH가 결국 중등도로 높은 유사한 수준에 이르는 것을 보여주었다. 2009년에 발표된 KDIGO Clinical Practice Guideline에 따르면 투석 환자가 유지해야 할 iPTH 수준이 정상치의 2배내지 9배이므로, adynamic bone disease에 해당하는 1군과 심한 이차성 부갑상선항진증에 해당하는 3군에서 긍정적으로 호전되는 효과를 보였다.
혈청 칼슘과 인의 변화는 전체 환자 및 군별 환자에서 모두 유의하지 않았으나, 기저 iPTH > 300 pg/mL이었던 3군에서 칼시트리올 투여 용량이 유의하게 증가하였다. 투석액 칼슘 농도를 낮추면 체내 칼슘 평형이 부족해지고, 따라서 이를 보상하기 위한 칼시트리올 투여 요구가 증가했기 때문으로 해석된다. 전체 환자에서 혈청 알칼리포스파타제의 변화는 유의하지 않았으나, 1군과 3군에서 각각 6개월째에 증가하고 12개월째에 감소한 것은 iPTH의 변화 방향에 부합하는 소견일 것이다.
다른 연구에서도 본 연구의 1군과 같은 adynamic bone disease 환자에서 저칼슘 투석액을 사용하여 혈청 iPTH와 알칼리포스파타제가 증가하여 adynamic bone disease가 호전되었다고 보고하였다[16,17]. 한편, 본 연구의 3군과 같이 iPTH 분비가 크게 증가한 이차성 부갑상선기능항진증 환자에서는 저칼슘 투석액 사용 여부에 대해 명확히 연구된 바는 없다. 일부 연구에서는 칼슘 평형이 음성화되면서 이차성 부갑상선기능항진증이 더 악화될 수 있다고 하였다[14,18]. DOPPS에서는 저칼슘 투석액 사용에 의해 부갑상선절제술 빈도가 증가하였다고 보고하였고[10], 심한 저칼슘혈증에 의해 저혈압[2,6] 혹은 부정맥[19] 등 부작용이 발생할 수도 있다. 그러나 또 다른 연구에서는 이차성 부갑상선기능항진증 환자에서 투석액 칼슘 농도를 낮춤으로 오히려 고칼슘혈증 빈도가 감소하였고, 이로 인해 비타민 D 제제를 적극적으로 투여하여 부갑상선호르몬 분비가 감소되었다[4,16]. 또한 부갑상선절제술 빈도가 감소하였다는 보고도 있었다[20]. 본 연구에서도 이차성 부갑상선기능항진증인 3군에서 혈청 칼슘 농도의 변화소견은 없었지만 표준칼슘 투석액으로 전환 후 6개월째부터 칼시트리올 투여 용량이 유의하게 증가하였다. 그 결과, 혈청 부갑상선호르몬 농도가 감소하는 골대사의 개선 효과를 유도하였다고 생각한다.
흥미롭게도, 투석액 칼슘 농도 감소에 따른 반응이 일정하지 않아서 일부 환자에서는 혈청 iPTH의 과도한 증가 혹은 감소 소견이 관찰되었다. 1군의 경우 3예에서는 혈청 iPTH가 1,000 pg/mL 이상으로 증가하였고, 4예에서는 여전히 150 pg/mL 미만으로 유지되었다. 투석액 칼슘 농도 저하에도 불구하고 1년동안 iPTH가 150 pg/mL 미만으로 억제된 환자들은 1군의 다른 환자들과 비교할 때 연령, 성별, 혈액투석 기간, 요소감소율 및 원인질환에서 차이가 없었으며, 기저 교정 칼슘, 혈청 인, 교정 칼슘 × 인 값, 알칼리포스파타제 뿐만 아니라 초기에 사용된 인결합제와 칼시트리올 용량도 다르지 않았다. Park 등에 따르면, 칼슘감지수용체의 유전자형(Codon 990 G/G vs. non-G/G)에 따라 저칼슘 투석액에 의해 나타나는 부갑상선의 반응에 차이가 있을 수 있다[21].
본 연구는 단일기관에서 수행되어 대상 환자 수가 적었고 후향적인 연구였다는 제한점을 가지고 있다. 그러나 칼슘 평형에 영향 미치는 약물요법들이 발전하는 현실에서 투석액 칼슘 농도의 중요성을 제시한 의의가 있다고 생각한다. 과거에 흔히 사용되던 1.75 mmol/L 농도가 아닌 1.5 mmol/L 투석액을 사용하면서 적절한 인결합제와 비타민 D 제제를 투여하면 adynamic bone disease 및 이차성 부갑상선기능항진증 환자의 적어도 일부에서는 골 대사가 개선될 수 있는 결과를 보여주었다. 한편, 환자의 혈압, 동반하는 심혈관계질환, 인결합제 및 비타민 D 제제 용량 등에 따라 투석액 칼슘 농도를 개별화할 필요도 있을 것이다. 향후 대규모 다기관 공동 연구를 통해, 혈액투석 환자에서 투석액 칼슘 농도가 골대사에 미치는 영향에 대한 전향적 연구가 도움될 것이다.
REFERENCES
1. Drüeke TB, Touam M. Calcium balance in haemodialysis: do not lower the dialysate calcium concentration too much (con part). Nephrol Dial Transplant 2009;24:2990–2993.


2. Maynard JC, Cruz C, Kleerekoper M, Levin NW. Blood pressure response to changes in serum ionized calcium during hemodialysis. Ann Intern Med 1986;104:358–361; Erratum in: Ann Intern Med 1986;105:635.


3. Toussaint N, Cooney P, Kerr PG. Review of dialysate calcium concentration in hemodialysis. Hemodial Int 2006;10:326–337.


4. Lezaic V, Pejanovic S, Kostic S, et al. Effects of lowering dialysate calcium concentration on mineral metabolism and parathyroid hormone secretion: a multicentric study. Ther Apher Dial 2007;11:121–130.


5. Spasovski G, Gelev S, Masin-Spasovska J, Selim G, Sikole A, Vanholder R. Improvement of bone and mineral parameters related to adynamic bone disease by diminishing dialysate calcium. Bone 2007;41:698–703.


6. Van der Sande FM, Cheriex EC, van Kuijk WH, Leunissen KM. Effect of dialysate calcium concentrations on intradialytic blood pressure course in cardiac-compromised patients. Am J Kidney Dis 1998;32:125–131.


7. Chyun JH, Yoon HJ, Kang HJ, et al. Effect of low calcium dialysate on bone markers in hemodialysis patients who may have adynamic bone disease. Korean J Bone metab 2003;10:193–200.
8. Ferri FF. Ferri's Clinical Advisor 2011. Philadelphia, PA: Elsevier, 2011.
9. National Kidney Foundation. K/DOQI clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am J Kidney Dis 2003;42(4 Suppl 3):S1–S201.
10. Young EW, Albert JM, Satayathum S, et al. Predictors and consequences of altered mineral metabolism: the Dialysis Outcomes and Practice Patterns Study. Kidney Int 2005;67:1179–1187.


11. Yoo SJ, Oh DJ, Yu SH. The effects of low calcium dialysate on arterial compliance and vasoactive substances in patients with hemodialysis. Korean J Intern Med 2004;19:27–32.


12. Goodman WG, Goldin J, Kuizon BD, et al. Coronary-artery calcification in young adults with end-stage renal disease who are undergoing dialysis. N Engl J Med 2000;342:1478–1483.


13. Kidney Disease: Improving Global Outcomes (KDIGO) CKDMBD Work Group. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int Suppl 2009;(113):S1–S130.
14. Yokoyama K, Kagami S, Ohkido I, et al. The negative Ca(2+) balance is involved in the stimulation of PTH secretion. Nephron 2002;92:86–90.


15. Sánchez Perales MC, García Cortés MJ, Borrego FJ, et al. Hemodialysis with 2.5 mEq/L of calcium in relative hypoparathyroidism: long-term effects on bone mass. Nefrologia 2000;20:254–261.

16. Hamano T, Oseto S, Fujii N, et al. Impact of lowering dialysate calcium concentration on serum bone turnover markers in hemodialysis patients. Bone 2005;36:909–916.


17. Holgado R, Haire H, Ross D, et al. Effect of a low calcium dialysate on parathyroid hormone secretion in diabetic patients on maintenance hemodialysis. J Bone Miner Res 2000;15:927–935.


18. Argilés A, Mion CM. Low-calcium dialysate worsens secondary hyperparathyroidism. J Am Soc Nephrol 1996;7:635–636.

19. Severi S, Grandi E, Pes C, Badiali F, Grandi F, Santoro A. Calcium and potassium changes during haemodialysis alter ventricular repolarization duration: in vivo and in silico analysis. Nephrol Dial Transplant 2008;23:1378–1386.


20. Heaf JG, Løkkegård H. Parathyroid hormone during maintenance dialysis: influence of low calcium dialysate, plasma albumin and age. J Nephrol 1998;11:203–210.

21. Park TJ, Seo JW, Pack KM, et al. Calcium-sensing receptor gene polymorphism is associated with the parathyroid response to low calcium dialysate in hemodialysis patients with low parathyroid hromone secretion. Korean J Nephrol 2007;26:440–447.
Changes in serum parathyroid hormone (PTH) level after conversion from 1.75 to 1.5 mmol/L hemodialysate calcium. (A) Group 1; (B) group 2; (C) group 3. The results are presented as a box plot (boxes represent median and interquartile ranges, and vertical lines represent the 10th-90th percentiles). Comparisons were performed using the Wilcoxon matched-pairs signed-ranks test.
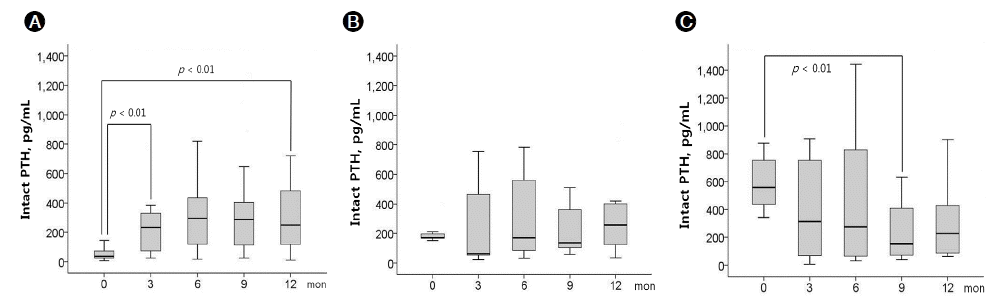
Figure 1.
Changes in serum alkaline phosphatase after conversion from 1.75 to 1.5 mmol/L hemodialysate calcium. (A) Group 1; (B) group 2; (C) group 3. The results are presented as a box plot (boxes represent median and interquartile ranges, and vertical lines represent the 10th-90th percentiles). Comparisons were performed using the Wilcoxon matched-pairs signed-ranks test.
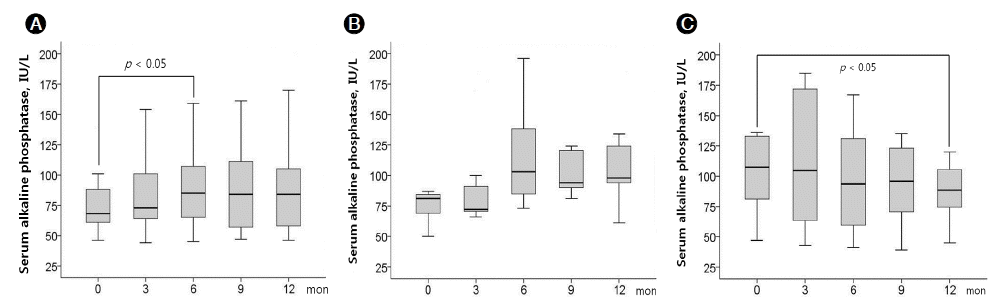
Figure 2.
Table 1.
Composition of standard and high-calcium hemodialysates
| Standard | High-calcium | |
|---|---|---|
| Ca++ (mEq/L) | 3.0 | 3.5 |
| Na+ (mEq/L) | 140 | 135 |
| K+ (mEq/L) | 2.0 | 2.5 |
| Mg++ (mEq/L) | 1.0 | 1.5 |
| Cl- (mEq/L) | 110 | 106.5 |
| CH3COO- (mEq/L) | 8 | 8 |
| Dextrose (g/L) | 35 | 0 |
Table 2.
Changes of urea reduction ratio, serum corrected calcium, phosphorus, Ca × P product, alkaline phosphatase and parathyroid hormone before and after conversion to hemodialysate calcium 1.5 mmol/L (n = 36)
| Baseline | 3 months | 6 months | 9 months | 12 months | pa | |
|---|---|---|---|---|---|---|
| URR, % | 71.4 ± 6.3 | 70.5 ± 7.6 | 70.2 ± 7.3 | 71.2 ± 8.7 | 71.5 ± 7.7 | 0.696 |
| c-Ca, mg/dL | 10.6 ± 0.8 | 10.5 ± 0.7 | 10.7 ± 0.8 | 10.6 ± 0.7 | 10.6 ± 0.7 | 0.605 |
| P, mg/dL | 4.6 ± 1.5 | 4.9 ± 1.7 | 4.7 ± 1.4 | 4.8 ± 1.5 | 4.9 ± 1.5 | 0.654 |
| c-Ca × P, mg2/dL2 | 45.6 ± 16.1 | 48.3 ± 17.2 | 47.2 ± 15.4 | 46.8 ± 15.2 | 48.8 ± 14.9 | 0.781 |
| AP, IU/L | 87 ± 38 | 92 ± 39 | 97 ± 37 | 95 ± 35 | 94 ± 36 | 0.439 |
| iPTH, pg/mL | 202 ± 238 | 308 ± 299 | 391 ± 371b | 329 ± 320 | 316 ± 301 | 0.037 |
Table 3.
Dosage of phosphate binders (mg/day) and calcitriol (μg/month) before and after conversion to hemodialysate calcium 1.5 mmol/L (n = 36)
| Baseline | 3 months | 6 months | 9 months | 12 months | pb | |
|---|---|---|---|---|---|---|
| Phosphate binders | ||||||
| Calcium-baseda | 1897 ± 1872 | 1398 ± 1700 | 1542 ± 1879 | 1501 ± 1983 | 1566 ± 1906 | 0.576 |
| Sevelamer | 133 ± 800 | 867 ± 1828 | 467 ± 1259 | 800 ± 1721 | 667 ± 1583 | 0.119 |
| Calcitriol | 0.8 ± 3.6 | 2.8 ± 4.4c | 3.6 ± 4.5c | 5.4 ± 5.1c | 4.5 ± 4.9c | 0.002 |
Table 4.
Comparison of basal characteristics among groups based on parathyroid hormone level
| Group 1 (n = 21) | Group 2 (n = 7) | Group 3 (n = 8) | p | |
|---|---|---|---|---|
| Age, yra | 57.9 ± 9.5 | 58.2 ± 13.8 | 47.3 ± 11.4 | NS |
| Male, %b | 11 (52.3) | 2 (28.6) | 5 (62.5) | NS |
| Dialysis duration, mona | 157.5 ± 62.5 | 228.3 ± 100.1 | 191.3 ± 88.0 | NS |
| URR, % | 70.7 ± 4.9 | 72.8 ± 10.6 | 70.8 ± 5.3 | NS |
| Causes of ESRDb | NS | |||
| Diabetes, % | 3 (14.3) | 2 (28.6) | 1 (12.5) | |
| Hypertension, % | 8 (38.1) | 3 (46.9) | 1 (12.5) | |
| Glomerulonephritis, % | 2 (9.5) | 0 (0) | 3 (37.5) | |
| Unknown, % | 8 (38.1) | 2 (28.6) | 3 (37.5) | |
| Phosphate bindersa | ||||
| Calcium carbonate and acetate, mg/day | 1802 ± 1804 | 966 ± 1574 | 2959 ± 1976 | NS |
| Sevelamer HCl, mg/day | 0 | 0 | 600 ± 1697 | NS |
| Calcitriol, μg/mona | 0.7 ± 2.3 | 2.1 ± 3.7 | 4.4 ± 5.1 | 0.053 |
| c-Ca, mg/dLa | 10.6 ± 0.8 | 10.6 ± 0.6 | 10.6 ± 0.9 | NS |
| P, mg/dLa | 4.8 ± 1.3 | 4.3 ± 1.7 | 4.5 ± 2.1 | NS |
| c-Ca × P, mg2/dL2 a | 47.0 ± 14.5 | 42.4 ± 17.4 | 44.7 ± 20.5 | NS |
| AP, IU/La | 78 ± 31 | 94 ± 58 | 103 ± 32 | NS |
| iPTH, pg/mLa | 57 ± 48 | 191 ± 46 | 589 ± 200 | < 0.001 |
Table 5.
Calcitriol dosage (μg/month) before and after conversion to hemodialysate calcium 1.5 mmol/L in each group
| Baseline | 3 months | 6 months | 9 months | 12 months | pa | |
|---|---|---|---|---|---|---|
| Group 1 | 0.7 ± 2.3 | 1.1 ± 2.7 | 1.4 ± 3.0 | 2.7 ± 4.6 | 2.0 ± 3.9 | 0.435 |
| Group 2 | 2.1 ± 3.7 | 4.0 ± 5.3 | 3.2 ± 4.0 | 7.1 ± 0.1b | 5.6 ± 3.7 | 0.165 |
| Group 3 | 4.4 ± 5.1 | 6.1 ± 5.5 | 9.6 ± 2.9b | 10.9 ± 2.9b | 10.3 ± 2.9b | 0.001 |
| pc | 0.053 | 0.022 | < 0.001 | < 0.001 | < 0.001 |
- TOOLS
-
 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link XML Download
XML Download Full text via DOI
Full text via DOI-
 Download Citation
Download Citation
 Print
Print-
Share :








