서 론
급성골수성백혈병(acute myeloid leukemia, AML)에서 나타나는 가장 흔한 염색체 이상소견은 t (8;21)(q22;q22)이며 새로이 진단되는 전체 AML 환자의 약 8-21%에서 발견되고 있다. 8번 염색체와 21번 염색체 사이의 상호 전좌로 인해 8번 염색체의 RUNX1T1 유전자와 21번 염색체의 RUNX1 (또는 AML1) 유전자 사이에서 RUNX1/RUNX1T1 (또는 AML1/ETO)라는 새로운 융합 유전물질이 만들어지며[1], 2008년 개정된 세계보건기구(world Health Organization, WHO)의 분류에 따라 t (8;21)(q22;q22);RUNX1/RUNX1T1을 동반한 AML에 속한다[2]. 형태학적으로, 이러한 상호 전좌는 FAB 분류에서의 M2 아형과 연관되어 있으며 표준 항암 치료로 높은 완전 관해율을 보이며 골수육종(myeloid sarcoma) 혹은 녹색종(chloroma)이 나타나는 경우가 많다고 알려져 있다.
AML에서 c-kit는 약 60-80%의 높은 발현율을 보인다. c-kit 수용체(CD117)는 type III receptor tyrosine kinase (RTK)에 속하며 생식세포, 비만세포, 혈구세포 및 멜라닌세포의 성장과 분화에 중추적 역할을 한다. 전체 AML 환자의 2% 이하에서 c-kit 돌연변이를 보이나 RUNX1/RUNX1T1 유전자 재배열이 동반된 AML에서는 c-kit 돌연변이 발현율이 24-39%에 이르며 진단 당시 높은 백혈구 숫자, 높은 재발률, 낮은 생존율, 골수육종의 높은 발생 빈도를 보이는 것으로 알려져 있다[3].
이와 같이 c-kit 유전자의 돌연변이가 동반된 RUNX1/RUNX1T1 양성 AML에서 골수육종의 발생은 상관관계가 있는 것으로 생각된다. 저자들은 최근 c-kit 유전자의 돌연변이가 확인된 RUNX1/RUNX1T1 양성 AML 환자에서 골수육종이 동반된 3예를 경험하였기에 독특한 임상양상을 문헌고찰과 함께 보고하고자 한다.
증 례
증례 1
환 자: 남자, 18세
주 소: 일주일 전부터 시작된 오른쪽 이통, 청력 감소
현병력: 일주일 전부터 오른쪽 이통, 청력 감소 발생하여 개인 의원에서 중이염으로 치료하였으나 호전이 없어 시행한 혈액 검사에서 이상 소견 발견되어 전원되었다.
과거력 및 가족력: 특이 소견 없었다.
진찰 소견: 내원 당시 열은 없었고, 혈압 145/75 mmHg, 맥박수 121회, 호흡수 20회였다. 오른쪽 외이도와 고막에 발적, 삼출물이 있었다. 흉부 검진에서는 우하폐야에서 호흡음이 감소되어 있었으며 림프선 비대는 없었고 간, 비장은 촉지되지 않았다.
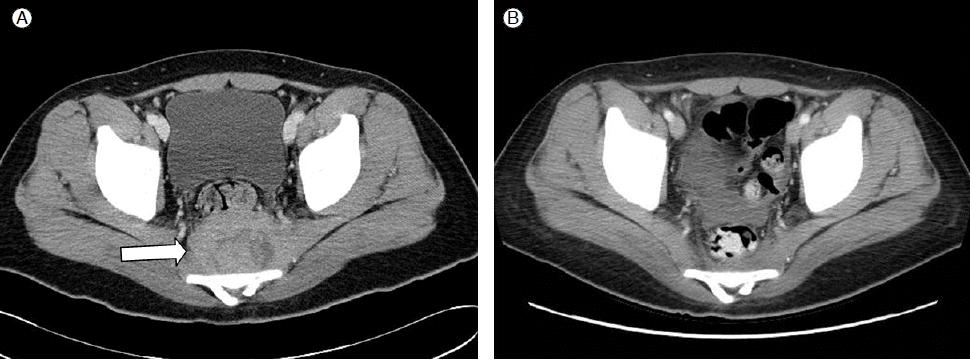
검사 소견: 입원 당시 말초 혈액 검사에서 혈색소 6.4 g/dL, 헤마토크리트 19.2%, 백혈구 68,590/μL (모세포 45%), 혈소판 69,000/μL였다. 생화학 검사 및 요검사에서 특이 소견 없었다. 단순 흉부 엑스선 검사에서 양측 흉수 및 상부 종격동 확장 소견이 보였으며 흉부 및 복부 컴퓨터 단층촬영에서 양측 흉수를 비롯하여 척추옆 공간, 횡격막각 후방, 흉골, 천골 전방부에 연부 조직 음영의 종괴가 관찰되었다(Fig. 1A).
흉수의 세포화학 염색에서 골수세포형과산화효소(myeloperoxidase, MPO) 염색에 양성 반응을 보여 백혈병 세포의 침윤이 확인되었다. 또한 뇌 자기 공명 검사에서 뇌실질은 정상이었으나 비인두의 전반적인 비후 및 골수의 신호 강도가 감소되어 있어 이 또한 백혈병 세포의 침윤으로 생각되었다.
골수검사 소견: 세포 충실도는 100%였으며, 핵 세포질비가 높은 모세포가 83%로 현저히 증가되어 있었고, Auer 막대가 관찰되었다. 골수세포의 세포화학 염색에서 결과 MPO 염색에 양성, 비특이적 에스테라제(nonspecific esterase) 염색에 음성, periodic acid-Schiff (PAS) 염색에 음성 반응을 나타내어 FAB 분류상 AML, M2 아형에 해당하였다. 골수 세포의 면역 표현 분석법(immunophenotypic analysis)을 통한 검사에서 cy-MPO, CD33, CD38, CD13, CD14, CD15, CD117, CD34, HLA-DR에 양성, CD19에 음성 소견을 보였다. 염색체 검사에서 20개의 중기 세포 모두 t (8;21)과 Y 염색체의 소실이 관찰되었다(45 X, -Y, t (8;21)(q22;q22)[20]). 형광제자리부합법(fluorescence in situ hybridization, FISH)을 통해 RUNX1/RUNX1T1 재배열이 확인되어 WHO 분류로 t (8;21)(q22;q22);RUNX1/RUNX1T1를 동반한 AML로 진단하였다. 실시간 정량분석 중합효소 연쇄반응법(real-time quantitative reverse transcription polymerase chain reaction, qRT-PCR)으로 측정한 RUNX1/RUNX1T1 유전자의 전사체 값은 2.234였다. c-kit 돌연변이 검사에서 D816V 돌연변이가 확인되었다(Table 1).
치료 및 경과: Idarubicin, cytarabine 병합화학요법을 이용한 관해 유도치료 후 골수 및 말초혈액에서는 모세포가 관찰되지 않았다. RUNX1/RUNX1T1 유전자의 전사체값은 0.0246으로 감소되었으며 흉부 및 복부 전산화 단층 촬영 결과 이전에 보이던 연부 조직 음영은 거의 소실되었다(Fig. 1B). 관해 유도치료와 같은 idarubicin, cytarabine을 통한 1차 공고 요법 후 시행한 골수 검사에서 완전 관해 소견을 보였다. RUNX1/RUNX1T1 유전자의 전사체값은 0.01105로 감소하였고, 흉부 및 복부 전산화 단층 촬영 검사에서 골수육종은 보이지 않아 완전관해 소견에 합당한 것으로 판단되었다. 환자는 일차 관해 상태에서 주 조직적합 항원이 일치하는 형제로부터 동종 조혈모세포 이식을 받았다. 이식 후 21일째 시행한 혈액 및 골수 검사상 성공적인 생착이 확인되었으며, RUNX1-RUNX1T1 유전자의 전사체 값은 0.0166으로 이식 전 추적검사 결과와 비슷한 정도로 낮게 측정되었다. 환자는 급, 만성 이식편대 숙주병이나 말초 혈액 소견상 백혈병 및 골수육종의 재발 소견 없이 외래 추적관찰 중이다(Table 2).
증례 2
환 자: 남자, 21세
주 소: 요통, 우하지의 위약감
현병력: 일주일 전부터 상기의 증상 발생하여 개인 의원에서 촬영한 요추 자기 공명 영상 검사에서 경막외 종괴가 발견되었으며 혈액 검사에서 백혈구 증가 소견이 보여 전원되었다.
과거력 및 가족력: 특이 소견 없었다.
진찰 소견: 내원 당시 열은 없었고, 혈압 110/50 mmHg, 맥박수는 70회, 호흡수 20회였다. 요부의 압통은 없었으나 우측 하지의 운동능 및 감각이 저하되어 있었다. 흉부 검진에서 양폐야의 호흡음은 정상이었으며 림프선 비대는 없었고 경도의 간비대가 있었다.
검사 소견: 말초 혈액 검사에서 혈색소 8.5 g/dL, 헤마토크리트 25.3%, 백혈구 48,150/μL (모세포 81%), 혈소판 9,000/μL였다. 생화학 검사 및 요검사는 정상이었다. 흉부 단순 엑스선 촬영은 정상이었으며 요추 자기 공명 영상 검사에서 요추 4번-천추 2번 부위의 신경근 압박 소견이 관찰되었다.
골수검사 소견: 세포 충실도는 100%, 모세포가 68%였으며 Auer 막대가 관찰되었다. 골수세포의 세포화학 염색에서 MPO 염색에 양성, NSE 염색에 약양성, PAS 염색에 음성 반응을 보였다. 골수 세포의 면역표현 분석검사에서 cy-MPO, CD45, CD33, CD34, CD13, CD117, HLA-DR에 양성, CD19, CD 56음성이었다. 염색체 검사에서 20개의 중기 세포 중 19개의 세포에서 t (8;21)과 Y 염색체의 소실이 확인되었으며 이 중 2개의 세포에서 9번 염색체 장완의 일부 결실이 추가로 관찰되었다(45 X, -Y, t (8;21)(q22;q22)[17]/45, idem, del (9) (q22q32)[2]/46,XY[1]). FISH를 통해 RUNX1/RUNX1T1 재배열을 확인하였으며 qRT-PCR 법으로 측정한 RUNX1/RUNX1T1 유전자의 전사체값은 12.9였고, c-kit의 D816V 돌연변이가 확인되었다(Table 1).
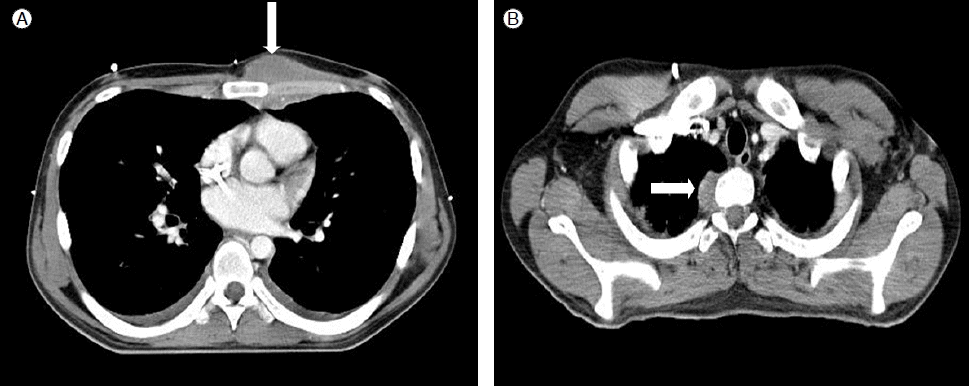
치료 및 경과: 골수육종으로 인한 척수 압박으로 진단하고 신경근 압박 부위에 응급 방사선 조사 및 고용량의 dexamethaxone을 투여하였다. 그 후 Idarubicin, cytarabine 병합화학요법을 이용한 관해 유도치료 후 골수 및 말초혈액에서 모세포는 관찰되지 않았다. RUNX1/RUNX1T1 유전자의 전사체값은 0.15로 감소되었으며 요추 자기 공명 영상 검사에서 이전에 보이던 종괴는 사라졌다. Idarubicin, cytarabine 병합화학요법을 통한 1차 공고 요법 후 요추 자기 공명 영상 검사에서 새로운 종괴는 없었으나 골수 검사에서 세포 충실도 20%, 모세포가 7% 관찰되어 불완전 관해로 판단되었으며 RUNX1/RUNX1T1 유전자의 전사체값은 0.76이었다. Mitoxantrone, cytarabine, etoposide을 통한 삼제병합화학요법으로 재관해 치료를 하였으나 골수 검사에서 세포 충실도 10%, 모세포 49%로 치료에 반응을 보이지 않았으며 RUNX1/RUNX1T1 유전자의 전사체값도 6.49로 이전 검사에 비해 크게 증가되었다. Fludarabine, cytarabine, mitoxantrone을 통한 2차 재관해유도요법을 시행하였으나 역시 관해 유도에 실패하였다. 2차 재관해유도 치료를 시행한 지 1개월 뒤 전흉벽이 부어올랐으며 흉부 전산화 단층 촬영에서 좌측 흉골연 부위의 대흉근의 부종이 관찰되어 백혈병 세포침윤 또는 근염이 의심되었다. 한달 뒤 백혈구 수가 100,910/μL로 증가하여 백혈구 성분채집술을 시행하였으며 요추 자기 공명 영상 검사는 이전과 변화 없었으나 흉부 전산화 단층 촬영에서 이전에 부종이 있던 좌측 흉골연 부위의 대흉근에 3.6 × 6 cm 크기의 연부조직 음영의 종괴가 있었으며(Fig. 2A) 그 외에도 우측 세번째 흉추옆 공간에 2.5 × 1.0 cm 크기의 종괴가 새로이 발견되었다(Fig. 2B). 골수육종으로 진단하여 이에 대해 국소 방사선 치료를 시작하였으나 치료 도중 폐렴으로 사망하였다(Table 2).
증례 3
환 자: 남자, 38세
주 소: 한달 전부터 발생한 하지의 점상 출혈
현병력: 점상 출혈 발생하여 타 지역 병원에서 골수 검사 시행, AML 진단받고 히크만 중심정맥관을 삽입하였으나 도관 관련 감염 발생하여 도관 제거 후 전원되었다.
과거력 및 가족력: 10갑년의 흡연력 외 특이 소견 없었다.
진찰 소견: 내원 당시 혈압 140/70 mmHg, 맥박수 110회, 호흡수 30회, 체온 38.5℃였다. 우측 내경 정맥내 히크만 중 심정맥관을 삽입하였던 부위에 발적, 열감, 압통이 있었다. 흉부 청진에서 양측 폐 하부에서 수포음이 들리고 복부에서 간비대가 있었으며 양측 하지에 광범위한 점상 출혈이 관찰되었다.
검사 소견: 말초 혈액 검사에서 혈색소 9.0 g/dL, 헤마토크리트 25.7%, 백혈구 15,882/μL (모세포 70%), 혈소판 18,000/μL였다. 생화학 검사 및 요검사는 정상이었다. 흉부 전산화 단층 촬영에서 양측 흉수와 함께 폐부종이 관찰되었으며 흉골하부와 검상돌기 주변을 따라서 조영 증강되는 연부 조직 음영이 보였다.
골수검사 소견: 세포 충실도 100%, 모세포가 100%였으며 Auer 막대가 관찰되었다. 골수세포의 세포화학 염색에서 MPO 염색에 강양성, NSE 염색에 약양성, PAS 염색에 음성 반응을 보였다. 골수 세포의 면역표현 분석 검사에서 cy-MPO, CD45, CD33, CD34, CD13, CD117, HLA-DR에 양성, CD19, CD56에 음성을 나타내었다. 염색체 검사에서는 20개의 중기 세포 모두 t (8;21)이 관찰되었으며(46 XY, t (8;21)(q22;q22)[20]), FISH를 통해 RUNX1/RUNX1T1 재배열을 확인하였고, qRT-PCR 법으로 측정한 그 전사체값은 4.89였다. c-kit 돌연변이 검사에서 역시 D816V 돌연변이가 확인되었다(Table 1).
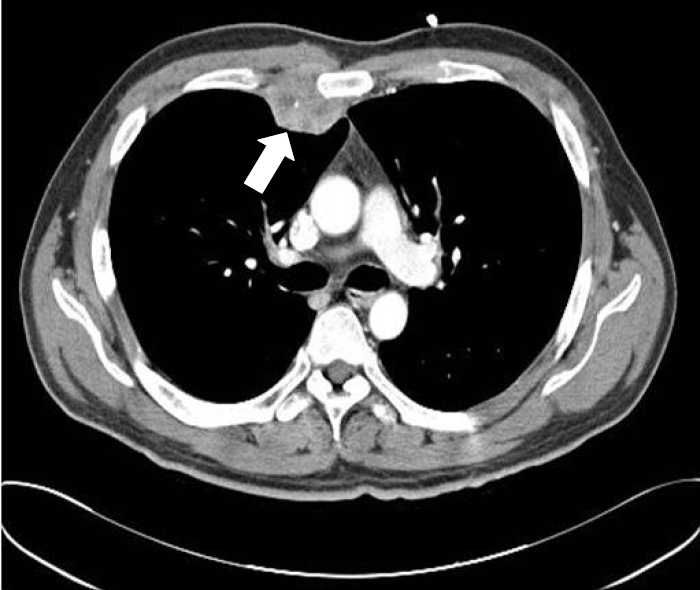
치료 및 경과: 중심정맥도관 감염에 대한 항생제 치료 후, idarubicin, enocitabine을 통한 관해유도 요법 후 시행한 골수 및 말초혈액 검사에서 모세포는 관찰되지 않았으며 RUNX1/RUNX1T1 유전자의 전사체 값은 0.04로 감소되었다. 같은 약물로 1차 공고요법 후 골수 검사에서 모세포가 8% 관찰되어 불완전 관해로 판단되었으며 당시 RUNX1/RUNX1T1 유전자의 전사체값은 1.43이었다. 환자 요통 호소하여 요추 자기 공명 영상 검사 시행하였으며 좌측 두번째 천골 신경근을 압박하고 있는 3.0 × 1.5 × 1.6 cm 크기의 종괴가 있어 골수육종으로 판단, 방사선 치료 및 척수막강 내 methotrexate, cytarabine을 투여하였다. 이후 10일 경과한 시점에서 fludarabine, cytarabine, mitoxantrone의 삼제병합화학요법을 통한 1차 재관해 요법을 시행하였다. 추적 골수 및 말초혈액 검사에서 모세포는 관찰되지 않았으며 RUNX1/RUNX1T1 유전자의 전사체 값이 0.00769로 감소하였고 요추 자기 공명 영상 검사에서도 이전에 보이던 종괴는 완전히 사라졌다. 환자는 흉부 불편감을 호소하였으나 다른 검사상 특이 소견 없어 흉부 전산화 단층 촬영을 시행하였고, 우측 2-4번째 갈비뼈 전방부위에 흉골과 접하고 있는 4.7 × 3.1 cm 크기의 흉벽 내 종괴가 발견되어 골수육종으로 판단되었다. 한편, 주조직적합 항원이 일치하는 형제가 있어 동종 조혈모세포 이식술을 시행하였으며 이식 후 28일째 골수 검사에서 성공적인 생착이 확인되었다. RUNX1/RUNX1T1 유전자 전사체 값은 측정되지 않았으며 흉부 전산화 단층 촬영 및 요추 자기 공명 영상 검사에서 골수육종으로 의심되는 소견은 없었다. 골수 이식 3개월 후 추적 골수 검사에서 모세포는 보이지 않았으나 세포 충실도 5%였으며 RUNX1/RUNX1T1 유전자 전사체 값은 0.294였다. 전흉벽의 통증 및 종괴가 있어 시행한 흉부 전산화 단층 촬영에서 2.5 × 1.3 cm 크기의 흉벽 내 종괴가 이식 전과 같은 부위에서 확인되었으며(Fig. 3) 조직의 면역 표현형 검사에서 CD34, MPO 양성으로 골수육종으로 진단되어 국소 방사선 치료를 하였다. 이식편대 백혈병(graft versus Leukemia) 효과를 보기 위한 의도로 면역억제제 용량을 급속하게 감량하던 중 피부 및 간의 급성이식편대 숙주병이 발생하였으며 cyclosporin으로 인한 것으로 추정되는 혈전성 미세혈관병증(thrombotic microangiopathy)이 발생하여 혈장교환술을 시행하였으나 급성 신부전 및 급성 심근 경색증이 발생하여 사망하였다(Table 2).
고 찰
t (8;21)(q22;q22); RUNX1/RUNX1T1를 동반한 AML은 8번 염색체의 RUNX1T1 유전자와 21번 염색체의 RUNX1 유전자의 상호전좌로 인해 발생한다. RUNX1유전자는 정상 조혈 작용에 필수 인자인 core-binding factor (CBF)의 α-아단위를 부호화(coding)하는데, RUNX1/RUNX1T1 융합 유전자는 core-binding factor 전사 복합체를 무력화하여 백혈병을 유발시킨다[4].
t (8;21)(q22;q22)은 젊은 연령층에 호발하며, 골수외 백혈병(extramedullary leukemia)의 빈도가 높다. 형태학적으로는 풍부한 세포질과 다량의 과립구를 함유하며 Auer rod와 세포질내 공포가 흔히 관찰되고 골수내 호산구가 증가되어 있는 것이 특징이다. 면역표현형 검사에서 골수계 세포 표지자인 CD13, CD15와 줄기세포 항원인 CD34, HLA-DR의 발현율이 높고, B-세포 표지자인 CD19와 자연살해 세포 표지자인 CD56이 발현되는 경우가 있다[5]. 또한 항암 화학요법에 좋은 반응을 보여 완전 관해율 96-98%, 5년 총 생존율(overall survival)이 70%에 달하며 5년 무재발 생존율(5-year event free survival) 또한 35개월 이상으로 매우 양호한 예후를 보인다[6]. 하지만 RUNX1/RUNX1T1 재배열이 동반된 AML 중 일부는 높은 재발률과 낮은 생존율을 보이며 급격한 임상 경과를 밟는데, 이러한 아형은 c-kit 돌연변이와 연관되어 있다고 알려져 있으며 진단 당시 높은 백혈구 수, 골수외 백혈병의 임상양상을 보이는 경우가 많다[1].
c-kit 수용체(CD117)는 4번 염색체의 장완에 위치하고 있는 원종양 유전자(proto-oncogene)의 일종인 c-kit 유전자에 의해 부호화(encoding)된다. fms-like tyrosine kinase 3 (FLT3), colony-stimulating factor 1 receptor (CSF1R), 혈소판유래성장인자(platelet-derived growth factor) 수용체와 유사구조를 가지며 이들과 함께 type III receptor tyrosine kinase (RTK)에 속한다. RTK는 세포외막 영역(extracellular membrane domain), 하나의 막통과 영역(transmembrane domain), 막근접 영역(juxtamembrane domain), 그리고 kinase insert에 의해 분리된 두 개의 protein tyrosine kinase 영역(PTK1, PTK2)으로 이루어진 세포내 영역(intracellular domain)으로 구성되어 있다. C-KIT 수용체는 steel factor라고 하는 줄기세포인자(stem cell factor) 또는 비만세포 성장인자(mast cell growth factor)를 리간드(ligand)로 갖는다. c-kit 수용체와 리간드 사이의 상호작용에 의해 수용체의 tyrosine 잔기의 이합체 및 자가인산화가 일어나 생식세포, 비만세포, 혈구세포 및 멜라닌세포의 성장과 분화에 중추적 역할을 하는 일련의 생화학적 신호가 세포 내로 전달된다[7,8].
c-kit는 AML에서 약 60-80%의 높은 발현율을 보이며[9] 세포 증식에 기여한다. c-kit 돌연변이는 대개 core binding factor leukemia (CBFL)에서 발견되는데, 전체 AML의 2% 이하에서 c-kit 돌연변이를 보이는 반면, RUNX1/RUNX1T1 재배열이 동반된 경우에는 그 발생 빈도가 24-39%에 이른다[10].
PKT2 영역의 17번 exon의 816 위치에 존재하는 aspartic acid가 valine으로 대치되는(D816V) 점 돌연변이가 RUNX1-RUNX1T1 양성 AML에서 발견되는 c-kit 돌연변이의 가장 흔한 형태로 이러한 돌연변이는 수용체의 구조적인 변화를 가져와 PTK 영역의 구조를 불안정하게 하여 리간드의 결합과 관계 없이 수용체의 지속적인 활성화 및 자가 인산화를 초래하며 임상적으로 불량한 예후를 보이는 것으로 알려져 있다[10-12]. 본 증례에서도 모두 D816V 돌연변이가 확인되었다.
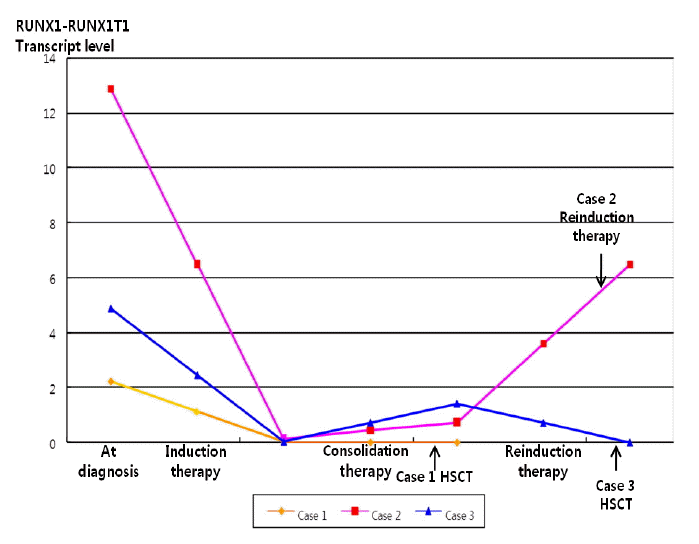
RUNX1/RUNX1T1 유전자의 전사체 값은 미세잔존질환(minimal residual disease)과 재발을 예측할 수 있는 수단으로[13,14] 증례 1의 환자에서는 관해유도 요법 후 그 수치가 급격하게 감소하였으나 증례 2,3의 환자에서는 관해유도 치료 후 그 수치가 지속적으로 상승 내지 유지되었으며 임상경과와도 부합하는 결과를 보여주었다(Fig. 4).
AML에서 골수성 분화(myeloid differentiation)를 갖는 모세포에 림프구 항원인 CD19의 이상 발현은 잘 알려져 있다. 특히, t (8;21)(q22;q22) 양성 AML에서 CD19의 발현은 63-80%에 달해 t (8;21)(q22;q22)이 없는 군에 비해 높은 빈도를 보인다[15]. 또한 t (8;21)(q22;q22) 양성 AML의 약 50-60%에서 CD56의 발현이 나타난다[16]. CD56은 신경세포 부착인자(neural cell adhesion molecule, NCAM)의 표지자로서 자연 살해세포(natural killer cell)의 대표적인 표지자이며 cadherin, selectins, integrins 등의 세포 부착 물질에서 발현된다[17]. 하지만 c-kit 돌연변이가 동반된 경우 CD56의 발현은 유지되나 CD19의 발현이 감소 내지 발현되지 않는 양상을 보여 CD19 항원이 c-kit 돌연변이의 발생에 영향을 줄 것으로 보이며 CD56의 발현이 골수외 백혈병의 발생 및 생존 기간의 단축과 연관되어 있을 것으로 생각한다[1].
골수외 백혈병(extramedullary leukemia)은 골수외 공간에 백혈병 세포가 침윤되는 것으로 결절을 형성하기도 하며(myeloid sarcoma, 또는 chloroma), 피부(leukemia cutis), 뇌막, 잇몸 등 신체의 어느 부위든지 침범할 수 있다. AML 환자의 20-40%에서 나타나며 낮은 관해율, 짧은 생존 기간을 보이며 동종조혈모세포이식 후에도 높은 재발률을 보인다. 몇몇 보고에 의하면 골수외 백혈병 발생과 관련된 위험인자로는 t (8:21), inv (16)과 같은 유전자 이상, 백혈병 세포에서 부착 분자(NCAM, T-세포 표지자, CD15)의 발현, Auer 막대의 결핍, 높은 모세포 분화능(FAB M4, M5)을 보이는 경우, 진단 당시 높은 백혈구 수 등이 제시되고 있다[18].
본 증례의 환자들도 CD19 항원은 모두 음성이었으며 진단 당시 백혈구 수는 40,000/μL 이상으로 높았다. 첫 번째 증례의 환자에서는 CD56 항원에 대한 검사는 시행되지 않았으며 나머지 두 명의 환자에서는 음성으로 나타나 이제까지 알려진 골수외 백혈병과 CD56 항원의 관련성과는 상충되는 결과를 보여주었다. CD56 항원 외에 골수외 백혈병의 발생에 기여하는 또다른 요인이 있을 것으로 추측되며 향후 이에 대한 연구가 필요할 것이다.
Imatinib mesylate와 같은 c-kit의 표적 치료제는 c-kit 돌연변이의 양상에 따라 다양한 효과를 보이는데, c-kit D816V 돌연변이가 있는 경우 imatinib mesylate에 저항성을 나타내지만 N822K 돌연변이에 대해서는 감수성을 보인다. 최근의 연구에서 c-kit D816V 돌연변이는 IL-3에 비의존적으로 Ba/F3 세포의 성장을 유도하여 imatinib, SU5614에 저항성을 나타낸다고 보고한 바 있다[7]. Imatinib에 저항성을 보이는 c-kit 돌연변이를 표적으로 하는 약제의 개발이 이루어지고 있으며 최근 PKC412가 임상 시험 중으로 향후 c-kit D816V 돌연변이가 동반된 AML의 치료제로서 기대를 모으고 있다[1].



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






