서 론
위장관 운동은 자율신경에 의해 조절되며, 평상시에는 규칙적이고, 매우 섬세하게 조절되고 있다. 위장관 운동의 조절에는 평활근, 신경세포, 기질세포 등의 세포들이 매우 복잡한 상호작용을 통해 이루어지며, 현재까지도 모든 기전이 명확히 알려져 있지는 않다. 중추신경과 연합뉴론(interneuron), 감각신경의 복잡한 신경얼기에 의해 발생한 신경전달신호가 신경말단에서 평활근으로 전달되어 평활근의 수축이 이루어진다고 믿던 과거의 개념은 카할간질세포(interstitial cell of Cajal; ICC)의 기능이 알려지면서 변화하였다[1]. 복잡한 기전에 의해 ICC로부터 발생한 주기적인 수축반응은 위장관 운동에 중요한 역할을 하며, 신경과의 상호작용을 통하여 좀 더 정교해지고, 근위부와 원위부의 평활근이 잘 연동되도록 하는 역할을 한다. 하지만 신경말단-ICC-평활근의 신호전달 체계에 대한 많은 연구에도 설명할 수 없는 부분이 있다. 최근에 위장관의 근육층에 존재하는 다양한 기질세포 중의 하나인, 섬유아세포-유사 세포(fibroblast-like cells; FLCs)의 형태학적 특성과 기능에 대하여 관심이 높아지고 있다[2]. 이 종설에서는 위장관 운동이 직접적으로 일어나는 평활근으로부터, 신호전달체계의 가장 윗 단계인 신경말단까지의 과정을 생리학적인 신호전달의 역순으로 기술하며 1) 위장관 평활근의 수축은 어떤 기전에 의해 나타나며, 영향을 주는 여러 경로에는 어떤 것이 있는가? 2) 위장관 평활근과 ICC는 어떤 상호작용을 하며, 해부학적 생리학적 특성은 어떠한가?3) 새로이 발견된 FLCs는 어떠한 특성이 있으며, 생리학적 역할은 무엇인가에 대하여 알아보고자 한다.
위장관 평활근의 수축기전
정상적인 평활근의 수축은 세포막에 존재하는 수용체 조절작용에 의한, 액틴과 미오신이 결합하여 연결고리(actin myosin cross-bridge)를 형성하여 평활근 세포의 길이가 짧아지는 것이므로, 평활근의 수축정도는 일차적으로, 미오신 경사슬 인산화(phosphorylation of myosin light chain) 정도에 의해 결정되는데, 이 반응의 에너지원은 myosin ATPase에서 공급되어 myosin light chain kinase (MLCK)가 20 kDa 크기의 미오신 경사슬을 인산화하여 액틴과의 상호작용을 통해 반복적인 연결고리의 형성이 가능하게 한다[3]. 미오신 경사슬 인산화는 평활근 수축의 최종단계이며, 여기에는 세포내 Ca2+의 농도변화에 의한 경로인 Ca2+-의존 수축반응(Ca2+-dependent contraction)과, Rho kinase에 의한 경로인 Ca2+-감작반응(Ca2+-sensitization contraction)이 있다[4].
Ca2+-의존 수축반응
평활근 수축의 첫 단계는 특별한 자극에 의해 세포외 Ca2+이 여러 가지 칼슘채널(voltage dependent, receptor-operated Ca2+ channels)을 통해서 세포내로 이동하여 세포내 Ca2+ 농도가 증가하는 것이다. 그래서 이 반응을 Ca2+ signaling cascades라고 부르기도 한다. 이렇게 증가된 Ca2+은 세포내의 calmodulin과 결합하여 calcium-calmodulin complex를 형성하는데, 이 복합체는 MLC kinase를 활성화시켜, 미오신 경사슬 인산화를 유도한다(Fig. 1). 세포내 Ca2+ 증가에는 세포밖으로부터의 유입 외에도 세포내 Ca2+ 저장소인 근소포체(sarcoplasmic reticulum; SR)로부터의 분비도 포함되는데, Norepinephrine, angiotension II endothelin 등과 같은 평활근 수축 효능제는 세포막의 특별한 수용체에 결합하여 G 단백을 통한 phospholipase C를 활성화 시켜 membrane lipid phosphatidylinositol 4, 5-bisphosphate를 inositol triphosphage (IP3)와 diacylglycerol (DG)로 분해한다(Fig. 1). IP3는 근소포체막의 수용체에 작용하여 분비를 증가시키고, DG는 protein kinase C (PKC)를 활성화하여 세포내의 표적 단백을 인산화하는 역할을 하게 되는데 PCK의 다양한 동질효소(isozyme)는 여러 장기의 세포들이 각각 다른 특별한 역할을 할 수 있게 한다. 결론적으로 Ca2+-의존 수축반응은 평활근 세포에 전달된 신호에 의한 세포내 Ca2+ 농도증가를 증폭하여 평활근 수축이 일어나는 기전이다.
Ca2+-감작 반응
세포내 Ca2+ 농도 증가를 통한 수축반응은 일차적인 수축으로, 수축의 정도와 수축의 유지 및 이완과 같은 정교한 조절에 필요한 것이 Ca2+-감작 반응으로, Rho kinase 경로가 대표적이며 Rho/Rho kinase signaling pathway로 기술하기도 한다. Myosin phosphatase의 작용에 의해 미오신 경사슬 인산화를 조절한다(Fig. 1). 이 효소는 인산화된 미오신 경사슬에서 인산을 분해하여 수축이 더 이상 지속되지 않도록 하는 역할을 한다. 결과적으로 myosin phosphatase의 작용을 억제하면 수축이 지속된다. 그러므로, MLC phosphatase의 조절에 중요한 역할을 하는 Rho kinase의 역할은 평활근의 수축과 이완에 중요한 역할을 하게 되며, 이론적으로 Rho kinase는 MLC phosphatase의 미오신-결합부위(myosin-binding subunit)를 인산화하여 활성화를 방해하므로, 결과적으로 MLC phosphatase는 비활성화 상태를 유지하게 되어, 평활근의 지속적 수축을 유지한다(Fig. 1). 실험적으로, Rho kinase 길항제(fasudil, Y-27632)를 사용하면, 평활근의 이완이 관찰된다[5,6].
카할간질세포와 위장관 평활근
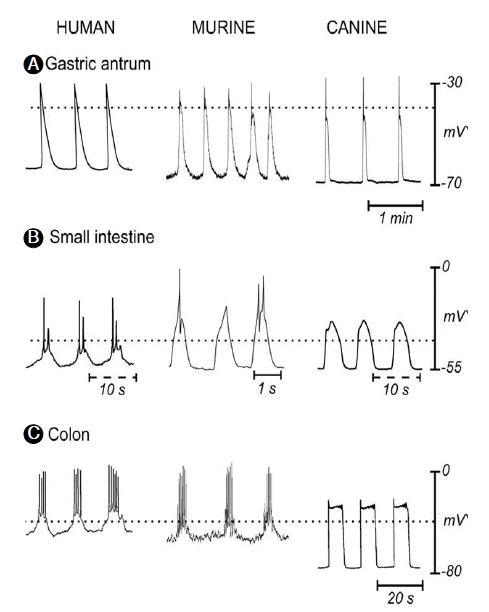
위장관 평활근의 가장 두드러진 특징은 규칙적인 수축운동을 하는 것이다(Fig. 2). 수축을 유발하는 세포막의 탈분극 기간이 길고, 빈도가 적어 서파(slow wave)라고 하며, 발생의 기전에 대하여 오랫동안 연구하였으나, 신경 또는 평활근의 자동성으로는 설명하기 힘들었다[7]. 기전을 밝히기 위한 연구는 자연스럽게 뉴론과 평활근에 밀접하게 위치하지만 기능이 정확히 알려져 있지 않았던 ICC로 이동하였다[8]. ICC의 형태학적인 연구로, ICC 네트워크를 형성하고 있으며, 평활근과 20 nm 이내의 매우 밀접한 간연접(gap junction)을 가지고 있어서 위장관 운동의 조절능력이 있다는 것을 알았다[9]. 지난 20년 동안의 ICC의 생리학적인 연구의 결과를 정리하면, 서파를 발생시키는 독특한 이온전류를 제공하는 pacemaker의 역할을 하며, 전압의존성(voltage-dependent)기전과 다른 세포들과의 네트워크를 통한 반복적인 서파의 발생과 연동(propagation)을 조절하고, 위장관으로 전달되는 신경전달신호에 대한 신경말단이후반응(post-junctional response)에 관여하는 수용체의 발현과 형질도입에 관여하고, 기저막 전압과 신경합포체의 전도에 기여하여 평활근의 흥분성을 조절하고, 서파의 빈도를 조절하고, 세포신축에 민감한 수용체를 통하여 평활근 흥분도의 조절에 관여한다는 것이다[1].
ICC는 위장관 근층에 존재하며, 그 위치에 따라 분류하는데, 각각의 부위에 따라 ICC의 분포에 차이가 있다[10]. 위, 소장에서는 근육층 내에 존재하는 ICC-IM (intramuscular)과 근신경총(myenteric plexus)에 위치하는 ICC-MY (myenteric plexus), 또는 ICC-MP (myenteric plexus; Auerbach’s plexus라고 쓰여 ICC-AP로 기술된 논문도 있다)가 있으며, 대장에서는 ICC-IM, ICC-MY와 함께 점막하 신경얼기에 존재하는 ICC-SM (submucosa)이 있고, 환상근(circular muscle)의 점막 하층쪽으로 위치하는 ICC-DMP (deep muscular plexus)도 있다. 각각의 위치에 존재하는 ICC의 기능은 다르게 나타나며, 위와 소장에서는 ICC-MY가 pacemaker 역할을 하지만, 개나 사람의 대장에서는 ICC-SM이 그 역할을 한다. 이와 같이 서파를 만드는 ICC로는 ICC-MY와 ICC-SM이, 신경전달에 관여하는 ICC는 ICC-IM, ICC-DMP 등이 있고, ICC 중에는 평활근 다발사이의 격벽에 존재하며 근육다발의 동시수축에 관여하는 것으로 알려진 ICC-SEP (septa)도 있다. ICC-IM의 주요기능이 내장신경으로부터의 정보를 전달하는 역할이지만, 어떤 환경에서는 intrinsic pacemaker로 작용하기도 한다[10-12].
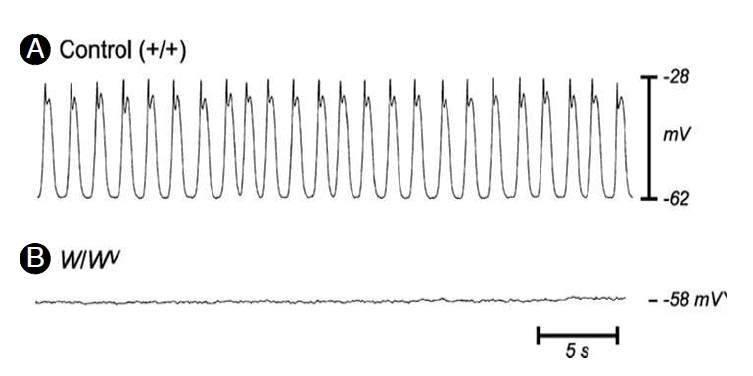
ICC의 형태학적인 연구에는 c-Kit에 대한 면역현광염색이 이용되고, 기능 및 생리학적 연구에는 특정부위의 ICC가 소실된 W mutant (dominant white spotting locus coding) mouse & rat, Kit ligand의 변형이 발생한 Sl/Sld mice가 주로 이용된다. W/Wv mouse인 경우, 위기저부와 위전정부의 ICC-IM, 소장의 ICC-MY가 소실되어 있다[13,14]. 신체의 항상성에 중요한 tyrosine kinase인 c-Kit에 대한 중화항체(neutralizing antibody)를 처리한 신생동물(new born animal)에서 위내 우유가 저류되고(위배출 장애), 장마비가 생겼으며[15], W mice에서 특정한 ICC의 분포가 소실된 경우에서도 서파가 소실되었다(Fig. 3) [16]. 조직에서의 칼슘흐름을 직접 확인할 수 있는 칼슘 영상(calcium imaging) 기술을 통해서도, 서파의 활동이 ICC에서 시작하여 평활근으로 전도되어[10], ICC가 서파의 발원지이며, pacemaker라는 사실에 더 이상 의의를 제기할 학자는 없을 것이다.
평활근 칼슘 활성화 기전(smooth muscle calcium activation mechanisms)
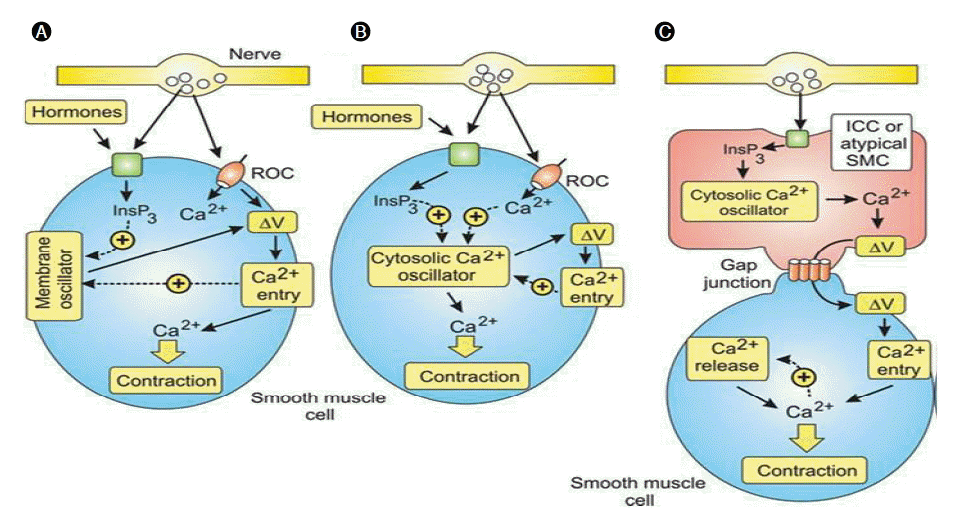
위장관 평활근의 수축작용은 외부 자극(신경으로부터의 전압차, 신경전달물질, gap junction을 통한 전압차 등)에 대한 평활근의 반응으로 나타난다. 기술한 다양한 외주 자극에 의한 평활근의 활성화 기전이 칼슘 활성화 기전이다. 체내에 존재하는 다양한 평활근은 직간접적으로 신경과 연결되어 있어 신경의 반응에 따라 수축과 이완상태를 유지하게 되지만 각각의 평활근은 조금씩 다른 조절기전을 가지고 있어 각각의 특성을 이해하지 않고서는 자극에 대한 반응을 해석할 수가 없다. 특히, 위장관 평활근은 ICC에 의한 신경전달 신호의 변형과 pacemaker 전달신호로 더욱 복잡한 양상을 보인다[17]. 이러한 다양한 평활근 수축 반응은 세 가지로 분류할 수 있으며 각각에 대하여 알아보자(Fig. 4).
첫 번째 기전에서는 칼슘채널이 중요한 역할은 담당한다. 칼슘채널은 Ca2+을 세포내로 옮기는 기능을 하며, 이 중 전압의 변화로 구동하는 경우를 L-type voltage-operated channels(VOCs)이라고 하며, 이 채널에 의한 증가된 세포내 Ca2+이 평활근 수축을 유발한다(Fig. 4A). 정관, 방광, 자궁의 평활근이 이 기전에 해당한다. 두 번째 기전은 주기적인 수축을 하는 혈관, 림프관, 기관지, 해면체 평활근이 해당하며, cytosolic Ca2+ oscillator에 의해 구동된다. 주기적으로 세포내 Ca2+의 증가는 변화된 막전압이 원인이지만, 이런 수축은 이들 평활근의 일차적인 기능이 아니고, 특수한 상황에서 oscillatory 기전이 증폭될 때 일어나는 이차적인 기능으로, 신경전달물질이나 호르몬 등에 의해 수축의 빈도와 강도가 조절된다(Fig. 4B). 세 번째 기전은 ICC와 같은 pacemaker 역할을 하는 세포에 의해서 활성화되는 평활근에서 관찰되며, 요관, 위장관 평활근에서 관찰된다. Cytosolic oscillator를 내장하고 있는 pacemaker 세포에서 발생한 반복적인 세포내 Ca2+ 농도변화는 세포내로의 전류(inward currents)를 만들어 세포막을 통해 전파한다. 세포막과 연관된 gap junction을 통해서 평활근으로 전달된 탈분극 신호(depolarizing signal; ΔV)가 평활근 내에서 첫 번째 기전과 같은 기전을 통해 수축이 유발된다(Fig. 4A and 4C) [18].
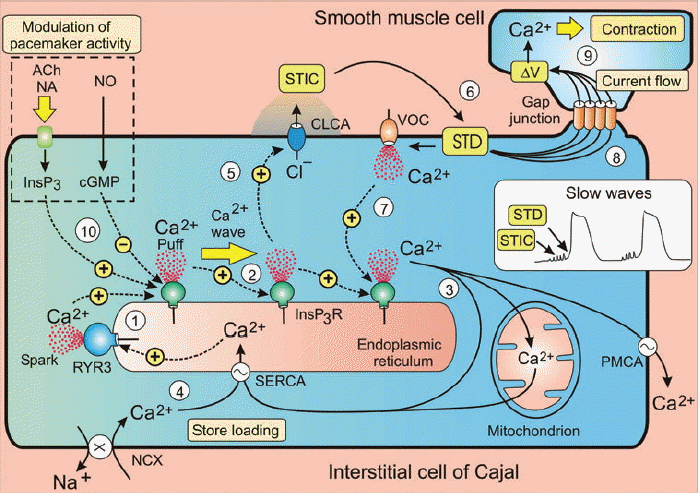
서파발생의 기전은 ① ICC 세포내의 칼슘저장소인 근소포체(SR)의 막에 많이 분포하고 있는 ryanodine receptor 3 (RYR3)에 의한 SR로부터 일시적인 Ca2+ 분비로 발화한다. ② 이렇게 발생한 Ca2+ 농도변화는 Ca2+-induced Ca2+ release (CICR) 반응을 유발하여 ICC 세포내 Ca2+ wave를 만든다. SR내의 Ca2+ 농도가 감소하면 Ca2+ wave도 감소한다. ③ 회복기에 세포질 내의 Ca2+는 세 가지 기전에 의해 농도가 감소하는데: 세포막 Ca2+-ATPase (PMCA)에 의한 세포 밖으로 밀려나거나; sarcoendoplasmic reticulum Ca2+-ATPase (SERCA)에 의해 칼슘저장소인 SR에 다시 저장되거나; 미토콘드리아로 흡수된다[18]. ④ 세포질내 Ca2+이 SR으로 재흡수될 때 세포질내 Ca2+농도가 중요하며, 재흡수가 계속 일어나야 Ca2+ oscillation 활동이 지속적으로 일어난다. Na+/Ca2+ exchanger (NCX)는 세포질 내의 지속적인 Ca2+ 농도상승에 도움을 주며, T-type Ca2+ channels도 돕는다. ⑤ Ca2+ wave로 분비된 Ca2+은 Ca2+-sensitive chloride channels (CLCA)을 활성화하여 세포막 탈분극을 통한 서파를 발생시킨다. CLCA의 작용으로 STICs이 발생한다. ⑥ STICs의 합은 spontaneous transient depolarization (STD)를 유발하여 서파가 발생한다. ⑦ 발생한 STD는 VOC을 열어 세포밖의 Ca2+이 세포내로 이동한다. VOCs opening은 ICC oscillator의 작동에 필수적인 것은 아니지만 중요한 역할을 하는데, 세포내로 들어온 Ca2+은 SR로부터의 Ca2+ 분비를 도와서 서파의 발생속도를 높이고, ICC network의 넓은 지역에서 서파발생이 동시에 일어날 수 있도록 돕는다. ⑧ ICC pacemaker slow wave는 gap junction을 통한 전압이 수동적으로 평활근에 전파된다. ⑨ 서파가 평활근에 도착하면, L-type Ca2+ channel이 활성화하여 평활근 수축이 일어난다. ⑩ 신경말단에서 분비되는, 아세틸콜린(Ach), 노에피네프린(NA), 산화질소(NI)와 같은 효과제는 ICC pacemaker의 활성도를 조절한다. Ach, NA는 InsP3 형성을 증가하여 Ca2+ 농도 상승을 유발하고, NO는 cyclic GMP-dependent protein kinase 1β (cGK1 β)을 통하여, InsP3 receptor를 인산화하여 Ca2+ sensitivity를 감소하여 pacemaker의 활성도를 감소시킨다(Fig. 5) [19].
위장관 평활근층의 fibroblast-like cells (FLCs)의 생리
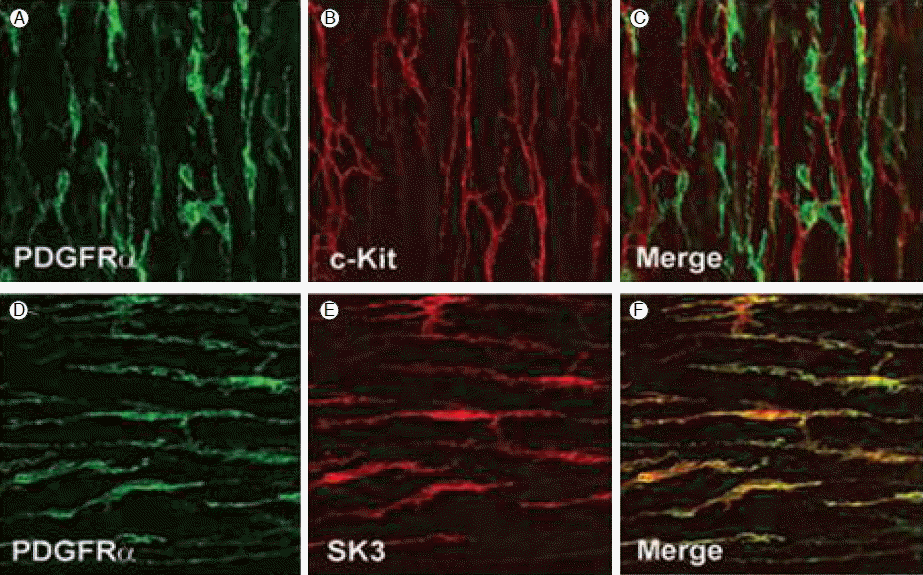
평활근조직을 구성하는 세포는 다양하여, 근육세포, 신경세포와 다양한 형태로 밝혀지고 있는 간질세포(interstitial cells)들이 있다. Fibroblast-like cells (FLCs)로 불리는 간질세포는 많은 평활근 조직내에 분포하며, 해부학적으로 ICC의 분포와 거의 일치한다[20]. 면역조직화학염색 없이는 근육세포와 간질세포의 형태학적 차이를 구분할 수 없지만, FLCs는 ICC와 미세구조에서 뚜렷한 차이로, 높은 전자밀도와 잘 발달된 조면소포체(rough endoplasmic reticulum)를 가지고 있어 흥분성을 내재한 세포라는 것을 알 수 있다[21]. ICC에서 c-Kit 항체양성 소견과 같이 FLCs에서는 platelet-drived growth factor receptor α (PDGFRα) 항체양성 소견을 보인다(Fig. 6). 즉, FLCs는 형태학적으로 ICC와 유사하며, 분포도 유사하여 근육층의 신경얼기와 동일한 방향으로 주행하며, 근육세포와는 gap junction을 가지고 있어 ICC와 유사하지만 PDGFRα+라는 특징을 가진다. 기능적으로는 Ca2+-activated K+ channel protein (SK3)의 존재가 알려져 있어 신경전달에 관여할 것이다. 최근의 연구에서 SK3 channel은 apamin (벌독소)에 의해 차단되는 위장관의 purinergic inhibitory junction potentials(IJPs)로 알려져 있다[22,23]. 다시 말하면 FLCs는 Ca2+-activated K+ current를 만들 수 있으므로, gap junction을 통하여 주위의 평활근과 FLCs로 흥분성을 전파할 수 있는 충분한 능력이 있고, 특히 퓨린성 흥분을 한다면, P2Y1 수용체 경로를 통하여, 내장신경의 억제신경전달(inhibitory neurotransmission)을 매개할 것이다[21].
맺음말
위장관 평활근의 수축은 서파에 의해 발생하며, 서파는 ICC에서 발생한다. RYR3 수용체의 점화로 시작된 ICC 세포내 Ca2+ 농도증가는 세포막의 Ca2+-sensitive chloride channels을 활성화하여 STIC을 유발하고 합쳐져 STD를 만들고, gap junction을 통하여 위장관 평활근으로 전달된다. 평활근 세포막으로 전달된 신호에 의한 VOD의 활성화로, 평활근 세포내 Ca2+이 증가되고, calmodulin과 결합하여 결합체를 형성하며, 활성화된 MLC kinase에 의한 미오신 경사슬 형성은 평활근 수축을 유발한다.
위장관의 신경은 억제신경으로, 평활근 세포막의 수용체와 연계된 G 단백을 통한 반응으로 수축의 강약과 기간에 영향을 미치고, ICC 세포막의 InsP2, cGMP 경로를 통하여 ICC pacemaking의 빈도를 조절하는 역할을 한다.
FLCs은 PDGFRα+의 새로 밝혀지고 있는 간질세포로, 형태학적으로 신경얼기와 평활근과의 gap junction을 가지고 있으며, SK3로 알려진 Ca2+ activated K+ channel을 다수 보유하고 있어, 내장신경말단에서 평활근으로의 신호전달체계를 밝히는 중요한 열쇠일 것이다.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






