서 론
담관암(cholangiocarcinoma)은 간내 또는 간외 담관의 상피세포인 담관세포(cholangiocyte)에서 기원하는 악성 종양으로 간세포암(hepatocellular carcinoma)에 이어 두 번째로 흔하게 간에 발생하며 간에 일차적으로 생기는 암의 약 15%를 차지한다고 알려져 있다. 담관암을 일으키는 위험인자로는 간흡충(Opisthorchis viverrini와 Clonorchis sinensis), 간내담석, 서구에 비교적 흔한 원발성 경화성 담관염(Primary sclerosing cholangitis), 간경변 등이 알려져 있으며 간경변의 위험인자가 되는 B형 간염 바이러스(HBV), C형 간염 바이러스(HCV)도 위험인자가 되는 것으로 보고되고 있다. 그 외에도 드문 원인들로 담관 낭종(choledochal cyst), 담관내 유두종증(biliary papillomatosis), Thorotrast 노출 등이 제시되고 있다[1].
인간의 암 발생에 있어 기생충은 바이러스나 박테리아에 비해 그 역할이 적은 것으로 알려져 있으나 아직 세계적으로 기생충의 감염자가 많은 현실을 고려하면 그 역할에 대해 관심을 가져야 한다. 현재까지 인간에 암을 일으키는 것으로 확실히 알려져 group I carcinogen (carcinogenic to humans)으로 분류된 기생충은 세 가지가 있다. 방광암을 일으키는 것으로 알려진 방광주혈흡충(Schistosoma haematobium)과 담관암을 일으키는 간흡충인 Opisthorchis viverrini (O. viverrini)와 Clonorchis sinensis (C. sinensis)가 있다. 이 중 O. viverrini는 태국, 라오스, 베트남 등 동남아시아 지역에 흔하고 특히 태국에서는 담관암 발생과 밀접한 관계가 있음이 잘 연구되어 있고, 그 기전에 대해서도 널리 연구되고 있다. C. sinensis는 동아시아 즉 한국, 북한, 중국 등에 흔하며 O. viverrini (1994년)보다 늦은 2009년에 International Agency for Research on Cancer (IARC)에서 group I carcinogen으로 분류되었다[1,2].
간흡충은 성충의 경우 길이 10~25 mm, 넓이 3~5 mm에 이르는데 1차 중간숙주로 달팽이를 필요로 한다. 사람, 개, 고양이 등 종숙주의 대변으로 분비된 충란을 달팽이가 섭취하고, 달팽이 몸 안에서 cercariae라는 유충으로 변하여 달팽이 몸 밖으로 나가 강물에 헤엄쳐 다니다가 제 2 중간숙주로 담수어인 잉어과 물고기(잉어, 참붕어, 붕어 등)의 근육을 뚫고 들어가 낭(cyst)에 싸인 metacercariae 형태로 존재한다. 사람이 이 담수어를 완전히 익히지 않은 상태로 먹을 경우 감염되게 되는데 metacercariae가 십이지장 안에서 낭에서 나와 담관으로 이동하여 담관 또는 담낭 점막에 빨판을 부착하여 기생하면서 성충으로 자라게 된다.
간흡충에 의한 담관암의 확률 증가는 odd ratio 약 4.8 정도로 알려져 있고[1], 한국에서는 담관암의 약 10%가 간흡충증과 관련이 있다고 알려져 있다[3]. 한편 간흡충이 담관암을 발생시키는 기전은 상당히 복잡한 과정으로 보여지고 아직 연구가 부족한 실정인데, 담관의 만성적인 염증이 가장 중요한 특징으로 여겨지고 이로 인한 미세 환경의 변화로 담관세포의 DNA 손상과 유전적 불안정성을 초래하여 악성화를 일으키는 것으로 보인다. 이 과정에서 기생충 자체에 의한 물리적 손상, 충란이나 분비물에 의한 손상 조직의 과증식 등도 발암 과정에 관여할 것으로 보인다[2]. 따라서 본 논문은 담관암의 명백한 위험인자로 알려진 간흡충이 담관암을 일으키는 병태생리학적, 분자생물학적 기전에 대해 고찰해 보고자 한다.
병리학적 변화
간흡충은 보통 큰 직경과 중간 크기 직경의 담관에 기생하게 되는데 다량 감염되었을 경우 담낭이나 총담관, 췌관 등에도 존재할 수 있다. 간흡충은 간 실질로는 침범할 수 없기 때문에 대부분의 질병 양상 및 조직학적 변화는 기생충의 담관에 대한 직접 혹은 간접적인 영향으로 나타난다. 담관의 확장과 담관 주위 결합조직(periductal connective tissue)의 섬유화는 간흡충 감염 시 공통적으로 보이는 소견이다[4]. 현미경적으로는 담관 상피세포의 과형성(hyperplasia), 박리(desquamation), 선종형 증식(adenomatous proliferation)과 함께 림프구, 단핵구, 호산구 및 형질세포의 침착을 볼 수 있다. 충란이나 죽은 성충에 대해 육아종성 반응이 나타날 수 있고 문맥부 섬유화를 보일 수 있다. 기생충이 다량 감염된 경우에는 이차적 세균 감염이 동반되어 화농성 담관염이나 다발성 간농양을 보이는 경우도 있다. 또 간흡충이 담낭을 침범한 경우 담낭염을 일으킬 수 있다[5]. 한편 햄스터 동물 모델 연구 결과에서 감염 7~14일에 조직학적 변화가 일어나고 60일 정도에 최고조에 이른다고 알려져 있으며, 간외 담관에서 담낭보다 심한 변화를 보인다고 알려져 있다[6].
발암 기전
간흡충에 의한 담관암 발생의 기전 연구는 다른 기생충이나 감염질환에서의 발암 기전 연구에서처럼 복잡하고 여러 가지 제한 점이 있다. 먼저 간흡충은 다른 대부분의 기생충처럼 인체 안에서 증식할 수 없기 때문에 감염의 정도는 환자가 섭취한 기생충의 축적 양에 따라 달라진다. 또 간흡충 감염에서 담관암 발생까지는 장기간의 잠복기가 있기 때문에 간흡충 감염 정도나 기간이 환자 마다 다를 수 있다는 점은 발암기전 연구에 큰 제한 점이 될 수 있다. 한편 긴 잠복기간에 여러 가지 다른 감염 질환 또는 발암 물질(예, aflatoxin) 등 다른 요소가 작용할 수 있다는 점, 막상 암이 생겼을 때는 기생충 감염 현증이 없어 기생충과의 관련성을 밝힐 수 없는 경우도 있다는 점 등이 발암기전 연구를 복잡하게 한다[7,8].
일반적으로 암이 발생하는 과정은 크게 initiation, promotion, progression의 세 단계로 나누어 설명할 수 있다[2]. Initiation은 유전자에 독성을 보이는(genotoxic) 발암물질에 의한 일차적인 DNA 변이를 말한다. DNA 변이는 비가역적이며 조직 안에서 이차적인 자극을 받을 때까지 지속적으로 존재할 수 있다[9]. 정상적으로는 핵심 유전자에 변이가 일어날 경우 세포 항상성이 파괴되어 세포가 죽음에 이르게 된다. 하지만 암 전구 유전자 변이(pro-neoplastic mutation)가 암 억제 유전자(tumor-suppressor genes)의 발현을 감소시키면 세포가 생존하여 증식하는 방향으로 유도할 수 있다[8]. Promotion은 하나의 암 전구 세포(pro-neoplastic cell)가 특정 자극에 의해 그 숫자가 늘어나는 것을 말하고, progression은 조기 암세포 클론이 완전한 암 표현형(phenotype)을 가지게 되어 조절 불가능한 증식을 하는 단계를 말한다[10].
실험 동물 모델
실험 동물에서 간흡충(O. viverrini와 C. sinensis)의 감염과 담관암간의 관계를 밝히는 연구들이 진행되어 왔는데 간흡충 단독으로 담관암을 일으킨다는 증거는 아직 부족하다[8]. 한편 햄스터에 O. viverrini를 감염시키고 저 용량의 N-nitrosodimethylamine(NDMA)를 식수에 타서 일정 기간 먹이면 사람에서 발생하는 담관암과 육안소견 및 조직소견이 유사한 담관암을 일으키는 것으로 보고되고[11], 여러 유사한 연구에서 다양한 유병률로 담관암 발생이 보고되었다[12-15]. 이와 비슷하게 국내에서 실시된 연구에서도 C. sinensis를 감염시킨 햄스터에 NDMA를 식수에 타서 먹여도 담관암이 발생하는 것으로 보고되었다[16,17]. 그러나 간흡충 단독 또는 NDMA 단독으로 담관암이 발생된 보고는 아직 없어서 담관암 발생에 기생충의 작용 외에 외부의 nitrosamine 등 발암물질(carcinogen)이 복합적으로 작용함을 시사한다.
만성 염증
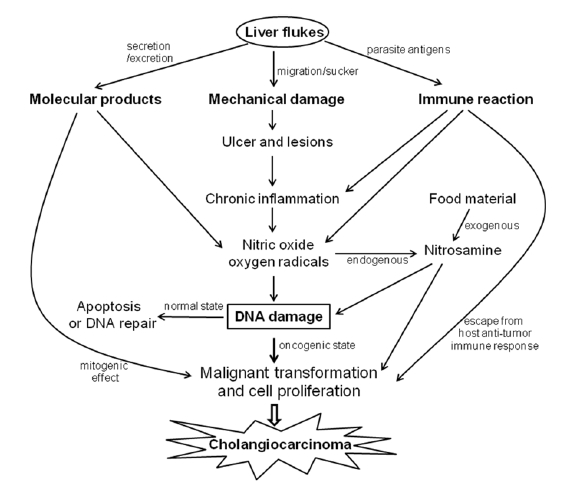
감염과 관련된 대부분의 암은 감염 부위 자체의 만성 염증과 동반되어 나타나고 염증 세포에 의해 조성된 미세 환경이 발암과정에 결정적 역할을 하게 된다[9]. 때문에 암은 조직 손상이나 염증이 발생한 부위 또는 인접 부위에 발생한다[7]. 그러나 신경 낭미충증(neurocysticercosis) 환자에서 골수세포나 말초 림프구에서 유전자 변이가 높은 빈도로 발견된 연구 결과도 있어 만성 기생충 감염에서 국소 염증 이외의 기전으로 다른 부위에 암이 생길 수 있음을 시사한다[18]. 만성 염증 부위에서 발암 기전에 가장 중요한 요소는 DNA 손상인데, 대식세포나 호산구 등 염증세포는 기생충에 대한 반응으로 nitric oxide 등 free radical을 생성하여 DNA의 산화 또는 손상을 통한 돌연변이를 일으키고 유전적 불안정성이나 암 변이를 초래할 수 있다(Fig. 1) [8]. 한편 염증부위에 존재하는 대식세포와 T-임파구에서 분비하는 cytokine인 macrophage migration inhibitory factor (MIF)는 염증세포에 의 한 DNA 손상을 악화시킬 수 있는데, p53 발현을 감소시켜 DNA 손상에 대한 정상적인 반응기전에 지장을 초래하여 암세포 변이 가능성을 높이는 것으로 알려져 있다[19].
기생충 대사 산물
간흡충은 외피나 배설공을 통해 여러 가지 대사산물(metabolic product)을 담즙으로 분비 또는 배설하는데 그 중 일부는 숙주에서 강하게 면역반응을 일으킨다[21]. 간흡충 대사산물은 면역반응을 일으키는 외에도 담관 상피세포에 직접적인 독성을 나타낼 수 있으며 상피세포와 증식에 관여된 상호 작용을 일으킬 수도 있다. 실제로 생쥐 fibroblast와 O. viverrini를 co-culture할 경우(물리적으로 분리되어 있고, 배양액만 공유) O. viverrini가 없이 배양할 때에 비해 4배 정도 세포 증식이 빠른 것으로 알려져 있고[22], microarray 등을 이용한 fibroblast 유전자 발현 연구에서 transforming growth factor 등 성장을 촉진하는 단백질 유전자를 과발현시키는 것으로 보고된다[23]. 이러한 소견은 간흡충이 분비 또는 배설하는 대사산물이 mitogen 기능을 가지고 있음을 분명히 하며, 간흡충 감염 초기에 보이는 담관 상피세포 과형성(hyperplasia)의 원인을 어느 정도 설명해 준다[24]. 한편 이러한 담관세포 증식이 결국은 담관암을 유발하게 되는데(Fig. 1), 이를 통해 기생충이 얻는 이점에 대해서는 불분명하다. 비록 간흡충이 손상된 담관 점막을 통해 혈액을 섭취하는 것으로 알려져 있지만[25], 담관세포 과증식과 이를 통해 분비되는 mucin 등이 기생충의 영양섭취 대상으로서 유리하게 작용할 가능성이 있다.
기생충과 숙주간 면역 반응
장기 이식 후 면역억제 치료를 받는 환자나 선천성 혹은 후천성 면역결핍증 환자에서 암 발생률이 높은 점은 암 발생에 면역 시스템이 분명히 작용함을 시사한다[26,27]. 암세포 변이 초기에 항암 면역 반응(anti-tumor immune response)이 존재한다는 증거들이 많으며[18,19,26,27], 많은 종양들이 이를 피하기 위한 면역 회피 기전들을 가지고 있는 것으로 알려진다[26]. 암세포들이 항암 면역 반응을 피하기 위해 몇 가지 기전들을 사용하는데, MHC 1 분자 또는 antigen presenting cell과 관련된 분자들의 발현 감소[28], TGF-β 와 IL-10 같은 cytokine의 분비[29], Th1-Th2 균형에서 Th2 반응 쪽으로 이동을 통한 암세포 거부 반응과 관련된 세포매개 면역력의 억제[26,27,29] 등이 있다. 대부분의 기생충 감염은 사람이나 동물에서 Th2 관련 cytokines (IL-4, IL-5, IL-9, IL-10, IL-13) 생성으로 특징되는 면역반응을 일으키고 감염 기간 내내 지속되는 것으로 알려져 있다[30]. 이는 장기간의 기생충 감염 동안 숙주의 면역 감시 체계에 영향을 미쳐 암 변이 세포가 증식을 할 수 있게 하는 결과를 초래하고[26], 또 Th1 면역 반응 감소를 통한 Th1-Th2 균형의 변화로 암세포에 대한 거부 반응의 억제를 가져 오는 것으로 보인다(Fig. 1) [29,31].
간흡충에 대한 숙주의 면역 반응이 만성 염증 및 간담도계도 일으키는 것으로 알려져 있고[32], 햄스터 모델에서도 담관 주위에 염증반응이 간흡충에 대한 숙주의 면역반응의 결과라는 것이 밝혀져 있다[33]. 간문맥 주변부위에 일어나는 다량의 염증세포 침윤이 담관세포내에서 면역조직화학검사에 의해 검출되는 기생충 항원과 관련이 있다고 알려지고 간흡충이 들어 갈 수 없는 작은 직경의 담관에서도 간흡충항원 양성반응과 염증이 발견된다. 한편 간흡충 항원은 육아종내에 있는 대식세포, 상피양(epithelioid) 세포, 거대세포에서도 관찰된다[33].
N-니트로소 화합물(N-nitroso compound)
햄스터 동물 모델에서 간흡충만 감염시킨 경우 담관암이 발생하지 않고 저 용량의 NDMA를 같이 투여해야 담관암이 발생하는 점은 기생충에 감염된 환자에서 담관암 발생과정에 외부에서 투여된 nitrosamine 등 발암 물질이 같이 작용함을 시사한다(Fig. 1). 실제로 매우 높은 담관암 유병률을 보이는 태국 일부 지방에서 섭취하는 발효 음식에 nitrosamine 등 N-nitroso 화합물이 들어 있고 이것이 발암물질로 작용하는 것으로 보고된다[34]. 태국과 일본의 담관암 환자 조직의 유전자 발현을 비교한 연구에서도 태국 환자들의 조직에서 xenobiotic 대사과정에 참여하는 유전자 발현이 증가되어 있어, 외부에서 들어온 nitrosamine 등 발암물질 제거를 위한 대사 과정이 증가되어 있음을 시사하고 간흡충 감염에서의 담관암 발생시 발암물질이 작용함을 뒷받침 한다[35].
외부에서 투여된 발암 물질 외에도 endogenous nitrosation 이 동물 모델과 사람에서 연구 되어 있다. 그 한 예로 간흡충에 의한 담관세포 손상이 염증유발 cytokine에 의해서 활성화된 면역세포에서 분비되는 nitric oxide에 의해서 유발될 수 있음이 햄스터 동물 모델에서 밝혀져 있으며[36,37], 사람에서도 간흡충에 대해 증가된 면역 반응이 endogenous nitrosation의 증가와 관련되어 있다고 보고 된다[38]. 그 외에도 간흡충에 감염된 환자들이 정상인에 비해 endogenous nitrosation 가능성이 높다는 여러 연구들이 보고되어 있으며[39,40], 정상인에 비해 proline과 thioproline의 nitrosation에 의해 증가된 혈중 또는 소변내의 nitrate와 nitrite 농도가 간흡충 치료제인 praziquantel과 함께 ascorbic acid, proline을 같이 복용하면 감소하는 것으로 알려져 있다[41]. 이렇게 endogenous 혹은 exogenous하게 투여된 nitrosamine은 만성염증이 동반된 조직 세포의 DNA의 alkylation과 deamination을 통한 손상을 초래하여 암 변이를 일으키는 것으로 여겨진다[2,7,42,43].
결 론
간흡충, 즉 O. viverrini와 C. sinensis는 group I carcinogen으로 분류되어 담관암 발생과 명백한 관련이 있다. 간흡충이 담관암을 일으키는 기전에 대해서는 암 발생까지의 긴 잠복기간, 기생충 감염 정도의 다양성, 발암 물질 등 다른 인자와의 상관관계 등으로 인해 연구에 상당한 어려움이 있으나 기생충 감염 부위의 만성적인 염증과 이로 인한 미세 환경의 변화 및 DNA 손상이 발암기전의 핵심적인 특징으로 알려진다. 빨판을 부착하고 영양분을 섭취하거나 다른 부위로 이동하는 기생충에 의한 담관 손상이 만성 염증을 유발하는 것으로 보이고 간흡충이 분비 또는 배설하는 대사 산물이 담관 손상, 면역 반응 및 염증 반응 등을 일으키며 담관 상피세포의 증식 촉진효과도 가지는 것으로 보인다. 숙주의 면역 반응은 발암기전과 매우 밀접한 관계를 가지는데 장기간의 기생충 감염이 숙주의 항암 면역 반응을 억제하고 Th1-Th2 균형을 Th2 반응 쪽으로 이동을 시켜 암세포에 대한 거부 반응의 억제를 가져 오는 것도 발암 기전과 관련이 있는 것으로 보인다. 또 증가된 면역반응에서 활성화된 면역세포에서 분비된 nitric oxide 등 free radical이 DNA 손상을 일으키는 것으로 보이며 외부에서 음식물로 투여된 nitrosamine 등 발암 물질도 담관암 발생에 중요한 역할을 하는 것으로 보인다.
바이러스나 박테리아 외에 기생충도 암 발생과 분명한 관련이 있으며 최근 들어 생활 환경의 개선으로 기생충 감염률이 비록 감소하고는 있으나 치명률이 높은 담관암 발생과 밀접한 관련을 가지는 간흡충과 이의 발암기전에 대해 관심이 필요하다. 기생충 감염 민물고기 생식을 금지하는 등 기생충 감염경로 차단을 통한 유병률 감소, 적절한 진단을 통한 기생충 박멸에 노력해야 함은 물론이고, 발암기전에 대한 자세한 연구를 통해 담관암의 조기 발견을 위한 표지자 개발, 항암 물질 개발 등에 노력을 가해야 할 것으로 보인다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






