서 론
위장관 간질종양(Gastrointestinal stromal tumors, GIST)은 면역조직학적으로 C-kit 양성인 간엽조직 기원의 종양으로서 모든 위장관 종양의 1% 미만의 비교적 드문 종양으로 위에 가장 흔하게 발생한다[1,2]. 종양의 크기와 세포분열지수에 따라 저 위험군과 고 위험군으로 분류할 수 있고, 이에 따라 재발률과 예후도 많은 차이가 있어 절제 가능한 위장관 간질 종양의 경우 전체 재발률은 17~24%까지 알려져 있으나[2] 저 위험군의 경우는 재발률이 극히 드문 것으로 보고되고 있다[3].
저자들은 8년 전 위의 저 위험도 위장관 간질종양을 진단받고 근치적 절제술을 시행받은 환자에서 간 우엽 전체를 차지하는 간 종괴로 내원하여 간에 국한된 위장관 간질 종양의 재발을 진단하였기에 보고하고자 한다.
증 례
환 자: 82세 여자
주 소: 복부 불편감
현병력: 약 1개월 전에 발생한 복부 불편감이 내원 1주일 전부터 악화되어 본원으로 전원되었다.
가족력 및 사회력: 특이 소견이 없었다.
과거력: 8년 전 위 저부의 4×3.5 cm 크기의 점막하 종양에 대하여 근치적 절제술을 시행받았고, 당시 조직학적 진단은 위장관 간질 종양이었고, 세포 분열 지수는 저 위험군에 해당하는 5/50 high power field 미만이었다.
이학적 검사: 내원시 생체 징후는 정상이었고, 외견상 만성 병색을 보였으나 전신 상태는 비교적 양호하였다. 복부진찰에서 우상복부에서 우하복부에 이르기까지 비대한 간이 촉지되었고, 약간의 압통이 동반되었지만 반발통은 없었다. 하지 진찰에서 경도의 하지 함요 부종이 관찰되었다.
검사실 소견: 내원 당시 시행한 말초 혈액 검사에서 백혈구 4,000/mm3, 혈색소 10.0 g/dL (MCV 86.5 fL, MCH 28.2 pg, MCHC 32.6 g/dL), 혈소판 333,000/mm3였고, 생화학 검사에 서 AST 42 IU/L, ALT 18 IU/L, ALP 314 IU/L, GGT 210 IU/L, LDH 735 IU/L, 총 단백 7.0 g/dL, 알부민 3.9 g/dL, 총 빌리루빈 0.7 mg/dL였다.
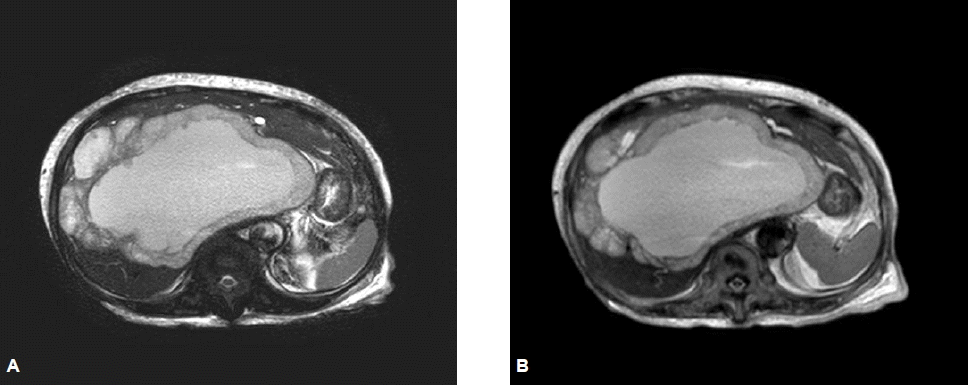
영상 검사 소견: 입원 후 시행한 복부 전산화 단층 촬영(그림 1)을 시행하였고, 간 우엽의 전체를 차지하는 18×14 cm 크기의 낭성 종괴 소견을 보였으며 낭성 종괴의 중심부는 저음영의 괴사성의 양상이었고, 낭성 종괴를 둘러싼 경계부는 조영제 주입 후 동맥기, 문맥기, 지연기에 조영 증강이 되고 특징적으로 동맥기에 비정상 혈관들이 관찰되었다. 특히 관상면에서는 간 종괴로 인한 하대정맥의 압박이 동반되어 있어 간 종괴가 하지 함요 부종의 원인임을 확인할 수 있었다. 간의 낭성 병변에 대한 감별 진단을 위해 간 자기 공명 영상 촬영(그림 2)을 시행하였고, T1 강조 영상에서 지연기에 경계부가 조영 증강되고 괴사가 의심되었던 중심부는 T1, T2모두에서 고신호 강도를 보이고 있어 중심부의 괴사와 함께 출혈이 동반되어 있을 가능성을 시사하는 소견이었다.
내시경 소견: 위장관의 다른 원발 병소의 동반 유무를 확인하기 위해 위 내시경과 대장 내시경을 시행하였으나 특이소견이 없었다.
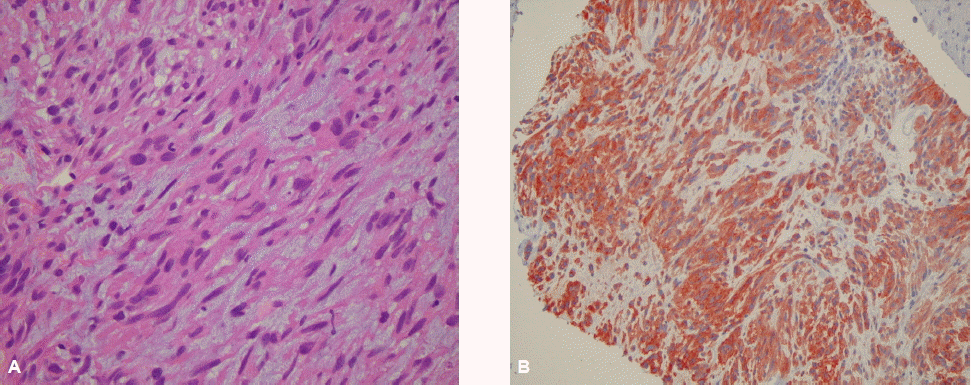
병리 조직학적 소견: 확진을 위해 간 조직 검사를 시행하였고, 조직학적 소견(그림 3)에서 방추형 세포들이 증식되어 격자형의 섬유 다발상을 이루었고, 면역 조직 화학 염색에서 c-kit과 CD34에서 양성이었다.
치료 및 경과: 환자는 위 저부의 원발 병소를 수술로 절제한 후 8년만에 간에 단독으로 재발한 위장관 간질 종양으로 최종 진단하게 되었고, 이에 치료를 권유하였으나 거부하고 외래에서 경과관찰 중이다.
고 찰
위장관 간질 종양(GIST)은 1790년대 이전에는 평활근에서 유래한 것으로 생각되어 평활근종, 평활근육종과 평활근모세포종 등으로 혼용되어 불리다가 전자 현미경 및 면역조직 화학 염색법이 발달하면서 1983년에 Mazur와 Clark이 처음으로 gastrointestinal stromal tumor라는 용어를 도입하였다[4].
위장관 간질 종양의 발생 연령은 평균 50~60세로 알려져 있으며 위장관의 어느 부위에서도 발생이 가능하지만 위에서 60~70%, 소장에서 20~25%, 대장과 직장에서 5%, 식도에서는 5% 미만으로 발생한다[5]. 본 증례에서 원발 병소는 위의 저부였다.
위장관 간질 종양의 임상양상은 종양의 크기와 위치, 궤양의 유무에 따라 매우 다양하여 출혈, 복통, 복부 종물, 오심, 구토, 체중 감소 등이 나타날 수 있으나, 무증상이거나 증상이 경미하여 진단 당시 이미 전이가 된 경우도 많다[6]. 본 증례에서도 환자는 8년간 아무런 증상 없이 지내오다가 간을 거의 차지하는 거대한 종물이 발생한 후에야 상 복부의 불편감으로 내원하게 되었다.
확진은 내강 내 돌출의 경우 중심부 생검을 통해 종종 확진이 가능하나, 대부분 수술 후 병리 조직학적으로 확진을 한다. 면역 조직 화학 염색에서 c-kit (CD117)는 95%, CD34는 60~70%, smooth muscle actin은 30~40%, S-100 단백은 5~10%, desmin or keratine은 5% 미만에서 양성을 보여 평활근종, 평활근육종 등의 다른 간엽 종양들과 구분된다[7].
복부 전산화 단층 촬영으로는 주위 장기로의 침범이나 국소 림프절의 전이 등을 통해 악성과 양성을 감별하고 종양의절제 가능성을 예측할 수 있다는 보고가 있다[8]. 복부 전산 화단층 촬영으로 거대한 간 종괴가 발견되었다 하더라도 가장 흔한 발생 부위는 위장관이므로 원발 병소를 찾기 위하여 상부 및 하부 장관에 대한 내시경 검사는 반드시 필요하다.
위장관 간질 종양의 적절한 치료 방법은 광범위한 절제연을 포함하여 완전 절제하는 것이고 국소 림프절 전이가 매우 드물기 때문에 위에 발생한 경우에는 일반적인 위 절제술 대신 쐐기 절제술을 시행하는 경우가 많다[9,10]. 위장관 간질 종양은 비교적 성장 속도가 늦고 원격 전이도 늦게 나타나므로 크기와 관계없이 적극적 절제를 하면 예후가 좋다[11].
악성 위장관 간질 종양은 발생 부위에 따라 유사 분열의 수가 다르다는 보고가 있어 절대적인 기준을 제시하지 못하지만 일반적으로 크기가 5 cm 이하이고, 유사 분열의 수가 5/50 HPF 이하를 양성으로, 유사 분열수가 5개 이하이지만 크기가 5 cm 이상이면 경계성, 크기에 상관없이 유사 분열수가 5개 이상이면 악성으로 분류하자는 주장이 받아들여지고 있다[12]. 하지만 종양의 크기가 2 cm 이하이고, 유사 분열수도 5개 이하인 종양에서도 종종 전이가 발견되는 경우도 있다. 임상적으로 위장관 간질 종양의 진행을 예측하기 어렵고 병리 학자들은 어떤 위장관 간질 종양도 진정한 양성으로 보기 어렵다고 생각하므로 근래에는 악성과 양성이라는 용어보다는 저 위험군과 고 위험군이라는 용어로 대치되고 있다. 종양의 악성도와 예후에 관련된 요소를 예측하기 위해 많은 연구가 꾸준히 이루어지고 있으나 아직까지 확실히 정립된 것은 없으며 예후인자로 종양의 크기 및 위치, 유사 분열의 수, 인접 장기 침범 여부, 원격 전이 여부, 점막 침윤 소견, 세포 밀집도, 종양 내 괴사 및 출혈의 유무, 세포의 이형성도, 상피양 세포 형태, c-kit 돌연변이 등이 중요한 지표로 여겨지며 그 중 종양의 크기와 유사분열 수가 가장 중요하다. 위장관 간질종양의 위험도 평가도 종양의 크기와 유사 분열의 수를 토대로 분류되었다[13].
위장관 간질 종양은 수술로 완전 절제한 경우에도 17~24%에서 재발한다고 보고되고 있으며 그 중 저 위험군의 재발은 극히 드문 것으로 알려져 있다[2,3]. 본 증례에서도 8년 전 위의 원발 위장관 간질 종양을 진단받았을 당시 종괴의 크기는 4 cm 정도였고, 유사분열수가 5/50 HPF 이하로 저위험군으로 판단되었고, 이에 따라 환자는 원발 병소에 대하여 쐐기 절제술을 받았으나 거대한 간 종괴로 재발하게 되었다.
본 증례는 위의 저 위험군 위장관 간질 종양을 수술적 절제 후 뒤늦게 간의 거대 종괴로 재발한 경우로 저 위험군 위장관 간질 종양이라 할 지라도 치료 후에 지속적인 추적관찰이 필요할 것으로 생각되며 아직까지 저 위험군 위장관 간질 종양 환자의 추적관리에 대한 확실한 진료 지침이 정립되어 있지 않아 이에 대한 전향적인 연구도 함께 있어야 하겠다[14].




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






