 |
 |
| Korean J Med > Volume 79(6); 2010 > Article |
|
요약
목적:
2010년 미국당뇨병협회에서 당뇨병의 진단기준으로 당화혈색소 6.5% 이상을 채택하였다. 새롭게 채택된 당화혈색소 6.5% 이상이라는 기준이 한국 성인에서 당뇨병 진단에 적용 가능한지 알아보고자 했다.
방법:
2000년 1월부터 2010년 1월까지 건양대학교병원에 방문한 환자 중 75 g 경구당부하검사 및 당화혈색소를 시행한 1,862명 중 급성 질환을 앓고 있는 환자, 혈색소가 10 g/dL 이하인 환자, 크레아티닌 2 mg/dL 이상인 환자, 경구 혈당강하제나 인슐린을 처방 받았던 환자, 임신한 환자를 제외한 1,474명을 대상으로 조사하였다.
Abstract
Background/Aims:
In 2010, the American Diabetes Association (ADA) adopted glycated hemoglobin (HbA1c) as a new diagnosticcriterion for diabetes mellitus. However, HbA1c values may differ among races. We determined whether this criterion couldbe applied to Korean diabetics.
Methods:
Between January 2000 and January 2010, 1,862 patients among Konyang University Hospital visitors in which the75 g oral glucose tolerance test (OGTT) and HbA1c were checked at the same time were enrolled. We excluded patients withacute disease, an Hb ≤ 10 g/dL, a Cr ≥ 2 mg/dL, those prescribed oral hypoglycemic agents or insulin, and those who were pregnant.
Results:
After applying the exclusion criteria, 1,474 Korean patients were enrolled. All had common features of Koreandiabetics for body mass index and homeostatic model assessment of insulin resistance values. Using the 0 and 120 minuteglucose levels of the OGTT from the receiver operating characteristic curve, the HbA1c cutoff value was 6.25%. The cutoffvalue to diagnose diabetes with the presence of diabetic retinopathy was 6.75%.
Conclusions:
Our study showed a difference between the HbA1c values for diagnosing diabetes and the new diagnostic criterionfrom the ADA. Considering that the HbA1c characteristics may be influenced by race or culture, larger studies on diabetes complicationsare needed to identify the appropriate HbA1c value for Korean diabetics. (Korean J Med 79:673-680, 2010)
최근 산업화 및 식단의 서구화가 진행되면서 체중 증가와 비만이 사회적 문제로 떠오르고 있으며 이에 따라 제2형 당뇨병의 유병률도 증가하고 있다. 국민건강통계 2008 1) 및 보건복지가족통계연보 2009 2)를 통하면 국내의 당뇨병 유병률이 2001년 8.6% (남자 9.0%, 여자 8.3%)에서 2007년 9.7% (남자 11.6%, 여자 7.8%)로 증가하고 있음을 알 수 있다.
제2형 당뇨병은 체내 인슐린의 부족과 말초조직의 인슐린 저항성의 증가로 인해 발병한다3). 인슐린 저항성이 증가되면서 체내 인슐린 요구량이 증가되고 인슐린 분비능이 필요량에 미치지 못하면 고혈당이 진행되고 고혈당에 의한 합병증이 발생된다4). 이러한 고혈당은 당뇨병이 진단되기 수년 전부터 진행되기 때문에 진단 당시 이미 합병증이 동반된 경우가 많다5-11).
내당능장애와 같은 전당뇨병에서 엄격한 혈당조절을 통해 당뇨병으로의 진행 및 합병증의 발현을 늦출 수 있다는 연구에서도12-14) 알 수 있듯이 당뇨병 및 전당뇨병을 조기에 발견하여 혈당조절을 시행하는 것이 중요하기에 당뇨병의 선별검사 및 진단법 역시 중요하다15).
2000년 1월부터 2010년 1월까지 건양대학교병원에 방문한 환자 중 75 g 경구당부하검사 및 당화혈색소를 시행한 1,862명의 차트를 조사하였다. 그 중 급성 질환을 앓고 있는 환자를 제외하였고, HbA1c의 값에 영향을 줄 수 있는 요소를 고려하여 빈혈(혈색소 10 g/dL 이하), 신장 기능의 이상(크레아티닌 2 mg/dL 이상), 경구당부하검사 시행 전 경구 혈당 강하제나 인슐린을 처방 받았던 자, 임신한 환자를 제외한 1,474명(남자 946명, 여자 528명, 평균나이 52.9±12.29)을 대상으로 하였다.
1,474명의 환자의 연령, 성별, 나이, 체질량지수, 혈색소, 크레아티닌, 당화혈색소, C-펩타이드, HOMA-IR, 당뇨병성 망막병증 유무를 차트를 통해 조사하였다. 체질량지수는 몸무게(kg)를 키의 제곱(m2)으로 나누어 계산하였고, HOMA-IR은 University of Oxford의 Diabetes Trials Unit Home page를 통한 HOMA calculator로 계산하였다.
모든 환자가 시행한 75 g 경구당부하 검사는 8시간 공복 상태에서 시행하였고, 75 g 포도당 용액을 먹기 직전 및 120분 후 혈액을 채취하여 바로 원심 분리하였으며 혈장 포도당 농도를 hexokinase method (AU5400 auto analyzer; Olympus, Tokyo, Japan)로 측정하였고, HbA1c는 high performance liquid chromatography (HLC-723G7; Tosoh, Tokyo, Japan)로 측정하였다. HbA1c 측정값은 NGSP에 의해 지정된 표준화된 calibrator set를 이용하여 보정하였고, 정도관리는 대한임상검사 정도관리협회로부터 정기적으로 받아왔으며 CV 값은 0.63~1.22%였다.
당대사 이상의 정의는 미국당뇨병협회(American Diabetes Association)에서 권고한 공복혈당 농도<100 mg/dL, 120분 혈당 농도<140 mg/dL인 경우를 정상, 공복혈당 농도≥126 mg/dL 또는 120분 혈당 농도≥200 mg/dL인 경우를 당뇨병으로 정의하였으며 그 사이의 공복혈당 및 120분 혈당 농도에 해당되는 경우를 전당뇨병으로 정의하였다.
전체 환자 1,474명 중 남자는 946명(64.2%), 여자는 528명(35.8%)이었으며, 전체 환자의 평균 연령은 52.9±12.29세였고, 남자는 51.4세, 여자는 55.6세였다. BMI는 남자 25.1±4.05 kg/m2, 여자 24.7±3.80 kg/m2, 공복 시 C-peptide는 남자 2.94±1.368 ng/mL, 여자 3.08±1.548 ng/mL였으며 혈색소는 14.2±1.64 g/dL, 크레아티닌은 0.93±0.185 mg/dL였다(표 1).
75 g 경구당부하검사를 시행한 결과상 정상은 116명이었으며, 전당뇨병 환자는 464명, 당뇨병 환자는 894명이었다. 전당뇨병 환자 464명 중 공복혈당장애만을 가진 환자는 168명, 내당장애만 가진 환자는 73명, 복합장애를 가진 환자는 223명이었다. 각각의 공복 시 혈당과 경구당부하검사 후 2시간 혈당은 정상군 91.0±6.71 mg/dL, 105.6±21.56 mg/dL, 공복혈당장애군 110.8±6.51 mg/dL, 114.3±17.18 mg/dL, 내당장애군 89.4±8.30 mg/dL, 165.1±16.63 mg/dL, 복합장애군 112.6±7.00 mg/dL, 168.8±18.14 mg/dL, 당뇨병군 145.8±45.13 mg/dL, 280.6±84.67 mg/dL였으며, HOMA-IR은 정상군 1.8±0.88, 공복혈당장애군 2.4±1.09, 내당장애군 1.9±1.23, 복합장애군 2.1±1.02, 당뇨병군 2.7±1.46이었다(표 2).
ROC curve를 통해 당뇨병 선별을 위한 당화혈색소의 값을 알아보고자 당뇨병 진단 기준 중 75 g 경구당부하검사상 공복혈당 126 mg/dL 이상에 해당하는 환자군을 분석하였을 때 cutoff value는 6.25% (민감도 64.9%, 특이도 73.6%)였고(그림 1), 120분 혈당 200 mg/dL 이상에 해당하는 환자군을 분석하였을 때 cutoff value는 6.25% (민감도 63.6%, 특이도 84.1%)였다(그림 2).
당뇨병 진단 기준인 75 g 경구당부하검사상 당뇨병이 진단된 환자군에서 당뇨병 선별 기준으로서 당화혈색소의 값을 분석한 결과 cutoff value는 6.25% (민감도 58.7%, 특이도 84.0%)였다(그림 3).
전체 환자 중 안과 진료를 통해 당뇨병성 망막병증 유무에 대해 진단 받은 616명의 환자를 조사하였고, 당화혈색소에 대한 ROC curve (AUC 0.814)를 분석하였다. 당뇨의 진단기준으로서 민감도가 85% 이상의 기준에 해당하는 당화혈색소는 6.75%였다(표 3).
당뇨병의 선별검사로 소변 당 검사, 공복 혈장 혈당 검사, 모세혈관 혈당 검사, 당화혈색소 및 프락토사민 검사 등이 있으며 진단법으로 공복 혈장 혈당 검사 및 경구당부하검사를 사용하고 있다24). 현재 사용 중인 당뇨병 진단기준은 1997년 미국당뇨병협회에서16) 권고하였으며 1999년 세계보건기구에서25) 인정한 것으로 공복 시 혈당 126 mg/dL 이상 또는 75 g 경구당 부하검사 2시간 혈당 200 mg/dL 이상 또는 당뇨병에 의한 전형적인 증상과 함께 무작위 혈당 200 mg/dL 이상 중 한 가지를 만족하면 되는 것이다. 많은 연구자들은 보다 효율적이며 손쉽게 당뇨병을 진단할 수 있는 방법을 찾아오던 중 당화혈색소에 관심을 기울였고, 당뇨병 진단에 당화혈색소의 적합한 값을 찾고자 하는 많은 연구들이 보고되었지만 국제 전문가 위원회 1997 (The International Expert Committee 1997)에서 당화혈색소는 전 세계적으로 공통된 측정법이 없으며 보정 기준이 없어 당뇨병 진단 기준으로 채택하지 않았다16).
이후 당화혈색소와 당뇨병에 의한 미세혈관합병증인 당뇨병성 망막병증 사이의 관계를 연구한 자료와18,19) 미국의 국립 당화혈색소 표준화 프로그램(National Glycohemoglobin Standardization Program, NGSP)과 같은 표준화 단계를 진행시켜26) 2010년 미국당뇨병협회에서 당화혈색소 6.5% 이상이라는 당뇨병 진단 기준을 채택하게 되었다17).
하지만 당화혈색소 값을 진단 기준으로 채택함에 있어 혈색소병, 임신여부, 만성신장 질환 등의 여러 제한점들이 있으며, 인종간의 차이 또한 중요한 제한점이다. Herman 등은 백인에 비해 흑인과 스페인계, 미국 인디언, 아시아인들의 당화혈색소가 높다는 결과를 보고하였고22), Davidson과 Schriger는 당뇨병이 진단되지 않은 비스페인계 흑인, 멕시코계 미국인과 비스페인계 백인의 당화혈색소 값 사이에 차이가 있었으며, 각각의 당화혈색소 값은 비스페인계 흑인, 멕시코계 미국인, 비스페인계 백인의 순이라 보고하였다27). Likhari와 Gama 역시 남아시아인의 당화혈색소 값이 백인에 비해 높았다 보고하였다23). 이는 당뇨병 유무를 떠나 당화혈색소 값 자체가 인종에 따라 차이가 있음을 예측할 수 있는 자료이며, 미국당뇨병협회에서 채택한 6.5%라는 기준도 인종 간의 차이에 대해 고려되어야 한다고 생각될 수 있다.
본 연구 대상자들의 혈색소나 크레아티닌은 정상 범위에 해당하여 당화혈색소의 값에 영향이 미치지 않았다. 또 다른 연구 대상자들의 특징을 보면 HOMA-IR은 높지 않았고, BMI는 남자 25.1 kg/m2, 여자 24.7 kg/m2으로 미국 성인보다 낮아 기존에 알려진 인슐린 저항성이 적고 비만하지 않은 한국인 당뇨병의 특징을 갖고 있음을 알 수 있다.
75 g 경구당부하검사를 통해 당뇨를 진단받은 환자군의 당화혈색소 cutoff value 및 공복혈당 126 mg/dL 이상의 조건에 해당하는 환자군의 당화혈색소 cutoff value, 120분 후 혈당 200 mg/dL 이상의 군에서 모두 6.25%였다. 이는 Bennett 등이 미국인과 영국인을 중심으로 조사한 2형 당뇨병 선별검사로서의 당화혈색소 cutoff value인 6.1~6.2%28)와 Buell 등이 1999~2004년의 미국 국민 건강 영양 조사(National Health and Nutrition Examination Survey)를 통해 조사한 공복 시 혈당 126 mg/dL 이상인 환자군의 당화혈색소 cutoff value인 5.8%보다29) 높은 값이었다. 이와 같이 당화혈색소 값 자체가 인종간의 차이를 보이듯, cutoff value 또한 인종 간의 차이를 보였다.
이미 보고된 국내의 발표에 의하면 당뇨병을 예측할 수 있는 당화혈색소의 cutoff value를 5.95%로 낮게 제시하였다30). 그러나 이 결과는 조사된 전체 환자 수는 비슷하지만 당뇨병 환자군의 수가 다른 조사들에 비해 작아 당화혈색소의 cutoff value가 낮아졌을 것으로 판단되며, 저자 또한 이러한 제한점을 기술하였다.
이와 같은 당화혈색소의 차이는 여러 원인으로 설명할 수 있으나 한국인과 서양인의 식습관이 이러한 차이를 설명할 수 있는 원인일 수 있다. 2008 국민건강통계에1) 따르면 하루 식품섭취량 중 탄수화물을 함유하고 있는 곡류가 286.5 g (22.08%)에 해당한 반면 2006 미국 국민건강영양조사에 의하면31) 하루 식사량 중 265 g의 탄수화물을 섭취하고 있어 한국인의 식후 혈당지수가 높을 수 있는 원인으로 추측할 수 있다. 또 다른 원인으로 식후 분비되는 인슐린 양의 차이를 생각할 수 있다. 윤 등은 췌장의 베타 세포량은 체질량지수와 비례하며 한국인 당뇨병 환자의 경우 베타 세포량이 감소되어 있다고 연구하였고32), 이를 통해 한국인의 췌장의 베타세포 용적이 서양인에 비해 적어 당뇨병 발생 과정 중 식사 후 발생하는 고혈당에 대한 인슐린의 양이 부족할 것이라 생각해 볼 수 있으며 이는 공복 시 혈당보다 식후 혈당 조절 정도에 더 민감한 당화혈색소에 반영되어 한국인의 당화혈색소 값이 서양인에 비해 높게 측정되는 원인이 될 수 있을 것이다. 또한 생각해 볼 수 있는 다른 원인으로 비효소적인 당화작용에 대한 감수성, 해당과정에서의 효소 활성도, 세포 내 A1c의 축적 정도가 있으며33), 문화 및 사회 경제적인 차이 등도 있을 것이다34).
물론 당뇨병 진단에 대한 당화혈색소의 cutoff value는 외국의 여러 논문에서 보고된 바와 같이 미국당뇨병학회에서 제시한 6.5%보다 낮다. 6.5%라는 값은 당뇨병 환자군의 당화혈색소 표준편차의 3배보다 낮은 범위에 해당하는 값으로 당뇨병에 의한 합병증인 망막병증의 유병률 및 진단 기준의 역할을 위해 높은 특이도를 고려하여 채택된 것이다.
본 연구에서도 당뇨병성 망막병증을 통해 당뇨병을 진단하기 위한 당화혈색소의 값을 구하였으며 진단 기준이라는 점을 고려하여 특이도 85%에 해당하는 값을 찾았고 6.75% (민감도 47.1%, 특이도 85.0%)로 6.5%보다 높은 값을 보였다. 이는 당화혈색소의 cutoff value가 높아 결국 당뇨병 진단에 사용되는 당화혈색소의 값도 증가된 것으로 생각하였다. 하지만 본 자료 조사상 1,474명의 전체 환자 중 안과 진료를 받은 616명의 환자군을 대상으로만 분석하였고, 차트 내 정보가 부족하여 진단 기준으로서의 당화혈색소 값에 오차가 있을 것이라 생각되며 이는 연구의 제한점일 것이다.
결론적으로 저자들은 본 연구를 통해 진단법으로서 특이도가 중요하게 고려된 당화혈색소는 본 연구에서도 6.5%에 해당하는 민감도 약 50%, 특이도 약 89%를 보였듯 6.5% 미만에서도 많은 수의 당뇨병 환자가 존재하는 부족한 점이 있어 아직 단독적인 당뇨병 진단 기준이 되기보다 기존의 진단 방법과 더불어 더 효율적인 진단을 내릴 수 있는 수단일 것이고, 또한 6.5%라는 기준보다 인종 간의 차이를 고려한 한국인에게 적합한 값을 찾기 위해 당뇨병의 합병증에관한 대규모 연구를 진행하여 진단 기준으로서의 당화혈색소 값을 조사해야 할 이유를 제시해 본다.
REFERENCES
1. Ministry of Health and Welfare: 국민건강통계 2008. Avail from: http://www.e-welfare.go.kr/wp/data/sta/view-Sta02Info.laf? content_id=208813&rn=35&path=/wfisc/wp/inf/sta/02/html&findword=&sub_class1=&search_div=¤tPage=31&search1=
2. Ministry of Health and Welfare: 국민건강통계 2009. Avail from: http://www.mw.go.kr/front/jb/sjb0501vw.jsp?PAR_MENU_ID=03&MENU_ID=030501&page=4&BOARD_ID=320&BOARD_FLAG=&CONT_SEQ=224933&SEARCHKEY=&SEARCHVALUE=&SCH_SILKUK_ID=&SCH_DEPT_ID=
3. Alvin CP. Diabetes Mellitus. In: Fauci AS, Braunwald E, Kasper DL, Hauser SL, Dan L, Longo L, Jameson L, Loscalzo L, eds. Harrison’s principles of internal medicine. 17th ed. p. 2275–2304. New York: McGraw-Hill companies, 2008.
4. Kahn SE. Clinical review 135: the importance of beta-cell failure in the development and progression of type 2 diabetes. J ClinEndocrinol Metab 86:4047–4058, 2001.


5. Wang WQ, Ip TP, Lam KS. Changing prevalence of retinopathy in newly diagnosed non-insulin dependent diabetes mellitus patients in Hong Kong. Diabetes Res Clin Pract 39:185–191, 1998.


6. Harris MI, Klein R, Cowie CC, Rowland M, Byrd-Holt DD. Is the risk of diabetic retinopathy greater in non-Hispanic blacks and Mexican Americans than in non-hispanic whites with type 2 diabetes?: a U.S. population study. Diabetes Care 21:1230–1235, 1998.


7. Rajala U, Laakso M, Qiao Q, Keinänen-Kiukaanniemi S. Prevalence of retinopathy in people with diabetes, impaired glucose tolerance, and normal glucose tolerance. Diabetes Care 21:1664–1669, 1998.


8. Kohner EM, Aldington SJ, Stratton IM, Manley SE, Holman RR, Matthews DR, Turner RC. United Kingdom prospective diabetes study, 30: diabetic retinopathy at diagnosis of non-insulindependent diabetes mellitus and associated risk factors. Arch Ophthalmol 116:297–303, 1998.


9. Harris MI, Klein R, Welborn TA, Knuiman MW. Onset of NIDDM occurs at least 4-7 yr before clinical diagnosis. Diabetes Care 15:815–819, 1992.


10. Ballard DJ, Humphrey LL, Melton LJ 3rd, Frohnert PP, Chu PC, O’Fallon WM, Palumbo PJ. Epidemiology of persistent proteinuria in type II diabetes mellitus: population-based study in Rochester, Minnesota. Diabetes 37:405–412, 1988.


12. Knowler WC, Barrett-Connor E, Fowler SE, Hamman RF, Lachin JM, Walker EA, Nathan DM. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 346:393–403, 2002.



13. Tuomilehto J, Lindström J, Eriksson JG, Valle TT, Hämäläinen H, Ilanne-Parikka P, Keinänen-Kiukaanniemi S, Laakso M, Louheranta A, Rastas M, Salminen V, Uusitupa M. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med 344:1343–1350, 2001.


14. Pan XR, Li GW, Hu YH, Wang JX, Yang WY, An ZX, Hu ZX, Lin J, Xiao JZ, Cao HB, Liu PA, Jiang XG, Jiang YY, Wang JP, Zheng H, Zhang H, Bennett PH, Howard BV. Effects of diet and exercise in preventing NIDDM in people with impaired glucose tolerance: the Da Qing IGT and diabetes study. Diabetes Care 20:537–544, 1997.


16. Committee on the Diagnosis and Classification of Diabetes Mellitus. Report of the expert committee on the diagnosis and classification of diabetes mellitus. Diabetes Care 20:1183–1197, 1997.
17. American diabetes association. Diagnosis and classification of diabetes mellitus. Diabetes Care 33(Suppl 1):S62–S69, 2010.
18. Van Leiden HA, Dekker JM, Moll AC, Nijpels G, Heine RJ, Bouter LM, Stehouwer CD, Polak BC. Risk factors for incident retinopathy in a diabetic and nondiabetic population: the Hoorn study. Arch Ophthalmol 121:245–251, 2003.


19. Tapp RJ, Tikellis G, Wong TY, Harper CA, Zimmet PZ, Shaw JE. Longitudinal association of glucose metabolism with retinopathy: result from the Australian diabetes obesity and lifestyle (AusDiab) study. Diabetes Care 31:1349–1354, 2008.



20. DCCT Research Group. The association between glycemic exposure and longterm diabetes complications in the Diabetes Control and Complications Trial. Diabetes 44:968–983, 1995.
21. Stratton IM, Adler AI, Neil HA, Matthews DR, Manley SE, Cull CA, Hadden D, Turner RC, Holman RR. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ 321:405–412, 2000.



22. Herman WH, Ma Y, Uwaifo G, Haffner S, Kahn SE, Horton ES, Lachin JM, Montez MG, Brenneman T, Barrett-Connor E. Differences in A1C by race and ethnicity among patients with impaired glucose tolerance in the diabetes prevention program. Diabetes Care 30:2453–2457, 2007.



23. Likhari T, Gama R. Glycaemia-independent ethnic differences in HbA(1c) in subjects with impaired glucose tolerance. Diabet Med 26:1068–1069, 2009.


24. World health Oragnization. Screening for type 2 diabetes: report of a WHO and international diabetes federation meeting. Geneva: World Health Organization, 2003.
25. World health Oragnization. Definition, diagnosis and classification of diabetes mellitus and its complications: report of a WHO consultation: part 1. diagnosis and classification of diabetes mellitus Geneva: World health Organization; 1999.
26. Little RR, Rohlfing CL, Wiedmeyer HM, Myers GL, Sacks DB, Goldstein DE. The national glycohemoglobin standardization program: a five year progress report. Clin Chem 47:1985–1992, 2001.

27. Davidson MB, Schriger DL. Effect of age and race/ethnicity on HbA1c levels in people without known diabetes mellitus: implications for the diagnosis of diabetes. Diabetes Res Clin Pract 87:415–421, 2010.


28. Bennett CM, Guo M, Dharmage SC. HbA(1c) as a screening tool for detection of Type 2 diabetes: a systemic review. Diabet Med 24:333–343, 2007.


29. Buell C, Kermah D, Davidson MB. Utility of A1C for diabetes screening in the 1999-2004 NHANES population. Diabetes Care 30:2233–2235, 2007.


30. 배지철, 박철영, 오기원, 박성우, 김지훈, 이원영, 김선우, 최은숙, 이은정, 김원준, 박세은, 유승현. 서울의 한 대학병원에서 당뇨병을 예측하는 당화혈색소 값의 분석. Korean Diabetes J 33:503–510, 2009.

31. Centers for Disease Control and Prevention. National Health and Nutrition Examination Survey 2005-2006. Avail from:http://www.cdc.gov/nchs/nhanes/nhanes2005-2006/nhanes05_06.htm
32. Yoon KH, Ko SH, Cho JH, Lee JM, Ahn YB, Song KH, Yoo SJ, Kang MI, Cha BY, Lee KW, Son HY, Kang SK, Kim HS, Lee IK, Bonner-Weir S. Selective beta-cell loss and alpha-cell expansion in patients with type 2 diabetes mellitus in Korea. J Clin Endocrinol Metab 88:2300–2308, 2003.


Receiver operating characteristic curves for corresponding glycated hemoglobin (HbA1c) values of a fasting glucose above 126 mg/dL (AUC=0.753).
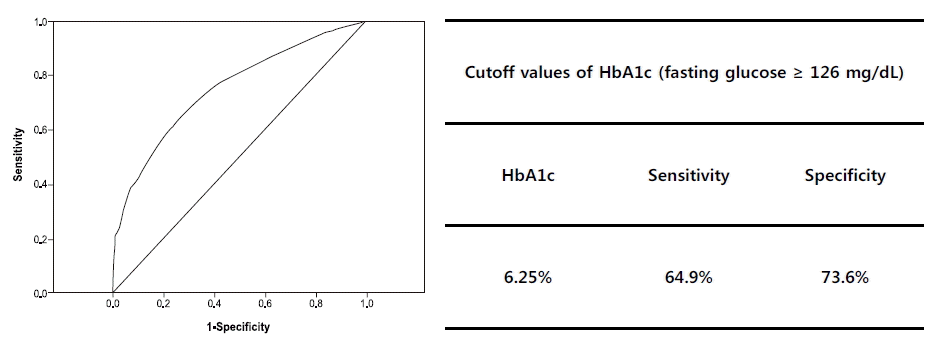
Figure 1.
Receiver operating characteristic curves for corresponding glycated hemoglobin (HbA1c) values of a 120 min glucose above 200 mg/dL (AUC=0.798).
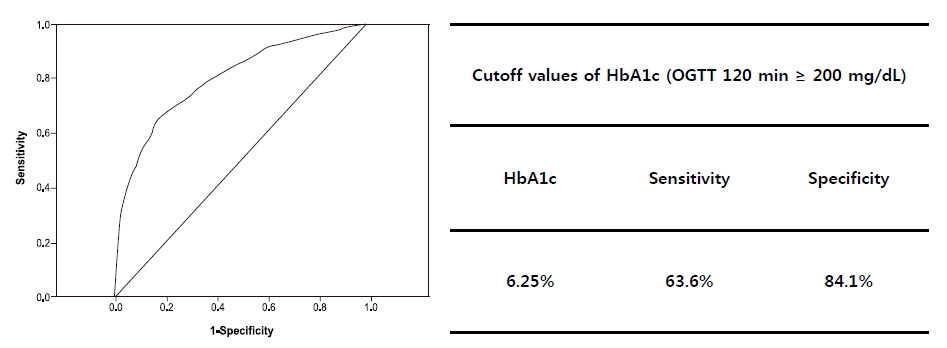
Figure 2.
Receiver operating characteristic curves for glycated hemoglobin (HbA1c) values corresponding to diagnosed diabetes defined by American Diabetes Association criteria (AUC=0.770).
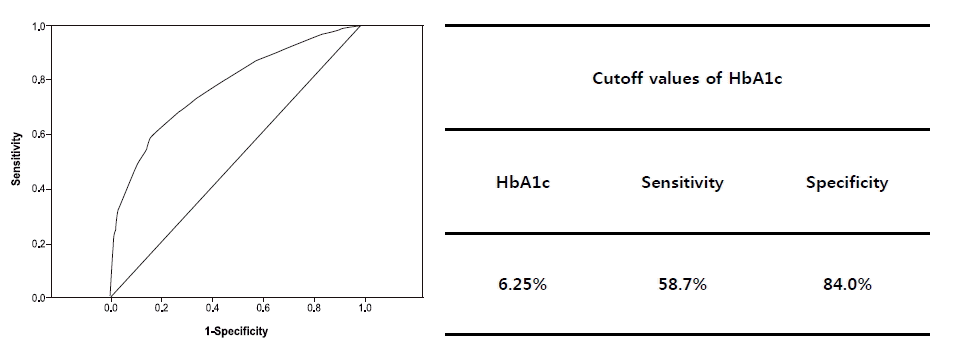
Figure 3.
Table 1.
Clinical characteristics of the subjects
Table 2.
Distribution of subjects according to glucose tolerance status group
|
Normal (n=116) |
Prediabetes (n=464) |
Diabetes (n=894) |
p-value* | |||
|---|---|---|---|---|---|---|
|
I‐IFG (n=168) |
I‐IGT (n=73) |
Combined (n=223) |
||||
| Fasting glucose (mg/dL) | 91.0 ±6.71 | 110.8 ±6.51† | 89.4 ±8.30 | 112.6 ±7.00† | 145.8 ±45.13 | <0.05 |
| 2 hr glucose (mg/dL) | 105.6 ±21.56 | 114.3 ±17.18 | 165.1 ±16.63‡ | 168.8 ±18.14‡ | 280.6 ±84.67 | <0.05 |
| HOMA‐IR | 1.8 ±0.88 | 2.4 ±1.09§ | 1.9 ±1.23∥ | 2.1 ±1.02∥ | 2.7 ±1.46§ | <0.05 |
Table 3.
Glycated hemoglobin (HbA1c) cutoff values from the receiver operating characteristic curves for HbA1c corresponding to diagnosed diabetic retinopathy (AUC=0.814, n=616)
| HbA1c cutoff values (diabetic retinopathy) | ||
|---|---|---|
| HbA1c | Sensitivity | Specificity |
| 6.65% | 52.9% | 84.3% |
| 6.75% | 47.1% | 85.0% |
| 6.85% | 41.2% | 85.8% |
- TOOLS
-
 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link XML Download
XML Download Full text via DOI
Full text via DOI-
 Download Citation
Download Citation
 Print
Print-
Share :








