 |
 |
| Korean J Med > Volume 97(5); 2022 > Article |
|
Abstract
The rate of detection of thyroid nodules and carcinomas has increased with the widespread use of ultrasonography (US), which is the primary imaging modality for the detection and risk stratification of thyroid nodules. The appropriate diagnosis and management of these patients is based on the risk factors related to the patients as well as the thyroid nodules. The Korean Society of Thyroid Radiology (KSThR) published consensus recommendations for US-based management of thyroid nodules in 2011 and revised them in 2016. These guidelines have been used as the standard guidelines in Korea. However, recent advances in the diagnosis and management of thyroid nodules have necessitated the revision of the original recommendations. The task force of the KSThR has revised the Korean Thyroid Imaging Reporting and Data System and recommendations for US lexicon, biopsy criteria, US criteria of extrathyroidal extension, optimal thyroid computed tomography protocol, and US follow-up of thyroid nodules before and after biopsy. The biopsy criteria were revised to reduce unnecessary biopsies for benign nodules while maintaining an appropriate sensitivity for the detection of malignant tumors. The goal of these recommendations is to provide the optimal scientific evidence and expert opinion consensus regarding US-based diagnosis and management of thyroid nodules.
Ļ░æņāüņäĀ Ļ▓░ņĀłņØĆ ņĀä ņäĖĻ│äņĀüņ£╝ļĪ£ ĒØöĒĢ£ ņ¦łĒÖśņ£╝ļĪ£, ņ┤ēņ¦ä ņŗ£ 4-8%, ņ┤łņØīĒīī(ultrasonography, US)ņŚÉņä£ 17-67%, Ļ▓ĮļČĆ ņ╗┤Ēō©Ēä░ļŗ©ņĖĄņ┤¼ņśü(computed tomography, CT) Ēś╣ņØĆ ņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāü(magnetic resonance imaging, MRI)ņŚÉņä£ 16-17%, ņ¢æņĀäņ×Éļ░®ņé¼ļŗ©ņĖĄņ┤¼ņśü(positron emission tomography, PET)ņŚÉņä£ 1-2%, ļČĆĻ▓Ć ņŗ£ 50%ņØś ļ╣łļÅäņŚÉņä£ ļ░£Ļ▓¼ļÉ£ļŗż[1-3]. Ļ░æņāüņäĀ Ļ▓░ņĀł ļīĆļČĆļČäņØĆ ņ¢æņä▒Ļ▓░ņĀłņØ┤ņ¦Ćļ¦ī ņĢĮ 5-15%ļŖö ņĢģņä▒Ļ▓░ņĀłņØ┤ļ®░, ļŗżņ¢æĒĢ£ ņ£ĀņĀäņĀü ĒÖśĻ▓ĮņĀü ņÜöņØĖ ļ░Å ņØśļŻī ĻĖ░ĻĖ░ņØś ļ░£ļŗ¼, Ļ▒┤Ļ░ĢĻ▓Ćņ¦ä ĒöäļĪ£ĻĘĖļשņØś ļ│┤ĻĖē ļō▒ņ£╝ļĪ£ ņĀä ņäĖĻ│äņĀüņ£╝ļĪ£ Ļ░æņāüņäĀņĢö ļ░£ņāØņØĆ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ”ØĻ░Ć ņČöņäĖņŚÉ ņ׳ļŗż.
Ļ░æņāüņäĀ Ļ▓░ņĀłņØś ņ¦äļŗ©ņØĆ ņ┤łņØīĒīī Ļ▓Ćņé¼ņÖĆ ņĪ░ņ¦ü Ļ▓Ćņé¼ņŚÉ ņØśĒĢ┤ ņØ┤ļŻ©ņ¢┤ņ¦äļŗż. ņ┤łņØīĒīī Ļ▓Ćņé¼ļŖö Ļ░æņāüņäĀ Ļ▓░ņĀłņØä ĒÅēĻ░ĆĒĢśļŖö Ļ░Ćņן ĻĖ░ļ│ĖņĀüņØĖ Ļ▓Ćņé¼ņØ┤ļ®░ Ļ░æņāüņäĀ Ļ▓░ņĀłņØś ļ░£Ļ▓¼ļ┐É ņĢäļŗłļØ╝ Ļ▓░ņĀłņØś ņĢö ņ£äĒŚśļÅä ļČäļźś ļ░Å ņ┤łņØīĒīīņ£ĀļÅä ņĪ░ņ¦ü Ļ▓Ćņé¼ņÖĆ ņ┤łņØīĒīīņ£ĀļÅä ļ╣äņłśņłĀņĀü ņ╣śļŻīņŚÉ ņé¼ņÜ®ļÉ£ļŗż. ņØ┤ņŚÉ ļīĆĒĢ£Ļ░æņāüņäĀņśüņāüņØśĒĢÖĒÜīņŚÉņä£ļŖö 2011ļģäņŚÉ ņ▓śņØīņ£╝ļĪ£ Ļ░æņāüņäĀ Ļ▓░ņĀłņŚÉ ļīĆĒĢ£ ĻČīĻ│ĀņĢłņØä ņČ£Ļ░äĒĢśņŚ¼ ņ¢æņä▒Ļ│╝ ņĢģņä▒ņ┤łņØīĒīī ņåīĻ▓¼ņØä ņĀĢņØśĒĢśņśĆĻ│Ā, ĻĘĖņŚÉ ļö░ļźĖ ņĪ░ņ¦ü Ļ▓Ćņé¼ņØś ņĀüņØæņ”ØņØä ņĀ£ņĢłĒĢśņśĆļŗż[4]. ņŚ¼ļ¤¼ ĒĢ┤ ļÅÖņĢł ņČĢņĀüļÉ£ ļģ╝ļ¼ĖņØä ĻĖ░ļ░śņ£╝ļĪ£ 2016ļģä Ļ░£ņĀĢĒīÉ[5]ņØä ņČ£Ļ░äĒĢśņśĆĻ│Ā, ĻĄŁļé┤ņÖĖ Ļ░æņāüņäĀ ņ¦äļŻīņØś Ēæ£ņżĆ ņ¦Ćņ╣©ņØ┤ ļÉśņŚłļŗż.
2016 ĻČīĻ│ĀņĢłņØ┤ ļŗżļźĖ ļéśļØ╝ ņ¦äļŻīĻČīĻ│ĀņĢłĻ│╝ ļ╣äĻĄÉĒĢĀ ļĢī ļ¬ć Ļ░Ćņ¦Ć ņ░©ņØ┤ņĀÉ(ļåÆņØĆ ļČłĒĢäņÜöĒĢ£ ņĪ░ņ¦ü Ļ▓Ćņé¼ņ£©)ņØ┤ ļ░£Ļ▓¼ļÉśņŚłĻ│Ā ĻĘĖļÅÖņĢł ņČĢņĀüļÉ£ ņŚ░ĻĄ¼ņÖĆ ņÜ░ļ”¼ļéśļØ╝ 22Ļ░£ ĻĖ░Ļ┤Ć 27ļ¬ģņØś ļīĆĒĢ£Ļ░æņāüņäĀĒĢÖĒÜī ĒÜīņøÉļōżņØ┤ ņ░ĖņŚ¼ĒĢ£ ļŹ░ņØ┤Ēä░ļ▓ĀņØ┤ņŖżļź╝ ĻĄ¼ņČĢĒĢśņŚ¼ ņØ┤ļź╝ ĻĖ░ņ┤łļĪ£ Ļ░£ņĀĢĒĢ£ ĻČīĻ│ĀņĢł(2021 K-TIRADS) [6]ņØä ļ¦łļĀ©ĒĢśņśĆļŗż. Ļ░£ņĀĢļÉ£ 2021ļģä ņ¦äļŻī ĻČīĻ│ĀņĢłņŚÉņä£ļŖö 1) ĻĘĖļÅÖņĢł ņé¼ņÜ®ĒĢśņśĆļŹś ņÜ®ņ¢┤ļź╝ Ļ░äļŗ©ĒĢśĻ│Ā ļ¬ģļŻīĒĢśĻ▓ī ņĀĢļ”¼ĒĢśņśĆņ£╝ļ®░ (ņ┤łņØīĒīīĒæ£ņżĆņÜ®ņ¢┤ Ļ░£ņĀĢ), 2) ļČłĒĢäņÜöĒĢ£ ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ņżäņØ┤ĻĖ░ ņ£äĒĢ┤ ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ĒĢ┤ņĢ╝ ĒĢśļŖö Ļ▓░ņĀłņØś Ēü¼ĻĖ░ļź╝ ņĪ░ņĀĢ, 3) Ļ▓░ņĀłņØś Ļ░æņāüņäĀ ņÖĖļČĆņ╣©ļ▓ö(extrathyroidal extension)ņØś ņ┤łņØīĒīī ņåīĻ▓¼ņØä ļ¬ģņŗ£, 4) ņĪ░ņ¦ü Ļ▓Ćņé¼ĒĢśņ¦Ć ņĢŖņØĆ Ļ▓░ņĀłņØś ņČöņĀü Ļ┤Ćņ░░ ĻĖ░Ļ░äņØä ļ¬ģņŗ£, 5) CT ņ┤¼ņśü ļ░®ļ▓ĢņØä ļ¬ģņŗ£ĒĢśņśĆļŗż. Ļ░æņāüņäĀ Ļ▓░ņĀłņØä ņ¦äļŻīĒĢśļŖö ņØśļŻīņ¦äļōżņØĆ 2016 ĻČīĻ│ĀņĢłņŚÉ ņØĄņłÖĒĢ┤ ņ׳ņ¢┤ņä£ 2016ļģä ĻČīĻ│ĀņĢłņØä ĻĖ░ņżĆņ£╝ļĪ£ 2021 ĻČīĻ│ĀņĢłņŚÉņä£ ļ│ĆĒÖöļÉ£ Ļ▓āņØä ņżæņŗ¼ņ£╝ļĪ£ ņäżļ¬ģĒĢśļĀżĻ│Ā ĒĢ£ļŗż. ņ┤łņØīĒīīņØś ņØ╝ļČĆ ĒŖ╣ņ¦ĢņĀüņØĖ ņåīĻ▓¼ņØĆ ĒĢ£ĻĖĆ ņØśĒĢÖņÜ®ņ¢┤ļĪ£ ņ×æņä▒ĒĢśļŖö Ļ▓āņŚÉ ņ¢┤ļĀżņøĆņØ┤ ņ׳ņ¢┤ ņśüņ¢┤ļĪ£ Ēæ£ĻĖ░ĒĢśņśĆļŗż.
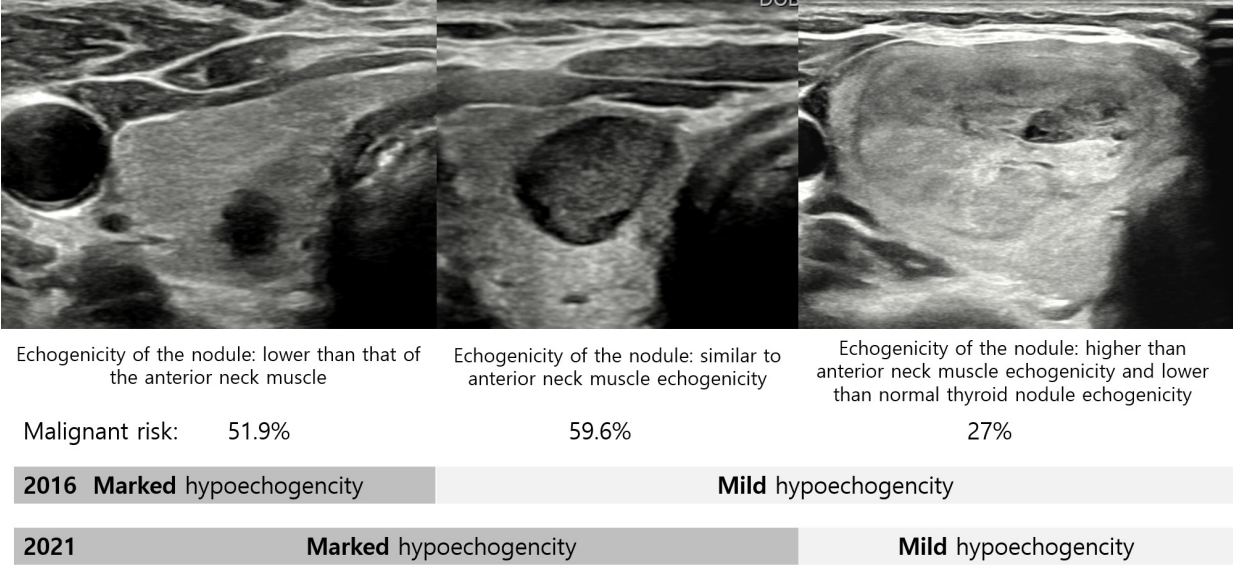
Ļ░æņāüņäĀ Ļ▓░ņĀłņØ┤ ņĢģņä▒ Ēś╣ņØĆ ņ¢æņä▒ņØĖņ¦Ć ņČöņĀĢĒĢĀ ņłś ņ׳ļŖö Ļ░æņāüņäĀ Ļ▓░ņĀłņØś ņ┤łņØīĒīī ņåīĻ▓¼ņØä 5Ļ░£ņØś ņ┤łņØīĒīīĒæ£ņżĆņÜ®ņ¢┤(lexicon)ļĪ£ ņĀĢņØśĒĢśņśĆļŗż. ņ”ē, ņĪ░ņ¦üĻĄ¼ņä▒(composition), ņŚÉņĮöņ¢æņāü(echogencity), ļ░®Ē¢źņä▒(orientation), ļ│ĆņŚ░(margin), echogenic foci (ņäØĒÜīĒÖö)ņØ┤ļŗż(Table 1).
ņĪ░ņ¦üĻĄ¼ņä▒ņØĆ Ļ│ĀĒśĢ(solid), ļīĆļČĆļČä Ļ│ĀĒśĢ(predominantly solid), ļīĆļČĆļČä ļéŁņä▒(predominantly cystic), ļéŁņä▒(cystic), ņŖżĒÄĆņ¦Ć ļ¬©ņ¢æ(spongiform)ņ£╝ļĪ£ ļČäļźśĒĢśņśĆĻ│Ā 2016ļģäĻ│╝ ļ│ĆĒÖöĻ░Ć ņŚåļŗż.
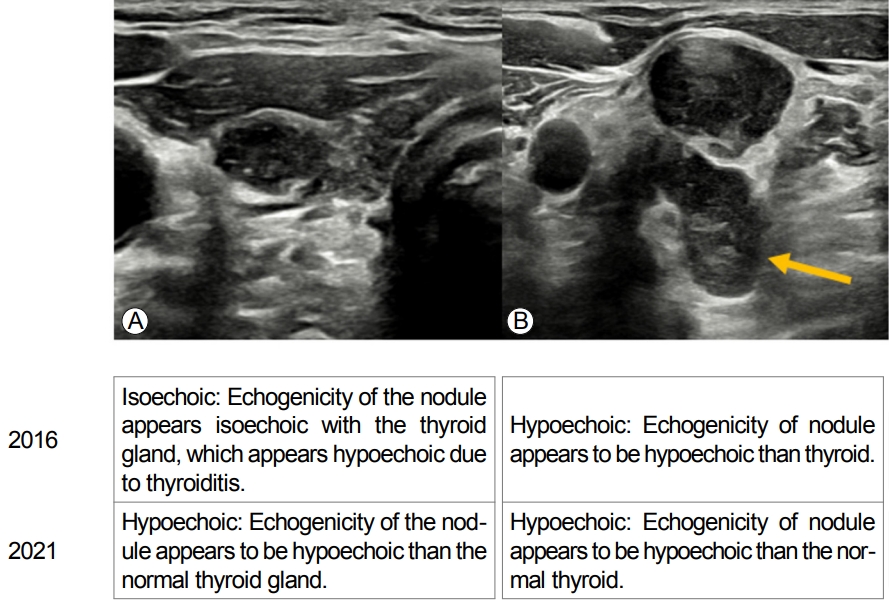
Ļ▓░ņĀłņØś ņŚÉņĮöņ¢æņāüņØĆ ļÜ£ļĀĘĒĢ£ ņĀĆņŚÉņĮöņ¢æņāü(marked hypoechogenicity), ņĢĮĻ░äņĀĆņŚÉņĮöņ¢æņāü(mild hypoechogenicity), ļō▒ņŚÉņĮöņ¢æņāü(isoechogenicity), Ļ│ĀņŚÉņĮöņ¢æņāü(hyperechogenicity) 4Ļ░£ļĪ£ ļČäļźśĒĢśļŖö Ļ▓āņØĆ ļ│ĆĒĢ©ņØ┤ ņŚåņ¦Ćļ¦ī ņŚÉņĮöņ¢æņāüņØä ĒīÉļŗ©ĒĢśļŖö ĻĖ░ņżĆņØ┤ ļ│ĆĒĢśņśĆļŗż. ņ”ē, 2016 ĻČīĻ│ĀņĢłņŚÉņä£ļŖö ļ¬® ņĢ×ņ¬Į ĻĘ╝ņ£Īļ│┤ļŗż ļé«ņØĆ ņŚÉņĮöņ¢æņāüņØä ļ│┤ņØĖ Ļ▓ĮņÜ░ļź╝ ļÜ£ļĀĘĒĢ£ ņĀĆņŚÉņĮöņ¢æņāüņØ┤ļØ╝Ļ│Ā ĒĢśņśĆņ¦Ćļ¦ī 2021 ĻČīĻ│ĀņĢłņŚÉņä£ļŖö ļ¬® ņĢ×ņ¬Į ĻĘ╝ņ£Īļ│┤ļŗż ļé«Ļ▒░ļéś Ļ░ÖņØĆ Ļ▓ĮņÜ░ņŚÉ ļÜ£ļĀĘĒĢ£ ņĀĆņŚÉņĮöņ¢æņāüņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż. ļśÉĒĢ£ 2016 ĻČīĻ│ĀņĢłņŚÉņä£ļŖö ņĢĮĻ░ä, ļō▒, Ļ│Ā-ņŚÉņĮöņ¢æņāüņØä ĒīÉļŗ©ĒĢśļŖö ĻĖ░ņżĆņØ┤ Ļ░æņāüņäĀņŗżņ¦łņØ┤ņśĆņ¦Ćļ¦ī 2021 ĻČīĻ│ĀņĢłņŚÉņä£ļŖö ņÜ░ļ”¼Ļ░Ć ņĢīĻ│Ā ņ׳ļŖö ņĀĢņāü Ļ░æņāüņäĀņŗżņ¦ł ņŚÉņĮöņ¢æņāü(normal thyroid parenchyma echogenicity)ņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż(Fig. 1). ņ”ē Ļ░æņāüņäĀņŚ╝ņØ┤ ņ׳ļŖö Ļ░æņāüņäĀņŚÉ ņĀĆņŚÉņĮö Ļ▓░ņĀłņØ┤ ņ׳ņØä Ļ▓ĮņÜ░ņŚÉ Ļ░æņāüņäĀņŚ╝ņ£╝ļĪ£ ņØĖĒĢ┤ Ļ░æņāüņäĀņØ┤ ņĀĆņŚÉņĮöņ¢æņāüņ£╝ļĪ£ ļ│┤ņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ ĻĘĖ Ļ▓░ņĀłņØĆ 2016 ĻČīĻ│ĀņĢłņŚÉ ļö░ļź┤ļ®┤ ļō▒ņŚÉņĮö Ļ▓░ņĀłņØ┤ ļÉśĻ│Ā 2021 ĻČīĻ│ĀņĢłņŚÉ ļö░ļź┤ļ®┤ ņĀĆņŚÉņĮö Ļ▓░ņĀłņØ┤ ļÉ£ļŗż(Fig. 2). ĻĘĖļ¤¼ļ»ĆļĪ£ 2021 ĻČīĻ│ĀņĢłņŚÉņä£ļŖö ņÜ░ļ”¼Ļ░Ć ņśłņĖĪĒĢśļŖö ņĀĢņāü Ļ░æņāüņäĀ ņŚÉņĮöņ¢æņāüņØä ĻĖ░ņżĆņ£╝ļĪ£ ĒĢśņśĆļŗż.
ļśÉĒĢ£ Ļ▓░ņĀłņØś ņŚÉņĮöņ¢æņāüņØ┤ ļ¬® ņĢ×ņ¬Į ĻĘ╝ņ£Ī ņŚÉņĮöņ¢æņāüļ│┤ļŗż ļé«Ļ▒░ļéś ļ╣äņŖĘĒĢ£ Ļ▓ĮņÜ░ņŚÉ Ļ▓░ņĀłņØś ņĢģņä▒ ņ£äĒŚśļÅäĻ░Ć ļ╣äņŖĘĒĢśļ»ĆļĪ£ ļæśņØä ĒĢśļéśļĪ£ ļ¼Čņ¢┤ ļÜ£ļĀĘĒĢ£ ņĀĆņŚÉņĮöņ¢æņāüņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż[7].
ļ░®Ē¢źņä▒(orientation)ņØĆ ĒÅēĒ¢ē(parallel)Ļ│╝ ļ╣äĒÅēĒ¢ē(nonparallel)ļĪ£ ļéśļłäļŖö Ļ▓āņØĆ ļ│ĆĒĢ©ņØ┤ ņŚåņ£╝ļéś 2016 ĻČīĻ│ĀņĢłņŚÉņä£ļŖö ļ╣äĒÅēĒ¢ēĻ▓░ņĀłņØĆ Ļ░ĆļĪ£ļ®┤(transverse) Ēś╣ņØĆ ņäĖļĪ£ļ®┤ ņśüņāü(longitudinal image) ņżæ ņ¢┤ļŖÉ ĒĢ£ Ļ││ņŚÉņä£ ļ│┤ņØ┤ļŖö ņåīĻ▓¼ņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆņ£╝ļéś 2021 ĻČīĻ│ĀņĢłņŚÉņä£ļŖö Ļ░ĆļĪ£ļ®┤ņŚÉņä£ļ¦ī ĒÅēĻ░ĆĒĢśĻĖ░ļĪ£ ņĀĢņØśĒĢśņśĆļŗż. ĻĘĖ ņØ┤ņ£ĀļŖö 1) Ļ░ĆļĪ£ļ®┤ņŚÉņä£ļ¦ī ĒÅēĻ░ĆĒĢśļŖö Ļ▓āĻ│╝ Ļ░ĆļĪ£ļ®┤ Ēś╣ņØĆ ņäĖļĪ£ļ®┤ņŚÉņä£ ĒÅēĻ░ĆĒĢśļŖö Ļ▓ā(risk stratification system, RSS)ņŚÉ ņ░©ņØ┤Ļ░Ć ņŚåĻ│Ā, 2) Ļ░ĆļĪ£ļ®┤ņØ┤ Ļ░äļŗ©ĒĢśĻ│Ā, 3) ĻĘĖļ¤¼ļ»ĆļĪ£ Ļ┤Ćņ░░ņ×É Ļ░ä ņØ╝ņ╣śļÅä(less interobserver variability) Ļ░Ć ļåÆĻĖ░ ļĢīļ¼ĖņØ┤ļŗż[8].
ļ╣äĒÅēĒ¢ē ļ░®Ē¢źņä▒(taller-than-wide shape)ņØĆ ņĢö Ļ░ĆļŖźņä▒ņØ┤ ļåÆņØĆ ņåīĻ▓¼ņØ┤ņ¦Ćļ¦ī(ļÅģļ”ĮņĀü ņĢö ņśłņĖĪņØĖņ×É, ļ»╝Ļ░Éņä▒: 15.2-53.0%; ĒŖ╣ņØ┤ļÅä: 88.2-98.7%; ņ¢æņä▒ņśłņĖĪņ╣ś: 47.3-77.5%), ļČĆļČä ļéŁņä▒ Ēś╣ņØĆ ļō▒/Ļ│ĀņŚÉņĮö Ļ▓░ņĀł(10.5-31.3%)ņŚÉņä£ļ│┤ļŗżļŖö Ļ│ĀĒśĢ ņĀĆņŚÉņĮö Ļ▓░ņĀł(77.0-87.7%)ņŚÉņä£ ņĢö Ļ░ĆļŖźņä▒ņØ┤ ļŹö ļåÆļŗż.
ļ│ĆņŚ░(margin)ņØĆ 2016 ĻČīĻ│ĀņĢłņŚÉņä£ļŖö ļ¦żļüłĒĢ£(smooth), ņ╣©ņāü/ļ»ĖņäĖņåīņŚĮņāü(spiculated/microlobulated), ļČłļČäļ¬ģĒĢ£(ill-defined) ļ│ĆņŚ░ņ£╝ļĪ£ ļéśļłäņŚłĻ│Ā 2021 ĻČīĻ│ĀņĢłņŚÉņä£ļŖö ļ¦żļüłĒĢ£, ļČłĻĘ£ņ╣ÖņĀüņØĖ(irregular), ļČłļČäļ¬ģĒĢ£ņ£╝ļĪ£ ļéśļłäņŚłļŖöļŹ░ Ļ░ü ļ¬ģņ╣ŁņØś ņĀĢņØśļŖö Ļ░Öņ£╝ļéś ņÜ®ņ¢┤ļ¦ī ņ╣©ņāü/ļ»ĖņäĖņåīņŚĮņāü ļ│ĆņŚ░ņØä ļČłĻĘ£ņ╣Ö ļ│ĆņŚ░ņ£╝ļĪ£ ĒåĄņØ╝ĒĢśņśĆļŗż.
ļ¦żļüłĒĢ£ Ēś╣ņØĆ ļČłļČäļ¬ģĒĢ£ ļ│ĆņŚ░ ņåīĻ▓¼ņØĆ ņĢģņä▒ Ļ░ĆļŖźņä▒ņØ┤ ļåÆņ¦Ć ņĢŖņ¦Ćļ¦ī ļČłĻĘ£ņ╣ÖĒĢ£ ļ│ĆņŚ░ņØĆ ņĢģņä▒ Ļ░ĆļŖźņä▒ņØ┤ ļåÆļŗż(ļ»╝Ļ░ÉļÅä: 29.0-71.4%; ĒŖ╣ņØ┤ļÅä: 87.1-98.6%; ņ¢æņä▒ņśłņĖĪņ╣ś: 32.1-86.7%). ļČłĻĘ£ņ╣ÖĒĢ£ ļ│ĆņŚ░ ņåīĻ▓¼ņØĆ ļČĆļČä ļéŁņä▒ Ēś╣ņØĆ ļō▒/Ļ│ĀņŚÉņĮö Ļ▓░ņĀł(47.8-88.9%)Ļ│╝ ļ╣äĻĄÉņŗ£ Ļ│ĀĒśĢ ņĀĆņŚÉņĮö Ļ▓░ņĀł(80.0-86.6%)ņŚÉņä£ ņĢĮĻ░ä ļåÆĻ▒░ļéś ļ╣äņŖĘĒĢśļŗż. ņ”ē Ļ▓░ņĀłņØś ļČłĻĘ£ņ╣Ö ļ│ĆņŚ░ņØĆ Ļ▓░ņĀłņØś ņĪ░ņ¦üĻĄ¼ņä▒(composition)Ļ│╝ ņŚÉņĮöņ¢æņāüņŚÉ ņāüĻ┤ĆņŚåņØ┤ ņĢö Ļ░ĆļŖźņä▒ņØ┤ ļåÆļŗż.
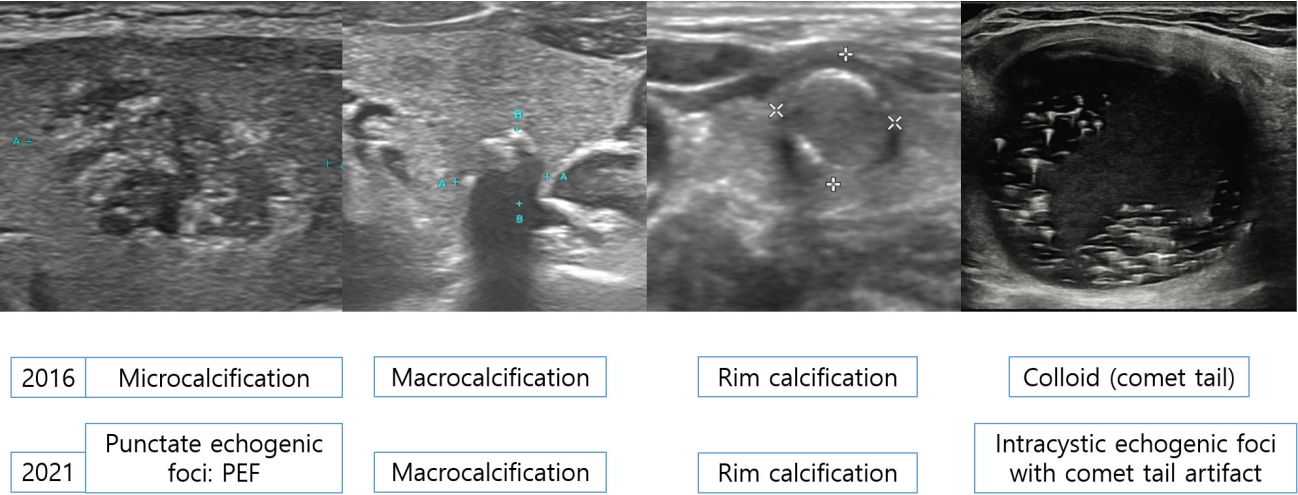
Echogenic fociļŖö ņĀĢņāü Ļ░æņāüņäĀĻ│╝ Ļ▓░ņĀłļ│┤ļŗż ļåÆņØĆ ņŚÉņĮöņ¢æņāüņØä ļ│┤ņØ┤ļŖö ņ×æņØĆ ļČĆļČäņØä ļ¦ÉĒĢ£ļŗż. ņØ┤ļŖö 4Ļ░£ļĪ£ ļéśļēśļŖöļŹ░ 1) punctate echogenic foci (PEF), ļ»ĖņäĖņäØĒÜīĒÖö(microcalcification), Ōēż 1 mm), 2) Ļ▒░ļīĆņäØĒÜīĒÖö(macrocalcification) (> 1 mm), 3) Ļ░Ćņןņ×Éļ”¼ ņäØĒÜīĒÖö(rim calcification), 4) intracystic echogenic foci with comet-tail artifactņØ┤ļŗż(Table 2, Fig. 3).
Ļ▓░ņĀłņŚÉņä£ ļ│┤ņØĖ PEFļź╝ 2016 ĻČīĻ│ĀņĢłņŚÉņä£ļŖö ļ»ĖņäĖņäØĒÜīĒÖö(microcalcification)ļĪ£ ņ╣ŁĒĢśņśĆņ£╝ļéś ņŚ¼ļ¤¼ ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ ļåŹņČĢļÉ£ ņĮ£ļĪ£ņØ┤ļō£, ļ¬©ļלņóģ(psammomatous) Ēś╣ņØĆ Ļ▒░ņ╣£ ļ»ĖņäĖņäØĒÜīĒÖö ļ¬©ļæÉĻ░Ć Ļ│ĀņŚÉņĮö ņ┤łņĀÉņ£╝ļĪ£ ļ│┤ņØ┤Ļ│Ā ĻĄ¼ļ│äņØ┤ ņēĮņ¦Ć ņĢŖņĢäņä£ ņäØĒÜīĒÖöļ│┤ļŗżļŖö PEFļĪ£ ņĀĢņØśĒĢśņśĆļŗż. PEFļŖö ļ│┤ĒåĄ Ļ░æņāüņäĀņ£ĀļæÉņĢöņŚÉņä£ ļ░£Ļ▓¼ļÉśļŖö ļ¬©ļלņóģ ņäØĒÜīĒÖöņØä Ļ░Ćļ”¼ĒéżĻ│Ā ņĢģņä▒Ļ▓░ņĀłņŚÉ ļīĆĒĢ£ ļÅģļ”ĮņĀüņØĖ ņĢö ņśłņĖĪņØĖņ×É(ņśłļ»╝ļÅä: 36.9-59.6%; ĒŖ╣ņØ┤ļÅä: 78.6-94.6%; ņ¢æņä▒ņśłņĖĪņ╣ś: 25.8-68.3%)ņØ┤ņ¦Ćļ¦ī, ļō£ļ¼╝Ļ▓ī ņ¢æņä▒Ļ▓░ņĀłņŚÉņä£ļÅä ļ░£Ļ▓¼ļÉ£ļŗż. PEFņØ┤ ļČĆļČä ļéŁņä▒, ļō▒/Ļ│ĀņŚÉņĮö Ļ▓░ņĀł(11.6-25.9%)ņŚÉņä£ ļ░£Ļ▓¼ļÉśļŖö Ļ▓āļ│┤ļŗż ņĀĆņŚÉņĮö Ļ│ĀĒśĢ Ļ▓░ņĀł(60.7-81.3%)ņŚÉņä£ ļ░£Ļ▓¼ļÉśņŚłņØä Ļ▓ĮņÜ░ņŚÉ ņĢģņä▒ ņśłņĖĪļÅäĻ░Ć ļåÆļŗż. Intracystic echogenic foci with comet-tail artifactļŖö ņ¢æņä▒Ļ▓░ņĀłņØś ņĮ£ļĪ£ņØ┤ļō£ņ×äņØ┤ ļ¬ģļ░▒ĒĢśļŗż. ĻĘĖļ¤¼ļéś intrasolid echogenic foci with comet-tail artifactļŖö ļåŹņČĢļÉ£ ņĮ£ļĪ£ņØ┤ļō£ņØĖņ¦Ć Ēś╣ņØĆ Ļ░æņāüņäĀņ£ĀļæÉņĢöņŚÉņä£ ļ│┤ņØĖ ļ¬©ļלņóģ ņäØĒÜīĒÖöņØĖņ¦Ć ļ¬ģĒÖĢĒĢśņ¦Ć ņĢŖļŗż. 1 mmļ│┤ļŗż Ēü░ echogenic foci with posterior shadowingļź╝ Ļ▒░ļīĆņäØĒÜīĒÖöļØ╝Ļ│Ā ņĀĢņØśĒĢśļŖöļŹ░ ņØ┤ ņżæ ņÖäņĀäņäØĒÜīĒÖö Ļ▓░ņĀłņØś ņĢģņä▒ņ£äĒŚśļÅäļŖö ņĢĮ 18.4-23.3%ņØ┤ļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ 2021 ĻČīĻ│ĀņĢłņŚÉņä£ļŖö ņÖäņĀäņäØĒÜīĒÖö Ļ▓░ņĀłņØĆ K-TIRADS 4ļĪ£ ļČäļźśĒĢśņśĆļŗż.
ņóģņ¢æņØś Ļ░æņāüņäĀņÖĖļČĆ ņ╣©ļ▓öņØĆ ļČäĒÖöĻ░æņāüņäĀņĢöņØś ņĢĮ 11.5-30%ņŚÉņä£ ļ░£ņāØĒĢśļ®░, Ļ▓ĮļČĆ ņ×¼ļ░£Ļ│╝ ņ¦łļ│æļ│ä ņé¼ļ¦ØļźĀ(disease specific mortality) ņØä ņ”ØĻ░Ćņŗ£Ēé©ļŗż. ņ×æņØĆ(minor) ETEļŖö Ļ░æņāüņäĀ Ēö╝ļ¦ēņØä ņ╣©ļ▓öĒĢ£ Ļ▓āņ£╝ļĪ£ ļ│æļ”¼ Ļ▓Ćņé¼ ņāü ļ│┤ņØ┤ļŖö ņåīĻ▓¼ņ£╝ļĪ£ T stageņŚÉ ņśüĒ¢źņØä ņŻ╝ņ¦Ć ņĢŖņ¦Ćļ¦ī, ņ£ĪņĢłņ£╝ļĪ£ ļ│┤ņØ┤ļŖö(gross) ETEļŖö ņłśņłĀ ņĀä Ēś╣ņØĆ ņłśņłĀ ņŗ£ņŚÉ ļ░£Ļ▓¼ļÉśļŖö ņåīĻ▓¼ņ£╝ļĪ£ T3b ļØĀĻĘ╝ņ£Ī(strap muscle) ņ╣©ļ▓ö, T4(ņŻ╝ņÜö Ļ▓ĮļČĆĻĄ¼ņĪ░ļ¼╝ ņ╣©ļ▓ö)ļĪ£ ļČäļźśļÉ£ļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ ņłśņłĀ ņĀä Ļ░æņāüņäĀņĢö ļ│æĻĖ░ Ļ▓Ćņé¼(staging)ļź╝ ņ£äĒĢ┤ ņ┤łņØīĒīī Ļ▓Ćņé¼ļĪ£ ņ×æņØĆ ETEņÖĆ ņ£ĪņĢłņ£╝ļĪ£ ļ│┤ņØ┤ļŖö(gross) ETEļź╝ ĒÅēĻ░ĆĒĢśļŖö Ļ▓āņØĆ ļ¦żņÜ░ ņżæņÜöĒĢśļŗż.
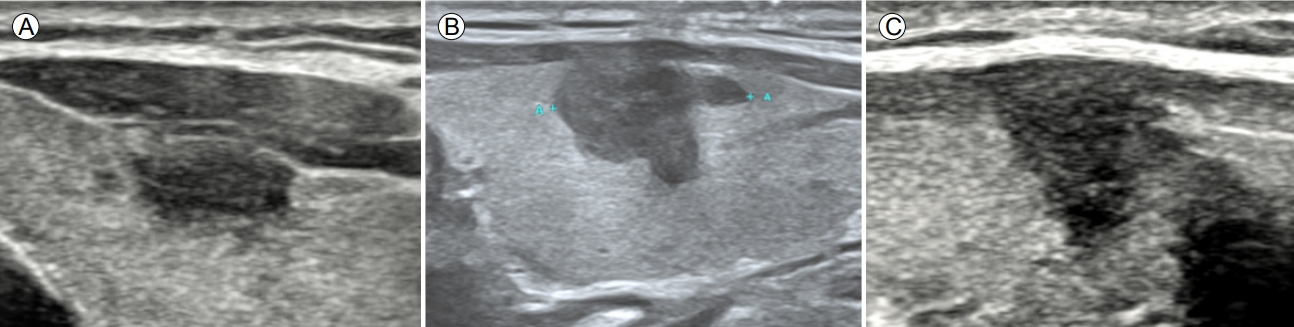
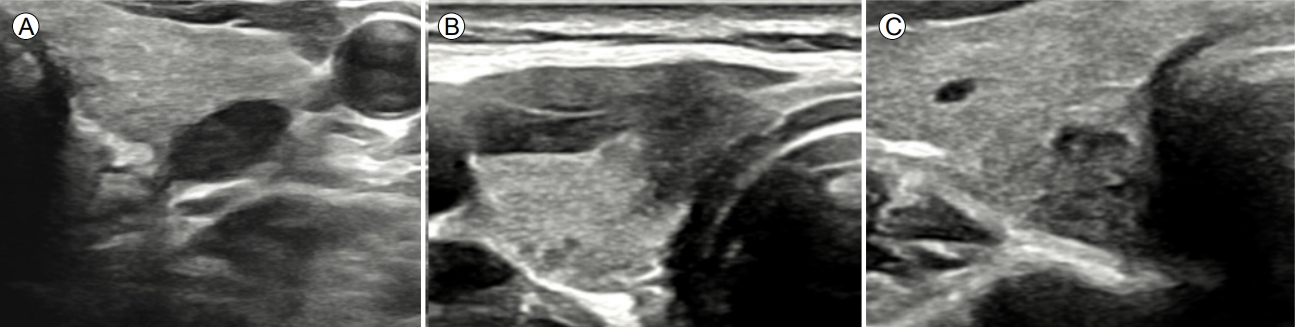
Ļ░æņāüņäĀĒö╝ļ¦ēĻ│╝ ņĀæĒĢ┤ ņ׳ļŖö ņĢģņä▒Ļ▓░ņĀłņØś ETEļź╝ ņśłņĖĪĒĢśļŖö ņ┤łņØīĒīī ņåīĻ▓¼ņ£╝ļĪ£ļŖö Ļ░æņāüņäĀĒö╝ļ¦ēĻ│╝ ņØĖņĀæ(abutment), Ēö╝ļ¦ē ĒīīņŚ┤(disruption), ļÅīņČ£(protrusion), ĻĘĖļ”¼Ļ│Ā ļØĀĻĘ╝ņ£Ī(strap muscle) ņ╣©ļ▓ö(replacement of strap muscles)ņØ┤ ņ׳ļŗż(Table 3, Fig. 4). Ļ░æņāüņäĀĒö╝ļ¦ē ņØĖņĀæņØĆ ņĢģņä▒Ļ▓░ņĀłĻ│╝ Ļ░æņāüņäĀĒö╝ļ¦ē ņé¼ņØ┤ņŚÉ ņĀĢņāü Ļ░æņāüņäĀņĪ░ņ¦üņØ┤ ļ│┤ņØ┤ņ¦Ć ņĢŖļŖö Ļ▓āņØ┤Ļ│Ā, Ēö╝ļ¦ēĒīīņŚ┤ņØĆ ņĢģņä▒Ļ▓░ņĀłņØ┤ ņĀæĒĢśĻ│Ā ņ׳ļŖö Ļ░æņāüņäĀņØä ņŗĖĻ│Ā ņ׳ļŖö ņŚÉņĮöņäĀņØ┤ ņŚåņ¢┤ņ¦ĆļŖö Ļ▓āņØ┤ļŗż. Ļ░æņāüņäĀĒö╝ļ¦ē ļÅīņČ£ņØĆ Ēö╝ļ¦ēĒīīņŚ┤ ņŚ¼ļČĆņÖĆ ņāüĻ┤ĆņŚåņØ┤ ņĢģņä▒Ļ▓░ņĀłņØ┤ Ļ░æņāüņäĀ ņŻ╝ņ£ä ĻĄ¼ņĪ░ļ¼╝ļĪ£ ļČłļŻ®ĒĢśĻ▓ī ĒŖĆņ¢┤ļéśņś© Ļ▓ā(bulging)ņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż. Ļ░æņāüņäĀņĢöņØ┤ ļØĀĻĘ╝ņ£Ī(strap muscle)ņØä ņ╣©ļ▓öĒĢśļŖö ņåīĻ▓¼(replacement of the strap muscle by thyroid cancer)ņØĆ Ļ▓░ņĀłņØ┤ ļØĀĻĘ╝ņ£Ī(strap muscle)ņ£╝ļĪ£ ļČłļŻ®ĒĢśĻ▓ī ĒŖĆņ¢┤ ļéśĻ░ĆĻ│Ā(protrusion) ļØĀĻĘ╝ņ£Ī(strap muscle)Ļ│╝ņØś Ļ▓ĮĻ│äĻ░Ć ļČłļČäļ¬ģĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĀĢņØśĒĢśņśĆļŗż.
Ļ░æņāüņäĀņØś ņĀäņÖĖņĖĪĒö╝ļ¦ēņĖĪņŚÉņä£ ņ×æņØĆ ETEļź╝ ņśłņĖĪĒĢĀ ņłś ņ׳ļŖö ņåīĻ▓¼ņØĆ Ēö╝ļ¦ēĒīīņŚ┤(ņśłļ»╝ļÅä: 61.6%; ĒŖ╣ņØ┤ļÅä: 87.1%; ņ¢æņä▒ņśłņĖĪņ╣ś: 58.5%; ņØīņä▒ņśłņĖĪņ╣ś: 88.5%; ņĀĢĒÖĢļÅä: 81.3%)ņØ┤Ļ│Ā, ļØĀĻĘ╝ņ£Ī(strap muscle)ņØä ņ╣©ļ▓öĒĢśļŖö ņ£ĪņĢłņ£╝ļĪ£ ļ│┤ņØ┤ļŖö(gross) ETEļź╝ ņśłņĖĪĒĢĀ ņłś ņ׳ļŖö ņåīĻ▓¼ņØĆ ļØĀĻĘ╝ņ£Ī(strap muscle) ņ╣©ļ▓ö ņåīĻ▓¼(replacement of strap muscle) (ņśłļ»╝ļÅä: 45.4%; ĒŖ╣ņØ┤ļÅä: 99.1%; ņ¢æņä▒ņśłņĖĪņ╣ś: 75.9%; ņØīņä▒ņśłņĖĪņ╣ś: 96.7%; ņĀĢĒÖĢļÅä: 96.0%)ņØ┤ļŗż. ĒøäņĖĪ Ļ░æņāüņäĀ ņŚ░ņĪ░ņ¦üņŚÉ Ļ▓Įļ»ĖĒĢ£ ETEļź╝ ņŗ£ņé¼ĒĢśļŖö ņ┤łņØīĒīī ņåīĻ▓¼ņØĆ ĒÖĢļ”ĮļÉśņ¦Ć ņĢŖņĢśļŗż. ĻĘĖļ¤¼ļéś ņĢģņä▒Ļ▓░ņĀłņØ┤ Ļ░æņāüņäĀ Ēøäļ░®Ļ▓ĮĻ│ä(expected margin) ļź╝ ļäśņ¢┤ ļÅīņČ£ļÉ£ Ļ▓ĮņÜ░ Ēøäļ░® ņ×æņØĆ(minor) ETEņØś Ļ░ĆļŖźņä▒ņØä Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢ£ļŗż.
ņĢģņä▒Ļ▓░ņĀłņØ┤ ĻĖ░ļÅäļź╝ ņ╣©ļ▓öĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö ņēĮĻ▓ī ņ¦äļŗ©ĒĢĀ ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņĢģņä▒Ļ▓░ņĀłņØ┤ ĻĖ░ļÅäņÖĆ ņĀæĒĢ┤ ņ׳ļŗżļ®┤ ņ¦äļŗ©ņØĆ ņ¢┤ļĀĄĻ▓ī ļÉ£ļŗż. ņØ┤ļ¤░ Ļ▓ĮņÜ░ņŚÉļŖö ņĢģņä▒Ļ▓░ņĀłĻ│╝ ĻĖ░ļÅäĻ░Ć ņØ┤ļŻ©ļŖö Ļ░üļÅäņŚÉ ļö░ļØ╝ ĻĖ░ļÅä ņ╣©ļ▓öņØä ņśłņĖĪĒĢĀ ņłś ņ׳ļŗż. ņ”ē, ņĢģņä▒Ļ▓░ņĀłĻ│╝ ĻĖ░ļÅäĻ░Ć ļæöĻ░üņØä ņØ┤ļŻ¼ Ļ▓ĮņÜ░ņŚÉļŖö ĻĖ░ļÅä ņ╣©ļ▓öĻ░ĆļŖźņä▒ņØ┤ ļåÆļŗż(ņśłļ»╝ļÅä: 85.7%; ĒŖ╣ņØ┤ļÅä: 98.9%; ņ¢æņä▒ņśłņĖĪņ╣ś: 40.0%; ņØīņä▒ņśłņĖĪņ╣ś: 99.9%; ņĀĢĒÖĢļÅä: 98.8%). ņ£ĀļæÉĻ░æņāüņäĀ ļ»ĖņäĖņĢö(papillary thyroid microcarcinoma)ņØĖ Ļ▓ĮņÜ░ņŚÉļÅä ļ¦łņ░¼Ļ░Ćņ¦ĆņØ┤ļŗż. ļÉśļÅīņØ┤ĒøäļæÉņŗĀĻ▓Į(recurrent laryngeal nerve) ņ╣©ļ▓öņØä ņśłņĖĪĒĢśļŖö ņåīĻ▓¼ņØĆ 1) ņĢģņä▒Ļ▓░ņĀłĻ│╝ ĻĖ░Ļ┤ĆņŗØļÅäĻ│Āļ×æ(tracheoesophageal groove) ņé¼ņØ┤ņŚÉ ņĀĢņāü Ļ░æņāüņäĀ ņĪ░ņ¦üņØ┤ ņŚåĻ▒░ļéś, 2) ņĢģņä▒Ļ▓░ņĀłņØ┤ ĻĖ░Ļ┤ĆņŗØļÅäĻ│Āļ×æņ£╝ļĪ£ ĒŖĆņ¢┤ļéśņÖĆ ņ׳ļŖö Ļ▓ĮņÜ░(protrusion) (ņśłļ»╝ļÅä: 83.3%; ĒŖ╣ņØ┤ļÅä: 96.5%; ņ¢æņä▒ņśłņĖĪņ╣ś PPV: 25.6%; ņØīņä▒ņśłņĖĪņ╣ś: 99.8%; ņĀĢĒÖĢļÅä: 96.3%)ņØ┤ļŗż(Fig. 5). ĻĘĖļ¤¼ļéś ETEļź╝ ņśłņĖĪĒĢśļŖö ņ┤łņØīĒīī ņåīĻ▓¼ņŚÉ ļīĆĒĢ£ ļģ╝ļ×ĆņØ┤ ļé©ņĢä ņ׳ļŗż. ņĢ×ņ£╝ļĪ£ ļŹö ļ¦ÄņØĆ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż.
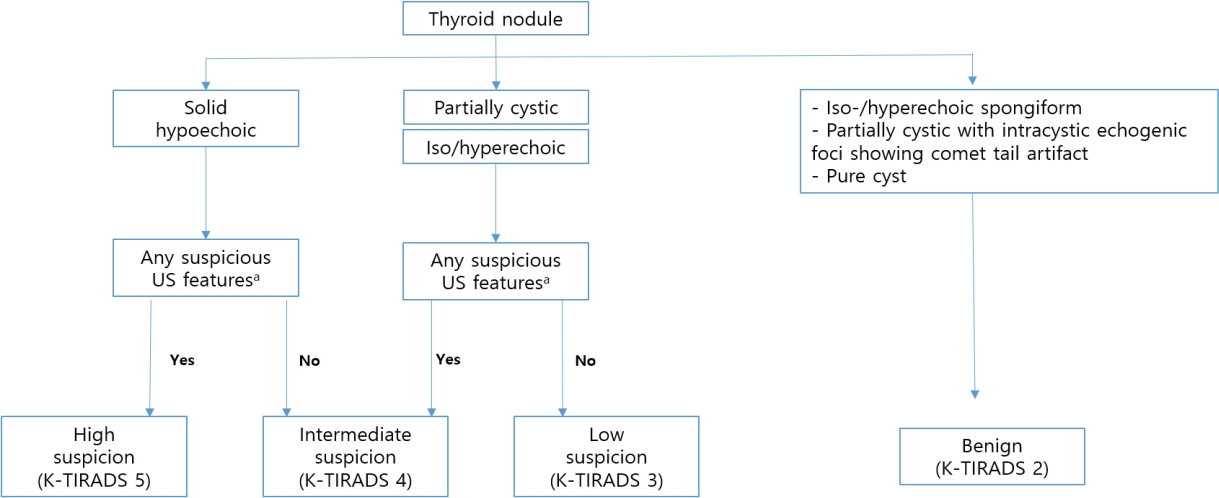
2021 K-TIRADS ĻČīĻ│ĀņĢłļÅä 2016 ĻČīĻ│ĀņĢłņ▓śļ¤╝ ņĪ░ņ¦üĻĄ¼ņä▒(composition), ņŚÉņĮöņ¢æņāü(echogencity), ņĢģņä▒ ņØśņŗ¼ ņ┤łņØīĒīī ņåīĻ▓¼ņØä ņĪ░ĒĢ®ĒĢśņŚ¼ Ļ▓░ņĀłņØś ņĢģņä▒ļÅäļź╝ ļéśļłäļŖö Ēī©Ēä┤ ĻĖ░ļ░ś ņŗ£ņŖżĒģ£ņØ┤ļŗż(Fig. 6). ņĢģņä▒Ļ▓░ņĀłņØä ņŗ£ņé¼ĒĢśļŖö ņ┤łņØīĒīī ņåīĻ▓¼ņØĆ punctate echogenic foci (PEF), ļČłĻĘ£ņ╣Ö ļ│ĆņŚ░(irregular margin), ļ╣äĒÅēĒ¢ē ļ░®Ē¢źņä▒(nonparallel orientation)ņØ┤ļŗż. 2016 ĻČīĻ│ĀņĢłĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ K-TIRADS 4ņÖĆ 2ņŚÉ ņĢĮĻ░äņØś ļ│ĆļÅÖņØ┤ ņ׳ļŗż. K-TIRADS 4ņŚÉ 3Ļ░Ćņ¦Ć ĒĢŁļ¬®ņØ┤ ņČöĻ░ĆļÉśņŚłļŖöļŹ░ ļŗżņØīĻ│╝ Ļ░Öļŗż: 1) entirely calcified nodule, 2) extensive parenchymal PEF (microcalcification) without discrete nodules (suspicious for diffuse sclerosing variant of PTC), 3) diffusely infiltrative lesions (suspicious for infiltrative malignancy, such as metastasis or lymphoma). K-TIRADS 2ņŚÉ ņåŹĒĢśļŖö ņ┤łņØīĒīī ņåīĻ▓¼ņØä ļ│┤ņØ┤ļŖö Ļ▓░ņĀłņØĆ ņĢģņä▒ņØśņŗ¼ņ┤łņØīĒīī ņåīĻ▓¼ ņŚ¼ļČĆņÖĆ ņāüĻ┤ĆņŚåņØ┤ K-TIRADS 2ļĪ£ ļČäļźśĒĢśņśĆļŗż.
ņĄ£ĻĘ╝ ļ░£Ēæ£ļÉ£ ļ╣äĻĄÉ ņŚ░ĻĄ¼[9-13]ņŚÉ ļö░ļź┤ļ®┤ 2016 ĻČīĻ│ĀņĢłņØĆ 1 cm ņØ┤ņāüņØĖ Ļ░æņāüņäĀ Ļ▓░ņĀłņŚÉņä£ Ļ░æņāüņäĀņĢö ļ░£Ļ▓¼ņŚÉ ļīĆĒĢ£ ņśłļ»╝ļÅäĻ░Ć Ļ░Ćņן ļåÆĻ│Ā, ņ¢æņä▒Ļ░æņāüņäĀ Ļ▓░ņĀłņŚÉ ļīĆĒĢ£ ļČłĒĢäņÜöĒĢ£ ņĪ░ņ¦ü Ļ▓Ćņé¼ ļ╣łļÅäĻ░Ć Ļ░Ćņן ļåÆņĢśļŗż. ņØ┤ņÖĆ Ļ░ÖņØĆ Ļ▓░Ļ│╝ļŖö ņĪ░ņ¦ü Ļ▓Ćņé¼ĒĢ┤ņĢ╝ ĒĢśļŖö Ļ▓░ņĀłņØś Ēü¼ĻĖ░ ļĢīļ¼ĖņØ┤ņŚłļŗż. ņŚ¼ļ¤¼ ĻČīĻ│ĀņĢłņŚÉ ļö░ļź┤ļ®┤ Ļ░ÖņØĆ Ēü¼ĻĖ░ņŚÉņä£ ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ĒĢĀ Ļ▓ĮņÜ░ ņ¦äļŗ©ņ£©ņØĆ ļ╣äņŖĘĒĢśņśĆļŗż.
1 cm ņØ┤ņāüņØĖ Ļ▓░ņĀłņŚÉņä£ ņĢö ļ░£Ļ▓¼ņŚÉ ļīĆĒĢ£ ņĀüņĀłĒĢ£ ņśłļ»╝ļÅäļź╝ ņ£Āņ¦ĆĒĢśļÉś ņ¢æņä▒Ļ▓░ņĀłņŚÉ ļīĆĒĢ£ ļČłĒĢäņÜöĒĢ£ ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ļé«ņČöļŖö Ļ▓āņØ┤ ĒĢäņÜöĒĢśņśĆļŗż. ņĢģņä▒Ļ▓░ņĀłņØś Ēü¼ĻĖ░Ļ░Ć 2 cm ņØ┤ņāü ļÉśļ®┤ ņøÉĻ▓®ņĀäņØ┤Ļ░Ć ņ”ØĻ░ĆĒĢśĻ│Ā, ņĢģņä▒Ļ▓░ņĀłņØś Ēü¼ĻĖ░Ļ░Ć ņ╗żņ¦łņłśļĪØ ĻĄŁņåīņóģņ¢æņ╣©ļ▓ö, ļ”╝ĒöäņĀłņĀäņØ┤, ņøÉĻ▓®ņĀäņØ┤ļÅä ņ”ØĻ░ĆĒĢ£ļŗż. Ļ▓░ĻĄŁņØĆ ņĪ░ņ¦ü Ļ▓Ćņé¼ĒĢ┤ņĢ╝ ĒĢśļŖö Ļ▓░ņĀłņØś Ēü¼ĻĖ░ļź╝ Ļ▓░ņĀĢĒĢśļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļŗż. ļīĆļČĆļČäņØś ņĀĆņ£äĒŚś Ļ░æņāüņäĀņĢöņØś ļŖÉļ”░ ņä▒ņןļźĀņØä Ļ│ĀļĀżĒĢĀ ļĢī, ņśłļ»╝ļÅä ņĀĆĒĢśļź╝ Ļ░ÉņłśĒĢśļ®┤ņä£ ļČłĒĢäņÜöĒĢ£ ņāØņ▓┤Ļ▓Ćņé¼ļź╝ ņżäņØ┤ļŖö ņĀäļץņØĆ ņ£äĒŚśĒĢ£ ņ┤łņØīĒīī ņåīĻ▓¼ņØ┤ ņŚåļŖö ņ×æņØĆ Ļ▓░ņĀł(1-2 cm)ņŚÉ ņĀüĒĢ®ĒĢĀ ņłś ņ׳ļŗż. ņ×æņØĆ Ļ▓░ņĀł(1-2 cm)ņŚÉ ļīĆĒĢ£ ļČłĒĢäņÜöĒĢ£ ņĪ░ņ¦ü Ļ▓Ćņé¼ļŖö ļČłĒÖĢņŗżĒĢ£ ņĪ░ņ¦ü Ļ▓Ćņé¼ Ļ▓░Ļ│╝ļĪ£ ņØĖĒĢ£ ĒÖśņ×ÉļōżņØś ļČłņĢłĻ│╝ ļČłĒĢäņÜöĒĢ£ ņ¦äļŗ©ņĀü ņłśņłĀņØä ņ┤łļלĒĢśņŚ¼ ņØśļŻīņŗ£ņŖżĒģ£ņŚÉ ļČĆļŗ┤ņØä ņżä ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ 2021 ĻČīĻ│ĀņĢłņŚÉņä£ ņĪ░ņ¦ü Ļ▓Ćņé¼ĒĢ┤ņĢ╝ ĒĢśļŖö Ļ▓░ņĀłņØś Ēü¼ĻĖ░ļź╝ K-TIRADS ņ╣┤ĒģīĻ│Āļ”¼ņŚÉ ļö░ļØ╝ ņłśņĀĢĒĢśņśĆļŗż(Table 4).
ļ¦īņĢĮ ļ”╝ĒīīņĀłņĀäņØ┤Ļ░Ć ņØśņŗ¼ļÉśĻ▒░ļéś, ņŻ╝ņ£ä ĻĄ¼ņĪ░ļ¼╝(ĻĖ░ļÅä, ĒøäļæÉ, ņØĖļæÉ, ļÉśļÅīņØ┤ĒøäļæÉņŗĀĻ▓Į, Ļ░æņāüņäĀņŻ╝ņ£äĒśłĻ┤Ć) ņ╣©ļ▓öņØ┤ ĒÖĢņŗżĒĢ£ Ļ▓ĮņÜ░, ņøÉļ░£ņĀäņØ┤Ļ░Ć ņ¦äļŗ©ļÉ£ Ļ▓ĮņÜ░, ņłśņ¦łĻ░æņāüņäĀņĢö(medullary thyroid cancer)ņØ┤ ņØśņŗ¼ļÉśļŖö Ļ▓ĮņÜ░ņŚÉļŖö Ļ░æņāüņäĀ Ļ▓░ņĀł Ēü¼ĻĖ░ņÖĆ ņāüĻ┤ĆņŚåņØ┤ ņĪ░ņ¦ü Ļ▓Ćņé¼ĒĢ┤ņĢ╝ ĒĢ£ļŗż.
5-10 mm Ēü¼ĻĖ░ņØś K-TIRADS 5 Ļ▓░ņĀłņØĆ ļÉśļÅīņØ┤ĒøäļæÉņŗĀĻ▓Įņ╣©ļ▓öņØ┤ ņØśņŗ¼ļÉśĻ▒░ļéś, ĻĖ░ļÅä ņ╣©ļ▓öņØ┤ ņØśņŗ¼ļÉĀ Ļ▓ĮņÜ░ņŚÉ ņĪ░ņ¦ü Ļ▓Ćņé¼Ļ░Ć ĻČīĻ│ĀļÉ£ļŗż. ļśÉĒĢ£ ņ╣śļŻī Ļ│äĒÜŹņØä ņäĖņÜ░ĻĖ░ ņ£äĒĢ┤ņä£ļÅä ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ĻČīĒĢĀ ņłś ņ׳ļŗż. ņ¢┤ļ”░ņØ┤ņØĖ Ļ▓ĮņÜ░ņŚÉļŖö ņ╣śļŻī Ļ│äĒÜŹņØä ņ£äĒĢ┤ ņ×äņāüņĀü ļ¦źļØĮņØä Ļ│ĀļĀżĒĢśņŚ¼ ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢ┤ņĢ╝ ĒĢ£ļŗż.
K-TIRADS 4 Ļ▓░ņĀłņØś ņĪ░ņ¦ü Ļ▓Ćņé¼ ĻČīĻ│Ā Ēü¼ĻĖ░ļź╝ 1-1.5 cmļĪ£ ĒĢ£ ņØ┤ņ£ĀļŖö ņ┤łņØīĒīī ņåīĻ▓¼, Ļ▓░ņĀł ņ£äņ╣ś, ņ×äņāüņĀü ņ£äĒŚśņÜöņåī(PET-CT Ļ▓Ćņé¼ņŚÉņä£ ļ░£Ļ▓¼, ņĢöĻ░ĆņĪ▒ļĀź, ļ¬®ņåīļ”¼ ļ│Ćņä▒Ļ│╝ Ļ░ÖņØĆ ņ£äĒŚś ņ”Øņāü), ĒÖśņ×É ņÜöņåī(ļéśņØ┤, ļÅÖļ░ś ņ¦łĒÖś, ĒÖśņ×ÉņäĀĒśĖļÅä)ņŚÉ ļö░ļØ╝ Ļ▓░ņĀĢĒĢĀ ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż.
K-TIRADS 2 Ļ▓░ņĀłņØĆ ĒåĄņāüņĀüņ£╝ļĪ£ ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ĻČīĒĢśņ¦Ć ņĢŖņ£╝ļéś Ļ▓░ņĀłņØ┤ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņ╗żņ¦ĆĻ▒░ļéś ņ╣śļŻī(ļ╣äņłśņłĀņĀü Ēś╣ņØĆ ņłśņłĀņĀü ņ╣śļŻī) ņĀäņŚÉ ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ļŗż. 2016 K-TIRADSņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ 2021 K-TIRADSļŖö ņ×æņØĆ Ļ▓░ņĀł(Ōēż 2 cm)ņŚÉņä£ ļČłĒĢäņÜöĒĢ£ ņāØĻ▓ĆņØś ļ╣äņ£©ņØä 19.2-32.8%ļĪ£ Ēü¼Ļ▓ī ņżäņØ┤ļ®┤ņä£, Ēü¼ĻĖ░Ļ░Ć Ēü░ ņĢģņä▒Ļ▓░ņĀł(> 2cm) ņ¦äļŗ©ņŚÉ ļīĆĒĢ£ ļ¦żņÜ░ ļåÆņØĆ ļ»╝Ļ░ÉļÅä(98.0%)ļź╝ ņ£Āņ¦ĆĒĢśņśĆļŗż[14].
2021 K-TIRADSņŚÉņä£ ņ×æņØĆ Ļ▓░ņĀł(Ōēż 2 cm)ņŚÉ ļīĆĒĢ£ ļČłĒĢäņÜöĒĢ£ ņĪ░ņ¦ü Ļ▓Ćņé¼ņ£©(17.6%)ņØĆ ļŗżļźĖ ņŚ¼ļ¤¼ ļéśļØ╝ ĻČīĻ│ĀņĢł(American Association of Clinical Endocrinologists/American College of Endocrinology/Associazione Medici Endocrinologimedical guidelines, the European-TIRADS, and the American College of Radiology [ACR]) (18.6-28.1%)ļ│┤ļŗż ļé«ļŗż. ļśÉĒĢ£ Ēü░ ņĢģņä▒Ļ▓░ņĀł(> 2 cm) ņ¦äļŗ©ņØä ņ£äĒĢ£ ļ»╝Ļ░ÉļÅä(98.0%)ļŖö ļŗżļźĖ ņŚ¼ļ¤¼ ļéśļØ╝ ĻČīĻ│ĀņĢł(89.7%)ļ│┤ļŗż ļåÆļŗż. Ļ▓░ļĪĀņĀüņ£╝ļĪ£ ņ×æņØĆ Ļ▓░ņĀłņŚÉ ļīĆĒĢ£ ļČłĒĢäņÜöĒĢ£ ņĪ░ņ¦ü Ļ▓Ćņé¼ņ£©ņØĆ ļé«ņČöĻ│Ā Ēü░ ņĢģņä▒Ļ▓░ņĀł ņ¦äļŗ©ņŚÉ ļīĆĒĢ£ ļ»╝Ļ░ÉļÅäļź╝ ļåÆņØĖ Ļ▓āņØ┤ļŗż.
ņĪ░ņ¦ü Ļ▓Ćņé¼ĒĢśņ¦Ć ņĢŖņØĆ Ļ▓░ņĀłņØś ņČöņĀü Ļ┤Ćņ░░ ĻĖ░Ļ░äņŚÉ ļīĆĒĢ£ Ļ▓āņØĆ ņĢäņ¦ü ĒÖĢļ”ĮļÉśņ¦Ć ņĢŖņĢśļŗż. ĻČīĻ│ĀņĢł ņ£äņøÉĒÜīļŖö Ļ▓░ņĀłņØś K-TIRADS ņ╣┤ĒģīĻ│Āļ”¼ņŚÉ ļö░ļØ╝ ņČöņĀü Ļ▓Ćņé¼ĒĢĀ Ļ▓āņØä ĻČīĻ│ĀĒĢ£ļŗż. K-TIRADS 5 Ļ▓░ņĀłņØĆ 1-2ļģä ļÅÖņĢł 6Ļ░£ņøöļ¦łļŗż, ĻĘĖ ņØ┤ĒøäņŚÉ Ēü¼ĻĖ░ ļ│ĆĒÖöĻ░Ć ņŚåņ£╝ļ®┤ 1ļģäļ¦łļŗż ņČöņĀü ņ┤łņØīĒīī Ļ▓Ćņé¼ļź╝ ĻČīĻ│ĀĒĢ£ļŗż. K-TIRADS 3 Ēś╣ņØĆ 4 Ļ▓░ņĀłņØĆ 1, 3, 5ļģäņŚÉ ņČöņĀü ņ┤łņØīĒīī Ļ▓Ćņé¼ļź╝ ĻČīĻ│ĀĒĢ£ļŗż. ļ¦īņĢĮ 5ļģä Ļ▓Ćņé¼ņŚÉņä£ Ēü¼ĻĖ░ ļ│ĆĒÖöĻ░Ć ņŚåņ£╝ļ®┤ K-TIRADS 4 Ļ▓░ņĀłņØĆ 3-5ļģäļ¦łļŗż, K-TIRADS 3 Ļ▓░ņĀłņØĆ 5ļģäļ¦łļŗż ņČöņĀü ņ┤łņØīĒīī 0 Ļ▓Ćņé¼ļź╝ ĻČīĒĢ£ļŗż. K-TIRADS 2 Ļ▓░ņĀłņØĆ ņĢģņä▒Ļ░ĆļŖźņä▒ņØ┤ ļ¦żņÜ░ ļé«ņ£╝ļ»ĆļĪ£ ņ▓½ ļ▓łņ¦Ė ņČöņĀü Ļ▓Ćņé¼ļź╝ 2-5ļģä ĒøäņŚÉ ĒĢĀ Ļ▓āņØä ĻČīĻ│ĀĒĢ£ļŗż. ņĪ░ņ¦ü Ļ▓Ćņé¼ Ļ▓░Ļ│╝ ņ¢æņä▒ņ£╝ļĪ£ ņ¦äļŗ©ļÉ£ Ļ▓░ņĀłņØĆ ņČöņĀü Ļ▓Ćņé¼ļź╝ 2ļģä ņØ┤ņāüņ£╝ļĪ£ ĒĢĀ Ļ▓āņØä ĻČīĻ│ĀĒĢ£ļŗż. ņČöņĀü ņ┤łņØīĒīī Ļ▓Ćņé¼ ņżæļŗ© ĻĖ░ņżĆņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļ│┤Ļ│ĀļŖö ņŚåļŗż.
Ēü¼ĻĖ░ ļ│ĆĒÖöļĪ£ ņĢģņä▒Ļ│╝ ņ¢æņä▒ Ļ▓░ņĀłņØä ĻĄ¼ļ│äĒĢĀ ņłś ņŚåļŗż. K-TIRADS 2 Ēś╣ņØĆ 3 Ļ▓░ņĀłņØĆ ļ¦īņĢĮ 5ļģä ņČöņĀü Ļ▓Ćņé¼ņŚÉņä£ Ēü¼ĻĖ░ ļ│ĆĒÖöĻ░Ć ņŚåņ£╝ļ®┤ ņČöņĀü ņ┤łņØīĒīī Ļ▓Ćņé¼ļź╝ ņŚ░ĻĖ░ĒĢśĻ│Ā ņ×äņāüņĀü ņČöņĀü Ļ▓Ćņé¼ļź╝ ĻČīĒĢśņ¦Ćļ¦ī Ēü¼ĻĖ░Ļ░Ć ņ╗żņä£ ņ”ØņāüņØ┤ ņ׳ņ£╝ļ®┤ ļŹö ņ×ÉņŻ╝ ņČöņĀü ņ┤łņØīĒīī Ļ▓Ćņé¼ļź╝ ņŗżņŗ£ĒĢśļ®┤ ļÉ£ļŗż. 1 cmļ│┤ļŗż ņ×æņØĆ Ļ▓░ņĀłņØĆ ņČöņĀü Ļ▓Ćņé¼ļź╝ ņŚ░ĻĖ░ĒĢśĻ▒░ļéś ņżæļŗ©ĒĢĀ ņłś ņ׳ļŗż. ļ¦īņĢĮ ņČöņĀü Ļ▓Ćņé¼ņŚÉņä£ K-TIRADS ņ╣┤ĒģīĻ│Āļ”¼Ļ░Ć ļ░öļĆīļ®┤ ļ░öļĆÉ ņāłļĪ£ņÜ┤ K-TIRADS ĻĖ░ņżĆņŚÉ ļö░ļØ╝ ņČöņĀü Ļ▓Ćņé¼ļź╝ ņŗżņŗ£ĒĢ┤ņĢ╝ ĒĢ£ļŗż. ļŗ©, Ēü¼ĻĖ░Ļ░Ć ņØśļ»Ė ņ׳Ļ▓ī Ļ░ÉņåīĒĢ£ Ļ▓░ņĀłņØĆ ņśłņÖĖņØ┤ļŗż. Ēü¼ĻĖ░Ļ░Ć ņ╗żņĀĖņä£ ņ”ØņāüņØä ņØ╝ņ£╝Ēé©ļŗżļ®┤ K-TIRADS ņ╣┤ĒģīĻ│Āļ”¼ņŚÉ ņāüĻ┤ĆņŚåņØ┤ ņ┤łņØīĒīī Ļ▓Ćņé¼ņÖĆ ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ņŗżņŗ£ĒĢĀ ņłś ņ׳ļŗż. ņ┤łņØīĒīī ņČöņĀü Ļ▓Ćņé¼ļŖö ņ×äņāüņĀü ņ£äĒŚśņØĖņ×ÉņÖĆ ĒÖśņ×ÉņØś ņäĀĒśĖļÅäļź╝ Ļ│ĀļĀżĒĢ£ Ēøä ņ×äņāüņĀü ĒīÉļŗ©ņŚÉ ļö░ļØ╝ ņłśņĀĢļÉĀ ņłś ņ׳ļŗż.
FNA Ēøä Ļ▓░ņĀłņØś Ļ┤Ćļ”¼ļŖö FNA Ļ▓░Ļ│╝ļ┐Éļ¦ī ņĢäļŗłļØ╝ ņ┤łņØīĒīī ļ░Å ņ×äņāü ņ¢æņāüņØä ĻĖ░ļ░śņ£╝ļĪ£ ĒĢ┤ņĢ╝ ĒĢ£ļŗż. ņ┤łņØīĒīī ĻĖ░ļ░ś ņ£äĒŚś Ļ│äņĖĄĒÖö(K-TIRADS)ņÖĆ Bethesda ņŗ£ņŖżĒģ£ņØä ĒĢ©Ļ╗ś Ļ│ĀļĀżĒĢśļ®┤ Ļ░æņāüņäĀņĢöņØä ņĪ░ĻĖ░ņŚÉ ļ░£Ļ▓¼ĒĢĀ ņłś ņ׳Ļ│Ā FNA Ēøä ņĄ£ņĀüņØś Ļ┤Ćļ”¼ Ļ▓░ņĀĢņØä ļé┤ļ”¼ļŖöļŹ░ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ļŗż(Table 5).
Ļ░æņāüņäĀņĢö ĒÖśņ×ÉņŚÉņä£ ņĪ░ņśü ņĀäĻ│╝ ņĪ░ņśü Ēøä CT Ļ▓Ćņé¼Ļ░Ć ĒĢäņÜöĒĢśļŗż. ņĪ░ņśü ņĀä CT Ļ▓Ćņé¼ļŖö ņäØĒÜīĒÖö, ņØ┤ņåīņä▒ Ļ░æņāüņäĀ ņĪ░ņ¦ü(ectopic thyroid tissue), Ļ░æņāüņäĀņĀłņĀ£ņłśņłĀ ĒøäņŚÉ ļé©ņØĆ Ļ░æņāüņäĀ ņĪ░ņ¦üĻ│╝ ņ×¼ļ░£ņĢöĻ│╝ņØś Ļ░Éļ│ä ņ¦äļŗ©ņŚÉ ņ£ĀņÜ®ĒĢśļŗż. ņĪ░ņśüĒøä CT Ļ▓Ćņé¼ļŖö ļ”╝ĒīīņĀł ņĀäņØ┤ ņ¦äļŗ©ņŚÉ ĒĢäņłśņĀüņØ┤ļŗż. ļ”╝ĒīīņĀł ņĀäņØ┤ļŖö Ļ░ĢĒĢśĻ▓ī Ēś╣ņØĆ ļ╣äĻĘĀņ¦łĒĢśĻ▓ī ņĪ░ņśüņ”ØĻ░ĢļÉśĻ│Ā ļéŁņä▒ļ│ĆĒÖöļź╝ ļ│┤ņØĖļŗż. CT Ļ▓Ćņé¼ļŖö ļæÉĻ░£ņĀĆ(skull base)ņŚÉņä£ ņāüļČĆņóģĻ▓®ļÅÖ(aortopulmonary [AP] window)Ļ╣īņ¦Ć ĒżĒĢ©ļÉśņ¢┤ņĢ╝ ĒĢ£ļŗż. ņØ┤ļŖö ņóģĻ▓®ļÅÖ ļ”╝ĒöäņĀłĻ│╝ ĻĖ░ĒśĢ ņÜ░ņĖĪ ņćäĻ│© ĒĢśļÅÖļ¦ź(aberrant right subclavian artery)ņØä ĒÅēĻ░ĆĒĢ┤ņĢ╝ ĒĢśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż. Ļ░æņāüņäĀņĢö ņ¦äļŗ©ņØä ņ£äĒĢ┤ņä£ļŖö ņĄ£ņĀüĒÖöļÉ£ ņĀäņÜ® ĒöäļĪ£ĒåĀņĮ£ņØä ņé¼ņÜ®ĒĢśņŚ¼ CTļź╝ ņŗ£Ē¢ēĒĢ┤ņĢ╝ ĒĢ£ļŗż[6].
ļīĆĒĢ£Ļ░æņāüņäĀņśüņāüņØśĒĢÖĒÜīņŚÉņä£ ņĀ£ņŗ£ĒĢ£ K-TIRADSļŖö ņŗżņŗ£Ļ░ä ņ┤łņØīĒīī Ļ▓Ćņé¼ĒĢĀ ļĢī Ļ▓░ņĀłņØś ļČäļźśĻ░Ć ņÜ®ņØ┤ĒĢ£ Ēī©Ēä┤ ĻĖ░ļ░ś ņĢö ņ£äĒŚśļÅä Ļ│äņĖĄĒÖö ņŗ£ņŖżĒģ£(RSS)ņØ┤ļŗż. K-TIRADSņØś ļ¬®ņĀüņØĆ ņŗżņĀ£ ņ×äņāü ņ¦äļŻīņŚÉņä£ Ļ░æņāüņäĀ Ļ▓░ņĀłņØś ņ┤łņØīĒīīĻ▓Ćņé¼ ĻĖ░ļ░ś ņ¦äļŗ© ļ░Å Ļ┤Ćļ”¼ņŚÉ Ļ┤ĆĒĢ£ ņĄ£Ļ│ĀņØś Ļ│╝ĒĢÖņĀü ņ”ØĻ▒░ņÖĆ ĒĢ®ņØśļÉ£ ņĀäļ¼ĖĻ░Ć ņØśĻ▓¼ņØä ņĀ£ņŗ£ĒĢśļŖö Ļ▓āņØ┤ļŗż. Ļ░£ņĀĢļÉ£ 2021ļģä K-TIRADSņŚÉņä£ļŖö Ļ░æņāüņäĀ Ļ▓░ņĀłņØś ņ┤łņØīĒīīĒæ£ņżĆņÜ®ņ¢┤(US lexicon), ņ£äĒŚśĻ│äņĖĄĒÖö(risk stratification), ņØ┤ļ»Ėņ¦Ć ĻĖ░ļ░ś Ļ┤Ćļ”¼(image-based management)Ļ░Ć ņēĮĻ▓ī ņ×äņāüņŚÉ ņé¼ņÜ®ļÉĀ ņłś ņ׳ļÅäļĪØ ņŚģļŹ░ņØ┤ĒŖĖ ļÉśņŚłļŗż. 2021ļģä K-TIRADSņŚÉņä£ ņĪ░ņ¦ü Ļ▓Ćņé¼ ņ╗ĘņśżĒöä ņé¼ņØ┤ņ”łļŖö Ļ▓░ņĀł Ēü¼ĻĖ░ņŚÉ ļö░ļźĖ ņĢģņä▒ņóģņ¢æ Ļ▓ĆņČ£ņŚÉ ņĀüņĀłĒĢ£ ļ»╝Ļ░ÉļÅäļź╝ ņ£Āņ¦ĆĒĢśļ®┤ņä£ ļČłĒĢäņÜöĒĢ£ ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ņżäņØ┤ĻĖ░ ņ£äĒĢ┤ Ļ░£ņĀĢļÉśņŚłļŗż.
REFERENCES
1. Frates MC, Benson CB, Charboneau JW, et al. Management of thyroid nodules detected at US: Society of Radiologists in Ultrasound consensus conference statement. Radiology 2005;237:794ŌĆō800.


2. Guth S, Theune U, Aberle J, Galach A, Bamberger CM. Very high prevalence of thyroid nodules detected by high frequency (13 MHz) ultrasound examination. Eur J Clin Invest 2009;39:699ŌĆō706.


3. Tan GH, Gharib H. Thyroid incidentalomas: management approaches to nonpalpable nodules discovered incidentally on thyroid imaging. Ann Intern Med 1997;126:226ŌĆō231.


4. Moon WJ, Baek JH, Jung SL, et al. Ultrasonography and the ultrasound-based management of thyroid nodules: consensus statement and recommendations. Korean J Radiol 2011;12:1ŌĆō14.



5. Shin JH, Baek JH, Chung J, et al. Ultrasonography diagnosis and imaging-based management of thyroid nodules: revised Korean Society of Thyroid Radiology consensus statement and recommendations. Korean J Radiol 2016;17:370ŌĆō395.



6. Ha EJ, Chung SR, Na DG, et al. 2021 Korean thyroid imaging reporting and data system and imaging-based management of thyroid nodules: Korean Society of Thyroid Radiology consensus statement and recommendations. Korean J Radiol 2021;22:2094ŌĆō2123.



7. Lee JY, Na DG, Yoon SJ, et al. Ultrasound malignancy risk stratification of thyroid nodules based on the degree of hypoechogenicity and echotexture. Eur Radiol 2020;30:1653ŌĆō1663.


8. Kim SY, Na DG, Paik W. Which ultrasound image plane is appropriate for evaluating the taller-than-wide sign in the risk stratification of thyroid nodules? Eur Radiol 2021;31:7605ŌĆō7613.


9. Ha EJ, Na DG, Baek JH, Sung JY, Kim JH, Kang SY. US fine-needle aspiration biopsy for thyroid malignancy: diagnostic performance of seven society guidelines applied to 2000 thyroid nodules. Radiology 2018;287:893ŌĆō900.


10. Ha EJ, Na DG, Moon WJ, Lee YH, Choi N. Diagnostic performance of ultrasound-based risk-stratification systems for thyroid nodules: comparison of the 2015 American Thyroid Association guidelines with the 2016 Korean Thyroid Association/Korean Society of Thyroid Radiology and 2017 American College of Radiology guidelines. Thyroid 2018;28:1532ŌĆō1537.


11. Ha SM, Baek JH, Na DG, et al. Diagnostic performance of practice guidelines for thyroid nodules: thyroid nodule size versus biopsy rates. Radiology 2019;291:92ŌĆō99.


12. Middleton WD, Teefey SA, Reading CC, et al. Comparison of performance characteristics of American College of Radiology TI-RADS, Korean Society of Thyroid Radiology TIRADS, and American Thyroid Association guidelines. AJR Am J Roentgenol 2018;210:1148ŌĆō1154.


Nodules with marked and mild hypoechogenicity. The echogenicity of the nodules is determined as compared to that of reference structures (normal thyroid parenchyma and anterior neck muscles, including the strap and sternocleidomastoid muscles).
Figure┬Ā1.
Different echogenicity definition of the nodules in cases of abnormal thyroid parenchyma hypoechogenicity due to (A) diffuse thyroid diseases and (B) normal thyroid echogenicity.
Figure┬Ā2.
US findings of anterior ETE. (A) No ETE, (B) minor ETE, (C) gross ETE. US, ultrasonography; ETE, extrathyroidal extension.
Figure┬Ā4.
US findings of posterior, tracheal, RLN ETE. (A) minor ETE to posterior capsule, (B) gross ETE to trachea, (C) gross ETE to RLN. US, ultrasonography; RLN, recurrent laryngeal nerve; ETE, extrathyroidal extension.
Figure┬Ā5.
Algorithm of the 2021 K-TIRADS for malignancy risk stratification based on the nodule composition and echogenicity, and suspicious US features. K-TIRADS, Korean Thyroid Imaging Reporting and Data System; US, ultrasonography. aPunctate echogenic foci (microcalcifications), nonparallel orientation (taller than wide shape), and irregular margins.
Figure┬Ā6.
Table┬Ā1.
Terminology and definitions of the major us lexicon for thyroid nodules [6]
Table┬Ā2.
Echogenic foci (calcifications)
Table┬Ā3.
US findings for ETE of thyroid cancer
Table┬Ā4.
US pattern and malignancy risk of thyroid nodules and biopsy size thresholds in the 2021 K-TIRADS
Table┬Ā5.
Management of thyroid nodules based on FNA results and US patterns
| FNA diagnosis | US pattern (K-TIRADS) | Management |
|---|---|---|
| Nondiagnostic | High suspicion | Repeat FNA or CNBa within 6 months |
| Intermediate or low suspicion | Repeat FNA or CNBa within 12 months | |
| Benign | High suspicion | Repeat FNA within 12 months |
| Intermediate or low suspicion | US follow-up at 24 months | |
| AUS/FLUS | High suspicion | Repeat FNA or CNBa within 6 months |
| Intermediate or low suspicion | Repeat FNA or CNBa within 12 months | |
| US surveillanceb or molecular test | ||
| FN/SFN | All nodules | Diagnostic surgery (lobectomy) |
| US surveillancec or molecular test | ||
| Suspicious for malignancy | High suspicion | Surgery |
| Intermediate or low suspicion | Repeat FNA or surgery | |
| Active surveillanced | ||
| Malignant | All nodules | Surgery |
| Active surveillanced |
FNA, fine needle aspiration; US, ultrasonography; K-TIRADS, Korean Thyroid Imaging Reporting and Data System; AUS, atypia of undetermined significance; FLUS, follicular lesion of undetermined significance; FN, follicular neoplasm; SFN, suspicious for follicular neoplasm; CNB, core needle biopsy.
b US follow-up may be considered, depending on the nodule size, US features, cytological features, clinical features, patient preferences, and, if possible, molecular test results. If the repeat FNA cytology findings are inconclusive, frequent US follow-up or diagnostic surgery may be considered;



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




