서 론
전 세계적으로 위암은 5번째로 흔한 암으로 위암에 의한 사망률은 2번째로 높다. 우리나라에서 위암은 갑상선암에 이어 2번째로 많이 발생하고, 10만 명당 41여 명 정도로 세계에서는 가장 높은 발생률을 보인다. 그렇지만 위암에 대한 조기 진단율이 증가하면서 위암 관련 사망률은 감소하고 있다. 조기 위암은 암세포가 위의 점막층 혹은 점막하층에 국한되어 침투한 단계로, 대부분의 경우에 병변의 국소 절제만으로 완치를 기대할 수 있다. 따라서, 위암의 조기 발견은 매우 중요하다 할 수 있겠으나, 조기 위암 단계에서는 점막과 혈관의 미세한 변화만을 동반하는 경우가 흔하기 때문에 이를 정확히 발견하기 어려운 경우가 있다.
1806년 Philipp Bozzini는 귀, 요도, 직장, 자궁경부, 구강, 비강 등을 관찰할 수 있는 원시내시경인 “light conductor”를 개발하였다. 이후 1950년대에 개발된 연성내시경은 광섬유를 통해 이미지를 전송하고, 이 전송된 이미지를 결합시켜 합성된 이미지를 관찰할 수 있게 하였다. 1980년대에는 이미지의 선명도를 높이기 위해 내시경에 charge-coupled device를 장착하였고, 이로써 비디오 내시경 검사 시대가 도래하게 되었다. 마이크로칩과 이미지 프로세싱 기술의 발달로 여러 나라에서 고해상도 내시경을 제작하고 있으며, 간단한 스위치 조작만으로 병변과 주위 점막과의 대조를 극대화하여 색소내시경(chromoendoscopy)처럼 병변을 세밀하게 관찰할 수 있게 해주는 영상증강 내시경(image-enhanced endoscopy)을 개발하고 있다. 본고에서는 협대역 영상(narrow-band imaging, NBI), 컴퓨터가상 색소 내시경(flexible spectral imaging color enhancement, FICE), blue laser imaging (BLI), i-scan, 광학 강화(optical enhancement, OE), storz professional image enhancement system (SPIES), 공초점 현미경 내시경(confocal laser endomicroscopy) 등 새롭게 개발된 영상증강 내시경들이 어떻게 조기 위암의 진단을 위해 활용되고 있는지 알아보고자 한다.
본 론
색소 내시경
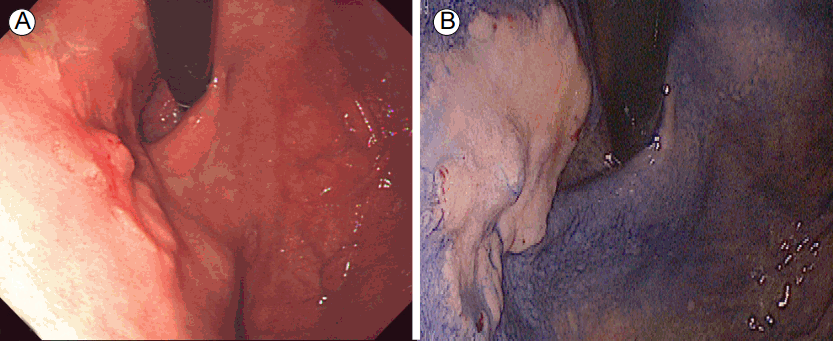
색소 내시경은 백색광 내시경 검사 후 놓칠 수 있는 미묘한 점막의 불규칙성을 식별하기 위해 여러 가지 색소를 위 점막에 도포한 후 관찰하는 방법이다. 이는 기술적으로 쉽고 위험성이 적으며, 경제적으로도 저렴하여 현재까지 널리 사용되고 있다. 인디고카르민은 위 병변을 관찰하기 위해 사용되는 대표적인 색소로서, 병변부에 착색이 되지 않아 병변의 틈새에 쌓여 병변부가 강조되면서 병변의 경계와 표면의 구조를 알 수 있게 해준다(Fig. 1). 그러나 색소내시경 수기 자체가 번거롭고 색소가 불균등하게 살포되거나 위치에 따라 병변에 색소가 고이는 경우, 오히려 병변 관찰이 어려울 수 있다. 또한 염증으로 인한 점막 변화나 삼출물이 있는 경우에도 오히려 병변 식별이 어려워 질 수 있다.
NBI
NBI는 지금까지 가장 많이 연구되었고 현재 주로 사용 중인 영상증강 내시경 검사법이다. 내시경으로 위 점막을 관찰하기 위해서는 빛을 비추어야 하는데, 이 때 빛이 투과하는 깊이는 빛의 파장의 길이에 비례하고, 단파장의 빛은 혈관내의 헤모글로빈을 강하게 흡수한다는 원리를 이용한 기술이다. 위암은 점막에서 기원하는데 점막까지만 투과하는 좁은 대역폭의 단파장 가시광선을 이용한 광학 이미지 기술이다. 일반적인 유형의 내시경 시스템은 제논 램프를 백색광 조명으로 사용한다. 기존의 NBI 시스템은 크세논 광원 및 광학 필터를 사용한다. 415 nm (390-445 nm)의 청색광 이미지는 표면 모세혈관 네트워크를 볼 수 있게 해주고, 540 nm(530-550 nm) 녹색광 이미지는 점막의 깊이에서 수집 혈관을 분석할 수 있게 해준다. 이로써, NBI는 점막 혈관과 상피의 변화에 대한 화질을 향상시킨다. NBI는 규칙적인 표면 모세혈관 네트워크 양상의 소실, 암과의 경계 구분선, 불규칙한 미세혈관 양상과 정상 미세 점막 구조물의 소실 등의 소견을 통해 위암의 조기 발견을 가능하게 한다(Fig. 2). 그러나 내강이 넓은 위를 단파장 가시광선으로 관찰하면 어둡고 화질이 떨어져서 일반적으로 적용하기 어려운 점이 있다. 그래서 일반적으로 백색광 내시경으로 관찰하다가 병변이 의심되면 NBI로 전환하는 스위치를 눌러 병변을 관찰하게 된다. 대부분 확대내시경을 같이 이용하여 연구되고 있는데, 기존의 색소내시경과 유사하거나 우월한 결과를 보여주고 있다. 한 연구에 따르면 fine network pattern의 미세혈관 구조에서는 68%가 고분화도 선암을 보였고, corkscrew pattern에서는 85%가 미분화도 선암으로 진단되었다[1].
FICE and blue laser image
이미지 향상을 위한 디지털 사후 처리 기법은 여러 가지가 있는데, FICE는 전자 내시경에서 얻어지는 컬러 영상을 특정 파장의 빛을 분리하여, 즉 적색, 청색 또는 녹색 스펙트럼의 빛을 선택하여 재구성된 영상을 보여준다. NBI와는 달리, FICE는 소프트웨어 기반이며 광학 필터를 사용하지 않는다. 가시광은 400 nm에서 700 nm의 범위를 가지는데, FICE는 이 사이를 5 nm마다 분광하여 60가지 색상의 조합을 구성하고, 이를 다시 5단계로 설정한 영상이다. 조작은 NBI와 마찬가지로 내시경 조작부의 버튼을 누르면 FICE 영상으로 전환되어 실시간으로 내시경 영상을 변환할 수 있다. 이렇게 설정된 영상을 통해 점막의 미세한 변화를 강조하여 조기 위암 진단에 도움을 준다. 보고에 따르면 특히 530 nm 파장에서 조기 위암의 병변 경계를 더 확실히 구분할 수 있었고, 종양 표면의 모세혈관망도 잘 관찰할 수 있어 작은 용종의 조직학적 소견을 예측하는 데 도움이 되었다[2]. BLI 내시경 시스템에는 레이저 조명 기술이 포함되어 있다. 레이저 조명은 크세논 광원 및 필터로 얻은 조명보다 밝다. 하나의 광원은 백색광 모드 레이저로써 일반적인 관찰에 적합한 넓은 스펙트럼을 갖고, 다른 하나는 단파장의 협대역 레이저로 표면의 미세혈관과 미세구조에 대한 명확한 이미지를 만들어낸다. 위암에서 종양 표면의 불규칙한 미세혈관은 NBI와 유사하게 확인된다. 대부분의 위암은 표면이 약간 돌출되거나 함몰되어 고르지 않게 분포하게 되는데, 이를 고배율에서 보면 좋은 초점을 얻기 힘들다. 그러나 BLI는 이러한 표면과 미세혈관이 불규칙성이 분명하게 나타난다. 레이저 조명을 사용하는 BLI 내시경 시스템은 낮은 전력 소비로 내구성도 뛰어나다[3].
I-scan and optical enhancement
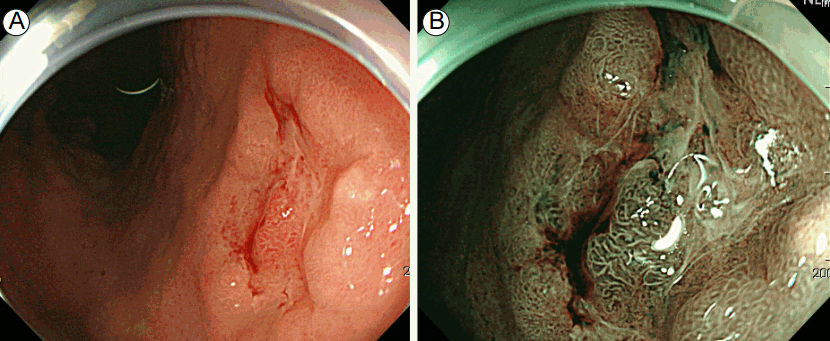
I-scan 또한 디지털 사후 처리 기법으로 다양한 파장을 조합하는 영상증강 내시경이다. 색조, 표면 및 대비 향상을 위해 디지털 필터를 통해 원래 영상을 변환시키고 강조함으로써 병변을 돋보이게 하는 내시경이다. i-scan은 이같이 크게 세 가지 모드를 적용할 수 있는데, contrast enhancement (CE) 모드는 영상의 각 픽셀의 밝기 강도에 대한 데이터에서 상대적으로 어두운 영역에 디지털로 푸른색을 첨가함으로써 색의 대조도를 높이고 점막 표면의 미묘한 차이를 자세히 관찰할 수 있도록 고안된 것이다. Surface enhancement (SE) 모드는 영상의 각 픽셀의 밝기 강도에 대한 데이터에서 회색 대조도(light-dark contrast)를 높임으로써 조직 표면의 구조, 혈관 패턴 및 국소해부영상을 강조하는 영상 기법이고, 마지막으로 컬러의 톤을 바꾸는 방식에 따라 특정 장기나 병변 관찰을 용이하게 하는 tone enhancement (TE) 모드가 있다[4]. 최근 미세혈관 구조를 좀더 정확하게 알기 위해 OE 기능이 추가되었는데, OE는 혈관, 선 구조 및 점막의 표면 구조를 색조로 표시하여 혈관을 이전보다 잘 대비시켜 혈관 특성을 지원하고 있다(Fig. 3).
SPIES
칼스토츠 내시경은 200만 화소 1,920 × 1,080픽셀의 full HD 해상도를 구현하여 기존 내시경에 비해 선명한 화질의 이미지를 보여주며, 혈관과 표면의 관찰을 위해 세가지 기술을 시각화에 이용하고 이를 SPIES라고 부른다[5]. 이 이미지 필터는 clara, chroma, spectra라고 하는 기술이 포함되는데, clara는 카메라로 관찰하는 모든 영역의 내시경 이미지에 최적의 조명을 제공하는 기술로써 어두운 위 내부를 밝게 하여 병변을 놓치지 않게 도와준다. Chroma는 자연스러운 색상인식을 변경시키지 않으면서 색상 대비를 향상시킨다. 이를 통해 점막의 구조는 더 명확하게 표현되고 다른 조직 간의 경계가 더욱 분명해질 수 있다. 마지막으로 spectra는 둘로 나뉘는데, spectra A는 적색 색조의 필터링을 제공하여 혈관의 녹색 색조와 대조를 이루게 하여 점막의 미세한 변화를 관찰할 수 있게 하고, spectra B는 적색을 줄이고 녹색-파랑 스펙트럼을 강화하여 미세혈관과 모세 혈관을 강조하게 된다. 칼스토츠 내시경은 확대를 하지 않고도 조기 위암의 경계구분선과 미세혈관 변화를 관찰할 수 있는 민감한 내시경이다. 아직까지 색소내시경이나 타사의 고해상도 내시경과 직접적으로 비교한 연구는 없어 앞으로의 연구가 기대된다(Fig. 4).
공초점 현미경 내시경
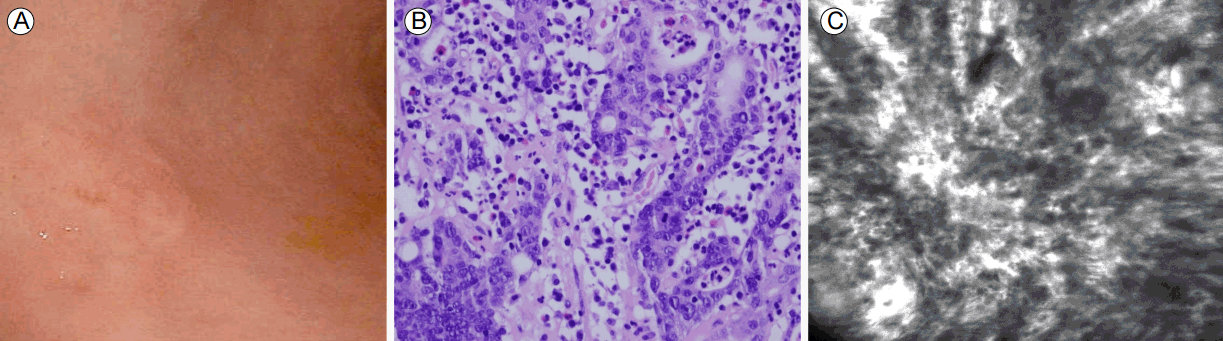
공초점 현미경 내시경은 형광 제제를 적용한 후 위장 점막의 현미경 검사를 할 수 있게 한다. 레이저 광원을 사용하여 원하는 파장의 형광 영상 및 초점이 맞은 상만을 획득할 수 있기 때문에 관찰하고자 하는 조직세포에 따라 파장을 달리하거나, 다양한 형광물질을 이용하여 조직내 형광물질에 적합한 파장대의 빛만을 조사(excitation)하고 형광물질의 발산(emission)을 유도한 후 다양한 종류의 필터를 선택해서 원하는 파장의 형광 영상만을 얻고, 최종적으로 조리개(pinhole)를 검출기 앞에 위치하여 초점이 맞은 상만을 받아 볼 수 있기 때문에 관찰하고 싶은 조직 세포를 고해상도로 볼 수 있다. 고해상도 영상을 얻기 위해 생체에 사용할 수 있는 형광 물질로는 정맥 주사로 투여되는 fluorescein과 국소적으로 도포할 수 있는 acriflavine을 사용하고 있으며 정맥투여 fluorescein은 조영제 주입 후 20초 미만에 동일하게 분포되기 시작하여 30분까지 효과가 지속되어 점막 표면부터 250 μm 심부 점막층까지 전체 면을 관찰할 수 있다(Fig. 5). 한 위암 관련 연구에 따르면, 공초점 현미경 내시경을 통한 조직검사의 정확도는 98%에 달하였다[6].
결 론
내시경 영상의 발전으로 광학적 진단이라는 용어가 나오고 있다. 앞서 소개한 영상증강 내시경 외에도 많은 고해상도 내시경들이 광학적 진단을 위해 연구되고 있다. 현재까지 연구 결과들을 종합해보면, 영상증강 내시경은 미세혈관과 구조의 관찰을 통해 암을 조기에 발견하는데 도움이 된다. 그러나 아직까지 분류가 명확하지 않고, 경험에 따른 관찰자 사이의 재현성이 부족한 실정이다. 특히 본고에서 소개한 BLI, OE, SPIES 등의 새롭게 연구되는 영상증강 내시경과 공초점 현미경 내시경은 아직 연구가 많이 부족하다. 향후 대규모 연구를 통해 영상증강 내시경을 통한 광학적 진단이 조기 위암 발견에 더욱 도움이 되기를 기대한다.





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






