 |
 |
| Korean J Med > Volume 89(6); 2015 > Article |
|
요약
방법:
2012년 1월에서 2014년 12월까지 본원 내분비내과에서 당뇨병 발생 고위험군으로 진단받은 환자 중, 연령 30-64세 및 당화혈색소 5.7-6.4%에 해당하는 125명을 선택하여 20세에서 내분비내과 방문 사이의 체중 변화량과 인슐린저항성 및 대사증후군의 각종 지표와의 연관성에 대해 분석하였다.
Abstract
Background/Aims:
The present study aimed to investigate the associations between a change in body weight from 20 years of age to the present with insulin resistance and several parameters of metabolic syndrome in individuals at an increased risk of diabetes.
Methods:
From patients with a diagnosis related to an increased risk of diabetes who were examined at our endocrinology clinic from January 2012 to December 2014, the present study recruited 125 individuals between 30 and 64 years of age with hemoglobin A1c levels from 5.7 to 6.4%. The change in body weight of each patient from 20 years of age to the present was retrospectively determined, and the associations of this change with insulin resistance and several parameters of metabolic syndrome were analyzed.
Results:
The average gain in body weight after 20 years of age was 11.3 kg and there was no significance difference between the male and female patients. The proportion of overweight and obese patients at 20 years of age was 14%, but was 74% at the time ofthe visits to our endocrinology clinic. A change in body weight was significantly correlated with body mass index, insulin resistance, and waist circumference. Additionally, as the tertile of change in body weight increased, fasting insulin levels, insulin resistance, and the prevalence of abdominal obesity significantly increased.
청년기는 넓게 13-14세부터 22-23세에 걸치는 시기를 가리키며[1], 전반의 성적 성숙이 두드러지는 시기를 사춘기라고도 한다. 이 중 골격의 크기는 청년기의 시작과 동시에 발달하며 20세에 발육이 정지된다. 이후 키는 성장이 되지 않으나, 서구화된 식습관과 운동량 부족, 바쁜 사회 생활 및 육아 등으로 인해 많은 성인에서 체중증가를 보인다. 체질량지수와 비만과 관련된 생활습관병 및 대사증후군의 유병률의 관련성은 잘 알려져 있다.
당뇨병 발생 고위험군(increased risk for diabetes)은 제2형 당뇨병은 물론 심혈관질환의 위험도를 예측하는 지표로 이용되고 있으며[2] 대사증후군의 구성요소에 속한다. 과거 ‘당뇨병전기’ 또는 ‘전당뇨병(prediabetes)’으로 불렸으나, 2010년도 미국당뇨병학회 표준진료 권고안[3]에서부터 ‘당뇨병 발생의 고위험군(categories of increased risk for diabetes)’으로 명칭이 변경되었고, 공복혈당장애, 내당능장애와 함께 당화혈색소(HbA1C) 수치 5.7-6.4%가 당뇨병 발병의 고위험군의 진단 기준에 포함되었다.
체중증가에 따른 비만은 혈당과 혈압을 상승시키고, 혈중 중성지방을 증가시키며 고밀도지질단백질을 감소시켜 결과적으로 대사증후군의 위험을 높이고, 심혈관질환의 위험도를 증가시킨다[4]. 당뇨병 발생 고위험군에게 생활습관교정을 시행한 연구들에서, 체중 감량, 식사요법 및 운동요법과 함께 체중 감량을 5-7% 이상 권장한 결과 연구 기간뿐만 아니라 연구 종료 후 7-10년 후에도 당뇨병 발생 위험에서 34-36%의 상대위험도 감소를 나타냈다[5-7]. 또한 여러 생활습관교정 치료 항목 중에서 체중감소가 다른 항목보다 큰 비중을 차지하였다[5]. 실제 체중 1 kg 감소당 당뇨병 발생의 위험성은 16% 정도 감소하였다[8]. 고혈압 환자와 고혈압 위험 환자에서 중등도의 체중감소로 의미 있는 혈압감소가 있었고, 체중이 5-10%만 줄어도 중성지방이 현저하게 줄고 고밀도지질단백질은 증가하는 효과가 있다[9]. 그러나 당뇨병 발생 고위험군에서 성인기에 얼마나 체중이 증가하였는지, 그리고 체중증가의 정도와 대사증후군 요소와의 관련성은 잘 알려져 있지 않다.
본 연구는 당뇨병 발생 고위험군을 대상으로 20세 때와의 체중 변화를 분석하면서 체질량지수의 변화 양상을 살펴보았고, 체중 변화량에 따른 인슐린저항성 및 대사증후군의 지표들과의 연관성을 분석하였다.
2012년 1월부터 2014년 12월까지 본원에서 당뇨병 발생 고위험군 관련 진단명(R730)이 입력된 459명 환자 중, 내분비내과를 방문한 423명을 대상으로 연구를 진행하였다. 20세 때의 체중이 기록되고 공복 인슐린이 측정된 자를 포함하였으며, 30-64세인 자 중에서 당화혈색소 5.6% 이하거나 6.5% 이상 해당되거나 경구당부하 검사가 시행된 대상자 중에서 당뇨병에 해당되는 경우를 제외하였고, 결론적으로 총 125명의 자료를 최종 분석에 이용하였다.
대상자들의 내분비내과 처음 방문 당시의 키, 체중 및 20세 때의 체중을 차트 기록을 통해 조사하였다. 내분비내과 방문 당시의 체중은 의료진이 측정 및 기록하였고, 20세 때의 체중은 과거 기억과 자기 보고에 의해 기록되었다. 체질량지수(body mass index, BMI)를 다음 공식으로 산출하였다(체질량지수 = 체중[kg]/신장[m2]). 20세 때의 BMI는 대상자들의 키가 20세 이후에 더 이상 변화하지 않았다는 가정 하에, 20세 때와 내분비내과 처음 방문 당시의 체중 변화량은 다음 공식으로 산출하였다(체중 변화량[ △weight] = 내분비내과 방문 당시의 체중 - 20세 때의 체중). 비만 판정은 체질량지수에 따른 비만도는 세계보건기구에서 정한 아시아-태평양 지역의 비만 기준에 따라 저체중(BMI < 18.5 kg/m2), 정상체중(BMI 18.5-23 kg/m2), 과체중(BMI 23.0-24.9 kg/m2), 비만(BMI ≥ 25.0 kg/m2)으로 분류하였다[10]. 허리둘레는 남자는 90 cm 이상, 여자는 85 cm 이상을 복부 비만으로 정의하였다[11].
과거력에서 고혈압과 이상지질혈증을 의사에게 진단받은 적이 있는 자 또는 약 복용 중인 자를 조사하였고, 흡연 유무는 비흡연자/현재 흡연자로 구분하였으며, 음주 섭취는 주 1회 이상 음주 여부로 분류하였다. 운동 여부는 주 150분 이상 시행 여부에 따라 구분하였다.
인슐린저항성의 지표로서는 homeostasis model assessment of insulin resistance (HOMA-IR)를 다음 공식으로 산출하였다(HOMA-Ir = 공복인슐린[μU/mL] × 공복혈당[mg/dL]/405) [12]. 계산 결과 HOMA-IR 값이 3.0 이상이면 인슐린저항성이 있는 것으로 보고[13] 체중 변화량 삼분위에 따라 분석하였다.
본원에서의공복혈당(fastingbloodglucose),당화혈색소(HbA1c)및혈청총 콜레스테롤(totalcholesterol),중성지방(triglyceride), 고밀도지질단백질(high density lipoprotein), 저밀도지질단백질(low density lipoprotein) 측정값을 조사하였다. 공복혈당은 hexokinase 방법으로, 당화혈색소는 turbidimetric inhibition immunoassay 방법으로, 혈청 인슐린 농도는 immunoradiometric assay (IRMA) 방법으로 측정하였다. 총 콜레스테롤은 enzymatic colorimetric assay 방법, 중성지방은 Glycerol-3-Phosphate Oxidase N-(3-sulfopropyl)-3-Methoxy-5-Methylaniline (GPO HMMPS) glycerol blanking 방법, 고밀도지질단백질과 저밀도지질단백질은 selective inhibition 방법으로 측정하였다.
수집된 자료는 IBM SPSS statistics 19.0 (IBM Co., Armonk, NY, USA)을 이용하여 통계 처리를 하였다. 연구 대상자의 임상 및 생화학적 특성은 mean ± standard deviation 또는 number (%)로 표시하였고, 대상자의 기본적인 특성을 먼저 남녀별로 구분하여 Chi-square test 및 student’s t-test로 비교검정하였으며, 20세 때의 체질량지수에 따른 비만도 및 현재의 비만도를 percentage (%)로 빈도 분석하였다. 체중 변화량과 연속 변수간의 관련성은 pearson correlation 분석을 이용하였고, 체중 변화량을 삼분위로 나누었을 때의 생화학적 특성은 one-way analysis of variance (ANOVA)로 분석하였으며, 체중 변화량 삼분위에 따른 인슐린저항성 여부는 binary logistic regression analysis를 이용하였다. 그리고 p 값이 0.05 미만일 때 통계적으로 유의한 것으로 평가하였다.
총 125명의 대상자 중 남자는 66명(52.8%), 여자는 59명(47.2%)로서, 평균 연령은 49세였다. 남성이 여성보다 허리둘레, 현재 체중과 BMI, 20세 때의 체중과 BMI, 키가 유의하게 높았고, 공복혈당, 공복인슐린 및 HOMA-IR 수치도 높았다. 고혈압과 이상지질혈증의 유병률은 차이가 없었으나, 남성이 여성보다 중성지방이 유의하게 높았고, 고밀도지질단백질 수치는 낮았다. 1주에 150분 이상의 운동 여부는 차이가 없었으나, 흡연력 및 음주력은 남성이 각 10배 및 17배 높았다. 그러나 현재와 20세 때의 체중 변화량은 남녀 각 11.2 kg, 11.3 kg으로 통계적으로 남녀 간의 유의한 차이는 없었다. 또한 20세 때의 체중에 비해 평균 20% 정도 대상자들의 체중이 증가한 상태로, 여자에서 평균 23.1% 증가하였고, 남자는 평균 18.6% 증가하였으나 남녀 간의 통계적 차이는 없었다(Table 1).
과거 20세 때 체질량지수를 기준으로 저체중, 정상체중, 과체중, 그리고 비만 분포는 남성에서 각 6명(3%), 44명(67%), 14명(21%), 2명(3%)였고, 여성에서 각 9명(15%), 49명(83%), 1명(2%), 0명(0%)이었다. 현재 체질량지수를 기준으로 한 저체중, 정상체중, 과체중, 그리고 비만 분포는 남성에서 각 0명(0%), 9명(14%), 20명(30%), 37명(56%), 여성에서 각 1명(2%), 23명(39%), 9명(15%), 26명(44%)으로 과체중, 비만 인구가 남녀 모두 증가하였다(Fig. 1). 남녀 구분 없이 전체 대상자를 분석하였을 때, 20세 때는 저체중, 정상체중, 과체중, 그리고 비만이 각 15명(12%), 93명(74%), 15명(12%), 2명(2%)으로 과체중 및 비만에 속했던 그룹은 전체의 14%였지만, 내분비내과 방문 시점에서 각 1명(1%), 31명(25%), 30명(24%) 및 63명(50%)으로 과체중 및 비만에 속하게 된 그룹은 전체의 74%로 증가하였다(Data not shown).
체중 변화량과 다른 지표 간의 상관성을 살펴보면, BMI와 강한 상관성(r = 0.741, p < 0.001)을 가졌고, HOMA-IR, 허리둘레, 중성지방과 상관성을 나타냈으나, 나이, 당화혈색소, 고밀도지질단백질과는 상관성을 가지지 않았다. 남녀별로 나누어 분석했을 때 양 군에서 체중 변화량은 HOMA-IR과 허리둘레의 상관성을 나타냈으나, 중성지방은 남성에서만 유의한 상관성을 보였다(Table 2). 그 외 총콜레스테롤, 저밀도지질단백질과도 상관성을 가지지 않았다(Data not shown).
Table 3은 체중 변화량을 삼분위로 나누었을 때, 체중 변화량과 임상 지표와의 관련성을 나타냈다. 체중 변화량 삼분위가 증가할수록 공복인슐린, HOMA-IR, 복부 비만율과 고혈압 유병률이 유의하게 증가하였다. 남녀별로 나누어 분석하였을 때 양 군에서 체중 변화량은 공복인슐린, HOMA-IR, 복부 비만율과 유의한 상관관계를 나타냈고, 고혈압 유병률과의 유의성은 여성에서만 관찰되었다. 이상지질혈증, 외래 방문 당시의 흡연 행태, 음주 및 운동 행태와는 무관하였다. 현재 체질량지수를 삼분위로 나누었을 때 체질량지수와 임상 지표와의 관련성도 동일한 유의성을 나타냈다(Data not shown).
인슐린저항성은 체중 변화량의 1삼분위에 비해 2삼분위 및 3삼분위는 odds ratio (95% confidence interval [CI])가 각 6.5 (1.6-26.4), 8.3 (2.0-33.7)로 유의하게 높았다(Fig. 2).
본 연구는 2012년에서 2014년까지 일개 대학병원에서의 차트 분석을 통해 당뇨병 발생 고위험군의 20세 이후의 체중 변화량 실태를 조사하였고, 임상학적 변수들과의 관련성을 살펴보았다. 연구의 대상은 30-64세 성인으로, 남녀 성인기 초기 체중보다 평균 11.3 kg 정도 증가하였고, 과체중 및 비만에 해당하는 비율은 5.3배 증가하였다. 허리둘레, 중성지방과 상관성을 가진 체중 증가량은 인슐린저항성과 깊은 연관성을 가지고 있었다.
당뇨병 발생 고위험군은 당뇨병으로 진행하기 쉬운 고위험의 시기이고, 이 시기부터 이미 당뇨병성 미세혈관합병증이 시작하며, 내피세포 기능장애 및 염증의 증가로 인한 죽상경화증의 촉진으로 심혈관질환을 포함한 대혈관합병증의 이환율 및 이로 인한 사망률이 증가할 수 있다[14]. 따라서 당뇨병 발생 고위험군에 속한 경우에도 당뇨병 발생을 예방하고 심혈관질환 위험성을 낮추기 위해 생활습관교정이 필요하다. 미국당뇨병협회(American Diabetes Association)의 제2형 당뇨병예방 권고안[15]에 따르면 공복혈당장애 혹은 내당능장애가 있는 경우 5-10%의 체중 감량과 매일 30분간의 중등도 운동과 같은 생활습관교정을 해야만 한다.
de Mutsert 등[16]은 이른 성인기의 비만과 이후의 체중 증가는 모두 중년기와 노인기의 남성의 주요 만성질환의 위험도를 크게 증가시켰다고 보고하였다. 39,909명의 남자 참여자들을 대상으로 성인기의 과도한 체중 증가를 살펴본 연구에서, 비만관련 만성질환(제2형 당뇨병, 심혈관계 질환 등 포함)은 성인 체중 변화가 없었던 군과 비교해서 체중이 2.5-4.9 kg 증가한 군에서 1.12배, 체중이 5-9.9 kg 증가한 군에서 위험도가 1.41배, 체중이 10-14.9 kg 증가한 군에서 1.72배, 체중이 15 kg 이상 증가한 군에서 위험도가 2.45배 증가하였다. 한편, Finnish Diabetes Prevention Study 연구[5]는 총 1,079명의 과체중 혹은 비만한 내당능장애 환자를 대상으로 생활습관을 교정하여 제2형 당뇨병 발생의 감소 효과를 관찰한 최초의 무작위 배정 연구로서, 이 연구에서 대조군과 비교하여 의미 있는 체중 감소가 있었던 실험군에서 공복혈당과 경구당부하 2시간 후 혈청 인슐린 농도, 당뇨병 발생률이 줄어들었을 뿐만 아니라 혈압과 중성지방도 감소했음이 확인되었다. 또한 3,234명의 당뇨병 발생 고위험군인 미국 성인을 대상으로 한 대규모 무작위 배정 임상연구였던 U.S. Diabetes Prevention Program [17]에서는, 치료 시작 1년 후 체중이 1 kg 감소될 때마다 당뇨병의 위험도는 16%씩 감소되었다.
본 연구는 20세 때 체중을 환자 자신의 기억에 의존하여 외래 의무기록지에 쓰인 값을 이용하였다. Rimm 등[18]은 123명을 대상으로 자기가 기록한 체중과 두 차례 의료인이 측정한 체중 사이에 pearson 상관 계수가 0.97로 높았으며, 자기 기록에 의한 경우가 1.06 kg (95% CI: 0.44, 1.71)으로 다소 적었으나 통계적으로 유의한 차이가 없음을 확인하였다. 다른 코호트에서도 기억 및 자기 보고에 의한 체중과 실제 측정된 체중을 비교할 때 높은 정확성을 보고하였다[19,20]. McAdams 등[21]은 20세 이상의 성인 10,639명을 대상으로 한 연구에서, 자기 기록에 의한 계산된 평균 BMI (25.07 kg/m2)와 실제 측정한 BMI (25.52 kg/m2) 사이에는 높은 상관성을 나타냈다. 본 연구에서 20세 때의 체중을 실제로 측정하지는 못했지만, 기억과 자기 보고에 의한 체중도 충분히 신뢰할 만하며 본 연구에서 20세 때 비만한 남성은 2명밖에 되지 않았다.
본 연구에서 체질량지수를 기준으로 성인기 초기에 과체중/비만은 17명 밖에 되지 않았던 것이, 당뇨병 발생 고위험군이 된 시점에는 93명이 과체중/비만으로 되면서 5.5배 증가하였다. 특히 성인기 초기에 대부분 정상 체중이었고 2%만이 비만이었으나, 성인기를 지나면서 당뇨병 발생 고위험군이 되었을 때는 절반이 비만에 속하였다. 2013년 국민건강영양조사 통계에 따르면 체질량지수를 기준으로 한 비만의 유병률은 19세 이상 성인 남자의 37.6%, 성인 여자의 25.1%로 평균 32%대를 유지하고 있다. 남성의 경우 30-50대까지 40%가 넘다가 60대에는 29.3%로 감소하는 데 반해 여자는 30대 17.9%, 40대 25.7%, 50대 33.7%, 60대 42.7%로 증가하였다. 평균 연령 49.2세인 본 연구의 비만 유병률은 50%로서, 국민건강영양조사 통계보다 매우 높았고 남성과 여성의 체질량지수 차이가 크지 않았다. 이것은 일반 성인이 아닌 당뇨병 발생 고위험군만을 대상으로 하였기 때문으로 보인다.
1988년 Reaven [22]이 포도당불내성, 고혈압, 이상지질혈증 등 심혈관계 위험인자들이 한 사람에게서 함께 잘 나타나는 현상의 원인이 인슐린저항성임을 주장하며, 이를 인슐린저항성증후군이라고 명명하였다. 이는 후에 비만을 포함하여 대사증후군이라는 개념으로 발전되었다. 대사증후군의 한 요소인 당뇨병 발생 고위험군의 알려진 주된 병인은 상대적인 인슐린 결핍과 인슐린저항성으로, 공복혈당장애는 간에서의 인슐린저항성에 따른 공복혈당상승에 의한 것이고, 내당능장애는 골격근에서의 인슐린저항성에 의한 것으로 보고 있다. 실제로 McAuley 등[23]은 식사, 운동요법 등 생활습관의 교정과 이에 따른 체중 감량이 인슐린저항성을 개선하는 효과가 있다고 보고하였다.
국내연구에 의하면, HOMA-IR은 2.3 이상이면 대사증후군이 동반될 확률이 높아지며 3.0 이상이면 인슐린저항성이 있다고 보고 있다[13]. 일본당뇨병학회에서는 1.6 이하이면 정상이라고 하고 있고, 2.5 이상이면 인슐린저항성을 의심하도록 권고하고 있다[24]. HOMA-IR 3 이상인 군을 인슐린저항성이 있다고 하였을 때, 비만을 불러오는 성인기 초기 이후의 체중 증가량 삼분위가 증가할수록 인슐린저항성이 급격히 증가하였다(Table 3, Fig. 2). 체중 변화량은 공복혈당이나 당화혈색소와 상관성이 없었다. 공복 혈당이 100-124 mg/dL로 제한되어 있던 본 연구에서 체중 증가량과 HOMA 구성 성분의 하나인 공복인슐린은 강한 상관성을 가지고 있었기 때문으로 판단된다(Table 3).
본 연구의 한계점으로는 다음과 같다. 첫째, 비록 자기 보고 방식에 의한 체중과 실제 측정된 기록 사이에 큰 차이가 없다는 논문들이 보고되고 있으나, 20세 때의 체중을 본인의 기억에 의존했다. 둘째, 모든 대상자에게 경구당부하 검사를 시행되지 못하였고, 당화혈색소와 공복혈당 값으로만 고위험군으로 진단된 대상자들이 있어 초기 당뇨병 환자가 일부 포함되었을 수가 있다. 셋째, 20세 때 및 현재의 생활 패턴을 보정하지 못하였다. 넷째, 본 연구는 오직 당뇨병 발생 고위험군의 체중증가를 대상으로 하였다. HOMA-IR이 남성에서 연령과 반비례하는 상관 관계를 보였는데, 이는 연령이 증가하면서 인슐린저항성과 당뇨병 유병률이 증가하여 고위험군이 상대적으로 줄어들었을 가능성이 있겠다. 이에 대해서는 추후 대조군 또는 당뇨병 환자군과의 비교가 필요하겠다. 다섯째, 본 연구에서는 대상자의 연령을 30-65세로 제한하였는데, 20세부터 현재까지의 체중 변화까지는 대상자들마다 기간에 상당한 차이가 있었다는 점이다.
결론적으로 당뇨병 발생 고위험군에서 20세 이후 평균 11.3 kg의 체중 증가를 가져오면서 체질량지수의 증가와 함께 비만의 유병률을 높였고, 체중 증가율은 인슐린저항성과 깊은 관련성을 가졌다. 성인기 초기부터 적극적인 체중 조절을 하여 체중증가를 최소화하는 것이 인슐린저항성을 병인으로 하는 대사증후군 예방에 큰 도움이 될 것임을 재확인할 수 있었다.
REFERENCES
1. Dishion TJ, Owen LD. A longitudinal analysis of friendship and substance use: bidirectional influence from adolescence to adulthood. Dev Psychol 2002;38:480–491.


2. Ford ES, Zhao G, Li C. Pre-diabetes and the risk for cardiovascular disease: a systematic review of the evidence. J Am Coll Cardiol 2010;55:1310–1317.


3. Summary of revisions for the 2010 Clinical Practice Recommendations. Diabetes Care 2010;33 Suppl 1:S3.

4. Poirier P, Giles TD, Bray GA, et al. Obesity and cardiovascular disease: pathophysiology, evaluation, and effect of weight loss: an update of the 1997 American Heart Association Scientific Statement on Obesity and Heart Fisease from the Obesity Committee of the Council on Nutrition, Physical Activity, and Metabolism. Circulation 2006;113:898–918.


5. Tuomilehto J, Lindström J, Eriksson J, et al. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med 2001;344:1343–1350.

6. Lindström J, Louheranta A, Mannelin M, et al. The Finnish Diabetes Prevention Study (DPS): lifestyle intervention and 3-year results on diet and physical activity. Diabetes Care 2003;26:3230–3236.


7. Knowler W, Barrett-Connor E, Fowler SE, et al. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 2002;346:393–403.

8. Hamman RF, Wing RR, Edelstein SL, et al. Effect of weight Loss with lifestyle intervention on risk of diabetes. Diabetes Care 2006;29:2102–2107.



9. Wing RR, Lang W, Wadden TA, et al. Benefits of modest weight loss in improving cardiovascular risk factors in overweight and obese individuals with type 2 diabetes. Diabetes Care 2011;34:1481–1486.



10. World Health Organization, Western Pacific Region. The Asia-Pacific perspective: redefining obesity and its treatment. [Internet]. Sydney (AUS): Health Communications, c2000 [cited 2015 Aug 10]. Available from: http://www.wpro.who.int/nutrition/documents/docs/Redefiningobesity.pdf
11. Lee SY, Park HS, Kim DJ, et al. Appropriate waist circumference cutoff points for central obesity in Korean adults. Diabetes Res Clin Pract 2007;75:72–80.


12. Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985;28:412–419.


13. Lee S, Choi S, Kim HJ, et al. Cutoff values of surrogate measures of insulin resistance for metabolic syndrome in Korean non-diabetic adults. J Korean Med Sci 2006;21:695–700.



15. Nathan DM, Davidson MB, DeFronzo RA, et al. Impaired fasting glucose and glucose tolerance; implications for care. Diabetes Care 2007;30:753–759.


16. de Mutsert R, Sun Q, Willett WC, Hu FB, van Dam RM. Overweight in early adulthood, adult weight change, and risk of type 2 diabetes, cardiovascular diseases, and certain cancers in men: a cohort study. Am J Epidemiol 2014;179:1353–1365.



17. Hamman RF, Wing RR, Edelstein SL, et al. Effect of weight loss with lifestyle intervention on risk of diabetes. Diabetes Care 2006;29:2102–2107.



18. Rimm EB, Stampfer MJ, Colditz GA, Chute CG, Litin LB, Willett WC. Validity of self-reported waist and hip circumferences in men and women. Epidemiology 1990;1:466–473.


19. Tamakoshi K, Yatsuya H, Kondo T, et al. The accuracy of long-term recall of past body weight in Japanese adult men. Int J Obes Relat Metab Disord 2003;27:247–252.


20. Perry GS, Byers TE, Mokdad AH, Serdula MK, Williamson DF. The validity of self-reports of past body weights by U.S. adults. Epidemiology 1995;6:61–66.


21. McAdams MA, Van Dam RM, Hu FB. Comparison of self-reported and measured BMI as correlates of disease markers in US adults. Obesity (Silver Spring) 2007;15:188–196.


22. Reaven GM. Banting lecture 1988. Role of insulin resistance in human disease. Diabetes 1988;37:1595–1607.


23. McAuley KA, Williams SM, Mann JI, et al. Intensive lifestyle changes are necessary to improve insulin sensitivity: a randomized controlled trial. Diabetes Care 2002;25:445–452.


24. Japan Diabetes Society. Treatment Guide for Diabetes 2010. Tokyo: Bunkodo, 2010.
Change in percent distribution according to body mass index from 20 years of age to the present.
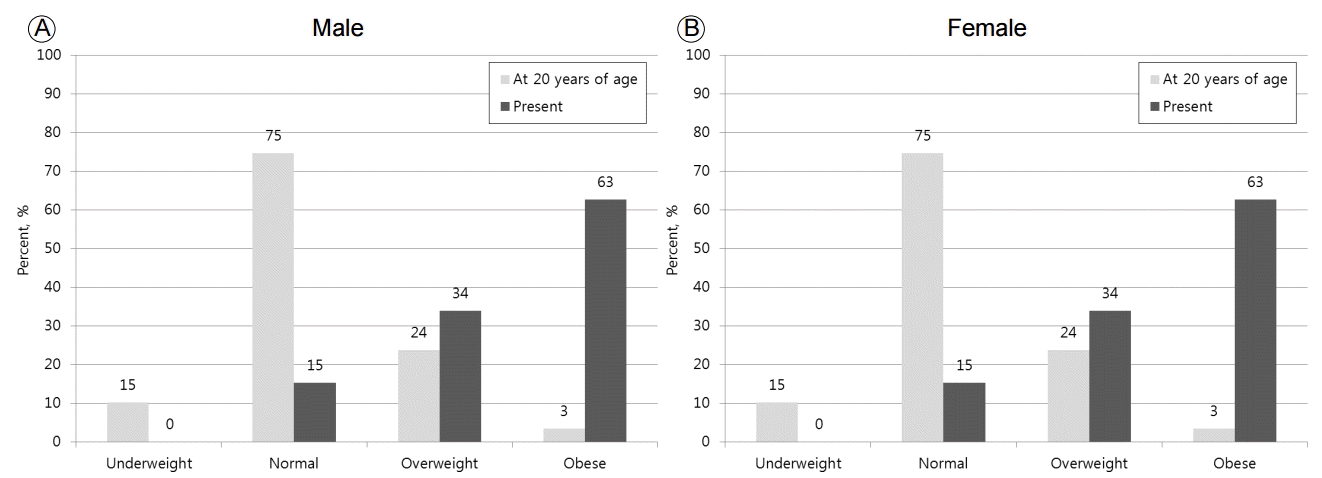
Figure 1.
Odds ratios (95% CI) for insulin resistance according to the tertile of weight change from 20 years of age to the present. The presence of insulin resistance was defined as a HOMA-IR level ≥ 3. CI, confidence interval; HOMA-IR, homeostasis model assessment of insulin resistance; T, tertile. ap < 0.05. b(weight at present) - (weight at 20 years of age).
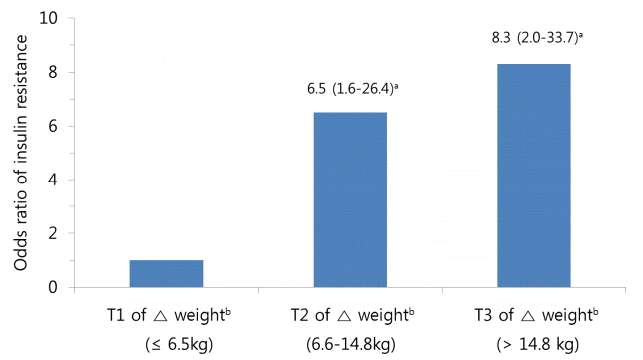
Figure 2.
Table 1.
Characteristics of study subjects
| Variables | Total | Male | Female | p value |
|---|---|---|---|---|
| Number | 125 | 66 (52.8) | 59 (47.2) | |
| Age, yr | 49.2 ± 7.7 | 47.6 ± 7.2 | 50.9 ± 8.0 | 0.019 |
| Waist, cm | 86.4 ± 7.8 | 89.0 ± 7.1 | 83.5 ± 7.6 | < 0.001 |
| Weight, kg | 67.6 ± 10.7 | 73.7 ± 9.5 | 61.0 ± 7.9 | < 0.001 |
| Weight at 20 years of age, kg | 56.3 ± 8.9 | 62.3 ± 7.7 | 49.7 ± 4.5 | < 0.001 |
| △ Weighta, kg | 11.3 ± 7.2 | 11.2 ± 7.1 | 11.3 ± 7.4 | 0.961 |
| Ratio of weight changeb, % | 20.1 ± 14.4 | 18.6 ± 12.9 | 23.1 ± 15.7 | 0.083 |
| Height, cm | 164.2 ± 7.8 | 169.7 ± 5.6 | 158.0 ± 4.8 | < 0.001 |
| BMI, kg/m2 | 25.0 ± 2.8 | 25.5 ± 2.5 | 24.5 ± 3.1 | 0.047 |
| BMI at 20 years of age, kg/m2 | 20.8 ± 2.0 | 21.6 ± 2.2 | 19.9 ± 1.4 | < 0.001 |
| Change in BMI, kg/m2 | 4.2 ± 2.7 | 3.9 ± 2.4 | 4.5 ± 3.0 | 0.173 |
| FBS, mg/dL | 113.0 ± 6.6 | 115.0 ± 6.9 | 110.8 ± 5.5 | < 0.001 |
| HbA1c, % | 5.9 ± 0.2 | 5.8 ± 0.2 | 5.9 ± 0.2 | 0.201 |
| TC, mg/dL | 196.7 ± 29.6 | 195.7 ± 29.9 | 198.8 ± 30.0 | 0.461 |
| TG, mg/dL | 131.0 ± 60.9 | 152.9 ± 70.3 | 108.0 ± 38.1 | < 0.001 |
| HDL, mg/dL | 50.4 ± 10.4 | 46.5 ± 8.2 | 54.8 ± 10.9 | < 0.001 |
| LDL, mg/dL | 117.3 ± 25.4 | 117.7 ± 26.9 | 117.3 ± 23.9 | 0.992 |
| Insulin, IU/mL | 9.6 ± 4.3 | 10.4 ± 5.3 | 8.6 ± 2.7 | 0.014 |
| HOMA-IR | 2.7 ± 1.2 | 3.0 ± 1.5 | 2.4 ± 0.8 | 0.005 |
| Presence of hypertension | 24 (19.2) | 10 (15.2) | 14 (23.7) | 0.224 |
| Presence of dyslipidemia | 18 (14.4) | 8 (12.1) | 10 (16.9) | 0.443 |
| Smoking | 25 (20.0) | 23 (34.8) | 2 (3.4) | < 0.001 |
| Alcohol intake (≥ 1/wk) | 20 (16.0) | 19 (28.8) | 1 (1.7) | < 0.001 |
| Exercise (≥ 150 min/wk) | 60 (48.0) | 33 (50.0) | 27 (45.8) | 0.636 |
Table 2.
Correlation between a change in weight and continuous variables
| Variables | △ Weighta | Age | HOMA-IR | Waist r (p value) | HbA1c | TG |
|---|---|---|---|---|---|---|
| Age | ||||||
| Total | 0.045 (0.615) | |||||
| Male | -0.077 (0.537) | |||||
| Female | 0.163 (0.217) | |||||
| HOMA-IR | ||||||
| Total | 0.455 (< 0.001) | -0.317 (< 0.001) | ||||
| Male | 0.357 (0.003) | -0.431 (< 0.001) | ||||
| Female | 0.400 (0.002) | -0.042 (0.751) | ||||
| Waist | ||||||
| Total | 0.631 (< 0.001) | 0.071 (0.427) | 0.455 (< 0.001) | |||
| Male | 0.660 (< 0.001) | -0.242 (0.051) | 0.419 (< 0.001) | |||
| Female | 0.683 (< 0.001) | 0.248 (0.059) | 0.449 (< 0.001) | |||
| HbA1c | ||||||
| Total | 0.167 (0.061) | 0.103 (0.252) | 0.109 (0.225) | 0.049 (0.584) | ||
| Male | 0.117 (0.349) | -0.107 (0.394) | 0.131 (0.294) | -0.010 (0.937) | ||
| Female | 0.220 (0.094) | 0.242 (0.065) | 0.181 (0.169) | 0.183 (0.165) | ||
| TG | ||||||
| Total | 0.284 (< 0.001) | -0.128 (0.154) | 0.299 (< 0.001) | 0.343 (< 0.001) | -0.097 (0.279) | |
| Male | 0.457 (< 0.001) | -0.139 (0.266) | 0.280 (0.023) | 0.416 (< 0.001) | -0.074 (0.555) | |
| Female | 0.015 (0.908) | 0.126 (0.342) | 0.052 (0.695) | -0.067 (0.614) | -0.025 (0.852) | |
| HDL | ||||||
| Total | -0.113 (0.206) | 0.151 (0.091) | -0.249 (0.005) | -0.287 (< 0.001) | 0.125 (0.164) | -0.381 (< 0.001) |
| Male | -0.210 (0.090) | 0.122 (0.329) | -0.265 (0.031) | -0.258 (0.037) | 0.082 (0.511) | -0.319 (0.009) |
| Female | -0.051 (0.702) | 0.034 (0.796) | -0.064 (0.628) | -0.099 (0.456) | 0.080 (0.546) | -0.275 (0.035) |
Table 3.
Characteristics and metabolic parameters according to tertile of change in weighta



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




