ņä£ ļĪĀ
ļ¦īņä▒ ņŗĀņן ņ¦łĒÖś ĒÖśņ×ÉņŚÉņä£ ļÅÖļ░śļÉśļŖö ļ╣łĒśłņØś ņżæņÜöĒĢ£ ņøÉņØĖņØĆ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ņØś ņāØņä▒ Ļ░ÉņåīņØ┤ļ®░, ņĀüņĀłĒĢ£ ņ×¼ņĪ░ĒĢ® ņØĖ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ņ╣śļŻīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ļ╣łĒśłņØ┤ ņ¦ĆņåŹļÉśļŖö Ļ▓ĮņÜ░ņŚÉļŖö ņ▓ĀļČä Ļ▓░ĒĢŹ, ļ¦īņä▒ņĀüņØĖ ņČ£Ēśł, Ļ░ÉņŚ╝ ļśÉļŖö ņŚ╝ņ”Øņä▒ ņ¦łĒÖś ļ░Å ļČĆĻ░æņāüņäĀĻĖ░ļŖź ĒĢŁņ¦äņ”Ø ļō▒ņØä ņÜ░ņäĀņĀüņ£╝ļĪ£ Ļ░Éļ│äĒĢ┤ņĢ╝ ĒĢ£ļŗż[1]. ĻĘĖļ¤¼ļéś ņĄ£ĻĘ╝ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ņ╣śļŻīņŚÉ ņĀĆĒĢŁņä▒ņØä ļ│┤ņØ┤ļŖö ĒÖśņ×ÉņŚÉņä£ Ļ│©ņłśņŚÉņä£ ļ░▒ĒśłĻĄ¼ņÖĆ ĒśłņåīĒīÉņØś ņāØņä▒ņØĆ ņĀĢņāüņØ┤ļéś ņäĀĒāØņĀüņ£╝ļĪ£ ņĀüĒśłĻĄ¼ņØś ņāØņä▒ļČĆņĀäņØ┤ ļ░£ņāØĒĢśņŚ¼ ņŗ¼ĒĢ£ ļ╣łĒśłņØä ļ│┤ņØ┤ļŖö ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ĒĢŁņ▓┤ņŚÉ ņØśĒĢ£ ņł£ņłś ņĀüĒśłĻĄ¼ ļ¼┤ĒśĢņä▒ņ”ØņØ┤ ļō£ļ¼╝Ļ▓ī ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[2-6].
ņĀĆņ×ÉļōżņØĆ ņĪ░ĻĖ░ņ£äņĢöņØä ņ¦äļŗ©ļ░øņĢśņ£╝ļéś ņ╣śļŻīļź╝ Ļ▒░ļČĆĒĢśĻ│Ā ņ¦Ćļé┤ļŹś ĒÖśņ×ÉĻ░Ć ņĀüņĀłĒĢ£ ņ×¼ņĪ░ĒĢ® ņØĖ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ņ╣śļŻīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņ╣śļŻīņŚÉ ņĀĆĒĢŁņä▒ņØä ļ│┤ņŚ¼ ņŗ£Ē¢ēĒĢ£ ņ£äļé┤ņŗ£Ļ▓Į ņåīĻ▓¼ņŚÉņä£ ļ¦īņä▒ņĀüņØĖ ņ£äņĢö ņČ£Ēśł ņåīĻ▓¼ņØ┤ ņØśņŗ¼ļÉśņ¢┤ ņłśņłĀņØä ņŗ£Ē¢ēĒĢśņśĆņ£╝ļéś ļ╣łĒśłņØ┤ ņ¦ĆņåŹļÉśņ¢┤ ņĄ£ņóģņĀüņ£╝ļĪ£ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ĒĢŁņ▓┤ ņ¢æņä▒ ņł£ņłś ņĀüĒśłĻĄ¼ ļ¼┤ĒśĢņä▒ņ”Øņ£╝ļĪ£ ĒÖĢņ¦äĒĢ£ ĒÖśņ×Éļź╝ Ļ▓ĮĒŚśĒĢśņśĆĻĖ░ņŚÉ ļ¼ĖĒŚīĻ│Āņ░░Ļ│╝ ĒĢ©Ļ╗ś ļ│┤Ļ│ĀĒĢśļŖö ļ░öņØ┤ļŗż.
ņ”Ø ļĪĆ
ĒÖś ņ×É: Ļ╣ĆŌŚŗŌŚŗ, ļé©ņ×É 67ņäĖ
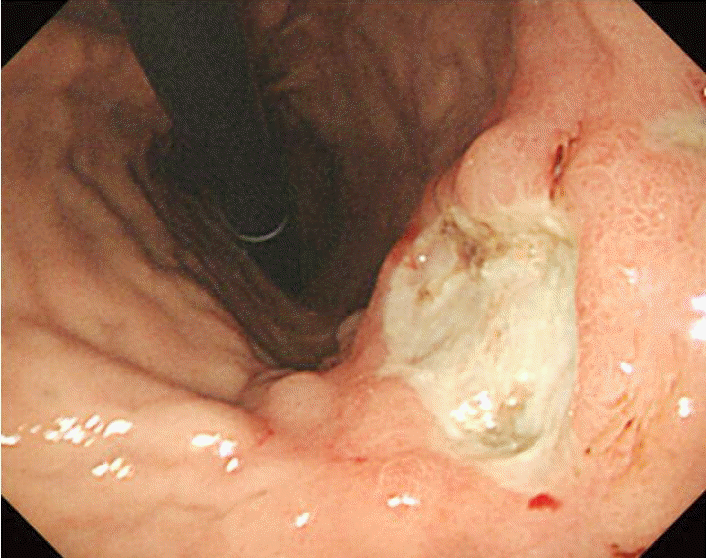
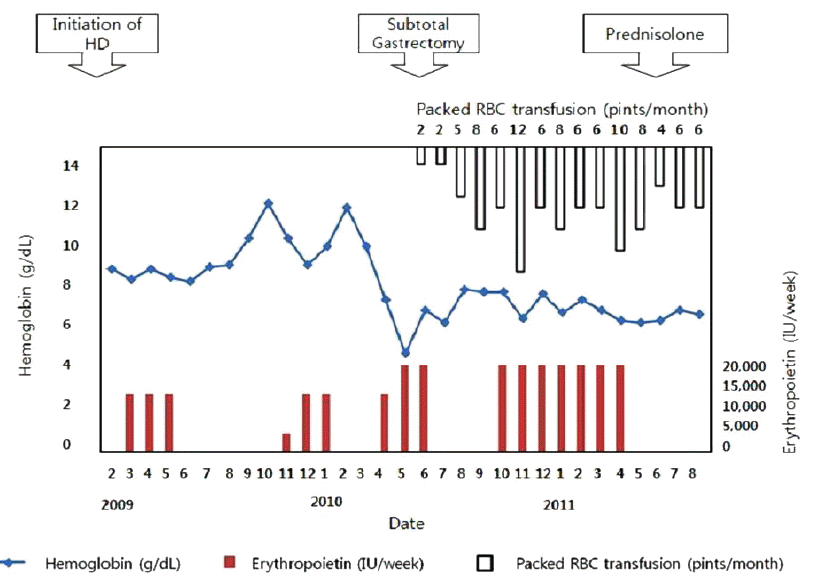
Ļ│╝Ļ▒░ļĀź ļ░Å Ēśäļ│æļĀź: ĒÖśņ×ÉļŖö ļŗ╣ļć©ļ│æņŚÉ ņØśĒĢ£ ļ¦ÉĻĖ░ ņŗĀļČĆņĀäņ£╝ļĪ£ 2ļģä ņĀäļČĆĒä░ ĒśłņĢĪ Ēł¼ņäØņØä ņŗ£Ē¢ēļ░øņĢśņ£╝ļ®░ Ēł¼ņäØĻ│╝ ļÅÖņŗ£ņŚÉ ņĪ░ĻĖ░ ņ£äņĢöņØä ņ¦äļŗ©ļ░øņĢśņ£╝ļéś ņ╣śļŻīļź╝ Ļ▒░ļČĆĒĢśļ®░ ņ¦Ćļāłļŗż. ņ▓ĀļČäņĀ£ņÖĆ ņ×¼ņĪ░ĒĢ® ņØĖ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤(Epokine┬«: recombinant human erythropoietin alfa)ņØä ņŻ╝ļŗ╣ 12,000 IU ņØ┤ĒĢśļĪ£ Ēö╝ĒĢśņŻ╝ņé¼ Ēł¼ņŚ¼ĒĢśļ®┤ņä£ Ēśłņāēņåī 10-12 g/dL ņé¼ņØ┤ļź╝ ņ£Āņ¦ĆĒĢśļŹś ņżæ ņ×ģņøÉ 6Ļ░£ņøö ņĀä Ļ░æņ×æņŖżļ¤ĮĻ▓ī ĒśłņāēņåīĻ░Ć 4.8 g/dLĻ╣īņ¦Ć Ļ░ÉņåīĒĢśņśĆļŗż. Ļ░æņ×ÉĻĖ░ ņĢģĒÖöļÉ£ ļ╣łĒśłņØś ņøÉņØĖņØä ņ░ŠĻĖ░ ņ£äĒĢ£ ņ£äļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ņŚÉņä£ ĻĖēņä▒ ņČ£ĒśłņØś ņåīĻ▓¼ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśņ£╝ļéś ļ░£ņĀüņä▒ ņ£äņŚ╝Ļ│╝ ĻČżņ¢æņØä ļÅÖļ░śĒĢ£ ņ£äņĢö ļ│æļ│ĆņØ┤ ĒÖĢņØĖļÉśņŚłņ£╝ļ®░ ļīĆļ│Ć ņ×ĀĒśł Ļ▓Ćņé¼ ņ¢æņä▒ņØ┤ņŚłļŗż(Fig. 1). ņ╗┤Ēō©Ēä░ ņĀäņé░ĒÖö ņ┤¼ņśüņāüņŚÉņä£ ņŻ╝ņ£äņØś ņ×äĒīīņäĀ ņ╣©ļ▓öņØ┤ļéś ļŗżļźĖ ņןĻĖ░ļĪ£ņØś ņĀäņØ┤ļŖö ņŚåņŚłļŗż. ņ£äņĢöņŚÉ ņØśĒĢ£ ļ¦īņä▒ ņ£äņČ£ĒśłļĪ£ ņØĖĒĢ£ ļ╣łĒśłļĪ£ ĒīÉļŗ©ļÉśņ¢┤ ļČĆļČäņĀü ņ£äņĀłņĀ£ņłĀ ļ░Å Billoth II ļ¼ĖĒĢ®ņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ĻĘĖļ¤¼ļéś ņłśņłĀ ņØ┤ĒøäņŚÉļÅä ļ╣łĒśłņØ┤ ĻĄÉņĀĢļÉśņ¦Ć ņĢŖņĢśĻ│Ā ņ×¼ņĪ░ĒĢ® ņØĖ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ņØä ņŻ╝ļŗ╣ 18,000 IUĻ╣īņ¦Ć ņ”Øļ¤ē Ēł¼ņŚ¼ĒĢśņśĆņ¦Ćļ¦ī ļ╣łĒśłņØ┤ ņ¦ĆņåŹļÉśņŚłļŗż. ĒĢ£ ļŗ¼ņŚÉ 6 pint ņØ┤ņāüņØś ļåŹņČĢ ņĀüĒśłĻĄ¼ ņłśĒśłņØä ņŗ£Ē¢ēĒĢśņŚ¼ļÅä Ēśłņāēņåī 10.0 g/dLļź╝ ņ£Āņ¦ĆĒĢĀ ņłś ņŚåņ¢┤ ļ╣łĒśłņØś ņøÉņØĖņØä Ļ░Éļ│äĒĢśĻĖ░ ņ£äĒĢ┤ ņ×ģņøÉĒĢśņśĆļŗż.
ņ¦äņ░░ ņåīĻ▓¼: ņ×ģņøÉ ļŗ╣ņŗ£ ĒśłņĢĢņØĆ 150/80 mmHg, ļ¦źļ░Ģņłś 80ĒÜī/ļČä, ĒśĖĒØĪņłś 20ĒÜī/ļČä, ņ▓┤ņś© 36.6Ōäā, ņ▓┤ņżæ 60.5 kgņØ┤ņŚłļŗż. ļ¦īņä▒ ļ│æņāēņåīĻ▓¼ņØä ļ│┤ņśĆņ£╝ļ®░ Ļ▓░ļ¦ēņØĆ ņ░Įļ░▒ĒĢśņśĆļŗż. ļ│ĄļČĆņŚÉņä£ Ļ░ä, ļ╣äņן ļ░Å ļ╣äņĀĢņāüņĀüņØĖ ņóģĻ┤┤ļŖö ļ¦īņĀĖņ¦Ćņ¦Ć ņĢŖņĢśļŗż.
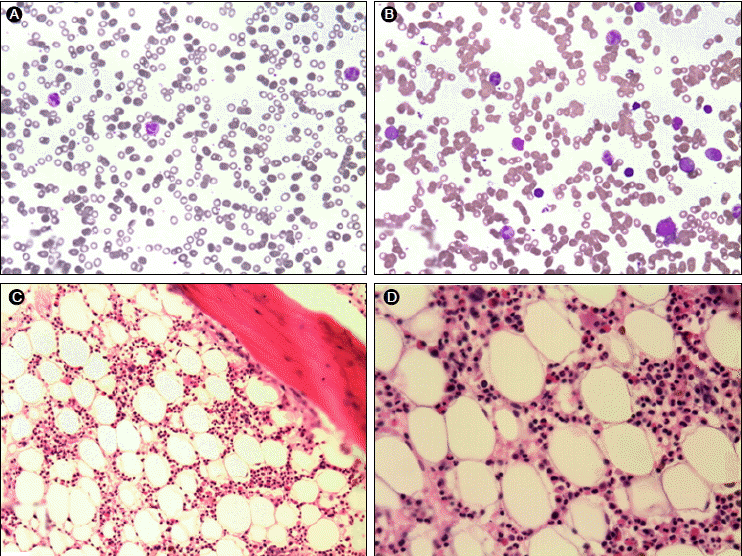
Ļ▓Ćņé¼ ņåīĻ▓¼: ĒśłņāēņåīļŖö 7.2 g/dL, ņĀüĒśłĻĄ¼ ņÜ®ņĀüļźĀ 20.5%, ļ░▒ĒśłĻĄ¼ 7,030/mm3, ĒśłņåīĒīÉ 123,000/mm3, ļ¦Øņāü ņĀüĒśłĻĄ¼ļŖö 0.1%ņśĆĻ│Ā ļ¦Éņ┤ł ĒśłņĢĪ ļÅäļ¦É Ļ▓Ćņé¼ļŖö ņĀĢņĀüĒśłĻĄ¼ņä▒ ņĀĢņāēņåīņä▒ ļ╣łĒśłĻ│╝ ĒĢ©Ļ╗ś ĒśłņåīĒīÉ Ļ░Éņåīņ”ØņØ┤ņŚłļŗż(Fig. 2A). Ēśłņ▓Ł ņ▓ĀņØĆ 163 ug/dL, ņ┤Øņ▓ĀļČäĻ▓░ĒĢ®ļŖźņØĆ 197 ug/dLņØ┤ņŚłĻ│Ā ferritinņØĆ 2256 ng/dLņØ┤ņŚłļŗż. Ļ░äņĀæ ļ░Å ņ¦üņĀæ ņ┐ĀņøĆņŖż ĒĢŁĻĖĆļĪ£ļČłļ”░ Ļ▓Ćņé¼ļŖö ļ¬©ļæÉ ņØīņä▒ņØ┤ņŚłņ£╝ļ®░ ņ£Āņé░ĒāłņłśņåīĒÜ©ņåīļŖö 175 IU/LņØ┤ņŚłļŗż. ļ╣äĒāĆļ»╝ B12ļŖö 761.7 pg/mL, ņŚĮņé░ņØĆ 15.42 ng/mLņ£╝ļĪ£ ņĀĢņāüņØ┤ņŚłļŗż. ņ╣╝ņŖśņØĆ 8.9 mg/dL, ņØĖņØĆ 3.2 mg/dLņØ┤ņŚłņ£╝ļ®░ ļČĆĻ░æņāüņäĀ ĒśĖļź┤ļ¬¼ņØĆ 101.2 pg/mLņØ┤ņŚłļŗż. ņ£äļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ņŚÉņä£ ĻČżņ¢æ Ēś╣ņØĆ ņóģņ¢æ ņ×¼ļ░£ņØś ĻĘ╝Ļ▒░ļŖö ņŚåņŚłĻ│Ā ļīĆņןļé┤ņŗ£Ļ▓ĮņŚÉņä£ļÅä ņČ£Ēśł ņåīĻ▓¼ņØĆ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. Ļ│©ņłś ņ▓£ņ×Éļź╝ ņŗ£Ē¢ēĒĢśņśĆĻ│Ā Ļ│©ņłś ņĪ░ņ¦üĻ▓Ćņé¼ņŚÉņä£ Ļ▒░ļīĆ ĒĢĄņäĖĒż ļ░Å ļ░▒ĒśłĻĄ¼ ĒśĢņä▒ņØĆ ņĀĢņāüņØ┤ņŚłņ£╝ļéś ņĀüĒśłĻĄ¼Ļ│ä ņĀäĻĄ¼ ņäĖĒżĻ░Ć Ļ▒░ņØś Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖļŖö ņł£ņłś ņĀüĒśłĻĄ¼ ļ¼┤ĒśĢņä▒ņ”Ø ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż(Fig. 2B, 2C and 2D). ņł£ņłś ņĀüĒśłĻĄ¼ ļ¼┤ĒśĢņä▒ņ”ØņØś ņøÉņØĖ Ļ░Éļ│äņØä ņ£äĒĢ┤ ņŗ£Ē¢ēĒĢ£ ĒØēļČĆ ņĀäņé░ĒÖö ļŗ©ņĖĄ ņ┤¼ņśüņŚÉņä£ ĒØēņäĀņóģņØś ņ”ØĻ▒░ļŖö ņŚåņŚłĻ│Ā Human immunodeficiency virus ĒĢŁņ▓┤ļŖö ņØīņä▒ņØ┤ņŚłĻ│Ā, Parvovirus B19, Ebstein-Barr virus ļ░Å CytomegalovirusņØś IgMņØĆ ļ¬©ļæÉ ņØīņä▒ņØ┤ņŚłļŗż. ĒĢŁĒĢĄĒĢŁņ▓┤ ļ░Å ļ®┤ņŚŁĻĖĆļĪ£ļČłļ”░ ņłśņ╣śņÖĆ ļ│┤ņ▓┤ ņłśņ╣ś ņŚŁņŗ£ ņĀĢņāü ļ▓öņ£äņśĆļŗż. ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ņØĆ 14.6 mIU/mLļĪ£ ņĀĢņāü ļ▓öņ£äņśĆņ£╝ļéś ļ░®ņé¼ņäĀ ļ®┤ņŚŁņ╣©Ļ░Ģļ▓ĢņØä ĒåĄĒĢ£ Ēśłņ▓Ł ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ņŚÉ ļīĆĒĢ£ ĒĢŁņ▓┤Ļ░Ć 15420.8 cpm (ļīĆņĪ░ĻĄ░ 369.3 cpm ņØ┤ĒĢś)ņ£╝ļĪ£ 40ļ░░ ņØ┤ņāü ņāüņŖ╣ļÉ£ ņ¢æņä▒ņ£╝ļĪ£ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ĒĢŁņ▓┤ ņ¢æņä▒ ņł£ņłś ņĀüĒśłĻĄ¼ ļ¼┤ĒśĢņä▒ņ”Øņ£╝ļĪ£ ĒÖĢņ¦äĒĢśņśĆļŗż.
ņ╣śļŻī ļ░Å Ļ▓ĮĻ│╝: ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ĒĢŁņ▓┤Ļ░Ć Ļ▓ĆņČ£ļÉ£ ņØ┤ĒøäņŚÉ ņ×¼ņĪ░ĒĢ® ņØĖ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ņŻ╝ņé¼ļŖö ņżæļŗ©ĒĢśņśĆņ£╝ļéś ļ╣łĒśłņØ┤ ĒśĖņĀäļÉśņ¦Ć ņĢŖņĢśĻ│Ā, ņØ┤Ēøä Ļ│ĀņÜ®ļ¤ēņØś ņŖżĒģīļĪ£ņØ┤ļō£ ņÜöļ▓ĢņØä ņŗ£ņ×æĒĢśņśĆņ£╝ļéś ņ£äņןĻ┤Ć ņČ£Ēśł ļ░Å ĒÅÉļĀ┤ ļō▒ņØś ļČĆņ×æņÜ®ņØ┤ ļ░£ņāØĒĢśņŚ¼ ņżæļŗ©ĒĢ£ Ēøä ļåŹņČĢ ņĀüĒśłĻĄ¼ļź╝ ļ¦żļŗ¼ 6 pint ņØ┤ņāü ņłśĒśłĒĢśņŚ¼ ļ╣łĒśłņØä ĻĄÉņĀĢĒĢśĻ│Ā ņ׳ļŗż(Fig. 3).
Ļ│Ā ņ░░
ļ¦īņä▒ ņŗĀņ¦łĒÖśņŚÉņä£ ļ╣łĒśłņØś Ļ░Ćņן ņżæņÜöĒĢ£ ņøÉņØĖņØĆ ņŗĀņןņŚÉņä£ņØś ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ņØś ņāØņé░ Ļ░ÉņåīņØ┤ļ®░, ņ×¼ņĪ░ĒĢ® ņØĖ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ņØĆ ņŗĀņ¦łĒÖś ĒÖśņ×ÉņØś ļ╣łĒśł ņ╣śļŻīņŚÉ ņ׳ņ¢┤ņä£ Ļ░Ćņן ĒÜ©Ļ│╝ņĀüņØĖ ņ╣śļŻīņĀ£ļĪ£ ņØ┤ņÜ®ļÉśĻ│Ā ņ׳ļŗż[3,4]. ĻĘĖļ¤¼ļéś ņØ╝ļČĆņŚÉņä£ļŖö ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ņ╣śļŻīņŚÉ ļ░śņØæņØ┤ ņĀĆĒĢśļÉ£ Ļ▓ĮņÜ░Ļ░Ć ņ׳ņ£╝ļ®░ ņØ┤ļŖö ĒÖśņ×ÉņØś ļåÆņØĆ ņé¼ļ¦ØļźĀĻ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ļŗż[7]. ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ņĀĆĒĢŁņä▒ ļ╣łĒśłņØĆ ņØ╝ņŻ╝ņØ╝ņŚÉ ņĀĢļ¦źņ£╝ļĪ£ 450 U/kg ņØ┤ņāü ļśÉļŖö Ēö╝ĒĢśļĪ£ 300 U/kg ņØ┤ņāüņØś ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ņŻ╝ņé¼Ļ░Ć ĒĢäņÜöĒĢ£ Ļ▓ĮņÜ░ļĪ£, ļ¦īņä▒ņĀüņØĖ ņČ£ĒśłņØ┤ļéś ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ņŻ╝ņé¼ņŚÉ ņØśĒĢ£ ņĪ░Ēśł ļ░śņØæņØś ĒĢŁņ¦äņ£╝ļĪ£ ņĀĆņןņ▓ĀņØ┤ Ļ│ĀĻ░łļÉśņ¢┤ ļ░£ņāØĒĢśļŖö ņ▓ĀļČä Ļ▓░ĒĢŹņØ┤ Ļ░Ćņן ĒØöĒĢ£ Ļ▓āņ£╝ļĪ£ ļÉśņ¢┤ ņ׳ņ¢┤ ņÜ░ņäĀņĀüņ£╝ļĪ£ Ļ░Éļ│äĒĢ┤ņĢ╝ ĒĢ£ļŗż[4,8]. ļ│Ė ņ”ØļĪĆ ĒÖśņ×ÉņØś Ļ▓ĮņÜ░ ņ×¼ņĪ░ĒĢ® ņØĖ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ņØä ņØ╝ņŻ╝ņØ╝ņŚÉ 300 U/kg Ēö╝ĒĢś ņŻ╝ņé¼ĒĢśņśĆņ£╝ļéś ņłśĒśł ņŚåņØ┤ļŖö ļ¬®Ēæ£ Ēśłņāēņåīļź╝ ņ£Āņ¦ĆĒĢĀ ņłś ņŚåņŚłņ£╝ļ»ĆļĪ£ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ņĀĆĒĢŁņä▒ ļ╣łĒśłļĪ£ ņ¦äļŗ©ĒĢĀ ņłś ņ׳ņŚłļŗż. ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ņĀĆĒĢŁņä▒ ļ╣łĒśł ņżæ ļ¦īņä▒ņĀüņØĖ ņ£äņĢö ņČ£ĒśłņØä ņÜ░ņäĀņĀüņ£╝ļĪ£ Ļ│ĀļĀżĒĢśņśĆņ£╝ļéś ņ£äņĢö ņĀłņĀ£ņłĀ Ēøä Ļ│ĀņÜ®ļ¤ēņØś ņ×¼ņĪ░ĒĢ® ņØĖ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ņŻ╝ņé¼ņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ļ╣łĒśłņØĆ ņ¦ĆņåŹļÉśņ¢┤ Ļ│©ņłśĻ▓Ćņé¼ņÖĆ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ĒĢŁņ▓┤Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ┤ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ĒĢŁņ▓┤ņŚÉ ņØśĒĢ£ ņł£ņłś ņĀüĒśłĻĄ¼ ļ¼┤ĒśĢņä▒ņ”Øņ£╝ļĪ£ ņĄ£ņóģ ņ¦äļŗ©ĒĢśņśĆļŗż.
ņł£ņłś ņĀüĒśłĻĄ¼ ļ¼┤ĒśĢņä▒ņ”ØņØĆ Ļ│©ņłśņŚÉņä£ ļ░▒ĒśłĻĄ¼ņÖĆ ĒśłņåīĒīÉņØś ĒśĢņä▒ņØĆ ņĀĢņāüņØ┤ļ®┤ņä£ ņĀüĒśłĻĄ¼ņØś ņäĀĒāØņĀüņØĖ ņāØņä▒ļČĆņĀäņ£╝ļĪ£ ņØĖĒĢśņŚ¼ Ļ│©ņłś ļé┤ ņĀüņĢäĻĄ¼Ļ░Ć Ļ▒░ņØś ņŚåļŖö ņ¦łĒÖśņ£╝ļĪ£ ņŗ¼ĒĢ£ ļ╣łĒśł, ļ¦ØņāüĻĄ¼ņØś Ļ░Éņåīļź╝ ĒŖ╣ņ¦Ģņ£╝ļĪ£ ĒĢ£ļŗż[9]. ņøÉņØĖņ£╝ļĪ£ļŖö ĒØöĒ׳ ĒØēņäĀņóģ, ļ░▒Ēśłļ│æ, Ļ│©ņłśņØ┤ĒśĢņä▒ ņ”ØĒøäĻĄ░, ļ”╝Ēöäņóģ ļ░Å ņĀäņŗĀņä▒ ņ×ÉĻ░Ć ļ®┤ņŚŁņ¦łĒÖś ļō▒ņØ┤ ņĢīļĀżņĀĖ ņ׳ņ£╝ļ®░ ņĢĮņĀ£ņŚÉ ņØśĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö phenyltoin, chlormphenicolĻ│╝ņØś ņŚ░Ļ┤Ćņä▒ņØ┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳Ļ│Ā ļ░öņØ┤ļ¤¼ņŖżņŚÉ ņØśĒĢ£ Ļ▓ĮņÜ░ļŖö parbovirus B19 Ļ░ÉņŚ╝ņØ┤ Ļ░Ćņן ĒØöĒĢ£ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[3,4,9]. ļśÉĒĢ£ ļ│Ė ĒÖśņ×ÉņŚÉņä£ņÖĆ Ļ░ÖņØ┤ ņ×¼ņĪ░ĒĢ® ņØĖ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ņØä Ēł¼ņŚ¼ļ░øĻ│Ā ņ׳ļŖö ļ¦īņä▒ ņŗĀņ¦łĒÖś ĒÖśņ×ÉņŚÉņä£ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ņŚÉ ļīĆĒĢ£ ĒĢŁņ▓┤ļź╝ ņ¦üņĀæņĀüņ£╝ļĪ£ ĒśĢņä▒ĒĢ©ņ£╝ļĪ£ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż.
ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ĒĢŁņ▓┤ņŚÉ ņØśĒĢ£ ņł£ņłś ņĀüĒśłĻĄ¼ ļ¼┤ĒśĢņä▒ņ”ØņØĆ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ļ▓ĀĒāĆļéś ļŗżļ▓ĀĒżņØ┤ņŚÉĒŗ┤ņŚÉņä£ļÅä ļō£ļ¼╝Ļ▓ī ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ņ£╝ļéś, ņŻ╝ļĪ£ ļ│Ė ņ”ØļĪĆņÖĆ Ļ░ÖņØ┤ ņĢīĒīī ņ×¼ņĪ░ĒĢ® ņØĖ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ņØä Ēö╝ĒĢś ņŻ╝ņé¼ļĪ£ Ēł¼ņŚ¼ļ░øņØĆ Ļ▓ĮņÜ░ņŚÉ ļ░£ņāØĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[5,10]. ņĀĢĒÖĢĒĢ£ ņØ┤ņ£ĀļŖö ņĢīļĀżņĀĖ ņ׳ņ¦Ć ņĢŖņ¦Ćļ¦ī Ļ░üĻ░üņØś ņĪ░ĒśłņĀ£ņŚÉ ĒżĒĢ©ļÉ£ ņ£ĀĻĖ░ Ēś╝ĒĢ®ļ¼╝Ļ│╝ ņĢłņĀĢņĀ£ļĪ£ ņé¼ņÜ®ļÉśļŖö polysorbateņØś ņé¼ņÜ®ņØ┤ ņżæņÜöĒĢ£ ĻĖ░ņĀäņ£╝ļĪ£ ņČöņĀĢĒĢśĻ│Ā ņ׳ļŗż[10]. polysorbateļŖö ņé¼ļ×ī Ēśłņ▓Ł ņĢīļČĆļ»╝ņŚÉ ļ╣äĒĢśņŚ¼ Ļ░ÉņŚ╝ ņĀäĒīīņØś ņ£äĒŚśņä▒ņØ┤ ļé«ļŗżļŖö ņןņĀÉņ£╝ļĪ£ ļ¬ćļ¬ć ņĪ░ĒśłņĀ£ņŚÉņä£ ņĢłņĀĢņĀ£ļĪ£ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŖöļŹ░, ļīĆĒæ£ņĀüņ£╝ļĪ£ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ņĢīĒīī ņĀ£ņĀ£ņØĖ Eprex┬«ņŚÉņä£ļŖö polysorbate 80ņØä ļ▓ĀĒāĆ ņĀ£ņĀ£ņØĖ NeoRecormon┬«ņŚÉņä£ļŖö polysorbate 20ņØä ņé¼ņÜ®ĒĢ£ļŗż. Eprex┬«ņŚÉņä£ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ĒĢŁņ▓┤ņŚÉ ņØśĒĢ£ ņł£ņłś ņĀüĒśłĻĄ¼ ļ¼┤ĒśĢņä▒ņ”ØņØś ļ░£ņāØ ļ╣łļÅäĻ░Ć ņøöļō▒Ē׳ ļ¦ÄņØĆ Ļ▓āņØĆ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ņŚÉ ļīĆĒĢ£ ĒĢŁņ▓┤ ĒśĢņä▒ņØ┤ polysorbateņØś ņóģļźśņÖĆ Ļ┤ĆļĀ©ņØ┤ ņ׳ņØīņØä ņŗ£ņé¼ĒĢ£ļŗż. ļśÉĒĢ£ ņŻ╝ņé¼ĻĖ░ņŚÉ ĒżĒĢ©ļÉ£ ņĮöĒīģĒĢśņ¦Ć ņĢŖņØĆ Ļ│Āļ¼┤ļ¦łĻ░£ņŚÉņä£ ņŖżļ®░ ļéśņśżļŖö ņ£ĀĻĖ░ Ēś╝ĒĢ®ļ¼╝ņØś ļ░£ņāØņØä Ļ│Āļ¼┤ļ¦łĻ░£ļź╝ ņĮöĒīģ ņ▓śļ”¼ĒĢśņŚ¼ ņĀ£Ļ▒░ĒĢ©ņ£╝ļĪ£ņŹ© ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ĒĢŁņ▓┤ņŚÉ ņØśĒĢ£ ņł£ņłś ņĀüĒśłĻĄ¼ ļ¼┤ĒśĢņä▒ņ”ØņØś ļ░£ņāØ ļ╣łļÅäĻ░Ć Ļ░ÉņåīĒĢśņśĆļŗżļŖö ļ│┤Ļ│ĀļŖö ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ĒĢŁņ▓┤ ĒśĢņä▒Ļ│╝ ņ£ĀĻĖ░ Ēś╝ĒĢ®ļ¼╝ņØś Ļ┤ĆļĀ©ņä▒ņØä ņŗ£ņé¼ĒĢ£ļŗż[11].
ņŚÉļ”¼ĒŖĖļĪ£ĒżņŚÉĒŗ┤ ĒĢŁņ▓┤ņŚÉ ņØśĒĢ£ ņł£ņłś ņĀüĒśłĻĄ¼ ļ¼┤ĒśĢņä▒ņ”ØņØś ņ¦äļŗ©ņØĆ ņØ╝ņŻ╝ņØ╝ņŚÉ ĒśłņāēņåīĻ░Ć 0.5-1.0/dL ņØ┤ņāü Ļ░ÉņåīĒĢ┤ņä£ ļ¬®Ēæ£ Ēśłņāēņåīļź╝ ņ£Āņ¦ĆĒĢśĻĖ░ ņ£äĒĢ┤ ņØ╝ņŻ╝ņØ╝ņŚÉ 1-2 pint ņØ┤ņāüņØś ņłśĒśłņØ┤ ĒĢäņÜöĒĢśļ®░, ļ¦Éņ┤łĒśłņĢĪņŚÉņä£ ļ░▒ĒśłĻĄ¼ņÖĆ ĒśłņåīĒīÉņØĆ ņĀĢņāüņØ┤Ļ│Ā ņĀłļīĆ ļ¦ØņāüĻĄ¼Ļ░Ć 10,000/microL ņØ┤ĒĢśņØ╝ ļĢī ņØśņŗ¼ĒĢ┤ņĢ╝ ĒĢśĻ│Ā Ļ│©ņłś Ļ▓Ćņé¼ņŚÉņä£ ņĀüņĢäĻĄ¼Ļ░Ć 5% ļ»Ėļ¦īņØĖ ņł£ņłś ņĀüĒśłĻĄ¼ ļ¼┤ĒśĢņä▒ņ”Ø ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśĻ│Ā ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ĒĢŁņ▓┤ ņ¢æņä▒ņØ╝ Ļ▓ĮņÜ░ņŚÉ ĒÖĢņ¦äĒĢĀ ņłś ņ׳ļŗż[10]. ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ĒĢŁņ▓┤ļź╝ Ļ▓ĆņČ£ĒĢĀ ņłś ņ׳ļŖö Ļ▓Ćņé¼ļŖö ĒÜ©ņåīļ®┤ņŚŁņĖĪņĀĢļ▓ĢĻ│╝ ļ│Ė ņ”ØļĪĆņŚÉņä£ ņé¼ņÜ®ĒĢ£ ļ░®ņé¼ņäĀļ®┤ņŚŁņ╣©Ļ░Ģļ░śņØæ Ļ▓Ćņé¼Ļ░Ć ņ׳ļŗż. ņØ╝ļ░śņĀüņØĖ ĒÜ©ņåīļ®┤ņŚŁņĖĪņĀĢļ▓ĢņØĆ ļ¦ÄņØ┤ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ņ£╝ļéś ņāüļīĆņĀüņ£╝ļĪ£ ļåÆņØĆ ņ£äņ¢æņä▒ļźĀĻ│╝ ņ£äņØīņä▒ļźĀņØ┤ ļ¼ĖņĀ£Ļ░Ć ļÉśļŖö ļ░śļ®┤ņŚÉ ļ░®ņé¼ņäĀļ®┤ņŚŁņ╣©Ļ░Ģļ░śņØæ Ļ▓Ćņé¼ļŖö ļ»╝Ļ░ÉļÅäņÖĆ ĒŖ╣ņØ┤ļÅäĻ░Ć ļ¦żņÜ░ ļåÆņØĆ Ļ▓āņ£╝ļĪ£ ļÉśņ¢┤ ņ׳ļŗż[3,10].
ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ĒĢŁņ▓┤ņŚÉ ņØśĒĢ£ ņł£ņłś ņĀüĒśłĻĄ¼ ļ¼┤ĒśĢņä▒ņ”ØņØś ņ╣śļŻīļŖö ņØ╝ņ░©ņĀüņ£╝ļĪ£ ņ”ØņāüņØ┤ ņ׳ļŖö ļ╣łĒśłņŚÉ ļīĆĒĢ┤ņä£ļŖö ņłśĒśłņØä ĒĢśĻ│Ā ņ×¼ņĪ░ĒĢ® ņØĖ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ Ēł¼ņŚ¼ļź╝ ņżæņ¦ĆĒĢśļŖö Ļ▓āņØ┤ļ®░ ļŗżļźĖ ņĪ░Ēśł ĒśĖļź┤ļ¬¼ņĀ£ņĀ£ļĪ£ ļ░öĻ┐öņä£ Ēł¼ņŚ¼ĒĢśļŖö Ļ▓āņØĆ ĻČīņןļÉśņ¦Ć ņĢŖļŖöļŗż[2,5]. ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ņ╣śļŻīļź╝ ņżæļŗ©ĒĢ£ ĒøäņŚÉļÅä ņ×ÉņŚ░ Ļ┤ĆĒĢ┤ļŖö ļō£ļ¼╝ņ¢┤ ļīĆļČĆļČäņØś ĒÖśņ×ÉņŚÉņä£ ņŖżĒģīļĪ£ņØ┤ļō£ņÖĆ cyclophosphamide ļ│æĒĢ®ņÜöļ▓Ģ ļō▒ ļ®┤ņŚŁņ¢ĄņĀ£ņĀ£ Ēł¼ņŚ¼Ļ░Ć ĻČīņןļÉśĻ│Ā ņ׳ļŗż[4,5,12]. ņĄ£ĻĘ╝ņŚÉļŖö ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ņłśņÜ®ņ▓┤ņŚÉ Ļ▓░ĒĢ®ĒĢśņŚ¼ ĒÖ£ņä▒ĒÖöņŗ£ĒéżļŖö ĒĢ®ņä▒ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ņĀ£ņĀ£ņØĖ PeginesatideĻ░Ć ņ╣śļŻīņĀ£ļĪ£ ņŗ£ļÅäļÉśĻ│Ā ņ׳ļŗż. PeginesatideļŖö ņāØņ▓┤ ļé┤ Ēś╣ņØĆ ĻĖ░ņĪ┤ņØś ņ×¼ņĪ░ĒĢ® ņØĖ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤Ļ│╝ ņĢäļ»ĖļģĖņé░ ņä£ņŚ┤ņØ┤ ļŗ¼ļØ╝ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ĒĢŁņ▓┤ ņ¢æņä▒ņŚÉ ļīĆĒĢ£ ĻĄÉņ░© ļ░śņØæņØ┤ ļ░£ņāØĒĢśņ¦Ć ņĢŖņ£╝ļ»ĆļĪ£ ņŚÉļ”¼ĒŖĖļĪ£ĒżņØ┤ņŚÉĒŗ┤ ĒĢŁņ▓┤ņŚÉ ņØśĒĢ£ ņł£ņłś ņĀüĒśłĻĄ¼ ļ¼┤ĒśĢņä▒ņ”ØņØä ņØ╝ņ£╝Ēéżņ¦Ć ņĢŖļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[6,13]. ļ│Ė ņ”ØļĪĆņØś Ļ▓ĮņÜ░ ņŖżĒģīļĪ£ņØ┤ļō£ Ēł¼ņŚ¼ ĒøäņŚÉ ņ£äņןĻ┤Ć ņČ£Ēśł, Ļ░ÉņŚ╝ ĒĢ®ļ│æņ”ØņØ┤ ļ░£ņāØĒĢśņŚ¼ ņĪ░ĻĖ░ņŚÉ ņżæļŗ©ĒĢśņśĆļŗż.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print






