말단비대증 환자에서 소마토스타틴 유사체 사용에 대한 권고안
- 진상욱1, 구철룡2, 김병준3, 김성운1, 박경혜4, 송기호5, 오승준1, 윤현구6, 이은직2, 이정민7, 임정수8, 김정희9, 김광준10, 진흥용11, 김대중12, 이경애11, 문성수13, 임동준7, 신동엽2, 김세화14, 권민정15, 김하영16, 김진화17, 김동선18, 김종화19
Medical Treatment with Somatostatin Analogues in Acromegaly: Position Statement
- Sang Ouk Chin1, Cheol Ryong Ku2, Byung Joon Kim3, Sung-Woon Kim1, Kyeong Hye Park4, Kee Ho Song5, Seungjoon Oh1, Hyun Koo Yoon6, Eun Jig Lee2, Jung Min Lee7, Jung Soo Lim8, Jung Hee Kim9, Kwang Joon Kim10, Heung Yong Jin11, Dae Jung Kim12, Kyung Ae Lee11, Seong-Su Moon13, Dong Jun Lim7, Dong Yeob Shin2, Se Hwa Kim14, Min Jeong Kwon15, Ha Young Kim16, Jin Hwa Kim17, Dong Sun Kim18, Chong Hwa Kim19
- Received May 9, 2019; Accepted June 27, 2019;
- Abstract
-
Acromegaly is a chronic disorder caused by excessive growth hormone (GH) secretion. In most cases, the excess GH originates from GH-producing pituitary adenomas. Surgery is the preferred first-line treatment for patients with acromegaly, but medical management is considered when the disease persists after surgery or in cases where patients refuse surgery or are poor candidates for surgery. Somatostatin analogues are commonly used to treat acromegaly. The Korean Endocrine Society and the Korean Neuroendocrine Study Group have developed a position statement for the use of somatostatin analogues in the medical treatment of acromegaly. This position statement is based on evidence from the current literature and expert opinions. In the case of discrepancies among expert opinions, the experts voted to determine the recommended approach.
- 서 론
- 서 론
말단비대증은 성장호르몬의 과다 분비가 원인인 질환으로 약 95%의 환자에서 성장호르몬 분비성 뇌하수체 종양으로 인해 발생하는 것으로 알려져 있다[1]. 인구 100만 명당 연간 발병률이 3.3명, 유병률이 40-130명으로 추정되는 희귀 질환이며[2], 우리나라의 경우 2007년 기준으로 인구 100만명당 연간 발생률 3.9명, 유병률은 100만 명당 27.9명으로 보고되었다[3]. 성장호르몬을 과다하게 분비하는 뇌하수체 종양에 의한 말단비대증 환자에서 일차적인 치료는 수술이며[4], 경접형골동 선종제거술을 통해 뇌하수체 종양을 제거한다. 그러나 종양의 크기, 침습 범위 및 수술을 시행하는 신경외과 의사의 숙련도 등에 따라 수술적 치료의 성공률이 달라진다[5-8]. 뇌하수체 미세선종의 경우 약 70%의 환자에서 수술적 치료를 통하여 성장호르몬 및 인슐린양 성장인자(insulin-like growth factor-1, IGF-1)를 정상 범위로 유지할 수 있으나[9], 거대선종은 50% 정도에서만 이러한 치료 효과를 기대할 수 있다[10]. 말단비대증은 일반적으로 응급 질환의 범주에는 속하지 않으므로 수술 3개월 후 75 g 경구 당부하 검사를 시행하여 성장호르몬이 1 μg/L 이하로 억제되지 않는 경우 잔여 종양이 있음을 확인할 수 있어 내과적 치료를 시작할 수 있다[4]. 말단비대증의 내과적 치료에는 소마토스타틴 유사체(octreotide, lanreotide, pasireotide), 성장호르몬 수용체 길항제(pegvisomant), 경구용 도파민 작용제(cabergoline) 등이 사용된다. 이러한 말단비대증의 치료 목표는 종양 크기를 감소시키고 성장호르몬 및 IGF-1을 최대한 정상 수준으로 유지하는 것이다[1]. 만일 수술적 치료가 불가능한 경우에는 약물 치료를 일차적으로 고려할 수 있다[1].대한내분비학회는 2011년 말단비대증에 대한 진료 가이드라인을 제작한 바 있으며 이후 내과적 치료 증례 및 관련 연구가 많아지고 보험 급여 관련 문제점 및 이에 대한 개선 요구가 늘어나면서 새로운 치료 권고안이 필요하여 2017년 대한내분비학회 보험위원회에서는 소마토스타틴 유사체를 사용하는 내과적 치료에 대한 권고안 제작을 결정하였다. 이에 관련 문헌 검색 및 이메일 등을 통한 토론을 진행함과 동시에 대한내분비학회, 대한신경내분비연구회 그리고 대한신경외과학회 소속 전문가들에게 의견 수렴을 위한 회의 참석을 요청한 바 있다. 2017년 11월 28일 진행된 회의에서 참석한 전문가를 중심으로 합의된 의견을 바탕으로 본 권고안을 작성하였으며 근거가 확실치 않은 일부 내용에 대해서는 전문가 의견으로 구성하였다. 전문가들 간의 이견이 있는 내용에 대해서는 투표를 통하여 다수 의견으로 권고안을 확정하였다. 본 권고안은 많은 의료진들이 진료에 참고할 수 있도록 논문으로 게재된 바 있다[11]. 근거 수준은 이전 논문에서 기술한 방법 그대로 하였다[11].
- 본 론
- 본 론
- 소마토스타틴 및 소마토스타틴 수용체
- 소마토스타틴 및 소마토스타틴 수용체
일반적으로 뇌하수체 전엽에서 분비되는 성장호르몬은 시상하부에서 분비되는 소마토스타틴에 의해 억제된다[12]. 소마토스타틴은 시상하부 이외에 소화기관에서도 분비되는데, 14개의 아미노산으로 구성된 SST14는 시상하부에서, 28개의 아미노산으로 구성된 SST28은 소장의 δ (델타) 세포에서 분비된다[13]. 소마토스타틴은 세포막에 위치한 소마토스타틴 수용체(somatostatin receptor, SSTR)에 결합하여 뇌하수체, 췌장, 위장관 및 담낭에서의 호르몬 분비 억제 효과를 보이며 지금까지 총 다섯 종류의 아형이 확인되었다[13]. 그중에서 성장호르몬 분비성 뇌하수체 종양 세포에는 주로 2형(SSTR2, > 95%) 및 5형 수용체(SSTR5, > 85%)가 발현한다[14]. 2형 및 5형 외에도 3형(SSTR3)과 1형(SSTR1)이 각각 40% 정도에서 발현되고 4형(SSTR4)은 뇌하수체 종양 세포에서는 거의 발현하지 않는 것으로 보고되었다[15]. SSTR은 이외에도 중추신경계, 위장관, 염증 및 면역세포와 다른 내 분비 장기를 구성하는 세포에서의 발현이 확인되었다[16].- 소마토스타틴 유사체
- 소마토스타틴 유사체
체내에서 분비되는 내인성 소마토스타틴은 반감기가 3-5분 정도로 매우 짧다. 따라서 이를 치료제로 사용하기 위해서는 지속적인 정맥 주사를 필요로 하고 주입 이후의 성장호르몬, 인슐린 및 글루카곤 등의 분비의 반동현상(rebound secretion)도 나타날 수 있어 직접 사용에는 제한이 있다[17]. 이러한 단점을 보완하여 반감기를 연장시킨 octreotide 및 lanreotide 등의 소마토스타틴 유사체가 개발되었다[18,19]. 두 약제 모두 소마토스타틴의 기능에 중요한 역할을 하는 β-turn (7-10번 아미노산 사슬) 및 3번과 14번 아미노산(cysteine)을 연결하는 disulfide bond를 유지하면서 동시에 반감기가 연장되도록 개발되었다[13].Octreotide는 cyclic octapeptide의 형태로 피하 또는 정맥으로 투여하며 주로 SSTR2에 대한 결합력이 내인성 소마토스타틴에 비하여 45배 이상 강한 것으로 알려져 있다(Kd = 0.4 pM). 초기 용량은 100-250 ug을 8시간 간격으로 투여하며 최대 하루 1.5 mg까지 사용할 수 있다[20]. 최대 약물 혈중 농도는 투여 40분 후에 도달하며 반감기는 약 2시간이다[1]. Octreotide는 내인성 소마토스타틴보다는 약물의 반감기가 길어졌으나 여전히 하루에 여러 차례 투여해야 하는 단점이 있어, 체내에서 분해되는 glucose polymer에 둘러싸인 미세입자(microsphere) 및 diluent (carboxymethylcellulose sodium, mannitol, water)를 octreotide와 혼합한 형태의 octreotide long-acting release (LAR)가 개발되었다[13]. Octreotide LAR은 근육 주사의 형태로 투여하며 최대 약물 혈중 농도는 투여 후 최초 1시간 내에 최대 농도에 도달한다. 이는 약물 운반체 역할을 하는 미세입자에 흡착된 약제로 인한 것으로 알려져 있다[21]. 이후 12시간 동안 감소하여 약 7일 동안 유지되고 다시 증가하여 14일째에 최대 농도에 도달하는 두 개의 단계(biphasic manner)를 거친다[22]. 이후 농도는 35-60일 정도 유지되고 점차 감소하며 이러한 특성을 반영하여 octreotide LAR는 4주 간격으로 투여하고 3회 투여 후 혈중 농도가 안정적으로 유지된다[21].Lanreotide sustained-release는 체내에서 분해되는 lactide/glycolide copolymer 형태로 개발되어 SSTR2에 높은 결합력을 보이고 약 5일 정도의 반감기를 가지면서 7-14일 간격으로 근육 주사로 투여하는 약물이다[1]. 이후 점액형태의 과포화된 수용화 용액이 사전에 충전된 형태(prefilled)인 lanreotide Autogel (ATG)이 개발되어 투여 기간이 4주 이상으로 연장되었고 심부 피하주사의 형태로 사용한다[23]. 반감기는 약 23-29일이며 4회 투여 후 혈중 농도가 안정적으로 유지된다[1].성장호르몬 분비성 뇌하수체 종양에서 SSTR2 이외에도 SSTR5의 발현이 유사한 수준으로 관찰되고 SSTR5의 발현 정도와 질환 활성도 사이의 유의한 관련성이 있음이 보고되었다[24,25]. 이를 근거로 SSTR5 및 다른 SSTR 아형에 대한 결합력을 높인 pasireotide가 개발되었다. Pasireotide는 cyclohexapeptide 형태로 1047 Da의 분자량을 가지며([2-aminoethyl]aminocarbonyloxy)-L-proline, phenylglycine 및 tyrosine (benzyl)의 구조로 이루어져 있다[26]. Octreotide 및 lanreotide와 비교하여 SSTR5, SSTR1 및 SSTR3에 각각 40배, 30배 및 5배 이상 그리고 SSTR2에 대해서는 약 2.5배 정도 낮은 결합력을 가지고 있다[27]. 이후 octreotide LAR와 유사한 polymer를 사용하여 투여 간격을 연장한 pasireotide LAR이 개발되었다[13]. Pasireotide LAR은 최초 투여 후 약 24시간이 지난 시점에서 첫 번째 혈중 최고 농도를 보이고 이후 7일째까지 감소하다 다시 증가하여 21일째에서 두 번째 혈중 최고 농도를 보이는 약물 역동학을 가진다[28]. Octreotide LAR와 유사하게 4주 간격으로 투여 시 3회 투여 후 혈중 농도가 안정적으로 유지되는 것으로 알려져 있다[28].이들 소마토스타틴 유사체들은 SSTR에 결합하여 뇌하수체에서의 성장호르몬 분비 및 성장호르몬 분비 세포의 분열을 억제하고, 간에서 IGF-1의 생성을 억제하는 효과를 가진다[1,29]. 또한 이들 약제 사용을 통하여 종양 크기의 감소도 기대할 수 있으며 뇌하수체 전엽 세포 내 ZAC1 단백질 발현 유도를 통한 세포자멸[13], octreotide 사용 후 Ki67 index의 감소 및 이를 통한 성장호르몬 분비성 뇌하수체 종양의 세포주기 감소[30] 등이 종양 크기 감소의 기전으로 제시되었다. 30여 년 전 octreotide를 말단비대증 환자에게 사용하여 증상 및 성장호르몬 및 IGF-1의 정상화를 확인한 증례[31]가 처음 보고된 이후 두 약제를 사용한 말단비대증 환자의 치료 효과는 연구 조건에 따라 다양한 결과를 보이고 있다. Octreotide LAR는 일반적인 용량(20-30 mg/month)으로 사용 시 IGF-1은 38-85%, 성장호르몬(< 2.5 μg/L)은 33-75%의 환자에서 정상 범위로 개선됨이 보고되고 있고[32], lanreotide ATG의 경우 IGF-1은 39-80%, 성장호르몬은 38-80%의 환자에서 정상 범위로 개선됨이 보고되고 있다[33]. 또한 octreotide LAR를 48주간 사용 시 약 75%의 환자에서 종양 크기의 유의한 감소(> 20%)가 관찰되었고[34], lanreotide ATG은 12주 사용 후 54%의 환자에서 유의한 수준의 종양 크기 감소가 확인되었다[35]. Lanreotide ATG은 국내 환자를 대상으로 하여 후향적으로 분석한 연구 결과에서도 6-12개월간의 치료 후 성장호르몬 및 IGF-1의 유의한 감소를 확인하였다[36]. Pasireotide LAR는 내과적 치료의 과거력이 없는 말단비대증 환자를 대상으로 12개월의 기간 동안 진행한 연구에서 octreotide LAR 사용군에 비하여 치료 목표(성장호르몬 2.5 μg/L 이하 억제 그리고 정상 범위 내의 IGF-1)를 달성한 환자의 비율이 유의하게 높았다(31.3% vs. 19.2%) [37]. 이전에 외과적 수술을 시행받은 환자만을 대상으로 시행한 하위분석에서도 유사한 결과가 확인되었다[37]. 치료 목표를 달성한 환자들을 대상으로 12개월간 추가로 사용기간을 연장한 연구에서도 pasireotide LAR를 유지한 환자들 중 48.6% 그리고 octreotide LAR를 계속 사용한 환자의 45.7%에서 치료 효과가 그대로 유지되었다[38]. 또한 치료 목표를 달성하지 못한 환자들을 대상으로 약제 교차변경 후 26개월까지의 결과를 분석한 결과에서도 octreotide LAR에서 pasireotide LAR로 변경한 경우, 17.3%의 환자에서 치료 목표를 달성하였으나 pasireotide LAR에서 octreotide LAR로 변경한 환자군에서는 치료 목표를 달성한 환자가 없었다[39]. 이에 더하여 기존의 octreotide 및 lanreotide 사용 시 치료 효과를 보이지 않은 환자군을 대상으로 pasireotide LAR로 변경 또는 기존 약제를 유지한 환자들의 치료 성적을 비교한 pasireotide versus continued treatment with octreotide or lanreotide in patients with inadequately controlled acromegaly 연구[40]를 통하여 pasireotide LAR 60 mg/4주로 변경한 환자의 약 20%에서 치료 목표를 추가로 달성하였음을 확인하였다.- 소마토스타틴 유사체 사용 시 최초 용량 및 증감
- 소마토스타틴 유사체 사용 시 최초 용량 및 증감
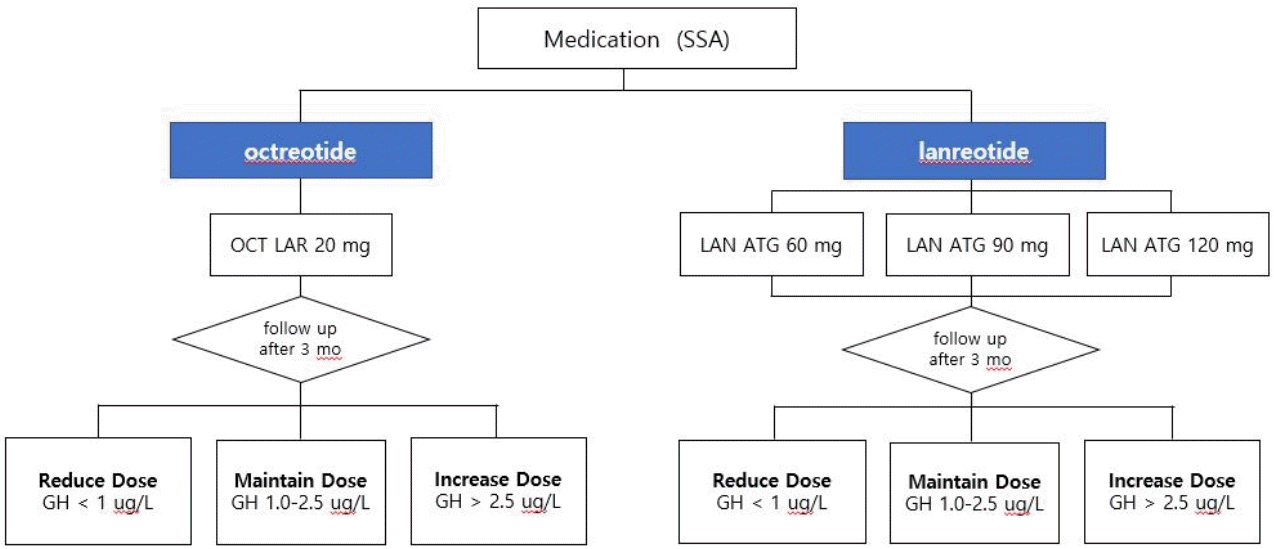
Octreotide LAR의 최초 용량은 20 mg이며 4주 간격으로 근육주사의 형태로 투여한다. 최초 3개월간 사용 후에도 성장호르몬이 2.5 μg/L 이하로 억제되지 않을 경우, 용량을 30 mg/4주로 증량할 수 있고 같은 방식으로 최대 40 mg/4주까지 증량할 수 있다(Fig. 1). 최근 말단비대증 환자의 치료에서 성장호르몬이 1.0 μg/L 이하로 억제될 경우, 환자들의 향후 사망률을 일반인 수준으로 개선할 수 있다는 보고가 나오고 있으나[41], 현재 사용 중인 성장호르몬 측정 키트의 정확도 및 표준화가 충분히 확립되지 않아 본 권고안에서는 약제 증량 및 변경 등의 기준이 되는 성장호르몬 농도를 2.5 μg/L로 기술하였다. 또한 IGF-1 단독으로 말단비대증의 진단 또는 질환 활성도 및 성장호르몬 과다분비 상태 등을 평가함은 권고되지 않고[42,43], 한국인에서의 연령대별 IGF-1 정상 범위에 대한 자료 부족 및 질환 이외의 다양한 외부 요인들에 의해 IGF-1의 분비량이 영향을 받을 수 있다는 점[42]을 고려하여 본 권고안에서는 약제 증량 및 약제 변경 등의 기준에 IGF-1을 포함하지 않았다. 향후 관련 연구 자료가 축적되면 권고안 개정 시 IGF-1도 고려 기준에 포함할 예정이다. Octreotide LAR를 20 mg/4주 용량으로 3개월 이상 사용하여 성장호르몬 농도가 지속적으로 1 μg/L 이하로 측정되고 가역적인 말단비대증 징후 및 증상의 대부분이 소실되었다면 10 mg/4주로 감량할 수 있다. 약제 사용 중에는 성장호르몬 등의 생화학적 지표, 임상징후 및 증상들을 세심하게 정기적으로 관찰해야 한다(expert opinion).Lanreotide ATG는 최초 용량으로 60 mg, 90 mg, 120 mg 중에서 진료의사의 판단에 따라 용량을 선택하여 4주 간격으로 심부 피하 주사의 형태로 투여할 수 있다. 60 mg/4주 또는 90 mg/4주 투여로 3개월간 사용 후에도 성장호르몬이 2.5 μg/L 이하로 억제되지 않는다면 투여 용량을 점진적으로 증량하여, 최대 120 mg/4주까지 증량하여 사용할 수 있다(Fig. 1). 성장호르몬이 정상 범위 내에서 지속적으로 유지될 경우, 용량을 최소 60 mg/4주까지 줄일 수 있고 120 mg으로 투여 간격을 6-8주까지 연장하여 투여할 수 있다(자세한 내용은 아래 해당 문단 참조). 용량 변화 없이 지속적으로 투여하는 경우, 정기적으로 성장호르몬을 측정한다(expert opinion). Pasireotide LAR의 경우 최초 용량은 40 mg/4주이며 최초 3개월 사용 후에도 성장호르몬의 억제가 관찰되지 않을 경우 60 mg/4주로 증량하여 사용할 수 있다.- 사용 중인 소마토스타틴 유사체의 변경
- 사용 중인 소마토스타틴 유사체의 변경
말단비대증 환자의 내과적 치료에 있어 octreotide LAR와 lanreotide ATG의 치료 효과를 직접 비교한 대규모 임상 연구는 없다. 그러나 다수의 소규모 연구를 통하여 두 약제는 종양 크기 감소 및 성장호르몬 등의 생화학적 지표의 개선에서 유사한 효과를 가지고 있음이 확인되었다[44]. Andries 등[45]은 octreotide LAR 10 mg과 lanreotide ATG 60 mg을, octreotide LAR 20 mg과 lanreotide ATG 90 mg을, octreotide LAR 30 mg과 lanreotide ATG 120 mg을 교차 투여하여 두 약제가 말단비대증 환자의 성장호르몬 및 IGF-1 수치 감소 및 임상 증상 개선에 거의 동등한 효과를 나타냄을 보고한 바 있다. 또한 같은 연구[45]에서 두 가지 약제 모두에서 공통되게 나타나는 부작용은 없는 것으로 나타나, 치료 목표 달성에 실패하였거나 부작용이 있는 경우 octreotide LAR와 lanreotide ATG 간의 약물 변경이 도움이 될 수 있을 것으로 생각된다. 한국인 환자를 대상으로 후향적으로 분석한 연구에서도 두 약제의 효과는 유의한 차이를 보이지 않았다[46].환자의 생화학적 지표 및 부작용 개선을 위한 다른 소마토스타틴 유사체로의 약물 변경 시에는 새롭게 처방하는 약제의 최초 용량으로 변경하여 처방한다. Octreotide LAR에서 lanreotide ATG로 약물을 변경하는 경우, 기존에 치료하던 octreotide LAR의 용량과는 무관하게 진료 의사의 판단에 따라 lanreotide 60 mg, 90 mg 혹은 120 mg으로 변경하여 처방할 수 있다. Lanreotide ATG에서 octreotide LAR로 약물을 변경하는 경우에는 octreotide LAR의 초기 용량인 20 mg/4주로 우선 변경한다. 약제 변경 후에는 최소 3개월간 처방을 유지하면서 치료 반응 평가를 위하여 성장호르몬을 정기적으로 측정하며 성장 호르몬이 2.5 μg/L 이하로 억제되지 않는다면 약제의 증량이 가능하다(expert opinion). Octreotide LAR 또는 lanreotide ATG의 최대 용량을 사용한 최소 6개월 이상 치료에도 불구하고 성장호르몬이 효과적으로 억제되지 않을 경우 pasireotide LAR로 변경하여 사용할 수 있다.- Lanreotide ATG의 투여 간격 연장(extended dose interval, EDI)
- Lanreotide ATG의 투여 간격 연장(extended dose interval, EDI)
2014년 미국내분비학회에서 발표한 말단비대증 진료 지침에서는 저용량의 소마토스타틴 유도체에서 치료 반응이 좋을 경우 투여 간격의 연장이 가능한 것으로 기술되어 있다[4,47]. The lanreotide extended ATG duration 연구[48]를 통하여 octreotide LAR 10 mg 혹은 20 mg을 4주 간격으로 투여받으면서 성장호르몬이 안정적으로 유지되고 있는 환자군을 lanreotide ATG 120 mg/4주로 변경하여 6개월간 우선 투여하고 이후 치료 성적에 따라 6주 혹은 8주 간격으로 투여 기간을 연장한 결과 이전 octreotide LAR 사용 시와 동등한 수준의 치료 효과가 유지됨을 입증하였다. 또한 투여 간격의 연장이 환자의 주사 횟수 감소 및 이에 따른 치료비 감소로 이어져 환자의 약물 선호도에도 긍정적인 영향을 주었다[48]. 폴란드에서 다기관 관찰연구로 진행되었던 Lanro 연구[49]에서는 4주 간격으로 lanreotide ATG 120 mg을 투여받던 환자를 대상으로 투여 간격을 8주까지 연장하였을 경우 치료비와 관련한 경제적 부담을 줄일 수 있음을 확인하였다. 이러한 근거들을 바탕으로 말단비대증의 내과적 치료에 있어 lanreotide ATG는 약제의 EDI가 승인된 유일한 소마토스타틴 유사체이다[48].따라서 octreotide LAR 또는 lanreotide ATG을 3개월 이상 사용하여 성장호르몬(< 2.5 μg/L) 및 임상적 증상 등이 충분히 잘 조절되는 환자의 경우 이전에 사용하였던 소마토스타틴 유사체의 용량과 상관없이 lanreotide ATG 120 mg으로 변경하여 8주까지 투여 간격을 연장할 수 있다(expert opinion). 투여 간격을 연장하는 경우에도 증상 조절 여부 및 성장호르몬 등의 생화학적 지표에 대한 정기적인 평가가 필요하다.- 수술 전 소마토스타틴 유사체의 사용
- 수술 전 소마토스타틴 유사체의 사용
Preoperative octreotide treatment of acromegaly 연구[50]에서 수술 전 octreotide LAR 치료를 받은 군과 바로 수술적 치료를 시행받은 군을 3개월간 비교 관찰한 결과, 거대선종을 가진 환자의 경우 수술 전 octreotide LAR를 사용한 군에서 수술적 치료를 바로 시행받은 환자군에 비하여 IGF-1의 개선효과가 유의하게 높음을 보고하였다. 그러나 이들 환자를 5년간 추적 관찰한 후속 연구에서 유의한 수준의 차이가 유지되지 않았음을 확인하였다[51]. 이러한 근거들을 바탕으로 2014년 미국내분비학회 진료 지침에서는 말단비대증 환자의 치료에 있어 수술 전 소마토스타틴 유사체의 일반적인 사용은 권고하지 않고 있다[4]. 다만 수술적 치료가 불가능하거나, 환자가 거부하는 경우에는 약물 치료를 일차적으로 고려할 수 있다[1].- 소마토스타틴 유사체 사용 기간 중의 특수 상황
- 소마토스타틴 유사체 사용 기간 중의 특수 상황
소마토스타틴 유사체의 부작용은 췌장 및 위장관에서의 펩타이드 분비 및 연동 운동 억제와 관련이 있는 것으로 알려져 있다. 오심, 설사, 복통, 위장관마비, 담즙 찌꺼기, 담낭결석 등이 발생할 수 있으며 대부분 경미하고 약제를 중단하거나 용량 감량 시 완화된다[17]. 소수의 환자에서 서맥이 발생하였다는 보고도 있다[20]. Octreotide 또는 lanreotide의 경우 이들 약제의 주요 결합 수용체인 SSTR2가 췌장의 알파세포에서 발현되는 것으로 보고되었으며[52], 베타세포에서의 인슐린 분비에는 큰 영향을 가지지 않는다. 따라서 혈당 조절 상태가 악화되는 경우는 흔하지 않으며, 오히려 성장호르몬 및 IGF-1의 과다 분비가 호전되면서 혈당 조절 상태가 개선되는 경우가 많다[53,54]. 반면 기존 연구에서 octreotide LAR와 비교하여 pasireotide LAR를 사용하였던 환자군에서 고혈당 발생 또는 당뇨병으로 이환되는 빈도가 높았다[37]. 이는 pasireotide와 결합력이 높은SSTR5가 베타세포 및 glucagon-like peptide (GLP-1)를 분비하는 세포에서도 발현하기 때문으로 여겨지고 있다[17,55]. 다만 약제 사용 시 인슐린 분비능은 저하되나 인슐린 감수성에는 큰 영향을 미치지 않음이 보고되어[56], 고혈당 발생 시 일반적인 2형 당뇨병 치료와 동일하게 metformin을 1차 치료제로 사용할 수 있고 이후 dipeptidyl-peptidase-4 inhibitors 또는 GLP-1 receptor agonists 등의 추가가 권고된다[57].소마토스타틴 유사체를 사용 중인 말단비대증 환자의 임신과 관련해서는 약 50예의 증례가 보고된 바 있으며, 이들에게서 태아 기형이 보고된 적은 없다[4]. 그러나 태반에 SSTR이 발현하고 octreotide가 태반을 통과할 수 있음이 보고되어[58] 태아의 발달에 소마토스타틴 유사체가 영향을 미칠 가능성은 존재한다. 또한 속효성 octreotide 사용 시 자궁동맥의 혈류 감소[58] 및 저용량의 octreotide LAR 사용 환자에서 자궁 내 태아 발달 지연이 보고된 바 있다[59]. 결론적으로 임신과 관련된 약제 안정성에 대한 자료가 부족하므로 소마토스타틴 유사체를 사용하는 환자는 피임을 유지하고 임신을 희망할 경우 약제 중단이 권고된다[4]. 오랜 기간에 걸쳐 질환이 진행하는 말단비대증의 특성을 고려할 때 9-12개월간의 약물 치료 중단이 추후 치료 결과에 큰 영향을 미칠 가능성은 높지 않다[4].- 권고안 요약
- 권고안 요약
말단비대증 환자에서 내과적 치료의 적응증 및 목표
말단비대증 환자에서 내과적 치료의 적응증 및 목표
말단비대증은 일반적으로 응급 질환의 범주에는 속하지 않으므로 수술 3개월 후 75 g 경구 당부하 검사를 시행하여 성장호르몬이 1 μg/L 이하로 억제되지 않는 경우, 잔여 종양이 있음을 확인할 수 있어 내과적 치료를 시작할 수 있다. 치료 목표는 종양 크기의 감소, 성장호르몬 및 성장호르몬양 유사인자(IGF-1)의 정상화 및 임상 증상 및 징후의 개선이다(근거수준 A).소마토스타틴 유사체 사용 시 최초 용량 및 증감
소마토스타틴 유사체 사용 시 최초 용량 및 증감
1. LAR의 최초 용량은 20 mg이며 4주 간격으로 근육 주사의 형태로 투여한다. 최초 3개월간 사용 후에도 성장호르몬이 2.5 μg/L 이하로 억제되지 않을 경우, 용량을 30 mg/4주로 증량할 수 있고 같은 방식으로 최대 40 mg/4주까지 증량할 수 있다. 20 mg/4주 용량으로 3개월 이상 사용하여 성장 호르몬 농도가 지속적으로 1 μg/L 이하로 측정되고 가역적인 말단비대증 징후 및 증상의 대부분이 소실되었다면 10 mg/4주로 감량할 수 있다(근거수준 B).2. ATG는 최초 용량으로 60 mg, 90 mg, 120 mg 중에서 진료의사의 판단에 따라 용량을 선택하여 4주 간격으로 심부 피하 주사의 형태로 투여할 수 있다. 60 mg 또는 90 mg/4주 투여로 3개월간 사용 후에도 성장호르몬이 2.5 μg/L 이하로 억제되지 않는다면 투여 용량을 점진적으로 증량하여 최대 120 mg/4주까지 증량하여 사용할 수 있다(근거수준 B).3. Pasireotide LAR의 경우, 최초 용량은 40 mg/4주이며 최초 3개월 사용 후에도 성장호르몬의 억제가 관찰되지 않을 경우, 60 mg/4주로 증량하여 사용할 수 있다(근거수준 B).사용 중인 소마토스타틴 유사체의 변경
사용 중인 소마토스타틴 유사체의 변경
1. 환자의 생화학적 지표 및 부작용 개선을 위하여 다른 소마토스타틴 유사체로의 약물 변경 시에는 새롭게 처방하는 소마토스타틴 유사체의 최초 용량으로 변경하여 처방한다(근거수준 E).2. Octreotide LAR에서 lanreotide ATG로 약물을 변경하는 경우, 기존에 치료하던 octreotide LAR의 용량과는 무관하게 진료 의사의 판단에 따라 lanreotide 60 mg, 90 mg 혹은 120 mg으로 변경하여 처방할 수 있다. Lanreotide ATG에서 octreotide LAR로 약물을 변경하는 경우에는 octreotide LAR의 초기 용량인 20 mg/4주로 우선 변경한다(근거수준 E).Lanreotide ATG의 EDI
Lanreotide ATG의 EDI
Octreotide LAR 또는 lanreotide ATG를 3개월 이상 사용하여 성장호르몬(< 2.5 μg/L) 및 임상적 증상 등이 충분히 잘 조절되는 환자의 경우, 이전에 사용하였던 소마토스타틴 유사체의 용량과 상관없이 lanreotide ATG 120 mg으로 변경하여 8주까지 투여 간격을 연장할 수 있다(근거수준 C).수술 전 소마토스타틴 유사체의 사용
수술 전 소마토스타틴 유사체의 사용
말단비대증 환자의 치료에 있어 수술 전 소마토스타틴 유사체의 일반적인 사용은 권고하지 않는다. 다만 수술적 치료가 불가능하거나 환자가 거부하는 경우에는 약물 치료를 일차적으로 고려할 수 있다(근거수준 A).소마토스타틴 유사체 사용 기간 중의 특수 상황
소마토스타틴 유사체 사용 기간 중의 특수 상황
1. Pasireotide LAR 등의 소마토스사틴 유사체 사용 시 발생할 수 있는 고혈당의 1차 치료제는 메트포르민이며, dipeptidyl-peptidase-4 억제제 및 glucagon-like peptide-1 유사체도 사용할 수 있다(근거수준 E).2. 소마토스타틴 유사체 사용 중에는 피임이 권고되며 임신을 원할 경우, 약제 사용 중단이 권고된다(근거수준 E).
- 결 론
- 결 론
소마토스타틴 유사체는 말단비대증 환자의 내과적 치료시 사용하는 약물로 수술 후 완치가 되지 않거나 환자가 수술을 거부하는 경우 등에서 사용할 수 있다. 본 권고안은 말단비대증 환자에서 소마토스타틴 유사체 사용에 관한 임상연구를 토대로 한 근거와 전문가의 합의된 의견을 바탕으로 제정하였다. 다만 말단비대증의 특성 및 부족한 국내 자료 등을 고려할 때 완벽한 권고안이라 할 수 없으므로 임상 현장에서 의사결정은 진료를 수행하는 의료진의 결정이 본 권고안의 내용보다 우선한다고 할 수 있다. 향후 객관적이고 과학적인 국내 자료가 축적되면 이를 근거로 권고안의 추가 보완 및 수정을 진행할 계획이다.
Figure 1.
Initial dose and up-/down-titration of octreotide LAR and ATG in patients with acromegaly. SSA, somatostatin analogues; OCT, octreotide; LAR, long-acting release; LAN, lanreotide; GH, growth hormone; ATG, lanreotide Autogel; mo, months.
- References
- References
REFERENCES
1. Melmed S. Acromegaly pathogenesis and treatment. J Clin Invest 2009;119:3189–3202.
[Article] [PubMed] [PMC]2. Reid TJ, Post KD, Bruce JN, Nabi Kanibir M, Reyes-Vidal CM, Freda PU. Features at diagnosis of 324 patients with acromegaly did not change from 1981 to 2006: acromegaly remains under-recognized and under-diagnosed. Clin Endocrinol (Oxf) 2010;72:203–208.
[Article] [PubMed]3. Kwon O, Song YD, Kim SY, Lee EJ. Nationwide survey of acromegaly in South Korea. Clin Endocrinol (Oxf) 2013;78:577–585.
[Article] [PubMed]4. Katznelson L, Laws ER Jr, Melmed S, et al. Acromegaly: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2014;99:3933–3951.
[Article] [PubMed]5. Wass JA, Turner HE, Adams CB. The importance of locating a good pituitary surgeon. Pituitary 1999;2:51–54.
[Article] [PubMed]6. Ahmed S, Elsheikh M, Stratton IM, Page RC, Adams CB, Wass JA. Outcome of transphenoidal surgery for acromegaly and its relationship to surgical experience. Clin Endocrinol (Oxf) 1999;50:561–567.
[Article] [PubMed]7. Shimon I, Cohen ZR, Ram Z, Hadani M. Transsphenoidal surgery for acromegaly: endocrinological follow-up of 98 patients. Neurosurgery 2001;48:1239–1243discussion 1244-1235.
[Article] [PubMed]8. McLaughlin N, Laws ER, Oyesiku NM, Katznelson L, Kelly DF. Pituitary centers of excellence. Neurosurgery 2012;71:916–924discussion 924-926.
[Article] [PubMed]9. Kreutzer J, Vance ML, Lopes MB, Laws ER Jr. Surgical management of GH-secreting pituitary adenomas: an outcome study using modern remission criteria. J Clin Endocrinol Metab 2001;86:4072–4077.
[Article] [PubMed]10. Choe JH, Lee KS, Jeun SS, Cho JH, Hong YK. Endocrine outcome of endoscopic endonasal transsphenoidal surgery in functioning pituitary adenomas. J Korean Neurosurg Soc 2008;44:151–155.
[Article] [PubMed] [PMC]11. Chin SO, Ku CR, Kim BJ, et al. Medical treatment with somatostatin analogues in acromegaly: position statement. Endocrinol Metab (Seoul) 2019;34:53–62.
[Article] [PubMed] [PMC]13. Cuevas-Ramos D, Fleseriu M. Somatostatin receptor ligands and resistance to treatment in pituitary adenomas. J Mol Endocrinol 2014;52:R223–R240.
[Article] [PubMed]14. Fleseriu M, Petersenn S. Medical management of Cushing's disease: what is the future? Pituitary 2012;15:330–341.
[Article] [PubMed] [PMC]15. Reubi JC, Schaer JC, Waser B, Mengod G. Expression and localization of somatostatin receptor SSTR1, SSTR2, and SSTR3 messenger RNAs in primary human tumors using in situ hybridization. Cancer Res 1994;54:3455–3459.16. Krantic S, Goddard I, Saveanu A, et al. Novel modalities of somatostatin actions. Eur J Endocrinol 2004;151:643–655.
[Article] [PubMed]17. Maffezzoni F, Formenti AM, Mazziotti G, Frara S, Giustina A. Current and future medical treatments for patients with acromegaly. Expert Opin Pharmacother 2016;17:1631–1642.
[Article] [PubMed]18. Bauer W, Briner U, Doepfner W, et al. SMS 201-995: a very potent and selective octapeptide analogue of somatostatin with prolonged action. Life Sci 1982;31:1133–1140.
[Article] [PubMed]19. Taylor JE, Bogden AE, Moreau JP, Coy DH. In vitro and in vivo inhibition of human small cell lung carcinoma (NCI-H69) growth by a somatostatin analogue. Biochem Biophys Res Commun 1988;153:81–86.
[Article] [PubMed]20. Freda PU. Somatostatin analogs in acromegaly. J Clin Endocrinol Metab 2002;87:3013–3018.
[Article] [PubMed]21. Grass P, Marbach P, Bruns C, Lancranjan I. Sandostatin LAR (microencapsulated octreotide acetate) in acromegaly: pharmacokinetic and pharmacodynamic relationships. Metabolism 1996;45(8 Suppl 1):27–30.
[Article] [PubMed]22. McKeage K, Cheer S, Wagstaff AJ. Octreotide long-acting release (LAR): a review of its use in the management of acromegaly. Drugs 2003;63:2473–2499.
[Article] [PubMed]23. Ciccarelli A, Daly A, Beckers A. Lanreotide Autogel for acromegaly: a new addition to the treatment armamentarium. Treat Endocrinol 2004;3:77–81.
[Article] [PubMed]24. Taboada GF, Luque RM, Bastos W, et al. Quantitative analysis of somatostatin receptor subtype (SSTR1-5) gene expression levels in somatotropinomas and non-functioning pituitary adenomas. Eur J Endocrinol 2007;156:65–74.
[Article] [PubMed]25. Park C, Yang I, Woo J, et al. Somatostatin (SRIF) receptor subtype 2 and 5 gene expression in growth hormone-secreting pituitary adenomas: the relationship with endogenous srif activity and response to octreotide. Endocr J 2004;51:227–236.
[Article] [PubMed]26. Dietrich H, Hu K, Ruffin M, et al. Safety, tolerability, and pharmacokinetics of a single dose of pasireotide long-acting release in healthy volunteers: a single-center Phase I study. Eur J Endocrinol 2012;166:821–828.
[Article] [PubMed]27. Bruns C, Lewis I, Briner U, Meno-Tetang G, Weckbecker G. SOM230: a novel somatostatin peptidomimetic with broad somatotropin release inhibiting factor (SRIF) receptor binding and a unique antisecretory profile. Eur J Endocrinol 2002;146:707–716.
[Article] [PubMed]28. Wolin EM, Hu K, Hughes G, Bouillaud E, Giannone V, Resendiz KH. Safety, tolerability, pharmacokinetics, and pharmacodynamics of a long-acting release (LAR) formulation of pasireotide (SOM230) in patients with gastroenteropancreatic neuroendocrine tumors: results from a randomized, multicenter, open-label, phase I study. Cancer Chemother Pharmacol 2013;72:387–395.
[Article] [PubMed] [PMC]29. Jørgensen JO, Feldt-Rasmussen U, Frystyk J, et al. Cotreatment of acromegaly with a somatostatin analog and a growth hormone receptor antagonist. J Clin Endocrinol Metab 2005;90:5627–5631.
[Article] [PubMed]30. Conway-Campbell BL, Brooks AJ, Robinson PJ, Perani M, Waters MJ. The extracellular domain of the growth hormone receptor interacts with coactivator activator to promote cell proliferation. Mol Endocrinol 2008;22:2190–2202.
[Article] [PubMed] [PMC]31. Lamberts SW, Uitterlinden P, Verschoor L, van Dongen KJ, del Pozo E. Long-term treatment of acromegaly with the somatostatin analogue SMS 201-995. N Engl J Med 1985;313:1576–1580.
[Article] [PubMed]32. Fleseriu M. Clinical efficacy and safety results for dose escalation of somatostatin receptor ligands in patients with acromegaly: a literature review. Pituitary 2011;14:184–193.
[Article] [PubMed]33. Roelfsema F, Biermasz NR, Pereira AM, Romijn JA. Therapeutic options in the management of acromegaly: focus on lanreotide Autogel. Biologics 2008;2:463–479.
[Article] [PubMed] [PMC]34. Mercado M, Borges F, Bouterfa H, et al. A prospective, multicentre study to investigate the efficacy, safety and tolerability of octreotide LAR (long-acting repeatable octreotide) in the primary therapy of patients with acromegaly. Clin Endocrinol (Oxf) 2007;66:859–868.
[Article] [PubMed] [PMC]35. Caron PJ, Bevan JS, Petersenn S, et al. Tumor shrinkage with lanreotide Autogel 120 mg as primary therapy in acromegaly: results of a prospective multicenter clinical trial. J Clin Endocrinol Metab 2014;99:1282–1290.
[Article] [PubMed]36. Yang SJ, Seo YJ, Eun CR, et al. Therapeutic effects of a long-acting formulation of lanreotide in Korean patients with acromegaly. Korean J Med 2007;73:50–57.37. Colao A, Bronstein MD, Freda P, et al. Pasireotide versus octreotide in acromegaly: a head-to-head superiority study. J Clin Endocrinol Metab 2014;99:791–799.
[Article] [PubMed] [PMC]38. Sheppard M, Bronstein MD, Freda P, et al. Pasireotide LAR maintains inhibition of GH and IGF-1 in patients with acromegaly for up to 25 months: results from the blinded extension phase of a randomized, double-blind, multicenter, phase III study. Pituitary 2015;18:385–394.
[Article] [PubMed]39. Bronstein MD, Fleseriu M, Neggers S, et al. Switching patients with acromegaly from octreotide to pasireotide improves biochemical control: crossover extension to a randomized, double-blind, phase III study. BMC Endocr Disord 2016;16:16.
[Article] [PubMed] [PMC]40. Gadelha MR, Bronstein MD, Brue T, et al. Pasireotide versus continued treatment with octreotide or lanreotide in patients with inadequately controlled acromegaly (PAOLA): a randomised, phase 3 trial. Lancet Diabetes Endocrinol 2014;2:875–884.
[Article] [PubMed]41. Holdaway IM, Rajasoorya RC, Gamble GD. Factors influencing mortality in acromegaly. J Clin Endocrinol Metab 2004;89:667–674.
[Article] [PubMed]42. Zeinalizadeh M, Habibi Z, Fernandez-Miranda JC, Gardner PA, Hodak SP, Challinor SM. Discordance between growth hormone and insulin-like growth factor-1 after pituitary surgery for acromegaly: a stepwise approach and management. Pituitary 2015;18:48–59.
[Article] [PubMed]43. Ayuk J, Clayton RN, Holder G, Sheppard MC, Stewart PM, Bates AS. Growth hormone and pituitary radiotherapy, but not serum insulin-like growth factor-I concentrations, predict excess mortality in patients with acromegaly. J Clin Endocrinol Metab 2004;89:1613–1617.
[Article] [PubMed]44. Paragliola RM, Corsello SM, Salvatori R. Somatostatin receptor ligands in acromegaly: clinical response and factors predicting resistance. Pituitary 2017;20:109–115.
[Article] [PubMed]45. Andries M, Glintborg D, Kvistborg A, Hagen C, Andersen M. A 12-month randomized crossover study on the effects of lanreotide Autogel and octreotide long-acting repeatable on GH and IGF-l in patients with acromegaly. Clin Endocrinol (Oxf) 2008;68:473–480.
[Article] [PubMed]46. Park JK, Lee EJ. Comparison of the efficacy of octreotide long-acting repeatable and lanreotide Autogel in acromegalic patients. J Korean Endocr Soc 2010;25:25–27.
[Article]47. Giustina A, Bonadonna S, Bugari G, et al. High-dose intramuscular octreotide in patients with acromegaly inadequately controlled on conventional somatostatin analogue therapy: a randomised controlled trial. Eur J Endocrinol 2009;161:331–338.
[Article] [PubMed]48. Neggers SJ, Pronin V, Balcere I, et al. Lanreotide Autogel 120 mg at extended dosing intervals in patients with acromegaly biochemically controlled with octreotide LAR: the LEAD study. Eur J Endocrinol 2015;173:313–323.
[Article] [PubMed] [PMC]49. Orlewska E, Kos-Kudla B, Sowinski J, Sworczak K, Zgliczynski W, Lanro-Study Group. Dosage and costs of lanreotide Autogel 120 mg administered as part of routine acromegaly care in Poland - two years of data from Lanro-Study. Endokrynol Pol 2015;66:142–148.
[Article] [PubMed]50. Carlsen SM, Lund-Johansen M, Schreiner T, et al. Preoperative octreotide treatment in newly diagnosed acromegalic patients with macroadenomas increases cure short-term postoperative rates: a prospective, randomized trial. J Clin Endocrinol Metab 2008;93:2984–2990.
[Article] [PubMed]51. Fougner SL, Bollerslev J, Svartberg J, Øksnes M, Cooper J, Carlsen SM. Preoperative octreotide treatment of acromegaly: long-term results of a randomised controlled trial. Eur J Endocrinol 2014;171:229–235.
[Article] [PubMed]52. Strowski MZ, Parmar RM, Blake AD, Schaeffer JM. Somatostatin inhibits insulin and glucagon secretion via two receptors subtypes: an in vitro study of pancreatic islets from somatostatin receptor 2 knockout mice. Endocrinology 2000;141:111–117.
[Article] [PubMed]53. Correa LL, Taboada GF, Van Haute FR, et al. Evaluation of glucose metabolism in acromegalic patients before and after treatment with octreotide LAR. Arq Bras Endocrinol Metabol 2008;52:55–64.
[Article] [PubMed]54. Caron PJ, Petersenn S, Houchard A, Sert C, Bevan JS, PRIMARYS Study Group. Glucose and lipid levels with lanreotide autogel 120 mg in treatment-naïve patients with acromegaly: data from the PRIMARYS study. Clin Endocrinol (Oxf) 2017;86:541–551.
[Article] [PubMed]55. Kumar U, Sasi R, Suresh S, et al. Subtype-selective expression of the five somatostatin receptors (hSSTR1-5) in human pancreatic islet cells: a quantitative double-label immunohistochemical analysis. Diabetes 1999;48:77–85.
[Article] [PubMed]56. Henry RR, Ciaraldi TP, Armstrong D, Burke P, Ligueros-Saylan M, Mudaliar S. Hyperglycemia associated with pasireotide: results from a mechanistic study in healthy volunteers. J Clin Endocrinol Metab 2013;98:3446–3453.
[Article] [PubMed]57. Colao A, De Block C, Gaztambide MS, Kumar S, Seufert J, Casanueva FF. Managing hyperglycemia in patients with Cushing's disease treated with pasireotide: medical expert recommendations. Pituitary 2014;17:180–186.
[Article] [PubMed]
